N° 2833 _______ ASSEMBLÉE NATIONALE CONSTITUTION DU 4 OCTOBRE 1958 DOUZIÈME LÉGISLATURE Enregistré à la Présidence de l'Assemblée nationale le 26 janvier 2006 RAPPORT FAIT AU NOM DE LA MISSION D'INFORMATION (1) SUR LA GRIPPE AVIAIRE : MESURES PRÉVENTIVES
Président M. Jean-Marie LE GUEN, Rapporteur M. Jean-Pierre DOOR, Députés -- TOME I Menace de pandémie grippale : préparer les moyens médicaux (1) La composition de cette mission figure au verso de la présente page. La mission d'information sur la grippe aviaire : mesures préventives est composée de : M. Jean-Marie LE GUEN, Président ; Mme Bérengère POLETTI, M. Jean-Michel BOUCHERON, Vice-Présidents ; Mme Jacqueline FRAYSSE, M. Claude LETEURTRE, Secrétaires ; M. Jean-Pierre DOOR, Rapporteur ; MM. Gérard BAPT, Gabriel BIANCHERI, Jérôme BIGNON, Mme Françoise BRANGET, MM. Gérard CHARASSE, Roland CHASSAIN, Alain CLAEYS, Gérard DUBRAC, Yannick FAVENNEC, Jean-Claude FLORY, Mmes Arlette FRANCO, Geneviève GAILLARD, Catherine GENISSON, M. François GUILLAUME, Mme Paulette GUINCHARD, MM. Pierre HELLIER, Denis JACQUAT, Mme Janine JAMBU, MM. Marc JOULAUD, Marc LE FUR, Michel LEJEUNE, Germinal PEIRO, Daniel PREVOST, Serge ROQUES, Rudy SALLES. S O M M A I R E Page Avant-propos du president 11 I. Face au risque de pandémie grippale en France, le Gouvernement a décidé d'appliquer le principe de précaution 19 1.-1. Pourquoi se préparer à une pandémie ? 19 1.-1.-1. Une épizootie difficile à contrôler 20 1.-1.-2. Des cas, encore limités, de transmission à l'homme 21 -- Les cas recensés 21 -- Les explications avancées 25 1.-1.-3. La crainte de voir apparaître un virus mutant, de nature pandémique 30 -- La grande mutabilité des virus grippaux 30 -- Des virus très contagieux 32 -- Une propagation favorisée par les modes de transports collectifs 33 -- Un vaccin qui n'existe pas encore et des antiviraux imparfaits 34 1.-2. L'application du principe de précaution 35 1.-3. La mise au point par la France, dès 2004, d'un plan de lutte contre la pandémie 39 1.-3.-1. Le plan français mis au point en 2004 39 1.-3.-2. Une actualisation en cours 41 II. Des stocks de moyens pharmaceutiques et de matériels de prévention ont été constitués mais la France n'est pas encore prête 43 2.-1. : Les stocks d'antiviraux 44 2.-1.-1. Le rôle essentiel des antiviraux en cas de pandémie 44 2.-1.-2. Les différents antiviraux disponibles 45 2.-1.-3. Les stocks actuels 46 2.-1.-4. Une diversification nécessaire des antiviraux utilisables 49 2.-2. Les stocks de médicaments destinés au traitement des complications de la grippe 53 2.-3. Les stocks de masques de protection individuelle 54 2.-3.-1 La fonction des masques de protection 54 2.-3.-2. Les stocks français 55 2.-4. La problématique spécifique du vaccin pandémique 57 2.-4.-1 Les spécificités du vaccin pandémique 58 2.-4.-2 La stratégie de production mise au point 59 2.-4.-3 Les commandes de vaccins pandémiques 61 2.-5. Qu'en est-il de la capacité des fabricants à augmenter leur production ? 62 2.-5.-1. Pour tous les fabricants, un risque industriel et financier 63 2.-5.-2. Pour certains fabricants, une inquiétude sur l'approvisionnement en matières premières 65 2.-5.-3. La question du brevet de fabrication du Tamiflu 67 2.-5.-4. Des interrogations sur la fabrication du vaccin pandémique 73 RECOMMANDATIONS DE LA MISSION 77 AUDITIONS AUXQUELLES LA MISSION A PROCEDE 79 Mesdames, Messieurs, L'opinion publique a soudainement découvert, à la fin de l'été 2005, que la grippe aviaire de type H5N1, qui touche actuellement l'Asie du Sud-Est, pouvait constituer une grave menace sanitaire pour l'humanité. En quelques semaines, une inquiétude, d'abord sourde, puis de plus en plus manifeste, s'est emparée des Français, en même temps, d'ailleurs, que des autres habitants de la planète, lorsqu'il est apparu que le risque d'une transmission du virus aviaire à l'homme n'était pas théorique et qu'une contamination interhumaine était également concevable. Il faut dire que des informations en provenance d'Asie du Sud-Est mettaient en évidence une progression de l'épizootie de grippe aviaire, qui y sévit depuis 2003, aussi bien dans la région qu'en direction des pays d'Europe centrale, et faisaient état des premiers cas de décès humains. Suscitant un emballement médiatique plutôt inattendu mais particulièrement efficace pour transformer l'inquiétude initiale en une psychose collective, ces informations, bien évidemment alarmantes, n'ont pas cessé, depuis, d'être régulièrement confirmées par la découverte de nouveaux foyers aviaires et l'annonce de nouveaux décès humains. La menace d'une pandémie grippale s'est, dès lors, dessinée. Cette pandémie ne serait pas la première à laquelle l'Humanité serait confrontée. Depuis que l'on sait établir scientifiquement la réalité d'une pandémie, c'est-à-dire depuis les années 1940, on en a recensé trois : la première s'est produite en 1957-1958, dite « grippe asiatique », la deuxième en 1968-1970, dite « grippe de Hongkong », la dernière en 1977-1978, dite « grippe russe ».Il y en a eu certainement bien d'autres auparavant mais le diagnostic de leur nature grippale reste encore aujourd'hui hasardeux. Les premières dateraient de l'Antiquité. Devant la mission d'information, le Professeur Jean-Philippe Derenne1 a indiqué : « Les historiens ont dénombré trente et une grippes pandémiques depuis 1581 ». La seule pandémie antérieure aux années 40 dont on soit aujourd'hui certain qu'elle a été provoquée par un virus grippal est celle dite de la « grippe espagnole », survenue en 1918-1919. Elle tient son nom, comme l'a expliqué le Professeur Derenne, du fait que « le roi d'Espagne a été touché, même s'il en a guéri ». Une épidémie de grippe apparaît en Chine en 1915. Elle frappe les États-Unis peu de temps après : environ 500.000 personnes en mourront. Au Canada, près de 50.000 décès sont constatés et près de deux millions de personnes sont atteintes par la maladie. La grippe touche l'Europe à l'été 1918, facilitée par les déplacements importants de combattants. Elle serait apparue en avril 1918 à Bordeaux et aurait atteint le Nord en mai 1918. Une deuxième vague frappe Brest en mai 1918. Les populations civiles, affaiblies par les privations, succombent, très nombreuses, à la maladie.L'épidémie prend le nom de « grippe espagnole », parce que le roi d'Espagne lui-même en fut victime, mais en a guéri. Ce nom fait aussi référence à une autre hypothèse, selon laquelle la maladie aurait été introduite en France par les Allemands, à partir de boîtes de conserve venues d'Espagne. En France, entre 200.000 et 400.000 personnes mourront de la grippe espagnole. L'épidémie diminue au cours de l'année 1919, pour disparaître l'année suivante. La grippe espagnole a causé au moins vingt millions de morts dans le monde. C'est probablement l'épidémie la plus meurtrière que le monde ait connue au XXe siècle. Les experts pensent que le virus de la grippe de 1918 est une version mutante très sévère. Certains chercheurs tentent aujourd'hui de le décrypter à partir de fossiles. Une recherche a été entreprise à partir des cadavres de marins norvégiens enterrés dans le Nord, et dont les corps ont été conservés par le froid. A l'heure actuelle, les cas de contamination humaine constatés ne se sont accompagnés d'aucune mutation génétique du virus, qui est donc passé de l'animal à l'homme dans sa structure aviaire, elle-même restée inchangée. Mais un certain nombre d'experts n'excluent pas le risque d'une mutation à l'occasion de passages répétés dans l'organisme humain, rendant le virus plus facilement transmissible d'homme à homme. Toutefois, dans cette hypothèse, la pathogénicité du virus muté pourrait être moindre. Il reste que la menace d'une pandémie est aujourd'hui perçue comme une probabilité que les gouvernants du monde entier intègrent désormais dans leur politique de santé publique. Tous ont gardé en mémoire l'épidémie de SRAS (syndrome respiratoire aigu sévère) de 2003, partie de Chine et qui s'est rapidement propagée dans nombreux pays. Elle a touchée plus de 8.000 personnes et causé environ 800 décès. Qualifié par l'Institut Pasteur de « première maladie émergente du XXIè siècle » (www.pasteur.fr), le SRAS était totalement inconnu des experts, qui n'ont toutefois pas tardé à en identifier l'agent causal : un virus respiratoire d'origine animale. Une mobilisation internationale sans précédent, sous l'égide de l'OMS, a permis d'endiguer l'épidémie, grâce, notamment, à des mesures d'isolement et de quarantaine. Si la gestion de cette crise peut, bien sûr, servir aujourd'hui de référence aux autorités politiques et sanitaires du monde entier, elle ne saurait inciter à un optimisme excessif : en effet, la contagiosité du virus du SRAS est bien moindre que celle d'un virus grippal ; par ailleurs, sa durée d'incubation, de l'ordre d'une dizaine de jours, est beaucoup plus longue que celle de la grippe (deux à trois jours), ce qui ralentit sensiblement sa vitesse de propagation. C'est pourquoi le gouvernement français n'a pas attendu l'aggravation de l'épizootie actuelle pour prendre, au nom du principe de précaution, les dispositions nécessaires face à un risque de pandémie. Dès l'automne 2004, un plan de lutte fut élaboré : d'abord classé « confidentiel défense », il a été rendu public en mai 2005 et mis en ligne sur le site du ministère de la santé. Quelques mois plus tard, le 25 août 2005, le Président de la République a demandé au Gouvernement « d'appliquer pleinement le principe de précaution (...) afin que chaque Français soit protégé ou puisse être soigné en cas d'apparition de la maladie ». La représentation nationale ne pouvait pas rester à l'écart de ce mouvement de prise de conscience des conséquences possibles, sur la santé humaine, de l'actuelle épizootie de grippe aviaire à laquelle, il faut bien le reconnaître, peu d'entre nous portaient une grande attention jusqu'à ces derniers temps. Elle ne pouvait pas non plus demeurer insensible à l'anxiété grandissante des Français face à une menace sanitaire encore invisible mais dont un grand nombre d'experts ne cessent, depuis des semaines, d'annoncer la réalisation à plus ou moins brève échéance. Notre collègue M. Jean-Marie Le Guen, devenu depuis le président de notre mission, a déposé, le 9 septembre 2005, une proposition de résolution demandant la création d'une commission d'enquête sur l'état de préparation de la France à une éventuelle pandémie grippale. Au cours de sa réunion du 4 octobre 2005, la Conférence des Présidents a fait le choix de créer, plutôt, une mission d'information sur les mesures préventives qu'appelle la lutte contre la grippe aviaire. Constituée le 19 octobre, notre mission a aussitôt arrêté les grandes lignes de l'organisation de ses travaux. Elle a considéré que si l'évaluation du plan gouvernemental de préparation au risque pandémique, rendu public en mai 2005, serait, bien évidemment, au centre de sa réflexion, il était préférable d'en attendre la version actualisée, annoncée pour la fin de l'année ou le début de l'année prochaine. En revanche, il lui a semblé souhaitable de dresser dès maintenant un état des lieux des moyens pharmaceutiques et des outils de prévention disponibles en cas de pandémie, et d'apprécier ce qu'il resterait à faire pour que la riposte sanitaire soit à la hauteur des enjeux. Par ailleurs, comme on sait que plus l'actuelle épizootie perdure, plus le risque de mutation du virus aviaire s'aggrave, la mission a jugé indispensable de faire le point sur l'évolution de l'épizootie, sur sa propagation et les moyens de l'endiguer ; elle s'est également penchée sur les mesures prises en France, jusqu'à présent épargnée, pour prévenir l'épizootie, et sur celles qui seraient prises en cas de découverte de foyers de grippe « à virus H5N1 » sur le territoire national. La question du caractère public ou non des travaux de la mission a fait l'objet de longs échanges de vue. La mission a finalement décidé que les auditions auxquelles elle procèderait seraient, sauf cas particuliers, ouvertes à la presse. Ce souci de transparence et d'information immédiate du public a paru à une majorité de députés d'autant plus justifié que le sujet traité était d'une persistante actualité et que les Français étaient impatients de pouvoir faire enfin un tri parmi toutes les informations, nombreuses, souvent inquiétantes, parfois contradictoires ou confuses, qui leur sont quotidiennement fournies. C'est dans ce même esprit que la décision a été prise de mettre en ligne le compte rendu des auditions auxquelles la mission procèdera, sur le site officiel de l'Assemblée nationale, sans attendre la publication des résultats de ses travaux. Enfin, ce souci de répondre au plus vite à l'attente des Français a conduit la mission à décider de rendre publiques ses conclusions au fur et à mesure de l'avancée de ses investigations. Elle publiera donc, non pas un rapport final, mais trois rapports successifs portant, chacun, sur l'une des trois problématiques identifiées plus haut : les moyens pharmaceutiques et les outils de prévention aujourd'hui disponibles, l'épizootie, le plan gouvernemental de lutte contre la pandémie. Ces rapports s'inscriront parfaitement, au demeurant, dans le cadre général de la lutte contre le risque épidémique que votre Rapporteur a analysé dans le rapport qu'il a présenté avec Mme Marie-Christine Blandin, sénatrice, au nom de l'Office parlementaire des choix scientifiques et technologiques, le 10 mai 2005. Le présent rapport est donc le premier des trois annoncés. Il fait le point sur les matériels de prévention et les moyens pharmaceutiques disponibles en cas de pandémie, au terme d'une dizaine d'auditions ciblées et particulièrement riches d'informations. Après avoir expliqué pourquoi la France avait décidé de se préparer à une éventuelle pandémie grippale en faisant application du principe de précaution, votre rapporteur abordera la question des stocks existants de masques de protection et de moyens pharmaceutiques, et évaluera la marge de manœuvre encore disponible pour augmenter les capacités de production. _ AVANT-PROPOS DU PRÉSIDENT Alors que la grippe aviaire se développe en Chine depuis plusieurs années (l'alerte de Hong Kong en 1997 en a été le premier symptôme), l'épidémie animale et ses conséquences sur la santé humaine se sont révélées à l'opinion internationale, dès les premiers cas humains, fin décembre 2003 au Vietnam et en janvier 2004 en Thaïlande. Très vite, les autorités sanitaires internationales, OIE et OMS, ont alerté les gouvernements sur la gravité du risque sanitaire pour la santé mondiale. Les premières recommandations ont été publiées et des plans nationaux élaborés dans plusieurs pays, certains directement en ligne de front et d'autres comptant parmi les plus développés de la planète. Mais, la véritable prise de conscience de l'opinion et, surtout, la nécessité d'une mobilisation nationale et internationale ne se sont affirmées qu'au cours de l'été 2005. Il faudra s'interroger, le moment voulu, sur le temps de latence entre l'alerte donnée par les milieux scientifiques et la prise en compte réelle des enjeux par les autorités politiques. Certes, il est heureux de constater, que, jusqu'à présent, ce retard n'a pas érodé nos chances de lutte contre l'épidémie. Mais, à l'avenir, nos autorités auront le devoir d'être plus réactives. S'agissant plus spécifiquement de la France, nous pouvons nous féliciter d'avoir commencé à réfléchir, dès 2004, à une première version du Plan de lutte contre l'épidémie, et, surtout, d'avoir été un acteur principal de la mobilisation de ces derniers mois. Dans ce mouvement de prise de conscience et de mobilisation, l'Assemblée nationale a décidé de constituer, en octobre 2005, une mission d'information dédiée à cette crise sanitaire. L'originalité notable de ce travail parlementaire, par contraste avec ceux que l'Assemblée nationale conduit habituellement, est de se situer en amont de l'action gouvernementale, pour agir sur cette dernière et sur l'information de l'opinion publique en temps réel. Dans ce contexte, notre mission a à répondre à des enjeux particuliers. En effet, nous nous sommes fixés comme objectifs non seulement de contrôler l'action du gouvernement, dans le cadre du dispositif de préparation du Plan de lutte contre la grippe aviaire, mais aussi de porter attention, en toute transparence et pondération, à l'expression des citoyens et à leur information, et, enfin, de proposer aux autorités françaises de nouvelles formes d'action. Pour réaliser les buts que cette mission s'est assignée, nous avons choisi de travailler selon des formes spécifiques : - Des audiences publiques : Ainsi, pour contribuer à l'information publique et pour garantir sa totale transparence - enjeu stratégique du traitement de toute crise sanitaire - nous avons pris la décision de rendre publiques la plupart de nos auditions. Lors de celles-ci, nous avons fait preuve d'insistance dans nos questionnements - nos interlocuteurs voudront bien nous en excuser -, animés que nous étions par la volonté de rendre directes, compréhensibles et précises les réponses qui nous furent données. - Des rapports d'étape : En outre, nous avons choisi de rendre nos rapports publics au plus vite, pour coller à une actualité qui voit, malheureusement, se développer la grippe aviaire. Ce rendu de notre part s'est fait par étapes, selon l'ordre logique de préparation du Plan de lutte. C'est dans ce sens que nous avons privilégié, en premier lieu, l'examen des problèmes posés par l'acquisition des produits médicaux (médicaments et vaccins) et des dispositifs techniques (masques etc.), non qu'ils soient, à eux seul, déterminants (nous y reviendrons), mais parce qu'il s'agit d'une question qui, pour des raisons pratiques, doit être résolue en amont du risque pandémique. Nous avons déjà abordé la question de l'épizootie, au sujet de laquelle nous publierons un second rapport d'ici quelques semaines avant, si possible, le retour des migrations d'oiseaux qui pourraient poser des problèmes de contamination aviaire sur notre sol. Nous examinerons ensuite, point par point, le plan de lutte contre la pandémie et les dispositifs opérationnels tels qu'ils seront publiés par le gouvernement. S'agissant de la première étape de cette mission, nous pouvons déjà formuler plusieurs remarques et recommandations : - Fallait-il communiquer fortement sur la réalité du risque aviaire alors même qu'il ne s'agissait que d'un risque potentiel ? L'automne 2005 a été l'occasion, à l'instigation des media, d'une prise de conscience de l'opinion publique du phénomène de grippe aviaire et du risque pandémique et, nous l'espérons, du distinguo nécessaire : cela ne s'est pas fait, bien évidemment, sans des réactions contrastées et quelques dérapages somme toute limités. - La consommation de volaille a un peu baissé dans notre pays sans que cela soit justifié. Il est à noter que ce sont moins les alertes médiatiques que les déclarations inappropriées des responsables européens qui ont encouragé cette réaction des consommateurs, qui, espérons-le, restera limité puisque totalement injustifiée. - Des achats intempestifs de traitements, notamment médicamenteux, ont eu lieu. Les pouvoirs publics ont, à juste titre, su prendre les mesures nécessaires sans, pour autant, inquiéter la population. - En réponse à des informations relayées par les media, ici et là, certains ont fait part de leur scepticisme quant à la véracité de ces informations. L'exercice d'un regard critique, dans un domaine où les certitudes observables ne peuvent exister, est fondamental. Il fut, ainsi, possible, parce que nécessaire, d'informer sur le caractère spécifique de la maladie aviaire tant pour la santé humaine que pour le développement équilibré de la planète, mais, aussi, de relativiser le rôle de tel ou tel médicament. - En outre, certaines voix se sont élevées pour exprimer leur déni vis-à-vis de la gravité de la situation. Il s'agit d'une réaction naturelle devant la perspective dramatique du risque. Mais, tout compte fait, le bilan de cette communication s'avère très largement positif. Cette étape de rencontre avec l'opinion était nécessaire et concourt à la conduite d'une attitude à avoir face au risque qui se doit d'être innovante. Même si, aujourd'hui, une totale incertitude demeure quant à la date, à l'importance et même à l'éventualité d'une pandémie grippale, personne ne conteste plus, sérieusement, la gravité de l'épizootie, la nécessité de la combattre sur la planète ni même le risque que celle-ci représente pour la santé humaine et, au-delà, pour le fonctionnement de nos sociétés. Tout le monde consent, donc, à reconnaître la pleine légitimité de préparer des plans de lutte contre la pandémie. Au-delà du risque lui-même, il est important aussi de réfléchir à son contexte, à sa signification dans nos sociétés. Maladies émergentes : Fatalité, malédiction ou nouveau défi ? Il serait dramatiquement erroné d'aborder ces questions des maladies émergentes avec une quelconque forme de panique, d'exagération ou de ressentiment à l'égard du progrès. Somme toute, nous voulons faire preuve de vigilance et de préparation pour ne pas subir ce que nos ancêtres ont vécu, par exemple, en 1918 avec la grippe espagnole. Par cette mobilisation, nous accordons, pour nous mêmes et pour tous les peuples de la terre, une valeur à la vie que nos aïeux ne pouvaient reconnaître, aidés que nous sommes par les avancées de notre temps. Grâce à la science et au progrès de la conscience humaine, nous avons les moyens de prévoir et, espérons-le, de lutter contre cette épidémie mondiale. Nous avons acquis le droit de ne pas accepter ce qui a longtemps été considéré - et le serait, sans doute, encore si nous n'y prenions garde - comme une fatalité. Nous avons, aussi, en notre possession, le droit de connaître les risques auxquels nous sommes confrontés. C'est, d'abord, à cette tâche que s'est attelée la mission d'information. La situation française, examinée par Jean-Pierre Door dans ce premier rapport, sans qu'il soit fait exception des autres Nations, est - et, surtout, tend à devenir - satisfaisante, en comparaison, notamment, avec les autres pays, y compris parmi les plus développés. Ce bilan doit être complété par deux remarques que je crois fondamentales : - Les moyens médicaux nous renseignent peu sur notre capacité de résistance face à la crise : les médicaments antiviraux sont, en effet, d'utilisation complexe (nous y reviendrons dans le deuxième rapport), voire même incertaine ; les vaccins n'arriveront pas dans les premiers temps de la crise sanitaire. L'essentiel des mesures de contention de l'épidémie reposera sur l'usage des masques, le respect des mesures d'hygiène individuelle et collective, et, en grande partie, sur notre capacité de solidarité commune. Une crise sanitaire est, tout d'abord, un défi social. Le chacun pour soi serait inefficace à titre individuel et catastrophique au plan collectif. - Il n'y a pas de frontière qui nous protège face à une pandémie de ce type. Ainsi, le combat que nous menons auprès des paysans vietnamiens, chinois ou kurdes, est bien une lutte pour notre santé à tous. Plus le virus H5N1 infectera les élevages et les hommes de ces régions, plus il y aura de risques qu'il mute en une forme humaine et pandémique. Si, demain, une crise de ce type devait survenir, il faudra nous souvenir qu'aucune frontière géographique n'aura force de contention face à la maladie. Aussi gardons-nous d'accroître par des mesures intempestives et inappropriées le caractère désastreux d'une situation qui n'en aura nul besoin. A l'heure où nous rendons ce premier rapport d'étape, les conditions de cette crise sanitaire, encore en évolution, font naître de nouvelles prises de conscience. 1. Au-delà de la grippe aviaire, mais aussi, hier, du SRAS, nos santés ont été et seront, à l'avenir, confrontées à un phénomène de maladies émergentes, infectieuses pour la plupart, et, notamment, virales, sans oublier la reviviscence de maladies traditionnelles telles que la tuberculose ou la malaria (cf. le rapport Le risque épidémique de Jean-Pierre Door et Marie-Christine Blandin). Ces maladies qui accompagnent la mondialisation, sans que, pour autant, celle-ci en soit forcément responsable, sont d'autant plus visibles que mieux détectées et qu'elles apparaissent dans un univers où les distances diminuent, les échanges s'intensifient et les écosystèmes, y compris humains, sont bouleversés. L'importance du bouleversement induit par les mutations des modes de vie entraîne, en partie, le développement, à l'échelle planétaire, de maladie comme l'obésité, les addictions ou les violences conjugales. Elles font partie de ces maladies émergentes qui nous concernent tous et devraient nous faire réfléchir, tant au niveau des risques médicaux que de l'organisation sociale. 2. Dans nos sociétés, l'aléa des épidémies et, peut-être même, dès demain, la main de l'homme, avec la montée en puissance du risque bioterroriste, nous poussent à apprendre à relever le défi de la biosécurité. De ce point de vue, l'effort considérable d'organisation et de remise en question que nous accomplissons pour faire face au risque de grippe aviaire nous sera, de toute façon, profitable, quand bien même nous échapperions à la pandémie grippale : gestion de crise, compréhension des phénomènes biologiques, organisation des premiers secours, chaînes de solidarité, refondation de notre offre de soin, rappel des règles d'hygiène, hypothèse de contrainte de fonctionnement économique et social sur un mode dégradé... autant d'acquis précieux pour faire face à l'avenir. 3. Nous ne pouvons que déplorer les dangers que nous fait courir, aujourd'hui, la faiblesse des investissements effectués, ces dernières années, en vaccinothérapie, anti-bactériothérapie et antiviraux notamment. Certains pays, parmi les plus développés, n'ont même pas pris la peine d'assurer une souveraineté - même partagée - dans ces domaines. La France, peut-être par hasard, mais aussi, sans doute, au nom d'une tradition médicale dans les maladies infectieuses et d'une volonté de clairvoyance de certains décideurs, compte parmi les Nations les mieux loties. Au moment où les besoins médicaux se font sentir, les lacunes dans les domaines de la recherche, de l'industrialisation et de la commercialisation de certains produits pharmaceutiques pèsent cruellement. Au-delà des propositions de notre rapporteur consacrées à cette crise, il est nécessaire, tout du moins en Europe, que la question des limites et des risques d'une recherche médicale entièrement confiée au marché soit posée. Les qualités premières du marché ne sont guère la prévoyance et la sauvegarde de l'intérêt général, alors qu'il s'agit des conditions requises pour une bonne sécurité sanitaire. Il nous faut inventer au plan européen d'abord, au plan international ensuite, un nouveau partenariat public-privé dans la recherche médicale. 4. Avec de nombreux parlementaires de notre mission, nous avons, au cours de nos réflexions, été amenés à proposer la création d'un « droit d'ingérence sanitaire ». En effet, nous avons mesuré les lacunes du droit international et de la gouvernance mondiale pour faire face aux nouveaux risques et pour préserver nos santés. Alors que les interdépendances ont évolué, le droit international, quant à lui, n'a pas suivi. Des efforts ont, pourtant, été réalisés : - Depuis Doha, l'OMC a reçu des clauses d'exception, dites de « licence obligatoire», qui permettent, dans certaines circonstances, de déroger au droit international sur les brevets et le commerce. Cependant, non seulement il n'existe aucune jurisprudence en la matière (quid du déclenchement du risque avéré pour la santé publique, des compensations... ?), mais, de surcroît, nous avons été amenés à constater, lors de notre mission, que les pays qui auraient le plus besoin de bénéficier des dispositifs médicaux et, notamment, des médicaments face au risque sanitaire comptent, aussi, parmi les plus réticents à y recourir en dehors des règles du commerce, soit par crainte que des rétorsions leur soient infligées ou que leur esprit de lucre les amène à ne pas vouloir effrayer les investisseurs. Pourtant, dans notre intérêt commun, il est nécessaire que ces pays, et pas seulement le nôtre, puissent disposer de moyens médicaux pour faire face à leurs propres besoins. - Si nous reconnaissons à tous les pays le droit d'avoir une protection médicale, nous voulons aussi qu'ils aient des devoirs, ne serait-ce que pour ce qui concerne le recueil et le partage de l'information sur la situation de leur pays lorsqu'il est concerné par un risque sanitaire. Droit à l'information et devoir d'informer qui, aujourd'hui, sont loin d'être respectés. Or, nul doute que, respectés, ils auraient pu permettre d'éviter la généralisation de l'épizootie. Ainsi l'OMS et l'OIE - pour ne parler que des organismes internationaux les plus impliqués - n'ont pas toujours été informées des situations réelles. Pour remédier à cette grave lacune, un nouveau Règlement Sanitaire International est en voie d'élaboration au sein de l'OMS. S'agissant de la grippe aviaire, il est prévu qu'il soit applicable immédiatement. Mais, il faut aller plus loin et se poser la question des moyens réels de contrôle dont nous disposerons. Ni sanction ni, surtout, moyens d'inspection internationale à l'image de ceux qui existent, par exemple, en matière de désarmement ou d'énergie nucléaire n'ont été prévus. Nous devons envisager de renforcer les pouvoirs de la gouvernance internationale et, en l'occurrence, de l'OMS, pour que soit reconnu pleinement le droit d'ingérence sanitaire dans ses deux volets : droit à l'information et droit à la protection médicale. Au travers de cette crise sanitaire, et nous le verrons tout au long du travail de la mission et de ses différents rapports, lorsque l'on refuse la fatalité, que l'on comprend que la technique et la science ne sont que des outils, nous vérifierons que l'organisation sociale de notre pays, de notre continent, du monde, sont au cœur de notre capacité de résistance face à ces risques. Nul doute que ces questions s'affirment de plus en plus au cœur de l'action politique. I. FACE AU RISQUE DE PANDÉMIE GRIPPALE EN FRANCE, LE GOUVERNEMENT A DÉCIDÉ D'APPLIQUER LE PRINCIPE DE PRÉCAUTION En 2004, lorsque l'élaboration d'un plan de lutte contre une pandémie a été engagée, aucun cas de contamination humaine par le virus de grippe aviaire alors en circulation en Asie du Sud-Est n'avait été constaté en France. Il en est toujours de même aujourd'hui : il n'y a pas en France, à ce jour, de personnes malades du virus de la grippe aviaire H5N1, pas plus d'ailleurs qu'il n'y a de foyers animaux de grippe aviaire ou « peste aviaire », selon la terminologie employée par les vétérinaires. Pour autant, le gouvernement français a fait le choix d'appliquer le principe de précaution et de préparer la France à une menace pandémique, pour au moins deux raisons. D'une part, l'absence manifeste de contrôle de l'épizootie en Asie du Sud-Est, qui n'a pas cessé de s'étendre depuis son apparition en 2003, accroît le risque d'une contamination interhumaine, en offrant au virus H5N1, grâce à des passages de plus en plus nombreux d'un animal à l'autre, l'occasion de muter et de se transformer en un virus adapté à l'homme. D'autre part, l'Organisation mondiale de la santé (OMS) invite avec insistance les Etats membres, depuis maintenant plusieurs années, à envisager très sérieusement la menace d'une pandémie provoquée par un virus grippal qui serait jusqu'alors inconnu chez l'homme, comme, par exemple, le H5N1. En 1999, elle a rendu public un plan d'action mondial de préparation à une pandémie de grippe, qui devait servir de référence aux autorités nationales dans la préparation de leur propre plan. Avant de voir les grandes lignes du plan français, revenons d'abord sur les raisons de cette mobilisation internationale. 1.-1. POURQUOI SE PRÉPARER À UNE PANDÉMIE ? Trois raisons au moins justifient de prendre très au sérieux le risque de pandémie : l'épizootie n'est toujours pas sous contrôle en Asie du Sud-Est ; des cas de contamination humaine se sont produits ; une fois adapté à l'homme, le virus pourrait avoir acquis une capacité de diffusion rapide. 1.-1.-1. Une épizootie difficile à contrôler Le virus H5N1 qui circule actuellement en Asie du Sud-Est est hautement pathogène. Il avait été repéré pour la première fois en 1997, lors d'une épizootie à Hong Kong, qui avait alors provoqué la mort de six personnes. Parmi d'autres mesures, l'extermination à grande échelle de volailles et d'oiseaux avait permis de stopper net l'épidémie. Il avait ensuite disparu avant de réapparaître en décembre 2003, lorsqu'une souche virale de type A(H5N1) a été identifiée dans des foyers de grippe aviaire en République de Corée et signalée à l'Office international des épizooties (OIE). Ce virus est à l'origine d'épizooties chez les volailles dans plusieurs pays d'Asie. Depuis le début de l'épizootie, l'Organisation internationale des épizooties (OIE) a recensé une vingtaine de pays touchés : Cambodge, Chine, Corée du Sud, Croatie, Hong Kong, Indonésie, Japon, Kazakhstan, Laos, Malaisie, Mongolie, Philippines, Roumanie, Russie, Taïwan, Thaïlande, Turquie, Ukraine et Vietnam (www.oie.int). Les foyers les plus récents ont été identifiés en Turquie, Roumanie, Chine, Russie, Thaïlande, Indonésie, Ukraine et au Vietnam (site OIE, au 12 janvier). La contamination entraîne, après une période d'incubation de 3 à 5 jours, une perte de l'appétit, la diminution de la production d'œufs2 puis la mort subite des volailles, avec ou sans signes digestifs, respiratoires ou nerveux. Les signes cliniques sont variables, parfois frustes, souvent très discrets chez le canard. La mortalité peut atteindre 90 à 100% chez certaines espèces. Mais, surtout, cette épizootie est anormalement longue : devant la mission, M. Philippe Vannier3 a souligné qu'il était « rare de voir une épizootie durer plus de deux ans dans le monde ». Or, plus une épizootie se prolonge, plus le risque de contamination humaine augmente. Comme l'a expliqué M. Jean-Claude Désenclos4 lors de son audition, « Le risque d'une pandémie à partir de l'épizootie aviaire pourrait survenir si le virus aviaire se recomposait avec un virus grippal humain ou s'il mutait mal, de façon purement aléatoire. Le virus recomposé serait alors plus adapté à la transmission interhumaine (...). Cette recombinaison du virus pourrait se produire chez le porc ou chez l'homme lui-même. La probabilité de cette recombinaison augmente bien sûr avec la persistance et l'intensité de l'épizootie H5N1(...) ». 1.-1.-2. Des cas, encore limités, de transmission à l'homme Les premiers cas de contamination humaine par le virus H5N1 ont été constatés au début de l'année 2004. Outre qu'ils mettaient en évidence la capacité du virus à toucher l'homme, certes dans des proportions encore très limitées, ils se sont rapidement révélés inquiétants dans la mesure où ils se sont accompagnés d'un taux de mortalité élevé : près d'un malade sur deux est décédé. A la fin de l'année 2003, les responsables de l'OMS, placés en état d'alerte depuis l'épidémie de 1997 à Hong Kong, à la recherche d'éventuels signes d'un passage possible du virus A(H5N1) à l'homme en dépit de la barrière des espèces, ont été informés de la présence à Hanoi de la concomitance de 11 cas d'affection respiratoire grave chez des enfants initialement en bonne santé. Le laboratoire de référence a confirmé l'identification de la présence du virus H5N1. La présomption de l'existence d'un lien entre les affections humaines et l'exposition à des volailles infectées a été confirmée par la suite avec l'extension des flambées aviaires : dans les trois semaines qui ont suivi le signalement initial, plus de 400 foyers ont été décelées dans l'ensemble du pays. La Thaïlande a ensuite annoncé ses premiers cas humains, en liaison avec de nouvelles flambées aviaires (au cours de la dernière semaine de janvier 2004, ce pays a signalé 156 foyers dans 32 provinces). Depuis le début de l'identification des premiers cas en janvier 2004 jusqu'à fin 2005, tous les cas humains étaient apparus en Asie, en trois phases : janvier-mars 2004, puis août-octobre 2004, et depuis décembre 2004 jusqu'à maintenant. Le virus est maintenant endémique dans ces zones. Depuis le début 2006, plusieurs cas ont été signalés en Turquie. Au 5 janvier 2006, 144 cas humains de grippe A(H5N1) ont été identifiés, dont 76 mortels, soit un taux de mortalité un peu supérieur à 50 %. L'OMS publie régulièrement un tableau récapitulatif actualisé des cas confirmés biologiquement par les laboratoires agréés à cet effet. Récapitulatif des cas humains de grippe A(H5N1) confirmés biologiquement au 13 janvier 2006
Source : InVS Le Vietnam compte le plus grand nombre de victimes à ce jour : au 5 janvier, 93 personnes malades, dont 42 décédées. Le tableau ci-dessus montre par ailleurs que dans certains pays touchés, le taux de mortalité est supérieur à la moyenne générale : ainsi, les 4 malades recensés au Cambodge sont-ils tous morts ; en Thaïlande, seules 8 des 22 personnes touchées ont survécu ; en Indonésie, 11 décès ont été enregistrés sur les 16 cas signalés. On remarquera que les mois compris entre décembre et juin correspondent à des pics d'épidémie, les mois les plus frais semblant donc favorables à la résurgence du virus. L'apparition de nouveaux cas au cours de l'hiver 2005-2006 est donc à craindre dans la région. Les pays touchés sont, pour l'instant, au nombre de 6 mais ils le sont inégalement et ont été affectés différemment selon les phases. Le nombre des cas humains au Vietnam et en Thaïlande a été respectivement de 27 et de 17 entre décembre 2003 et octobre 2004. Mais à la différence de la Thaïlande, qui n'a pas observé de cas nouveaux de décembre 2004 à juin 2005, le Vietnam a enregistré une forte hausse du nombre de nouvelles contaminations pendant cette période : 65 cas observés depuis décembre 2004. Cependant, le taux de mortalité (30%) a baissé au cours de cette même période, grâce sans doute à une meilleure prise en charge des malades. La situation en Chine mérite une attention particulière. En effet, sur 25 foyers officiellement déclarés dans 9 provinces depuis la mi-octobre, 5 cas humains mortels seulement ont été officiellement recensés. A la demande du gouvernement chinois, une délégation de l'OMS a effectué des inspections dans plusieurs provinces chinoises. L'organisation internationale, de son côté, a demandé à la Chine, le 28 décembre, de lui communiquer en urgence les prélèvements réalisés dans les 31 foyers de grippe aviaire déclarés en 2005 dans ce pays. Il apparaît que Pékin n'a transmis aux experts étrangers aucun échantillon biologique du virus H5N1 qui a frappé ses élevages, alors que la surveillance des mutations du virus est la clé de la prévention d'une éventuelle pandémie. En Europe, aucun cas de contamination humaine n'avait été signalé jusqu'à ce que l'OMS confirme, depuis le début de cette nouvelle année, 3 décès dus à la forme humaine de la grippe aviaire en Turquie. On ne peut que faire le lien avec à l'extension vers l'Ouest des zones de foyers aviaires. Après avoir exclu, dans un premier temps, toute infection par le virus H5N1, sur la base de résultats d'analyse préliminaires, les autorités sanitaires turques ont ensuite confirmé que le décès des trois personnes était dû à ce virus. Elle appartenaient à la même famille et vivaient dans un village d'Anatolie orientale proche des frontières avec l'Iran et l'Arménie, au contact proche et prolongé de poulets malades. Ces éléments sont donc fortement évocateurs d'une source commune, animale, de contamination. M. David Nabarro, coordonnateur principal du système de l'ONU pour les grippes aviaire et humaine, a insisté sur « l'absolue nécessité de la plus grande vigilance sur le plan local, national et international, et des efforts intensifs pour être en mesure de répondre à toutes les formes de manifestations de la maladie ». Il a ajouté que pour l'instant, il n'y avait aucun indice déterminant sur la possibilité que la maladie soit contagieuse d'homme à homme. Si, donc, les données de base ne sont donc pas fondamentalement changées par l'apparition de ces nouveaux cas, l'extension de la zone géographique constitue inévitablement un facteur d'inquiétude. A la demande des autorités turques, une équipe d'experts de l'OMS, de la FAO ainsi que du centre européen de prévention et de contrôle des maladies (CEPCM) se sont rendus en Turquie pour enquêter sur la situation. Pour en revenir aux statistiques établies par l'OMS au plan mondial, il faut noter que les patients qui ont été hospitalisés pour un cas avéré de grippe aviaire sont plutôt jeunes, le plus souvent de jeunes enfants ou des adultes jusque là en bonne santé. Au Vietnam, l'âge moyen est de 15 ans : les enfants malades ont de 14 mois à 15 ans et l'adulte le plus vieux à avoir développé la maladie était âgé de 35 ans. En Thaïlande, la moyenne d'âge est de 20 ans. En Indonésie, le dernier cas concerne un adolescent de 16 ans. Les victimes turques avaient moins de 15 ans. Sur la totalité des cas recensés, seuls deux adultes de plus de 50 ans ont été atteints par la maladie. L'OMS n'a fourni pour l'instant aucune explication scientifique à ce profil pathologique. Enfin, dernière caractéristique : un taux élevé de létalité. Le tableau clinique de la maladie associe à des signes généraux (fièvre, malaise et douleurs diffuses), des signes neurologiques (prostration voire coma) mais ce sont surtout les atteintes respiratoires qui font la gravité de la maladie. Il s'agit de « pneumopathie virale primaire » : par rapport à la pneumopathie survenant chez les patients atteints de grippe habituelle, et qui est généralement une complication due à une infection bactérienne secondaire, celle-là est directement provoquée par le virus A(H5N1)et ne répond pas aux antibiotiques. Le taux de mortalité s'élève à 50% depuis le début de la crise. Sur ce point, l'OMS invite toutefois à la prudence : « Il n'est pas possible de calculer un taux de létalité fiable, les formes pauci symptomatiques survenant dans la communauté pouvant échapper à la détection. » (« Grippe aviaire : évaluation du risque de pandémie » - janvier 2005). En l'absence d'un système de détection systématique des cas, des formes bénignes de la maladie échappent vraisemblablement aux statistiques. Une délégation de la mission d'information en Asie du Sud-Est au mois de janvier Le Président et le Rapporteur de la mission se sont rendus en Asie du Sud-Est du 14 au 21 janvier. Après une étape à Hanoi, ils ont rejoint Pékin avant d'achever leur voyage par un passage à Hong Kong. A Pékin s'est tenue, les 17 et 18 janvier, une conférence internationale des pays donateurs en vue de financer la lutte contre la grippe aviaire et la préparation à une éventuelle pandémie humaine. Cette conférence, à laquelle le Président et le Rapporteur ont participé, a permis de réunir 1,6 millions d'euros, soit davantage que l'objectif de 1,2 millions d'euros initialement fixé. Ce financement global, témoin d'une prise de conscience internationale, permettra d'établir les bases d'une coordination renforcée entre tous les pays en matière de veille épidémiologique et sanitaire, animale et humaine. La déclaration de Pékin, qui a clos la conférence et par laquelle les pays s'engagent notamment à partager les informations et le matériel biologique, devrait inciter les pays atteints par la grippe aviaire à plus de transparence. L'aide de la France, d'un montant de 26 millions d'euros, sera accordée prioritairement au Laos, au Cambodge, au Vietnam et, à un moindre degré, à la Chine, surtout par le biais du très actif réseau local des instituts Pasteur, destinataire de 9 millions d'euros. Les instituts Pasteur du Cambodge, du Vietnam et de Chine (Hong Kong et Shanghai) développent des recherches de pointe en matière de virologie, cette recherche fondamentale poursuivant par ailleurs une visée thérapeutique (vaccinologie, nouvelles molécules antivirales). Les infections humaines par les virus grippaux aviaires sont rares. Les spécialistes de l'OMS sur la grippe humaine à influenza notent que « la faible fréquence de la grippe aviaire chez l'homme, malgré l'étendue de l'exposition à des volailles infectées, montre que la barrière des espèces est importante » (www.oms.int). Quand elles adviennent, elles ne provoquent, la plupart du temps, que des pathologies bénignes se manifestant souvent par une conjonctivite virale suivie de guérison complète. On a ainsi relevé des cas de transmission des virus A(H7N7) en 1996 et A(H3N2) (deux enfants hollandais infectés en 1994 par un virus aviaire réassorti chez le porc avec un virus humain). Plus récemment et plus gravement, en 2003, en Belgique et aux Pays-Bas, lors d'une épizootie de grippe aviaire A(H7N7), 89 cas humains ont été recensés, essentiellement des conjonctivites, avec 7 cas de syndrome grippal dont un fut mortel. · un virus animal qui est parvenu à infecter l'homme S'agissant du virus H5N1, on estimait, avant 1997, que le passage par le porc était obligatoire pour permettre le réassortiment des virus, dans la mesure où la surface des cellules des voies respiratoires de ce mammifère porte des récepteurs au virus grippal aviaire et au virus grippal humain. Mais, en 1997, un épisode de grippe aviaire a battu en brèche l'idée que ce virus ne pouvait pas contaminer directement les humains : à Hong Kong, un enfant de trois ans présenta des symptômes de grippe (toux, fièvre) et mourut infecté par ce virus. 17 autres cas, dont 5 fatals, suivirent. La décision fut alors prise de stopper l'infection aviaire en procédant à l'abattage de toutes les volailles domestiques et oiseaux d'ornement. La plupart des experts de la grippe reconnaissent que cet abattage a probablement permis d'éviter alors une pandémie. Pourtant, la forme humaine de la grippe aviaire H5N1 est réapparue en 2003 en Asie du Sud-Est. L'Institut Pasteur explique ainsi la contamination humaine : « L'infection de l'homme, inhabituelle, suppose une exposition forte de l'individu à la source de contamination. Ainsi, bien que les virus H5N1 ne se transmettent pas efficacement d'un individu à l'autre, ils ont déjà parcouru la première étape vers l'adaptation à l'homme, c'est-à-dire vers une menace de pandémie, ce qui est d'autant plus grave qu'ils se traduisent dans la majorité de cas par une maladie sévère. Le danger, c'est qu'ils acquièrent cette capacité à se transmettre d'homme à homme » (www.pasteur.fr). · des contacts répétés et prolongés avec des volailles contaminées Mme Sylvie Van der Werf5 a confirmé devant la mission d'information que l'infection de l'homme nécessitait une « exposition forte » de l'individu à la source de la contamination. Interrogée sur la portée de cette notion, elle a répondu : « Je crains de ne pouvoir fournir une réponse quantifiée pour mesurer ce que j'ai qualifié d'« exposition forte » ; tout dépend de la quantité de virus présente sur des particules, comme les poussières en suspension ; la concentration de virus à laquelle le sujet est exposé doit être importante pour initier l'infection. Je répète que le virus H5N1 est inadapté à l'homme, dans le sens où la quantité de virus nécessaire à l'infection doit être plus élevée - même si on ne peut pas la quantifier - que dans le cas de la grippe saisonnière. En théorie, une seule particule virale infectieuse peut suffire à contaminer un individu. Cependant, même en Asie, notamment au Vietnam, où les volailles sont omniprésentes sur les marchés et où il existe de nombreux élevages familiaux, le simple fait de passer à une dizaine de mètres d'un animal infecté ne suffit pas à attraper la maladie. En revanche, il est vrai que l'opération de plumage a donné lieu à plusieurs cas d'infection par le virus H5N1 ». L'exposition forte dépend donc largement des modes de vie et de consommation : là où il y a eu contamination humaine, il existe une grande promiscuité entre l'homme et l'animal. On considère actuellement que l'infection humaine résulte principalement d'un contact direct entre les volailles infectées et des objets contaminées par leurs déjections. Selon les constatations faites par l'OMS, les cas humains sont survenus dans des zones rurales ou périurbaines, où de nombreuses familles vivent avec quelques volailles qu'on laisse divaguer, voire pénétrer dans les habitations ou dans les aires de jeux d'enfants. Comme les volailles infectées excrètent d'importantes quantités de virus, les occasions d'exposition à des déjections infectées ou à un environnement contaminé sont nombreuses. En outre, les volailles constituant une source importante de revenus et de nourriture pour de nombreuses familles en Asie, celles-ci n'hésitent pas à vendre, abattre ou consommer des volailles qui présentent pourtant des signes de maladie. M. Philippe Vannier a ainsi confirmé devant la mission : « Il faut se souvenir que, sauf cas très particuliers, les animaux infectés n'entrent jamais dans la chaîne alimentaire en Europe. Il en va tout autrement en Asie ou dans les pays où, faute de protéines, les gens n'hésitent pas à consommer des animaux morts de grippe aviaire, ce que personne ne ferait ni en France ni en Europe ». Il est probable que l'exposition au virus se produit surtout lors des différentes phases de préparation de la volaille avant cuisson : abattage, plumage et dépeçage. Les experts de l'OMS corroborent cette analyse, en démontrent que, parmi les personnes travaillant dans le domaine de la santé ou dans les élevages de volailles, et exposées au virus aviaire A(H5N1), très peu de cas séropositifs ont été identifiés et la plupart du temps, ils étaient asymptomatiques. Il peut donc être admis que « les plus vulnérables se sont révélés être les fermiers vivant de l'agriculture de subsistance et leur famille, et ce sont eux qui constituent le véritable groupe à risque »6 . Au total, il apparaît donc que c'est, avant tout, à la suite de contacts fréquents et étroits avec des animaux malades que le virus de grippe aviaire a pu se transmettre à l'homme. · le rôle éventuel d'oiseaux porteurs sains du virus Dans quelques cas, les personnes contaminées n'avaient pas été en contact avec des volailles manifestement malades. Comment, dès lors, expliquer leur état ? Certains experts ont évoqué la possibilité d'une contamination par l'intermédiaire d'animaux porteurs sains du virus, comme pourraient l'être les canards domestiques notamment. Devant la mission d'information, M. Philippe Vannier a évoqué les conclusions des travaux du professeur Robert Webster, directeur du laboratoire de Hong Kong collaborant avec l'OMS, qui a inoculé les souches de virus H5N1 isolées à Hong Kong en 1997 à des canards : un quart d'entre eux n'a pratiquement pas manifesté de signes cliniques, ce qui laisserait penser que certaines espèces peuvent développer des résistances au virus et en être donc des porteurs sains. Dès la fin de l'année 2004, un communiqué conjoint de la FAO, de l'OMS et l'OIE faisait état d'études sur des canards domestiques infectés par le virus H5N1 mais restés asymptomatiques, et exprimait la crainte qu'ils puissent constituer un réservoir silencieux du virus. Le risque de contamination est majeur dans les pays d'Asie du Sud-est, où canards et poulets sont élevés en plein air, se mêlent à la faune sauvage et fréquentent les mêmes plans d'eau. Des flambées aviaires pourraient passer inaperçues dans les zones rurales où les familles ont un petit élevage en liberté mêlant canards et poulets, ce qui accroît d'autant la probabilité d'exposition humaine. Dans son document « Grippe aviaire : évaluation du risque de pandémie » cité plus haut, l'OMS indiquait que l'hypothèse d'oiseaux porteurs sains du virus pourrait aider à comprendre pourquoi plusieurs cas humains récents n'ont pas pu être expliqués par un contact avec des animaux malades. Votre Rapporteur propose de revenir sur cette question dans le deuxième rapport de la mission d'information consacré à l'épizootie, dans la mesure où il s'agit d'un sujet davantage lié à la santé animale qu'à la santé humaine. · une suspicion de transmission interhumaine, pour l'instant « inefficace » Si, donc, la plupart des cas humains de grippe aviaire ont pu être expliqués par l'exposition des malades à une source animale de contamination, il reste quelques cas pour lesquels cette explication ne suffit pas, les personnes concernées n'ayant pas été en contact avec des oiseaux malades ou susceptibles de l'être. Faut-il, pour eux, envisager la possibilité d'une transmission interhumaine du virus ? Pour les scientifiques de l'Institut Pasteur, « deux mécanismes sont imaginables : soit les virus, profitant du nombre croissant d'élevages contaminés, accumulent par hasard un ensemble de caractéristiques qui les rendent de plus en plus transmissibles ; soit, au cours de l'hiver, un sujet est infecté à la fois par un virus de la grippe saisonnière et par un virus de la grippe aviaire, et des échanges de matériel génétique interviennent à cette occasion, conférant en bloc au virus résultant de cet échange l'ensemble des caractéristiques nécessaires à son adaptation à l'homme et à une transmission accélérée » (www.pasteur.fr). Les auteurs d'une étude scientifique réalisée entre janvier 2004 et juillet 20057 retiennent l'hypothèse d'une transmission interhumaine. Ils montrent que sur les 109 cas humains constatés à cette date, 15 concernent des « clusters » (regroupements de cas) familiaux. Le cas le plus probant est le « cluster » n 6, survenu en Thaïlande, concernant une mère ayant soigné son enfant malade. Les auteurs de l'étude considèrent ce cas comme bien documenté et vraisemblablement le résultat d'une transmission limitée de personne à personne. Ils recommandent d'ailleurs des investigations rapides chaque fois qu'un « cluster » est identifié car il peut être la première indication d'une mutation virale vers une plus grande transmission interhumaine. C'est aussi l'explication avancé par Mme Sylvie Van der Werf a retenue devant la mission d'information : « (...) dans quelques cas cliniques, elle (la contamination interhumaine) semble être la seule option envisageable, les personnes touchées n'ayant jamais été exposées à des volailles infectées mais ayant par contre été au contact, de manière proche et prolongée, à des personnes malades ». Ces constatations doivent-elles faire craindre aujourd'hui qu'une transmission interhumaine est d'ores et déjà acquise ? Les spécialistes considèrent que si contamination interhumaine il y a, elle n'est pas, pour le moment, « efficace » ou « facile », les experts utilisant l'un ou l'autre adjectif. L'efficacité se caractérise, selon les critères de l'OMS, par la formation de chaînes de transmission durables, provoquant des flambées à l'échelle des populations : c'est la pandémie. Nous n'en sommes pas là pour le moment. Devant la mission d'information, Mme Margaret Chan8 , en charge du dossier de la grippe aviaire à l'OMS, évoquant l'hypothèse d'une « transmission facile de la maladie d'une personne à une autre », a précisé : « ce n'est pas encore le cas ». Pour le moment, l'OMS considère que ces transmissions interhumaines inefficaces ne doivent pas faire l'objet d'une inquiétude particulière. Elle relève, en effet, que dans aucun des cas recensés, le virus ne s'est propagé au-delà d'une première génération de contacts étroits, ni n'a provoqué de cas dans la population générale. Au demeurant, dans un certain nombre de situations, la grippe aviaire a touché les membres d'une même famille : il est alors très difficile, voire impossible, de déterminer s'il y a eu effectivement transmission interhumaine, dans la mesure où tous les membres de la famille ont généralement été exposés aux mêmes sources animales de contamination. En tout état de cause, dans tous les cas d'infection humaine enregistrés à ce jour, et quelle qu'ait pu être la source de contamination, le virus aviaire a gardé sa structure génétique d'origine et n'a donc subi aucune mutation à l'occasion de sa transmission à l'homme. Mme Sylvie Van der Werf l'a confirmé devant la mission : « Dans tous les cas où une infection interhumaine était soupçonnée, l'analyse du virus a établi que celui-ci avait conservé une nature totalement aviaire, sans aucune recombinaison du matériel génétique ». Mais que se passerait-il si le virus, un jour, mutait ? 1.-1.-3. La crainte de voir apparaître un virus mutant, de nature pandémique L'hypothèse d'une mutation du virus aviaire H5N1 est aujourd'hui très sérieusement envisagée par la communauté scientifique. Les experts n'excluent pas qu'à l'occasion de contaminations successives de plus en plus nombreuses, le virus puisse subir une mutation génétique qui le rende plus facilement mais aussi plus rapidement transmissible d'homme à homme. La propagation de ce virus muté se trouverait, au surplus, favorisée par la mondialisation du trafic aérien et la généralisation des transports collectifs en milieu urbain. Enfin, les moyens médicaux que les autorités sanitaires auraient à leur disposition seraient certainement insuffisants pour contrôler au plus vite ce qui serait alors devenue, à l'évidence, une pandémie. -- La grande mutabilité des virus grippaux La grippe est due à trois groupes de virus, A, B et C. Or, si les virus de type C sont relativement stables, les virus de type A et B évoluent sans cesse. Trois mécanismes de variation ont été identifiés9. Un premier mécanisme de variation est appelé glissement antigénique : des mutations de gènes codant des protéines de surface provoquent des modifications mineures du virus. Le nouveau variant reste très proche du précédent, si bien que l'immunité conférée par une grippe contractée précédemment protégera contre le nouveau variant. Cependant, l'accumulation de ces modifications finit par entraîner une différence antigénique qui aboutit à une moindre reconnaissance du nouveau virus par les systèmes immunitaires qui ont rencontré les précédents virus dans le passé. C'est pourquoi les fabricants de vaccins sont obligés de changer les souches vaccinales plus ou moins régulièrement. Le caractère progressif de ces changements explique que la plupart des épidémies soient souvent mineures ou de moyenne importance. Pour les virus de type A, il existe un deuxième phénomène de variation, appelé cassure, qui peut être plus grave. Des changements radicaux des protéines antigéniques du virus, avec le remplacement d'une protéine par une autre, donnent naissance à un nouveau virus, totalement différent de celui qui circulait jusque-là. Brutalement ce nouveau virus apparaît et gagne tous les continents. C'est la pandémie. L'immunité préexistante ne protège pas et un vaccin préparé avec les souches précédentes est inefficace. Une cassure impliquant le gène de la protéine majeure de surface du virus, l'hémagglutinine, constitue le point de départ d'une pandémie potentielle, après laquelle une période de circulation dans l'espèce humaine s'installe avec des épidémies saisonnières dites « normales ». Depuis vingt-cinq ans, les virus en circulation sont des descendants du virus Hong Kong (1968). Les vaccins préparés chaque année, dits interpandémiques, sont efficaces. A ces deux mécanismes, il faut ajouter la possibilité de réémergence d'un virus ancien. Ainsi, un sous-type disparu depuis 1957 est réapparu en 1977 causant "l'épidémie de grippe russe", et les virus qui en sont dérivés circulent toujours aujourd'hui. Deux raisons sont avancées pour expliquer un changement soudain de sous-type. La première possibilité serait que la circulation d'un sous-type dans la population humaine cesse pendant plusieurs années, mais que le virus reste présent dans une population animale. Dans ce cas, un contact direct entre un animal infecté et un être humain pourra alors remettre à nouveau le virus en circulation. Par exemple, le sous-type H1N1 qui a provoqué la « grippe espagnole » en 1918, avait disparu de la population humaine vers 1957. Pourtant, il est resté présent chez le porc, ce qui lui a permis de réapparaître chez l'homme 20 ans plus tard, en 1977. La seconde possibilité est qu'un sous-type soit nouvellement créé par réassortiment génétique. Il se produit lors d'une co-infection d'un hôte par deux virus différents qui, dans le cas qui nous intéresse, seraient un virus aviaire et un virus infectant les mammifères (donc l'homme). Au sein d'une même cellule, les deux virus vont se multiplier, faisant ainsi de nombreuses copies de leurs génomes. Lors de l'assemblage des nouveaux virus, des virus mosaïques ayant incorporé aléatoirement des segments de génome de l'un et de l'autre des virus parentaux seront formés. Si ce nouveau virus possède des segments H5 et N1 propres au virus aviaire, il échappera complètement à la reconnaissance du système immunitaire humain. S'il possède également des gènes qui lui permettent de se multiplier efficacement chez les mammifères, il aura alors la capacité de se transmettre d'homme à homme aussi efficacement que la grippe « classique ». Ceci est en faveur d'une dissémination rapide et mondiale du virus répondant à la définition de pandémie. Les virus de la grippe se transmettent par voie aérienne, par le biais des gouttelettes de salive émises lors de la toux. Ce mode de transmission est particulièrement efficace et explique donc la forte contagiosité de la maladie, le nombre de particules virales atteignant un à dix millions par millilitre. Elle est d'autant plus grande que les individus sont proches : le métro et l'école sont, par exemple, des lieux privilégiés de contamination. La contagiosité dépend aussi du statut immunitaire du sujet qui inhale les particules virales, selon qu'il est vacciné, ou bien immunodéprimé, âgé, bébé de moins d'un an, etc. Lorsqu'il pénètre l'organisme, le virus entame un processus de multiplication nécessaire à sa survie. Pour en comprendre le mécanisme, référons-nous aux explications fournies par les Professeurs Jean-Philippe Derenne et François Bricaire dans leur ouvrage « Pandémie : la grande menace » : « Le virus de la grippe ne peut survivre qu'en se multipliant et il n'est capable de le faire qu'à l'intérieur d'une cellule, car il ne possède pas de système lui permettant de reproduire seul ses acides nucléiques pour assurer sa réplique, il doit donc pénétrer une cellule et obliger cette dernière à fabriquer non pas sa propre structure mais la sienne -celle du virus. La réplication virale s'opère en plusieurs étapes ». Le schéma suivant décrit le processus de réplication. 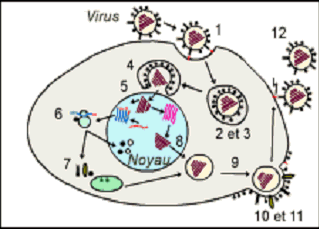 Source : www.ornithomedia.com 1) Amarrage du virus à la cellule. 2) Entrée dans la cellule par endocytose. 3) Diminution du pH jusqu'à un niveau suffisant d'acidité pour entraîner les étapes ultérieures. 4) Fusion, libération du contenu du virus dans la cellule. 5) Entrée de l'ARN viral dans le noyau de la cellule. 6) Fabrication de nouveaux brins d'ARN viral, copiés de ceux d'origine. 7) Fabrication des protéines virales. 8) Sortie du noyau des nouvelles copies d'ARN. 9) Migration des éléments. 10) Assemblage. 11) Bourgeonnement. 12) Libération des nouvelles particules virales. Dès qu'il est contaminé, le malade commence à excréter des particules virales contagieuses, l'excrétion se poursuivant pendant les 5 à 7 jours suivants. Il est donc contagieux dès le début de la période d'incubation, qui dure environ 2 jours et pendant laquelle aucun signe clinique n'est visible. La grippe résulte donc, on le voit, d'un processus de contamination extrêmement rapide, qui touche aussi bien l'organisme atteint que l'environnement immédiat du sujet malade. -- Une propagation favorisée par les modes de transports collectifs Une personne infectée par un virus grippal est extrêmement contagieuse dans un rayon de deux à quatre mètres. Elle contamine, de ce fait, plusieurs personnes dans les transports en commun. On imagine le nombre de personnes pouvant être atteintes, dans une rame de métro, aux heures de pointe, par un usager malade. La mondialisation des transports aériens complique, en outre, singulièrement les données du problème. Autrefois, lorsque les longs voyages s'effectuaient par bateau, la personne malade développait la maladie pendant la traversée et, en arrivant au port, tous les passagers du bateau étaient alors mis en quarantaine. Les voyages par avion sont aujourd'hui trop courts pour qu'une personne embarquant alors qu'elle est déjà infectée mais sans signes cliniques apparents puisse être détectée. Les caméras thermiques, qui permettent de repérer, à l'embarquement ou au débarquement, les passagers fébriles ne pourront pas identifier toutes les personnes atteintes. Comme l'a souligné M. Jean-Claude Désenclos devant la mission d'information : « L'installation de caméras thermiques dans les aéroports permettrait certes de détecter les voyageurs ayant de la fièvre, mais seulement une très faible proportion des porteurs de virus de la grippe aviaire ou de grippes endémiques revenant de l'étranger : au mieux 20 % en fonction des périodes d'incubation. Autrement dit, ces outils très coûteux n'empêcheront pas les 80 % qui restent de développer la maladie, une fois rentrés chez eux. Leur impact sera donc très limité. Ce ne sont pas eux, quoi qu'on ait dit, qui ont permis de gérer le SRAS, mais des mesures rigoureuses de détection et d'isolement des malades - avec, il est vrai, l'avantage d'une période d'incubation beaucoup plus longue ». L'arrivée dans un pays de quelques personnes infectées pourrait donc suffire à déclencher une pandémie. Or, il est à craindre que cette hypothèse ne se réalise avant la déclaration de pandémie par l'OMS, dont le premier effet sera d'entraîner la suspension de toutes les liaisons aériennes avec la région contaminée. -- Un vaccin qui n'existe pas encore et des antiviraux imparfaits La variabilité et les mutations fréquentes des virus grippaux interdisent de disposer d'un vaccin permanent garantissant une immunité sur plusieurs années, ce qui explique que la composition du vaccin contre la grippe doive, chaque année, être modifiée pour tenir compte des caractéristiques des différentes souches virales en circulation au moment de la fabrication du vaccin. Ces ajustements réguliers n'empêchent pas que, parfois, le vaccin mis sur le marché ne corresponde pas exactement au virus qui provoquera l'épidémie grippale quelques mois plus tard. De ce fait, la couverture vaccinale est parfois imparfaite. Le virus H5N1, s'il devait muter vers une forme transmissible à l'homme, n'aura que peu à voir, voire rien à voir, avec le virus à l'origine de l'épizootie actuelle. C'est ce qui complique singulièrement la tâche des fabricants de vaccins qui, ignorant encore aujourd'hui les caractéristiques de ce virus muté, d'un type nouveau, ne peuvent pas proposer de vaccin adapté, même si, on verra plus loin, ils s'efforcent dès maintenant d'en anticiper autant que faire se peut la préparation. La fabrication du futur vaccin ne pourra commencer qu'une fois la souche virale responsable de la pandémie identifiée. En attendant d'en disposer, les autorités sanitaires auront à leur disposition, en termes de moyens pharmaceutiques, les quelques antiviraux actuellement sur le marché pour soigner la grippe. Or, le principal d'entre eux, le Tamiflu, n'est efficace que s'il est prescrit très vite après l'apparition des premiers symptômes, au plus tard dans les 48 heures, comme on le verra plus loin. Si on ne consulte pas son médecin dès les premières sensations de fébrilité, dans l'attente de symptômes plus évidents de la grippe, le délai de 48 heures est vite passé. Quant au Relenza, un autre antiviral grippal, il est d'un usage peu aisé, s'administrant par aérosol, et est donc peu prescrit. Si, donc, pour l'heure, la contamination humaine reste limitée à un nombre de cas somme toute réduit, comparé aux millions de personnes qui auraient pu être infectées, une épée de Damoclès reste suspendue au-dessus de nos têtes : le risque pandémique est, en l'état actuel des connaissances scientifiques et des constatations sur le terrain, impossible à écarter. La prudence impose donc d'envisager toutes les hypothèses, allant de quelques cas de contamination humaine à la pandémie. Tel est l'objectif auquel répond le plan élaboré par le Gouvernement français en 2004, et qui constitue un cas d'application du principe de précaution. 1.-2. L'APPLICATION DU PRINCIPE DE PRÉCAUTION A l'issue du Conseil des ministres du 13 octobre 2004, le ministre de la santé et de la protection sociale, présentant une communication sur le plan de prévention et de lutte contre le risque de pandémie grippale d'origine aviaire, a indiqué que ce plan avait été mis au point « en application du principe de précaution ». Plus récemment, le Président de la République a demandé au Gouvernement lors du Conseil des ministres du 25 août 2005 « d'appliquer pleinement le principe de précaution concernant la grippe aviaire, et ce afin que chaque Français soit protégé ou puisse être soigné en cas d'apparition de la maladie ». C'est bien dans cet esprit que devant la mission, M. Xavier Bertrand, ministre de la santé et des solidarités, a souligné que la situation actuelle imposait de prendre le « maximum de précautions ». Il importe de faire ici une mise au point sur la portée juridique stricte du principe de précaution, expression souvent employée improprement, d'autant plus qu'en matière de santé publique, la confusion entre principe de prévention et principe de précaution est fréquente. Rappelons la distinction énoncée dans le rapport remis en octobre 1999 au Premier ministre sur « Le principe de précaution » par M. Philippe Kourilsky10 et Mme Geneviève Viney11 : « La précaution vise à limiter les risques encore hypothétiques, ou potentiels, tandis que la prévention s'attache à contrôler les risques avérés (...). La précaution se distingue de la prévention du fait qu'elle opère en univers incertain ». C'est sur la base du principe de prévention face à un risque avéré qu'ont été décidées, en leur temps, des mesures instituant des cordons sanitaires lors des épidémies de choléra, de mise à l'écart des lépreux ou d'isolement de malades tuberculeux. Ce même principe de prévention a inspiré la rédaction du code de la santé publique sur la question de la luute contre les épidémies et certaines maladies transmissibles, plus spécifiquement son article L.3110-1. Cet article permet au ministre chargé de la santé, « en cas de menace sanitaire grave appelant des mesures d'urgence », de prendre par arrêté motivé, « dans l'intérêt de la santé publique, toute mesure proportionnée aux risques courus et appropriés aux circonstances de temps et de lieu afin de prévenir et de limiter les conséquences des menaces possibles sur la santé de la population ». Dans la gestion du risque - incertain- de pandémie de grippe aviaire, les pouvoirs publics ont décidé d'aller au-delà du simple principe de prévention et d'appliquer le principe de précaution, eu égard aux conséquences qu'entraînerait la réalisation de ce risque. C'est en matière d'environnement que le principe de précaution a été consacré, d'abord sur le plan international, par la déclaration de Rio en 1992. Ce principe a ensuite été mentionné dans le traité de Maastricht, la seule référence explicite au principe de précaution étant contenue dans le titre consacré à l'environnement du traité de l'Union européenne, plus précisément à l'article 174-2 du traité instituant la Communauté européenne. Toutefois, la Cour de justice des Communautés européennes (CJCE), dans deux arrêts rendus le 5 mai 1998 dans des affaires relatives à l'encéphalite spongiforme bovine (affaires C-157/96 et C-180/96), a posé le principe de précaution en matière de santé publique comme un principe général du droit européen : « il doit être admis que, lorsque des incertitudes subsistent quant à l'existence ou à la portée des risques pour la santé des personnes, les institutions peuvent prendre des mesures de protection sans avoir à attendre que la réalité et la gravité de ces risques soient pleinement démontrées ». En outre, le juge communautaire a, par deux arrêts du 11 septembre 2002 (Affaires T-13 /99), apporté des précisions importantes sur le principe de précaution en matière sanitaire : la mesure de précaution ne peut être fondée sur de simples hypothèses scientifiquement non vérifiées, mais doit se fonder sur un risque ayant un certain degré de probabilité. Tirant les conséquences de ces arrêts, la Commission européenne affirme, dans sa communication intitulée « Le recours au principe de précaution » (COM/2000/1), que le principe de précaution est un principe d'application générale qui doit notamment être pris en compte dans le domaine de la santé humaine. En droit français, les textes établissant expressément le principe de précaution sont propres à l'environnement. Ainsi, après avoir été inscrit dans la loi (« loi Barnier » n°95-101 du 2 février 1995 codifiée dans le code de l'environnement), ce principe a été consacré sur le plan constitutionnel dans l'article 5 de la Charte de l'environnement de juin 2004. Ce texte définit les conditions de mise en œuvre de ce principe et la nature des mesures à prendre : « Lorsque la réalisation d'un dommage, bien qu'incertaine en l'état des connaissances scientifiques, pourrait affecter de manière grave et irréversible l'environnement, les autorités publiques veillent, par application du principe de précaution et dans leurs domaines d'attributions, à la mise en œuvre de procédures d'évaluation des risques et à l'adoption de mesures provisoires et proportionnées afin de parer à la réalisation du dommage ». Ce cadre est probablement le plus précis parmi les Constitutions contemporaines. En matière de santé publique, c'est la jurisprudence qui a reconnu le principe de précaution. Dans sa décision du 29 décembre 1999, « Syndicat national du commerce extérieur des produits congelés et surgelés », relative à l'affaire dite des « perches du Nil », le Conseil d'État a admis la suspension de mise sur le marché de certains produits « eu égard aux mesures de précaution qui s'imposent en matière de santé publique ». Au regard de ces données, l'examen de la situation internationale actuelle, la nature du risque pandémique encouru par la population française et mondiale, ainsi que les analyses scientifiques sur les perspectives de réalisation de ce risque justifient pleinement l'application du principe de précaution. Certes, si comme l'a précisé Mme Nathalie Kosciuko-Morizet, députée, dans le rapport relatif à la Charte de l'environnement fait au nom de la commission des lois constitutionnelles, de la législation et de l'administration générale de la République (page 98), « La Charte de l'environnement n'est pas une charte de santé publique », elle peut, à l'évidence, servir de référence dans le cas qui nous occupe, en particulier son article 5. Aujourd'hui, les critères définis par cet article semblent satisfaits : d'une part, la réalisation du dommage est incertaine mais elle est plausible, au vu des données scientifiques disponibles ; d'autre part, en cas de concrétisation du risque pandémique, il va de soi que les conséquences seraient à la fois graves et irréversibles. Les spécialistes appellent, eux aussi, les responsables politiques à agir dès maintenant. Ainsi, les professeurs François Bricaire12 et Jean-Philippe Derenne invitent-ils les autorités publiques, dans leur ouvrage « Pandémie : La grande menace. Grippe aviaire : 500 000 morts ? », à adopter cette démarche de précaution : « Il n'y a pas de fatalité. La catastrophe est annoncée, mais ses conséquences seront toutes différentes si une politique raisonnable et pragmatique est décidée et menée ou si, au contraire, l'incurie et l'indifférence nous laissent désarmés face à la menace. Peut-être même ne se passera-t-il rien. Mais les indices, unanimement reconnus par la communauté scientifique internationale, sont suffisamment inquiétants pour craindre le pire. Il est donc impératif de se tenir prêt, de décider des mesures à prendre et des les mettre en œuvre pour l'affronter ». Dans leur rapport cité plus haut, M. Philippe Kourilsky et Mme Geneviève Viney observaient que : « Au dicton « dans le doute, abstiens toi », le principe de précaution substitue l'impératif « dans le doute, mets tout en œuvre pour agir au mieux » : il appartient à notre mission d'apprécier si les pouvoirs publics ont pleinement appliqué cette formule dans l'élaboration des mesures de lutte contre la pandémie et si celles-ci sont proportionnées aux dommages envisagés. Observons, pour conclure, que le contrôle du Parlement sur la mise en œuvre du principe de précaution sera d'autant plus important et légitime que certaines des décisions prises le moment venu (réquisitions des personnes et des biens, limitation des déplacements...) pourraient comporter des restrictions provisoires à certaines libertés publiques. 1.-3. LA MISE AU POINT PAR LA FRANCE, DÈS 2004, D'UN PLAN DE LUTTE CONTRE LA PANDÉMIE Le plan de lutte contre une pandémie grippale est le fruit d'une réflexion menée par les pouvoirs publics français, notamment le ministère de la santé, en liaison avec l'OMS et les autorités communautaires. Le Rapporteur se bornera ici à quelques remarques générales : il en proposera une analyse complète dans son troisième rapport qui sera consacré, conformément au programme de travail que la mission s'est fixé, à l'analyse du dispositif français. 1.-3.-1. Le plan français mis au point en 2004 Le plan français, reprenant les niveaux d'alerte définis par l'OMS en 1999, distingue une phase pré-pandémique et une phase pandémique, chacune se déclinant en différents niveaux d'alerte afin de tenir compte de facteurs supplémentaires de préoccupations (tableau joint). Les niveaux d'alerte peuvent représenter un niveau d'entrée direct dans la crise sans avoir été précédés par les niveaux d'alerte moindres. Le plan s'articule en trois volets, le seuil clé étant la confirmation par l'OMS d'une transmission interhumaine liée à l'apparition d'un nouveau sous-type de virus vis-à-vis duquel l'immunité de la population apparaît faible ou nulle. Dans le cadre du premier volet intitulé « Une nouvelle menace grippale, sans transmission interhumaine », trois cas de figure sont envisagés. Une épizootie sans infection humaine située en dehors de France ne justifie que des mesures de surveillance vétérinaire internationale. Dès qu'elle atteindrait la France, les mesures viseraient à contenir le virus et à protéger les personnes exposées. L'apparition d'un seul cas humain, point de départ de l'alerte de l'OMS à la pandémie, impliquerait des mesures de détection précoce des cas humains sur le territoire français, les malades étant pris en charge à domicile. Dans l'hypothèse de plusieurs cas humains, et en l'absence d'infections en France, l'accent serait mis sur les mesures d'information du public, notamment des voyageurs, et sur la surveillance des cas pouvant entrer en France. En cas d'infection humaine déclarée en France, la détection précoce et la surveillance épidémiologique renforcée viseraient à contenir la progression du virus. La prise en charge médicale des patients serait organisée autour du numéro d'urgence 15 et le patient, hospitalisé si nécessaire, bénéficierait d'un traitement curatif. C'est dans le cadre de ce premier volet qu'est prévue la constitution de stocks de sécurité de médicaments pour un usage prophylactique et curatif. La « confirmation d'une transmission interhumaine mais qui reste limitée » (deuxième volet) rend possible la diffusion rapide du nouveau virus et donc, le déclenchement de la pandémie. A ce stade, les stocks de sécurité d'antiviraux et d'équipements de protection devraient être prêts et, le cas échéant, complétés en fonction des prévisions épidémiologiques et des capacités de production. Les mesures susceptibles d'être prises devraient être fonction de l'évolution de la transmission interhumaine à l'étranger et sur le territoire national et pourraient être contraignantes. Si la transmission humaine ne concerne que des cas hors de France, l'objectif consisterait à limiter les risques d'importation du virus le plus précocement possible et à détecter l'arrivée sur le territoire des premiers cas d'infection humaine afin de ralentir la transmission locale. Des mesures de restrictions de voyages et d'isolement à l'entrée du territoire s'appliqueraient. La prise en charge des malades, organisée par le centre 15, comprendrait un traitement curatif précoce par antiviraux et des mesures d'isolement, à domicile ou à l'hôpital. En cas de transmission interhumaine touchant la France, toutes les mesures précédemment évoquées seraient applicables et les pouvoirs publics pourraient décider des traitements prophylactiques par antiviraux. En « phase pandémique » (troisième volet), l'Institut de veille sanitaire a évalué le nombre des malades entre 9 et 21 millions et celui des décès entre 91.000 et 212.000 ; le nombre des personnes dont l'état nécessiterait une hospitalisation serait de 500.000 à un million. Le plan envisage plusieurs vagues successives de pandémie et deux étapes différenciées, l'une au cours de laquelle le virus pourrait acquérir progressivement sa capacité de transmissibilité et l'une à cinétique rapide caractérisée par sa forte transmissibilité. Compte tenu des ces éléments, il s'agirait, dans un premier temps, de freiner autant que possible la diffusion du virus afin d'améliorer le niveau de préparation et de réaction, en continuité avec les deux phases précédentes. Par la suite, les mesures de restriction d'activité contribueraient à limiter le nombre des personnes affectées. Les mesures sectorielles prises pour assurer la continuité de l'État et de la vie sociale et économique devraient prendre en compte l'absentéisme induit par la pandémie, reposant sur la distinction entre services essentiels et services non essentiels. Le système de santé devrait donner une réponse adaptée à une augmentation massive et rapide des besoins ; le principe d'une prise en charge proportionnée à l'état des malades a été posé. 1.-3.-2. Une actualisation en cours M. Didier Houssin13 a indiqué à la mission d'information que l'exercice organisé le 30 juin 2005 sous l'égide du SGDN (secrétariat général de la défense nationale) et du SIG (Service d'information du gouvernement), avait mis en lumière les points à améliorer dans le dispositif. Un autre exercice, cette fois-ci européen, a eu lieu à la fin du mois de novembre, dont les résultats ne sont pas encore connus ; le ministre de la santé, M. Xavier Bertrand, a indiqué devant la mission que « nous attendons d'ailleurs ces résultats pour valider définitivement notre plan ». L'évolution de la situation internationale justifie également cette actualisation. Des propos du Ministre et de M. Didier Houssin devant la mission, il ressortait que l'actualisation devait porter sur les points suivants : -- le renforcement de la cohérence de l'État et la coordination gouvernementale. Tel a été l'objet de la nomination de M. Didier Houssin lui-même, par ailleurs directeur général de la santé, comme délégué interministériel à la lutte contre la grippe aviaire, par le décret n °2005-1057 du 1er septembre 2005. Lors de son audition, il a donné à la mission un aperçu de l'étendue de ses compétences : à son activité de coordination interministérielle, s'ajoutent une mission de suivi des mesures décidées et un rôle d'évaluation en continu de la pertinence des mesures décidées ; il assure aussi une mission de cohérence générale au niveau international et européen ; -- l'élaboration d'une stratégie « communication-formation-information » permettant d'informer les Français sur le risque sanitaire, de préparer les professionnels, notamment ceux du secteur de la santé et de la filière avicole, et de sensibiliser les acteurs économiques au maintien de l'activité de la société ; -- une attention particulière portée à la situation des Français de l'étranger. Le ministre de la santé, M. Xavier Bertrand, a souligné devant la mission que « la façon dont nous préparons la prise en charge de nos ressortissants permettra à notre opinion d'apprécier notre capacité à réagir face à un risque pandémique sur le territoire national ». Il a dit avoir constaté, lors de son voyage au mois de novembre en Asie, la grande sérénité de nos compatriotes sur le sujet de la grippe aviaire. Notons que les postes diplomatiques français à l'étranger ont d'ores et déjà reçu des dotations en antiviraux destinés aux personnels diplomatiques et aux Français résidant sur place ; -- l'approfondissement de la coopération internationale et européenne. Dans une logique visant à retarder la pandémie, la coopération européenne, aux yeux du ministre de la santé et des solidarités, est un sujet prioritaire. Un conseil informel des ministres européens de la santé s'est tenu le 20 octobre et une réunion des ministres s'est tenue le 9 décembre, dont l'objet était de tirer les leçons de l'exercice de simulation organisé les 23 et 24 novembre afin de tester les capacités de l'Union européenne à réagir efficacement. Dans la lutte qui sera engagée contre la pandémie, il est essentiel que les 25 pays membres de l'Union européenne adoptent les mêmes mesures de contrôle aux frontières et les plus rigoureuses possibles. Des mesures prises par un seul pays sont vouées à l'échec. La détermination d'un axe de coopération européenne ne peut se faire que si tous les pays ont un même niveau de conscience du risque. Devant la mission, M. Xavier Bertrand a souligné que l'actualisation du plan français en ce qui concerne les mesures de contrôle aux frontières était suspendue aux mesures qui seront décidées au plan européen ; -- un alignement des niveaux d'alerte sur le nouveau « phasage » décidé en 2005 par l'OMS ; la France devrait adopter le même découpage des périodes. Selon les critères de l'OMS, nous sommes aujourd'hui au stade 3 de la période d'alerte à la pandémie ; -- la prise en compte de l'élargissement de la zone d'épizootie. Selon M. Didier Houssin, le scénario le plus largement probable et le plus redoutable reste celui de l'arrivée en France d'une personne contaminée alors que vient de se déclencher une transmission interhumaine dans un pays d'Asie. Le plan actualisé devra tenir compte de l'élargissement de la zone d'épizootie vers le Sud (Indonésie), le Nord-Ouest (Chine, Mongolie, Sibérie, Kazakhstan) et l'Ouest (Turquie, Roumanie). Le Ministre a présenté à la mission d'information, le 11 janvier dernier, le nouveau plan, désormais intitulé : plan gouvernemental de prévention et de lutte « pandémie grippale », et qui remplace celui d'octobre 2004. Il est en ligne sur le site du ministère de la santé et des solidarités. La mission en entamera prochainement l'examen détaillé et présentera ses conclusions dans le dernier des trois rapports qu'elle a prévu de publier tout au long de ses travaux (cf supra). -------- II. DES STOCKS DE MOYENS PHARMACEUTIQUES ET DE MATÉRIELS DE PRÉVENTION ONT ÉTÉ CONSTITUÉS MAIS LA FRANCE N'EST PAS ENCORE PRÊTE Depuis 2004, le Gouvernement a donc décidé de préparer la France à une éventuelle pandémie. On a vu qu'un plan de lutte définissant les étapes successives de la mobilisation sanitaire après détection des premiers cas de contamination humaine avait été élaboré. L'objectif est, avant tout, de retarder au maximum la propagation du virus, en attendant la mise au point du vaccin qui permettra de stopper la pandémie. Le vaccin sera, en effet, l'arme la plus efficace, mais comme il sera fabriqué à partir de la souche virale responsable de la pandémie, il ne sera pas disponible tout de suite, mais seulement au mieux six mois après l'identification de la souche et le lancement de son processus de fabrication. En attendant, comme l'a indiqué M. Jean-Claude Désenclos devant la mission d'information, il faut « gagner du temps pour se rapprocher du moment où le vaccin sera produit. C'est une stratégie de course contre la montre au cours de laquelle la mise en œuvre de mesures imparfaites mais complémentaires peut diminuer l'impact initial de la maladie ». Les mesures auxquelles il est fait allusion sont, essentiellement, la prescription d'antiviraux et l'utilisation de matériels de protection individuelle, les masques principalement, associés à des mesures d'hygiène simples mais rigoureuses. Le plan français prévoit, dès le premier niveau d'alerte, la constitution de stocks de sécurité en produits de santé (anti-viraux, antibiotiques) et en équipements de santé. La constitution de ces stocks doit prendre en compte à la fois la durée estimée de la pandémie et sa gravité, éléments difficiles à évaluer. On sait qu'une pandémie se produit généralement en deux vagues, mais sans que leurs durées respectives ni l'intervalle les séparant l'une de l'autre ne soient aisément prévisibles. Quant à sa gravité, elle dépendra du « taux d'attaque » du virus : les projections réalisées par l'InVS ont été élaborées sur la base de deux hypothèses, l'une fixant le taux d'attaque à 15%, l'autre à 35%. Dans le premier cas, on compterait environ 9 millions de malades, dans le second 20 millions. C'est au regard de ces considérations qu'il faut donc apprécier les stocks d'ores et déjà constitués en France d'antiviraux, d'antibiotiques et de masques de protection. Redisons-le : ce seront les seules armes disponibles lors de la première vague pandémique, en attendant la mise au point du vaccin. On évoquera d'abord la question des stocks de médicaments et de masques de protection, avant d'aborder la problématique particulière du vaccin pandémique. 2.-1. : LES STOCKS D'ANTIVIRAUX 2.-1.-1. Le rôle essentiel des antiviraux en cas de pandémie Les antiviraux n'empêchent pas l'infection mais, comme l'a analysé Mme Sylvie Van der Werf, ils « réduiront la durée de la maladie, la multiplication du virus et par conséquent, sa capacité de propagation ». L'administration préventive d'antiviraux, en réduisant le nombre des cas humains, pourrait limiter le risque que le virus n'améliore encore sa transmissibilité. Par ailleurs, Mme Van der Werf a fait remarquer que les malades ainsi soignés efficacement lors de la première vague pandémique développeront des anticorps qui leur apporteront une protection immunitaire dont l'efficacité, au moment de la seconde vague, pourrait se révéler comparable à celle d'une vaccination. Enfin, les antiviraux auraient encore un rôle à jouer si, comme le craignent les professeurs Bricaire et Derenne dans leur ouvrage précité, le vaccin mis au point après la première vague n'était finalement que partiellement efficace. 2.-1.-2. Les différents antiviraux disponibles Deux sortes d'anti-viraux sont actifs sur le virus grippal : les uns ont pour cible la protéine M2 et les autres la neuraminidase NA. Les inhibiteurs de la molécule M2, tel l'amantadine, ont été les premiers sur le marché. Leur efficacité dans le traitement curatif et préventif de la grippe est avérée mais leur utilisation a toutefois été limitée par la constatation de résistances survenant très rapidement. Les souches isolées dans les cas de grippe humaine due au virus A(H5N1) se sont révélées résistantes : ainsi à Hong Kong, en 1997, cet antiviral s'est révélé inefficace. M. Henry-Vincent Charbonné14 n'a pas manqué de le rappeler devant la mission : « les (...) anti-viraux tels l'amantadine ou la rimantadine, voient rapidement apparaître des résistances, ce qui les rend inefficaces en cas de pandémie grippale. De plus, ces produits ne sont pas forcément bien tolérés ». Les inhibiteurs de la neuraminidase NA s'attaquent, quant à eux, à la protéine qui joue un rôle majeur dans la réplication du virus de la grippe, et donc de sa diffusion. La recherche sur ce concept thérapeutique, développé dès les années 70, a permis la mise au point de composés efficaces : le zanamivir en 1993 et l'oseltamivir en 1997. Le Relenza, dénomination commerciale du zanamivir, produit par le laboratoire GlaxoSmithKline (GSK), se présente sous forme de poudre sèche qui s'inhale et gagne ensuite les voies aériennes et les poumons. Ne pouvant pas franchir la barrière gastro-intestinale, le Relenza est administré à l'aide d'un dispositif d'inhalation, peu aisé d'emploi, ce qui explique que cet antiviral soit peu prescrit : alors que les ventes de Tamiflu, l'autre antiviral sur le marché, atteignaient déjà 460 millions de dollars pour la première moitié de 2005, GSK n'avait vendu que pour 5,4 millions de dollars de Relenza en 2004. M. Christophe Weber15 a confirmé que « ce produit n'a pas été un succès en raison des contraintes de son administration ». L'oseltamivir, commercialisé sous le nom de Tamiflu, est l'autre antiviral inhibiteur de la neuraminidase. Les études scientifiques ont montré son efficacité tant dans la prévention (réduction du nombre de cas et du nombre des complications) que dans le traitement curatif de la grippe. Ce médicament est homologué dans une cinquantaine de pays industrialisés ; plus 10 millions de personnes ont déjà été traités par cette molécule, certains pays l'utilisant plus largement que d'autres, comme le Japon où il est très couramment prescrit (6 millions de Japonais touchés par la grippe en 2004 ont été soignés par le Tamiflu). Le Tamiflu est conditionné sous forme de gélules et s'administre à raison de 2 gélules par jour pendant 5 jours. Son absence de contre-indications, sa facilité d'administration et sa biodisponibilité (pourcentage de médicament absorbé après administration par voie orale) font qu'il est le médicament recommandé par la communauté scientifique en cas d'émergence d'une pandémie de grippe aviaire. Mais son efficacité reste subordonnée à son administration dans les quelques heures suivant l'apparition des premiers symptômes, au plus tard dans les 48 heures. L'OMS préconise de constituer, dans chaque pays, des réserves « suffisantes » d'antiviraux à usage national. Mais elle n'a pas donné d'indications chiffrées sur le niveau de ces stocks. Sur la base des prévisions faites du taux d'attaque de la pandémie, il est apparu qu'un taux de couverture de 25 à 40% de la population nationale devait être l'objectif à atteindre. C'est celui que se sont fixés un certain nombre de pays européens, dont la France. Les stocks français sont composés, principalement, de Tamiflu et, en appui stratégique, de Relenza. S'agissant du Tamiflu, la France avait commencé à constituer des réserves dès février 2004, après une épidémie de grippe aviaire de type A(H7N7) survenue en 2003 aux Pays-Bas et en Belgique, pays où le Tamiflu avait montré son efficacité sur les patients infectés. La France avait alors stocké 130.000 doses, ce qui, compte tenu de la posologie habituelle, aurait permis de soigner 13.000 personnes. Il est bien évident que ce niveau de stockage aurait été dérisoire en cas de pandémie. Les Professeurs François Bricaire et Jean-Philippe Derenne font remarquer, dans leur ouvrage précité : « Rien que pour traiter les malades, il faudrait entre 90 et 210 millions de traitements. A quoi il faudrait ajouter le traitement préventif de ceux qui en contact avec eux, ne présenteraient pas de signes de la grippe ». Le gouvernement s'est donc donné comme objectif de porter ce niveau à 14 millions de traitements, soit 140 millions de gélules, à la fin de l'année 2005. S'agissant du Relenza, les stocks devraient représenter 200.000 traitements. Mais, même à ces niveaux, les stocks français ne permettront pas d'assurer un taux de couverture de la population conforme aux objectifs évoqués ci-dessus. Certains pays européens s'en approchent davantage que la France : ainsi, les Pays-Bas annoncent un taux de couverture de leur population de l'ordre de 30%, et le Royaume-Uni un taux de 25%. Aussi, M. Didier Houssin a -t-il souligné devant la mission que le stockage de 14 millions de traitements de Tamiflu n'était qu'une première étape. Il a annoncé l'augmentation des stocks « de façon à pouvoir traiter tous les malades, y compris dans l'estimation la plus forte de la pandémie ». Cet objectif répond, au demeurant, a-t-il souligné, à la demande exprimée par le Président de la République en août 2005 que « les réserves de médicaments et d'anti-viraux soient portés aux niveaux requis pour assurer la santé de tous les Français en cas de pandémie ». M. Didier Houssin a indiqué que des commandes supplémentaires seraient passées aux fabricants : « Le ministre de la santé est très déterminé - et suivi, me semble-t-il- à faire en sorte que ce stock ne se limite pas à 14 millions de traitements et à faire acquérir des quantités plus importantes de Tamiflu comme de Relenza (...) » Il n'a cependant fourni aucune indication chiffrée ; cet élément devrait figurer dans le plan actualisé. Cette augmentation des stocks imposera, bien évidemment, de dégager de nouveaux crédits ; rappelons que l'enveloppe financière affectée au risque de grippe aviaire avait été fixée à 700 millions d'euros pour la période 2004-2006. Mais il va de soi que la constitution des stocks doit tenir compte de la capacité des fabricants à répondre aux commandes du Gouvernement. Sur ce point, leur audition devant la mission d'information a mis en évidence la faible élasticité des capacités de production existantes, le Rapporteur y reviendra plus loin. C'est pourquoi le Gouvernement a décidé de retirer des officines, dès maintenant, les stocks de Tamiflu. Ils sont dorénavant conservés dans des sites sécurisés, sous la garde de l'Armée. M. Didier Houssin a justifié cette décision par la crainte que les Français, redoutant la pandémie, ne constituent eux-mêmes chez eux des stocks de Tamiflu, vidant ainsi les réserves des pharmacies, et donc du pays : « Les citoyens (...) se demandent pourquoi, puisque l'État stocke, ils ne pourraient pas en faire autant. Nous avons beau leur expliquer que nos médicaments ne risquent pas de se périmer et que nous les donnerons gratuitement, cela n'empêche pas ceux qui ont envie de stocker de vouloir le faire ». Pour M. Henry-Vincent Charbonné, on évitera ainsi « l'anarchie dans la consommation » et donc un « extraordinaire gâchis des stocks ». On devrait aussi, de cette manière, empêcher la constitution de stocks spéculatifs, alors que s'est déjà mis en place, via Internet, un marché noir du Tamiflu, où les boîtes se vendent, d'après M. Didier Houssin, « à plus de 100 euros ». Précisons que le Tamiflu est aujourd'hui stocké, pour moitié déjà conditionné sous forme de gélules, et pour moitié sous forme de poudre en vrac ; le conditionnement devrait être assuré, le moment venu, par la pharmacie centrale des armées. Quant au Relenza, il est stocké dans sa version « produit chimique » car il ne peut être conditionné à l'avance, compte tenu de sa nature « aérosol ». Le 5 janvier 2006, une délégation de députés membres de la mission d'information s'est rendue sur l'un des sites, gardés par l'Armée, où sont stockées les réserves nationales de Tamiflu. Au cours de cette visite, les responsables de la Pharmacie centrale des Armées (PCA) ont présenté le projet qu'ils ont mis au point pour développer un procédé de conditionnement, sous forme de comprimés, de la poudre d'oseltamivir stockée en vrac. Le processus retenu rend possible la fabrication du produit en quantités industrielles. La PCA prévoit de lancer la production d'ici mars 2006 et d'achever la transformation du stock de poudre actuellement sous la protection de l'Armée environ quatre mois plus tard. La durée de péremption du Tamiflu est de 5 ans, mais M. Henry-Vincent Charbonné a considéré que la poudre en vrac devrait pouvoir rester stable au moins 10 ans. Notons que dans la mesure où personne n'est en mesure de prédire le moment où la pandémie se produira, le renouvellement des stocks devra être envisagé. La durée de péremption du Relenza, initialement de 3 ans, vient d'être portée à 10 ans. Il appartiendra aux autorités sanitaires de déterminer, le moment venu, la doctrine d'emploi des antiviraux. S'il va de soi qu'ils seront distribués aux malades dont l'état justifie un traitement, leur utilisation prophylactique n'est pas encore définitivement précisée : à qui seront prioritairement distribués les médicaments ? Aux personnels en contact avec des personnes malades (soignants, pompiers, ambulanciers ...) ? A d'autres personnels, indispensables au fonctionnement normal des services publics ? A quelles catégories de personnes dans la population (personnes à risques) ? Votre rapporteur reviendra sur ce point, essentiel, dans son troisième rapport consacré à l'examen du plan gouvernemental de lutte contre la pandémie : on peut penser que d'ici là, la doctrine d'emploi des antiviraux aura été mise au point. 2.-1.-4. Une diversification nécessaire des antiviraux utilisables Le Gouvernement concentre, donc, pour l'instant son effort de stockage sur les deux principaux antiviraux grippaux existants, principalement le Tamiflu. Cette stratégie n'est cependant pas sans inconvénients. · Le Tamiflu doit être pris au tout début de la contamination Pris en traitement curatif de la grippe, le Tamiflu doit être administré au plus tard dans les 48 heures suivant l'apparition des premiers symptômes. Plus le médicament est pris tôt, plus son efficacité est grande. Dans leur ouvrage « Pandémie : la grande menace » les professeurs Jean-Philippe Derenne et François Bricaire indiquent : « Administré avant la douzième heure, il diminue d'environ trois jours la durée des symptômes. Passé ce délai, le médicament perd progressivement ses propriétés thérapeutiques ». Le professeur Derenne l'a redit devant la mission d'information : « Concrètement, il (le Tamiflu) n'est vraiment efficace qu'au cours des douze premières heures. Passée la quarante-huitième heure, le Tamiflu n'a plus aucune efficacité. Comme il n'est pas toujours facile de diagnostiquer avec certitude une grippe en quelques heures, on ne peut traiter les malades que sur une présomption clinique. Si l'on a beaucoup de médicaments, cela ne pose pas de problèmes. Mais si l'on en a peu ... ». Expliquons d'un mot pourquoi le Tamiflu n'est efficace que dans les premières heures de l'incubation. Lorsque le virus s'est multiplié à l'intérieur de la cellule (cf. supra), sa libération à l'extérieur est permise par l'action de la neuraminidase, une glycoprotéine située dans l'enveloppe virale et qui défait l'amarrage à la cellule des virus multipliés : elle joue donc un rôle essentiel dans la réplication du virus. C'est à elle que s'attaque le Tamiflu, qui appartient à la famille des anti-viraux dits « inhibiteurs de la neuraminidase » parce qu'ils cherchent à en bloquer l'action. M. Henry-Vincent Charbonné l'a confirmé devant la mission d'information : « ce médicament produit un effet significatif sur la sévérité des symptômes, qui diminue d'environ 40 %. Il provoque une diminution significative des complications - bronchite chez l'adulte, otite et sinusite chez l'enfant. On constate également une diminution significative de la prise d'antibiotiques et du nombre d'hospitalisations. Enfin, s'il est pris entre 36 et 48 heures après l'apparition des symptômes, la durée de celle-ci diminue d'un jour, ce qui veut dire qu'une grippe classique passe de cinq à quatre jours ». On comprend, dès lors, l'importance d'une administration la plus précoce possible du Tamiflu, afin de bloquer au plus vite le processus de réplication. Il faudrait donc consulter son médecin dès les premiers signes de grippe pour qu'il prescrive, si nécessaire, le Tamiflu. Or, nombreux sont ceux qui attendent quelques jours avant d'aller voir leur médecin, tablant, souvent avec raison, sur une guérison spontanée. L'efficacité du traitement par Tamiflu a donc ses limites, qui expliquent, d'ailleurs que cet anti-viral soit peu prescrit par les médecins, qui en connaissent les conditions d'administration. · des résistances possibles Comme tout antiviral, le Tamiflu peut créer des résistances. Devant la mission d'information, M. Henry-Vincent Charbonné a évalué à 0,4% le taux de résistance, aujourd'hui, du Tamiflu. Même s'il a relativisé ce problème : « la très grande majorité des souches résistantes au Tamiflu sont bâtardes, (...) elles ont perdu leur pouvoir pathogène », il reconnaît qu'« en cas de pandémie, il est évident que l'utilisation massive de Tamiflu conduira à l'apparition de souches résistantes ». L'OMS a d'ailleurs élaboré un programme de surveillance qui développe des tests de sensibilité aux antiviraux. Pour les experts, l'apparition de résistances ne serait pas étonnante. Par exemple, le docteur Menno de Jong et ses collègues de l'hôpital pour les maladies tropicales d'Ho Chi Min ville ont, dans un article paru le 21 décembre dernier dans le « New England Journal of Medicine », présenté les résultats d'une étude qu'ils ont menée sur huit patients infectés par le virus H5N1, tous traités avec du Tamiflu. Quatre sont morts ; pour d'entre eux, une fillette de 13 ans et une femme de 35 ans, l'étude de la souche virale a révélé une mutation sur le gène de la neuraminidase, qui a conféré à la souche virale une capacité de résistance. Les auteurs de cette étude écrivent que « l'émergence de résistance à l'oseltamivir ne devrait pas être une grande surprise. Chez les adultes atteints de la grippe saisonnière due au virus H3N2 ou H1N1, les résistances à ce médicament sont rares chez les adultes, mais ont été repérées chez 18% des enfants traités ». Ils concluent que « la stratégie de traitement d'une infection grippale due au virus H5N1 devrait comprendre des agents antiviraux supplémentaires » Le scientifique japonais Keiji Fukuda, qui dirige le programme mondial contre la grippe de l'OMS, n'est pas, lui non plus, autrement surpris, ni alarmé par ces résistances au Tamiflu. Il a déclaré à l'Agence de presse Reuters « Dès lors que l'on prend n'importe quelle forme de médicament, que ce soient des antiviraux ou des antibiotiques, il faut s'attendre à ce que l'organisme développe une résistance. Trouver de la résistance en soi n'est pas surprenant ni nécessairement alarmant ». Mais il a ajouté que les constatations du docteur Menno de Jong montrent qu'il faut poursuivre les recherches sur une meilleure utilisation du Tamiflu et souligne que ce qui est important est de savoir si la façon dont le médicament est utilisé contribue à créer des résistances. · un risque d'effets secondaires mais à relativiser Les spécialistes s'interrogent sur d'éventuels effets secondaires du Tamiflu. Depuis sa mise sur le marché en 1999, des effets secondaires ont été rapportés chez des enfants et des adolescents traités par ce médicament : troubles neurologiques et psychiatriques (délires, encéphalites, hallucinations,...), réactions cutanées sévères et décès (douze cas recensés depuis 1999), pour la plupart survenus au Japon, où le Tamiflu est couramment prescrit chez les enfants de moins de 16 ans. Ces constatations ont conduit l'Agence américaine du médicament (Food and Drug Administration) à demander, au mois de novembre 2005, une évaluation des effets secondaires du Tamiflu. Après analyse, il apparaît que les décès ne peuvent être attribués au seul usage du Tamiflu. Les troubles neurologiques sont fréquents chez les patients grippés et des cas d'encéphalopathie associés à la grippe ont été observés dans le milieu des années 1990. Le comité consultatif a demandé le renforcement de la surveillance des effets secondaires du Tamiflu, en particulier des effets cutanés. Après deux années de surveillance supplémentaires, soit deux saisons de grippe, le Tamiflu sera à nouveau soumis à l'évaluation du comité consultatif. L'agence européenne du médicament (European Medicines Agency ou EMEA), pour sa part, a enregistré la déclaration de deux suicides chez des adolescents traités par Tamiflu. Là aussi, il n'a pas été établi de relation de cause à effet entre la prise de Tamiflu et les symptômes psychiatriques. L'EMEA a cependant demandé au laboratoire Roche de recenser toutes les données concernant les troubles psychiatriques dus au Tamiflu. L'EMEA rendra un avis à l'issu de cette évaluation. · une diversification souhaitable Compte tenu de tous ces éléments, quelle stratégie thérapeutique adopter ? A l'évidence : une diversification de la panoplie des antiviraux à la disposition des autorités sanitaires. Les experts sont d'accord pour considérer que le Relenza constitue une bonne alternative au Tamiflu, dans la mesure où il développe moins de résistances, comme l'a précisé M. Christophe Weber devant la mission d'information : « Nous n'avons à ce jour qu'un seul cas chez un enfant vietnamien immunodéprimé. Nous pensons que du fait de sa puissance d'action et de son mode d'administration, le Relenza pourrait développer moins de résistances que d'autres produits (...). Il est établi que des souches résistantes au Tamiflu sont sensibles au Relenza ». C'est pourquoi, au demeurant, le Relenza figure dans le dispositif de stockage arrêté par le Gouvernement français. Son utilisation pourrait être développée si les recherches en cours sur d'autres modes d'administration du produit (voie intraveineuse, nébulisateur...) aboutissaient. D'autres experts suggèrent que les inhibiteurs de la molécule M2 tels que l'amantadine viennent compléter les stocks de Tamiflu et de Relenza. L'OMS a ainsi fait valoir qu'en cas d'apparition d'un nouveau virus par réassortiment génétique, ces produits pourraient être efficaces, même si leur administration nécessiterait un suivi clinique attentif. De plus, outre un prix attractif, ils ont l'avantage de se conserver plus longtemps (20 ans, voire davantage). La direction générale de la santé estime, quant à elle, que « ces produits pourraient rendre service en période pandémique dans la mesure où le rapport bénéfice/risque serait alors plus favorable ». Le docteur Menno de Jong évoque, pour sa part, la possibilité d'ajouter au stock d'antiviraux le Ribavirin, un antiviral contre l'hépatite, et qui pourrait être prescrit dans le cadre d'un « cocktail » de médicaments, comme c'est le cas pour le traitement du sida. Notons que BioCryst Pharmaceuticals Inc. a développé un nouvel inhibiteur de la neuraminidase, le Peramivir, qui pourrait constituer une autre option. Des recherches sont en cours sur d'autres molécules, comme le REP9 sur lequel travaille la compagnie pharmaceutique canadienne Replicor, et qui pourraient ouvrir de nouvelles perspectives. On conclura ces développements en rappelant la mise en garde du Professeur Derenne devant la mission d'information contre le risque de ne disposer que d'« un fusil à un seul coup face aux maladies infectieuses : il suffirait d'une très mauvaise utilisation pour fusiller la seule arme dont nous disposons, ce qui serait notamment le cas si le Tamiflu était prescrit à tout va, n'importe comment et à n'importe qui » 2.-2. LES STOCKS DE MÉDICAMENTS DESTINÉS AU TRAITEMENT DES COMPLICATIONS DE LA GRIPPE Les complications de la grippe peuvent toucher tous les organes, mais les plus fréquentes et les plus graves sont les complications respiratoires. Elles sont le plus souvent en rapport avec des surinfections microbiennes et relèvent donc du traitement par antibiotiques. Certaines complications (broncho-pneumopathie obstructive, asthme) nécessitent par ailleurs des thérapeutiques spécifiques (oxygénothérapie). Le professeur Jean-Philippe Derenne les a ainsi décrites à la mission : « Les principales (complications) sont d'origine bactérienne. Deux germes sont plus particulièrement concernés : le pneumocoque et le staphylocoque doré. Il existe effectivement un vaccin contre le pneumocoque, le Pneumo 23, d'une efficacité de l'ordre de 80 % et grosso modo sans effets secondaires majeurs. On peut donc encourager la vaccination, au moins pour les groupes à risques ; l'effet du Pneumo 23 dure cinq ans et je n'ai jamais vu d'effets secondaires, ce qui n'est pas toujours le cas avec la vaccination antigrippale. Non seulement nous disposons de nombreux médicaments contre le pneumocoque, mais il n'existe pas de pneumocoque résistant aux antibiotiques. Un pneumocoque dit « résistant » n'est qu'un pneumocoque moins sensible aux traitements et qui doit être traité avec des doses plus élevées. Cela n'a rien à voir avec la résistance d'un staphylocoque doré. Aucun pneumocoque ne résiste à six grammes d'amoxycilline par exemple. De nombreuses stratégies sont donc possibles. Il en va tout autrement pour le staphylocoque doré, car si les souches sauvages sont très sensibles aux antibiotiques, des souches résistantes sont apparues, face auxquelles nous risquons de ne pas avoir suffisamment d'antibiotiques efficaces. C'est là que pourra se poser un problème d'approvisionnement, et, avant, de prévision des besoins ». Selon les informations fournies à votre Rapporteur, le gouvernement n'a pas, pour le moment, jugé nécessaire de constituer des stocks de sécurité, considérant que les stocks actuellement disponibles permettraient de répondre, le cas échéant, aux premiers besoins. Cependant, la question d'une augmentation massive de la production, en cas de pandémie, devrait être prochainement envisagée avec les industriels concernés. 2.-3. LES STOCKS DE MASQUES DE PROTECTION INDIVIDUELLE 2.-3.-1 La fonction des masques de protection Dès lors qu'aux premiers jours de la pandémie, la distribution d'antiviraux aura tout juste commencé et que le risque de contamination sera grand, l'OMS conseille d'utiliser tous les moyens non médicaux susceptibles d'offrir une certaine protection. Les masques de protection individuelle en font partie. Rappelons que la grippe est due à un virus particulièrement contagieux, qui se transmet par projection des sécrétions des voies aériennes supérieures ou de salive pouvant contenir des agents infectieux. La prophylaxie consiste à porter des masques de protection individuelle, en association avec des mesures d'hygiène simples, comme le lavage systématique des mains. Une étude scientifique en cours de publication, mentionnée par M. Didier Houssin, a démontré que le port de masques à Hong Kong, pendant l'épidémie de SRAS en 2003, a entraîné une diminution significative du nombre d'affections respiratoires. Il existe deux catégories de masques. Les masques dits « anti-projection » ou « chirurgicaux » sont destinés à protéger l'entourage d'une personne malade de ses projections contaminantes. Ce type de masques porté par le soignant prévient la contamination du patient et de son environnement. Porté par le patient contagieux, il diminue les risques de contamination de ceux qui l'entourent. Il est important de noter que le masque médical protége celui qui le porte contre les agents infectieux transmissibles par voie de gouttelettes mais, en aucun cas, ne lui assure de protection contre ces mêmes agents transmissibles par voie aérienne. L'autre catégorie de masques est constituée de ceux dits de protection respiratoire, destinés à protéger celui qui le porte contre l'inhalation d'agents infectieux transmissibles par voie aérienne ou par gouttelettes. Il existe trois classes de masques qui se distinguent par leur degré d'efficacité : FFP1, FFP2, FFP3. Ces sigles correspondent à des normes de filtration des particules solides et liquides. Le taux de protection respiratoire exigé est de 92 % pour le masque FFP 2 et de 98 % pour le FFP3. La catégorie recommandée pour se protéger contre la grippe est celle FFP2, les masques FFP3, dont la protection est plus grande, ne présentant pas d'avantage particulier en cas de grippe. Les masques utilisés pour lutter contre le SRAS étaient d'un type moins élaboré que les masques FFP2 et ont cependant apporté un bon niveau de protection dans le cas d'une affection qui était hautement contagieuse. Les masques FFP2 sont constitués de plusieurs couches de matériau non tissé disposées en quinconce et deux caoutchoucs passés derrière la tête permettent de les maintenir plaqués de façon étroite sur la peau de sorte que la totalité de l'air inspiré et expiré passe à travers le masque lui-même, fait de matière poreuse, et qu'il n'y ait pas de fuite latérale. Les normes de fabrication, très strictes - ces appareils sont des équipements de protection individuelle relevant de la directive européenne 89/686/CEE - ont été rappelées dans le cahier des charges signés par les industriels qui ont répondu aux appels d'offres passés par l'Union des groupements d'achats publics. Pour ce qui concerne les masques chirurgicaux, M. Didier Houssin a apporté les précisions suivantes : « Des quantités importantes ont été et seront achetées : il est prévu d'acquérir au total 250 millions de masques chirurgicaux, à faire porter, à raison d'un masque toutes les quatre ou cinq heures, aux malades en contact avec un entourage familial ou professionnel ». Pour l'heure, ces masques n'ont pas encore été livrés. Quant aux masques FFP2, il a indiqué que le Gouvernement en avait acquis « d'ores et déjà environ 50 millions, livrés ou en cours de livraison, à travers un marché UGAP16, et stockés dans les grands hôpitaux. Une deuxième livraison de 68 millions de masques est prévue, pour lesquels la question du stockage n'est pas encore résolue. Des contacts ont été pris par le haut fonctionnaire de défense, M. Gérard Dumont, avec les ministères de l'Intérieur et de la Défense, pour trouver des sites de stockage. Enfin, une troisième commande, via l'UGAP, de 80 millions de masques permettra d'atteindre l'objectif prévu : plus de 200 millions de masques FFP2 stockés d'ici au début 2006. ». La première commande a été confiée à sept prestataires ; une seule entreprise française figure parmi eux : Bacou -Dalloz, pour une commande de 12 millions de masques. Dans la mesure où un masque perd ses qualités de filtration en quelques heures (quatre à six heures), il est nécessaire de prévoir un nombre suffisant de masques pour assurer l'efficacité du dispositif. Pour les seuls personnels soignants, le nombre estimé de masques nécessaires est de 2 millions par jour de pandémie. Le plan de lutte contre une pandémie grippale précise que le contingent de masques FFP2 constitué sera prioritairement destiné aux professionnels de santé. Selon M. Jean-Claude Désenclos, cet ordre de priorité se justifie : « L'utilisation des masques constitue un moyen de lutte efficace, en particulier pour le personnel soignant, mais on ne dispose pas d'étude comparative sur les effets qu'aurait l'extension du port du masque à toute la population. ». M. Didier Houssin n'a pas exclu une distribution plus large de masques, notamment à d'autres personnels en contact avec le public, si les capacités de production nouvelles qui devraient être mises en service l'année prochaine accroissent à due concurrence les stocks disponibles. La question des modalités de stockage n'a pas encore été réglée, ni celle du traitement des masques usagés. Il faut espérer que ces deux points, essentiels, le premier sur le plan logistique, le second en termes de prévention des risques de contamination secondaire, seront réglés dans le cadre de la version actualisée du plan « Pandémie ». Si la question de la péremption des masques ne semble pas se poser, il faut tout de même noter que les caoutchoucs de serrage qui maintiennent le masque sur le visage ne sont plus efficaces au bout de deux ans. Mais, surtout, la question centrale qui reste en suspens, comme pour les antiviraux, est de savoir comment le Gouvernement envisage d'accroître les stocks de masques, aujourd'hui à l'évidence insuffisants, pour les fixer à un niveau permettant de répondre aux besoins lorsque la pandémie sévira. La faible élasticité des capacités actuelles de production et les difficultés d'approvisionnements en matière première auxquels les fabricants risquent de trouver bientôt confrontés imposent de trouver des solutions sans tarder (cf. infra). 2.-4. LA PROBLÉMATIQUE SPÉCIFIQUE DU VACCIN PANDÉMIQUE Lors de la première vague pandémique, les autorités sanitaires françaises auront à leur disposition les antiviraux et les matériels de protection mais pas de vaccin. En effet, celui-ci ne pourra être mis au point qu'une fois la souche virale responsable identifiée. L'arme la plus efficace pour juguler la pandémie ne sera donc disponible qu'au moment de la seconde vague pandémique. On comprend, dès lors, pourquoi il est si important de retarder au maximum la propagation du virus pandémique : ce sera autant de temps de gagné pour la fabrication du vaccin et les opérations de vaccination. La mission d'information a, naturellement, entendu les responsables de Sanofi Pasteur MSD, le seul fabricant français de vaccins grippaux. Leur audition a mis en évidence un certain nombre de spécificités du futur vaccin pandémique et a permis de préciser la stratégie de production envisagée. 2.-4.-1 Les spécificités du vaccin pandémique · un vaccin qu'on ne peut pas mettre au point à l'avance Comme on l'a vu plus haut, le vaccin pandémique ne pourra être mis au point que lorsque l'OMS aura communiqué aux fabricants la souche virale responsable de la pandémie. M. Didier Hoch17 a précisé devant la mission d'information : « Les antiviraux interviendraient lors de la première partie de la pandémie, les vaccins lors de la seconde, car le vaccin ne peut être fabriqué que lorsqu'on a identifié le virus - un virus pandémique, passant de l'homme à l'homme. Le virus est identifié par les experts des différents laboratoires et certifié par l'OMS. A partir de ce moment-là, nous pouvons produire le vaccin pandémique ». · un vaccin dont on évalue difficilement encore les quantités nécessaires Chaque année, l'évaluation du nombre de doses de vaccin contre la grippe à fabriquer est établie par référence au nombre de doses produites l'année précédente. Cette évaluation est beaucoup plus difficile à faire, s'agissant du vaccin pandémique. La seule référence dont disposent les fabricants est la couverture vaccinale contre la grippe hivernale mais elle est délicate à exploiter, dans la mesure où le vaccin saisonnier s'adresse à une population ayant déjà été exposée au virus lors des épidémies précédentes et qui a pu développer des anticorps. Dans une pandémie grippale provoquée par un virus inconnu, la population ne bénéficiera pas de cette protection naturelle et on ne sait pas si une seconde injection ne sera pas nécessaire. Les fabricants de vaccins considèrent toutefois la couverture vaccinale saisonnière comme un indicateur utile pour l'appréciation des besoins futurs en vaccin pandémique et, donc, des capacités de production à mobiliser le moment venu. 2.-4.-2 La stratégie de production mise au point Les fabricants de vaccins se préoccupent, depuis plusieurs années, d'anticiper la production d'un vaccin pandémique contre la grippe, en particulier Sanofi Pasteur, qui « représente environ 40 % du marché mondial pour la grippe interpandémique. Notre responsabilité est d'être particulièrement performants si une pandémie se déclare » (M. Jacques Berger18 ). Comme l'a précisé M. Didier Hoch : « nous n'attendons pas de connaître le virus pour commencer à travailler. Depuis des années, à la demande initiale de l'OMS, puis de certains États membres et de la Commission européenne, nous avons anticipé la préparation des vaccins pandémiques. Nous avons à mener une course de vitesse contre la propagation du virus et, pour cela, il faut anticiper, au niveau de la recherche et du développement, mais aussi au niveau des capacités de production ». Cette anticipation s'est traduite par plusieurs initiatives, dont deux sur lesquelles le Rapporteur souhaite revenir ici : d'une part, un essai d'évaluation des besoins en vaccin pandémique au niveau européen ; d'autre part, la mise au point d'un « vaccin prototype ». · l'évaluation des besoins au niveau européen Dès 2002, les fabricants européens de vaccins ont alerté les pays de l'Union européenne sur la nécessité de chiffrer, le plus tôt possible, leurs besoins potentiels en vaccins pandémiques, afin d'évaluer les capacités de production supplémentaires qu'il faudrait créer pour être en mesure de répondre à la demande le moment venu. M. Didier Hoch, qui préside l'Association des fabricants européens de vaccins, a indiqué : « Nous avons demandé, dans le cadre de l'Association des fabricants de vaccins européens, dont je suis le Président, à avoir le plus d'informations possibles sur ce que serait la demande potentielle des différents États membres, afin de déterminer à quel niveau il faudrait adapter l'outil industriel. Une augmentation de la capacité de production demande du temps ». Il a ajouté que, début 2004, l'Association avait rendu public un plan pour la préparation à la pandémie, qui a été discuté avec la Commission européenne, présenté à l'OMS et envoyé aux États membres. · l'élaboration d'un vaccin prototype Dans le cadre du processus d'anticipation de la pandémie, Sanofi Pasteur MSD s'est attaché à mettre au point un « vaccin prototype » sur la base de virus animaux connus, et notamment le H5N1. M. Didier Hoch en a expliqué le principe en ces termes : « Puisqu'on ne disposera du vrai virus qu'au moment de la pandémie elle-même, nous essayons de définir un « vaccin prototype pandémique », c'est-à-dire d'identifier le véhicule dans lequel on placera, le moment venu, le vrai virus identifié et certifié. Nous le faisons à partir des virus sauvages comme le H5N1, le H7N7, etc. ». M. Jacques Berger a détaillé la stratégie arrêtée : « L'élément de base sur lequel nous travaillons, c'est le fameux H5N1. Nous savons qu'une souche pandémique va se comporter d'une façon différente d'une souche interpandémique. Le H5N1 est considéré comme l'une des souches les plus proches de celle qui pourrait être, un jour ou l'autre, pandémique. D'où l'idée de l'utiliser pour travailler sur un vaccin prototype (...). Nous allons tester notre système industriel sous toutes ses formes, avec ce vaccin prototype. On fabriquera d'abord des vaccins en petite quantité, qui nous serviront éventuellement à faire des études cliniques. Ensuite, il y aura une montée en puissance : nous travaillerons sur un ou deux millions de doses, puis sur dix millions de doses ou plus. Ainsi, le jour venu, lorsque la souche pandémique aura été identifiée par l'OMS, souche dont nous pensons que le comportement devrait être relativement proche de celle du H5N1, nous serons dans les meilleures conditions pour produire le vaccin. Pour autant, il faudra que l'efficacité de ce vaccin soit prouvée. (...) Nous avons commencé à fabriquer de petits lots de H5N1, qui nous semble proche de la future souche pandémique, et qui nous ont permis de faire des tests cliniques, actuellement effectués en France et aux Etats-Unis. Lorsque nous aurons ces informations, nous disposerons d'un certain nombre d'éléments, sur la tolérance du vaccin et sur son efficacité. C'est alors que nous pourrons déterminer s'il faudra une ou deux doses et quelle sera la charge antigénique à mettre dans chacune des doses. Cela nous permettra d'ajuster la formulation du produit, laquelle nous renseignera sur notre capacité industrielle le moment venu ». La fabrication du vaccin prototype, encore appelé « vaccin prépandémique » ou « vaccin candidat », présente donc un double intérêt : avancer au maximum dans la mise au point de la formule du vaccin pandémique ; stimuler les capacités de production pour qu'elles « répondent » du mieux possible lorsque la production du vaccin pandémique sera lancée. Sanofi Pasteur MSD a annoncé, à la fin de l'année dernière, que la phase I des essais du vaccin prototype contre la grippe aviaire était terminée et que la phase II allait pouvoir commencer : après avoir été testé sur 300 volontaires de moins de 40 ans, le vaccin va être évalué sur des enfants et des personnes de plus de 60 ans. M. Didier Hoch a insisté sur le fait que : « Le vaccin prototype est un élément primordial de notre fonctionnement : on gagne du temps pour plus tard et, en plus, on teste ainsi, au plan industriel, la production d'un vaccin sauvage ». M. Didier Houssin a repris cet argument devant la mission d'information : « Il y a déjà plusieurs mois, la France a lancé un appel d'offres européen et passé marché avec Chiron et Sanofi Pasteur pour un total de 2,5 millions de doses de vaccins H5N1, c'est-à-dire contre le virus actuellement en circulation La stratégie d'utilisation de ce vaccin n'est pas encore définie avec une grande précision. Ce marché était avant tout destiné à mobiliser l'industrie et à l'amener à démontrer sa capacité à produire rapidement un vaccin d'un type nouveau, puisque dirigé contre un virus très différent de celui qui circule actuellement dans l'espèce humaine. On peut toutefois prévoir d'ores et déjà des utilisations possibles : on pourrait ainsi s'en servir en cas d'épizootie aviaire pour conférer une protection à certains professionnels exposés - la question reste ouverte. Enfin, dans l'hypothèse où apparaîtrait un virus pandémique génétiquement peu différent de l'actuel H5N1, peut-être serait-il possible d'utiliser ces premiers vaccins afin de protéger les populations prioritaires avant même qu'un vaccin spécifique du virus pandémique soit mis au point. Mais pour l'heure, si la livraison du vaccin aura bien lieu début 2006, les conditions de son utilisation ne sont pas encore réglées, compte tenu des incertitudes scientifiques qui demeurent ». 2.-4.-3 Les commandes de vaccins pandémiques Pour le moment, les commandes passées par le gouvernement français s'élèvent à 28 millions de traitements, comme l'a indiqué M. Jacques Berger : « Nous avons passé des accords qui portent sur la fourniture de certaines quantités de H5N1 et qui nous engagent à fournir au gouvernement français l'équivalent de 28 millions de traitements - une ou deux doses par traitement, nous ne le savons pas encore. Le gouvernement s'est par ailleurs adressé à d'autres fournisseurs pour compléter ses besoins ». M. Didier Hoch a précisé : « L'accord passé porte sur 28 millions de traitements, mais il est à géométrie variable : il tient compte de la productivité possible. Il assure une couverture adéquate à la population française, en tenant compte des contraintes de production, et il respecte l'idée d'une distribution équitable. En livrant la France de cette manière, nous ne pénalisons pas, ou relativement peu, les autres pays ». M. Didier Houssin a précisé, pour sa part : « Un deuxième vaccin (vaccin pandémique) a été commandé, dans les conditions particulières dites de « sleeping contract » - les fabricants ne livreront le vaccin que le jour où, le virus ayant été isolé, le vaccin pourra être produit -, à Chiron pour 12 millions de vaccins et Sanofi-Pasteur pour 28 millions de vaccins, qui ne seront évidemment disponibles et payés que le jour où ils pourront commencer à être produits ». 2.-5. QU'EN EST-IL DE LA CAPACITÉ DES FABRICANTS À AUGMENTER LEUR PRODUCTION ? « La réduction de la morbidité et de la mortalité au cours d'une pandémie sera freinée par le manque de vaccins et d'antiviraux (...). Si les tendances actuelles se poursuivent, ils ne pourront être utilisés dans des quantités suffisantes ou équitablement répartis dès le début de la pandémie et même pendant les mois qui suivront ». Cette inquiétante mise en garde de l'OMS conduit à s'interroger sur l'aptitude des fabricants à adapter leurs capacités de production à une demande qui a d'ores et déjà commencé à « exploser ». Une augmentation significative du potentiel de production confronterait les industriels à un risque économique et financier non négligeable, qu'ils sont en train d'évaluer, ainsi qu'ils l'ont indiqué à la mission lors de leur audition. Se posait par ailleurs, pour la fabrication du principal antiviral, le Tamiflu, un problème de droit de propriété industrielle mais qui semble aujourd'hui réglé. Enfin, une inquiétude persiste quant à l'approvisionnement en matières premières nécessaires à la fabrication du Tamiflu et des masques de protection. 2.-5.-1. Pour tous les fabricants, un risque industriel et financier En cas de pandémie, les besoins en moyens médicaux, quels qu'ils soient, seraient tels que les capacités de production actuelles, si elles demeuraient inchangées, ne permettraient pas, c'est une évidence, de répondre à la demande. Les industriels entendus par la mission confirment cette inadéquation de leur outil de production. La capacité annuelle de production du Relenza par GSK est actuellement inférieure à 10 millions de traitements. Celle du Tamiflu par le laboratoire Roche, qui a été doublée en 2004, s'est élevée à 60 millions de traitements en 2005. M. Henry-Vincent Charbonné a indiqué que le laboratoire Roche prévoyait un nouveau doublement de ses capacités de production en 2006, jusqu'à être en mesure de produire 300 millions de traitements par an en 2007. Quant à la capacité de production du seul fabricant français de masques, Bacou-Dalloz, elle est actuellement de 30 à 40 millions d'unités par an. Les industriels s'interrogent aujourd'hui sur le risque économique et financier qu'ils seraient amenés à prendre s'ils devaient investir massivement pour être en mesure de répondre à la demande résultant d'une pandémie. M. Roland Fangeat, le président de Bacou-Dalloz-Plaintel, a tenu devant la mission le raisonnement suivant : « Si une pandémie se déclarait aujourd'hui, il est évident que toutes les sociétés spécialisées du monde fabriqueraient d'abord pour le pays où elles sont implantées », et ajoute : « Chaque pays devant se contenter de sa production nationale, le nôtre n'aurait pas les moyens de s'équiper ». Evoquant alors l'hypothèse d'une augmentation significative de sa capacité de production, il s'interroge : « Que se passera-t-il dans deux ou trois ans, quand nous aurons une capacité de production de 200 millions (de masques), alors que le marché n'absorbera plus que 60 millions ? ». M. Henry-Vincent Charbonné a, pour sa part, abordé la question en ces termes : « (Le laboratoire Roche a) intégré le risque financier, et nous savons qu'à un certain moment, nous allons nous retrouver avec des capacités industrielles excédentaires. Cela dit, nous assumerons notre responsabilité jusqu'au bout. L'essentiel, encore une fois, est de faire face à la demande ». Les responsables de Sanofi Pasteur MSD ont, quant à eux, estimé que : « Le problème, pour un industriel, n'est pas tant d'investir que de risquer de construire des usines qu'on ne pourrait pas faire tourner. Il faut que les vaccins produits soient utilisés » (M. Didier Hoch). « Je précise par ailleurs qu'il n'est techniquement pas possible de construire une usine qui ne servirait à rien, du moins pendant de nombreuses années. En effet, une usine de vaccins nécessite d'être utilisée quotidiennement, notamment pour que les personnels restent opérationnels continuellement » (M. Jacques Berger). Il est vrai que, dans une économie de marché, il est difficile de demander à des industriels d'engager des investissements dont la rentabilité reste douteuse. Pour, malgré tout, trouver une solution, car il faudra bien répondre aux besoins en cas de pandémie, certains fabricants ont suggéré une sorte de partenariat entre l'Etat et eux. M. Roland Fangeat a ainsi déclaré : « L'Etat devrait s'équiper, quitte à ce que les industriels l'aident pour la mise en place des moyens de production et pour la maintenance. Ensuite ce serait à l'Etat de réguler le système car les industriels en seraient incapables ». Mais, en tout état de cause, quelle que soit la solution retenue, il faut décider vite. Car la mise en service de nouvelles structures de production demande beaucoup de temps. Ainsi, M. Philippe Boele19 a indiqué que, pour ce qui concerne la fabrication des masques : « Il y a deux grandes étapes dans la production de masques : la fabrication des fibres et l'extrusion d'une part, le formage d'autre part. Il se trouve que, sur le même site de production 3M en Angleterre, nous disposons des deux technologies. Si l'on veut disposer de capacités supplémentaires de formage de masques, il faut compter six à huit mois. Pour accroître les capacités de fabrication des fibres, ce qui nécessite de créer des équipements plus complexes et plus onéreux, il faut en compter dix-huit ». S'agissant du Tamiflu, M. Henry-Vincent Charbonné a indiqué : « nous savons qu'il nous faut deux ans pour monter des capacités nouvelles (...) ». Pour les dirigeants de Sanofi Pasteur, « si on veut augmenter la capacité de production, la création d'un nouveau site de production réclame quatre à cinq ans. Dans cette période, il y des phases de construction et des phases réglementaires » (M. Didier Hoch). 2.-5.-2. Pour certains fabricants, une inquiétude sur l'approvisionnement en matières premières Les auditions auxquelles la mission d'information a procédé ont mis en évidence une contrainte du processus de fabrication, d'une part du Tamiflu, d'autre part, des masques de protection, qui risque de devenir une fragilité majeure en cas de pandémie : l'utilisation de matières premières qui ne se trouvent qu'à l'étranger. · le Tamiflu Pour la fabrication du Tamiflu, le laboratoire Roche utilise aujourd'hui de l'acide shikimique, principe actif du médicament, issu de la badiane ou anis étoilé, une épice provenant d'un petit arbre de la famille du magnolia. Il se fournit dans la province de Guangxi, dans le Sud de la Chine, d'où proviennent d'ailleurs les trois quarts de la production mondiale, soit 50 000 tonnes par an. Les cours de l'anis étoilé se sont tendus à la fin de l'année 2005 et le prix de l'acide shikimique a fortement grimpé (entre 400 et 600$US le kilogramme). Le laboratoire Roche a cherché à s'affranchir de cette contrainte d'approvisionnement en élaborant un acide shikimique de synthèse, par bio-fermentation de la bactérie « Escheria coli ». M. Henry-Vincent Charbonné a précisé devant la mission d'information : « nous sommes maintenant capables, grâce à un processus biotechnologique, de produire la matière première de base, l'acide shikimique, sans utiliser de la badiane de Chine. Les premières quantités de cette nouvelle source de matière première sont entrées dans la chaîne de production cet été. Nous gagnons en temps, mais surtout en souplesse et en indépendance. Cela étant, nous n'avons pas pour autant l'intention de renoncer à l'anis étoilé, puisque l'objectif est de pouvoir produire les plus grandes quantités possibles de matière première nécessaire à la fabrication du Tamiflu ». Il s'agit donc d'une voie d'avenir mais, pour le moment, le laboratoire Roche utilise quasi exclusivement la badiane et indique d'ailleurs avoir acheté d'ores et déjà, une grande partie de la récolte chinoise. Cependant, dans la mesure où le laboratoire Roche a déjà accordé des licences secondaires et en accordera vraisemblablement d'autres, il ne sera plus le seul à vouloir accéder à ce marché. Les provisions que voudront réaliser les laboratoires et même les États comme Taïwan, font ainsi peser un risque de pénurie sur la matière première du Tamiflu ; cette concurrence sur les approvisionnements peut d'ailleurs constituer un des éléments d'explication de la réticence du laboratoire Roche à accorder des licences secondaires. Dans ce contexte de possibles difficultés d'approvisionnement, une société de biotechnologie canadienne, Biolyse Pharma, a annoncé qu'elle aurait découvert le moyen d'extraire de l'acide shikimique des aiguilles de sapin. Cette découverte ouvre peut-être une perspective encourageante, même si, comme l'a souligné un porte parole du groupe Roche, « tout dépend de la quantité d'acide shikimique qu'ils (les chercheurs de Biolyse Pharma) pourront produire et surtout à quel prix ». · les masques de protection Interrogé sur les matières premières utilisées pour la fabrication des masques, M. Roland Fangeat a donné des précisions suivantes : « Pour les masques FFP1, FFP2 et FFP3, nous (Bacou-Dalloz) utilisons un matériau filtrant tel que le polyéthylène ou le polypropylène, qui subit un traitement électrostatique lui permettant d'attirer les charges. L'extérieur des masques peut être fait avec des matériaux de type polyester qui, une fois thermoformés, permettent d'obtenir des masques en forme de coquille - et non pas plats ». Mais Bacou-Dalloz, le seul fabricant français, rappelons-le, ne produit pas ces matériaux de base, pour lesquels elle est dépendante d'approvisionnements en provenance d'Allemagne. M. Fangeat a admis que « Si une crise se déclenchait et que tous les pays demandaient des masques, nous rencontrerions certainement des difficultés ». La société 3M Santé n'est pas confrontée à ce problème car, comme l'a indiqué M. Philippe Boele devant la mission : « (3M) fabrique les fibres de base. Cette étape est intégrée au processus de fabrication des masques ». Pour M. Roland Fangeat, ce qui est inquiétant, c'est que la fabrication du matériau de base, réalisée par des industriels chimiques comme Rhodia ou Total, dépend directement des approvisionnements en pétrole : « Même si l'on réoriente les modalités de la production des masques en y intégrant la fabrication des fibres comme c'est le cas pour la société 3M Santé, des incertitudes d'approvisionnement en matières premières de base ne pourront pas être levées ». C'est pourquoi M. Philippe Boele (3M France) a suggéré de remonter la chaîne de production en amont pour identifier les goulots d'étranglement qui risquent d'entraver le développement de nouvelles capacités de production de masques : « Ma recommandation serait de focaliser le travail de réflexion en amont de la chaîne (...). Il faudrait donc réfléchir (...) avec les acteurs qui se trouvent en amont, notamment les chimistes qui fabriquent les polymères ». 2.-5.-3. La question du brevet de fabrication du Tamiflu En cas de pandémie, la principale arme dont disposeront les autorités sanitaires sera le Tamiflu, un antiviral utilisé dans le traitement de la grippe usuelle et qui, à ce jour, est le seul médicament susceptible a priori de pouvoir ralentir la propagation d'un virus pandémique de type H5N1. Il occupe donc une place stratégique dans le dispositif médical en cours de préparation en France, comme dans le reste du monde, pour faire face à la menace pandémique. Le Tamiflu est fabriqué par le laboratoire suisse Roche, détenteur d'une licence exclusive sur sa production et sa commercialisation. L'explosion de la demande mondiale en Tamiflu, provoquée par la perspective d'une pandémie grippale, a placé le laboratoire Roche, le seul fabricant au monde, donc, sous les feux de l'actualité et conduit la planète entière à presser ses dirigeants de répondre à l'évidente question : « pourrez-vous fabriquer les quantités de Tamiflu nécessaires à la constitution de stocks qui seront utilisés en cas de pandémie ? ». La question du brevet, on le voit, est donc aujourd'hui centrale. -- la licence exclusive détenue par le laboratoire Roche En 1996, un petit laboratoire californien de biotechnologie, Gilead Sciences Inc., met au point une molécule nouvelle, le phosphate d'oseltamivir, dénomination scientifique du Tamiflu, efficace contre les virus de la grippe. Tout juste en mesure de financer ses recherches, ce laboratoire cède l'exclusivité mondiale de la production et de la commercialisation du Tamiflu au géant pharmaceutique suisse Roche pour 50 millions de dollars et 10% de royalties sur le chiffre d'affaires. C'est le début de « la saga du Tamiflu » (Le Monde - 17 novembre 2005). Elle commence plutôt dans la morosité, la prescription d'antiviraux contre la grippe étant peu développée dans les pays industriels, à l'exception du Japon où le Tamiflu a toujours été largement utilisé. Mais, début 2004, lorsque l'épizootie de grippe aviaire s'installe de manière endémique en Asie du Sud-Est et que l'OMS lance ses premières alertes sur le risque de pandémie grippale, les ventes de Tamiflu s'envolent et les commandes affluent, un grand nombre de pays ayant décidé de constituer, à titre préventif, des stocks importants de Tamiflu La question s'est alors posée de savoir si le laboratoire Roche était en mesure de répondre à cette demande exceptionnelle et massive de Tamiflu, ou s'il fallait redouter une pénurie résultant de la saturation de ses capacités de production, la licence exclusive détenu par le fabricant suisse interdisant en principe à tout autre industriel de produire l'antiviral. Dans un premier temps, le laboratoire Roche a fait savoir que ses unités de production seraient à même de répondre à l'accroissement de la demande. Courant octobre, M. Olivier Hurstel, porte-parole du groupe, déclarait, dans des propos rapportés dans la presse : « Pour l'instant, nous répondons sans souci à la demande des gouvernements ». Le laboratoire excluait alors toute remise en cause de son monopole sur la fabrication du Tamiflu, considérant qu'il avait pris les dispositions appropriées et suffisantes pour augmenter ses capacités de production à un niveau compatible avec la nouvelle donne sanitaire mondiale. Comme l'a indiqué M. Henry-Vincent Charbonné devant la mission, « nous avons doublé nos capacités de production en 2004, puis en 2005. Nous les doublerons à nouveau en 2006, jusqu'à être capables, en 2007, de produire 300 millions de traitements par an. Nous avons déjà monté un véritable « Meccano industriel ». Actuellement, treize sites participent à la production du Tamiflu, dont la moitié appartiennent à Roche. Les autres appartiennent à des fournisseurs extérieurs, parce que nous avons dû faire appel à des partenaires ayant des capacités adaptées et des installations ad hoc ». Malgré ces assurances, le laboratoire suisse faisait l'objet de pressions de plus en plus fortes de la part de la communauté internationale, qui s'interrogeait sur sa réelle capacité à fabriquer du Tamiflu dans des quantités suffisantes pour répondre aux besoins résultant d'une éventuelle pandémie. Dans le doute, et alors que l'épizootie ne cessait de progresser et que des cas de contamination humaine, certains mortels, étaient signalés en Asie du Sud-Est, des voix se sont fait entendre, de plus en plus nombreuses, suggérant de « casser » le monopole du groupe suisse pour permettre à d'autres fabricants de produire du Tamiflu. Le secrétaire général des Nations Unies, Kofi Annan, a ainsi déclaré, le 7 octobre, que « la défense du droit de propriété ne doit pas entraver l'accès de tous aux médicaments » Après avoir rejeté, donc, dans un premier temps, la perspective de licences secondaires qui auraient permis à d'autres de fabriquer le Tamiflu, la position du laboratoire Roche a sensiblement évolué dans le sens d'un aménagement de sa licence. Cette évolution était, pour le groupe, la seule solution raisonnable, dès lors que, en plus de considérations morales, des arguments juridiques auraient permis, en tout état de cause, de passer outre les résistances du fabricant. -- il est juridiquement possible, en cas d'urgence sanitaire, de passer outre le droit de propriété du laboratoire Roche sur leTamiflu En France, si l'intérêt de la santé publique l'exige, et à défaut d'accord amiable avec le titulaire du brevet, l'article L.613-16 du code de la propriété intellectuelle ouvre la possibilité au ministre chargé de la propriété industrielle, sur proposition du ministre chargé de la santé publique, de soumettre un médicament au régime de la licence d'office dérogatoire aux droits des brevets. Cette option juridique n'a pour le moment pas été prise par les pouvoirs publics français. M. Didier Houssin a indiqué devant la mission qu'il avait demandé à l'AFSSAPS20 quelles étaient les possibilités de fabriquer le Tamiflu soit par le biais d'une licence secondaire concédée par Roche, soit par un système de médicament générique. Réponse : « Les informations que j'ai reçues confirment qu'il est difficile de produire ce médicament. Cela dit, si vraiment nous étions décidés à essayer de le faire, soit en fabriquant un générique, soit en poussant des industriels à devenir des sous-traitants pour Roche dans le cadre d'une licence secondaire, il faudrait analyser le processus de manière plus approfondie ». Sur le plan international, le directeur général de l'Organisation mondiale du commerce, M. Pascal Lamy, a rappelé, le 30 octobre dernier, que l'accès aux médicaments génériques pour les pays les moins développés est garanti. L'article 31 de l'accord de l'OMC sur les aspects des droits de propriété intellectuelle qui touchent au commerce (ADPIC) donne aux autorités publiques d'un pays la possibilité, par le biais des licences obligatoires, d'autoriser un tiers à fabriquer un produit breveté ou à utiliser le procédé breveté sans le consentement du titulaire du brevet. Cette flexibilité en matière de protection du brevet, prévue dès 1995, date de l'entrée en vigueur de l'accord sur les ADPIC, a été précisée par la déclaration ministérielle de Doha sur l'accord sur les ADPIC et la santé publique de novembre 2001. Cette déclaration confirme que les pays sont libres de déterminer les motifs pour lesquels les licences obligatoires sont accordées ; elles doivent néanmoins respecter un certain nombre de conditions énoncées par l'article 31. Ainsi, notamment, l'entreprise ou la personne qui demande une licence obligatoire doit avoir d'abord essayé de négocier une licence volontaire avec le détenteur du brevet à des conditions commerciales raisonnables. L'accord ADPIC prévoit qu'en cas d'urgence nationale ou d'extrême urgence, il n'est pas nécessaire d'essayer d'obtenir préalablement une licence volontaire. A l'origine, les licences obligatoires devaient être autorisées pour les approvisionnements du marché intérieur. La conférence interministérielle de Doha a décidée de modifier cette réglementation afin que les pays qui ne sont pas en mesure de fabriquer les produits pharmaceutiques puissent s'en procurer des copies les moins chères possible. Une décision du conseil général de l'OMC du 30 août 2003 a donc autorisé l'exportation de copies génériques fabriquées sous licences obligatoires vers des pays où la capacité de production est inexistante ou insuffisante. -- l'évolution de la position du laboratoire Roche Ainsi donc, sur le strict plan juridique, l'existence d'une licence exclusive ne peut en aucun cas constituer une légitimation de la position du laboratoire Roche défendant son monopole de production de Tamiflu. Le laboratoire avait aussi mis en avant des considérations d'ordre technique pour justifier l'exclusivité qu'il détient : la fabrication du Tamiflu est extrêmement complexe et requiert un savoir-faire qu'aucun autre industriel ne possède. M. Henry-Vincent Charbonné a ainsi expliqué devant la mission d'information : « Comme beaucoup de produits récents, la fabrication du Tamiflu est un processus compliqué. On est très loin de la chimie simple qu'on a pu connaître par le passé. Entre dix et douze mois sont nécessaires entre le ramassage de l'anis étoilé - ou badiane de Chine - jusqu'au stade final de la mise en boîte. En plus, le processus est complexe. D'abord, parce qu'il faut récolter l'anis étoilé et le traiter. Ensuite, parce qu'il y a des opérations de filtration et de purification, avant de passer à une étape chimique délicate, qui utilise des produits hautement toxiques et est explosive. Cette dernière étape de la fabrication de ce médicament ne peut se faire que dans des établissements agréés, lesquels sont actuellement, en tout et pour tout, au nombre de trois, aux Etats-Unis et en Europe. En outre, le caractère explosif de la réaction augmente avec la quantité produite » On ne pouvait douter de la capacité du laboratoire Roche à trouver une solution pour surmonter cet obstacle. Aurait-il pu en être autrement, face à la grave menace sanitaire qui pèse sur l'humanité, et alors que M. Charbonné lui-même a admis devant la mission : « Roche n'est pas capable de faire face à la demande mondiale ». Le problème semble aujourd'hui résolu, après que le Président directeur général du groupe, M. Franz Humer, ait lui-même exclu, le 18 octobre 2005, que le brevet soit un obstacle à la disponibilité du produit. Devant la mission d'information, M. Henry-Vincent Charbonné a indiqué que son groupe était aujourd'hui à la recherche de partenaires susceptibles de l'aider à accroître la production de Tamiflu : « Nous recherchons des partenaires capables de contribuer à une augmentation importante des quantités produites. Ils peuvent venir de l'industrie chimique, en apportant des capacités non utilisées, en prenant en charge telle ou telle phase du processus de production. Nous sommes en contact avec huit partenaires, après avoir reçu 150 demandes. Il s'agit soit de génériqueurs, soit des grands acteurs de la pharmacie ou de la chimie. Nous allons examiner de près ce qu'ils peuvent apporter à la production, et dans quels délais (...). S'agissant des coopérations, je ne citerai que ceux qui ont rendu publique leur démarche. Nous sommes en contact, en Inde, avec Ranbaxy, qui dit être en mesure de produire en grandes quantités dès lors qu'on lui fournirait la matière de base. Notre volonté est d'apporter notre savoir-faire et notre expertise à des partenaires capables de contribuer à une augmentation rapide et significative de la production ». Pour clarifier les données du problème, sans doute faut-il préciser que si le brevet constitue un obstacle juridique à la fabrication du Tamiflu par d'autres laboratoires, il n'en serait pas un pour celui qui voudrait produire un générique du Tamiflu. Seulement, le processus de production du médicament est si complexe que les laboratoires ne peuvent pas le maîtriser sans l'expertise du fabricant suisse. C'est pourquoi il leur est nécessaire de passer par la procédure des licences secondaires, afin de bénéficier du savoir-faire du titulaire de la licence exclusive. Le groupe suisse a donc engagé des discussions pour l'octroi de licences secondaires, avec des fabricants ou, même, des gouvernements. A la suite de l'autorisation donnée à l'Indonésie, le 25 novembre, de produire localement du Tamiflu, le ministre de la santé a annoncé son intention de produire un minimum de 220 millions de comprimés de Tamiflu. Pour sa part, Taiwan a annoncé qu'il allait produire le Tamiflu en dépit de l'absence d'autorisation du fabricant suisse. Le 13 décembre 2005, le groupe Roche a accordé une licence secondaire de fabrication du Tamiflu au laboratoire chinois Shanghai Pharmaceutical. Il a identifié 12 autres partenaires potentiels, la rumeur citant les noms de l'israélien Teva et les indiens Cipla, Dr Reddy et Ranbaxy. Selon un sénateur américain, Charles Schumer, qui a rencontré les représentants du groupe Roche, celui-ci serait sur le point d'annoncer des accords avec 15 laboratoires pharmaceutiques dont le laboratoire américain Mylan laboratories. Un porte-parole du laboratoire suisse a expliqué que « ces accords (permettraient) de faire bénéficier le laboratoire ou le chimiste de notre compétence, ce qui réduit de trois ans à six- huit mois le délai pour mettre au point la production ». Par ces initiatives, le géant suisse tente de désamorcer les critiques que son refus initial de discussion avec quiconque avait suscitées. Fin décembre, le laboratoire Roche a accordé une sous-licence au groupe indien fabricant de médicaments génériques Hetero, soulignant que cet accord « aura un effet immédiat sur la disponibilité de l'antiviral (...), à la fois directement et au travers d'accords futurs avec des entreprises locales ». Le groupe Hetero accède ainsi au rang de premier génériqueur capable d'accélérer les livraisons de Tamiflu. Les choses semblent donc avancer dans le bon sens, celui de l'intérêt général. Il n'est pas question de dénier au laboratoire Roche le droit de défendre ses intérêts, légitimes dans le cadre d'une économie de marché. Ainsi, il va de soi que l'octroi de licences secondaires devra s'accompagner d'une juste rémunération de l'industriel suisse, rémunération au demeurant prévue par les textes OMC mais qui n'en précisent pas les modalités de calcul, laissant aux deux contractants une entière liberté de manœuvre pour parvenir à un compromis. Il faut aussi faire crédit au laboratoire Roche d'une sincère détermination à chercher avant tout à répondre au défi sanitaire que constitue la menace de pandémie. Certains diront peut-être que l'explosion de la demande de Tamiflu provoquera pour le groupe suisse un effet d'aubaine inespéré. M. Henry-Vincent Charbonné a relativisé cette perspective : « Le Tamiflu représentera moins de 5 % de notre chiffre d'affaires en 2005 ; il est le 6ème ou 7ème produit. Le chiffre d'affaires de Roche vient surtout de toute une série de produits innovants, notamment dans le traitement des cancers, le cancer du sein en particulier (...). Je rappellerai qu'un produit comme le Tahor fait un chiffre d'affaires annuel de 10 milliards de dollars, et correspondant à des traitements qui s'étalent sur 10 ou 15 ans. Le Tamiflu fera un chiffre d'affaires important pendant deux, trois ou quatre ans, après quoi il retombera, fort heureusement, à un niveau beaucoup plus faible ». Relevons, pour conclure, le geste du laboratoire suisse qui a fait don de 3 millions de doses de Tamiflu à l'OMS ; ce médicament, vendu 15 euros aux pays riches, le sera à 7 euros aux pays les moins développés. Quand on sait que les dépenses de santé par habitant sont, au Vietnam, de 8 dollars$, alors qu'une cure d'antiviraux coûte de 30 à 40 dollars$, ce geste doit nous rappeler, nous Occidentaux, à notre devoir de solidarité à l'égard des plus démunis, auxquels nous devons garantir une distribution équitable des produits de santé en cas de pandémie. 2.-5.-4. Des interrogations sur la fabrication du vaccin pandémique La production en urgence et dans les délais les plus brefs possible d'un vaccin pandémique peut poser aux fabricants des problèmes à la fois juridiques et techniques. · la responsabilité des fabricants Les responsables de Sanofi Pasteur ont insisté devant la mission d'information sur le fait qu'une entreprise ne peut pas mettre sur le marché, dans des conditions de rapidité inhabituelle, un vaccin destiné à protéger la population en masse s'il n'est pas assuré que sa responsabilité ne sera pas engagée en cas d'accident lié à la vaccination. S'agissant du vaccin pandémique, M. Jacques Berger a indiqué que l'Etat, en passant sa commande, a accepté contractuellement d'assumer ce risque. Peut-être pourrait-on envisager de déplacer le règlement de cette question du terrain contractuel au terrain législatif, et de confier à la loi le soin d'organiser la prise en charge de ce risque vaccinal, l'indemnisation des patients restant assurée, en tout état de cause, par le fonds d'indemnisation des aléas thérapeutiques. · l'étendue de la vaccination L'étendue de la vaccination est une question centrale car elle conditionne le nombre de vaccins à fabriquer. Pour les experts, le développement d'une pandémie ne pourrait être efficacement enrayé que par la vaccination du tiers, environ, de la population. En France, cette évaluation conduirait donc à vacciner près de 21 millions de personnes, et, donc, à produire autant de vaccins, voire le double au cas où deux injections seraient nécessaires, ce dernier point ne pouvant pas, pour l'instant, être tranché. Les spécialistes considèrent que sur la base du volontariat, il serait possible d'atteindre un taux de couverture vaccinale satisfaisant de la population. Si la vaccination de toute la population française devait être rendue obligatoire, il faudrait envisager des quantités de vaccins comprises entre 60 et 120 millions de doses. Notons que sur un strict plan juridique, une telle mesure ne soulèverait pas d'objection car la loi permet de rendre une vaccination obligatoire ; la liste des maladies concernées est, quant à elle, fixée par l'autorité réglementaire et pourrait donc être complétée par la mention de la grippe aviaire. Votre rapporteur avait abordé cette question dans le rapport qu'il a écrit avec Mme Marie-Christine Blandin, sénatrice, sur le risque épidémique (cf. supra). · la sécurisation de l'approvisionnement en œufs Actuellement, les vaccins sont fabriqués à partir de souches virales sélectionnées et mises en culture sur œufs embryonnés de 11 jours, dans lesquels elles se développent. Les virus sont ensuite recueillis, purifiés et tués chimiquement pour fabriquer le vaccin. Il faut, selon les souches, entre un et quatre œufs pour produire une dose de vaccin. Mais encore faut-il que les œufs survivent à l'inoculation du virus. Or, la virulence de certains virus, comme le H5, fait que, cultivés dans les œufs de poule, ces virus les tuent rapidement. M. Didier Hoch a toutefois relativisé cette difficulté : « Aujourd'hui, il existe une technique, la reverse génétique, qui permet de maîtriser les virus sauvages et les rendre compatibles avec les œufs. Ce problème de toxicité du virus sur l'œuf n'existe plus en tant que tel : c'est l'une des grandes avancées de ces dernières années ». Et encore faut-il, aussi, que les poules ne soient pas atteintes par la grippe aviaire. Si les élevages devaient être un jour touchés, un sérieux problème d'approvisionnement se poserait à l'industrie du vaccin. Mme Catherine Gerdil21 , pour Sanofi Pasteur, a posé le problème en ces termes : « Revenons à la sécurisation de l'approvisionnement en œufs. Celui-ci se fait en plusieurs étapes. D'abord, nous mettons en place un approvisionnement annuel, pour être capable de produire quelle que soit la période de l'année. Il faut donc réfléchir en termes de nombre de fermes, de couvoirs... et de sécurisation de ces installations. Ensuite, nous devons prévoir des systèmes de stocks de sécurité supplémentaires, pour palier les éventuels problèmes d'un de nos fournisseurs d'oeufs. Nous avons estimé qu'il fallait un stock supplémentaire de l'ordre de 20 %. Enfin, nous devons diversifier géographiquement cet approvisionnement en œufs, pour diminuer l'impact d'épizooties localisées en France. En raison de la migration des oiseaux, nous risquons d'y être confrontés dès cette année ou dès le printemps prochain ». Il existe aujourd'hui une technique qui permet de s'affranchir de la contrainte que représente l'utilisation de l'œuf : la culture cellulaire. Des lignées cellulaires animales sélectionnées, cellules de rein de chien par exemple, sont produites en grande quantité dans des solutions nutritives et mises en attente. Dès l'apparition d'une nouvelle souche pathogène, les scientifiques peuvent inoculer la souche isolée dans ces cellules. Les virus vont s'y multiplier, puis seront recueillis, purifiés et inactivés. Cette technologie, qui offre des possibilités plus souples et plus rapides, n'est toutefois pas encore opérationnelle, ainsi que l'a confirmé M. Jacques Berger devant la mission : « Nous ne sommes pas encore capables de passer à la production sur culture cellulaire. Nous pouvons y réfléchir, mais la technologie n'est pas au point. Elle le sera d'ici à quelques années ». Il en a par ailleurs souligné les limites : « Elle permet l'élimination de l'utilisation des œufs. Mais elle ne permet pas de produire plus », ce qu'a confirmé Mme Catherine Gerdil : « Le système de culture cellulaire n'est pas aussi performant en termes de productivité que le système de culture sur œufs ». Malgré tout, la culture cellulaire restant la technologie de demain, Sanofi Pasteur a arrêté le projet de construction d'une usine de culture sur œufs aux Etats-Unis, ainsi que l'a confirmé M. Jacques Berger, avec une commande du gouvernement fédéral de l'ordre d'« une centaine de millions de dollars » (M. Jacques Berger). Mais pour le moment, c'est, donc, exclusivement sur l'œuf que repose la production des vaccins. S'agissant du vaccin pandémique, il est évident que toutes les dispositions doivent être prises pour sécuriser totalement l'approvisionnement. Il faut que des crédits publics soient dégagés pour assurer cette sécurisation, ces mesures devant être intégrées dans le plan « Pandémie ». Pour conclure sur ce point, votre Rapporteur insistera sur la nécessité de poser la question de la production de vaccins au niveau de l'OMS car les Etats qui disposent de l'outil industriel adapté auront peut-être tendance, en cas de pandémie, à vouloir privilégier leur population, une perspective difficilement compatible avec l'exigence de distribution équitable. --------------------- Au cours de sa réunion du 25 janvier 2006, la mission d'information a examiné le rapport, présenté par M. Jean-Pierre Door, rapporteur. Après un débat auquel ont pris part M. Jean-Pierre Door, rapporteur, M. Jean-Marie Le Guen, Président, MM. Gérard Bapt, Gabriel Biancheri, Jérôme Bignon, Gérard Charasse, Roland Chassain, Alain Claeys, Mmes Jacqueline Fraysse, Geneviève Gaillard, MM. François Guillaume, Pierre Hellier, la mission d'information a, à l'unanimité, adopté ce rapport et, conformément à l'article 145 du Règlement de l'Assemblée nationale, autorisé sa publication. Les médicaments et les vaccins 1. Garantir l'approvisionnement en matières premières nécessaires à la fabrication du Tamiflu. 2. Garantir l'approvisionnement en œufs pour la fabrication d'un vaccin. 3. Envisager la constitution de stocks d'antibiotiques pour soigner les complications de la grippe. 4. Charger l'Agence nationale de la recherche (A.N.R.) de lancer des programmes de recherche-développement sur les maladies émergentes, pour la mise au point d'antiviraux, d'antibiotiques et de vaccins. La protection personnelle 5. Garantir l'approvisionnement en matières premières nécessaires à la fabrication des masques de protection. 6. S'assurer que les besoins en matériels de protection, autres que les masques, (blouses, gants, lunettes) seront satisfaits, en cas de forte augmentation de la demande. 7. Encourager la recherche-développement sur les équipements personnels de protection, en particulier les masques permettant une respiration aisée. La coopération internationale 8. Poursuivre et amplifier les actions de soutien au réseau des Instituts Pasteur en Asie du Sud-Est. 9. Engager l'Union européenne à prendre les mesures nécessaires pour disposer de stocks suffisants d'antiviraux, notamment la délivrance de licences obligatoires. 10. Prendre au niveau européen et international les dispositions nécessaires pour donner suite à la proposition d'« union sacrée des fabricants de vaccins » lancée par le laboratoire GlaxoSmithKline, en vue d'une collaboration de tous les laboratoires du monde pour la fabrication d'un vaccin pandémique, en dépit des règles antitrust en vigueur. 11. Favoriser l'obtention par l'Organisation mondiale de la santé (OMS) d'un véritable pouvoir d'ingérence sanitaire (enquêtes et contrôles). --------------- SOMMAIRE DES AUDITIONS Les auditions sont présentées dans l'ordre chronologique des séances tenues par la Mission. Table ronde sur les données scientifiques disponibles concernant la grippe aviaire et le risque de transmission du virus à l'homme, avec : le professeur Jean-Philippe DERENNE, chef du service de pneumologie et de réanimation à l'hôpital de La Pitié-Salpêtrière, le docteur Jean-Claude DÉSENCLOS, chef du département des maladies infectieuses de l'Institut national de veille sanitaire (InVS), Mme Sylvie VAN DER WERF, chef de l'unité de recherche génétique moléculaire des virus respiratoires (GMVR) de l'Institut Pasteur, M. Philippe VANNIER, directeur de la santé animale à l'Agence française de sécurité sanitaire des aliments (AFSSA) (Procès-verbal de la séance du mercredi 26 octobre 2005) 83 Audition du professeur Didier HOUSSIN, Directeur général de la santé au ministère de la santé et des solidarités, Délégué interministériel à la lutte contre la grippe aviaire (Procès-verbal de la séance du mercredi 2 novembre 2005) 105 Audition de M. Christophe WEBER, président du laboratoire GlaxoSmithKline France (Procès-verbal de la séance du mardi 8 novembre 2005) 123 Audition de M. Henry-Vincent CHARBONNÉ, Président du laboratoire Roche France (Procès-verbal de la séance du mardi 8 novembre 2005 ) 131 Audition de M. Gérard DUMONT, haut fonctionnaire de défense au ministère de la santé et des solidarités, en charge de la question des masques de protection (Procès-verbal de la séance du mercredi 16 novembre 2005) 143 Audition conjointe de fabricants de masques : M. Frédéric BIFFAUD, président de 3M Santé, M. Philippe BOELE, directeur industriel de 3M France, M. Franck AJUELOS, conseiller scientifique de la gamme asepsie de 3M France, M. Roland FANGEAT, président de Bacou-Dalloz Plaintel (Procès-verbal de la séance du mercredi 16 novembre 2005) 153 Audition de M. Didier HOCH, Président de Sanofi Pasteur MSD, M. Jacques BERGER, directeur général délégué de Sanofi Pasteur,et Mme Catherine GERDIL, chef de projet Sanofi Pasteur (Procès-verbal de la séance du mercredi 16 novembre 2005) 163 Visio-conférence, depuis Genève, avec le Docteur Margaret CHAN, sous-directrice générale à l'Organisation mondiale de la santé (OMS), en charge de la grippe pandémique (Procès-verbal de la séance du jeudi 24 novembre 2005) 181 Audition de M. Xavier Bertrand, ministre de la santé et des solidarités (Procès-verbal de la séance du mardi 29 novembre 2005) 191 Table ronde sur les données scientifiques disponibles concernant la grippe aviaire et le risque de transmission du virus à l'homme, avec : le professeur Jean-Philippe DERENNE, chef du service de pneumologie et de réanimation à l'hôpital de La Pitié-Salpêtrière, le docteur Jean-Claude DÉSENCLOS, chef du département des maladies infectieuses de l'Institut national de veille sanitaire (InVS), Mme Sylvie VAN DER WERF, chef de l'unité de recherche génétique moléculaire des virus respiratoires (GMVR) de l'Institut Pasteur, M. Philippe VANNIER, directeur de la santé animale à l'Agence française de sécurité sanitaire des aliments (AFSSA) Présidence de M. Jean-Marie LE GUEN, Président M. le Président : La « grippe aviaire » est préoccupante à deux titres : à cause de l'épizootie, dont nous suivons la progression dans le monde et, surtout, du risque de pandémie virale humaine qu'elle pourrait provoquer. La tâche qui incombe à la mission d'information est inédite à l'Assemblée nationale, dans la mesure où c'est la première fois que nous sommes appelés à gérer en temps réel un risque sanitaire avéré. Nous apprécions l'action menée par les pouvoirs publics, singulièrement par le Gouvernement, mais notre rôle sera d'en appréhender et d'en évaluer tous les aspects, dans le cadre du contrôle que la représentation nationale a pour mission d'exercer sur l'action du Gouvernement en général. Je précise que notre rapporteur, Jean-Pierre Door, a déjà remis un rapport sur le risque épidémiologique au nom de l'Office parlementaire d'évaluation des choix scientifiques et technologiques, et que je suis moi-même le rapporteur pour avis de la Commission des affaires culturelles, familiales et sociales sur le budget de la sécurité sanitaire. En outre, tous les députés ici présents ont déjà travaillé sur ces questions, dans le cadre de leur vie professionnelle ou de leur activité parlementaire. Nous chercherons à apporter une réponse à la crise actuelle dans un cadre de travail collectif et pluraliste - tous les groupes de l'Assemblée nationale sont représentés dans la mission d'information -, l'enjeu consistant à « construire de la confiance ». À cet effet, nous nous appuierons sur le débat, sur la transparence et, en l'absence de vérité scientifique, sur le recueil des informations les plus sûres. Nous voulons être une source crédible d'information pour les Français, en même temps qu'une instance d'évaluation du dispositif de préparation et son efficacité. Si la formule de la mission d'information a été retenue, c'est parce que, contrairement à celle de la commission d'enquête, elle ne fixe pas de limite à la durée des travaux des députés. Nous apprécierons nous-mêmes cette durée mais nous n'attendrons pas l'achèvement de nos travaux pour rendre publics des recommandations ponctuelles ou des rapports d'étape, en fonction des circonstances, c'est-à-dire du développement de la menace, voire, le cas échéant, de la crise. Nous accueillons ce matin quatre experts : Mme Sylvie Van der Werf, chef de l'unité de recherche génétique moléculaire des virus respiratoires de l'Institut Pasteur, le GMVR, qui nous introduira dans le monde des virus d'influenza ; le professeur Jean-Philippe Derenne, médecin clinicien, chef du service de pneumologie et de réanimation à l'hôpital de la Pitié-Salpêtrière, co-auteur d'un ouvrage de référence - « Pandémie : la grande menace » - qui abordera les questions purement médicales ; le docteur Jean-Claude Désenclos, chef du département des maladies infectieuses de l'Institut de veille sanitaire, l'InVS, qui, en sa qualité d'épidémiologiste, décrira les différents scénarios possibles ; M. Philippe Vannier, vétérinaire, directeur de la santé animale à l'Agence française de sécurité sanitaire des aliments, l'AFSSA, qui interviendra sur la problématique de l'épizootie. Je propose, avec l'accord du rapporteur, que nous intercalions des séries de questions entre les interventions de nos invités. Mme Sylvie VAN DER WERF : Je vais m'efforcer de faire le point sur les caractères de la virologie grippale intéressant l'homme, en commençant par rappeler qu'il existe une multitude de virus grippaux, répartis en plusieurs types et sous-types. Les virus responsables des épidémies saisonnières - c'est-à-dire les virus de type B, de type A (H3N2) et de type A (H1N1) - circulent en permanence et se manifesteront, cette année encore, au cours de l'hiver. Tous les virus grippaux présentant la caractéristique de varier continuellement, nous sommes contraints de réactualiser chaque année la composition vaccinale, sur la base de l'ensemble des données recueillies l'année précédente par les laboratoires appartenant au réseau mondial de l'Organisation mondiale de la santé. Pour ce qui est de l'hémisphère nord, l'OMS émet sa recommandation en février en vue de la production des vaccins qui seront disponibles dans les officines au mois d'octobre. D'autres virus grippaux circulent parmi des espèces animales comme les chevaux, les porcs et surtout les oiseaux, plus particulièrement les oiseaux aquatiques migrateurs, canards et autres. C'est en effet chez ces derniers que peuvent être retrouvés tous les virus grippaux connus. Ils restent généralement cantonnés aux oiseaux et n'ont pas le pouvoir d'infecter les espèces mammifères, à commencer par l'homme. Il arrive néanmoins exceptionnellement que l'homme soit infecté après une exposition forte à un air très chargé en virus, comme ce fut le cas lors de l'épizootie de grippe du poulet survenue à Hong Kong en 1997 : dix-huit cas de transmission du virus avaient alors été diagnostiqués, occasionnant six décès. La transmission a été stoppée par une éradication à la source, c'est-à-dire par l'abattage massif d'animaux. Le virus a cependant continué à circuler avec vitalité en Asie parmi les diverses espèces d'oiseaux, évoluant au fil des passages d'une espèce à l'autre. C'est ainsi qu'a été constatée, fin 2003, une explosion des infections chez les volailles et les oiseaux sauvages en Asie du sud-est, accompagnée de l'apparition de nouveaux cas de maladie chez l'homme : 121 cas ont été confirmés depuis lors, dont 62 décès, au Vietnam, en Thaïlande, en Indonésie et au Cambodge. L'infection de l'homme, inhabituelle, suppose une exposition forte de l'individu à la source de contamination. Ainsi, bien que les virus H5N1 ne se transmettent pas efficacement d'un individu à l'autre, ils ont déjà parcouru la première étape vers l'adaptation à l'homme, c'est-à-dire vers une menace de pandémie, ce qui est d'autant plus grave qu'ils se traduisent dans la majorité de cas par une maladie sévère. Le danger, c'est qu'ils acquièrent cette capacité à se transmettre d'homme à homme. Pour ce faire, deux mécanismes sont imaginables : soit les virus, profitant du nombre croissant d'élevages contaminés, accumulent par hasard un ensemble de caractéristiques qui les rendent de plus en plus transmissibles ; soit, au cours de l'hiver, un sujet est infecté à la fois par un virus de la grippe saisonnière et par un virus de la grippe aviaire, et des échanges de matériel génétique interviennent à cette occasion, conférant en bloc au virus résultant de cet échange l'ensemble des caractéristiques nécessaires à son adaptation à l'homme et à une transmission accélérée. Quels sont les moyens susceptibles d'être mis en œuvre ? Les premières mesures sont relatives à la surveillance, en particulier virologique. Il s'agit d'abord de détecter et d'isoler les virus responsables des infections grippales : nous réalisons cette surveillance dans le cadre de l'épidémie de grippe saisonnière, pour suivre sa propagation, identifier les virus incriminés, analyser leur évolution et vérifier qu'ils sont adaptés à la composition vaccinale de la saison en cours. Il s'agit ensuite de déterminer les possibilités d'infection par les virus H5N1, notamment parmi les voyageurs entrant sur le territoire national en provenance de zones infectées : des méthodes ont été développées par le réseau des laboratoires de l'OMS afin de confirmer, lorsqu'ils reçoivent un prélèvement, la nature du virus découvert, de vérifier qu'il est resté complètement aviaire, mais également de dresser le bilan de ses caractéristiques antigéniques, afin de maintenir les vaccins à jour face à son évolution constante. En cas de pandémie, il faudra évidemment poursuivre ce type de travail sur le territoire national : détecter les cas et suivre l'évolution génétique et antigénique du virus. Un autre moyen de lutte est l'utilisation des antiviraux. Les virus H5N1 sont sensibles à une certaine classe d'antiviraux, les anti-neuraminidases, commercialisés sous la forme de deux médicaments : le Tamiflu et le Relenza. Il importe aussi de suivre l'éventuelle apparition de résistances car les antiviraux deviendraient alors inopérants. Les virus H5N1 ont certes la potentialité de développer des résistances, mais on sait que des virus devenus résistants sont moins vivaces que les virus sensibles ; on peut par conséquent s'attendre à ce que leur diffusion dans la population soit nettement moins efficace et que, mis en compétition avec des virus sensibles, ils soient rapidement éliminés. Une stratégie d'utilisation d'antiviraux, en cas de pandémie, passerait à la fois par le traitement, appliqué très précocement, et la prévention, de façon à éviter le développement de la maladie. Les antiviraux n'empêcheront en effet pas totalement l'infection mais réduiront la durée de la maladie, la multiplication du virus et par conséquent sa capacité de propagation. Les anticorps apporteront une réponse immunitaire protectrice. À cet égard, les laboratoires, au fur et à mesure de la circulation du virus pandémique, devront évaluer régulièrement le taux de population immune, de façon à pouvoir définir une prophylaxie. M. Denis JACQUAT : Je me méfie de l'idée selon laquelle une « exposition forte » serait nécessaire à la contamination. Après les catastrophes du sang contaminé et de Tchernobyl, la France a été accusée d'une certaine frilosité et il ne faudrait pas commettre la même erreur avec la grippe aviaire, en évacuant l'éventualité de contaminations à la suite d'expositions fugaces, lors du plumage des volailles, par exemple. Nous sommes responsables devant l'opinion publique et nous devons informer sans affoler. Ne nous trompons pas. M. Pierre HELLIER : Avec quelle rapidité le diagnostic de la grippe peut-il être établi avec certitude ? Est-il certain que le Tamiflu et le Relenza n'empêchent pas l'apparition des anticorps ? M. Jean-Pierre DOOR, Rapporteur : J'insiste sur la première question de M. Hellier : quel est le délai nécessaire pour obtenir un diagnostic biologique et viral de la grippe ? Quels sont les laboratoires de référence français ? Combien y en a-t-il ? Quelles sont les méthodes biologiques de dépistage qu'ils appliquent ? Enfin, comment les virus se recombinent-ils en passant par l'intermédiaire d'autres vecteurs animaux ? M. le Président : Le diagnostic des souches est certes crucial mais, en période de pandémie, un diagnostic de masse serait tout aussi essentiel. Avez-vous les moyens de mener à bien une telle opération ? D'autre part, les passages du H5N1 de l'oiseau vers l'homme qui ont été étudiés se sont-ils accompagnés d'un début de mutation virale ? Est-il possible, à partir du nouveau virus apparu chez l'homme, de commencer à travailler à un nouveau profil vaccinal ? L'inefficacité du passage de l'homme vers l'homme est-elle avérée ? Mme Sylvie VAN DER WERF : S'agissant de la notion d' « exposition forte », j'aurais du mal à la préciser, d'un point de vue quantitatif. En théorie, une seule particule virale infectieuse peut suffire à contaminer un individu. Cependant, même en Asie, notamment au Vietnam, où les volailles sont omniprésentes sur les marchés et où il existe de nombreux élevages familiaux, le simple fait de passer à une dizaine de mètres d'un animal infecté ne suffit pas à attraper la maladie. En revanche, il est vrai que l'opération de plumage a donné lieu à plusieurs cas d'infection par le virus H5N1. Je crains de ne pouvoir fournir une réponse quantifiée pour mesurer ce que j'ai qualifié d'« exposition forte » ; tout dépend de la quantité de virus présente sur des particules comme les poussières en suspension ; la concentration de virus à laquelle le sujet est exposé doit être importante pour initier l'infection. Je répète que le virus H5N1 est inadapté à l'homme, dans le sens où la quantité de virus nécessaire à l'infection doit être plus élevée - même si on ne peut pas la quantifier - que dans le cas de la grippe saisonnière. Mais d'autres facteurs entrent en ligne de compte : toute la population est « naïve » et par conséquent réceptive à ce virus, contrairement à ce qui se passe pour le virus grippal saisonnier, auquel nous sommes confrontés chaque année ; la charge virale nécessaire à l'infection dépend aussi de l'état de santé de chacun : certains sont plus sensibles que d'autres au risque infectieux. J'ai volontairement employé le terme d' « inefficace » à propos de la transmission interhumaine de la grippe aviaire. Certes, dans quelques cas cliniques, elle semble être la seule option envisageable, les personnes touchées n'ayant jamais été exposées à des volailles infectées mais ayant par contre été au contact, de manière proche et prolongée, à des personnes malades. L'exemple le plus probant est celui d'une maman, en Thaïlande, qui avait soigné sa petite fille atteinte. Mais, dans tous les cas où une infection interhumaine était soupçonnée, l'analyse du virus a établi que celui-ci avait conservé une nature totalement aviaire, sans aucune recombinaison du matériel génétique. Nous n'avons malheureusement pas encore décrypté l'ensemble des conditions nécessaires à l'adaptation à l'homme d'un virus aviaire. Plusieurs éléments ont cependant été identifiés et il est vrai que, dans certains cas détectés de passage de l'oiseau à l'homme, certaines de ces signatures particulières ont été retrouvées. Le réseau des laboratoires de l'OMS s'attache actuellement à séquencer entièrement le matériel génétique du virus pour aller à la recherche de ces signatures et suivre la moindre de ses évolutions vers l'adaptation. Ce dont on est sûr, c'est que l'évolution ne procède pas d'une modification unique mais d'une combinaison de signatures particulières. Un vaccin prototype a été élaboré à partir d'un virus isolé au Vietnam en 2004. Il a fallu modifier certaines de ses caractéristiques par des méthodes de génie génétique, afin de lui faire perdre de sa virulence - il ne faut pas, en effet, que le virus ainsi obtenu pour le vaccin tue le substrat de production, c'est-à-dire l'œuf de poule embryonné, ni exposer inutilement les producteurs de vaccin à une source de contamination trop forte. Des lots pilotes, produits par différents laboratoires pharmaceutiques, subissent à l'heure actuelle des essais cliniques. Il s'agit de déterminer les conditions optimales d'utilisation en termes de nombre d'injections, de dosage et d'apport d'adjuvants. Ce vaccin pandémique est destiné à une population « naïve », contrairement aux vaccins employés contre la grippe saisonnière. Il faut donc installer une immunité protectrice à partir de rien, ce qui nécessite au minimum deux injections, à trois semaines d'intervalle. Il faudra aussi vraisemblablement employer des adjuvants comme stimulants de la réponse immunitaire. Enfin, il conviendra de calculer la quantité de virus minimale à intégrer pour que le vaccin soit efficace, sachant que moins on en mettra, plus on pourra fabriquer de doses. Le diagnostic est effectué grâce à des techniques moléculaires extrêmement rapides : le résultat peut être obtenu vingt-quatre à trente-six heures après la détection d'un cas. Le goulet d'étranglement se situe au stade de l'acheminement des prélèvements. Les groupes d'experts ont beaucoup travaillé pour mettre au point des kits de prélèvement utilisables partout et améliorer les modalités d'acheminement des prélèvements vers les laboratoires agréés disséminés sur tout le territoire français, sachant qu'en cas de diagnostic positif sur le virus H5N1, ils sont ensuite adressés à l'un des deux centres nationaux de référence, situés à Paris et Lyon, de façon à confirmer le résultat et surtout à isoler le virus afin de le caractériser plus finement. M. le Président : Ce schéma n'est pas réaliste du point de vue opérationnel : vous n'aurez pas les moyens de traiter une masse de 50 000 prélèvements par exemple. Mme Sylvie VAN DER WERF : Je vous confirme que c'est totalement exclu. Aujourd'hui d'ailleurs, c'est à partir des informations communiquées par les réseaux de surveillance de médecins généralistes et de pédiatres qu'il est possible de suivre la diffusion du virus grippal dans chaque région. Il n'y a pas de diagnostic spécifique réalisé. M. le Rapporteur : Tous les laboratoires hospitaliers de France ont-ils la capacité d'effectuer ces diagnostics ? Mme Sylvie VAN DER WERF : Ces diagnostics nécessitent tout de même un minimum de technicité et un laboratoire de sécurité de type P3. Une liste de laboratoires compétents techniquement, ouverts sept jours sur sept et vingt-quatre heures sur vingt-quatre, a été dressée. Ceux-ci pourront être agréés pour réaliser les diagnostics selon des techniques mises au point par le centre de référence. Nous leur fournirons également des témoins positifs permettant de valider le diagnostic. M. Jean-Claude FLORY : Une fois que la mutation du virus aura été décelée, combien de temps faudra-t-il compter pour fabriquer des vaccins pandémiques ? Mme Jacqueline FRAYSSE : Je souhaiterais que nous posions nos questions aux intervenants une fois qu'ils se seront tous exprimés. M. le Président : Mme Van der Werf va répondre à la question de M. Flory. Mme Sylvie VAN DER WERF : Pour produire un vaccin pandémique adapté, le délai raisonnable serait de six mois. M. le Président : Je propose que les trois autres intervenants s'expriment, après quoi nous les interrogerons. Je vous rappelle que nous n'avons pas pour ambition de résoudre tous les problèmes dès ce matin, mais de progresser dans la connaissance du risque. M. Jean-Philippe DERENNE : Du point de vue clinique, trois aspects me semblent importants : la grippe est une maladie virale, mais ses complications peuvent être virales ou bactériennes ; la grippe pandémique est différente de la grippe usuelle. La grippe est une maladie virale, transmise presque exclusivement de façon respiratoire, par le biais des gouttelettes de salive émises lors de la toux. La contagiosité est très forte, le nombre de particules virales atteignant un à dix millions par millilitre. Elle est d'autant plus grande que les individus sont proches : autrement dit, la grippe s'attrape par exemple dans le métro. La contagiosité dépend du statut immunitaire du sujet qui inhale les particules virales, selon qu'il est vacciné, immunodéprimé, âgé, bébé de moins d'un an, etc. La grippe usuelle se caractérise tout d'abord par une phase d'incubation de trois jours, pendant laquelle le virus se multiplie sans aucun symptôme. Ensuite, ceux-ci apparaissent brutalement : de gros frissons, de la fièvre, des maux de tête, des douleurs musculaires et de la toux. Chez le sujet normal, qui se contente de prendre du paracétamol, la fièvre tombe au bout de trois jours mais on assiste parfois, au quatrième jour, à un regain, ce phénomène étant qualifié de « V viral ». La guérison, sans aucune séquelle, intervient alors dans 90 % des cas, ce qui confère à la grippe une réputation de bénignité. Néanmoins, même en dehors d'une pandémie, des complications peuvent toucher des individus identifiés et auxquels il est recommandé de se faire vacciner : les personnes âgées de plus de soixante-cinq ans ou frappées par une maladie chronique - immunodéprimés, diabétiques, transplantés ou cancéreux. Ces complications sont essentiellement respiratoires : bronchites et, pire, pneumonies, très graves par nature. Les pneumonies virales, précoces, peuvent très mal tourner, faute de traitements. Pour les pneumonies bactériennes, qui surviennent au quatrième, cinquième ou sixième jour, il existe des traitements. Permettez-moi de faire remarquer aux élus de la nation que les poussées de bronchopathie chronique liées à des virus respiratoires n'intéressent absolument personne, alors qu'elles constituent l'un des plus gros postes de dépenses de santé : les statistiques font apparaître un surcroît très net d'hospitalisations en réanimation au moment des pics d'épidémies grippales, et certainement pas lors des pics d'émission d'ozone... Chez l'enfant, la grippe se distingue par des signes digestifs, avec une complication éventuelle, le syndrome de Reye, sorte d'encéphalite avec hypertension intracrânienne, qui laisse des séquelles et se conclut même par un décès dans 20 % des cas. La grippe usuelle, selon les années, est plus ou moins bénigne, mais se montre davantage agressive sur les enfants ou sur les personnes âgées. Elle a par ailleurs pour conséquence d'accroître l'absentéisme au travail parmi les personnes âgées de vingt à soixante ans. Les historiens ont dénombré trente et une grippes pandémiques depuis 1581, dont trois sont plus connues : la grippe espagnole de 1918-1919, qui a frappé en trois fois, au printemps 1918, à l'automne 1918 et au printemps 1919 ; la pandémie de 1957, due à un virus H2N2 ; celle de 1968, due à un virus H3N2. La pandémie de 1918-1919 était, semble-t-il, imputable à un virus aviaire pur, capable de sauter sur l'homme alors que, pour les deux dernières, les virus s'étaient recombinés à partir d'un mélange homme-oiseau passé par le cochon. La mortalité de la pandémie de 1918 a été initialement estimée à 20 ou 22 millions de personnes. Des études ultérieures ont révisé les chiffres à la hausse : en 1982, on a parlé de 27 à 39 millions de morts puis, plus récemment, de 50 à 100 millions. Si le représentant de l'Organisation des Nations unies a agité le spectre de 150 millions de morts pour une future pandémie, c'est en extrapolant à partir du triplement de la population mondiale enregistré depuis un siècle. Sommes-nous menacés par le retour de la grippe espagnole sous une autre forme ? S'agissant de l'origine de ce virus, plusieurs hypothèses ont été émises, dont celles de la Chine et des États-Unis. L'armée américaine, pendant la Première Guerre mondiale, a perdu 43 000 hommes à cause de la grippe et 23 000 au combat. En Allemagne, 400 000 personnes sont mortes à cause du virus. Si cette grippe a été qualifiée d'« espagnole », c'est simplement que le roi d'Espagne a été touché, même s'il en a guéri, contrairement à Klimt, Schiele, Apollinaire, Rostand et beaucoup de dames de la Comédie française, ce qui a permis quelques promotions imprévues... En 1918, des cas d'encéphalites avec pneumonies virales hémorragiques œdémateuses, mais aussi bactériennes, ont également été signalés. La grippe était considérée comme une maladie bactérienne car une bactérie avait été identifiée, en 1890, au cours d'une pandémie précédente, comme responsable de la maladie. Or les médecins, lors de la pandémie de grippe espagnole, ont eu la surprise de trouver de temps en temps cette bactérie - haemophilus influenzae - mais beaucoup plus souvent du pneumocoque, voire du staphylocoque doré, et parfois rien du tout. C'est seulement en 1933 que le virus de la grippe a été identifié. Les pandémies de 1957 et 1968 ont été beaucoup moins mortelles : de l'ordre de un à trois millions de morts chacune. La grippe espagnole avait beaucoup touché les enfants de moins d'un an, presque personne entre un et quatorze ans, énormément de sujets de quinze à soixante-cinq ans et presque personne après soixante-cinq ans. La pandémie de 1957 a essentiellement touché les plus de soixante-quinze ans. Celle de 1968 a surtout atteint les moins d'un an et les plus de soixante-quinze ans. Une nouvelle symptomatologie apparaît chez la centaine d'individus touchés par la souche de grippe aviaire H5N1 non mutée : deux seulement avaient plus de cinquante ans et presque tous les autres avaient moins de dix-huit ans. M. Jean-Claude DÉSENCLOS : Quels risques la grippe aviaire fait-elle courir à la santé humaine ? Pourquoi et comment ces risques peuvent-ils se matérialiser ? Quel est le risque pour l'homme lors du contact direct avec les produits aviaires ? Quels sont les risques secondaires à moyen terme, pour l'homme, d'une épizootie incontrôlée, sur toute la planète ? Une pandémie humaine pourrait survenir à la suite d'une mutation ou d'une recombinaison du virus, qui s'adapterait alors à l'homme : la population dans son ensemble serait alors vulnérable, et dépourvue de vaccin disponible. Le virus de la grippe humaine se transmet de personne à personne à partir d'un malade, par voie aérienne, par l'intermédiaire de gouttelettes respiratoires ou, indirectement, via l'environnement contaminé. Le virus de la grippe aviaire, pour sa part, est rarement transmis à l'homme car, pour des raisons biologiques et génétiques, il lui est inadapté. On ne constate habituellement pas de transmission secondaire d'homme à homme à partir des sujets malades. La transmission du virus aviaire à l'homme à partir des oiseaux nécessite un contact étroit et intense avec des oiseaux malades ou morts de la grippe aviaire ou avec leur environnement contaminé. Elle s'opère alors par voie respiratoire, par un aérosol contaminé de virus ou, indirectement, par l'environnement contaminé. Le risque de transmission de la grippe aviaire H5N1 à l'homme est très faible, les chiffres en attestent. On estime à 150 millions au bas mot le nombre d'oiseaux touchés par l'épizootie H5N1 en Asie. Les personnes qui ont été en contact avec ces oiseaux malades ou morts et leur environnement se chiffrent donc probablement à plusieurs centaines de milliers. Or 121 cas humains seulement ont été répertoriés à ce jour, mais des cas très graves, puisque 60 décès ont été répertoriés parmi ces personnes. Même si le nombre de cas est sans doute sous-estimé par rapport à la réalité, le risque pour l'homme est faible et, surtout, il peut être réduit par des mesures de prévention simples, qui ont montré leur efficacité lors d'une épizootie de H7N7, aux Pays-Bas, en 2003. Celles-ci consistent à séparer autant que possible les travailleurs des animaux touchés, à leur faire utiliser des masques, éventuellement à leur prescrire des antiviraux et à les vacciner contre la souche de grippe qui circule pour éviter les recombinaisons. Le risque de SRAS, le syndrome respiratoire aigu sévère, pour le personnel de soin a pu être maîtrisé grâce à l'usage des masques FFP2 par le personnel soignant. H5N1 pose toutefois un problème inquiétant : la mortalité très élevée observée chez les personnes contaminées, qui atteint 50 %. Il est du reste tout autant agressif pour d'autres espèces animales comme les tigres ou les chats. Le risque d'une pandémie à partir de l'épizootie aviaire pourrait survenir si le virus aviaire se recomposait avec un virus grippal humain ou s'il mutait mal, de façon purement aléatoire. Le virus recomposé serait alors plus adapté à la transmission interhumaine et pourrait par conséquent se diffuser parmi la population humaine. Une contamination serait possible, pour toutes les classes d'âge, car personne ne serait immunisé. Cette recombinaison du virus pourrait se produire chez le porc ou chez l'homme lui-même. La probabilité de cette recombinaison augmente bien sûr avec la persistance et l'intensité de l'épizootie H5N1, mais aussi avec la densité de population concernée par l'infection et avec l'intensité des échanges entre population animale et population humaine. M. le Président : Pouvez-vous recentrer votre propos sur les problèmes épidémiologiques ? Certains ne comprennent pas forcément pourquoi nous sommes aujourd'hui confrontés à un défi mondial. Le Président des États-Unis en personne préconise la mise en quarantaine des personnes atteintes par le virus. Qu'en pensez-vous ? M. Jean-Claude DÉSENCLOS : J'y viendrai dans un instant. L'importance du contrôle de l'épizootie dans les pays pauvres d'Asie est d'autant plus grande. Il est indispensable que nous leur apportions notre aide car ils n'y arriveront pas seuls. Les trois pandémies du siècle dernier indiquent que 30 % au moins de la population pourrait être touchée, avec une mortalité susceptible de dépasser celle de la grippe saisonnière et qui ne se limiterait pas aux groupes à risques. Je vais m'attarder quelques instants sur le taux de reproduction, c'est-à-dire le nombre de nouveaux cas induits par un malade. L'épidémie commence lorsque ce taux excède un. Pour la grippe saisonnière, il est compris entre 1,5 et 2,5. Lors des pandémies du passé, il variait de 1,5 à 3. L'autre paramètre à prendre en compte est l'intervalle séparant deux cas successifs, qui, pour la grippe, est de deux jours seulement : la transmission est donc très véloce et exponentielle. Dans ces conditions, il est illusoire de penser que les malades pourraient être placés en quarantaine, d'autant que des transmissions auront lieu non seulement lors de contacts rapprochés mais aussi lors de contacts sociaux : si j'étais porteur du virus, vous tomberiez tous malades dans les deux jours qui viennent ! Pour prévenir une pandémie par recombinaison de l'actuel virus H5N1, très pathogène pour l'homme, il faudrait pouvoir contrôler l'épizootie depuis son déclenchement, ce qui n'est pas le cas. Il importe également de détecter la survenue de cas humains porteurs de virus mutés ou recomposés, ce que les programmes de surveillance, notamment sous l'égide de l'OMS, s'emploient à faire au mieux en Asie comme en Europe. Dès que nous est signalé le cas d'une personne arrivant d'un pays sensible et susceptible d'être touchée par la grippe aviaire, nous effectuons une évaluation et, le cas échéant, nous recherchons la présence du virus. Depuis le début de l'épizootie, 200 personnes ont ainsi été signalées, une dizaine d'entre elles, qui correspondaient à des critères d'exposition, ont été testées, mais tous les examens se sont révélés négatifs. M. le Président : Je ne crois pas que les médecins français soient invités à prévenir l'Institut de veille sanitaire lorsqu'ils diagnostiquent un cas de grippe chez une personne arrivant d'Asie. M. Denis JACQUAT : Les centres 15 sont en alerte. M. le Président : Mais les médecins n'appellent pas le centre 15 lorsqu'ils diagnostiquent une grippe chez un patient. Du reste, ils ne pensent pas forcément à lui demander s'il revient d'Asie. Je n'ai pas l'impression que la sensibilisation des médecins à laquelle vous faites allusion soit effective dans la pratique. M. Jean-Claude DÉSENCLOS : En tout cas, l'information est donnée, à l'aéroport, aux personnes en provenance d'Asie du Sud-Est, je l'ai encore vérifié il y a peu. Le système est peut-être imparfait mais il fonctionne : le centre 15 effectue un premier tri, selon que la personne a été en contact rapproché ou non avec des volailles. En l'état actuel de choses, il n'y a aucune raison de prendre des mesures plus radicales. La détection précoce est essentielle, de même que la décentralisation des tests, pour que les capacités de diagnostic soient plus proches des malades éventuels. La tendance centralisatrice de la France, de ce point de vue, constitue un handicap. En l'absence de vaccin, l'usage des antiviraux pourra retarder voire bloquer le développement de la pandémie, à condition que le taux de reproduction du virus reste relativement faible, ce qui est possible au tout début de la pandémie, si le virus s'adapte progressivement à l'homme. Il convient donc d'être en mesure de répondre rapidement et de disposer de stocks d'antiviraux d'oseltamivir en quantité suffisante : 14 millions de traitements sont actuellement disponibles, soit une couverture de l'ordre de 23 % de la population. La réduction des contacts sociaux, associée à l'utilisation d'antiviraux, pourrait aussi avoir une certaine efficacité. Quant au recours aux caméras thermiques pour détecter les personnes fiévreuses, il a fait l'objet de deux études mais les modélisations mathématiques sont peu concluantes : moins de 20 % des personnes malades seraient identifiées. Il faudrait réduire le trafic aérien de plus de 90 % pour retarder d'une à deux semaines l'arrivée de la pandémie sur le territoire européen. Enfin, l'utilisation de masques constitue un moyen de lutte efficace, en particulier pour le personnel soignant, mais on ne dispose pas d'étude comparative sur les effets qu'aurait l'extension du port du masque à toute la population. L'enjeu consiste à gagner du temps pour se rapprocher du moment où le vaccin sera produit. C'est une stratégie de course contre la montre, au cours de laquelle la mise en œuvre de mesures imparfaites mais complémentaires peut diminuer l'impact initial de l'épidémie, en attendant le vaccin, qui sera efficace dès la deuxième vague. La crise actuelle met en évidence les lacunes des connaissances sur la grippe et la nécessité de consacrer beaucoup d'énergie à de nouveaux travaux de recherche. M. le Rapporteur : Le système de surveillance existe, avez-vous dit, mais il est « imparfait ». Le mot me gêne... Pouvez-vous en en dire davantage ? Que faudrait-il faire pour qu'il ne soit plus imparfait ? M. Jean-Claude DESENCLOS : Il n'est certainement pas parfait, en ce sens que quelqu'un qui revient d'Asie du Sud-Est avec 40° de fièvre ne consultera pas nécessairement tout de suite, ou consultera un médecin qui ne pensera pas forcément à l'interroger sur son voyage, ou encore, s'il appelle le centre 15, pourra tomber sur quelqu'un qui a oublié la consigne... La surveillance est un état d'esprit qui va du malade au médecin, puis de celui-ci vers les autorités de santé publique qui doivent se mobiliser rapidement et efficacement. Or beaucoup de médecins n'ont pas du tout envie de déclarer des infections à l'autorité sanitaire. Si imperfection il y a, elle est sans doute de nature culturelle, s'agissant en particulier de la culture de santé publique du corps médical. Dans les pays nordiques ou anglo-saxons, les médecins collaborent beaucoup plus facilement lorsqu'on leur demande de signaler des cas. M. le Président : Il va donc falloir mener un travail de surveillance un peu plus particulier sur les personnes présentant un syndrome grippal ; les médecins doivent penser à leur demander si elles reviennent d'Asie du Sud-Est et, si oui, le signaler afin que puisse être mené le travail d'investigation épidémiologique. Il est vrai que nous n'avons pas cette culture en France ; il nous appartient, sans alourdir outre mesure les procédures, de faire avancer l'idée de santé publique et d'épidémiologie. M. Philippe VANNIER : Je vous recommande au préalable deux excellentes publications : la première, de la FAO, sur l'Asie du Sud-Est22, la seconde, du laboratoire de référence de l'OIE, sur l'historique de l'influenza aviaire. Dans le domaine animal, on compte quinze sous-types liés à l'hémagglutinine (H) et neuf sous-types liés à la neuraminidase (N). La peste aviaire, appelée improprement grippe aviaire, est liée essentiellement à deux sous-types : le H5 et le H7, voire le H9, qui entraînent des signes cliniques très marqués dans la population animale, aviaire en particulier. Mais l'affaire se complique par le fait que, dans le H5 comme dans le H7, on trouve des souches faiblement pathogènes qui n'entraînent aucun signe clinique sur les animaux, et des souches hautement pathogènes qui diffèrent des premières par une simple mutation génétique entraînant une modification des séquences des acides aminés, et qui sont seules responsables de la peste ou grippe aviaire. Les souches faiblement pathogènes sont une banalité dans le monde animal, notamment de la faune sauvage, depuis des décennies. Un peu d'histoire vous montrera que les cas cliniques d'influenza se retrouvent dans le monde entier. Au Mexique, entre 1994 et 2003, épizootie à H5N2 : un milliard de volailles mortes ou abattues. En Pennsylvanie, entre 1996 et 1998, épizootie à H7N2 : 2,4 millions de volailles mortes ou abattues. En Australie, en 1997, épizootie à H7N4 : 300 000 volailles mortes ou abattues. À Hong Kong, entre 1997 et 2003, épizootie à H5N1 : 3 millions de volailles mortes ou abattues. En Asie du Sud-Est, entre 2003 et 2004, épizootie à H5N1 : 100 millions de volailles mortes ou abattues. À Taïwan, en 2004, épizootie à H5N2 : 66 000 volailles mortes ou abattues. En Italie, en 1999 et 2001, épizootie à H7N1 : 17 millions de volailles mortes ou abattues. Aux Pays-Bas, en 2003, épizootie à H7N7 : 30 millions de volailles mortes ou abattues. Autrement dit, la grippe ou peste aviaire n'est pas un phénomène récent. Cela étant, on a recensé, entre 1959 et 1998, dix-sept épizooties, mais huit entre 1997 et 2004, dans douze pays. Je reviendrai sur les facteurs qui expliquent cette fréquence plus élevée. Qu'y a-t-il aujourd'hui de nouveau par rapport à ces cas historiques ? Premièrement, la durée de l'épizootie : il est rare de voir une épizootie durer plus de deux ans dans le monde. Deuxièmement, sa sévérité, autrement dit le niveau de pathogénéicité de la souche dans la population animale. Troisièmement, la forte mortalité observée dans la faune sauvage, phénomène tout à fait nouveau. Quatrièmement, le nombre de cas humains, mais qui doit être apprécié à la lumière de la durée exceptionnelle de cette épizootie et des conditions spécifiques de l'élevage aviaire en Asie du Sud-Est. Parmi ces spécifiés, l'une, fondamentale, est le mélange permanent d'espèces, particulièrement entre les canards et les autres oiseaux dans des élevages essentiellement en plein air. Une autre particularité est la très forte densité de populations animales et humaines, surtout sur les marchés, très nombreux en Asie, où, par ailleurs, la chaîne du froid n'est pas respectée et où les clients, pour des raisons liées à des habitudes culturelles, tiennent à acheter la bête vivante et à l'abattre eux-mêmes pour la consommer rapidement. Les marchés asiatiques concentrent ainsi des milliers de volatiles, au milieu desquels la population humaine, dense, est fortement exposée. Autre particularité : la taille des structures de production. Les petits élevages, comme ceux pratiqués en Asie du Sud-Est, sont, d'après la FAO, davantage susceptibles de développer des épizooties en raison de la fréquence des cas d'infection. Ce à quoi vient s'ajouter l'absence totale d'infrastructures efficaces d'État et d'organisations professionnelles, qui permettraient de juguler efficacement l'épizootie, et des considérations économiques, tenant à l'absence d'indemnisation de l'éleveur constatant des cas d'infection dans son élevage : loin d'être incité à déclarer ces cas aux autorités sanitaires, il va, bien au contraire, les camoufler, enterrer les cadavres et prier en espérant que son élevage ne sera pas tué. Autant de raisons déterminantes qui expliquent la « non-maîtrise » de l'épizootie dans le sud-est asiatique. L'exemple de la Chine est révélateur : pas d'infrastructures permettant une lutte efficace, à quoi vient s'ajouter une très probable forte sous-déclaration : 56 cas seulement ont été déclarés contre plus de mille en Thaïlande et au Vietnam. Inversement, au Japon, quatre élevages ont été infectés, apparemment par des oiseaux sauvages, mais sans doute par des souches faiblement pathogènes, et en Corée, des infections ont été détectées sur des élevages de canards ne présentant même pas de signes cliniques, ce qui montre l'efficacité des systèmes de vigilance dans ces deux pays où l'infection a été très rapidement jugulée. Très différente est la situation en Thaïlande et au Vietnam, en raison de la multitude de petits élevages et, aussi, du fait que certains foyers n'ont pas été repérés au début ou l'ont été trop tard pour être efficacement éteints. Quels sont les origines et les mécanismes d'induction de ces épizooties, passées et actuelles ? Toute épizootie a deux grandes causes : la première, la plus importante mais souvent la moins connue, reste le négoce, autrement dit le commerce d'oiseaux vivants, légal ou illégal. La situation en Sibérie, telle que l'analyse l'AFSSA, apparaît à cet égard très troublante : les cas recensés au Kazakhstan, en Mongolie, en Sibérie et tout récemment à Toula suivent non pas les routes des oiseaux migrateurs, mais la ligne du Transsibérien ! Ajoutons que, dans la plupart des foyers actuels, y compris en Russie, aucune enquête épidémiologique fiable n'a été diligentée par les autorités. Il n'en est heureusement pas de même en Roumanie et en Turquie : un remarquable travail a été conduit par les autorités turques, qui rend hautement probable l'hypothèse d'une transmission par les oiseaux migrateurs. La forte mortalité relevée chez les oiseaux migrateurs, ai-je dit, est un fait nouveau, et qui, au surplus, ne correspond pas à une explication cohérente du rôle des oiseaux migrateurs dans une transmission à longue distance : lorsqu'on a la grippe, on ne va pas courir un marathon... On imagine mal un oiseau manifestant des signes cliniques d'infection voler sur des milliers de kilomètres. Mais les récents travaux du professeur Webster, qui a inoculé les souches isolées à Hong Kong entre 1997 et 2003 à des lots de canards, dont un quart n'a pratiquement pas manifesté de signes cliniques, tendent à prouver l'existence d'une résistance chez certaines espèces, et, sans doute aussi, la présence de « porteurs sains », autrement dit d'animaux capables d'héberger le virus, de le multiplier et de le transmettre, sans en être victimes eux-mêmes. Or les cas relevés en Roumanie et en Turquie, pays traversés par des flux migratoires, s'articulent bien avec les cas apparus plusieurs mois auparavant en Sibérie orientale, en Mongolie et au Kazakhstan. Cela pourrait signifier que le flux migratoire dit « mer Caspienne - Est-Afrique » serait contaminé. En revanche, la mission dépêchée par l'OIE au Kazakhstan, en Mongolie et en Sibérie rapporte très clairement que les foyers observés dans ces zones ne correspondent pas au démarrage des flux migratoires. Ce qui soulève des questions, mais sans forcément apporter de réponses claires : si l'on a bien isolé des souches H5N1 hautement pathogènes sur des oiseaux migrateurs morts en Asie du Sud-Est, on n'en a encore jamais trouvé sur des oiseaux migrateurs vivants. Autrement dit, l'hypothèse des oiseaux migrateurs est hautement probable, mais pas encore totalement démontrée. Le foyer découvert tout récemment à Toula, au sud de Moscou, pourrait découler d'une contamination par un flux migratoire différent de celui cité plus haut, dit « mer Noire - Méditerranée » ou encore « Est-Atlantique », encore que cette hypothèse pose bon nombre de questions qui n'ont pas reçu de réponse : c'est en avril-mai et non en octobre, date à laquelle la majorité des espèces ont déjà migré, que l'apparition de ces foyers aurait dû logiquement survenir. Quoi qu'il en soit, à défaut de réponses certaines, la plus grande prudence est de mise, prudence qui inspire d'ailleurs les deux avis émis par l'AFSSA les 19 et 21 octobre derniers. Plus généralement, l'accroissement de la fréquence des foyers d'influenza aviaire au cours des sept derniers mois peut s'expliquer par plusieurs raisons sur lesquelles tous les spécialistes mondiaux de la question sont à peu près d'accord. En premier lieu, la vigilance accrue de l'ensemble des acteurs, autorités, éleveurs et structures, aidés par de meilleurs outils de diagnostic. Les techniques de biologie moléculaires, très décentralisées, permettent désormais un diagnostic et un typage rapides et se sont banalisées dans le monde vétérinaire. Il y a quelques années, personnes n'aurait parlé de ces pauvres dindons morts dans l'île de Chios... Aujourd'hui, quelques heures après leur mort, c'est l'affolement général et toute la planète est au courant de leur sort ! C'est dire à quel point la vigilance s'est accrue, peut-être même exagérément. Il n'est pas non plus impossible, de l'avis des spécialistes, que les changements climatiques aient eu un effet sur les flux migratoires. Cette hypothèse ne peut être totalement écartée. Mais la raison essentielle tient à l'évolution des structures de production avicoles dans les dix dernières années. L'augmentation du nombre d'élevages en plein air n'est pas anodine sur le plan de la santé animale. En effet, il faut bien différencier les causes du démarrage d'un foyer et les conditions qui permettront la propagation de l'épizootie. Parmi ces conditions, la densité des élevages, qui, par exemple aux Pays-Bas, a joué un rôle déterminant lors de la crise de 2003 : on comptait 25 élevages au kilomètre carré aux Pays-Bas, de même qu'au Nord de l'Italie où 17 millions de volailles ont été abattues entre 1999 et 2001. Je ne suis pas certain que cette densité soit aussi élevée en France. Le déclenchement d'un foyer, puis l'extension d'une épizootie sont liés à l'interaction de multiples facteurs, et celle-ci n'est jamais simple. On connaît en tout cas très bien les causes et les mécanismes de départ des épizooties historiquement recensées depuis dix ans. La première cause est évidemment l'introduction d'une souche hautement pathogène par le biais du négoce, c'est-à-dire par l'échange d'animaux. Chacun a en mémoire l'épizootie de fièvre aphteuse en 2001, en France, provoquée par le négoce de moutons infectés, crise que la France a, au demeurant, remarquablement gérée : elle a pu limiter considérablement le nombre de foyers alors que les moutons infectés n'exprimaient pratiquement pas de signes cliniques de fièvre aphteuse. Le négoce, légal ou illégal, est la première cause d'introduction de souches pathogènes dans un pays. C'est ce qui explique les mesures drastiques prises pour empêcher toute importation d'animaux vivants et de produits animaux dans l'Union européenne. La deuxième raison, malgré tous les points d'interrogation qui demeurent, tient aux oiseaux migrateurs. Les cas roumains et turcs amènent en tout cas à se poser la question, à défaut d'avoir une réponse certaine. Le troisième mécanisme, classique, quoique peu connu des non-spécialistes, part des souches faiblement pathogènes, très banales en Europe : les prélèvements effectués montrent un taux de prévalence d'environ 4 %. Les oiseaux sauvages sont fréquemment porteurs de souches faiblement pathogènes d'influenza aviaire. Mais un contact inter-espèces, dans certaines conditions bien précises, entre un canard sauvage, par exemple, et une espèce beaucoup plus sensible comme le poulet de chair ou la dinde, va donner lieu à une réplication importante du virus au cours de laquelle pourra survenir une mutation. Durant une première phase préclinique d'infection de l'élevage par une souche H5 ou H7 faiblement pathogène, étape silencieuse pendant laquelle les animaux présenteront peu de signes cliniques, le virus va se répliquer et une mutation pourra survenir. Cela peut ne pas être le cas ; mais plus la réplication est importante, plus la probabilité augmente. Arrive alors une phase clinique, où l'élevage manifeste des signes patents d'infection par la souche H5 ou H7 devenue hautement pathogène. Ce n'est toujours pas une épizootie, mais un foyer isolé ; celle-ci n'apparaîtra que lorsque le virus se sera fortement propagé dans le voisinage. En Asie du Sud-Est, ce sera très rapide du fait des petits élevages, du négoce et des marchés. En Europe, la présence d'un ou plusieurs foyers créerait une situation grave, mais pas dramatique : tout dépend de la précocité du diagnostic. Plus rapidement on sait quels élevages sont infectés, plus facilement on peut maîtriser la propagation de l'infection avant qu'elle ne tourne à l'épizootie. En revanche, un retard dans la détection des premiers cas, conjugué à une grande densité des élevages et une propagation non maîtrisée par voisinage ou commerce, entraînera, comme en Hollande en 2003, une véritable épizootie, d'autant que les poulets et les dindes sont extrêmement sensibles au virus, tant sur le plan clinique que sur celui de la réplication. En conclusion, il n'y a, pas plus en France qu'en Europe, de crise sanitaire : à ma connaissance et à ce jour, aucun foyer n'a été détecté ou déclaré. En revanche, il existe une menace réelle qu'il ne faut ni exagérer ni sous-estimer. M. le Président : Il n'est pas question, dans l'heure qui nous reste, de mettre sur pied un plan de lutte contre la pandémie... Soyons modestes dans nos objectifs et restons-en à la phase de compréhension des données du problème. M. Pierre HELLIER : Apparemment, on décède de pneumopathie. Faut-il utiliser le vaccin Pneumo 23 ? A-t-on intérêt à associer deux anti-viraux ? Un vaccin antigrippal peut être mis au point en six mois à partir du moment où le virus mutant a été isolé, mais combien de temps faudra-t-il attendre pour qu'il soit réellement disponible ? Autre point : si une personne revient de l'étranger avec une grippe et qu'elle appelle le 15 ou le médecin, il est presque déjà trop tard : elle aura pu prendre les transports en commun pour rejoindre son domicile. La petite affichette dans les aéroports ne suffit pas. Il faudrait un dépistage plus précis au moment de l'arrivée en France. M. Daniel PREVOST : Seuls une vaccination et un abattage systématique des volailles domestiques dans les pays touchés permettront de réduire au plus vite la pression infectieuse. Cette stratégie défendue par la FAO et l'OMS ne tient pas compte de l'instabilité génétique des virus grippaux de type A impliqués dans la grippe aviaire, et de leur capacité à « réassortir » leur matériel génétique et à fusionner, voire à récupérer le bagage génétique d'un virus mort. Quel peut être le danger de ces mutations pour la population ? L'AFSSA a-t-elle mis en place un système de surveillance de la faune sauvage ? Mme Geneviève GAILLARD : Je remercie tous nos invités pour la clarté de leurs interventions. Nous sommes vigilants, certes, mais que fait-on sur le plan médical, voire vétérinaire, dans les pays en voie de développement où les foyers comme les risques sont les plus importants ? Si l'on ne prend pas le problème à la source, le risque ne pourra logiquement qu'augmenter. Comment l'Europe et la France peuvent-elles intervenir dans ces pays et les aider, dans l'immédiat et pour le long terme, à limiter ces épizooties et leurs conséquences humaines ? M. le Président : La Russie et la Chine ne sont pas des pays en voie de développement... Mme Geneviève GAILLARD : Disons les pays où les politiques sanitaires ne sont pas formidables... M. le Président : Osons le dire : où il y a du laxisme. Mme Geneviève GAILLARD : ...et les populations humaines et animales beaucoup plus concentrées. M. François GUILLAUME : Peut-on envisager une campagne de vaccination contre la peste aviaire, en dépit de la propension du virus à muter ? On a toujours hésité entre la vaccination et l'abattage systématique. Dans le cas de la fièvre aphteuse, la vaccination, particulièrement efficace, avait été abandonnée pour des raisons commerciales et l'épizootie a justement frappé de plein fouet un pays, la Grande-Bretagne, qui ne l'avait jamais pratiquée. La vaccination contre la peste aviaire, si elle est possible, n'est-elle pas préférable à l'abattage ? M. Marc JOULAUD : M. Vannier a rappelé à juste titre les spécificités des systèmes de production asiatiques et le fait que le phénomène n'avait rien de nouveau. L'organisation et la structuration des filières avicoles en France constituent-elles à ses yeux une garantie ou une chance face à une éventuelle extension du problème ? Nos filières doivent-elles envisager une vaccination systématique pour continuer leur activité ? Enfin, doit-on envisager des mesures de restriction pour les importations de volailles d'Amérique du Sud ? M. Jean-Claude FLORY : À supposer que les oiseaux migrateurs soient des vecteurs potentiels, se pose la question des lieux d'hivernage. Des points de suivi et de repérage ont-ils été mis en place dans le cadre de l'OMS ? Par ailleurs, on sait que la cuisson à 60° détruit le virus. Certains prônent la congélation. Mais quelle est la durée de vie du virus dans les animaux morts ? M. le Président : Nous avons entendu, en nous réveillant ce matin, que l'Autorité européenne de santé des aliments déconseillait de gober les œufs... Quel sens peut avoir une telle recommandation ? La conclusion de M. Vannier était très précise ; or nos œufs sont, en gros, français, ou sinon d'origine européenne. Cette recommandation quelque peu alarmiste ne risque-t-elle pas d'avoir des répercussions dramatiques ? M. Jean-Michel BOUCHERON : Ces exposés ont montré à quel point le facteur temps était fondamental. Quel est l'avis de nos invités sur l'efficacité de l'alerte ? Jugent-ils les esprits correctement mobilisés, qu'il s'agisse des médecins qui doivent signaler les cas douteux, ou des agriculteurs, qui doivent être assurés d'être indemnisés s'ils détectent eux-mêmes des signes d'infection ? Mme Sylvie VAN DER WERF : Le délai de disponibilité du vaccin de six mois s'entend entre le moment où le virus pandémique faisant l'objet d'une transmission interhumaine est identifié et celui où les premières doses sortent des unités de production. Il faut ajouter le temps de produire et de mettre à disposition les quantités suffisantes. M. Jean-Philippe DERENNE : Comprenez bien que, face à une pandémie grippale, il n'existe pas un médicament ou une stratégie permettant de traiter 100 % des cas. S'agissant de l'alerte, pour ce qui concerne non les animaux, mais les hommes, la déclaration de l'OMS du 2 septembre23 est parfaitement claire : le risque de pandémie est grand, le risque va persister, l'évolution de la menace n'est pas prévisible, le système d'alerte est faible, une intervention préventive est possible mais elle n'a jamais été tentée, et enfin, je cite, « la réduction de la morbidité et de la mortalité au cours d'une pandémie sera freinée par le manque de vaccins et d'antiviraux... » Formulation très diplomatique pour annoncer une situation peu rassurante ! De quoi disposons-nous concrètement ? Tout d'abord de mesures d'éviction, comme les éventuels systèmes de quarantaine, le port des masques FFP2, le lavage des mains, autant de procédures très importantes qui, à elles seules, ont permis d'éviter une pandémie avec le SRAS, beaucoup moins transmissible, il est vrai, que le virus de la grippe. Ces mesures concernent prioritairement tous ceux qui sont exposés professionnellement ou occasionnellement au risque d'infection. S'agissant des médicaments, associer deux antiviraux serait très bien... si nous en avions deux. Malheureusement, et pour diverses raisons, nous ne disposons pas d'un panel de médicaments comme nous en avons pour traiter le staphylocoque. On connaît deux catégories d'antiviraux efficaces : les inhibiteurs de la protéine M2, amantadine et rimantadine - mais il semble bien que les Chinois s'en soient servis pour traiter les poules, ce qui a donné des souches intégralement résistantes à l'amantadine - et les inhibiteurs de la neuraminidase - le « N » du sigle H5N1. Nous disposons de trois sortes d'inhibiteurs de la neuraminidase : le Tamiflu, produit par le laboratoire Roche, est le seul médicament dont nous disposons en quantité, mais sa fabrication est liée à l'approvisionnement en anis étoilé, intégralement produit en Chine. Roche aurait, paraît-il, trouvé le moyen de fabriquer un produit de synthèse sans avoir recours à l'anis étoilé, ce qui ferait ainsi sauter un goulet d'étranglement. Le deuxième médicament, le Relenza, était fabriqué par le laboratoire GlaxoSmithKline (GSK), mais celui-ci l'a mis de côté. En effet, à la différence du Tamiflu, facilement administrable par voie orale, le Relenza, détruit dans le tube digestif, n'est actif qu'en intraveineuse - ce qui pourrait être très utile dans certains cas - ou par inhalation, avec un système très compliqué... GSK étudie la possibilité d'un conditionnement en aérosols ; malheureusement, ceux-ci sont contre-indiqués pour les asthmatiques. Le troisième médicament devait être fabriqué par Johnson & Johnson, un des plus gros laboratoires mondiaux, mais celui-ci l'a finalement jugé insuffisamment rentable. Son inventeur crie au secours sur Internet et cherche un partenaire industriel. Nous nous retrouvons donc dans une situation extrêmement délicate, puisque nous n'avons finalement qu'un seul produit en quantité. Or on sait qu'il n'est jamais bon d'avoir un fusil à un seul coup face aux maladies infectieuses : il suffirait d'une très mauvaise utilisation pour fusiller la seule arme dont nous disposons, ce qui serait notamment le cas si le Tamiflu était prescrit à tout va, n'importe comment et à n'importe qui. Quelle est la particularité du Tamiflu ? Il n'est actif que contre la grippe. Il est actif en préventif et en curatif. Concrètement, il n'est vraiment efficace qu'au cours des douze premières heures. Passée la quarante-huitième heure, le Tamiflu n'a plus aucune efficacité. Comme il n'est pas toujours facile de diagnostiquer avec certitude une grippe en quelques heures, on ne peut traiter les malades que sur une présomption clinique. Si l'on a beaucoup de médicaments, cela ne pose pas de problèmes. Mais si l'on en a peu... Il faut à cet égard féliciter le Gouvernement - nous y sommes pour quelque chose - d'avoir ramassé tout le Tamiflu et de l'avoir mis sous la garde de l'armée pour que personne ne puisse s'en procurer, et qu'il soit disponible le jour où nous en aurons réellement besoin. De surcroît, il se conserve huit à dix ans s'il n'est pas en gélules, trois ou quatre ans seulement s'il est conditionné en gélules. On peut donc en mettre de côté pour très longtemps. Une pandémie est une guerre infectieuse ; or nous n'avons qu'une arme et elle doit être sous bonne garde. Venons-en aux complications de la grippe. Les principales sont d'origine bactérienne. Deux germes sont plus particulièrement concernés : le pneumocoque et le staphylocoque doré. Il existe effectivement un vaccin contre le pneumocoque, le Pneumo 23, d'une efficacité de l'ordre de 80 % et grosso modo sans effets secondaires majeurs. On peut donc encourager la vaccination, au moins pour les groupes à risques ; l'effet du Pneumo 23 dure cinq ans et je n'ai jamais vu d'effets secondaires, ce qui n'est pas toujours le cas avec la vaccination antigrippale. Non seulement nous disposons de nombreux médicaments contre le pneumocoque, mais il n'existe pas de pneumocoque résistant aux antibiotiques. Un pneumocoque dit « résistant » n'est qu'un pneumocoque moins sensible aux traitements et qui doit être traité avec des doses plus élevées. Cela n'a rien à voir avec la résistance d'un staphylocoque doré. Aucun pneumocoque ne résiste à six grammes d'amoxycilline par exemple. De nombreuses stratégies sont donc possibles. Il en va tout autrement pour le staphylocoque doré, car si les souches sauvages sont très sensibles aux antibiotiques, des souches résistantes sont apparues, face auxquelles nous risquons de ne pas avoir suffisamment d'antibiotiques efficaces. C'est là que pourra se poser un problème d'approvisionnement, et, avant, de prévision des besoins. M. Philippe VANNIER : Le problème des œufs rejoint celui de la survie du virus dans les animaux morts. Je ne comprends pas l'information que, tout comme vous, j'ai apprise par la presse ce matin. À partir du moment où aucun foyer n'est recensé ni en Europe ni en France, cette recommandation ne repose à mon sens sur rien de logique. M. le Rapporteur : Mais qui a lancé cette information ? M. le Président : J'ai entendu que ce serait l'Autorité européenne de sécurité des aliments, l'AESA. M. Philippe VANNIER : L'AESA a été créée dans la foulée des autres agences d'évaluation des risques. Le principe de la séparation entre analyse du risque et gestion du risque a été appliqué au niveau européen puisque, à côté de la DG « Sanco »24 de la Commission européenne, a été instituée une autorité européenne de sécurité des aliments dont le siège est à Parme. Elle peut être saisie par le Parlement européen, par les États et, surtout, par la Commission et notamment par sa DG « Sanco ». Elle a toute compétence en matière d'analyse et d'évaluation du risque dans les domaines de la sécurité des aliments et de santé animale. Je suis certain que l'AESA n'a émis aucun avis sur cette question. Je ne vois aucune explication rationnelle à cette recommandation sur la consommation des œufs en Europe, dans la mesure où on n'y a détecté aucun foyer de peste aviaire. Sur la question de la survie du virus dans les animaux abattus, l'AESA émettra prochainement un avis. Il faut se souvenir que, sauf cas très particuliers, les animaux infectés n'entrent jamais dans la chaîne alimentaire en Europe. Il en va tout autrement en Asie ou dans les pays où, faute de protéines, les gens n'hésitent pas à consommer des animaux morts de grippe aviaire, ce que personne ne ferait ni en France ni en Europe. Sitôt un foyer détecté, les systèmes de contrôle et de gestion sanitaires empêchent les animaux d'entrer dans la chaîne alimentaire : ils sont détruits. À supposer que quelques animaux atteints ne soient pas détectés, ce qui est peu probable, la survie du virus dépend de plusieurs facteurs assez compliqués, en premier lieu de la cuisson et de certains traitements technologiques. M. le Président : Réinsistons sur le fait que nous ne sommes absolument pas dans cette situation. Si une crise était avérée, d'autres mesures seraient prises pour éviter tout risque pour la santé humaine. Mais nous n'en sommes pas là du tout. M. Philippe VANNIER : Vous avez raison de le rappeler. S'agissant la vaccination, un avis de l'AFSSA sortira dans les jours à venir sur l'utilisation possible des vaccins pour le cas où une épizootie de peste aviaire surviendrait en France. Sans préjuger des conclusions des experts, plusieurs facteurs doivent être pris en considération, à commencer par les options de gestion et les impératifs économiques, qui relèvent du Gouvernement, mais également des producteurs. La question s'est posée pour la fièvre aphteuse : faut-il vacciner pour mieux maîtriser dans l'immédiat, auquel cas quid du risque de fermeture des marchés à long terme, alors qu'avec l'abattage, les marchés peuvent être rouverts à très brève échéance ? En revanche, si l'épizootie n'est pas maîtrisée, l'outil vaccinal peut être très intéressant. Mais il ne faut pas perdre de vue que, d'une part, la dérive du virus sur le plan génétique, et donc antigénique, n'est pas totalement connue, et, d'autre part, qu'une vaccination massive peut masquer une infection et, de ce fait, en affecter la maîtrise. La question de la stabilité du virus H5N1 mérite également quelques précisions, que Mme Van der Werf voudra bien compléter. Depuis 2003, des porcs ont été infectés en Chine, mais sont restés des « culs-de-sac épidémiologiques », en ce sens que s'ils ont séroconverti, on n'a pas pour autant relevé de recombinaisons ni de transmissions importantes de porcs à porcs depuis deux ans. Par ailleurs, si plusieurs génotypes de virus H5N1 ont bien été identifiés dans divers pays d'Asie, il semblerait que cela ne soit pas lié à une dérive génétique du virus, mais davantage à une évolution variable selon les pays en partant d'un ancêtre commun, probablement à Hong Kong. Mme Sylvie VAN DER WERF : La capacité des virus de type H5N1 à infecter l'homme, et qui dépend d'associations de gènes assez spécifiques, tient au fait qu'ils ont fait des allers et retours entre les volailles domestiques terrestres et les oiseaux sauvages, notamment aquatiques. Ces sauts d'espèces permanents ont abouti à la sélection d'un virus tout à fait particulier, virulent sur les volailles, mortel pour certaines espèces aquatiques, capable d'infecter une grande variété d'oiseaux, mais également bon nombre de mammifères, jusqu'à des léopards et des tigres. Certains zoos ont connu de véritables hécatombes. M. Philippe VANNIER : L'utilisation de la vaccination dépend de différents facteurs. L'AFSSA rendra dans les jours qui viennent un avis, à la demande des ministères de l'agriculture et de la santé, car il faut savoir anticiper afin d'avoir les outils disponibles pour le cas où le problème arriverait. Cela suppose un cahier des charges bien arrêté vis-à-vis des industriels chargés de produire les vaccins - pour peu qu'il y ait lieu de les utiliser, ce qui n'est pas encore le cas. Le risque lié à la faune sauvage a été anticipé depuis déjà plusieurs années par une surveillance à la fois active et passive. Sous l'égide de la DGAL25 du ministère de l'agriculture, un plan de surveillance a été mis en place avant même 2003, renforcé en 2004 et en 2005, auquel collaborent l'AFSSA, l'Institut Pasteur, l'Office national de la chasse et de la faune sauvage dont le rôle est très important, et le Muséum d'histoire naturelle qui compte des ornithologues très compétents. Les chasseurs eux-mêmes sont impliqués, dans le cadre du réseau SAGIR26 piloté par l'AFSSA, dans cette surveillance active de la faune afin de pouvoir détecter, le plus précocement possible, une éventuelle souche hautement pathogène - sachant que les souches faiblement pathogènes sont d'une banalité consternante depuis des années. Parallèlement, est assurée, à travers les fédérations départementales de chasseurs, une surveillance passive des mortalités anormales. Un maillage de réseaux a été organisé afin que tout un chacun n'aille pas ramener pour analyse un merle mort en Bretagne... Il faut savoir raison garder. Une panoplie d'outils parfaitement fonctionnels a été mise en place et renforcée, qui, à défaut de tout maîtriser, traduit en tout cas une réelle prise en compte du risque. Sur les lieux d'hivernage en Afrique du Nord, je ne suis pas certain qu'il y ait quelque chose à faire. Il faut prendre en compte le retour des oiseaux migrateurs en 2006, qui auront été en contact avec des oiseaux des flux « Mer Caspienne - Est-Afrique », peuvent avoir échangé des souches hautement pathogènes et pourraient éventuellement en ramener. Le risque sera à cet égard peut-être plus élevé qu'il ne l'est dans l'immédiat - mais on peut se tromper. L'organisation de nos filières avicole est très spécifique et du type plutôt « entreprises ». Le risque est beaucoup plus difficilement maîtrisable sur les petits élevages d'éleveurs amateurs ou même d'éleveurs fermiers qui n'ont pas nécessairement la même sensibilisation sanitaire que les structures plus organisées. Les responsables professionnels sont en tout cas particulièrement vigilants. Tout foyer de peste aviaire, même s'il ne causait pas un drame sur le plan de la santé animale - nous avons les moyens de le maîtriser -, créerait à coup sûr un risque catastrophique en termes de marché. Il faut donc agir immédiatement à la moindre suspicion. Des plans d'urgence prévoyant un dispositif d'indemnisation sont établis au niveau national : il faut les diffuser largement, ainsi que l'a recommandé l'AFSSA dans un de ses derniers avis. Tout cela est parfaitement organisé au niveau des structures de l'État. Plus que de l'organisation de la filière, c'est du parfait emboîtement, au niveau du pays, des structures professionnelles et des structures d'État que dépendra la rapidité de la réaction. Depuis plusieurs années, des systèmes d'abattage rapide des foyers d'épizootie ont été mis au point et validés, avec des procédés de gazage en camions permettant une euthanasie rapide des volailles. M. Jean-Claude DESENCLOS : La question d'un renforcement des contrôles aux frontières a été soulevée. L'installation de caméras thermiques dans les aéroports permettrait certes de détecter les voyageurs ayant de la fièvre, mais seulement une très faible proportion des porteurs de virus de la grippe aviaire ou de grippes endémiques revenant de l'étranger : au mieux 20 % en fonction des périodes d'incubation. Autrement dit, ces outils très coûteux n'empêcheront pas les 80 % qui restent de développer la maladie une fois rentrés chez eux. Leur impact sera donc très limité. Ce ne sont pas eux, quoi qu'on ait dit, qui ont permis de gérer le SRAS, mais des mesures rigoureuses de détection et d'isolement des malades - avec, il est vrai, l'avantage d'une période d'incubation beaucoup plus longue. Pour l'instant, le virus en Asie du Sud-Est ne s'est pratiquement jamais transmis de malade à malade. Le dépistage des patients a d'abord pour but de leur donner au plus tôt un traitement efficace, sachant que la mortalité est très élevée, puis de les placer dans des conditions propres à éviter toute transmission du malade au personnel soignant. Il peut également arriver que l'on trouve, parmi ces patients, un virus en train d'évoluer ; il est très important de le détecter au plus vite. Au-delà de toutes ses imperfections, nous avons un système qui fonctionne et qui met en relation, de façon efficace et quotidienne, les services médicaux, les centres 15, les DDASS, l'InVS, et assure l'interface avec les deux centres nationaux de référence chargés de caractériser les virus. L'opération qui prend le plus de temps reste le transport des prélèvements. D'où l'importance d'une capacité de diagnostic performant, décentralisée dans les principaux laboratoires hospitaliers de France. Un effort s'impose à ce niveau dans l'organisation de la détection et de la surveillance en France. Rappelons enfin que contrairement à ce qui a pu être dit ce matin, le Conseil supérieur d'hygiène publique et la Direction générale de la santé ne recommandent pas dans le calendrier vaccinal la vaccination contre le pneumocoque pour les personnes âgées. La recommandation concerne les jeunes enfants avant deux ans pour le vaccin conjugué heptavalent, dans le but d'éviter les formes graves, invasives ou méningées et certains groupes à risques très ciblés pour le vaccin polyoside 23 valence. Mme Geneviève GAILLARD : J'aurais aimé que l'on réponde à ma question, assez fondamentale. M. le Président : Nous n'en sommes pas encore aux questions thérapeutiques, encore que les réponses soient relativement connues : la FAO a proposé d'intervenir... Mme Geneviève GAILLARD : Comment ? Avec quels moyens ? M. le Président : Les estimations vont de 200 millions à un milliard de dollars. La question qu'il faudra nous poser ne se limite pas seulement à l'aspect de solidarité, aussi légitime soit-il ; elle touche également à la capacité d'action dans les États qui ne veulent pas de la transparence politique. Et cette question-là n'est pas encore posée. Mme Geneviève GAILLARD : C'est bien pour cela que je la pose. M. le Président : Dans certains des États cités tout à l'heure, le problème ne se pose pas seulement en termes de moyens financiers ou techniques, mais également en termes politiques. Mme Catherine GENISSON : Et de devoir d'ingérence. Mme Geneviève GAILLARD : C'était inclus dans ma question. M. le Président : J'entends bien. Mais elle est tellement structurante que nous ne saurions y répondre aujourd'hui. Il me reste à remercier nos invités. Nous n'avons aucunement l'ambition d'avoir clos le sujet ; nous n'avons fait que l'introduire. Nous allons maintenant continuer à travailler et approfondir les points dont cette table ronde a révélé l'importance. Audition du professeur Didier HOUSSIN, Directeur général de la santé au ministère de la santé et des solidarités, Délégué interministériel à la lutte contre la grippe aviaire Présidence de M. Jean-Marie LE GUEN, Président M. le Président : Monsieur le professeur, nous vous remercions d'avoir répondu à notre invitation. Nommé directeur général de la santé le 30 mars dernier, puis délégué interministériel à la lutte contre la grippe aviaire le 30 août, vous êtes chargé de l'actualisation du plan de lutte contre une pandémie grippale, qui devrait entrer prochainement dans les faits. Nous ne vous interrogerons pas aujourd'hui sur la problématique générale du plan, puisque le ministre et vous-même viendrez nous l'exposer dans sa version actualisée d'ici à quelques semaines. Je voudrais vous interroger sur l'actualité en vous demandant ce qui, selon vous, va ou ne va pas dans la gestion de la crise ? Certains trouvent que l'on en fait trop, au risque de créer une psychose, d'autres s'inquiètent. Je souhaiterais que vous évoquiez aussi la problématique du stockage des matériels, lequel dépend bien évidemment de l'utilisation que l'on compte en faire. Pourriez-vous, enfin, préciser votre rôle de délégué interministériel ? Votre responsabilité s'étend-elle, au-delà de la santé humaine, à l'épizootie de grippe aviaire proprement dite ? Quelle autorité vous donne votre position de délégué interministériel par rapport aux autres ministères, dans la préparation comme dans l'application du plan de lutte contre la pandémie ? M. Didier HOUSSIN : J'organiserai mon exposé autour de trois aspects, en commençant par préciser mon rôle, puis en évoquant l'actualité dans ses dimensions les plus générales, avant d'en venir au problème plus précis du stockage. Le rôle du délégué interministériel à la lutte contre la grippe aviaire (DILGA) est très précisément défini dans le décret n° 2005-1057 du 30 août 2005 qui désigne un délégué interministériel à la lutte contre la grippe aviaire, placé auprès du Premier ministre et qui peut s'appuyer sur toute une série de ministères, dont celui auquel j'appartiens en tant que directeur général de la santé (DGS). J'ai d'abord un rôle de coordination interministérielle : ma tâche consiste à réunir des membres de différents ministères qui ont travaillé, travaillent ou travailleront sur la grippe aviaire et qui n'auraient peut-être pas pu facilement se rassembler, faute de chef de file bien défini. Ces personnes se retrouvent au cours d'une réunion hebdomadaire que j'ai baptisée « mardi-grippe », consacrée à un sujet donné : doctrine d'emploi des produits, DOM-TOM, coordination des groupes de travail « intérieur » et « santé », collectivités territoriales, coopération civile et militaire, entreprises, etc. Je tiens évidemment les comptes rendus de ces réunions à votre disposition. M. le Président : J'imagine que tout cela reste relativement confidentiel... M. Didier HOUSSIN : Cette activité de coordination interministérielle s'exerce également dans le cadre de la communication : j'anime un groupe qui, tous les mardis aussi, rassemble les responsables « communication » des différents ministères pour mettre en place un plan de formation, d'information et de sensibilisation le plus cohérent possible. J'ai aussi une mission de suivi des mesures décidées par les ministres dans le domaine tant de la santé que de l'agriculture. Mon rôle est de m'assurer de leur mise en œuvre et de leur bon état d'avancement. Si tel n'est pas le cas, il me revient évidemment d'alerter le Premier ministre. J'ai également un rôle d'évaluation en continu de la pertinence des mesures décidées. Il est indispensable de veiller en permanence à la bonne actualisation des scénarios et de rester au courant des évolutions des savoirs et des techniques, pour pouvoir corriger immédiatement le tir si besoin est. J'ai enfin une mission de cohérence générale au niveau international ou européen, où je me dois d'essayer de faire en sorte que les actions de la France soient en cohérence avec les initiatives prises dans les différentes instances et inversement. Il serait par exemple dramatique qu'un plan européen soit préparé en total décalage avec le plan français ou avec le plan OMS. Je me dois également de faire en sorte que les dispositions arrêtées en France soient en harmonie avec les mesures de lutte contre les épizooties prises au plan international. Sur le plan interne, s'agissant par exemple de la doctrine d'emploi des produits disponibles, je m'efforce d'éviter tout décalage entre les diverses catégories professionnelles concernées - professionnels de santé, pompiers, etc. - et je m'assure de la bonne déclinaison de ce qui est décidé au niveau des grandes entreprises, des collectivités territoriales et des associations. À ce titre, ma présence peut être nécessaire aux côtés des ministres : le ministre de la santé, mais également le ministre de l'agriculture - j'étais avec lui ce matin même pour recevoir des associations de consommateurs - ou le Premier ministre. Je suis en quelque sorte le garant d'une certaine unité d'action, mais si j'ai un pouvoir de suggestion ou d'incitation, je n'ai aucun pouvoir de décision ni d'autorité. Sur le plan pratique, toutes ces missions représentent une charge de travail importante que je dois mener parallèlement à mes fonctions de directeur général de la santé. Venons-en à l'actualité, en commençant par un bref historique des événements. On sait depuis longtemps - je l'ai moi-même toujours entendu, y compris comme étudiant - que la pandémie grippale est une des menaces sanitaires identifiables les plus importantes qui pèsent sur l'espèce humaine. Dès la fin des années 1990, la préoccupation « influenza aviaire - passage à l'homme - risque de pandémie grippale» est redevenue d'actualité à l'occasion d'une épizootie survenue en Asie, et a repris consistance à mesure que l'épizootie s'étendait et qu'apparaissaient les premiers cas humains. Mais le point de départ, à mes yeux, reste l'appel de l'OMS enjoignant les pays à se préparer. La France a réagi rapidement dès le début 2004 et s'est engagée, sous l'égide du SGDN27,. dans l'élaboration d'un plan d'ensemble, dont on peut peut-être regretter qu'il ait été classifié « défense ». Ce plan gouvernemental, qui distingue une phase pré-pandémique et une phase pandémique, a été mis en avril 2005 sur le site du ministère de la santé. Il prévoit toute une série de mesures que je ne détaillerai pas ici. Fin juin, un exercice a été organisé sous l'égide du SGDN, qui a permis de prendre conscience de la réalité du danger, mais également de détecter les points à améliorer dans le dispositif. Sont notamment apparues la nécessité d'une meilleure prise en compte des Français à l'étranger, et celle de construire un véritable volet « communication-formation-information », la classification « défense », par définition peu propice à la communication, ayant pu, à cet égard, constituer un certain handicap, car nous aurions pu communiquer tout au long de l'élaboration du plan. Un autre point a été souligné, la nécessité d'accentuer la coopération internationale. Un renforcement de la cohérence de l'action de l'État est enfin apparu indispensable : je suppose que ce point fait partie des motivations qui ont conduit à la désignation d'un délégué interministériel. Parallèlement a été engagé un processus d'acquisition de moyens de protection - j'y reviendrai à propos du stockage. Les événements récents ont été essentiellement marqués par l'actualisation du scénario dominant, selon lequel le risque tiendrait avant tout à l'arrivée en France d'une personne contaminée alors que vient de se déclencher une transmission interhumaine dans un pays d'Asie. Ce scénario reste à mon avis le numéro 1. L'actualisation du scénario a surtout découlé de l'observation d'un élargissement, en juillet-août, de la zone d'épizootie vers le Sud - l'Indonésie - et le Nord-Ouest - Chine, Mongolie, Sibérie, Kazakhstan, etc. Cette évolution a montré le caractère non maîtrisé des foyers d'épizootie, déjà très nombreux en Thaïlande et au Vietnam, et a conduit à s'interroger sur le mode de propagation. Deux hypothèses prédominaient fin août : celle du rôle d'éventuels oiseaux migrateurs, encore peu solide bien que l'on ait retrouvé des oiseaux sauvages malades, et celle liée aux transferts d'animaux dans le cadre d'opérations commerciales plus ou moins organisées, particulièrement le long du Transsibérien. À la suite de cet élargissement de la zone d'épizootie et à mesure que les Européens percevaient un rapprochement du phénomène, la situation est devenue plus complexe à gérer. Si la situation en termes de santé humaine est restée assez stable, avec quelques cas humains seulement dans les pays les plus touchés, la zone d'épizootie n'a cessé de s'élargir et, surtout, de nouveaux foyers sont apparus en Turquie, en Roumanie et en Croatie, qui ont donné beaucoup plus de poids à l'hypothèse d'un rôle des oiseaux migrateurs dans la propagation. La planète a, du reste, découvert la réalité de ces voies de migration, jusqu'alors seulement connues de quelques ornithologues et spécialistes du Museum d'histoire naturelle... Je suis pour ma part convaincu du rôle de ces oiseaux dans l'apparition des foyers détectés en Turquie et en Roumanie ; cette hypothèse serait encore renforcée si, par malheur, de nouveaux foyers apparaissaient en Afrique ou au Moyen-Orient. Les spécialistes s'accordent sur le fait que les oiseaux ne sont pas comme les nuages atomiques : ils franchissent les frontières... La possibilité ne peut donc être exclue de voir des oiseaux éventuellement porteurs du virus arriver jusqu'en Europe de l'Ouest, dans les zones humides de rassemblement de migrateurs. Dans un tel contexte, les questions de communication deviennent délicates à gérer, car plusieurs niveaux de préoccupations s'entrecroisent légitimement, à tel point qu'il devient difficile de présenter la situation de manière globale. Nous avons d'abord une préoccupation de santé humaine, qui porte sur une menace sanitaire considérable à terme - sans que nous puissions dire si le terme sera court, moyen ou long -, et à laquelle il est de la responsabilité des gouvernements de se préparer ; ce premier niveau de préoccupation, même s'il ne revêt pas une priorité immédiate pour les habitants de France, amène nécessairement à parler du sujet, ne serait-ce que parce qu'il faut débloquer des financements importants et que l'on ne peut le faire sans l'accord des représentants de la Nation. Dans le même temps, nous avons à faire à un problème de santé animale d'ores et déjà très préoccupant dans la mesure où, dans de nombreux pays, l'épizootie n'est pas maîtrisée et n'est d'ailleurs peut-être même plus maîtrisable. La mobilisation internationale à laquelle appellent la FAO, l'OIE et l'OMS impose bien évidemment d'en parler. Il reste que ce phénomène demeure extra-français, même si l'amalgame est vite fait entre la santé des animaux en Asie du Sud-Est et la santé des animaux en France. Je suis moins préoccupé par la survenue éventuelle d'un foyer d'épizootie en France, que nous devrions être en mesure de détecter et d'éradiquer rapidement, que par la capacité de l'homme à se débarrasser de foyers infectés en Asie, et plus encore, le cas échéant, en Afrique. Ce deuxième niveau de préoccupation « santé animale », évidemment connecté à la problématique « santé humaine », apparaît donc très international dans sa dimension ; s'il mérite, sur le plan national, que l'on prenne des mesures, il ne saurait susciter une inquiétude exagérée. Vient enfin un troisième niveau de préoccupation très immédiat et qui intéresse chacun d'entre nous : la sécurité alimentaire. La population se préoccupe légitimement de savoir si ce qu'elle mange est convenable, ce qui l'amène à entrer dans des considérations où le rationnel n'a pas toujours sa place. Très rapidement, les Français se sont interrogés sur la sécurité de la consommation des volailles et des œufs et il est difficile dans pareilles circonstances de leur tenir un discours parfaitement convaincant. Un discours scientifique aura toujours tendance à dire qu'il n'y a pas de risques, mais qu'il vaut mieux prendre telle ou telle précaution, ce qui, dans un contexte d'inquiétude générale sur le plan de la santé humaine comme de la santé animale, a tendance à aggraver les doutes et donc à influer sur la consommation de volailles. Certains signes permettent d'espérer que ce phénomène restera transitoire, mais la situation demeure très fragile : si, d'aventure, un nouveau foyer d'épizootie est découvert un peu plus près de chez nous et a fortiori en France, il sera difficile de maîtriser la peur, qui se répercutera sur la consommation. Le ministre de l'agriculture a rencontré à ce propos les associations de consommateurs ce matin même. La communication apparaît donc bien comme le sujet aujourd'hui le plus difficile, du fait de la grande perméabilité entre les thématiques comme entre les zones géographiques concernées. Ajoutons que, bien souvent, la presse est au courant avant les pouvoirs publics de ce qui se passe à l'étranger, en Turquie ou ailleurs. J'en viens au troisième sujet : le stockage. S'agissant du stockage des produits, sont stockés, pour ce qui concerne la grippe aviaire, premièrement, des médicaments pour soigner des malades, que la France a achetés en grandes quantités et qu'elle achètera en plus grandes quantités encore. Il s'agit en l'occurrence d'une antineuraminidase, sous la forme de l'oseltamivir, qui a prouvé son efficacité, en gélules et en vrac. Le but est d'avoir stocké à la fin de l'année, dans une première étape, près de 14 millions de traitements. M. le Président : Ce qui veut dire 140 millions de gélules. M. Didier HOUSSIN : En effet. Un traitement correspond en gros à dix gélules, à raison de deux gélules par jour pendant cinq jours. Nous aurons à notre disposition à la fin de l'année environ 14 millions de traitements d'oseltamivir, le Tamiflu, que l'industriel nous livre pour moitié sous forme de gélules, pour moitié sous forme de poudre conditionnée en bidons. Par ailleurs, nous avons commandé 200 000 traitements d'une autre antineuraminidase, le Relenza,dont l'efficacité est voisine, mais qui présente l'inconvénient d'avoir un mode d'administration loco-régional - c'est un spray - et un conditionnement en petites boîtes, peu propice au stockage. Il est prévu d'accroître les quantités stockées de façon à pouvoir traiter tous les malades, y compris dans l'estimation la plus forte du nombre de malades en cas de pandémie. Les antineuraminidases seront distribués gratuitement aux personnes malades, c'est-à-dire à ceux qui présenteront les symptômes de la grippe. Nous évoquerons plus tard les dispositifs d'acheminement et de distribution, qui relèvent d'une autre problématique. M. le Président : C'est un point majeur, mais nous y reviendrons lorsque nous examinerons le plan de pandémie. Restons-en pour l'instant au stockage. M. Didier HOUSSIN : Ces produits sont actuellement stockés dans des sites de l'armée. Deuxième produit stocké, les masques de protection individuelle dits FFP2 - ce sigle correspond à une norme de filtration de particules solides et liquides. Nous en avons acquis d'ores et déjà environ 50 millions, à travers un marché UGAP28, livrés ou en cours de livraison, et stockés dans les grands hôpitaux. Une deuxième livraison de 68 millions de masques est prévue, pour lesquels la question du stockage n'est pas encore résolue. Des contacts ont été pris par le haut fonctionnaire de défense, M. Gérard Dumont, avec les ministères de l'Intérieur et de la Défense, pour trouver des sites de stockage. Enfin, une troisième commande en cours, via l'UGAP, de 80 millions de masques permettra d'atteindre l'objectif prévu : plus de 200 millions de masques FFP2 stockés d'ici la mi-2006. Ces masques sont pour l'instant achetés auprès de vendeurs asiatiques en attendant qu'un outil de production français se mette en place. M. le Président : Précisons que l'on utilise quatre masques par jour : autrement dit, ces 200 millions de masques correspondent à 50 millions de jours-masques. M. Didier HOUSSIN : En effet. Ce contingent, acheté par le ministère de la santé, sera prioritairement destiné aux professionnels de santé. Mais il est bien prévu - d'où la mise en place d'une capacité de production nationale courant 2006 - que d'autres professionnels en contact étroit et fréquent avec le public puissent progressivement s'en doter. M. le Président : J'ai entendu dire qu'on allait installer des usines de production de masques. M. Didier HOUSSIN : Je le confirme. Pour cela, les industriels doivent se doter de machines particulières capables de travailler le non-tissé. Plusieurs fabricants, comme Maco Pharma ou Bacou-Dalloz, se sont manifestés. Tous ne seront pas opérationnels au tout début 2006... M. Marc LE FUR : Certains le sont déjà. J'ai, dans ma circonscription, une usine qui travaille en trois huit, sept jours sur sept. M. Didier HOUSSIN : En effet, mais les quantités produites sont encore loin d'être à la hauteur des besoins. M. le Rapporteur : Quel est le coût unitaire d'un masque ? M. Didier HOUSSIN : Le prix arrêté dans les accords passés avec les industriels est de l'ordre de 35 centimes d'euro le masque. M. Claude LETEURTRE : Quelle est la durée de vie d'un masque ? M. le Président : Trois heures. M. Didier HOUSSIN : On admet qu'un masque perd ses qualités de filtration en quelques heures. La question de l'efficacité est assez délicate. Ces masques ont une réelle efficacité dans la filtration des gouttelettes liquidiennes ; mais le virus peut se trouver ailleurs. Si vous vous léchez les doigts juste après avoir serré la main d'un malade, le masque ne vous servira à rien... Il y a des mesures et des comportements d'hygiène à adopter. Nous devrons, dans les mois à venir, nous faire une idée plus précise de l'efficacité de ces masques. Un travail en cours de publication a d'ores et déjà montré que le port de masques à Hong Kong durant l'épidémie de SRAS a entraîné une diminution significative du nombre d'affections respiratoires. Mais nos données sont encore insuffisantes. M. Pierre HELLIER : S'agissait-il de ce type de masques ? M. Didier HOUSSIN : Il s'agissait de masques plus rudimentaires. J'aurais tendance à penser que les FFP2 conféreront un niveau de protection nettement plus important qu'un simple masque en tissu. M. Pierre HELLIER : Mais ils sont plus difficiles à supporter... M. Didier HOUSSIN : C'est l'envers de la médaille. On s'y fait... M. le Président : On peut évidemment choisir de mourir... M. Didier HOUSSIN : La question du stockage des futurs lots de masques achetés par les administrations, l'intérieur, la défense, etc., n'est pas encore résolue. Mais peut-être sera-t-elle plus facilement réglée par les ministères de l'intérieur et de la défense que par le ministère de la santé. M. le Président : Ce n'est pas vous qui centralisez les achats pour les différents ministères ? M. Didier HOUSSIN : La délégation interministérielle n'est pas le lieu de rassemblement de toutes les commandes. Le dossier « masques » a été confié au haut fonctionnaire de défense du ministère de la santé. Une réunion est d'ailleurs prévue cette semaine pour faire un point sur la commande de masques par les pouvoirs publics, et surtout pour faire en sorte qu'ils soient payés au juste prix. D'autres structures, les grandes entreprises notamment, seront vraisemblablement amenées à en acheter et nous n'avons aucune maîtrise sur la façon dont ces accords seront conclus avec les industriels. M. le Président : L'installation d'usines résulte-t-elle d'un simple accord verbal avec l'industriel ou a-t-elle fait l'objet d'un contrat en bonne et due forme, avec éventuellement un pré-achat ou une subvention à l'achat de matériels ? M. le Rapporteur : Y a-t-il un cahier des charges spécifiant comment les masques doivent être fabriqués ? M. Didier HOUSSIN : Le masque FFP2 répond à des normes précises spécifiées dans le cahier des charges que le fabricant est tenu de respecter. Pour ce qui est des accords avec les industriels, un protocole d'accord définit les conditions dans lesquelles l'État et les industriels peuvent être amenés à s'entendre. M. le Président : Nous recevrons dans quinze jours le responsable de cette question, M. Dumont, le haut fonctionnaire de défense. M. Marc LE FUR : L'usine Bacou-Dalloz, située dans ma circonscription, a déjà produit 45 millions de masques. Mais cette unité, la principale en France et en Europe, est arrivée à saturation de sa capacité de production. Or, la création de nouvelles lignes de production pose non seulement un problème de délai de fabrication, mais également un problème économique à plus long terme dans la mesure où d'autres entreprises mettront, elles aussi, de nouvelles lignes de production en service. L'enjeu, pour les industriels, est de définir un modèle de production valable pour plusieurs mois. Le problème, avant celui du stockage, est bien celui de la garantie d'une production a minima sur notre territoire. M. le Président : Nous le retrouverons sur tous les sujets : nous passons visiblement d'une économie de marché à une économie d'arsenal. M. Didier HOUSSIN : En effet. À côté des masques FFP2, il y a les masques dits antiprojections ou masques chirurgicaux, destinés à éviter que le malade ne projette des particules contaminantes. Ces masques, relativement plus simples à fabriquer, sont également plus disponibles. Des quantités importantes seront achetées : il est prévu d'acquérir, dans un premier temps, 250 millions de masques chirurgicaux à faire porter, à raison d'un masque toutes les quatre ou cinq heures, aux malades en contact avec leur entourage familial. La question du stockage n'a pas encore été abordée, dans la mesure où nous n'en sommes pas encore au stade de la livraison. Troisième type de produit, les vaccins. Il y a déjà plusieurs mois, la France a lancé un appel d'offres européen et passé marché avec Chiron et Sanofi-Pasteur pour un total de 2,5 millions de doses de vaccins H5N1, c'est-à-dire contre le virus actuellement en circulation. M. le Président : 2,5 millions de doses ou de traitements ? M. Didier HOUSSIN : De doses, avec évidemment une incertitude sur le nombre de doses qui seront nécessaires pour un traitement. M. le Président : Dans la mesure où nous sommes « vierges » face au virus, nous risquons d'avoir besoin de deux vaccinations successives pour acquérir une immunité satisfaisante. Mais certains fabricants soutiennent qu'en mettant un adjuvant et une dose plus forte, une seule injection pourrait suffire. À la différence du Tamiflu, où il vaut mieux parler en doses et non en traitements, il est préférable, s'agissant des vaccins, de parler en traitements plutôt qu'en doses. M. Didier HOUSSIN : La stratégie d'utilisation de ce vaccin n'est pas encore définie avec une grande précision. Ce marché était avant tout destiné à mobiliser l'industrie et à l'amener à démontrer sa capacité à produire rapidement un vaccin d'un type nouveau, puisque dirigé contre un virus très différent de celui qui circule actuellement dans l'espèce humaine. On peut toutefois prévoir d'ores et déjà des utilisations possibles : on pourrait ainsi s'en servir en cas d'épizootie aviaire pour conférer une protection à certains professionnels exposés - la question reste ouverte. Enfin, dans l'hypothèse où apparaîtrait un virus pandémique génétiquement peu différent de l'actuel H5N1, peut-être serait-il possible d'utiliser ces premiers vaccins afin de protéger les populations prioritaires avant même qu'un vaccin spécifique du virus pandémique soit mis au point. Mais pour l'heure, si la livraison du vaccin aura bien lieu début 2006, les conditions de son utilisation ne sont pas encore réglées, compte tenu des incertitudes scientifiques qui demeurent. Un deuxième vaccin a été commandé, dans les conditions particulières dites de sleeping contract - les fabricants ne livreront le vaccin que le jour où, le virus ayant été isolé, le vaccin pourra être produit -, à Chiron pour 12 millions de vaccins et Sanofi-Pasteur pour 28 millions de vaccins, qui ne seront évidemment disponibles et payés que le jour où ils pourront commencer à être produits. Ce type de contrat n'est pas sans susciter une certaine hésitation chez les industriels - vous avez vu récemment leur réaction face au gouvernement britannique - qui hésitent à investir pour un vaccin dont rien ne dit que l'on pourra l'utiliser dans les années à venir. Cette question n'est évidemment pas tranchée, mais elle est très importante et se pose à l'échelle internationale. Sont enfin concernés des produits tels que les aiguilles et les seringues, les antibiotiques, les vaccins antipneumocoques, les respirateurs ou encore les caméras thermiques, mais ceux-ci ne posent pas les mêmes problèmes de stockage. M. le Rapporteur : Notre système de veille actuel nous garantit-il l'alerte la plus précoce ? L'outil administratif dont vous disposez est-il suffisant en termes de moyens financiers et humains ? La coordination entre les systèmes vétérinaires et sanitaires d'alerte est-elle satisfaisante ? Comment une collectivité locale sera-t-elle informée de l'alerte ? Les maires et les présidents de conseils généraux ne devraient-il pas être parmi les premiers à être informés ? Qui gérera la communication en cas de crise, en direction tant des collectivités locales que de l'éducation nationale, des hôpitaux et des médecins ? M. le Président : Cette dernière question touche davantage au plan de pandémie qui nous sera présenté en temps utile par le ministre de la santé. M. le Rapporteur : Il reste que, en tant que maire, j'ai reçu voilà trois jours une lettre du préfet m'enjoignant d'interdire la vente de volailles vivantes sur mon marché... Il m'a fallu saisir la régie des marchés, vérifier sur place et apaiser les craintes. M. le Président : Si la sphère médico-administrative et médico-scientifique communique à peu près correctement, je crois percevoir de gros dysfonctionnements de communication dans le domaine de la santé animale. Au niveau européen, force est d'admettre le dysfonctionnement du système, avec l'alerte sur la consommation d'œufs crus... Mais au niveau français également, l'Agence française de sécurité sanitaire des aliments (AFSSA) semble avoir du mal à prendre certaines décisions ; le ministre est même revenu sur certaines de ses recommandations en matière de confinement d'animaux. Non seulement ces dysfonctionnements posent problème pour l'agriculture et l'alimentation, mais ils augurent mal du reste. N'envisagez-vous pas de reprendre en main la problématique de la communication sur la santé animale, sachant que nous n'avons connu jusqu'à présent aucun dérapage, hormis une petite difficulté à La Réunion, pour ce qui concerne la santé humaine ? M. Didier HOUSSIN : Si un foyer d'épizootie ou a fortiori des cas humains survenaient en France, nous serions rapidement alertés. La difficulté portera avant tout sur la gestion des cas suspects et finalement négatifs, mais qui n'en marqueront pas moins les esprits. Le risque de passer à côté d'un cas avéré n'est évidemment pas totalement nul mais, en France comme en Europe, les esprits sont en alerte et nous ne manquons pas de capacités de repérage, tant du côté de la santé animale que de celui de la santé humaine. Beaucoup plus délicate est la situation dans les pays où, à l'évidence, les conditions sanitaires humaines et animales sont plus difficilement gérables compte tenu notamment des conditions de développement : la découverte, avec un grand retard, d'un important foyer d'épizootie aviaire, jusque-là passé inaperçu, dans un pays africain, ne surprendrait qu'à moitié ; il pourrait en être de même au Moyen-Orient ou en Asie. Si certains pays asiatiques, désormais échaudés, se sont employés à mieux organiser leur système d'alerte, des interrogations demeurent pour ce qui est de la Chine ou de l'Indonésie, qu'il s'agisse de la propension des éleveurs à signaler un cas suspect aux autorités compétentes ou de la compétence desdites autorités... Le renforcement des capacités de surveillance et de détection précoce des cas animaux comme des cas humains est à l'évidence un des principaux enjeux auxquels sont confrontées les grandes organisations internationales. L'outil administratif, à commencer par celui de la délégation, est-il suffisant ? Aussitôt nommé, j'ai demandé au Premier ministre de pouvoir disposer d'une petite équipe, plus appropriée qu'une troupe imposante. J'ai très rapidement obtenu la mise à disposition d'un administrateur civil du ministère de l'intérieur et d'un représentant du ministère des affaires étrangères, qui sera très prochainement remplacé par un ambassadeur. Une vétérinaire avait également aussitôt été mise à ma disposition par le ministère de l'agriculture ; elle a depuis pris d'autres fonctions et son remplaçant vient d'être recruté. Enfin, le ministère de la santé a mis à ma disposition un IGAS29 qui est mon adjoint. Au total, l'équipe de la DILGA se compose de cinq personnes, plus une secrétaire en cours de recrutement. Je m'interroge toutefois sur la nécessité de la renforcer dans deux domaines. Il nous faudra d'abord établir un contact plus ferme et plus net avec la Défense ; je suis actuellement en pourparlers pour obtenir un appui de ce côté. Un contact avec le ministère du travail nous serait également très utile pour toutes les questions liées à la sécurité au travail, aux réquisitions, retraits, relations avec les syndicats, etc. Nous en avons récemment évoqué la possibilité avec le directeur de cabinet du ministre. Mais je préfère en rester à une petite équipe, quitte à l'étayer ou, à l'inverse, la réduire au vu des besoins. S'agissant de la coordination entre santé animale et santé humaine, les relations, très étroites, avec le ministère de l'agriculture ne me semblent pas faire de difficultés. Pour ce qui est de la communication, en revanche, la situation est plus délicate du fait de la confusion qui est faite entre les différentes données du problème - sécurité et hygiène alimentaire, santé animale ou santé humaine - et des télescopages entre les problématiques d'actualité, de court terme et de long terme. Et cela tient non pas à d'éventuelles difficultés d'articulation avec le ministère de l'agriculture, mais bien au sujet lui-même. Le Premier ministre m'a demandé de communiquer autant que possible ; je le fais autant que je peux, en articulation étroite avec les ministres de la santé et de l'agriculture, sous forme non pas d'annonces, mais plutôt d'une communication explicative, « à plat ». J'ai à cet égard demandé au service d'information du Gouvernement de m'aider. Il le fait. Au moment où j'ai été désigné, la mise à jour du plan de lutte contre une pandémie était déjà enclenchée, à la suite de l'exercice du 30 juin. J'ai souhaité que le SGDN continue son travail de préparation de la révision du plan ; je ne me sentais pas en mesure de prendre le relais alors qu'il s'était jusque-là très bien acquitté de cette tâche. La première partie de la mise à jour est terminée, nous en sommes aux annexes ; le plan réactualisé devrait être rendu public d'ici à une semaine, sinon quinze jours. L'essentiel du travail a été réalisé, et fort bien, par le SGDN et les ministères concernés. Je ne suis intervenu qu'en appui. Vous avez évoqué le problème des collectivités locales. J'en viens à la question de la problématique de la déclinaison de ce plan dans les territoires. Sitôt qu'il sera rendu public, une circulaire du ministère de l'intérieur sera envoyée aux préfets et une autre aux maires. Les préfets notamment sont demandeurs ; il n'est pas surprenant qu'ils aient commencé à se manifester. Les étapes d'acquisition des produits et de programmation stratégique feront donc place à une étape d'affinement des organisations, d'exercices et d'entraînements. Une réunion « mardi-grippe » sera très prochainement consacrée aux collectivités territoriales, avec l'association des maires de France, l'association des départements et l'association des régions afin d'aborder un sujet jusque-là laissé de côté - non sans raison : il fallait d'abord déterminer ce qu'il y avait à distribuer, donc prendre les choses dans l'ordre. M. le Président : Pourquoi le ministre a-t-il, peut-être fort légitimement, pris une position différente de celle des experts de l'AFSSA ? Le gouvernement français a-t-il réagi vis-à-vis de la Commission de Bruxelles et de l'AESA30 en les appelant à une communication un peu plus rationnelle ? M. Didier HOUSSIN : La communication de l'AESA, jugée maladroite, a eu pour effet, telle qu'elle a été rapportée par les médias en tout cas, de compliquer une situation déjà complexe. Cette difficulté aurait pu être évitée, mais cela dépassait notre capacité d'action. La question de la position française en matière de protection des élevages vis-à-vis des oiseaux migrateurs devra être posée au ministre de l'agriculture. Mais mon avis personnel est que, compte tenu de l'inquiétude de la population française, et conscient qu'il ne parviendrait pas à renverser l'orientation prise au niveau européen, le gouvernement français a préféré s'associer à l'orientation défendue par ses partenaires, favorables au confinement des élevages, plutôt que de prendre le risque de se retrouver en porte-à-faux ; il a cherché à préserver une cohérence à l'échelon européen. M. le Président. : Mais le Gouvernement français est-il intervenu auprès de l'AESA pour lui demander de faire attention ? Une protestation, pour le moins, s'imposait... M. Didier HOUSSIN : Je vérifierai. Si cela n'a pas été fait, cela pourrait ou devrait l'être... M. le Président : Le problème était que cette communication n'était scientifiquement pas fondée et extraordinairement maladroite. Elle a jeté un trouble profond dans le monde de la santé animale. M. Didier HOUSSIN : Le problème ne me semble pas tellement se poser au niveau de la santé animale. Si les chasseurs se sont insurgés contre l'interdiction d'utiliser des « appelants », le monde agricole, principalement concerné, s'est comporté de façon très positive. Plus problématiques ont été les réactions des consommateurs et l'inquiétude sur le plan de la sécurité alimentaire. C'est là que la communication de l'AESA a été maladroite, ou mal traduite, ou mal comprise. Associer à un discours sur le risque alimentaire lié à la grippe aviaire, pour l'instant totalement nul en Europe, des considérations générales d'hygiène alimentaire autour de la cuisson du poulet ou la crudité des œufs - tout un chacun sait qu'il vaut mieux manger le poulet cuit que cru en raison des salmonelles, et éviter de laisser traîner trop longtemps à température ambiante une mayonnaise ou une mousse au chocolat - a été maladroit. M. le Rapporteur : Cela a été plus que maladroit : catastrophique ! M. le Président : Reconnaissons, en sens inverse, que l'argument selon lequel la consommation d'un poulet atteint de grippe aviaire est sans conséquence, le virus ne franchissant pas la barrière intestinale, est assez difficile à comprendre pour nos concitoyens... M. Didier HOUSSIN : Je suis d'accord. M. Claude LETEURTRE : Les mesures de confinement ont-elles été décidées pour des raisons de communication au plan européen, autrement dit pour rassurer, ou pour des motifs scientifiques ? L'impact économique n'est pas neutre... M. Pierre HELLIER : Cette affaire de confinement est particulièrement désolante pour les poulets de Bresse : on a commencé par ordonner aux éleveurs de les enfermer avant de les autoriser à les ressortir entre quatorze et dix-sept heures ! M. Claude LETEURTRE : Les éleveurs de canards assurent qu'ils ne pourront pas faire de foie gras s'ils confinent leurs animaux. M. Pierre HELLIER : Le problème est qu'ils peuvent être contaminés par des oiseaux migrateurs... M. Claude LETEURTRE : Ceux qui sont infectés en Europe de l'Est descendent en Afrique, pas en France. M. le Président : Rien n'est moins sûr. M. Didier HOUSSIN : La décision du Gouvernement sur le confinement a été prise dans un souci de cohérence européenne, mais pas seulement : l'avis de l'AFSSA faisait état d'un risque négligeable, mais non d'un risque nul. Par exemple, on sait que certains oiseaux comme la grive gitorne ou le vanneau ont la capacité de migrer d'Est en Ouest vers les zones humides d'Irlande, de Grande-Bretagne et de France. Dès lors que l'on admettait l'hypothèse de migrateurs porteurs et vecteurs de propagation du virus, l'idée d'un contact possible entre un oiseau migrateur malade et une volaille française n'avait rien de déraisonnable. D'autres pays européens ayant suivi ce raisonnement et annoncé qu'ils prendraient des mesures, la France, pressentant qu'elle ne pourrait renverser cette tendance, a préféré s'y associer, mais d'une manière assez minorante : bon nombre de nos élevages sont restés à l'air libre. M. Marc LE FUR : Il reste que les mesures ainsi prises rassurent peut-être, mais en même temps inquiètent, d'autant que se conjuguent, vous-même l'avez souligné, une exigence immédiate face au risque d'épizootie et la crainte plus lointaine d'une pandémie. À cet égard, l'exercice de simulation prévu demain en Bretagne, et qui a été décidé en mai-juin, autrement dit avant cet emballement médiatique, ne devient-il pas depuis très compliqué à gérer ? Comment faire en sorte que les populations ne soient pas exagérément affolées ? M. Didier HOUSSIN : Vous mettez le doigt sur la difficulté du sujet : comment concilier une stratégie de long terme de la plus haute importance pour la santé publique et la santé animale à l'échelle planétaire, dont la mise en œuvre génère nécessairement un certain degré d'inquiétude, et la gestion de l'actualité et du très court terme pour laquelle on aimerait ne pas susciter d'inquiétude exagérée ? Communiquer là-dessus n'est effectivement pas chose facile. Mais l'exercice de simulation de demain a été programmé pour que nous en tirions des leçons. Mieux vaut, me semble-t-il, en souligner les effets positifs dans nos actions de communication locales et nationales, plutôt que de l'annuler. M. Marc LE FUR : Ce serait pire. M. Didier HOUSSIN : En effet, ce serait dangereux. Toute la difficulté du sujet tient effectivement à ce télescopage permanent entre le long terme et le court terme. M. le Président : Ce n'est pas vous qui gérez cet exercice ? M. Didier HOUSSIN : J'y suis associé. Mais même si le ministère de l'agriculture, le ministère de la santé et le délégué apportent un appui en termes d'expertise et de compétences, y compris sur le plan de la communication, cela reste un exercice local, sous la responsabilité du préfet. M. Marc LE FUR : Et il s'agit bien d'un exercice vétérinaire. M. Didier HOUSSIN : Il avait été prévu à l'origine de faire émerger un cas humain pour tester l'enchaînement des processus ; nous avons préféré y renoncer pour ne pas mettre la barre trop haut en matière de communication. M. Alain CLAEYS : La sécurité alimentaire vient incontestablement au premier rang dans la hiérarchie des peurs de nos concitoyens. Elle appelle, comme vous l'avez suggéré, une communication non pas globale, mais de proximité. Les contacts que vous établirez avec les préfets et les associations d'élus seront à mes yeux indispensables. Si vous parvenez à gagner cette première partie, les autres messages passeront plus facilement. M. Pierre HELLIER : Si je comprends bien, l'exercice de demain vous échappe ou vous a déjà échappé quelque peu... M. Didier HOUSSIN : Non. Parmi tous les exercices programmés depuis déjà assez longtemps, il était prévu une simulation sur le volet « sécurité et santé animale » en Bretagne. C'était une excellente idée et il nous appartiendra d'en tirer toutes les leçons en matière de rapidité de signalement, de mesures vétérinaires, etc. Le délégué interministériel le soutient, mais c'est une décision qui relève en premier lieu du préfet, et du ministre de l'agriculture. Nous avons seulement apporté notre contribution technique. M. Pierre HELLIER : Je ne juge pas de son bien-fondé ; je suis seulement étonné que tout ne passe pas par vous. M. Didier HOUSSIN : J'ai demandé une réunion de travail spécifique sur la programmation des exercices de l'année prochaine, en particulier sur ceux qui me paraissent indispensables, c'est-à-dire ceux concernant le fonctionnement des établissements de santé, la prise en charge des personnes à domicile, l'acheminement des produits de protection, et la continuité de la vie du pays. Une fois que j'aurai fixé les orientations générales, j'espère que tant les préfets que les élus se saisiront du sujet et organiseront les opérations au niveau local. M. Pierre HELLIER : Il faut tout de même une coordination nationale pour éviter de voir fleurir les initiatives en tous genres. M. le Président : J'imagine que le préfet ne fait pas cela sans l'autorisation de ses ministres... Je voudrais vous rassurer en vous annonçant que « seulement » 70 journalistes se sont inscrits pour assister à l'exercice qui se déroulera en Bretagne demain et après-demain ! Nos collègues Le Fur et Jacquat y assisteront, mais il est toujours possible à d'autres de s'inscrire. Mme Paulette GUINCHARD : La confiance sera un élément déterminant de la réussite du plan, qu'il s'agisse de la livraison de matériels ou de la communication. Quelles responsabilités entendez-vous laisser aux collectivités locales ? Je suis inondée de demandes de maires. M. le Président : Nous pourrions aborder cette question plus tard. Nous avons prévu que le délégué interministériel ou le ministre reviendrait devant nous dès que le plan actualisé sortira. Nous pourrons alors le passer au tamis. Venons-en aux questions sur le stockage. Le problème du stockage pose, en amont, la question de la production industrielle et, en aval, celle de l'utilisation des moyens. Je me concentrerai sur le seul Tamiflu - même s'il faudrait nous indiquer où vous en êtes en ce qui concerne les antibiotiques destinés à traiter les surinfections bactériennes, le vaccin Pneumo 23, les ventilateurs, les bouteilles d'oxygène, etc. S'agissant du Tamiflu, votre présentation nous pose problème sur le plan tant quantitatif que qualitatif. Vous nous parlez de 14 millions de traitements et sous-entendez qu'il sera utilisé en curatif. Or on peut craindre que la pandémie ne survienne en même temps qu'une grippe « régulière » ; s'y ajouteront les syndromes du stress, qui se traduiront par une prolifération de signes cliniques de maladie sans aucun substrat infectieux. Lors de l'affaire de l'anthrax aux États-Unis, le rapport entre ceux qui ont réellement contracté l'anthrax et ceux qui ont présenté des signes cliniques était de un à sept ! S'il est possible de pratiquer un test sur le premier voyageur suspect qui débarquera à l'aéroport, il sera parfaitement impossible de procéder à un diagnostic biologique de masse sur 50 000, 100 000 ou 500 000 cas, pour vérifier s'il s'agit réellement de la grippe pandémique. Or le Tamiflu n'est efficace que dans les 48 heures, plus vraisemblablement dans les 36, voire les 24 premières heures de l'infection. Comment, dès lors, peut-on raisonner en termes de traitement de masse ? Une autre stratégie d'emploi est mise en avant : elle consisterait à traiter à titre prophylactique les soignants et les personnels « utiles », ce qui exige des quantités de Tamiflu largement supérieures à celles qui sont aujourd'hui stockées : à raison d'une dose par personne et par jour pour 4 millions de personnes à protéger, selon les estimations du plan - médecins et infirmières, mais également policiers, techniciens des centrales nucléaires, grands malades, immuno-déprimés, etc. -, cela fait quatre millions de comprimés par jour ! Ne sommes-nous pas très en-dessous en termes de stocks disponibles ? Enfin, que savez-vous du processus de production du Tamiflu ? Les représentants du laboratoire Roche, que j'avais reçus dans le cadre de la préparation de mon rapport budgétaire pour la commission des affaires sociales, m'ont expliqué que personne d'autre qu'eux n'était capable, en tout cas à court terme, de fabriquer cette molécule qui exige un savoir-faire énorme et des usines extraordinairement compliquées. Ce discours est-il exact ou non ? M. le Rapporteur : Ne faudrait-il pas parler du rôle des médecins de base et des infirmières pour l'aspect « diagnostic », afin de distinguer les cas de grippe réelle des fausses grippes ? Les généralistes et les infirmières jouent un rôle de premier plan en matière de prévention. Comment vont-ils communiquer ? M. Didier HOUSSIN : Le stockage de 14 millions de traitements ne permet effectivement de prendre en charge qu'une population de malades légèrement en dessous du haut de la fourchette estimative arrêtée par l'Institut national de veille sanitaire (InVS). Aussi le ministre de la santé est très déterminé - et suivi, me semble-t-il - à faire en sorte que ce stock ne se limite pas à 14 millions de traitement et à faire acquérir des quantités plus importantes de Tamiflu comme de Relenza afin d'être sûr de traiter tous les malades - 21 millions au maximum, selon les estimations de l'InVS - tout en assurant un certain degré de protection aux professionnels particulièrement exposés. Cela dit, les capacités mondiales de production ne permettent pas d'espérer une livraison de ces quantités supplémentaires avant le courant 2006, sinon l'année 2007, même si la France a eu le mérite de se positionner très tôt. Il faut espérer que le processus, s'il vient à se déclencher, n'aille pas trop vite. Le processus de production de l'oseltamivir est compliqué et comporte de très nombreuses étapes, jusqu'à un problème de granulation alcoolique dans des conditions peu faciles. La pharmacie centrale des armées, dont il faut d'ailleurs souligner le grand mérite, semble être capable de prendre en charge la dernière phase délicate de la granulation, ce qui nous permet d'acheter de la poudre en vrac. En revanche, une phase de la transformation fait appel à une chimie difficile et explosive, qui ne peut être mise en œuvre que sur deux ou trois sites industriels dans le monde. Lorsque Roche dit que c'est un processus complexe dont certaines phases sont très délicates et prennent du temps, cela ne semble pas faux. M. le Président : Justement : avez-vous les moyens de le vérifier ? M. Didier HOUSSIN : J'ai demandé à l'AFSSAPS s'il était possible de fabriquer ce produit d'une autre façon, soit par le biais d'une licence secondaire concédée par Roche, soit par un système de générique. Les informations que j'ai reçues confirment qu'il est difficile de produire ce médicament. Cela dit, si vraiment nous étions décidés à essayer de le faire, soit en fabriquant un générique, soit en poussant des industriels à devenir des sous-traitants pour Roche dans le cadre d'une licence secondaire, il faudrait analyser le processus de manière plus approfondie. Pour l'instant, nous nous sommes plutôt concentrés sur l'acquisition d'oseltamivir, considérant que nous serions en mesure d'en accumuler une quantité importante, ce qui n'est pas le cas pour de nombreux pays. M. Jean-Michel BOUCHERON : A-t-on mesuré les coûts financiers et les contraintes juridiques que représenterait le lancement de chaînes de production secondaires, au-delà de l'accord passé avec le laboratoire ? M. Didier HOUSSIN : La loi de santé publique offre au ministre de la santé la possibilité, en situation d'urgence, de demander des « licences d'office ». La question est de savoir si le stockage de produits en prévision d'un phénomène pandémique peut être, sur le plan juridique, assimilé à une situation d'urgence. C'est le même problème que pour les accords ADPIC31 de l'OMC. On peut estimer qu'il y a une situation d'urgence... M. le Président : Surtout s'il faut huit mois pour fabriquer le médicament... M. Didier HOUSSIN : Si donc cette analyse prévaut, nous disposons de l'instrument juridique qui nous permet de le faire. Reste la question de la faisabilité technique. A priori, cela semble difficile, mais sûrement pas impossible. M. le Président : Il y a trois semaines, les représentants de Roche m'assuraient qu'ils fourniraient, qu'ils feraient ce qu'ils pourraient, qu'ils ouvriraient de nouvelles chaînes de production, etc. Dont acte. Trois semaines plus tard, les Indiens annoncent qu'ils vont fabriquer un générique. Réaction immédiate de Roche, qui se déclare prêt à accorder des brevets secondaires. Nous ne pouvons pas travailler en nous fiant à la seule bonne foi des laboratoires Roche. Ce qui est possible en Inde, en dépit de toutes les difficultés que l'on imagine, doit l'être tout autant au Brésil, en Israël, en France, en Grande-Bretagne, en Allemagne ou aux États-Unis ! On peut se féliciter que le gouvernement français soit plutôt leader dans l'achat d'oseltamivir, mais reconnaissons que, ce faisant, nous privons les autres... Cela peut poser problème lorsque, dans le même temps, on tient un discours de solidarité internationale. M. Didier HOUSSIN : Vous avez raison. Du reste, les deux approches ne sont pas exclusives l'une de l'autre : il faut poursuivre la politique d'achat, tout en explorant les possibilités d'accroître notablement les possibilités de fabrication grâce à l'entrée en jeu d'autres opérateurs. Ce qui oblige évidemment à considérer les choses sur le plan international. M. le Président : Je voudrais évoquer le problème économique auquel sont confrontés les fabricants de vaccins. Ainsi, Sanofi veut avoir des garanties économiques avant d'investir dans la construction d'usines supplémentaires. La situation se pose dans les mêmes termes pour les masques. Il y a deux ou trois ans, la Commission européenne avait, semble-t-il, refusé de discuter de la question avec les industriels du vaccin, les invitant à régler eux-mêmes la question. En attendant, il se pose un réel problème de modèle économique. Le ministère des finances a-t-il une doctrine ou un avis sur le sujet ? M. Didier HOUSSIN : Pas à ma connaissance. Je ne vois que deux solutions. La première serait que les pouvoirs publics européens et nationaux donnent des garanties économiques suffisantes aux industriels afin qu'ils investissent dans de nouvelles unités de production, y compris dans l'éventualité où il n'en sortirait pas grand-chose avant longtemps... M. Jean-Michel BOUCHERON : Quel est le coût d'une usine ? M. Didier HOUSSIN : Ce sont des sommes très importantes. M. le Président : De l'ordre de 600 ou 700 millions d'euros. Jean-Michel Boucheron est un spécialiste de défense : en nous entendant évoquer ces sommes, il nous considère comme de petits joueurs - et il a un peu raison ! M. Didier HOUSSIN : Le modèle « Défense » est très approprié en matière de pandémie et nous aurions tout intérêt à nous y référer le plus largement possible. La deuxième solution, très présente dans l'esprit des industriels, consisterait à élargir fortement la couverture vaccinale en matière de grippe saisonnière. Pour l'instant, on essaie de vacciner environ 10 à 12 millions de Français : ceux qui ont plus de soixante-cinq ans,... M. le Président : On en vaccine 80 %. M. Didier HOUSSIN : Un peu moins. ...les patients atteints de maladies susceptibles de « décompenser », de même que les professionnels de santé. Tout cela est très utile en termes de santé publique et on peut sûrement progresser. Si l'on élargissait la couverture vaccinale de 12 à 20 millions de Français, et si l'on en faisait autant dans les autres pays, on induirait un besoin de croissance de l'appareil de production industrielle mondiale tel qu'il serait aisé, le jour où apparaîtrait un virus pandémique, de « switcher » les outils de production sur la fabrication du vaccin antipandémique pour en produire des quantités énormes - certes sans pour autant couvrir les besoins de la planète, qui compte 6 milliards d'individus. La première question est de savoir si l'extension de la vaccination antigrippale aux enfants, aux plus de cinquante ans, etc., aurait un sens en termes de santé publique. Le problème est qu'une vaccination n'est jamais neutre : la vaccination antigrippale présente peu de risques, mais il n'y a pas de risque zéro. De surcroît, contrairement à la fièvre jaune, par exemple, pour laquelle l'immunité dure quinze ans, il faut revacciner chaque année, car le virus change toujours un peu. Dès lors, se profile le risque que nous avons connu pour l'hépatite B et d'autres vaccinations : les ligues anti-vaccinales sont actives et auraient beau jeu de mettre en avant le syndrome de Guillain-Barré survenu chez un jeune homme ou la sclérose en plaques survenue chez une jeune fille, d'accuser l'État de pousser à la vaccination, et de faire échouer l'élargissement de la couverture vaccinale contre la grippe saisonnière et la préparation à une pandémie grippale... La vaccination est toujours bien acceptée lorsque la maladie est très menaçante ou le bénéfice parfaitement clair. Mais rendre une vaccination obligatoire alors que la menace reste lointaine et qu'elle n'est pas exempte de risques, aussi faibles soient-ils, a fortiori s'il y a derrière des motivations économico-industrielles, c'est s'exposer à un danger. Je recommande la plus grande prudence. Je serais assez d'avis de mettre l'accent sur la couverture vaccinale conformément aux recommandations actuelles, quitte à envisager un élargissement progressif et fondé sur des raisons de santé publique - en prenant en compte notamment les maladies chroniques non prises en charge dans le cadre de la législation sur les ALD32, etc. -, mais je ne suis pas favorable à un à-coup trop brutal qui pourrait se retourner contre nos projets. M. le Président : Je partage totalement votre avis. Les industriels nous poussent à vacciner tout le monde afin de disposer de rampes de lancement pour lutter contre le virus pandémique ; c'est une erreur, tout au moins dans le cas de la population française. Peut-être y a-t-il une alternative : l'Europe pourrait décider de fabriquer des vaccins pour les offrir aux populations qui en ont besoin en Afrique, au Moyen-Orient et dans d'autres pays en voie de développement. Au moins cette augmentation de la production serait-elle légitimée par des besoins de santé publique. Sinon, il faut trouver un autre modèle d'aide économique aux entreprises ; car celui d'une hyperproduction annuelle aura à coup sûr les effets que vous venez de décrire. N'oublions jamais que la France, pays de Pasteur, a mis soixante ans avant de parvenir à mettre en place la vaccination obligatoire. Soixante ans de débats entre l'Assemblée nationale et le Sénat ! M. Didier HOUSSIN : Et cela reste fragile. M. Marc LE FUR : On sait qu'un masque coûte 35 centimes. Combien est payé le Tamiflu à l'unité ? Certains médecins ont dit qu'ils ne peuvent plus en trouver alors qu'ils s'en servaient pour soigner d'autres affections. Qu'en est-il ? M. le Président : Ce n'est pas vrai. Le Tamiflu était très peu utilisé, tout simplement parce que son usage est compliqué : la grippe doit être prise à son tout début. Or les gens viennent généralement voir le médecin au bout de deux ou trois jours. M. Marc LE FUR : Mais il servait bien à quelque chose. M. le Président : Pratiquement pas. Il est très peu utilisé. Beaucoup de médecins soutiennent même qu'il est inefficace, ce qui n'est pas exact. C'est tout simplement que l'utilisation qu'ils en font n'est pas la bonne. M. Marc LE FUR : Existe-t-il réellement un marché noir, ou « gris », du Tamiflu dans le monde ? Si oui, a-t-on réagi ? M. Didier HOUSSIN : Une boîte de Tamiflu coûte environ une dizaine d'euros, soit un euro la dose. M. le Président : Chez le pharmacien. M. Didier HOUSSIN : Les propos de M. Le Guen sont justes : le Tamiflu n'était jusque-là guère utilisé contre la grippe saisonnière : son efficacité est relative et ses conditions d'administration sont telles qu'il arrive souvent après la bataille ; c'est pourquoi l'accent avait été mis à juste titre sur la vaccination. Il est toutefois utilisé dans certaines collectivités - de personnes âgées, par exemple - pour essayer d'éviter une épidémie lorsque quelques cas de grippe apparaissent. L'industriel étant un peu court en termes de capacités de production, nous sommes convenus que nous nous efforcerions de dire à la population qu'il n'y avait aucune justification à se précipiter sur le Tamiflu dans les pharmacies. Si une grippe saisonnière survenait durant les mois d'hiver, l'industriel remettrait sur le marché une quantité suffisante pour soigner un certain nombre de malades. Le problème est que les citoyens sont des gens rationnels et se demandent pourquoi, puisque l'État stocke, ils ne pourraient pas en faire autant. Nous avons beau essayer de leur expliquer que nos médicaments ne risquent pas de se périmer et que nous les donnerons gratuitement, cela n'empêche pas ceux qui souhaitent stocker de vouloir le faire. M. le Président : Si vous remettez du Tamiflu sur le marché, il disparaîtra très vite. Les gens se rueront dessus. M. Didier HOUSSIN : En effet. Et un marché noir s'est effectivement mis en place sur l'Internet, où les boîtes de Tamiflu se vendent, dit-on, à plus de 100 euros. M. Gérard CHARASSE : Quelle est la durée de validité de ces médicaments ? M. Didier HOUSSIN : Pour les boîtes de Tamiflu conditionné en gélules, la durée de péremption est de trois ans, et de cinq ans pour l'oseltamivir en poudre. Cela dit, nous allons essayer - le sujet a été abordé ce matin même lors de notre réunion hebdomadaire - d'aborder le sujet de la péremption en suivant l'exemple des États-Unis, c'est-à-dire en ayant une approche beaucoup plus pro-active du problème de la péremption. On peut programmer des études et des contrôles de manière à allonger le délai de péremption de certains produits. C'est une action de long terme, mais elle mérite d'être menée. J'en profite pour évoquer un point dont j'ai parlé au ministre : la France va devoir changer d'échelle en matière de stockage pharmaceutique et se doter d'une structure de stockage qui soit gérée, maintenue à jour, sécurisée, etc., pour offrir une vision d'ensemble des stocks disponibles. M. le Président : Monsieur le délégué interministériel, il me reste à vous remercier de cet échange très riche. Nous nous reverrons sans doute bientôt, sitôt que nous pourrons passer le plan de pandémie au tamis de nos interrogations - nous en avons un certain nombre. Audition de M. Christophe WEBER, président du laboratoire GlaxoSmithKline France Présidence de M. Jean-Marie LE GUEN, Président M. le Président : Mes chers collègues, nous sommes heureux d'accueillir M. Christophe Weber, président du laboratoire GlaxoSmithKline (GSK) France. Monsieur Weber, GSK est le fabricant du Relenza, l'autre antiviral, avec le Tamiflu, sur lequel nous pouvons compter pour faire face à la crise sanitaire qui nous menace. Par ailleurs, vous vous lancez dans la fabrication de vaccins antigrippaux. Les caractéristiques du Relenza sont proches de celles du Tamiflu, à ceci près que son mode d'administration est apparemment un peu plus compliqué. Vous nous apporterez, si nécessaire, des compléments d'information sur ce produit. Nous évoquerons ensuite la question des vaccins. Nous pourrions conclure en abordant le problème sous l'angle économique et social : nous souhaiterions savoir comment vous comptez contribuer, en tant qu'industriel, à la stratégie qui sera conduite pour faire face à la pandémie au plan mondial. M. le Rapporteur : Pour compléter les propos de M. le président, je souhaiterais savoir où en est la recherche sur les antiviraux. D'autre part, comment avez-vous créé le Relenza et quelle est son efficacité ? Enfin, quelle est la politique commerciale de votre laboratoire en matière d'antiviraux dans le cas d'une éventuelle pandémie ? M. Christophe WEBER : Monsieur le président, mesdames, messieurs les députés, le Relenza est disponible depuis maintenant plus de cinq ans. Il présente quelques spécificités qu'il importe de souligner. Notamment, des données existent montrant une certaine efficacité sur des souches qui seraient résistantes au Tamiflu. En ce sens, il a probablement sa place dans un arsenal thérapeutique pour lutter contre la pandémie. Les démonstrations du Relenza ont été faites, mais pas in vivo, pour le virus H5N1. Elles ont été faites, in vivo, avec les souches classiques de la grippe, H3N2 et H1N1. Son indication concerne le traitement de la grippe. Quant à son mode d'administration, il se présente sous forme de système d'inhalation, au moyen duquel on inspire de la poudre sèche qui gagne ensuite les voies aériennes et les poumons. Le virus de la grippe se répliquant dans les poumons, l'efficacité du Relenza est donc rapide C'est un produit intéressant car il a peu de passage systémique. Nous n'avons pas, en Europe et aux États-Unis, une indication de prévention. Nous allons soumettre à nouveau un dossier pour obtenir cette indication dans les prochains mois. S'agissant du virus H5N1, les données in vitro montreraient son efficacité chez l'homme. Mais tant qu'il n'a pas été utilisé, il y a toujours un doute. Les données montrent son efficacité chez la souris. En ce qui concerne les résistances, nous n'avons à ce jour qu'un seul cas, chez un enfant vietnamien immuno-déprimé. Nous pensons que du fait de sa puissance d'action et de son mode d'administration, le Relenza pourrait développer moins de résistances que d'autres produits. Mais il convient d'être prudent, car le Relenza a été beaucoup moins utilisé que le Tamiflu, et il est donc difficile de conclure définitivement. Il est cependant établi que des souches résistantes au Tamiflu sont sensibles au Relenza. Commercialement, ce produit n'a pas été un succès en raison des contraintes de son administration : il doit être pris dans les 48 heures qui suivent les premiers symptômes, ce qui implique de voir son médecin rapidement. De plus, le Relenza n'est pas remboursé. En France, nous vendons traditionnellement environ 5 000 traitements par an, autant dire rien. Au moment où le risque de pandémie est apparu, nous n'avions pas les capacités de production nous permettant d'y faire face. Nous avons donc commencé à investir massivement, ce qui nous permettra d'augmenter beaucoup nos capacités de production à partir de 2006 et 2007 : elles pourraient être multipliées par cinq ou six dans les deux prochaines années. M. le Président : En termes de processus de fabrication, le Relenza est-il proche du Tamiflu ? M. Christophe WEBER : Il est très différent. La fabrication des médicaments respiratoires sous forme de poudre inhalée est très compliquée car il faut savoir maîtriser une forme sèche en poudre et un système qui permette d'avoir le bon dosage à chaque inhalation. Notre capacité de production va donc croître car une demande forte commence à apparaître de la part de certains États, dont la France. S'agissant de notre politique en matière de brevets, nous sommes tout à fait ouverts à toute collaboration, que ce soit avec des entreprises ou des États, qui permettrait d'augmenter significativement la production. Le problème est que peu d'acteurs maîtrisent cette technologie. M. le Rapporteur : Où se trouve le site de fabrication du Relenza ? M. Christophe WEBER : Une grande partie de la chaîne de production se trouve à Evreux, où 80 % de la production est assuré. La matière première est fabriquée en Écosse. Le Relenza a été beaucoup utilisé au Japon. Nous avons annoncé que, tant pour le Relenza que pour le vaccin, nous étions ouverts à des formules de collaboration ou de licence. Nous sommes en contact, déjà, avec quelques producteurs. Nous appliquons une politique de prix différenciés. C'est ce que nous faisons pour les médicaments visant à traiter certaines pathologies. S'agissant du SIDA, par exemple, nous vendons nos médicaments à des prix très peu élevés dans tous les pays en développement, notamment africains. Nous ferons de même pour le Relenza et le vaccin. M. le Rapporteur : Êtes-vous en contact avec des gouvernements étrangers ? M. Christophe WEBER : Oui. Certains ont déjà clairement annoncé qu'ils commanderaient du Relenza. La France a été le premier d'entre eux, en commandant 200 000 traitements en 2004. Elle a été suivie par Hong Kong, les Pays-Bas, l'Allemagne, qui a commandé près de 2 millions de traitements il y a quelques mois, et les États-Unis. M. Gérard BAPT : Pourquoi le Relenza n'est-il par remboursé, contrairement au Tamiflu ? M. Christophe WEBER : Le Tamiflu n'est remboursé que dans certains cas, notamment pour les immuno-déprimés. Quant au Relenza, la Commission de transparence avait estimé que ce produit n'était pas suffisamment efficace. Il amoindrit la sévérité des symptômes et réduit la durée de la grippe de 1,5 jour, mais ces éléments n'ont pas été jugés suffisants. M. le Président : C'est là un point important, qui explique pourquoi le Tamiflu et le Relenza ont la réputation, dans le corps médical, d'être des produits peu efficaces. Cette rumeur vient de là. Elle n'est pas totalement dénuée de fondement, mais elle n'est pas vraie non plus. M. Christophe WEBER : Les études cliniques ont établi clairement une efficacité comprise entre 60 et 80 %. Mais le fait est que le Relenza doit être pris dans les 48 heures qui suivent les premiers symptômes, et il réduit la durée de la grippe d'un jour, la question étant de savoir si c'est beaucoup ou pas. À l'époque, la commission avait estimé que cela ne méritait pas un remboursement. M. Gérard BAPT : Ce qu'a dit M. le président signifie-t-il que l'information médicale est mal faite ? M. Christophe WEBER : Lors du lancement du Relenza, nous avons informé le corps médical, comme nous avons l'habitude de le faire pour tous nos médicaments. Mais comme il n'était pas remboursé, nous n'avions plus d'ambition commerciale. Je précise qu'il n'y a pas aujourd'hui de Relenza dans les pharmacies et il n'y en aura probablement pas dans un avenir proche, dans la mesure où le produit n'était pas utilisé en temps normal. Nous privilégions en effet les commandes du Gouvernement dans le cadre de la lutte contre la pandémie, pour lesquelles notre capacité de production est déjà à peine suffisante. M. le Rapporteur : Comment le produit est-il stocké et quelle est sa longévité ? M. Christophe WEBER : Nous sommes obligés de stocker le produit fini. Il n'y a pas de possibilité de stockage en gros ou en container, car c'est un produit inhalé. La durée de péremption est de trois ans. Elle a récemment été portée à cinq ans. M. François GUILLAUME : Le Tamiflu et le Relenza présentent le même inconvénient, dans la mesure où ils doivent être utilisés rapidement. Après les 48 heures qui suivent l'apparition des symptômes, ils ne font que réduire légèrement la durée de la grippe. Où est la différence entre les deux produits ? M. Christophe WEBER : Dans le cas de la grippe aviaire, la sévérité est très forte puisque cette maladie est mortelle. Atténuer la virulence du virus est donc important. De ce point de vue, les médicaments ont à peu près la même efficacité. Mais si on regarde les résistances, elles sont comprises entre 0,5 et 4 % pour le Tamiflu. Aucune résistance n'a été identifiée pour le Relenza. M. le Rapporteur : Il faut aussi garder à l'esprit qu'on ne sait pas encore quel sera le virus responsable de la pandémie. M. Christophe WEBER : Des indices montrent que les antiviraux seraient efficaces, mais on n'en est pas sûr. M. le Rapporteur : Le site d'Evreux sera-t-il suffisant pour augmenter votre capacité de production, ou d'autres unités seront-elles construites ? M. Christophe WEBER : Nous construirons d'autres unités dans d'autres continents, en Amérique et en Asie. M. le Rapporteur : Et en Europe ? M. Christophe WEBER : Non. Le site d'Evreux suffira. C'est l'un des plus gros sites industriels de GSK dans le monde. Il emploie 2 000 personnes. M. François GUILLAUME : La matière première est-elle un produit naturel ? M. Christophe WEBER : Non, elle est purement chimique et fabriquée en Ecosse. Cette matière première est d'ailleurs explosive à une certaine étape du processus. M. le Rapporteur : Quel est le prix d'un traitement ? M. Christophe WEBER : Le prix fabricant est d'un peu moins de 15 euros par traitement. En prix public, il se situe autour de 30 euros, variant un peu selon les marges des pharmaciens. M. le Rapporteur : Quel sera le prix pratiqué pour les commandes gouvernementales ? M. Christophe WEBER : Nous ne le communiquons pas. M. le Rapporteur : Nous devrons donc le demander au Gouvernement ? M. Christophe WEBER : Oui. M. le Rapporteur : Qu'en est-il du vaccin ? M. Christophe WEBER : Dans le domaine du vaccin, GSK partage la première place mondiale avec Sanofi-Aventis. Nous avons beaucoup de vaccins pédiatriques ou contre l'hépatite B. La grippe n'est pas un vaccin majeur pour GSK, qui n'occupe que 10 % du marché mondial du vaccin de la grippe. La capacité de production n'est pas suffisante. L'ensemble des fabricants de vaccin sont capables de produire 300 millions de doses de vaccin grippal, dont 90 % sont destinées à l'hémisphère Nord. Si la production n'a pas connu d'augmentation au cours des années passées, c'est d'abord parce que la fabrication est encore difficile et se fait à partir d'oeufs. D'autre part, les risques commerciaux sont grands : la plupart des pays procédant par appels d'offres, vous n'êtes jamais certain d'être retenu pour vendre votre produit. En outre, les investissements en capital sont énormes. Enfin, le vaccin de la grippe ne peut être vendu à un prix élevé car il est devenu un produit « courant ». Toutes ces raisons expliquent que la production n'augmente pas. Aucun acteur majeur nouveau n'est apparu depuis des années sur le marché du vaccin. 95 % des vaccins sont fabriqués en Europe. La majorité des vaccins de GSK sont fabriqués en Belgique, et nous avons racheté en 2004 une petite unité de production à Saint-Amand-les-Eaux. Notre stratégie est la suivante. Nous travaillons sur un vaccin dit de première génération, qui sera un vaccin à cellule entière, avec un adjuvant à base d'aluminium. Ce sera un vaccin vivant atténué, ce qui nous permettra une capacité de production plus importante que celle actuelle : elle sera multipliée par dix ou par douze. Cela étant, les vaccins vivants atténués ont souvent plus d'effets secondaires que ceux qui ne contiennent que les antigènes. Mais nous estimons que l'urgence justifie ce choix. Il est important que la capacité de production soit forte, avec un vaccin suffisamment immunogène pour être efficace après deux doses. Dans les derniers mois, nous avons investi près de 2 milliards de dollars pour augmenter notre capacité de production, en Allemagne, au Canada, aux Etats-Unis. Ce vaccin sera développé sur des souches proches du H5N1. Nous le soumettrons d'ici la fin de l'année à la procédure classique d'enregistrement des vaccins. Mais nous avons passé un accord avec l'EMEA, l'Agence européenne pour l'évaluation du médicament, pour que soit appliquée une procédure accélérée. Nous travaillons également sur une deuxième génération de vaccins, dont la fabrication aura recours à des adjuvants spécifiques permettant de potentialiser l'effet immunogène. Ces vaccins ne seront plus vivants atténués mais trivalents ou pentavalents. Moins de doses seront nécessaires. De plus, le spectre d'efficacité sera plus large, ce qui est important dans les cas où le virus viendrait à muter. Le jour où la pandémie se déclenchera, nous arrêterons la production du vaccin classique et nous utiliserons toutes nos capacités de production, multipliées par 10, pour fabriquer les vaccins de première génération. Dans les vaccins de troisième génération, il s'agit d'abandonner la production à partir d'œufs. Il faut aujourd'hui un œuf par vaccin - en outre, un œuf spécifique -, ce qui constitue une limite très gênante, d'autant plus que la grippe aviaire risque de diminuer le nombre d'œufs disponibles. La troisième génération utilisera la culture cellulaire. M. le Rapporteur : Une fois connue la souche virale responsable de la pandémie, combien de temps vous faudrait-il pour produire ce vaccin ? M. Christophe WEBER : Le vaccin de première génération sera disponible à partir de 2007. Nous pourrons commencer la production quatre mois après que l'OMS nous aura communiqué la souche. M. le Président : Pour son appel d'offres, la France a retenu deux prestataires, Sanofi-Aventis et Chiron. Quel argument donneriez-vous pour que l'on retienne GSK s'il y avait une troisième commande ? M. Christophe WEBER : Lorsque le Gouvernement a lancé l'appel d'offres, nous avons estimé qu'il était trop tôt pour s'engager sur quoi que ce soit. Rien ne dit que les fabricants parviennent à mettre au point un vaccin suffisamment immunogène pour que la réaction soit suffisante après deux doses. Il est possible qu'un fabricant ne parvienne qu'à produire un vaccin efficace seulement après trois ou quatre doses. Si j'étais à la place du Gouvernement, je m'adresserais à tous les fabricants afin d'avoir le plus de chance possible d'avoir le meilleur vaccin. Je pense que c'est d'ailleurs son intention. M. le Président : Travaillez-vous sur les vaccins anti-ARN, pas propres au H5N1, et qui auraient un spectre beaucoup plus large, capables de conférer une immunité pour une grande variété de maladies infectieuses et non infectieuses ? D'autre part, les industriels font part de leurs hésitations à investir pour augmenter leurs capacités production qui ne serviraient qu'une fois, à produire de très grandes quantités. Quelle est votre position sur ce point ? M. Christophe WEBER : Comme je le disais tout à l'heure, les fabricants sont actuellement capables de produire 300 millions de doses pour la population mondiale. C'est probablement dix fois moins que ce qui devrait être nécessaire pour la grippe classique. L'augmentation de la capacité de production se justifie donc indépendamment même de la crise pandémique. J'insiste sur le fait que nous voulons sortir de la logique commerciale qui consiste à ne produire de médicaments que pour l'hémisphère Nord. Par exemple, pour le SIDA, nous avons décidé de vendre nos produits à prix coûtant dans les pays en voie de développement. Notre démarche est la même en ce qui concerne le vaccin. M. le Président : Comment suggérez-vous que les États interviennent ? Ils peuvent passer des commandes, ils peuvent aussi financer des investissements directs. M. Christophe WEBER : Je pense qu'il faut passer des commandes en amont pour montrer l'intention d'utiliser ces vaccins. Pour l'après-pandémie, il faut être vigilant sur la pression qu'on exerce sur les prix, et qui entrave le développement des investissements visant à augmenter la capacité de production. Enfin, des États peuvent co-investir dans la fabrication de vaccins, comme l'Allemagne l'a fait avec nous. M. le Président : Selon quelles modalités ? M. Christophe WEBER : Les détails ne sont pas publics. Dans d'autres pays, l'État peut s'engager dans des « joint-ventures ». Les formules de partenariat sont diverses. S'agissant des vaccins anti-ARN, le problème est de trouver un antigène suffisamment puissant. Nous y travaillons. M. Pierre HELLIER : Quand la technologie des vaccins sur hamster sera-t-elle prête ? M. Christophe WEBER : Nous pensons qu'il faut compter au moins cinq ans. M. Pierre HELLIER : S'agissant des commandes, je pense que vous avez eu raison de souligner que nous devrons faire appel à tous ceux qui seront en mesure de fabriquer le vaccin. Le fait de passer des commandes vous arrangerait-il sur le plan financier ? M. Christophe WEBER : Passer commande ne signifie pas forcément que les vaccins seront disponibles. Tous les États vont passer des commandes, et dans la mesure où les capacités de production seront limitées, il faudra imaginer un processus d'allocation, à supposer que tous les fabricants soient capables, au même moment, de produire un vaccin spécifique, ce qui n'est pas du tout certain. M. Pierre HELLIER : Dernière question : quel est l'intérêt de fabriquer un vaccin « proche du H5N1 », et pas un vaccin « H5N1 » ? M. Christophe WEBER : Parce que nous savons que le virus responsable de la pandémie ne sera pas le H5N1. Ceci dit, nous sommes en train de fabriquer un lot de vaccins « H5N1 ». M. le Rapporteur : Lors du Congrès mondial du vaccin qui s'est récemment tenu à Lyon, il a été dit que des études tendant à faire muter des virus étaient menées en laboratoire. Pouvez-vous le confirmer ? M. Christophe WEBER : Je ne suis pas assez expert pour vous répondre. Avant que vous ne concluiez cette audition, monsieur le président, j'ajoute que certains indices montreraient l'intérêt d'une primo-vaccination avant la pandémie et ceci, avant que le virus responsable de la pandémie ne soit connu. La politique consistant à favoriser la vaccination est donc opportune. M. le Président : Je vous remercie de votre contribution aux travaux de notre mission d'information. Audition de M. Henry-Vincent CHARBONNÉ, Président du laboratoire Roche France Présidence de M. Jean-Marie LE GUEN, Président M. le Président : Mes chers collègues, nous accueillons aujourd'hui M. Henry-Vincent Charbonné, président du laboratoire Roche France. Le travail de notre mission d'information s'inscrit dans le cadre général du contrôle exercé par le Parlement sur l'Exécutif. Mais nous sommes aussi les porte-parole de nos concitoyens et nous devons apporter une réponse à leurs attentes. C'est pourquoi nous interrogerons tous les acteurs appelés à jouer un rôle dans la crise sanitaire potentielle qui nous menace. Nous souhaiterions, dans un premier temps, obtenir des précisions sur le Tamiflu, un antiviral fabriqué par le laboratoire Roche. Peut-être pourriez-vous nous rappeler l'emploi principal de ce produit, et nous donner votre appréciation sur le risque de résistances éventuelles au Tamiflu. Dans un second temps, nous souhaitons aborder deux autres séries de questions, sur lesquelles nous sommes interpellés, tout comme vous. Il s'agit de la question financière, d'une part, et des problèmes de production, d'autre part. Votre communication n'a pas abouti à une grande clarté sur ces sujets. S'agissant de la question financière, une partie de l'opinion s'interroge sur les effets d'aubaine dont votre entreprise pourrait bénéficier à l'occasion de cette crise sanitaire. Nous avons lu certaines choses concernant le chiffre d'affaires du Tamiflu. Nous souhaitons que vous nous donniez des informations sur ce point, mais aussi que vous nous présentiez les principes sur lesquels votre entreprise se positionne par rapport à cette question des bénéfices attendus. Ce point est très important, pas seulement parce que les parlementaires se doivent d'être vigilants quant au bon emploi des deniers publics, mais aussi, et surtout, parce que la population s'interroge de plus en plus sur le bénéfice financier que vous pourriez tirer de la crise sanitaire annoncée, certains doutant peut-être de la légitimité de se préparer à cette crise. Il nous faut donc dénouer d'une manière ou d'une autre cette question. L'autre grand sujet d'interrogation est la question de la production en nombre suffisant de produits permettant de faire face à la crise, en France, en Europe et dans le monde. Sur ce point, les chiffres sont très fluctuants, et la communication qui a été celle de votre entreprise ces derniers mois a beaucoup évolué : on voit les chiffres augmenter, on entend parler d'implantations industrielles dont vous ne parliez pas il y a encore quelques mois. En outre, nous nourrissons un certain nombre d'interrogations sur les modalités de cette production. Il y a quelques semaines encore, vous disiez que seule une entreprise comme la vôtre avait le savoir-faire et les installations nécessaires pour produire ce médicament. Vous mettiez en avant cet argument pour justifier le monopole de la production de votre produit. Vous avez noté, comme nous, des inquiétudes et des réactions très fortes dans le monde. Votre discours a alors évolué : il y a quelque temps, vous ne souhaitiez pas vous dessaisir de votre brevet, pas même par le biais d'un brevet secondaire ; aujourd'hui, nous apprenons que la philosophie de votre entreprise a changé, et que vous êtes prêts à accepter l'idée de brevet secondaire, après que des fabricants de générique se sont proposés pour la fabrication de votre produit. En Inde, où vous n'aviez pas déposé de brevet, vous en déposez un. Pour tout vous dire, nous ne saisissons pas bien la continuité de votre pensée sur ce sujet. Personne ne peut douter que l'intérêt supérieur de l'humanité est en jeu. Les décisions qui doivent être prises par les firmes ne sauraient donc s'inscrire dans la seule logique de leurs intérêts financiers et industriels. Même s'il est légitime que ceux-ci soient pris en compte, on ne peut pas concevoir qu'ils constituent un obstacle à l'obtention, en France et dans le monde, des moyens de faire face à un risque sanitaire de première importance. Nous, parlementaires, avons besoin d'être éclairés sur les orientations de votre entreprise, et sur les moyens qui peuvent être trouvés pour apporter une solution aux problèmes gravissimes auxquels nous allons peut-être devoir faire face. M. Henry-Vincent CHARBONNÉ : Je commencerai par la description du Tamiflu lui-même. Il importe d'abord de rappeler que le Tamiflu n'est pas un vaccin mais un médicament, en l'occurrence, un antiviral spécifique de la grippe. Ses indications sont le traitement curatif de la grippe chez l'adulte et chez l'enfant au-dessus d'un an, la prévention de l'apparition de la grippe chez l'adulte et chez l'enfant au-dessus de treize ans. Un dossier est en cours d'évaluation aux États-Unis et en Europe pour l'utilisation, en usage préventif, chez l'enfant de un à treize ans. D'autre part, un certain nombre d'études sont menées, notamment au Japon, sur l'intérêt de ce médicament et sa posologie pour l'enfant de moins d'un an. La posologie, en usage curatif, est une gélule de 75 mg, deux fois par jour pendant cinq jours. La posologie, en usage préventif, est une seule gélule de 75 mg pendant dix jours. Le médicament existe également en suspension, pour les enfants et pour certains adultes ayant des difficultés à avaler des gélules. S'agissant des résultats en usage curatif, ce médicament produit un effet significatif sur la sévérité des symptômes, qui diminue d'environ 40 %. Il provoque une diminution significative des complications - bronchite chez l'adulte, otite et sinusite chez l'enfant. On constate également une diminution significative de la prise d'antibiotiques et du nombre d'hospitalisations. Enfin, s'il est pris entre 36 et 48 heures après l'apparition des symptômes, la durée de celle-ci diminue d'un jour, ce qui veut dire qu'une grippe classique passe de cinq à quatre jours. C'est là un point sur lequel il convient de s'attarder. Tous les antiviraux agissent en bloquant la multiplication du virus et en empêchant sa diffusion dans l'organisme. Dans le cas de la grippe, la multiplication du virus est très intense jusqu'à 48 heures, voire 72 heures après l'apparition des symptômes. Si le Tamiflu est pris dans les douze premières heures, la durée d'une grippe classique est réduite de cinq jours à deux jours, parce qu'il bloque très tôt la multiplication du virus. On comprend pourquoi le médicament a été peu efficace en Asie du Sud-Est : il a été prescrit trop tardivement, entre quatre et quinze jours après l'apparition des symptômes. Pris dans de telles conditions, le Tamiflu ne permet pas de sauver les malades. Il faut recourir aux antibiotiques, corticoïdes ou autres. S'agissant de l'action en usage préventif, il convient de distinguer entre deux usages. Le premier est celui de la prévention - ou prophylaxie - post-contact. C'est le cas typique d'une maison de retraite. Lorsqu'il y a un cas de grippe, les dommages peuvent être considérables étant donné que l'efficacité du vaccin est de seulement 50 % chez les personnes âgées. Dans ce cas, l'usage du Tamiflu peut réduire de 90 % le nombre de cas de grippe. Le second usage, la prophylaxie générale, qui est l'équivalent de la vaccination, n'a pas d'intérêt pour la grippe saisonnière : la substitution du Tamiflu au vaccin n'a pas lieu d'être. Les dernières études publiées lors du congrès européen sur la grippe aviaire organisé par le European Scientific Working group on Influenza, qui s'est déroulé à Malte en septembre dernier, ont confirmé les données existantes sur l'efficacité en prophylaxie post-contact. En termes curatifs, une étude américaine démontre une réelle efficacité du Tamiflu sur l'hospitalisation, la morbidité et même la mortalité. Du point de vue de la stratégie thérapeutique, le Tamiflu et les antiviraux spécifiques ne sont pas des concurrents du vaccin. Il faut continuer de vacciner. Le Tamiflu est un apport important en complément de la vaccination, notamment chez les personnes âgées de plus de 65 ans, chez qui la vaccination a une efficacité moindre. L'autre indication princeps concerne toutes les personnes qui ne peuvent pas être vaccinées, notamment les immuno-déprimés. Enfin, le Tamiflu peut être efficace pour tous ceux qui ne se sont pas fait vacciner, adultes ou enfants. M. le Rapporteur : Quelle est l'efficacité des autres antiviraux contre le H5N1 ? M. Henry-Vincent CHARBONNÉ : Je vais vous répondre dans un instant, Monsieur le rapporteur. Tout ce que je viens de rappeler concerne les grippes saisonnières classiques. Que peut-on attendre du Tamiflu en cas de pandémie ? Les antiviraux agissent sur la neuraminidase, qui est présente dans les virus humains comme dans les virus aviaires. Nous avons vérifié in vitro l'efficacité du Tamiflu sur le H5N1, mais aussi sur le H7N7, responsable d'une épidémie de grippe aviaire ayant eu des conséquences chez l'homme aux Pays-Bas il y a deux ans. On l'a même vérifiée sur la souche qui est à l'origine de la grippe espagnole de 1918. Nous l'avons vérifiée in vivo chez la souris, et surtout chez le furet, modèle animal plus proche de l'homme. L'efficacité sur tous les modèles animaux a donc été vérifiée. L'efficacité antivirale du Relenza est comparable à celle du Tamiflu. Il est cependant beaucoup moins développé. D'autre part, son mode d'administration, l'inhalation, est moins aisée. Enfin, il se diffuse dans les poumons, alors que le virus attaque tout l'organisme. Les autre antiviraux, tels que l'amantadine ou la rimantadine, voient rapidement apparaître des résistances, ce qui les rend inefficaces en cas de pandémie grippale. De plus, ces produits ne sont pas forcément très bien tolérés. S'agissant des résistances, je souligne qu'il existe un réseau international de surveillance d'apparition des résistances au Tamiflu. Au Japon, entre 14 et 15 millions de personnes ont été touchées par la grippe l'hiver dernier, dont 6 millions ont pris du Tamiflu. Le taux de résistance est aujourd'hui de 0,4 % chez l'adulte. Sur mille souches, quatre seront résistantes ou auront une sensibilité réduite. J'ajoute que la très grande majorité des souches résistantes au Tamiflu sont « bâtardes », qu'elles ont perdu beaucoup de leur pouvoir pathogène et que l'organisme est donc capable de les éliminer par lui-même. La presse s'est fait récemment l'écho de la découverte d'une souche H5N1 résistante au Tamiflu. Il pourrait s'agir d'une mauvaise nouvelle. En réalité, la lecture attentive de l'article de Nature montre qu'il s'agit plutôt d'une bonne nouvelle. Premièrement, la résistance qui est apparue correspond à un type connu de résistance avec les souches humaines. Deuxièmement, la souche résistante était une souche « bâtarde », avec un pouvoir pathogène réduit. Troisièmement, cette souche a été isolée chez une petite Vietnamienne qui a été mise sous traitement préventif de Tamiflu alors qu'elle était déjà atteinte par le virus. Lorsqu'elle a reçu un traitement curatif, elle a guéri. Cela dit, j'insiste sur le fait qu'en cas de pandémie il est évident que l'utilisation massive de Tamiflu conduira à l'apparition de souches résistantes. Mais elles apparaîtront probablement après, et non avant la pandémie, ce qui est beaucoup moins grave. Il n'y a aucune raison de penser que le Tamiflu ne sera pas efficace en cas de pandémie. Qui plus est, puisqu'il s'agit d'un antiviral, il n'empêchera pas les personnes qui auront été grippées de développer leurs défenses immunitaires. Ceux qui auront été atteints lors de la première vague pandémique mais guéris par le Tamiflu seront de fait immunisés lors de la seconde vague. M. le Président : Des résistances éventuelles s'opposent-elles, selon vous, à l'utilisation en prophylaxie généralisée pour les professions exposées ? M. Henry-Vincent CHARBONNÉ : Des experts virologues seraient sans doute mieux placés que moi pour vous répondre, mais d'après ce que l'on sait aujourd'hui de la résistance - 0,4 % des 6 millions de personnes ayant pris du Tamiflu au Japon -, l'utilisation en prophylaxie pour les professionnels exposés, une fois que la pandémie se sera déclarée, est a priori une action envisageable. Par contre, l'usage d'antiviraux est à proscrire pour traiter ou prévenir la grippe aviaire chez les poulets, car il conduit à des résistances. M. le Président : Cela aura des conséquences sur la quantité de matériel disponible. Il me semble que nous pouvons maintenant aborder les questions financières et celles relatives au problème de la production. M. Henry-Vincent CHARBONNÉ : Avec votre permission, je commencerai par les problèmes de production. Comme beaucoup de produits récents, la fabrication du Tamiflu est un processus compliqué. On est très loin de la chimie simple qu'on a pu connaître par le passé. Entre dix et douze mois sont nécessaires entre le ramassage de l'anis étoilé - ou badiane de Chine - jusqu'au stade final de la mise en boîte. En plus, le processus est complexe. D'abord, parce qu'il faut récolter l'anis étoilé et le traiter. Ensuite, parce qu'il y a des opérations de filtration et de purification, avant de passer à une étape chimique délicate, qui utilise des produits hautement toxiques et est explosive. Cette dernière étape de la fabrication de ce médicament ne peut se faire que dans des établissements agréés, lesquels sont actuellement, en tout et pour tout, au nombre de trois, aux Etats-Unis et en Europe. En outre, le caractère explosif de la réaction augmente avec la quantité produite. Il y a deux goulots d'étranglement : la phase explosive, donc, et l'approvisionnement en matière première. Sur ce dernier point, nous sommes maintenant capables, grâce à un processus biotechnologique, de produire la matière première de base : l'acide shikimique, sans utiliser de la badiane de Chine. Les premières quantités de cette nouvelle source de matière première sont entrées dans la chaîne de production cet été. Nous gagnons en temps, mais surtout en souplesse et en indépendance. Cela étant, nous n'avons pas pour autant l'intention de renoncer à l'anis étoilé, puisque l'objectif est de pouvoir produire les plus grandes quantités possibles de matière première nécessaire à la fabrication du Tamiflu. M. le Président : Y a-t-il une différence de prix ? M. Henry-Vincent CHARBONNÉ : Je l'ignore. Je sais par contre que le prix de l'anis étoilé est en train de monter. On voit apparaître des phénomènes spéculatifs. Pour résumer, je dirais que le processus industriel est complexe. En conséquence, toute décision d'investissement ou d'augmentation de capacité ne porte ses fruits qu'après dix-huit mois ou deux ans. De plus, comme nous sommes dans un processus de fabrication pharmaceutique, toutes les phases doivent être contrôlées, validées, agrées. M. Alain CLAEYS : Sur quelle phase du processus le brevet porte-t-il ? M. Henry-Vincent CHARBONNÉ : Nous avons un brevet portant sur l'exploitation du produit, et un autre qui porte sur son industrialisation. Cela étant, le processus est publié. Un chimiste de bon niveau ayant sous les yeux le brevet et la publication est capable de fabriquer l'oseltamivir dès lors qu'il détient l'acide shikimique. M. Alain CLAEYS : Le brevet biotechnologique a donc été déposé ? M. Henry-Vincent CHARBONNÉ : Oui. Je rappelle que le produit a été lancé aux États-Unis en 1999 et en Europe en 2002, à une époque où l'éventualité d'une pandémie était peu évoquée. Puis, nous avons été alertés par l'OMS sur la possibilité de mutation du H5N1. Dès lors, parce que nos capacités de production étaient relativement faibles, nous avons commencé à investir. Nous avons doublé nos capacités de production en 2004, puis en 2005. Nous les doublerons à nouveau en 2006, jusqu'à être capables, en 2007, de produire 300 millions de traitements par an. Nous avons déjà monté un véritable « Meccano industriel ». Actuellement, treize sites participent à la production du Tamiflu, dont la moitié appartiennent à Roche. Les autres appartiennent à des fournisseurs extérieurs, parce que nous avons dû faire appel à des partenaires ayant des capacités adaptées et des installations ad hoc. Nous en étions là il y a trois mois. Or, depuis cette date, la demande a explosé : tout le monde veut du Tamiflu, et tout le monde en veut pour demain. Dans ce contexte, quelle est notre position ? Je pense que nous avons la chance, qui est aussi une chance pour le monde entier, d'avoir pris le risque de développer, d'industrialiser, de commercialiser le Tamiflu. Dans notre esprit, cela nous donne des droits, et notamment le droit de gagner notre vie correctement. Mais cela nous donne aussi des devoirs. Nous n'oublions pas que notre responsabilité est de trouver les moyens de faire face à la demande. Notre devoir est de faire en sorte que le produit soit disponible en quantités suffisantes. Or, l'augmentation de notre capacité de production ne suffira pas à atteindre cet objectif. C'est pourquoi, comme l'a souligné le PDG du groupe, M. Franz Humer le 18 octobre dernier, Roche exclut que les brevets soient un obstacle à la disponibilité du produit. Nous sommes prêts à mettre en place toutes les coopérations nécessaires pour augmenter le plus vite possible la capacité de production, que ce soit avec des États ou des sociétés privées. Ces partenaires doivent pouvoir participer efficacement et rapidement à une augmentation importante de la production. On espère par exemple trouver des spécialistes de la chimie explosive. Au total, l'évolution de notre position a résulté de celle de la demande : nous avons pris conscience que nous ne pourrions pas, seuls, y répondre. M. Alain CLAEYS : Quelle va être, concrètement, votre politique de licence pour renforcer cette coopération avec des partenaires privés ? Et quelle sera votre attitude par rapport aux pays où il n'y a pas de brevet ? M. le Président : Le laboratoire indien Cipla affirme être sur le point de produire une copie du Tamiflu. Un laboratoire thaïlandais se dit prêt à produire du Tamiflu dès le mois de février prochain. Quel sérieux accordez-vous à ces déclarations, et quelle sera votre attitude ? M. Henry-Vincent CHARBONNÉ : Nous recherchons des partenaires capables de contribuer à une augmentation importante des quantités produites. Ils peuvent venir de l'industrie chimique, en apportant des capacités non utilisées, en prenant en charge telle ou telle phase du processus de production. Nous sommes en contact avec huit partenaires, après avoir reçu 150 demandes. Il s'agit soit de génériqueurs, soit des grands acteurs de la pharmacie ou de la chimie. Nous allons examiner de près ce qu'ils peuvent apporter à la production, et dans quels délais. Car nous savons qu'il nous faut deux ans pour monter des capacités nouvelles. Il faudra trois ans à celui qui n'a aucune expertise. M. François GUILLAUME : Actuellement, la demande est très forte. Vous développez au maximum vos investissements, tout en recherchant des collaborations. Votre entreprise ne prend-elle pas un risque, en cas de chute de la demande ? Lorsque la demande sera revenue à son niveau habituel, que ferez-vous de votre capacité de production ainsi augmentée ? M. Alain CLAEYS : Vous avez une licence exclusive. Quelles conséquences le développement des coopérations aura-t-il en termes de propriété intellectuelle, et quelles sont vos marges de négociation ? M. Michel LEJEUNE : Quel est le délai de péremption du Tamiflu ? Il est important de le savoir pour organiser le stockage. M. Daniel PRÉVOST : Les laboratoires travaillant sur les vaccins ont appelé à un soutien public à la recherche. Compte tenu des risques de pertes économiques qu'ils courent, qu'en pensez-vous ? M. Henry-Vincent CHARBONNÉ : Les gélules qui sortent de l'usine ont un délai de péremption de cinq ans. La poudre en vrac se périme pour l'instant au bout de cinq ans, mais devrait rester stable au moins dix ans. Cependant, en droit pharmaceutique, on ne peut augmenter le délai de péremption que lorsque l'augmentation de celle-ci a été constatée en temps réel. Nous avons une licence exclusive de Gilead, société américaine, qui nous donne tous les droits de commercialisation et d'industrialisation. Gilead a estimé que nous n'avons pas fait tous les efforts nécessaires pour développer le Tamiflu. L'arbitrage est en cours. Nous avons la volonté de régler le problème à l'amiable. Mais je souligne que, quelle que soit la position de Gilead, Roche ne cessera pas d'investir et de chercher toutes les solutions pour augmenter la disponibilité du produit. S'agissant des coopérations, je ne citerai que ceux qui ont rendu publique leur démarche. Nous sommes en contact, en Inde, avec Ranbaxy, qui dit être en mesure de produire en grandes quantités dès lors qu'on lui fournirait la matière de base. Notre volonté est d'apporter notre savoir-faire et notre expertise à des partenaires capables de contribuer à une augmentation rapide et significative de la production. En ce qui concerne la coopération avec les États, une dimension politique ou géopolitique doit être prise en compte. Taïwan, le Vietnam, la Chine nous ont approchés en souhaitant produire un médicament par leurs propres moyens et pour la défense de leurs propres citoyens. Nous leur demandons quelles sont leurs capacités du point de vue industriel, en étant prêts à les aider par notre expertise. Je n'ai pas envie de commenter les déclarations que vous avez évoquées, Monsieur le président, de laboratoires indiens ou thaïlandais. Je précise seulement que la politique de Roche est de ne pas déposer de brevets dans les pays à faibles revenus, tels qu'ils sont définis par les Nations unies. Cette politique vaut pour tous les produits, pas seulement pour le Tamiflu. Il n'y a pas de brevet en Thaïlande. Mais nous sommes en contact avec la Thaïlande pour tenter de faire avancer les choses. Il reste qu'il faut organiser nos contacts : sinon, le désordre risque de s'installer et, au lieu d'avancer, nous risquons de reculer en raison des goulots d'étranglement évoqués précédemment. Quant aux déclarations de Cipla, elles ont varié. Il y a trois mois, Cipla aurait déclaré - j'insiste sur le conditionnel, car il s'agit de propos rapportés par la presse - qu'il lui fallait trois ans pour produire le Tamiflu. Trois semaines après, Cipla aurait déclaré qu'il lui était possible de le produire en quinze jours. Récemment, Cipla aurait déclaré qu'il pouvait en produire à condition qu'on lui fournisse la matière première. Il m'est difficile de me faire une opinion. M. le Président : Le brevet industriel explicite-t-il très clairement toute la chaîne de production. Le savoir-faire est-il public ? M. Henry-Vincent CHARBONNÉ : En règle générale, un brevet ne contient pas tout. Mais une publication scientifique explique les grandes étapes de fabrication du Tamiflu. M. le Président : Un industriel de la chimie peut donc, à la lecture du brevet, produire le médicament ? Certains pays, comme Taïwan, la Chine ou l'Inde, disposent aujourd'hui d'une industrie chimique assez avancée et seraient donc en mesure de fabriquer le produit. Vous ne contestez donc pas la déclaration du laboratoire thaïlandais qui se dit prêt à produire du Tamiflu dès le mois de février ? M. Henry-Vincent CHARBONNÉ : La chimie employée dans la fabrication du Tamiflu n'est pas hors d'atteinte de bons industriels de la chimie. Cela dit, elle est complexe, elle requiert des installations qui sont très peu courantes. Elle requiert aussi des mesures de sécurité encore moins courantes. M. le Président : Cela étant, devant l'ampleur du risque sanitaire, certains pays prendront moins de précautions qu'ils n'en prendraient en temps normal. M. Alain CLAEYS : Jusqu'où êtes-vous prêts à aller dans votre coopération au niveau du processus de production ? M. Henry-Vincent CHARBONNÉ : Si nous avons affaire à des partenaires capables de produire en grandes quantités un produit de qualité, nous coopérerons avec eux. M. le Président : Le Tamiflu a un intérêt non seulement curatif mais prophylactique, du moins pour les populations particulièrement exposées qui seront au cœur de la crise. Plus la pression sera forte, plus nous risquons de voir apparaître des escrocs ou des apprentis sorciers, ou, en tout état de cause, des acteurs n'ayant pas les compétences nécessaires, qui vont produire, soit des produits sans aucune efficacité, comme on en voit aujourd'hui sur Internet, soit des produits dont l'efficacité n'est pas totale. Pour éviter cela, ne pensez-vous pas qu'il est temps que se mette en place un véritable réseau, sous la responsabilité d'une organisation internationale, par exemple l'OMS, qui soit capable de conduire une stratégie de distribution du produit, et de vérifier qu'il soit fabriqué en grandes quantités, non seulement par Roche, mais par des industriels patentés, dans tous les sens du terme, dans le monde entier ? M. Gabriel BIANCHERI : Pour compléter cette question, a-t-on les moyens d'expertise permettant de faire la différence entre le Tamiflu et ses succédanés ? M. Henry-Vincent CHARBONNÉ : Ce qu'a proposé Roche le 18 octobre dernier par la voix de M. Humer, c'est exactement ce que vous venez de décrire, monsieur le président. Roche n'est pas capable de faire face à la demande mondiale, il souhaite mettre en place un réseau d'industriels pour que le produit soit disponible le plus rapidement possible en grandes quantités, à condition, bien sûr, que nous trouvions des entreprises disposant des capacités de production suffisantes. Assumer la réponse à la demande par une offre de qualité est le meilleur moyen d'éviter l'apparition sur le marché d'acteurs qui feraient tout et n'importe quoi. Le risque de contrefaçon existe, mais nous parviendrons à le limiter. Cela dit, même si j'ai beaucoup de respect pour l'OMS, je souligne qu'elle n'est pas un industriel. Pour répondre à la question de M. Guillaume, je dirais qu'il faut que les pays occidentaux donnent leur place aux antiviraux, trop longtemps perçus comme des concurrents du vaccin alors qu'ils sont complémentaires. Oui, nous avons intégré le risque financier, et nous savons qu'à un certain moment, nous allons nous retrouver avec des capacités industrielles excédentaires. Cela dit, nous assumerons notre responsabilité jusqu'au bout. L'essentiel, encore une fois, est de faire face à la demande. M. le Rapporteur : Selon un grand quotidien de ce matin, vous êtes en contact avec plusieurs gouvernements et vous accorderez des licences. S'agit-il de pays qui pourraient être le point de départ de la pandémie, ou de pays occidentaux ? M. Henry-Vincent CHARBONNÉ : Les licences ne concernent pas a priori l'Europe. Nous sommes capables, en Europe, d'assurer la totalité de la chaîne de production. Nous avons été approchés officiellement par Taïwan. Les modalités de coopération restent à préciser. Notre volonté, je le répète, est de préserver la qualité et d'assurer la quantité. M. Gérard DUBRAC : Je suis pharmacien, et je suis dans l'incapacité de m'approvisionner en Tamiflu depuis plusieurs mois. Pour quelles raisons ? M. Henry-Vincent CHARBONNÉ : Notre politique d'allocation du produit pour 2005 a répondu à deux priorités. La première était de disposer de quantités suffisantes pour faire face à la grippe saisonnière classique. La seconde était de pouvoir répondre le plus vite possible aux commandes des États. Pour ce qui est de la France, les autorités ont fait le choix de la transparence sur l'évaluation du risque de pandémie et sur les décisions qu'elles comptaient prendre pour s'y préparer. Ce choix, que je ne critique pas, a eu pour conséquence une explosion de la demande, en raison de l'augmentation des achats de précaution. J'aurais pu choisir de répondre en fournissant les boîtes au fur et à mesure qu'elles étaient commandées. Dans ce cas, l'hiver venu, le risque de pénurie était réel. J'ai fait le choix, que j'assume, de vendre les stocks résiduels de l'hiver précédent et de garder les nouveaux stocks pour pouvoir les mettre à disposition des grossistes au moment de l'arrivée de la grippe saisonnière. M. Gérard DUBRAC : Avez-vous en stock les quantités de traitement qui permettraient de répondre à une pandémie en France ? M. Henry-Vincent CHARBONNÉ : Les stocks dont nous disposons correspondent au nombre de traitements nécessaires pour couvrir une épidémie grippale classique, et même de haut niveau. Cela dit, devant le risque de thésaurisation du Tamiflu, nous réfléchissons, avec la DGS33 et l'AFSSAPS34, sur les moyens de faire en sorte que les personnes qui auront vraiment besoin de Tamiflu puissent y avoir accès. M. le Président : Il faut souligner que si l'on n'agit pas pour éviter la thésaurisation, on constatera un extraordinaire gâchis des stocks, pour une efficacité quasiment nulle. Le Gouvernement a annoncé qu'il comptait mener une stratégie de distribution du Tamiflu et de la prophylaxie. Cela me semble judicieux. L'anarchie dans la consommation créerait de fausses protections, et une surconsommation telle que les industriels ne pourraient pas faire face à la demande. M. Gérard DUBRAC : Une telle surconsommation nécessiterait la complicité des médecins. M. le Président : En cas de pandémie, il sera difficile aux médecins de refuser les ordonnances. M. Henry-Vincent CHARBONNÉ : Je précise que les stocks dont dispose l'entreprise correspondent à l'épidémie de grippe usuelle qui va arriver cet hiver. Les stocks qui seraient utilisés en cas de pandémie sont entre les mains de l'État. M. le Président : Il reste que la population cherchera à se procurer du Tamiflu en vue d'une pandémie, même pendant l'épidémie hivernale. Les choses seront difficiles à gérer. M. Henry-Vincent CHARBONNÉ : C'est bien pour cela que nous réfléchissons aux moyens de faire en sorte qu'il restera toujours des quantités disponibles pour ceux qui en auront le plus besoin, les immuno-déprimés par exemple. M. le Président : Je pense que nous pouvons maintenant en venir aux questions financières. Selon Les Échos, les ventes de Tamiflu seraient de 214 millions d'euros en 2004, de 812 millions en 2005, de 929 millions en 2006, de 673 millions en 2007. Ces chiffres sont surprenants : les États-Unis ont commandé pour un milliard de dollars ; le Parlement français vient de voter quelques centaines de millions d'euros. Vous devriez dépasser le milliard d'euros en 2006 et 2007. Quelle est votre philosophie en la matière ? Je précise que, selon une dépêche que j'ai sous les yeux, vous auriez acheté les droits du Tamiflu en 1996 pour 50 millions de dollars. C'est un bon placement ! M. Henry-Vincent CHARBONNÉ : Cette somme est celle qui a été versée en 1996. Roche paie, chaque année, des royalties sur les ventes. Ensuite, il importe de ne pas confondre le chiffre d'affaires et les bénéfices. Les ventes de Tamiflu devraient être d'environ 800 millions d'euros en 2005. M. le Président : Combien cela représente-t-il par rapport à votre chiffre d'affaires ? M. Henry-Vincent CHARBONNÉ : Une partie du chiffre d'affaires 2005 vient de l'épidémie de grippe, notamment celle qui a sévi au Japon. Nos ventes sont extrêmement variables en fonction de l'intensité des épidémies. À ces ventes, s'ajoutent celles aux États, notamment à la France. Les ventes aux États se font à des prix très réduits par rapport au circuit classique. Le Tamiflu représentera moins de 5 % de notre chiffre d'affaires en 2005 ; il est le 6ème ou 7ème produit. Le chiffre d'affaires de Roche vient surtout de toute une série de produits innovants, notamment dans le traitement des cancers, le cancer du sein en particulier. M. le Président : Quelle est la part de Roche dans la pharmacie mondiale ? M. Henry-Vincent CHARBONNÉ : Environ 4 %. M. le Président : Donc, le Tamiflu représente, en 2005, 0,02 % du marché mondial. M. Henry-Vincent CHARBONNÉ : Oui. Mais puisque vous avez parlé d'effet d'aubaine, monsieur le président, je rappellerai qu'un produit comme le Tahor fait un chiffre d'affaires annuel de 10 milliards de dollars, et correspondant à des traitements qui s'étalent sur 10 ou 15 ans. Le Tamiflu fera un chiffre d'affaires important pendant deux, trois ou quatre ans, après quoi il retombera, fort heureusement, à un niveau beaucoup plus faible. En outre, il exige de notre part de grands investissements, et la mobilisation de nos meilleurs chercheurs au service de nos partenariats. M. le Président : Je vous remercie de votre contribution aux travaux de notre mission d'information. Audition de M. Gérard DUMONT, haut fonctionnaire de défense au ministère de la santé et des solidarités, en charge de la question des masques de protection Présidence de M. Jean-Marie LE GUEN, Président M. le Président : Notre mission, monsieur Dumont, a l'habitude de travailler devant la presse. Mais il se trouve que nous attendons la publication du plan gouvernemental et que nous ne voulons pas vous mettre en porte-à-faux. Notre réunion se déroulera donc à huis clos. Le but de notre travail est à la fois d'exercer un contrôle parlementaire sur la préparation du plan pandémie et de jouer un rôle de médiation vis-à-vis de l'opinion publique. En ce moment, nous travaillons sur les moyens médicaux disponibles et sur leur stockage, qu'il s'agisse des vaccins, des vaccins, des anti-viraux et des masques. C'est sur ce dernier point que portera votre audition, puisque vous êtes en charge de cette question auprès du Ministre de la santé et des solidarités. Cette audition se déroulera en deux temps : l'état de la technique et la stratégie d'emploi, puis les problèmes industriels et logistiques. Nous avons bien compris qu'il existait différentes catégories de masques. Je vous poserai donc d'emblée plusieurs questions. Pourquoi choisir telle catégorie de masques plutôt qu'une autre ? Le FFP 2 - présenté comme le « haut de gamme » - n'est-il vraiment utilisable que trois heures ? Quelle en est la doctrine d'emploi ? M. Gérard DUMONT : Il existe en effet deux grandes catégories de masques : les masques filtrants et les masques anti-projections. Les premiers filtrent dans les deux sens et permettent d'éviter tout contact avec les malades. Il y a trois niveaux de filtration : FFP 1, FFP 2 et FFP 3. Les experts recommandent, dans le domaine de la santé, les FFP 2, a fortiori les FFP 3 et, à défaut, les FFP 1. L'usage de ces masques est limité dans le temps : les règles européennes d'homologation, appliquées en France, prévoient qu'au bout de huit heures, un masque doit être jeté. M. le Président : Pour quelle raison ? M. Gérard DUMONT : Comme il n'y a pas de soupape sur les masques utilisés dans le domaine de la santé, il y a saturation du filtrage et la respiration devient très désagréable. Ces masques deviennent, en plus, humides et dangereux. On conseille aux médecins de les jeter plus souvent et de les manipuler avec précaution : il ne faut ni les toucher ni les retirer puis les remettre pendant qu'ils sont posés sur la bouche ; sinon, il faut les jeter et en changer. A défaut, on risque de disperser les microbes. Ce ne sont pas des masques « tout public ». Ils nécessitent une formation préalable et une grande vigilance. Ils sont recommandés pour les professionnels de santé qui approchent les malades et par tous les professionnels qui approchent des publics nombreux et non triés : les pompiers, et tous ceux en contact avec du public. M. Pierre HELLIER : Pour jeter le masque, il faudra donc faire comme en salle d'opération, c'est-à-dire le prendre par l'arrière, ne pas toucher l'avant et le jeter très précautionneusement dans un conteneur spécifique. Mais je ne comprends pas pourquoi on n'utilise pas le même type de masque pour le malade. Il est prévu que ce dernier porte un masque beaucoup plus simple et léger mais à mon avis moins efficace, avec, en plus, une certaine perméabilité sur les côtés. M. Gérard DUMONT : Pour les malades, on préconise les masques dits chirurgicaux, anti-projections, les meilleurs protégeant à hauteur de 95 à 98 % des projections du malade. Il s'agit en l'occurrence de protéger l'environnement du malade, son médecin, ceux qui le soignent, sa famille. A condition de ne pas s'approcher de trop près, il est suffisant pour prévenir la propagation du virus, même s'il est sûr qu'on n'échappera pas à quelques contaminations. L'expérience du SRAS au Canada a montré qu'un masque anti-projections éliminait une très grande part des contaminations. M. Pierre HELLIER : Je me méfie des protections latérales de ces masques et des risques de fuites vers le bas comme vers le haut. N'est-il pas possible d'équiper des mêmes masques FFP2 les personnes susceptibles d'être contaminées et celles susceptibles de contaminer ? M. Gérard DUMONT : Le masque FFP 2 est assez inconfortable, alors que le masque chirurgical se porte plus facilement et plus longtemps ; en outre, le malade n'a pas besoin d'être protégé des autres puisqu'il est déjà porteur du virus. Enfin, la différence de prix est considérable : moins de 4 centimes d'euros l'unité pour les masques chirurgicaux, contre environ 42 centimes pour les masques filtrants. Équiper tout le monde de masques filtrants entraînerait une dépense considérable pour un bénéfice faible. M. Gérard CHARASSE : Peut-on réutiliser les masques ? M. Gérard DUMONT : Certains experts pensent qu'on peut les réutiliser après les avoir placés au micro-ondes, mais nous n'avons aucune garantie sur la qualité du produit après son passage au micro-ondes. Nous sommes en train d'examiner avec l'industrie textile comment fabriquer des masques lavables, pour tous publics, dont le niveau de protection soit suffisant pour des personnes qui ne sont pas malades et qui veulent sortir en période de pandémie, sur le modèle de ce qui se fait en Asie, où les gens portent des masques lorsqu'ils sortent. M. Rudy SALLES : Quelle est la durée de vie du masque chirurgical ? M. Gérard DUMONT : Une journée au maximum. M. Pierre HELLIER : Dans l'hypothèse où le malade peut contaminer son environnement, on ne devra rentrer dans sa chambre qu'équipé. Car sur l'oreiller, par exemple, il reste des virus. M. Gérard DUBRAC : Comment va-t-on gérer le circuit des masques usagés ? M. Gérard DUMONT : Dans un premier temps, il sera conseillé aux médecins et aux familles de les jeter dans des sacs fermés hermétiquement. Mais un problème se poserait si le volume des déchets usagés devenait important. On n'a pas aujourd'hui de solution toute prête. Il faudra sans doute prévoir de les incinérer, mais les produits chimiques qui entrent dans leur fabrication constituent un facteur de risque. M. Gérard DUBRAC : Le plan pandémie prévoit-il un circuit de ramassage particulier ? M. Gérard DUMONT : Pas pour l'instant. Ce sera dans une annexe du plan, qu'il reste à élaborer. Mme Bérengère POLETTI : Vous envisagez, au moment de la pandémie, de faire porter, dans les hôpitaux, des masques chirurgicaux aux malades touchés de manière avérée, et des masques filtrants aux soignants a priori sains. Il me semble qu'on devrait faire porter aussi aux malades des masques efficaces. M. Gérard DUMONT : Le masque chirurgical est considéré comme efficace. Les chirurgiens le portent quand ils se penchent sur des plaies ouvertes, et ils n'infectent pas les malades. M. Gérard DUBRAC : Mais les chirurgiens ne toussent pas et n'ont pas 40° de fièvre ! Mme Bérangère POLETTI : On demandera aux soignants de changer leur masque, qui est plus cher et plus efficace, toutes les trois heures, alors que les malades ne changeront le leur qu'une fois par jour. M. Gérard DUBRAC : Si les patients toussent toute la journée, leur masque risque d'exploser ! M. Gérard DUMONT : Le masque chirurgical sera changé plus souvent si nécessaire, mais le fait qu'il soit légèrement infecté ne posera pas de problème au malade, puisqu'il est déjà atteint par le virus. M. Gérard DUBRAC : Peut-on envisager le port du masque dans la rue, en prévention ? M. Gérard DUMONT : Ce sera également recommandé. Mais il s'agira d'un troisième type de masque : un masque anti-projections, qui pourra être stérilisé et réutilisé. En effet, si on voulait donner à tous les Français des masques jetables, il en faudrait 8 à 10 milliards, et on produirait des montagnes de déchets ! Ne créons pas un problème que nous ne saurions pas résoudre ! L'usage de masques réutilisables, comme ceux que portent les Asiatiques pour se promener, aller travailler et faire leurs courses, est à encourager. Les industriels du textile travaillent sur des prototypes de masques bon marché, facilement stérilisables et vendus partout. M. Pierre HELLIER : J'aurais préféré que les masques FFP 2 soient utilisés à la fois par les soignants et par les malades. Quant aux masques de la rue, ils devront, en effet, être assez simples et pouvoir être désinfectés sommairement. M. Gérard DUMONT : Les médecins consultés nous disent que la double protection - celle du malade, d'une part, celle du médecin et de l'entourage du malade, d'autre part - sera efficace. Je précise que la plupart des malades seront soignés chez eux, et non à l'hôpital. Vous suggérez que médecins et malades portent le même masque filtrant. Le problème est que son utilisation n'est pas simple et qu'on n'en aura pas assez : la production mondiale de masques est de l'ordre de 600 millions. Sachez aussi qu'un masque FFP 2 mal porté est moins efficace qu'un masque chirurgical. Mme Bérengère POLETTI : Pourriez-vous nous parler stockage et logistique ? Comment envisagez-vous l'acheminement de ces masques ? Quel sera leur mode de distribution ? M. Gérard DUMONT : L'approvisionnement en masques pose des problèmes assez complexes. Le ministère de la santé a commandé à ce jour 200 millions de masques filtrants, qui sont pour l'essentiel importés, et 250 millions de masques chirurgicaux. Les livraisons son en cours. Jusqu'ici, l'industrie mondiale produisait environ 600 millions de masques filtrants par an. La France, à elle seule, en a commandé 200 millions sur le marché international. Malgré tout, les prix ont baissé. Tous les établissements de soins ont été sollicités pour stocker des quantités importantes de masques, 100 millions environ. Par ailleurs, nous travaillons avec le ministère de la défense pour stocker des masques sur une dizaine de sites militaires, et avec le ministère de l'intérieur, qui dispose de quelques lieux de stockage. Les acheteurs publics autres que le ministère de la santé, ou gérant des services publics, peuvent évidemment s'approvisionner auprès de l'UGAP35 aux mêmes prix que ceux consentis au ministère de la santé. Mais chacun, que ce soit l'armée, la police ou les pompiers, stockera des masques pour son propre compte. Nous avons commencé à discuter avec les associations d'élus locaux pour utiliser le réseau des écoles. Celles-ci, qui seront fermées en cas de pandémie, pourraient servir de lieux de stockage de masques dans chaque quartier, au plus près des médecins qui pourront ainsi se procurer, sans trop de déplacements, les masques nécessaires à leur protection lors de leurs visites. Dans les hôpitaux, la distribution se fera à l'intérieur du système hospitalier lui-même ; elle ne devrait pas poser de problèmes. Pour les masques chirurgicaux, il y aura à la fois un stockage hospitalier, stratégique, et une mise à disposition à travers le réseau des pharmacies, qui pourront être alimentées par les grossistes répartiteurs. En même temps qu'ils distribueront le Tamiflu, ils distribueront les masques chirurgicaux. Encore faut-il qu'il n'y ait pas de mouvements rendant nécessaire une protection policière accrue : dans ce cas, il faudra trouver un autre système de distribution. M. Gérard DUBRAC : Il existe, autour des centrales nucléaires, des réseaux de distribution de comprimés d'iode. Ne pourrait-on pas les utiliser ? M. Gérard DUMONT : Des plans, en effet, ont été mis en place autour des centrales nucléaires. Sur le reste du territoire, les préfets ont été chargés d'élaborer des plans de distribution, mais tous ne l'ont pas fait. Remarquez, au surplus, qu'entre la distribution d'un comprimé, un jour donné, et la distribution de masques pendant douze semaines, la logistique n'est pas la même. Il faudra éviter à tout prix le gaspillage pour tenir sur la durée. L'année dernière, nous avons procédé à des simulations et nous nous sommes aperçus qu'en quelques semaines, il n'y avait plus de masques et que les médecins travaillaient sans aucune protection. Nous devrions avoir des quantités suffisantes, sauf mauvaises surprises, en 2006 ou en 2007. Si la pandémie se produit plus tôt, il y aura un rationnement. Tous les achats effectués par le ministère de la santé sont livrables pour l'été prochain. Les autres administrations ont à peine commencé leurs achats. A partir du mois de janvier, nous allons développer la production, en France, de masques filtrants comme de masques chirurgicaux. En effet, il va de soi qu'en cas d'événements infectieux graves à l'échelle mondiale, les exportations s'arrêteront. Or, la production française étant traditionnellement très faible, de l'ordre de quelques mois de consommation en période très calme, il faut mettre en place une industrie française du masque. Nous avons donc contacté quelques industriels qui commenceront à fabriquer massivement des masques. L'objectif est de parvenir, dans l'année 2006, à produire en France 400 000 masques filtrants - en travail continu, sept jours sur sept, 24 heures sur 24. Les usines ouvriront les unes après les autres. M. Pierre HELLIER : Les communes, les conseils généraux ou les maisons de retraite se demandent si on leur fournira des masques ou si elles devront en acheter. Quelle est la procédure prévue ? M. Gérard DUMONT : Tous les services publics et les structures privées assurant des services au public ont exprimé leurs besoins. Globalement, il faudrait un stock national de 600 millions de masques filtrants. On est en train de le constituer, moitié par des importations, moitié par des fabrications françaises. Cela dit, il est probable que d'autres besoins vont apparaître. Ainsi, il me semble, pour avoir été secrétaire général d'une ville, que les besoins des collectivités locales ont été sous-estimés. Il ne s'agit pas d'équiper toute la population, car ce serait un gaspillage ruineux, mais de protéger ceux qui ont besoin de l'être en raison de leur métier - contact avec un public nombreux et non trié, contact avec des personnes malades. L'industrie française sera rapidement en mesure de fabriquer des masques à des prix raisonnables en quantités suffisantes : si la pandémie n'arrive pas trop vite, on sera capable d'équiper tous ceux qui auront besoin de masques filtrants. M. Gérard CHARASSE : Qui réglera l'addition ? L'État ? Demandera-t-on à chacune des administrations de participer au financement de l'opération ? M. Gérard DUMONT : Le principe adopté est que l'utilisateur est le payeur. Notez cependant que le principal utilisateur sera le monde de la santé, pour qui le payeur sera l'assurance maladie. In fine, c'est elle qui aura la charge d'équiper les médecins, les infirmières, les ambulanciers. C'est d'ailleurs par l'intermédiaire du fonds de concours de l'assurance maladie que sont financés les stocks du ministère de la santé. Chacun des autres ministères paiera pour son compte. Il en sera de même des entreprises, privées, publiques ou semi-publiques qui achèteront les masques sur leur propre budget. Le monde de la santé devrait consommer environ 300 millions de masques filtrants, et sans doute plus de 500 millions de masques chirurgicaux. Il restera donc 300 millions de masques filtrants disponibles, même si ce chiffre devrait rapidement augmenter au fur et à mesure que les entreprises ou les collectivités locales prendront conscience qu'un peu de protection ne fait pas de mal. M. Pierre HELLIER : Si pandémie il y a, elle se produira dans une zone circonscrite, qui sera isolée. A l'intérieur de cette zone, la distribution de masques devra être rapide et massive, comme d'ailleurs celle de Tamiflu. Or, il y aura en même temps des mesures sévères de restriction des déplacements. Comment fera-t-on ? M. Gérard DUMONT : C'est pour cette raison que nous avons prévu un stockage décentralisé important. M. Gérard DUBRAC : Est-il prévu de désinfecter les locaux ? M. Gérard DUMONT : Non, pas pour la grippe, car, d'après les experts, le virus n'aurait pas une durée de vie très longue. On a conseillé néanmoins aux médecins d'aérer soigneusement leur cabinet, de nettoyer leur matériel et de se laver les mains le plus souvent possible. Mme Bérangère POLETTI : Comment sont informés les professionnels de la santé sur le terrain ? J'imagine qu'ils doivent déjà disposer de certains éléments dans leur presse spécialisée. Ont-ils demandé à disposer de stocks ? Se sont-ils renseignés pour obtenir des masques ou des antiviraux ? M. Gérard DUMONT : Ils sont informés à la fois par l'Ordre de médecins, par l'INPES36 qui a diffusé un document intitulé « Repères pour votre pratique » et par la presse spécialisée, qui publie quasi quotidiennement toutes les informations nécessaires. Nous recevons aussi beaucoup de coups de téléphone ou de méls. Le site Internet du ministère donnera le plan de lutte, les conseils pratiques et les adresses des fournisseurs. L'Ordre des médecins et le directeur général de la santé ont recommandé aux médecins, en dehors même du cadre de la pandémie grippale, de prendre l'habitude de mieux se protéger, et de stocker des kits de protection permettant d'intervenir au début d'un épisode infectieux quel qu'il soit, par exemple une alerte SRAS. Le rapport de Didier Raoult sur le bioterrorisme37 a établi qu'un problème infectieux majeur ne manquera pas de survenir dans le monde dans les années qui viennent ; mais on ne sait ni quand, ni où, ni à partir de quels virus. Lorsque l'on passera au stade de la pandémie, les stocks constitués par le ministère de la santé seront distribués gratuitement à tous les professionnels. M. Pierre HELLIER : Pourrait-on avoir les documents qui ont été envoyés aux médecins ? M. Gérard DUMONT : Je vous les remettrai en partant. Mme Bérengère POLETTI : Quel est le niveau d'information des élus locaux sur ces questions ? M. Gérard DUMONT : Nous avons commencé à prendre des contacts avec eux afin de leur donner les informations nécessaires. Nos contacts n'ont pas toujours été fructueux avec les associations nationales, mais cela se corrigera très vite. Il faut absolument que le réseau des collectivités locales participe activement à la mise en œuvre du plan : il y a des moyens logistiques, des moyens humains - les milliers de fonctionnaires municipaux, départementaux et régionaux ont une grande capacité de dévouement - dont les fonctionnaires parisiens n'apprécient pas toujours très bien l'importance. M. Pierre HELLIER : Les préfets connaissent bien, eux, ce réseau local. Il faudrait aussi penser aux différentes structures, comme les coordinations gérontologiques, qui sont très présentes sur le terrain et capables de diffuser rapidement informations et matériels, ou comme les services de soins infirmiers à domicile. Les préfets sont en train de recenser toutes les mesures à prendre et l'information passera vers les élus locaux. Mais actuellement, elle n'est pas passée. M. Gérard DUMONT : Pas très bien, en effet. M. Jérôme BIGNON : Pour le moment, c'est zéro ! Mais, pour avoir abordé le sujet au sein de mon conseil municipal, j'ai la conviction que les élus locaux ne veulent pas savoir. Il faut donc que les préfets s'impliquent et informent les associations et les maires. Il y a tout de même 500 000 élus locaux en France. Dans les petites communes de moins de 500 habitants, on ne compte pas beaucoup de fonctionnaires territoriaux et il faudra utiliser le réseau des élus de base pour « irriguer » tout le territoire. M. Gérard DUBRAC : Comment se fera la distribution des médicaments ? Par prescription médicale et à travers le circuit pharmaceutique ? M. Gérard DUMONT : Pour l'instant, les négociations ont eu lieu avec les représentants du réseau des officines et avec les distributeurs de médicaments, qui se déclarent prêts à jouer leur rôle en période pandémique. Cela dit, on peut penser que ce réseau aura quelques problèmes si des convoitises très fortes s'exercent sur les stocks d'antiviraux. Même si nous en avons suffisamment en France, il faut savoir que nous sommes entourés de très nombreuses populations, à l'Est et au Sud, qui en seront totalement dépourvues. Des personnes mal intentionnées et bien équipées pourraient tenter de s'emparer d'une partie du stock pour l'exporter sauvagement. On a donc prévu un « plan B », qui restera confidentiel, et dont l'objectif sera de renforcer la protection existante. On peut craindre que la société n'évolue vite vers un grand désordre. Un autre problème nous préoccupe, c'est celui du fonctionnement, en mode très dégradé, de l'ensemble des services à la population. Avec un nombre important de malades, qui pourrait atteindre 10 à 12 millions au pic de la pandémie, il n'y aura plus d'école, les transports seront perturbés et de nombreuses personnes ne pourront plus aller travailler. Sans compter tous ceux qui auront peur, même parmi les médecins. On l'a vu pour le SRAS. Il faudra s'organiser avec des taux d'absentéisme qui pourront atteindre les deux tiers. Personne ne sait vraiment comment faire. C'est ça, le problème de la pandémie : tout le monde est touché en même temps. Ceux qui ont connu la grippe espagnole de 1918 le disent bien. Et ceux qui d'habitude répondent présents, quelles que soient les circonstances, risquent de faire défaut : pompiers, médecins, infirmières, policiers... Mme Catherine GENISSON : Cela suppose d'être très économes lorsqu'on mettra en place le plan et qu'on prévoira la mise à disposition de personnels supplémentaires. Il faudra trouver des réserves. M. le Président : Savez-vous où nous en sommes pour ce qui est des stocks d'antibiotiques, de bouteilles d'oxygène, de vaccins pneumocoques, etc. ? M. Gérard DUMONT : Cette question sort de mon domaine de compétence. Je peux malgré tout vous dire que, dans le cadre du plan Biotox, nous avons fortement développé le nombre de respirateurs et les stockages d'oxygène pour faire face à des évènements terroristes. Ces moyens sont disponibles pour la réanimation en cas d'évènements sanitaires classiques. M. le Président : Deux questions, Monsieur, par lesquelles nous aurions dû commencer, veuillez nous excuser : quelle est votre formation ? Comment travaillez-vous avec les autres ministères ? M. Gérard DUMONT : Je suis issu du corps préfectoral. J'ai travaillé comme sous-préfet, comme secrétaire général d'une grande ville, comme directeur d'agence régionale de l'hospitalisation dans une grande région pendant six ans et demi. Depuis deux ans et demi, je suis chargé des questions de défense civile auprès de deux ministres, celui de la santé et celui du travail. La coordination des hauts fonctionnaires de défense est assurée par le secrétaire général de la défense nationale. Nous sommes en contact quasi quotidien avec les différents ministères et les services du Premier ministre. M. le Président : Pour mettre au point le plan pandémie ? M. Gérard DUMONT : Non, dans le cadre de la lutte contre le terrorisme et pour préparer les plans de défense en général. Le plan pandémie est tout à fait particulier, dans la mesure où il n'est lié ni à la défense ni au terrorisme. Mais le ministre de la santé de l'époque avait souhaité que la coordination ministérielle soit assurée par le secrétaire général de la défense nationale en raison de ses compétences en matière de planification et de l'importance des problèmes d'ordre public dans le cadre d'un plan pandémie. M. Pierre HELLIER : En dehors des masques, est-il prévu de doter les professionnels de santé de blouses, de gants, etc. ? M. Gérard DUMONT : L'UGAP a provisionné certains produits accessoires de ce type. Les masques posaient un problème un peu particulier dans la mesure où il faut tout importer de très loin et où il est urgent d'en fabriquer en France. Ce n'est pas le cas des autres produits, dont la plupart sont récupérables et stérilisables. Mais il faudra penser également aux solutions de stérilisation. M. le Président : Avez-vous organisé l'équivalent d'un concours Lépine pour la mise au point de systèmes D susceptibles d'assurer un minimum de protection ? Dans la presse américaine, j'ai vu des photos montrant des personnes munies de ponchos et de masques qui ressemblaient à des masques de plongée. De telles solutions, simples, seraient à même de rassurer la population. M. Gérard DUMONT : Les industriels du textile sont imaginatifs et sont en train de mettre au point des prototypes de masques en tissu, d'un usage très simple, à des coûts de fabrication très faibles et surtout qu'on pourrait fabriquer avec des matériels de production qui existent en France. M. le Président : Pourrait-on avoir des contacts avec eux ? M. Gérard DUMONT : Oui, mais nous n'en sommes qu'à la qualification technique de ces prototypes. Les masques en tissu existent en Asie. Mais si on pouvait les produire en France avec des machines françaises, ce serait mieux. On pourrait ainsi garantir l'approvisionnement, ainsi qu'un niveau de qualité constant. M. Pierre HELLIER : A-t-on prévu quelque chose contre la contamination oculaire des professionnels de santé ? M Gérard DUMONT : Oui. Le port de lunettes, quelles qu'elles soient, est chaudement recommandé dans le document qui a été distribué aux médecins. Certaines, peu chères, se trouvent chez tous les fournisseurs et ont l'avantage d'être quotidiennement stérilisables. Il faudra également développer les solutions hydro-alcooliques, de préférence au port de gants, qui peuvent être source de contamination : il est rare que les médecins lavent leurs gants entre deux malades... M. le Président : Cela contribuera à la lutte contre les maladies nosocomiales ! Mme Catherine GENISSON : Ma question concerne la réanimation. On sait que les atteintes pulmonaires sont une des complications dramatiques de la grippe aviaire et nécessitent le plus souvent une hospitalisation en service de réanimation. Or on ne s'improvise pas réanimateur. A-t-on prévu des formations, des exercices ? M. Gérard DUMONT : Tous les plans de défense prévoient, en cas de catastrophe, le déclenchement du « plan blanc ». Les blocs opératoires seront alors fermés, sauf pour les urgences absolues, et toutes les salles de réveil se transformeront en salles de réanimation avec l'assistance d'anesthésistes. L'essentiel du système chirurgical sera affecté à la réanimation. M. Rudy SALLES : On a trop rapidement évoqué les masques de promenade. Or ce type de masque me semble très important, dans la mesure où la contamination sera causée par des gens qui ne se savent pas encore atteints et par d'autres qui ne savent pas qu'ils ont en face d'eux des malades en puissance. Ne pensez-vous pas qu'il faudrait généraliser ces masques ? Est-on d'ailleurs en mesure de le faire ? M. Gérard DUMONT : Sur le plan industriel, il est possible de fabriquer rapidement assez de masques stérilisables en tissu pour tous les Français. Nous allons mettre en contact les réseaux de la grande distribution avec les quelques fabricants français de masques en tissu, afin qu'ils prévoient un dispositif commode de mise à disposition du public : concrètement, à chaque caisse de supermarché, un présentoir de masques bon marché permettant de protéger une famille pendant une semaine. L'idée, c'est : « une famille, une semaine, un euro ». Pour le moment, je l'ai déjà dit, nous en sommes au stade de la qualification médicale. Les experts nous diront si les prototypes ont un niveau de protection convenable. D'après les premiers éléments, il vaut mieux porter ces masques que de ne pas les porter. Si on obtient une filtration de 90 % et si les gens respectent un éloignement minimum les uns des autres - un principe de base de la prophylaxie : rester à deux mètres les uns des autres - on réduira fortement le problème sans produire de déchets. M. Jérôme BIGNON : Quand cela sera-t-il prêt ? M. Gérard DUMONT : A mon avis, certains industriels disposeront des machines nécessaires à partir de janvier prochain. M. le Président : On relancera ainsi notre industrie textile ! M. Gérard DUMONT : Les masques filtrants fabriqués en France seront au même prix que les masques chinois, le coût de la main d'œuvre étant quasiment négligeable : tout est presque automatisé. Un industriel qui s'apprête à fabriquer 40 millions de masques nous a dit qu'il embaucherait 120 personnes. Si on fait une projection, avec 400 millions de masques, 1 200 emplois pourraient donc être créés. Et je parle uniquement des masques filtrants. M. Gérard CHARASSE : On n'a pas parlé de la réaction des individus, sur le plan psychologique notamment. Imaginez que les passants croisent quelqu'un qui se promène sans son masque... M. Gérard DUMONT : Je ne sais pas... Mme Catherine GENISSON : La personne pourrait être prise à parti, je ne plaisante pas ! M. le Président : La distance sociale, soit deux mètres, devrait suffira à écarter tout danger. On s'éloignera de celui qui ne porte pas de masque. Monsieur Dumont, je vous remercie. Audition conjointe de fabricants de masques : M. Frédéric BIFFAUD, président de 3M Santé, M. Philippe BOELE, directeur industriel de 3M France, M. Franck AJUELOS, conseiller scientifique de la gamme asepsie de 3M France, M. Roland FANGEAT, président de Bacou-Dalloz Plaintel Présidence de M. Jean-Marie LE GUEN, Président M. le Président. Messieurs, je vous remercie d'avoir accepté de venir témoigner devant nous. La mission d'information a pour tâche d'évaluer la préparation de la France à une éventuelle pandémie, et donc de contrôler l'action du Gouvernement dans ce domaine, tout en assurant la transparence de l'information vis-à-vis de nos concitoyens. Nous concentrons actuellement nos travaux sur l'analyse des dispositifs médicaux mis en place. Nous avons déjà entendu les représentants des laboratoires pharmaceutiques fabriquant des antiviraux grippaux, nous entendrons tout à l'heure les fabricants de vaccins. Nous vous interrogeons, vous, en tant que fabricants de masques. Pouvez-vous présenter vos produits, nous préciser vos capacités de production et les éventuelles difficultés que vous rencontrez ? M. Roland FANGEAT : Je suis le président d'une petite société installée en Bretagne, à Plaintel. Nous sommes les seuls fabricants de masques en France. Notre spécialité n'est pas spécifiquement médicale : elle concerne la protection de l'homme au travail : les masques FFP 1, FFP 2 et FFP 3 que nous produisons sont régis par la directive européenne 89/686 sur les équipements de protection individuelle et la norme EN 149. Notre société, qui appartient au groupe français Bacou-Dalloz, un des leaders mondiaux dans cette spécialité, emploie 120 personnes et sa capacité de production est de 30 à 40 millions de masques par an. Elle est plus particulièrement spécialisée dans la branche respiratoire. M. Frédéric BIFFAUD. Je suis le directeur général des laboratoires 3 M Santé, qui font partie du groupe 3 M. Je suis venu accompagné du directeur industriel de 3 M France, M. Philippe Boele, qui supervise l'ensemble de nos unités de production, et de notre conseiller scientifique dans le domaine des masques de protection respiratoire, M. Franck Ajuelos. Nous offrons aux professionnels de santé, hospitaliers et extra-hospitaliers, différentes sortes de produits dans le domaine du médicament et des dispositifs médicaux. Les masques que nous commercialisons dans le secteur hospitalier ont un statut de dispositif médical. Il s'agit des masques FFP 1, FFP 2 et FFP 3. Nous n'avons pas d'unités de production en France. Nos unités de production se trouvent en Europe, aux États-Unis et dans d'autres secteurs du monde, notamment en Asie. M. le Président : Avec quelle matière première travaillez-vous ? M. Roland FANGEAT : Pour les masques FFP 1, FFP 2 et FFP 3, nous utilisons un matériau filtrant tel que le polyéthylène ou le polypropylène, qui subit un traitement électrostatique lui permettant d'attirer les charges. L'extérieur des masques peut être fait avec des matériaux de type polyester qui, une fois thermoformés, permettent d'obtenir des masques en forme de coquille - et non pas plats. Ces masques sont régis par la directive européenne 89/686 et la norme EN 149. M. le Président : Avez-vous des difficultés pour vous procurer de la matière première ? M. Roland FANGEAT. Des difficultés commencent à apparaître au niveau mondial. Les normes européennes fixent des exigences de qualité que des fabricants non européens ne sont pas tenus d'appliquer. Quand on n'est pas soi-même fabricant de ces matériaux de base, on risque de se heurter, à terme, à des problèmes d'approvisionnement. Si une crise se déclenchait et que tous les pays demandaient des masques, nous rencontrerions certainement des difficultés. M. le Président : Ce sont des produits issus de l'industrie chimique ? M. Roland FANGEAT : Ce sont des produits non tissés, fabriqués schématiquement selon des méthodes papetières, ce qui permet d'aller très vite. Par rapport aux besoins actuels du marché, la capacité de production est largement suffisante. Mais on peut prévoir qu'en période de crise, la demande mondiale serait multipliée au moins par dix et que des problèmes se poseraient. M. le Président : Je voudrais savoir si vous vous contentez de mettre les masques en forme, ou si vous fabriquez vous-même la structure non tissée. M. Roland FANGEAT : Nous fabriquons uniquement le masque, et achetons la matière première en Allemagne. Nous n'avons pas de fournisseur français. M. Philippe BOELE : Ce n'est pas le cas de 3M, qui fabrique les fibres de base. Cette étape est intégrée au processus de fabrication des masques. M. le Président : Parlez-nous des commandes que vous a passées le gouvernement français. Avez-vous assez de stocks de matière première pour les honorer ? M. Roland FANGEAT : Pour l'instant, le gouvernement français a passé une première commande de 50 millions de masque. Je pense que les sociétés concernées n'auront pas de problème pour s'approvisionner en matière première. Mais en cas de pandémie, on passerait à 500 millions de masques, rien que pour la France. Comme cette pandémie touchera les autres pays, la quantité nécessaire au niveau mondial sera beaucoup plus importante. M. Alain CLAEYS : On nous a dit que si la crise était avérée, les exportations depuis les pays producteurs, comme la Chine, se tariraient. Or, actuellement, nous sommes dépendants de ces exportations. On nous a dit aussi qu'on était en train de réfléchir au moyen de produire en France 200 millions de masques. Où en est-on ? Qu'est-ce que cela suppose au niveau de l'outil de production ? M. le Président : Prévoit-on de créer des machines à mettre en forme les masques ? S'intéresse-t-on également à la fourniture de matière première ? M. Roland FANGEAT : Actuellement, Bacou-Dalloz Plaintel est le seul producteur sur le territoire français, avec 120 salariés et une production de 30 à 40 millions de masques par an. Si une pandémie se déclarait aujourd'hui, il est évident que toutes les sociétés spécialisées du monde fabriqueraient d'abord pour les pays où elles sont implantées, et donc pas pour la France. Chaque pays devant se contenter de sa production nationale, le nôtre n'aurait pas les moyens de s'équiper. D'où une réflexion nécessaire sur l'implantation, en France, d'autres unités de fabrications. M. le Président : C'est pourtant Bacou-Dalloz qui a été retenue dans le cadre de l'appel d'offres du gouvernement français. M. Roland FANGEAT : La société Bacou-Dalloz a reçu la commande de 12 millions de masques, sur les 50 millions faisant l'objet de l'appel d'offres. Sept autres fabricants, qui ne sont pas français, ont été contactés. Nous n'avons pas remporté l'intégralité du contrat. M. Alain CLAEYS : Aujourd'hui, en France, à combien d'unités s'élève la production ? M. Roland FANGEAT : Nous pouvons fabriquer au maximum 30 à 40 millions de masques par an. M. Marc JOULAUD : Exportez-vous ? M. Roland FANGEAT : Oui. M. Marc JOULAUD : Si on vous demande de produire davantage, êtes-vous à même de trouver la matière première nécessaire ? M. Philippe BOELE : Il y a deux grandes étapes dans la production de masques : la fabrication des fibres extrudées d'une part, le formage de masque (configuration) d'autre part. Il se trouve que, sur le même site de production 3M en Angleterre, nous disposons des deux technologies. Si l'on veut disposer de capacités supplémentaires de formage de masques, il faut compter six à huit mois. Pour accroître les capacités de fabrication de fibres, ce qui nécessite de créer des équipements plus complexes et plus onéreux, il faut en compter dix-huit, en y incluant l'étape de qualification. Comment sécuriser l'approvisionnement en fibres, l'élément déterminant ? Ma recommandation serait de focaliser le travail de réflexion en amont de la chaîne. Cela dit, nous n'avons pas été sollicités. Nous avons été consultés dans le cadre d'une mission interministérielle d'investigation et de préparation du plan « pandémie », nous avons reçu dans nos établissements deux représentants de l'administration, mais le débat a porté essentiellement sur la fin de la chaîne, c'est-à-dire sur le produit fini. Il faudrait donc réfléchir aussi avec les acteurs qui se trouvent en amont, notamment les chimistes qui fabriquent les polymères. M. le Président : Cela me paraît, en effet, évident. Si j'ai bien compris, Monsieur Fangeat, l'entreprise française Bacou-Dalloz configure le masque, sa production est de 40 millions par an mais le plan français porte sur 200 millions. C'est bien cela ? M. Roland FANGEAT : Jusqu'à 200 millions, il n'y a pas de problèmes. Mais les chiffres qui ont été avancés sont encore plus élevés. Mme Bérengère POLETTI : Au cours de l'audition précédente, nous avons appris qu'en 2006, on pourrait fabriquer 400 millions de masques filtrants en France. M. le Président : Les contrats ont-ils été passés ? M. Roland FANGEAT : Non. M. le Président : Avez-vous acheté la matière première ? M. Roland FANGEAT : Non. M. le Président : Je reviens à 3 M producteur en Grande-Bretagne. Vous nous avez bien dit que, pour construire une ligne de configuration de masques, il faudrait six mois, et pour construire une ligne de fabrication de fibre, il en faudrait dix-huit. M. Philippe BOELE : Nous le savons, car nous sommes en train d'en construire une en Asie. M. le Président : Quelles sont, en Europe, les capacités de production de la matière première ? On sait que les masques seront la première et la plus facile des réponses apportées en cas de crise, laquelle risque de prendre très vite une dimension européenne, voire mondiale. Disposez-vous d'une certaine élasticité de production ? M. Frédéric BIFFAUD : La réponse est non. M. Roland FANGEAT : Dans un contexte où seule la France serait concernée, on arriverait à produire 200 ou 300 millions de masques. Dans un contexte différent, ce ne serait pas possible. M. le Président : Parlons au moins de l'Europe. Aujourd'hui, vous n'êtes pas certains d'avoir la matière première pour répondre à la demande ? M. Philippe BOELE : Le vrai débat devrait être interindustriel pour porter sur toute la chaîne d'approvisionnement si l'on veut répondre aux questions qui vont se poser et établir un plan. M. le Président : Avez-vous été saisis par la Commission européenne ? M. Philippe BOELE : Non. M. Pierre HELLIER : Quelle matière première permet de fabriquer les fibres ? M. Philippe BOELE : Au départ, le pétrole, bien sur, comme toutes les matières plastiques. Ensuite des étapes classiques de pétrochimie qui se concluent par l'obtention de monomères, type propylène ou éthylène. M. Pierre HELLIER : Où ça ? M. Philippe BOELE : En Allemagne, en France, classiquement. Enfin, on transforme les produits obtenus en matière plastique après polymérisation. Ils prennent alors la forme de granulés. M. Pierre HELLIER : Qui le fait ? M. Philippe BOELE : Des chimistes, comme Total ou Rhodia. Deux scénarios sont alors possibles. Soit le fabricant de masque s'adresse à un producteur de fibres, lesquelles se présentent alors sous forme de trames. C'est alors l'industrie textile qui entre en jeu, pour fabriquer la matière non tissée. Soit on dispose, comme 3M, d'un processus intégré. M. le Président : L'industrie textile a-t-elle les moyens de produire la matière non tissée ? M. Philippe BOELE : Oui. M. le Président : Le problème n'est donc pas là. Il se trouve en amont, au niveau du produit chimique intermédiaire : c'est là qu'apparaît un goulet d'étranglement. M. Philippe BOELE : Il convient donc d'identifier ce goulet d'étranglement. Se situe-t-il au niveau de la fabrication du monomère, ou des granulés, les fameux polymères ? Aujourd'hui, je ne sais pas, mais je pense qu'il conviendrait de remonter la chaîne pour apprécier la situation. M. le Président : Cela a-t-il été fait ? M. Philippe BOELE : Je ne sais pas. En tout cas, nous n'avons pas été sollicités. M. Pierre HELLIER : Qui faudrait-il solliciter ? M. le Président : Toute la chaîne ! M. Philippe BOELE : Si j'avais un conseil à donner, il faudrait, je le redis, demander aux industriels qui fabriquent les produits finis d'organiser un travail d'investigation, en remontant toute la chaîne, pour déterminer les points de contrainte. M. le Président : Nous nous plaçons ici dans un contexte de crise, avec une demande mondiale, ou du moins européenne. Quels sont aujourd'hui les contrats, juridiquement et financièrement opposables, qui ont été signés ? M. Roland FANGEAT : L'information la plus fiable s'obtient auprès du ministère de la santé et de M. Gérard Dumont, haut fonctionnaire de défense qui sous-traite les achats au travers de l'UGAP38, laquelle a une vision exacte de toutes les commandes. De mon point de vue, une première commande de 50 millions a été faite à six ou sept prestataires. Pour Bacou-Dalloz : 12 millions. M. le Président : Qui sont les autres prestataires retenus ? Pas 3M, donc ? M. Roland FANGEAT : Non, pas 3M. De mémoire, MacoPharma, un distributeur du Nord, spécialisé dans les produits médicaux, et aussi d'autres distributeurs et un fabricant anglais. M. le Président : Quand cette commande arrivera-t-elle à échéance ? M. Roland FANGEAT : Ces 50 premiers millions devront être livrés au plus tard fin novembre. M. le Président : Ils sont destinés à un stockage hors crise, prépandémique ? M. Roland FANGEAT : En effet. Donc, Bacou-Dalloz a reçu commande de 12 millions de masques. Le projet initial était de stocker 200 millions de masques. D'autres commandes sont attendues, au fur et à mesure de l'arrivée des crédits. Certaines ont déjà été engagées. Nous en avons reçu une supplémentaire de 8 ou 10 millions, sachant que notre part totale sera de 48 millions. M. le Président : Sous quels délais ? M. Roland FANGEAT : Ils sont très courts, de l'ordre de quelques mois. L'objectif des 200 millions devrait être atteint au plus tard au mois d'avril prochain. M. Alain CLAEYS : Parlez-nous des possibilités de développement d'unités de production en France. M. Roland FANGEAT : En cas de pandémie, ces 200 millions de masques seraient insuffisants. Pour équiper le personnel médical, les pompiers, la police, la gendarmerie, on estime qu'il faudrait de 600 à 800 millions de masques. Pour de telles quantités, le ministère de la santé préconise de créer en France des outils de fabrication. Voilà pourquoi on nous a interrogés - comme MacoPharma et d'autres - sur les moyens de production supplémentaires que nous serions capables de mettre en place dans un délai de dix mois à un an. Pour notre part, nous avons répondu que nous pourrions augmenter notre capacité de production à 180 millions de masques par an. M. le Président. Etes-vous toujours le seul façonnier présent sur le territoire français ? M. Roland FANGEAT : Actuellement, oui, nous restons les seuls. Mais plus tard, ce ne sera plus le cas, ce qui nous pose d'ailleurs un problème. M. le Président : Un problème de concurrence ? M. Roland FANGEAT : Non seulement de concurrence, mais de surcapacité de production. M. le Président : Nous reviendrons sur le sujet. Revenons au délai de mise en place d'une nouvelle chaîne de production. Vous dites qu'il faut compter six mois. M. Philippe BOELE : Pour 3M, il faut six mois pour mettre en place une ligne de formage, et un ou deux mois supplémentaires pour le processus de qualification. Mais l'étape qui se trouve en amont, comme je l'ai déjà expliqué, est bien plus longue, parce que l'équipement est beaucoup plus compliqué. Pour les procédés qui sont les nôtres, il faut compter dix-huit mois. M. Roland FANGEAT : Au niveau mondial, il y a un numéro 1, à savoir 3 M, mais il n'y a pas de numéro 2. Nous sommes très loin derrière, même si, au niveau local, nous représentons quelque chose. L'intégration de la production, chez 3 M, est un schéma unique. M. Philippe BOELE : Pour autant, ce n'est pas le schéma le plus simple ni le plus économique. M. le Président : Quelle est votre situation aux États-Unis ? Êtes-vous en état de satisfaire la demande américaine ? M. Philippe BOELE : Aujourd'hui, oui. Mais, jour après jour, la situation évolue. Bien qu'il n'y ait pas de pandémie avérée, la demande ne fait que croître, parce que les administrations s'engagent dans un processus de stockage. M. Roland FANGEAT : En cas de pandémie, personne, pas même 3 M, ne pourra couvrir les besoins. M. Philippe BOELE : L'administration américaine a prévenu clairement qu'elle « nationaliserait », ou du moins qu'elle réquisitionnerait les unités existantes. M. Frank AJUELOS : Pour faire face à ce problème de capacité de production, on peut songer à faire porter à tout le monde un masque de type chirurgical, ce qui réduirait le nombre de masques de protection respiratoire nécessaire. M. le Président : Parlez-nous de la production de cet autre masque. M. Frank AJUELOS : Pour le moment, il n'y a aucun problème. M. le Président : Et en cas de pandémie ? On nous a dit qu'on envisageait de mettre au point des kits à distribuer à l'ensemble de la population. M. Frank AJUELOS : Ce sont des masques bien différents. Nous avons été consultés à propos de masques chirurgicaux, ou médicaux, et de masques respiratoires, comme les FFP 2, en emballage individuel. M. le Président : Combien coûte un masque chirurgical ? M. Frank AJUELOS : 4 ou 5 centimes d'euro. M. le Président : En période de pandémie, pourrez-vous en assurer la production ? M. Frank AJUELOS : Nous sommes capables d'augmenter considérablement nos volumes, voire de les doubler, mais seulement si la demande existe : nous ne fabriquons pas seulement pour fabriquer... M. le Président : Mais un doublement des volumes ne serait pas à la hauteur du problème ! M. Frank AJUELOS : En effet. Il faudrait remettre en place des lignes de production. M. Philippe BOELE : Il faudrait réfléchir en termes de « productivité » : un processus permettant de fabriquer 5 millions de masques par an sera peut-être moins intéressant qu'un autre procédé, certes plus cher en investissements, mais qui permettrait de fabriquer 40 millions de masques. Il faut évaluer le risque financier qu'on veut prendre. M. Franck AJUELOS : La réponse varie avec chaque protection. M. Gérard DUBRAC : Quelle est l'efficacité de ces masques ? M. Franck AJUELOS : Leur efficacité est différente. C'est aux experts de préciser la protection qu'il faut exiger. S'agissant des masques de protection respiratoire, la norme exigée est un taux de protection respiratoire de 92 % pour le FFP 2, 98 % pour le FFP 3. S'agissant des masques chirurgicaux ou médicaux, l'exigence porte sur l'efficacité de filtration bactérienne. La première indication des masques médicaux est de protéger un environnement et un patient, tandis que celle des masques de protection respiratoire est de protéger le porteur. Dans un milieu hospitalier, on doit imaginer qu'il faut à la fois protéger le soignant et le patient. M. Gérard DUBRAC : Qu'impose la norme EN 149 ? M. Roland FANGEAT : Les taux qui viennent d'être cités. Globalement, un masque FFP 2 diminue la concentration par dix. M. Franck AJUELOS : Aujourd'hui, je ne suis pas certain que les masques FFP 2 aient la capacité de filtration définie dans le registre des dispositifs médicaux. M. le Président : Je ne comprends pas très bien. Vous nous dites que la norme impose, pour les FFP 2, une efficacité de 92 %. Qu'est-ce donc que cette norme de filtration bactérienne ? M. Franck AJUELOS : Le masque respiratoire est censé purifier l'air que vous respirez, tandis que le masque chirurgical filtre celui que vous rejetez. M. François GUILLAUME : En cas de pandémie, si j'ai bien compris, nous sommes incapables de répondre à une demande de masques destinés à protéger ceux qui les portent. Pourquoi ne pas multiplier le nombre de masques destinés à protéger les autres, d'autant que cela semble plus facile à réaliser ? Supposons que tout le monde porte un masque chirurgical. Cela garantirait malgré tout une certaine protection collective. M. Pierre HELLIER : Pour le moment, avez-vous anticipé les commandes de matière première servant à la fabrication des fibres ? M. Philippe BOELE : Non. M. Pierre HELLIER. Aura-t-on suffisamment de matière première ? M. Philippe BOELE : La sécurisation de la chaîne ne m'apparaît pas évidente aujourd'hui. M. le Président : N'y a-t-il pas eu de réunion au niveau européen pour essayer de mettre en commun des moyens industriels et de voir si l'on peut, à un certain moment, commencer à fabriquer un minimum de matière première ? Que ce soit suffisant ou pas, c'est un autre débat. Savoir si on doit mettre en place de nouvelles chaînes de production et comment on pourrait les financer, c'est encore un autre débat. Mais il faudrait au moins réfléchir au plan européen et se mettre d'accord sur la production de matière première. La France, qui n'en possède pas, ne saurait avoir une position isolée. M. Roland FANGEAT : Les Français sont les premiers à avoir posé des questions en ce domaine - depuis mai ou juin 2004. M. le Président : Il n'empêche que le sujet est bien du ressort de l'Europe. M. Pierre HELLIER : Tout à l'heure, j'ai évoqué la question de la protection du professionnel de santé par rapport au malade. Ne pensez-vous pas que les malades devraient porter des FFP 2 ? M. Frédéric BIFFAUD : Nous avons été interpellés sur ce sujet et nous avons rencontré les représentants de l'AFSSAPS39. Le débat a porté sur le type de recommandations à faire et sur le type de produits à mettre à disposition en fonction des situations. En temps de crise, il faut raisonner en termes de priorités de situation. C'est ainsi que nous avons établi un tableau : quel type de produits, pour quel type de situation, pour quel type de professionnel ? Il est évident que le professionnel de santé devra être tout particulièrement protégé. M. Roland FANGEAT : Par définition, le malade est déjà malade. Inutile de lui mettre un masque de protection FFP2. En revanche, imaginer qu'on puisse protéger des gens avec un masque chirurgical plutôt qu'avec un FFP2 me semble constituer un raccourci hasardeux. Je voudrais revenir sur un sujet que nous n'avons pas développé : que se passera-t-il dans deux ou trois ans, quand nous aurons une capacité de production de 200 millions, alors que le marché n'absorbera plus que 60 millions ? M. le Président : C'est un vrai problème, mais nous n'avons pas le temps de le traiter maintenant. Si vous avez des suggestions à faire, faites-le par écrit... Je pense que l'État devrait intervenir directement pour acheter des chaînes de production et prendre le risque de les détruire ensuite, ou de les retransformer. M. Roland FANGEAT : C'est ce que j'avais proposé il y a un an, mais je n'ai pas été suivi. L'État devrait s'équiper, quitte à ce que les industriels l'aident pour la mise en place des moyens de production et pour la maintenance. Ensuite, ce serait à l'État de réguler le système, car les industriels en seraient incapables. M. le Président : Je vous remercie. Audition de M. Didier HOCH, Président de Sanofi Pasteur MSD, M. Jacques BERGER, directeur général délégué de Sanofi Pasteur,et Mme Catherine GERDIL, chef de projet Sanofi Pasteur Présidence de M. Jean-Marie LE GUEN, Président M. le Président : Madame, Messieurs, je vous remercie d'être venus devant notre mission, qui poursuit un double objectif : exercer un contrôle de l'action gouvernementale en ce qui concerne la préparation du plan « Pandémie », et garantir la transparence de l'information vis-à-vis de nos concitoyens. Nous avons décidé de commencer par ce qui nous est apparu le plus urgent : l'examen des moyens médicaux mobilisables en cas de pandémie. Nous évoquerons avec vous la question de la vaccination. Vous rappellerez d'abord les principales données d'ordre scientifique, puis vous aborderez les problèmes d'ordre industriel, voire économique, qui se posent en ce domaine. M. Didier HOCH : Je voudrais préciser d'emblée que nous ne travaillons pas sur la grippe aviaire, dont nous ne sommes d'ailleurs pas spécialistes, car il s'agit d'une épizootie. L'outil vaccinal s'intègre dans le dispositif de prévention et de réduction de l'impact d'une pandémie. Outre les mesures de protection, comme le port de masques ou la quarantaine, il y a les anti-viraux et le vaccin. Les anti-viraux interviendraient lors de la première partie de la pandémie, les vaccins lors de la seconde, car le vaccin ne peut être fabriqué que lorsqu'on a identifié le virus - un virus pandémique, passant de l'homme à l'homme. Le virus est identifié par les experts des différents laboratoires et certifié par l'OMS. A partir de ce moment-là, nous pouvons produire le vaccin pandémique. Cela dit, nous n'attendons pas de connaître le virus pour commencer à travailler. Depuis des années, à la demande initiale de l'OMS, puis de certains États membres et de la Commission européenne, nous avons anticipé la préparation des vaccins pandémiques. Nous avons à mener une course de vitesse contre la propagation du virus et, pour cela, il faut anticiper, au niveau de la recherche et du développement, mais aussi au niveau des capacités de production. Puisqu'on ne disposera du vrai virus qu'au moment de la pandémie elle-même, nous essayons de définir un « vaccin prototype pandémique », c'est-à-dire d'identifier le véhicule dans lequel on placera, le moment venu, le vrai virus identifié et certifié. Nous le faisons à partir des virus sauvages comme le H5N1, le H7N7, etc. Je fais, ici, une digression à propos du « vaccin interpandémique ». Les vaccins grippaux sont très spécifiques dans la mesure où il faut les renouveler tous les ans. L'OMS nous donne chaque année trois souches d'antigènes de référence, à partir desquelles on construit le vaccin. Pour l'hémisphère nord, à partir de février, on fabrique et on produit le vaccin jusqu'en juillet ; en parallèle, on fait les études cliniques et on dépose un enregistrement. On arrête la production en juillet, et les vaccins sont sur le marché entre septembre et novembre. Pour l'hémisphère sud, on refait la même chose de septembre à janvier. Ainsi, chaque année, nous faisons deux vaccins trivalents. Ce sont deux produits différents, qui ont vocation à être utilisés dans une période donnée et qui ne seront pas stockés. Ce mécanisme interpandémique est important à comprendre, car on va le retrouver pour le vaccin pandémique, dans la mesure où l'on va mettre au point un véhicule de base, dans lequel on placera les souches pour produire le vaccin. Il a l'avantage d'entraîner nos équipes à travailler vite et de façon renouvelée. Aujourd'hui, la capacité de production au niveau mondial est de l'ordre de 300 millions de doses par an, s'agissant des vaccins trivalents. M. le Président : Pouvez-vous préciser les notions de dose et de traitement ? M. Didier HOCH : Une dose, c'est une injection. Les vaccins interpandémiques sont des vaccins trivalents, c'est-à-dire à trois valences, mais avec une seule dose. Les vaccins pandémiques sont des vaccins monovalents, à une ou deux doses. Les experts pensent qu'il faudra utiliser deux doses de vaccin, dans la mesure où l'on va vacciner des populations naïves. Mais il faudra aussi attendre le résultat des études cliniques menées à partir des différentes formulations. Un élément entrera également en ligne de compte : si on n'injecte qu'une seule dose, on pourra vacciner plus de monde. Ces choix nous échappent : ils appartiennent à la communauté scientifique et à l'OMS. Le vaccin prototype est un élément primordial de notre fonctionnement : on gagne du temps pour plus tard et, en plus, on teste ainsi, au plan industriel, la production d'un vaccin sauvage. M. le Président : Précisez bien : le « vaccin prototype », c'est ce que l'on appelle aussi « vaccin prépandémique » ou « vaccin H5N1 » ? M. Didier HOCH : oui. Revenons-en à la capacité de production. Je vous ai dit qu'on pouvait évaluer à 300 millions de doses environ la capacité mondiale de production du vaccin interpandémique trivalent. Cette capacité de production mondiale, qui est évolutive, correspond aujourd'hui à l'utilisation qui est faite des vaccins. Elle est basée sur la consommation et les demandes faites au niveau interpandémique. Mais comment répondre au mieux aux besoins et comment les anticiper ? Voilà pourquoi nous avons demandé, dans le cadre de l'Association des fabricants de vaccins européens, dont je suis le Président, à avoir le plus d'informations possibles sur ce que serait la demande potentielle des différents États membres, afin de déterminer à quel niveau il faudrait adapter l'outil industriel. Une augmentation de la capacité de production demande du temps. M. le Président : Plusieurs questions. Quel est le temps de latence entre l'identification par l'OMS des antigènes et l'apparition industrielle des vaccins ? Quel est, en moyenne, le temps nécessaire pour la création d'une chaîne supplémentaire ? De quand date la demande d'informations de l'Association des fabricants de vaccins ? M. Didier HOCH : A partir du moment où une souche est identifiée et que l'OMS nous fournit les éléments nécessaires, on peut commencer la production effective du vaccin au bout de treize à quatorze semaines. Il faut donc à peu près trois mois. Cette période peut être légèrement antérieure à la déclaration de pandémie. Il est possible que nous ayons la souche et les réassortants avant la déclaration officielle de pandémie. Si on veut augmenter la capacité de production, la création d'un nouveau site de production réclame quatre à cinq ans. Dans cette période, il y des phases de construction et des phases réglementaires. Enfin, l'Association des fabricants de vaccins européens, après avoir travaillé sur le sujet à la fin de 2003, avait établi un plan pour la préparation à la pandémie, qui a été publié en février 2004, discuté avec la Commission européenne, présenté à l'OMS et envoyé aux États membres. Nous avions demandé des éléments très précis concernant l'aide au développement de vaccins prototypes à court terme et long terme, et l'évaluation des besoins en termes de pandémie et de couverture interpandémique. Nous avions également demandé une règle du jeu concernant la distribution équitable et, enfin, des mesures pour sécuriser les activités des firmes elles-mêmes : l'approvisionnement en œufs, les matériels d'injection, le site de production lui-même, la réponse à certains risques juridiques liés à une vaccination de masse. Nous avons obtenu des réponses dans la mesure où, progressivement, la plupart des éléments ont commencé à être pris en compte. Je pense notamment à la nécessité d'augmenter la couverture interpandémique et donc les capacités de production. Nous avons beaucoup plus de mal s'agissant de la recherche et du développement des vaccins prototypes. Il faut préciser que la responsabilité de la santé publique incombe aux États membres et que la Commission européenne n'a qu'un rôle de coordination. Il en est de même s'agissant des aides : la Commission européenne n'a pas forcément les outils qu'il faut. Elle soutient la recherche-développement à très long terme. Nous ne sommes pas parvenus à ce jour à une solution simple et efficace pour les prototypes vaccins. Mais les discussions ne sont pas finies. Nous aurons une réunion avec le commissaire européen Kyprianou et les principaux fabricants le 29 novembre. M. le Président : Vous avez dit que vous aviez été aidés au niveau de l'interpandémique. Que s'est-il passé ? M. Didier HOCH : On a repris l'idée qui avait été développée par l'OMS, à savoir que les États membres devaient augmenter leur couverture interpandémique en respectant la couverture des populations à risque, telles que définie dans les recommandations françaises ou d'autres pays et par l'OMS. M. le Président : Il est évident que les capacités de production du vaccin pandémique sont liées aux capacités de production du vaccin interpandémique. Pouvez-vous faire le point sur la situation européenne, nord-américaine et mondiale en la matière ? M. Didier HOCH : Aujourd'hui, avec 240 millions, la capacité de production de l'Europe représente les deux tiers de la capacité mondiale. 50 % de cette production est exportée hors d'Europe et couvre tous les autres pays, à l'exception des Etats-Unis, du Canada, du Japon et de l'Australie. D'où l'importance stratégique de l'Europe en la matière. Ces dernières années, les États-Unis avaient perdu presque tous les producteurs, en dehors de Sanofi-Pasteur, parce que le prix des vaccins grippaux était tombé trop bas. La plupart des fabricants s'étaient retirés du marché et ils reviennent seulement maintenant. M. le Président : Quand vous dites que le prix des vaccins était tombé très bas, vous voulez dire que les industriels ne trouvaient pas une source de profits suffisants ? M. Didier HOCH : Oui. M. Pierre HELLIER : Les vaccins expérimentaux sont produits selon la même technique que le vaccin interpandémique, le vaccin grippal. Mais ne faut-il se méfier d'une certaine toxicité liée à l'œuf ? M. Jacques BERGER : Il sera sûrement avantageux, à terme, de travailler avec d'autres technologies. Mais elles sont complexes, et ont besoin d'être testées. Comme pour tous les vaccins, il est nécessaire d'en passer par un processus d'acceptation par les autorités réglementaires. On sait que de nombreuses années vont encore s'écouler avant que la culture cellulaire ne soit disponible. Nous y travaillons très activement, parce que c'est un moyen de se passer de l'œuf. Mais en cas de pandémie, il faudra répondre avec la technologie existante qui est parfaitement éprouvée et solide, même s'il faut passer par l'œuf. M. le Président : Avez-vous eu une commande des États-Unis pour travailler sur cette culture cellulaire ? Pour quel montant ? M. Jacques BERGER : Oui, pour une centaine de millions de dollars. M. Pierre HELLIER : Vous ne travaillez pas du tout sur des vaccins animaux ? M. Jacques BERGER : C'est Merial qui le fait. M. Pierre HELLIER : Ni sur des vaccins pour les éleveurs, à partir du virus H5N1 ? M. Jacques BERGER : Nous travaillons sur le vaccin H5N1. M. Didier HOCH : Je voudrais revenir sur les œufs. Aujourd'hui, il existe une technique, la reverse génétique, qui permet de maîtriser les virus sauvages et les rendre compatibles avec les œufs. Ce problème de toxicité du virus sur l'œuf n'existe plus en tant que tel : c'est l'une des grandes avancées de ces dernières années. M. François GUILLAUME : La mutation des virus est-elle si rapide qu'elle rende l'adaptation difficile ? Estimez-vous que la vaccination des cheptels avicoles pourrait éradiquer tout virus susceptible de toucher les humains ? M. Didier HOCH : Je suis incompétent sur la question de la vaccination animale. En revanche, nous savons que la rapidité de mutation est très difficile à apprécier. Aujourd'hui, le virus H5N1 est un virus aviaire, relativement stable. Mais l'expérience montre que les virus mutent régulièrement, et qu'ils peuvent muter en se croisant avec un virus humain et en se recombinant. On ne peut pas dire avec certitude quand cela va arriver ni où. Peut-être même n'y aura-t-il pas de pandémie avec un H5N1. Mme Catherine GERDIL : Aujourd'hui, le rôle de l'OMS est important. Un lien très étroit s'est établi entre les laboratoires de l'OMS, qui isolent le virus et suivent son épidémiologie, et les fabricants. Il s'agit de réagir le plus rapidement possible. M. le Président : Venons-en maintenant à l'aspect production et distribution. M. Jacques BERGER : Sanofi-Pasteur représente environ 40 % du marché mondial pour la grippe interpandémique. Notre responsabilité est d'être particulièrement performants si une pandémie se déclare. C'est pourquoi des équipes dédiées y travaillent à 100 % de leur activité. Pour la grippe, nous avons un site de production près de New York et un autre en France. Nous avons fait le choix stratégique de doubler nos chances, et nous travaillons de façon équivalente sur les deux sites. Bien sûr, les équipes se coordonnent, mais elles doublent aussi certaines opérations. J'ajoute que les autorités américaines nous ont beaucoup aidés : par le biais des RFP, ou request for proposal, c'est-à-dire des appels d'offres, elles se sont adressées aux différents producteurs sur des sujets spécifiques. Ce ne fut pas le cas en Europe, et c'est pourquoi nous avons décidé, de notre propre chef, de mener des opérations un peu similaires. M. le Président : A quel moment cela s'est-il passé ? M. Jacques BERGER : Les premiers appels d'offres américains ont été lancés en mars-avril 2004, et le processus se poursuit, le gouvernement américain ayant mis de côté les fonds nécessaires au financement de ces recherches. Je ne peux pas dire que nous ayons été à l'origine de ces demandes. M. le Président : De quand date votre interpellation des autorités européennes ? M. Didier HOCH : Nous avons interpellé les autorités des pays européens en février 2004. Mais nous n'avons pas obtenu ce que nous voulions. Alors que nous n'avions rien demandé aux États-Unis... M. Jacques BERGER : Quand on se prépare à une pandémie, on est un peu comme le sportif de haut niveau qui sait qu'il va avoir à faire une course, mais qui ne sait pas quand, dans quel stade ni sur quelle distance. Cela ne veut pas dire qu'on ne peut pas faire beaucoup de choses pour s'y préparer. L'élément de base sur lequel nous travaillons, c'est le fameux H5N1. Nous savons qu'une souche pandémique va se comporter d'une façon différente d'une souche interpandémique. Le H5N1 est considéré comme l'une des souches les plus proches de celle qui pourrait être, un jour ou l'autre, pandémique. D'où l'idée de l'utiliser pour travailler sur un vaccin prototype. Nous allons tester notre système industriel sous toutes ses formes, avec ce vaccin prototype. On fabriquera d'abord des vaccins en petite quantité, qui nous serviront éventuellement à faire des études cliniques. Ensuite, il y aura une montée en puissance : nous travaillerons sur un ou deux millions de doses, puis sur dix millions de doses ou plus. Ainsi, le jour venu, lorsque la souche pandémique aura été identifiée par l'OMS, souche dont nous pensons que le comportement devrait être relativement proche de celle du H5N1, nous serons dans les meilleures conditions pour produire le vaccin. Pour autant, il faudra que l'efficacité de ce vaccin soit prouvée. En période interpandémique, il suffit de fabriquer des doses dans des quantités qu'on sait évaluer. En cas de pandémie, il faudra multiplier nos efforts de façon considérable. Notre première responsabilité sera de travailler vingt-quatre heures sur vingt-quatre, sept jours sur sept et d'être capables de fabriquer le maximum de doses dans le minimum de temps. Il sera important de déterminer la dose qui sera suffisante pour bien vacciner tout en étant parfaitement tolérée, mais qui pourra être fabriquée en grandes quantités. Voilà pourquoi nous avons commencé à fabriquer de petits lots de H5N1, qui nous semble proche de la future souche pandémique, et qui nous ont permis de faire des tests cliniques, actuellement effectués en France et aux Etats-Unis. Lorsque nous aurons ces informations, nous disposerons d'un certain nombre d'éléments, sur la tolérance du vaccin et sur son efficacité. C'est alors que nous pourrons déterminer s'il faudra une ou deux doses et quelle sera la charge antigénique à mettre dans chacune des doses. Cela nous permettra d'ajuster la formulation du produit, laquelle nous renseignera sur notre capacité industrielle le moment venu. Voilà pourquoi nous ne saurions répondre aujourd'hui de notre capacité industrielle au niveau pandémique. Cela dépendra de la souche. Encore une fois, notre responsabilité de professionnels de la vaccination est de nous mettre en situation de pouvoir, le moment venu, nous adapter le plus vite possible. Je précise par ailleurs qu'il n'est techniquement pas possible de construire une usine qui ne servirait à rien, du moins pendant de nombreuses années. En effet, une usine de vaccins nécessite d'être utilisée quotidiennement, notamment pour que les personnels restent opérationnels continuellement. Nous devons donc essayer d'optimiser les différentes étapes de la production pour être capables, le jour venu, de sortir le maximum de doses en un minimum de temps. Et si nous travaillons des deux côtés de l'Atlantique, c'est pour optimiser nos expériences. Tout cela ne serait pas possible sans deux conditions essentielles, que nous remplissons heureusement. D'abord, une volonté de dialogue avec des structures comme l'OMS, avec laquelle nous avons des contacts réguliers. Lorsque la pandémie sera avérée, nous devrons arrêter la production de vaccins interpandémiques. Ce sera une décision très importante. D'où l'intérêt de pouvoir réfléchir avec ces structures sur la façon de se préparer. Ensuite, de très bonnes relations avec les autorités nationales. Elles sont absolument essentielles à notre bon fonctionnement et pour notre préparation à une éventuelle pandémie. S'agissant des délais, on a parlé de trois mois. Mais il ne faut pas se tromper de point de départ. A partir du moment où la pandémie est déclarée, il faudra attendre entre quatre ou six mois. Car il faudra que l'OMS soit en situation de nous fournir la souche correspondante. M. le Président : Supposons que nous soyons en période de pandémie. Parlez nous production française, production mondiale, production équitable. M. Jacques BERGER : Depuis de nombreuses années, notre activité grippe est concentrée sur le site du Val-de-Reuil, à une trentaine de kilomètres de Rouen. C'est l'ancien site de l'Institut Pasteur Production. Il est très expérimenté dans le domaine de la vaccination. La totalité de la production « vrac » - c'est-à-dire la matière de base qui sera ultérieurement formulée, contrôlée et répartie - est assurée sur ce site. Nous menons une réflexion, qui est très avancée, pour tenter de préparer l'ensemble de nos sites, y compris le Val-de-Reuil, à répondre à la situation. Le jour venu, une grande partie des forces actives du site et des sites de production vont devoir se consacrer à cette pandémie. Nous devrons avoir prévu comment gérer la production des autres vaccins qui nous seront demandés. M. le Président : Mettons que nous soyons en période de pandémie. Au bout de quatre mois, combien sortez-vous de vaccins ? M. Jacques BERGER : Je suis incapable de vous le dire. M. le Président : Pourtant, le Gouvernement donne des chiffres. M. Jacques BERGER : Il faut savoir que nous aurons à produire des vaccins monovalents et non trivalents. Par ailleurs, nous consacrerons la totalité de l'année à fabriquer cette souche, alors que nous fabriquons actuellement deux vaccins équivalents, l'un pour l'hémisphère nord, l'autre pour l'hémisphère sud. Tant que nous n'aurons pas terminé nos premières estimations et testé les premiers produits issus de ces productions, il nous sera difficile de vous dire ce que cela devrait donner. M. le Président : Pourtant, je n'ai pas rêvé : vous avez bien passé un contrat avec le gouvernement ! Dans votre contrat, vous vous êtes engagés sur des chiffres. Donnez-les nous ! M. Jacques BERGER : Heureusement, notre capacité doit être bien supérieure à celle-ci. M. le Président : Donnez-nous les chiffres, et indiquez-nous une fourchette au plan mondial. M. Jacques BERGER. Globalement, au plan mondial, nous avons une capacité d'environ 165 millions de doses trivalentes - deux tiers en Europe et un tiers aux États-Unis. M. Jean-Pierre DOOR, rapporteur : Avez-vous passé des accords avec d'autres pays ? M. Jacques BERGER : En effet, d'autres pays nous ont sollicités pour conclure des accords. M. Pierre HELLIER : Et avec quels pays en avez-vous signé ? M. Jacques BERGER : Avec la France et les États-Unis. Nous avons été sollicités par un autre pays européen, la signature est imminente. M. le Président : Sur quoi portent ces accords ? Vous avez des contrats avec les États-Unis, pour fabriquer du H5N1, c'est-à-dire du prépandémique, et pour travailler sur les nouveaux modes de production. Mais nous voudrions connaître quels contrats vous avez passés s'agissant du vaccin pandémique. M. Jacques BERGER : Nous avons passé des accords qui portent sur la fourniture de certaines quantités de H5N1 et qui nous engagent à fournir au gouvernement français l'équivalent de 28 millions de traitements - une ou deux doses par traitement, nous ne le savons pas encore. Le gouvernement s'est par ailleurs adressé à d'autres fournisseurs pour compléter ses besoins. M. Pierre HELLIER : Il n'y a pas de délai ? M. Jacques BERGER : Non. M. Didier HOCH : Je voudrais ajouter que nous avons eu beaucoup de contacts avec les autorités de différents pays européens. Certains pays nous ont demandé du H5N1 avec, à la clé, un engagement pour un vaccin pandémique. C'est le cas de la France. Deux ou trois autres pays sont en train de faire la même chose. D'autres pays ont demandé un engagement pandémique, sans rien d'autre. Notre politique est de ne pas y répondre. D'autres encore lient, dans leur contrat, interpandémie et pandémie. Un dernier pays a passé un contrat de recherche-développement pure, nous demandant de produire tel type de vaccin dans le pays et accordant, à la clé, un contrat de couverture. Nous avons lancé nos programmes H5N1 aux États-Unis et en France fin 2003. Nous avons eu du mal à trouver une forme d'aide simple et logique. Les autorités françaises ont décidé de nous aider dans notre démarche de produire à échelle réelle le H5N1. Un des moyens de nous aider a été de conclure ce fameux contrat couplé avec un peu de H5N1 et avec une assurance de couverture. L'accord passé porte sur 28 millions de traitements, mais il est à géométrie variable : il tient compte de la productivité possible. Il assure une couverture adéquate à la population française, en tenant compte des contraintes de production, et il respecte l'idée d'une distribution équitable. En livrant la France de cette manière, nous ne pénalisons pas, ou relativement peu, les autres pays. C'est aussi pour cela que nous avons signé ce contrat. Voilà pourquoi Jacques Berger a eu du mal à vous répondre. Il y a trois hypothèses de timing en fonction de la productivité. Nous nous adapterons au fur et à mesure de l'avancée de la science et du résultat des études cliniques qui auront lieu à la fin de cette année et au début de l'année prochaine. M. Pierre HELLIER : Des retards sont possibles. Dans les contrats, vous n'avez pas de date de mise sur le marché du vaccin définitif ? M. Didier HOCH : Le vaccin définitif commencera à être sur le marché treize semaines après l'obtention de la souche. M. le Président : Vous êtes-vous engagés sur ce délai de treize semaines ? M. Didier HOCH : Dans le contrat français, oui. M. le Président : Par contre, vous ne savez pas si, pour les 28 millions de traitements, il faudra 28 ou 56 millions de doses ? M. Didier HOCH : Exactement. Mme Catherine GERDIL : Il est très difficile de s'engager sur un délai ferme parce qu'on a besoin d'éléments, ce que nous appelons des « réactifs », pour standardiser notre vaccin. C'est quelque chose que nous ne maîtrisons pas. M. le Président. Combien de temps faut-il compter entre la fourniture de la première dose et la fourniture de la 28 millionième ? M. Didier HOCH : Avec une productivité égale à celle d'un vaccin normal, quatre ou cinq mois à partir de la première dose. Nous sommes partis de l'hypothèse de vaccins interpandémiques à 15 microgrammes. Mais d'autres schémas sont possibles. M. Alain CLAEYS : Quelle ont été les contreparties, pour votre groupe, des aides apportées par le gouvernement américain à la recherche ? M. Jacques BERGER : Une seule, venue du gouvernement français : l'achat d'un certain nombre de doses de vaccin H5N1. M. Alain CLAEYS : D'accord, mais les contreparties du côté américain ? M. Jacques BERGER : Initialement, il nous a été demandé de faire des lots cliniques destinés justement à lancer des études cliniques permettant d'en savoir plus. La fabrication de ces lots cliniques a fait l'objet du premier appel d'offres. Il nous a été demandé, ensuite, de monter en puissance jusqu'à deux millions de doses, et une première commande de deux millions de doses a été passée au cours de l'année dernière. Puis on nous a demandé de monter encore davantage en puissance, avec des quantités antigéniques, pour un volume équivalent à plusieurs dizaines de millions de doses. Il y a donc eu un troisième appel d'offres, que nous avons également remporté. Nous nous trouvons ainsi en situation industrielle, ce qui nous permet de tester l'outil sous toutes formes. M. le Président : Construisez-vous une nouvelle usine ? M. Jacques BERGER : Nous en sommes seulement au niveau d'une commande de vaccins H5N1, mais c'est un niveau tel que cela nous met en situation industrielle. Autre problème : l'approvisionnement en œufs, à partir desquels sont fabriquées les doses de vaccin. Nous devons nous assurer que nous aurons des œufs en quantité suffisante. En période de pandémie, la production d'œufs risque d'être insuffisante. Un quatrième appel d'offres a donc été lancé. Le gouvernement américain a ainsi financé la sécurisation de l'approvisionnement en œufs. Ce qui implique de choisir la répartition géographique des endroits où on les fabrique, d'assurer un niveau qualitatif suffisant, une surveillance, et garantir une quantité d'œufs supplémentaire par rapport à ce qui est nécessaire. M. le Président : Est-ce que cela existe en France ? M. Jacques BERGER : L'équivalent de ce système de sécurisation de l'approvisionnement en œufs n'existe pas en France. C'est un sujet que nous aimerions bien aborder. M. le Président : Est-il au moins en discussion ? M. Jacques BERGER : Il a été évoqué, mais sans nous... Enfin, dernier point : nous souhaitons, à terme, utiliser une autre technologie que celle des œufs : la technologie de culture cellulaire. Là encore, aux USA, un appel d'offres supplémentaire a été passé. Nous l'avons également remporté. Il nous aide à développer cette culture cellulaire et à concevoir ce que serait une usine de culture cellulaire. M. Alain CLAEYS : De son côté, quels appels d'offres l'Europe a-t-elle lancés ? Quels sujets a-t-elle traités ? M. Jacques BERGER : L'Europe nous a sollicités pour fabriquer des lots cliniques à partir d'une souche un peu différente, la souche H7N1. M. Pierre HELLIER : Le vaccin H5N1 que vous êtes en train de préparer pourrait-il servir aux éleveurs ? M. Didier HOCH : Il faudra attendre le résultat des études cliniques. Le choix de vacciner ou non des éleveurs se posera, s'il s'avère que la souche circulante H5N1 reste stable et que le vaccin protège. M. Pierre HELLIER : Ce n'est pas dans ce but là qu'on vous l'a commandé ? M. Didier HOCH : Les éleveurs n'étaient pas spécifiquement visés. Le but était de circonscrire éventuellement un foyer naissant de H5N1 s'il s'avérait que la souche restait stable. M. Pierre HELLIER : En cas de déclaration de pandémie par l'OMS, on vous donnera la souche et vous vous mettrez à travailler le plus rapidement possible. Vous subirez une énorme pression pour raccourcir les périodes d'expérimentation. Mais vous aurez à tenir compte du risque médico-légal, que vous prendrez en travaillant vite. Vous risquez des procès. M. Didier HOCH : Ce serait la mort assurée de l'entreprise. M. le Président : De qui attendez-vous des réponses ? Du gouvernement français, de la Commission européenne, du gouvernement américain ? M. Didier HOCH : Il faut que la Commission européenne et les États membres acceptent de couvrir ce risque. M. le Président : Est-ce une condition sine qua non ? M. Jacques BERGER : Oui, c'est impératif. M. le Président : Est-ce que le contrat passé avec la France pour 28 millions de traitement prévoit de transférer la responsabilité au gouvernement français ? M. Jacques BERGER : Oui. M. le Président : Il semble que vous ayez choisi de construire aux Etats-Unis une nouvelle usine, ou une nouvelle chaîne de production, en plus de celle que vous possédez déjà aux États-Unis. M. Jacques BERGER : Nous avons besoin d'ajuster nos productions américaines. Notre usine date déjà d'un certain nombre d'années et il nous faut tenir compte des réglementations. Nous allons donc construire une nouvelle usine de culture sur œufs. M. le Président : C'est le gouvernement américain qui l'a financée ? M. Jacques BERGER : Non, c'est nous. Le Gouvernement américain s'est engagé, lui, pour l'engineering du projet d'usine de culture cellulaire. M. le Président : Le choix de construire une nouvelle usine est-il un choix interne à l'entreprise, indépendamment des commandes extérieures ? M. Jacques BERGER : Absolument. Le gouvernement américain ne nous a pas aidés pour cela. M. Alain CLAEYS : Le dernier appel d'offres lancé par l'administration américaine porte sur la sécurisation de l'approvisionnement en œufs, c'est une question importante. M. Jacques BERGER : Le sujet est en effet important, et nous sommes prêts à en rediscuter. Il faudra qu'en interne, nous finalisions notre projet, qui est très avancé. M. Pierre HELLIER : Parlez-nous de cette sécurisation, qui me paraît essentielle. Et dites-nous si le fait que l'on vaccine les animaux peut vous poser des problèmes - les œufs d'une poule vaccinée peuvent-ils encore vous servir ? Mme Catherine GERDIL : Oui, cette vaccination pourrait nous gêner dans la mesure où l'on ne sait pas si cela ne peut pas interférer avec la croissance du virus en question. Revenons à la sécurisation de l'approvisionnement en œufs. Celui-ci se fait en plusieurs étapes. D'abord, nous mettons en place un approvisionnement annuel, pour être capable de produire quelle que soit la période de l'année. Il faut donc réfléchir en termes de nombre de fermes, de couvoirs... et de sécurisation de ces installations. Ensuite, nous devons prévoir des systèmes de stocks de sécurité supplémentaires, pour palier les éventuels problèmes d'un de nos fournisseurs d'oeufs. Nous avons estimé qu'il fallait un stock supplémentaire de l'ordre de 20 %. Enfin, nous devons diversifier géographiquement cet approvisionnement en œufs, pour diminuer l'impact d'épizooties localisées en France. En raison de la migration des oiseaux, nous risquons d'y être confrontés dès cette année ou dès le printemps prochain. M. Pierre HELLIER : Avec qui faut-il discuter ? Qui vous donnera cette assurance ? Comment faire ? M. Jacques BERGER : Nous allons essayer d'identifier les personnes qui pourraient nous assurer ce surplus d'œufs. Nous travaillons en interne, car il nous faut bien réfléchir. Nous bénéficions de l'expérience américaine, même s'il n'est pas possible de la transposer telle quelle. Cela dit, nous sommes maintenant prêts à en discuter. M. le Président : Comment se présente la demande mondiale ? Pensez-vous que vous serez à même de répondre à la demande européenne ? Que se passe-t-il pour les clients traditionnels de votre industrie en France ? J'exclus ceux qui se trouvent dans la partie riche de l'Asie et aux États-Unis. M. Jacques BERGER : Nous ne sommes pas les seuls - puisque nous ne représentons que 40 %. D'autres producteurs réfléchissent au problème. La plupart d'entre eux essaient de monter en puissance en prévision d'un épisode pandémique. Il est exact que l'ensemble des producteurs européens approvisionne une bonne partie des pays qui ne sont pas en Amérique du Nord, en Australie et au Japon. Il y a aussi des pays qui n'utilisent pas actuellement de vaccins anti-grippe et qui, le jour venu, en auront besoin. Notre responsabilité est de fournir le plus grand nombre de doses possibles dans un minimum de temps. Mais il est également indispensable de parvenir à une distribution équitable. Il faut donc mettre en place une coordination entre États et mener des réflexions, auxquels les industriels doivent participer, mais dont ils ne doivent pas être l'élément moteur. M. le Président : Je n'ai pas de reproche à faire à votre entreprise. Vous êtes connus pour avoir continué à investir dans le vaccin, alors que la pharmacie mondiale désinvestissait. Mais parlons clair : à qui va-t-on fournir, et comment ? Il y a peut-être des conclusions à tirer. Tout à l'heure, vous nous avez dit qu'il fallait quatre ans pour construire une usine. La pandémie ne se déclarera pas forcément immédiatement, mais ne serait-il pas temps d'essayer de raccourci ces délais, d'envisager des formules économiques et financières pour la fabrication des vaccins ? Enfin, je repose ma question : que prévoyez-vous pour l'Europe ? Que prévoyez-vous pour vos clients traditionnels ? M. Didier HOCH : C'est ce que nous essayons de savoir. Notre association a interrogé les États membres et la Commission sur les perspectives attendues. Il faut que les pays fassent connaître leurs besoins. M. le Président : Mais vous connaissez les besoins d'un pays appartenant aux Vingt-Cinq ! En tant que scientifique, vous savez que l'indice souhaitable de protection des populations se situe à tel ou tel niveau, quel que soit le pays. L'Union européenne vous a-t-elle interrogés sur les taux de protection nécessaires de la population ? A-t-elle consulté les différents pays qui, inévitablement, viendront frapper à sa porte en cas de crise ? On ne peut pas attendre qu'ils le fassent. M. Didier HOCH : Pour notre part, nous n'avons pas attendu. En interpandémie, nous avons évalué le taux de couverture de la population européenne à 30 ou 33 %, soit 150 millions d'habitants, afin d'être tranquilles en cas de pandémie. M. le Président : Actuellement, où en est-on ? M. Didier HOCH : Nous en sommes à 90 millions. Nous nous plaçons dans une perspective de distribution équitable. Nous montons en production globale en Europe et dans le monde, et nous continuons à servir tout le monde. Ce sera utile à tous, et pas seulement aux pays européens. Telle est la logique de laquelle nous sommes partis. Mais aujourd'hui, nous n'avons pas encore d'engagements en ce sens. Dans le même esprit, nous essayons de faire que les pays dans lesquels il y a des producteurs de vaccins acceptent de ne pas fermer leurs frontières. Or ce n'est pas facile, certains pays européens préférant couvrir d'abord leur population. M. le Président : De quels pays parlez-vous ? M. Didier HOCH : Je ne peux pas vous dire lesquels. Mais on sait que certains pays ont fait des appels d'offres ou des demandes visant à protéger uniquement leur population, quoi qu'il arrive. M. le Président : La France aussi a lancé un appel d'offres. M. Didier HOCH. Si ce n'est que le gouvernement français, lui, tient compte du fait que nous produisons aussi pour d'autres Etats, en Europe et en dehors d'Europe. D'autres pays producteurs ne se sont pas posé les mêmes questions... M. le Président : Dites-nous lesquels... M. Didier HOCH : Vous le savez ! M. le Président : Vous êtes président de l'Association européenne des producteurs de vaccins ! Rappelez-nous donc les pays qui produisent. M. Didier HOCH : A cette question, évidemment sans lien avec la précédente... je répondrai : la France, l'Italie, l'Allemagne, les Pays-Bas, le Royaume-Uni et la Suisse. M. Pierre HELLIER : Vous avez parlé d'un taux de couverture de 33 %. Avec un tel taux en interpandémie, a-t-on l'espoir de juguler ainsi la pandémie ? M. Didier HOCH : Une couverture de 33 % en interpandémie permettrait de couvrir 50 à 100 % de la population totale en cas de pandémie. M. le Président : Nous avons auditionné un représentant du laboratoire Roche, qui fabrique un antiviral. Il y a quatre mois, ce laboratoire déclarait qu'il y aurait, en cas de pandémie, un problème de production, qu'il était le seul à pouvoir le résoudre et que, pour construire une nouvelle chaîne de production, il fallait dix-huit mois. La pression mondiale évoluant, ce laboratoire ne considère plus aujourd'hui qu'il est le seul à pouvoir produire, mais que des usines ailleurs dans le monde, au Vietnam notamment, en seraient capables, sous licence. Le même phénomène va-t-il se produire pour vous ? Vous nous dites qu'il faut quatre ans pour produire une nouvelle usine, vous insistez sur le fait qu'il existe un lien très direct entre la vaccination habituelle, régulière, et la vaccination pandémique, et vous déclarez que les usines ne doivent pas être seulement des chaînes de production en état de veille, mais qu'elles doivent fonctionner. D'accord. Mais nous voudrions que vous nous disiez si, selon vous, on doit créer d'autres chaînes de production pour fournir la demande mondiale en vaccin. J'exclus bien sûr le cas où la pandémie se déclarerait cette année ou l'année prochaine. M. Jacques BERGER : Ce qui est délicat, c'est que nous sommes pour quelques années encore à la fin d'un cycle d'une technologie de production et au début d'un autre. Il y a en effet deux types d'usines : celles qui fabriquent des vaccins à partir d'œufs et celles qui en fabriquent à partir de la culture cellulaire. Or les technologies qui y sont utilisées n'ont rien à voir entre elles. Il faut y réfléchir de manière approfondie, surtout dans la mesure où les montants en jeu sont considérables, de l'ordre de centaines de millions d'euros. Les Américains nous ont demandé d'estimer l'engineering d'une unité de culture cellulaire. Cela représente beaucoup d'argent pour des industriels comme nous. M. le Président : Pour vous, certes. Mais s'il s'agit de protéger la population mondiale, ce n'est pas beaucoup. M. Jacques BERGER : Nous ne sommes pas encore capables de passer à la production sur culture cellulaire. Nous pouvons y réfléchir, mais la technologie n'est pas au point. Elle le sera d'ici à quelques années. M. le Président : Quel est l'intérêt de la technologie cellulaire par rapport à la technologie précédente ? M. Jacques BERGER : Elle permet l'élimination de l'utilisation des œufs. Mais elle ne permet pas de produire plus. Mme Catherine GERDIL : Le système de culture cellulaire n'est pas aussi performant en termes de productivité que le système de culture sur œufs. M. le Président : Si j'ai bien compris, cette nouvelle technologie ne pose plus de problèmes de recherche, mais des problèmes de développement et d'industrialisation. Est-ce qu'un coup de « booster » financier vous permettrait d'accélérer les choses ? M. Jacques BERGER : Je ne le pense pas. En revanche nous souhaiterions réfléchir avec les autorités françaises sur l'approvisionnement en œufs. M. le Président : En tant qu'industriels, vous réfléchissez en fonction des intérêts de votre entreprise, et c'est normal. Il reste que, de notre côté, nous sommes confrontés à une question de santé publique de dimension mondiale. Il nous faudra bien, à un moment, faire des choix. Si nous décidons de ne pas mettre en place maintenant de nouvelles chaînes de production, nous manquerons de vaccins au moment où, éventuellement, la pandémie se déclarera. Savez-vous si, au niveau gouvernemental ou intergouvernemental, on s'est interrogé sur l'intérêt qu'il y aurait à choisir une formule plutôt qu'une autre ? Un jour ou l'autre, on nous interpellera, et on vous interpellera, à juste titre, sur ce que nous n'aurons pas fait au moment où il était encore temps d'agir, et alors que nous étions parfaitement conscients du problème. Vous nous avez dit que, pour vous, des centaines de millions d'euros représentaient beaucoup. Bien sûr. Mais ce n'est pas hors de proportion pour un Etat européen ou pour les Etats-Unis ; on sait dépenser beaucoup dans d'autres secteurs. Y a-t-il eu débat sur les capacités de production au niveau mondial, sur les choix à faire en matière d'investissements dans de nouvelles structures de production ? M. Pierre HELLIER : Pour compléter cette question : actuellement, si on décide de construire une nouvelle usine, ce ne peut être que pour produire à partir des œufs ? M. Jacques BERGER : En effet. M. Didier HOCH : Oui, le débat sur les capacités de production a lieu. Il a commencé avec l'OMS. Il va se prolonger, à la fin du mois, avec la rencontre avec le commissaire Kyprianou. En janvier ou février, une grande réunion est prévue avec l'OMS. Aujourd'hui, nous n'avons certainement pas, au niveau mondial, les capacités de production suffisantes. C'est un fait, inutile d'en discuter pendant des heures. Mais il faut savoir si ce qu'ont déjà prévu les fabricants, qui ont quand même un peu anticipé sur la pandémie, suffira à couvrir les besoins, ou s'il faut faire davantage. Nous sommes confrontés à des questions de santé publique. Le problème n'est pas de choisir entre le cellulaire et la culture sur œufs. Il faut faire les deux : le cellulaire est peut-être l'avenir, dans la mesure où il nous affranchirait de cette contrainte d'approvisionnement en œufs. Mais en même temps, il faut continuer à travailler sur les œufs et aider les industriels à prendre des risques pour produire davantage d'œufs. M. Jean-Pierre DOOR, rapporteur : Quel type de collaboration attendez-vous des pouvoirs publics, français et européens ? Que souhaiteriez vous, au-delà des accords que vous avez déjà passés ? M. Didier HOCH : Le problème, pour un industriel, n'est pas tant d'investir que de risquer de construire des usines qu'on ne pourrait pas faire tourner. Il faut que les vaccins produits soient utilisés. On peut penser à la constitution d'un fonds d'achat européen pour assurer la couverture « grippe » des populations des pays en voie de développement. Ce ne serait pas très compliqué. M. le Président : Est-ce que cela représente beaucoup d'argent ? M. Didier HOCH : Une unité de production nouvelle d'œufs coûte 200 millions d'euros. Cela permet de fabriquer une centaine de millions de doses de vaccins trivalents. Idéalement, il en faudrait une ou deux de plus. M. Jacques BERGER : Je tiens à revenir sur les propos précédents : il est impossible qu'une usine ne tourne pas. Nous le constatons dans nos propres bâtiments : la « cuisine » biologique est une cuisine fine et pour la fabriquer, on ne trouve pas tout dans les livres ; l'ancienneté et le savoir-faire sont tout aussi essentiels. M. le Président : Ne peut-on faire que des vaccins grippaux dans vos usines ? Ne pourrait-on pas, demain, les convertir en unités de fabrication de vaccins contre le paludisme ou la polio ? M. Didier HOCH : Non. M. le Président : Combien de temps faut-il pour construire une nouvelle usine ? M. Didier HOCH : De quatre à cinq ans. M. le Président : Ne pourrait-on réduire ce laps de temps ? M. Jacques BERGER : Nous le souhaiterions. Le problème est d'ordre réglementaire, et c'est donc sur la phase réglementaire qu'on pourrait gagner du temps. En gros, il faut compter six à huit mois pour la conception et l'obtention des autorisations locales. Ensuite, à peu près deux ans pour construire l'usine, commander les équipements et les incorporer. Enfin dix-huit mois à deux ans pour la validation réglementaire de l'ensemble. Nous tentons désespérément de réduire ces délais. M. le Président : Je reconnais que nous sommes les premiers à vous empêcher d'aller vite : après tout, notre métier est de fixer des normes ! Mais il se trouve, en l'occurrence, que nos souhaits respectifs iraient dans le même sens. M. Jacques BERGER : Actuellement, et a fortiori en cas de pandémie, les relations avec les autorités de tutelle sont essentielles. Si la situation se présentait, nous serions amenés à les solliciter. M. Pierre HELLIER : Il faut malgré tout trouver rapidement des interlocuteurs pour sécuriser votre filière « œufs ». M. le Président : Madame, Messieurs, je vous remercie. Visio-conférence, depuis Genève, avec le Docteur Margaret CHAN, sous-directrice générale à l'Organisation mondiale de la santé (OMS), en charge de la grippe pandémique Présidence de M. Jean-Marie LE GUEN, Président M. le Président : La mission de l'Assemblée nationale sur la grippe aviaire entend, d'une part, contrôler la mise en œuvre du plan français de préparation contre la pandémie, d'autre part, assurer la transparence de l'information vis-à-vis de nos concitoyens. Je vous remercie d'avoir accepté de dialoguer avec nous depuis Genève. Nous savons que vous avez joué un rôle important lors de précédentes pandémies, et vous avez aujourd'hui un rôle éminent à l'OMS. Pourriez-vous nous dire, pour commencer, comment vous appréciez la situation actuelle et son évolution ? Mme Margaret CHAN : Au nom de l'OMS et des nombreux pays qui luttent pour enrayer la grippe aviaire, ainsi que de l'ensemble de la communauté internationale, je souhaite remercier la France pour son rôle de leadership dans la crise actuelle. Le virus H5N1 est une menace pour l'être humain et un ennemi très tenace pour les volailles. Un certain nombre de pays d'Asie luttent sans succès depuis deux ans pour tenter d'enrayer cette maladie, qui s'est propagée très rapidement. Jusqu'à présent, près de 150 millions d'oiseaux, domestiques ou sauvages, sont morts ou ont été détruits. Des pays qui pensaient avoir gagné la bataille contre cette maladie ont finalement échoué. Quinze pays dans le monde, essentiellement en Asie, ont fait état de la présence de la maladie. On considère aujourd'hui que le virus est endémique dans plusieurs de ces pays. Malheureusement, il s'est surtout implanté dans de petits élevages de régions rurales, là où le contrôle est très difficile à exercer et où les possibilités de contact avec l'homme sont nombreuses. La vie de 300 millions de paysans a été bouleversée. On ne sait pas quand l'épizootie va s'arrêter. Les virus aviaires sont imprévisibles. L'une des dernières surprises que le H5N1 a réservées est sa capacité à se faire transporter sur de longues distances par des oiseaux migrateurs, entraînant des flambées dans de nouvelles régions. Les scientifiques sont presque certains que les oiseaux migrateurs ont apporté le virus en Europe au début de l'année. Ils s'accordent à dire que la propagation du virus dans de nouvelles zones est à peu près inévitable, notamment sur le continent africain, prochaine étape des oiseaux migrateurs. Actuellement, la barrière des espèces est importante. Le H5N1 est reste essentiellement une maladie d'oiseaux, mais lorsqu'il franchira cette barrière pour infecter les humains, il provoquera de graves maladies. Chez l'être humain, l'évolution clinique de la maladie est très agressive : jusqu'ici, 130 cas de contamination humaine ont été rapportés dans cinq pays : le Cambodge, la Chine, l'Indonésie, la Thaïlande et le Vietnam ; plus de la moitié des malades sont décédés. Les flambées de grippe aviaire qu'on a pu observer sont sans précédent de par leur étendue géographique, leur persistance et le nombre d'oiseaux touchés. Le défi est immense pour tous. Le réseau des instituts Pasteur en Asie a permis d'établir des diagnostics fiables. Le fait que ces instituts soient fortement implantés en Afrique est rassurant. La décision récente de la France de les renforcer, ainsi que d'autres réseaux techniques en Asie et en Afrique, ne saurait mieux tomber. Une de nos plus grandes inquiétudes est que le H5N1 se transforme en un virus susceptible de se transmettre très facilement d'une personne à une autre, se propageant comme la grippe ordinaire par l'air, la toux, l'éternuement. Lorsqu'il y aura eu contamination interhumaine, la pandémie commencera. On considère qu'elle sera alors impossible à stopper. A une époque comme la nôtre, où les populations sont très mobiles grâce aux transports aériens, les experts considèrent qu'un virus pandémique peut toucher en trois mois toutes les régions du monde, sans exception. Certaines mesures pourront être prises pour retarder l'arrivée du virus, mais tous les pays seront touchés. Cela dit, on ne peut pas prédire avec exactitude ni le moment ni la gravité de cette future pandémie. On ne peut pas non plus garantir que le H5N1 sera l'agent causal de cette pandémie. Mais comme il est désormais endémique dans beaucoup de pays et qu'il atteint de nouvelles zones, la probabilité qu'il cause une pandémie a considérablement augmenté. Les participants à la réunion sur la grippe aviaire et la grippe pandémique, qui a eu lieu ce mois-ci au plus haut niveau à l'OMS, ont estimé qu'une telle probabilité était imminente et presque certaine. Il est donc prudent, pour tous les pays, de s'y préparer. Au cours de cette réunion, l'intervention de la délégation française a recueilli des applaudissements particulièrement chaleureux. La France a indiqué que la coordination et la collaboration internationales étaient extrêmement importantes, dans la mesure où différents acteurs devaient agir de manière urgente à différents niveaux : il faut contrôler les flambées du virus chez la volaille, empêcher celui-ci de s'installer de manière permanente sur des zones importantes et limiter les possibilités d'émergence d'un virus pandémique. La communauté internationale doit se préparer à cette éventualité, pour pouvoir intervenir rapidement, dès qu'on aura les premiers signes de transmissibilité du virus d'une personne à l'autre. La France a vu là une chance à saisir, malgré la gravité de la situation. Cette crise pourrait en effet être l'occasion de trouver des solutions susceptibles d'améliorer de façon permanente la capacité de la communauté internationale à déceler et contenir de nouveaux agents pathogènes dangereux. Elle pourra ainsi mieux se préparer, et pour toujours, à se défendre contre de nouvelles maladies émergentes. Car le H5N1 ne sera certainement pas la dernière menace qui nous viendra du monde animal. Et comme tous les pays font partie d'une chaîne qui forme notre système d'alerte international, en renforçant la capacité des pays les plus vulnérables, on rendra le monde plus sûr. La France a également appelé l'attention sur la nécessité de disposer d'un soutien technique sur le terrain. Depuis un certain nombre d'années déjà, elle est l'un des plus importants partenaires de l'OMS, ses scientifiques et épidémiologistes jouant un grand rôle lors de flambées virales précédentes. Elle a apporté un soutien technique, financier et structurel. Elle a accueilli à Lyon le centre de l'OMS créé au cours de l'année 2000. Ce centre a pour but d'améliorer les systèmes nationaux de surveillance, d'alerte, de réponse et de diagnostic concernant les maladies susceptibles de se transformer en épidémies. Ce service rendu à la communauté internationale est grandement apprécié. La réunion de ce mois-ci, dont je viens de parler, a clarifié la menace qui plane sur nous tous. Il est absolument urgent de se préparer à l'éventualité d'une pandémie. Indépendamment du nombre de décès qu'elles provoquent, les pandémies sont à l'origine de bouleversements socio-économiques importants. La Banque mondiale a ainsi estimé que la première pandémie du XXIe siècle pourrait entraîner des pertes économiques mondiales d'environ 800 milliards de dollars en un an, notamment à cause du manque de coordination des efforts destinés à éviter l'infection. Les gouvernements les plus capables de fournir de l'information en temps utiles seront les mieux placés pour limiter les dommages créés par les réactions de panique. C'est pourquoi les institutions étatiques devront donner confiance à la population, même en période très difficile. La France a beaucoup fait dans le domaine de la préparation aux pandémies. Les vaccins sont considérés par tous comme la première ligne de défense si l'on veut réduire la morbidité et la mortalité. Mais le vaccin pandémique devant correspondre au véritable virus ennemi, sa production commerciale ne pourra pas commencer avant l'apparition du virus. Aucun pays ne pourra donc subvenir à ses propres besoins au début de la pandémie, même pendant plusieurs mois après qu'elle se soit déclarée. Du fait de leurs faibles capacités de production, certains pourraient ne jamais pouvoir protéger leur population. Les antiviraux peuvent protéger certains travailleurs exposés, notamment dans les hôpitaux, et améliorer la perspective de survie des personnes infectées. Par conséquent, il est recommandé de constituer des stocks nationaux d'antiviraux, qui devront être utilisés en début de pandémie. Sans, bien sûr, offrir la même protection que les vaccins, ils auront un important rôle d'appui. La France a une capacité nationale de production de vaccins et un stock d'antiviraux. Pendant une pandémie, d'autres mesures non pharmaceutiques, comme la mise en quarantaine, les restrictions de voyages, la fermeture des écoles, l'interdiction des rassemblements publics, le port de masques, auront un rôle à jouer. L'efficacité des mesures individuelles dépendra des caractéristiques du virus, qui ne peuvent pas être connues à l'avance, comme la gravité de la maladie, son mode de propagation, ou encore les groupes les plus exposés : est-ce que ce seront surtout les jeunes et les personnes âgées qui seront infectées, comme pendant les pandémies de 1957 et de 1968 ? Est-ce que la grippe tuera surtout des jeunes adultes, comme pendant la pandémie de 1918 ? Nous ignorons aussi le temps dont nous disposerons pour prendre des mesures d'isolation et de quarantaine. Il y a beaucoup d'inconnues. L'OMS, grâce au soutien de réseaux virtuels, de scientifiques et de cliniciens, fera de son mieux pour suivre l'évolution de la pandémie en temps réel, trouver des réponses et conseiller les pays sur les mesures considérées comme les plus efficaces. En conclusion, monsieur le Président, nous avons à relever un défi important, mais imprévisible. Nous nous préparons au pire. Ce sera l'occasion de démontrer notre solidarité. En résumé, il faut agir vite, agir ensemble et efficacement. M. le Président : Merci pour votre exposé, qui était très intéressant. Vous avez déjà répondu à plusieurs de nos questions. Notre rapporteur voudrait vous en poser quelques autres. M. Jean-Pierre DOOR, rapporteur : Quelle est la situation en Chine aujourd'hui ? Il paraît que ce pays a l'ambition de vacciner cinq à six milliards de volailles. Est-ce possible ? Mme Margaret CHAN : Avant de vous répondre, j'aimerais vous présenter le docteur Guénaël Rodier, présent à mes côtés, un scientifique français très connu, qui travaille en étroite collaboration avec nous dans le domaine des maladies transmissibles. M. Guénaël RODIER : Je suis là pour assister le docteur Chan, si des questions intéressant plus particulièrement l'Europe lui étaient posées. Mme Margaret CHAN : Jusqu'à présent, l'OMS a reçu confirmation de l'existence de trois cas humains de grippe en Chine. Une délégation d'experts de l'OMS se trouve sur le terrain et travaille avec le gouvernement chinois. Nous ne connaissons pas exactement l'étendue exacte de l'infection humaine, mais nous savons qu'il y a eu dernièrement vingt flambées chez les oiseaux. Il ne serait donc pas impossible qu'apparaissent des cas sporadiques chez les hommes. Je ne sais pas s'il est possible de vacciner des milliards de volailles. Je considère en tout cas que la vaccination est une mesure importante. La FAO et l'OIE la recommandent, ainsi que l'abattage. M. le Président : Je voudrais vous interroger sur la déclaration de pandémie. Quels seraient les critères, épidémiologiques ou autres, retenus par l'OMS pour passer de l'état d'alerte dans lequel nous sommes à l'état de pandémie ? Quel processus serait alors suivi par l'OMS ? Il serait important de le connaître. En France, par exemple, une partie du plan « pandémie » est articulée autour de cette déclaration. Mme Margaret CHAN : L'OMS a adopté des lignes directrices en concertation avec les experts et les scientifiques de plusieurs pays. Elle a défini six phases. Aujourd'hui, nous sommes en phase d'alerte 3. Nous passerions en phase 4 par exemple si nous constations que la maladie se transmettait facilement parmi les humains. En phase 6, ce serait la pandémie. Le passage à la phase 4 suppose que trois critères soient remplis. Deux le sont déjà. Le premier est l'arrivée d'un nouveau virus grippal ; c'est le cas du H5N1. Deuxième critère : le franchissement, par ce virus, de la barrière des espèces ; or, le H5N1 est déjà passé de l'animal à l'homme. On a donc le deuxième critère. Enfin, troisième critère, la transmission facile de la maladie d'une personne à une autre : ce n'est pas encore le cas. C'est le signe qu'on attend. Quand il sera repéré, nous passerons alors à la phase d'alerte 4, puis 5, puis 6 selon l'importance de la transmission. Le directeur général de l'OMS, au vu de certains rapports, consultera un panel d'experts. S'ils concluent que la situation a empiré, il déclarera le passage à la phase suivante. C'est à l'OMS, qui est, avec 192 États membres, la première agence de santé publique mondiale, qu'il reviendra d'annoncer publiquement la pandémie. Il est important que les plans nationaux de lutte contre la pandémie soient alignés sur les phases de l'OMS. Sinon, ce serait la confusion. M. le Président : Je voudrais revenir sur le passage de la phase 3 à la phase 4. Admettons qu'un pays ne vous indique pas qu'il y a eu transmission facile du virus à l'homme mais que vous disposiez par ailleurs d'indications allant dans ce sens. L'OMS est-elle tenue par les déclarations officielles des pays ou peut-elle agir de sa propre initiative, en se basant sur une très forte probabilité ? Mme Margaret CHAN : L'action de l'OMS ne dépend pas uniquement des notifications qui lui sont faites par les pays membres. Tous les matins, ici, au centre opérationnel, nous passons en revue toutes sortes d'informations. Il peut s'agir d'extraits de presse, il peut s'agir de rumeurs. Nous vérifions tout. S'il nous semble que les rumeurs sont fondées, nous contactons le pays concerné. Nous avons, en effet, des représentants dans 140 pays. Nous offrons une assistance technique et nous envoyons des équipes sur place, comme ce fut le cas en Chine. Mais je précise que c'est la Chine elle-même qui avait invité l'OMS à travailler avec elle. M. le Président : Avez-vous aujourd'hui des moyens financiers et humains à la hauteur de votre tâche ? Pourriez-vous nous faire un rapide bilan de la conférence de Genève ? Comment avez-vous réagi aux propos de l'OIE, qui considère que l'OMS se focalise trop sur les problèmes de santé humaine et pas assez sur les problèmes de santé animale ? Mme Margaret CHAN : La réunion de Genève du 7 au 9 novembre a été organisée conjointement par l'OIE, la FAO, l'OMS et la Banque mondiale. Douze mesures préventives ont été proposées, dans le secteur de la santé animale comme dans celui de la santé humaine. Il s'agit d'aider les pays à se préparer contre la pandémie, notamment ceux qui ont des systèmes de dépistage très limités.L'OIE, la FAO, l'OMS ont fait des recommandations stratégiques qui ont reçu le soutien des scientifiques et des gouvernements. Il nous faut travailler tous ensemble. Un risque dans un pays est un risque pour le monde entier. Certains se sont demandés pourquoi nous nous intéressions tant à la santé de l'homme. Monsieur le président, je suppose qu'en tant que dirigeant politique, lorsque le monde vous donne des signaux d'alerte, vous vous sentez tenu d'agir et ne voulez pas qu'on vous reproche ensuite de n'avoir rien fait pour protéger la santé humaine. L'OMS considère que les mesures de prévention doivent concerner l'animal comme l'être humain. Lors de la réunion à Pékin de janvier prochain, la communauté internationale prendra la décision de soutenir les pays où la surveillance et le dépistage précoce sont faibles, ce qui nécessitera des ressources supplémentaires. Les trois organismes techniques que sont l'OIE, la FAO et l'OMS présenteront à Pékin leur évaluation et tenteront de faire passer le message que la grippe aviaire et le risque d'une pandémie constituent un problème international nécessitant une collaboration et une solution internationales. Le directeur général de l'OMS et moi-même avons rencontré le président Jacques Chirac et certains représentants du ministère des affaires étrangères et du ministère de la santé. Nous sommes très impressionnés par le niveau d'implication de votre gouvernement pour protéger la population française. Nous savons également que vous avez proposé votre soutien aux pays en développement - soutien financier et soutien au niveau des laboratoires. En résumé, le monde doit débloquer des ressources supplémentaires pour faire face à cette nouvelle menace. Il y a déjà le VIH : nous ne voulons pas devoir déshabiller Pierre pour habiller Paul. Dans le cas du SRAS, le problème a pu être enrayé en sept à huit mois. Le SRAS n'a touché que trente pays. Il n'a contaminé que 8 000 personnes et a provoqué moins de 800 décès. Les pertes n'ont été « que » de 30 milliards de dollars. Ce n'est rien, en comparaison de ce que pourrait entraîner une pandémie due au H5N1 ! Voilà pourquoi nous devons nous y préparer. Et nos investissements d'aujourd'hui ne seront pas perdus demain. Il faut bien voir, en effet, que le monde continuera à être confronté à des infections nouvelles. Tous les investissements que nous ferons cette fois-ci nous serviront à long terme, pour d'autres maladies. J'exhorte donc les gouvernements à investir dans la surveillance des maladies, dans l'intérêt de la sécurité sanitaire mondiale. M. Gérard BAPT : L'objectif d'indemnisation des éleveurs dont l'élevage a été victime de l'épizootie sera-t-il atteint ? Il me semble important qu'ils soient indemnisés, et pas seulement à moitié mais en totalité si l'on veut diminuer les risques d'extension et de mutation du virus, et à terme, éradiquer l'épizootie. M. François GUILLAUME : Nous n'en sommes qu'au stade préventif d'une pandémie. Comme ce sont les volailles qui risquent de transmettre le virus, plus ou moins muté, ne serait-il pas utile de vacciner systématiquement l'ensemble du cheptel, par exemple grâce à un vaccin buvable ? Pensez-vous qu'on pourrait ainsi assez rapidement éradiquer ce virus, comme on a éradiqué la fièvre aphteuse des bovins ? M. le Président : Madame, nous savons que l'OMS est davantage centrée sur la santé humaine, mais votre point de vue sur les questions de santé animale est important. Mme Margaret CHAN : Je suis en effet spécialisée dans le domaine de la santé publique. Mais à Hong Kong, en tant que directeur de la santé, je me suis occupée de la première flambée d'H5N1 et j'ai pu être formée par un certain nombre d'experts du secteur animal. La question de l'indemnisation des éleveurs est très importante, car s'il n'y a pas d'indemnisation, la maladie ne sera pas déclarée. Certains pays indemnisent à 100 %, d'autres pas. Il faut en discuter soigneusement. Doit-on ou non vacciner la volaille ? Pour l'instant, il n'existe pas de vaccin oral pour la volaille. L'OIE et la FAO ont publié un excellent document, qui dresse une liste de mesures susceptibles d'être prises en cas de flambée de grippe aviaire. Première recommandation : abattre tous les oiseaux dans la zone touchée, voire au-delà. La vaccination est possible, voire obligatoire. Mais ce n'est pas une solution à long terme : elle ne peut servir qu'à éradiquer une flambée de grippe aviaire. En 1997, à Hong Kong, nous avons dû prendre une décision politique très dure. Nous avons fait tuer tous les poulets, soit 1,5 milliard d'animaux en trois jours. Il a fallu indemniser les éleveurs et, après l'abattage, nettoyer les exploitations. Nous nous sommes ainsi débarrassés du virus pendant plusieurs années. Mais il est revenu. Finalement, Hong Kong a adopté une politique de vaccination, qui lui a permis de se débarrasser du problème. La vaccination ne peut intervenir seule, elle doit s'accompagner d'autres mesures. Par exemple, il faut que les pays qui vaccinent disposent de moyens permettant de savoir si une augmentation des anticorps chez un animal est due au vaccin ou à une infection. Cela dit, je ne suis pas vétérinaire, et je préfère vous renvoyer au document stratégique préparé par la FAO et l'OIE dont je viens de parler. M. le Président : Nous connaissons le rôle tout à fait remarquable que vous avez joué à Hong Kong lors de la crise de grippe aviaire en 1997 puis du SRAS en 2003. Le fait que vous soyez aujourd'hui à l'OMS nous garantit que cette organisation se mobilisera au service de la santé publique au plan mondial. En période de déclaration de pandémie, recommanderez-vous la fermeture des frontières, et dans quelles conditions ? Comme dans tous les pays aujourd'hui, la France réfléchit aux moyens médicaux utilisables : vaccins, médicaments, etc. Nous nous heurtons parfois à l'existence de brevets. Est-ce que, dans des circonstances tout à fait exceptionnelles, l'OMS ne pourrait-elle pas jouer un rôle aussi normatif et aussi important que l'OMC ? Ne pourriez-vous pas intervenir, au plan mondial, dans le domaine économique et industriel ? Avez-vous réfléchi à ces questions ? Mme Margaret CHAN : Je réfléchis chaque jour au problème. Dans la mesure où l'OMS est la principale agence de santé publique, nous nous demandons sans cesse comment aider les pays membres et les populations. Compte tenu de ce que l'on sait sur le virus, la fermeture des frontières ne suffira pas à arrêter la pandémie. Tout au plus pourrait-elle la retarder. En 1968, certains pays ont fermé leurs frontières et ont ainsi réussi à retarder l'apparition de la pandémie de quelques mois. Si le virus mute, mais seulement au point de ne causer qu'un nombre limité de malades, la fermeture ne se fera pas. Compte tenu des réglementations internationales en matière de santé, nous ne voulons pas imposer des restrictions inutiles s'agissant de la circulation des biens et des personnes. C'est très important pour l'économie mondiale. Il faut donc suivre l'évolution du virus pour en comprendre les caractéristiques et faire aux États membres des recommandations judicieuses. L'OMS préconise de nombreuses mesures à prendre en parallèle : vaccins, mesures pharmaceutiques et non pharmaceutiques. C'est ainsi que la solidarité internationale et des mesures traditionnelles de santé publique nous ont aidés à arrêter le SRAS. On a sans doute un peu trop parlé des antiviraux : ils sont utiles, certes, mais ils ne sont pas la panacée. Concernant les brevets, à ce stade, et compte tenu des discussions que nous avons eues avec les entreprises, je ne crois pas que les brevets constitueront des obstacles. Roche, qui fabrique le Tamiflu, est en discussion avec de nombreux laboratoires, dans plusieurs pays du monde, pour travailler en collaboration avec eux. Il envisage même des licences et autres arrangements. Le problème qui se pose avec le Tamiflu concerne plutôt les capacités de production et la disponibilité des matières premières. C'est un médicament difficile à fabriquer, que Roche est prêt à fabriquer avec tout laboratoire, où qu'il soit, ayant les capacités pour cela. M. le Rapporteur : Vous nous avez parlé tout à l'heure de la prochaine escale des oiseaux migrateurs en Afrique, avec tous les risques qui en découlent. Quels sont les moyens dont dispose l'OMS pour surveiller ce qui va se passer en Afrique à la fin de la migration ? Mme Margaret CHAN : Nous sommes effectivement inquiets. J'ai déjà eu plusieurs réunions avec nos directeurs régionaux et nos experts de la région Afrique pour étudier la façon d'aider les pays concernés à développer leur système de surveillance. Le problème, en Afrique, est que beaucoup de pays n'ont pas de dispositifs de surveillance des maladies ou en ont de trop faibles ; leur système de santé est, en plus, également très faible. Comme cela prendrait trop de temps de renforcer leurs capacités, nous devrons faire preuve d'imagination et trouver d'autres méthodes pour les aider. Si nous arrivons au stade de la pandémie, le temps jouera contre nous. L'OMS a plusieurs stratégies : à court terme, et ensuite à moyen et long terme - c'est-à-dire sur trois à dix ans. C'est sur le court terme qu'il faut aujourd'hui se concentrer. Nous devons mettre en place des programmes de dépistage en Afrique. Dès que l'OIE et l'OMS recevront une notification de la part de ces pays, elles mobiliseront les ressources mondiales pour les aider. Comme je l'ai déjà dit, l'Institut Pasteur dispose d'un important réseau sur le continent. Nous sommes prêts à travailler avec tout gouvernement ayant la volonté d'aider les pays africains. Le centre de l'OMS de Lyon peut également y contribuer. Nous envisageons d'envoyer des équipes suivre des programmes de formation. Nous devrons également nous pencher sur les capacités de ces pays en termes d'infrastructures. A court terme, nous avons besoin de transparence et d'un système d'alerte précoce. Cela nous permettra de contenir la maladie le plus tôt possible. Si on ne peut pas la prévenir, on pourra au moins la retarder. M. le Président : Merci, Madame. Nous avons été très honorés de l'entretien que vous avez bien voulu nous accorder. Peut-être serons-nous amenés, dans les semaines ou les mois qui viennent, à vous rendre visite à l'OMS ou à avoir un nouveau contact avec vous. Nous connaissons, en effet, l'autorité qui est la vôtre sur ces sujets. Notre pays a la volonté de se mettre aux côtés de l'OMS pour tenter de faire face à ce grand danger. Pourriez-vous nous donner des précisions sur la réunion de Pékin ? Quand aura-t-elle lieu et qui réunira-t-elle ? Mme Margaret CHAN : Monsieur le Président, mesdames et messieurs les députés, je vous remercie de m'avoir donné l'occasion de traiter d'un sujet aussi important. J'espère vous recevoir bientôt à l'OMS. La conférence de Pékin aura lieu les 17 et 18 janvier 2006. Elle est co-organisée par la Banque mondiale, la Commission européenne, les trois organismes techniques que nous sommes, et David Nabarro, le coordonateur des Nations Unies pour la grippe aviaire et humaine. Elle est destinée à aider les pays à mettre en place des plans intégrés portant sur la santé animale et humaine. C'est une réunion d'engagement de donateurs, de bailleurs de fonds. Nous y attendons les représentants des ministères responsables de l'aide au développement, des affaires étrangères, et de tous ceux chargés de l'aide internationale. M. le Président : Merci beaucoup Madame, pour cet entretien vraiment très intéressant. Audition de M. Xavier Bertrand, ministre de la santé et des solidarités Présidence de M. Jean-Marie Le Guen, Président M. le Président : Notre discussion d'aujourd'hui ne portera pas, comme cela était initialement prévu, sur la nouvelle version du plan gouvernemental de lutte contre la pandémie, car il est encore en cours de finalisation. Après nous être demandés, le Ministre et moi-même, si nous maintenions cette audition, nous avons finalement décidé de la maintenir pour avoir l'occasion d'aborder ensemble la dimension internationale et européenne du dossier grippe aviaire. Nous entendrons le Ministre sur la version actualisée du plan « Pandémie » dans les prochaines semaines. M. Xavier BERTRAND : L'officialisation de la nouvelle version du plan pandémie est, en effet, une question de jours. Des réunions interministérielles ont d'ores et déjà eu lieu et nous n'attendons plus qu'une ultime réunion ministérielle, qui devrait se tenir très bientôt. Sitôt qu'elle aura eu lieu, je reviendrai devant votre mission pour vous présenter le plan actualisé. Nous avons tenu à décliner le plan français sur le même phasage que celui de l'OMS, modifié en mai dernier. La version actualisée du plan va ainsi distinguer six phases, réparties en trois périodes. Je peux les évoquer devant vous car elles sont déjà définitivement calées. La première période, dite interpandémique, couvre deux phases : la phase 1, où n'est constatée la présence d'aucun virus dit hautement pathogène ; la phase 2, correspondant à l'apparition d'un virus hautement pathogène chez l'animal, que ce soit à l'étranger ou en France. La deuxième période, dite de l'alerte pandémique, correspond à l'apparition d'une contamination humaine et distingue trois phases : la phase 3, dans laquelle nous nous trouvons aujourd'hui, où l'on a pu constater une transmission de l'animal à l'homme ; la phase 4, qui est celle d'une contamination interhumaine limitée ; la phase 5, qui est celle d'une contamination plus étendue, mais géographiquement localisée. La troisième période est la période pandémique, qui correspond à une forte transmission interhumaine et à une extension géographique rapide. C'est la phase 6. Dès la fin 2004, le ministère de la santé avait commandé 13,8 millions de traitements antiviraux. Au moment où je vous parle, 12 millions de traitements ont déjà été livrés - 11,8 millions de Tamiflu et 200 000 de Relenza. Nous avons commandé 10 millions supplémentaires de traitements de Tamiflu et 9 millions supplémentaires de Relenza, qui seront livrés en 2006 et au début de l'année 2007. Une partie du Tamiflu se présente en vrac. Il peut être transformé en gélules en deux mois environ par la pharmacie centrale des armées. Je précise que la péremption de ces stocks en vrac est actuellement de dix ans. Avec l'ensemble de ces traitements, la France se situerait à un niveau de couverture supérieure à celui recommandé par l'OMS, qui est de 25 % de la population. Nous pourrions ainsi prévenir les risques de résistance et, aussi, nous adapter dans les stratégies mises en œuvre en fonction des caractéristiques du virus et de la pandémie. S'agissant des vaccins, 40 millions de vaccins pandémiques ont d'ores et déjà été réservés : 28 millions auprès de Sanofi-Pasteur et 12 millions auprès de Chiron. Nous sommes actuellement en pourparlers avec cinq grands groupes mondiaux, de façon à étendre la couverture vaccinale jusqu'à 62 millions de traitements vaccinaux. Je voudrais maintenant aborder la coordination européenne entre les États membres. Un conseil informel des ministres de la santé s'est tenu à Hertfordshire le 21 octobre. Un Conseil européen, très formel celui-ci, se tiendra le 9 décembre prochain à Bruxelles. L'idée est que nous avons besoin de renforcer la coordination entre tous les États membres. Pour cela, il nous faut renforcer la communication entre eux. Le commissaire européen Markos Kyprianou et moi-même avons demandé à chacun des États membres de nous informer, le 9 décembre, de leur état de préparation en nous indiquant : si leurs plans sont en phasage complet avec l'OMS ; quelles sont leurs disponibilités en médicaments ; quelles sont leurs réservations vaccinales ; quelles sont leurs dotations en masques ; quel est leur niveau d'organisation. C'est important, même si les résultats officiels de l'exercice Common Ground qui s'est tenu la semaine dernière ne sont pas encore communiqués par la Commission européenne. Nous attendons d'ailleurs ces résultats pour valider définitivement notre plan ; il reste des points en suspens comme le contrôle renforcé aux frontières ou la mutualisation des capacités de rapatriement des Français et des autres Européens à l'étranger. Nous devons également savoir si nous avons la volonté et la capacité de constituer des stocks de médicaments au plan européen, en plus des stocks nationaux. Le commissaire européen avait fait une proposition en ce sens, que j'ai l'intention de reprendre le 9 décembre pour qu'elle émane d'un Etat membre, puisque la Commission n'a pas de compétence en matière de santé. Nous avons en effet l'impérieuse nécessité de doter l'Europe de stocks supplémentaires, de façon à mutualiser notre action en faveur de pays qui ne seraient pas suffisamment pourvus, et aussi à développer des capacités d'action internationales. Nous avons besoin de renforcer la coordination de l'information délivrée aux voyageurs. Nous avons d'ores et déjà renforcé cette information dans les aéroports français, et nous la renforcerons encore davantage en cas de transmission d'homme à homme. Les vols internationaux pourront être suspendus de manière temporaire. La question du contrôle aux frontières nationales et européennes doit aussi être posée et recevoir une réponse claire de la part de l'ensemble des États membres de l'Union européenne. Il faut également savoir si nous sommes capables d'avoir une veille sanitaire, une veille épidémiologique, et s'il existe une volonté européenne de renforcer les moyens de recherche à l'échelle européenne, pour aider les pays directement exposés au risque de grippe aviaire. Chacun doit bien avoir conscience qu'aujourd'hui, il faut prendre le mal à la racine et apporter notre assistance à tous les pays qui sont en première ligne. Ce n'est pas seulement une question de solidarité : c'est aussi le moyen de nous protéger nous-mêmes. Aujourd'hui, la demande la plus pressante que formulent ces pays est qu'on leur apporte un soutien en matière de veille sanitaire et de veille épidémiologique, un soutien pour l'analyse des données recensées et la recherche. On pourra répondre à leur attente si la coordination, à la fois européenne et internationale, est au rendez-vous. La France a choisi de renforcer son aide aux structures multilatérales, qu'il s'agisse de l'OMS, de l'OIE ou de la FAO. Lors de la conférence des donateurs qui s'est tenue à Genève du 7 au 9 novembre 2005, la Banque mondiale a chiffré entre 750 millions et un milliard de dollars le montant de l'aide à apporter aux pays peu équipés pour qu'ils puissent faire face non seulement à l'épizootie, mais aussi à une éventuelle pandémie - en dehors bien sûr des coûts vaccinaux et des antiviraux. Elle a estimé les besoins urgents à 80 millions de dollars. La France a d'ores et déjà indiqué qu'elle verserait 12 millions de dollars, soit 10 millions d'euros, ce qui couvre 15 % des besoins recensés sur le plan international. Une nouvelle conférence des donateurs aura lieu à Pékin entre le l7 et le 19 janvier - la date n'est pas encore arrêtée. Nous pourrons alors faire le point sur qui donne quoi et comment nous pouvons aider les uns et les autres. Nous avons décidé de renforcer la contribution française contre la grippe aviaire dans les pays qui sont aujourd'hui en première ligne, notamment les pays d'Asie. Quatre experts viennent de prendre leurs fonctions auprès du bureau des ressources animales de l'ASEAN et du bureau de l'OIE à Bangkok. Nous augmenterons nos contributions volontaires pour 2006 de 2,5 millions d'euros supplémentaires. La contribution totale de la France représente aujourd'hui huit postes, dont un auprès de « Vétérinaires sans frontières » à Hanoï. Parallèlement, nous entretenons des liens très étroits avec l'OIE. Mais nous devons aussi réfléchir pour savoir si nous voulons passer des accords bilatéraux de coopération renforcée avec un certain nombre d'États. Après le déplacement que je viens d'effectuer à Hanoï, à Pékin et à Hong Kong, je considère qu'il est indispensable de passer de tels accords. Les pays concernés sont d'ailleurs demandeurs. J'ai proposé, lors de la réunion du G7 + Mexique, qui s'est tenue à Rome le 18 novembre dernier, la mise en place d'une Université de sécurité sanitaire mondiale, qui serait ancrée au sein du pôle de l'OMS de Lyon, sur le modèle de ce qui a été fait il y a quelques années à Malmö avec l'Université de sécurité maritime. Cette proposition, qui permettrait de faire profiter tout le monde des connaissances et de l'expertise d'ores et déjà acquises, a recueilli un large assentiment, non seulement de la part des pays présents au G7 + Mexique, mais aussi du Vietnam ou de la Chine. M. le Président : Je vous propose de commencer la discussion par la question de la gestion, au plan européen et international, d'une crise en phase 4, 5 ou 6, s'agissant, par exemple, du contrôle aux frontières ou du rapatriement des Français de l'étranger. M. Xavier BERTRAND : Je souhaite le maximum de coordination entre les différents États membres, et des politiques communes, s'agissant notamment des contrôles aux frontières. J'ai participé à un exercice grandeur nature qui s'est tenu le 30 juin dernier à Paris. Nous nous sommes aperçus que moins on hésitait à prendre des mesures radicales au début d'une transmission interhumaine, plus on retardait l'arrivée d'un virus sur le territoire européen et donc national. Il faut contrôler les frontières aériennes, dans les aéroports internationaux ; les frontières portuaires ; les frontières terrestres. L'intérêt de cette coopération internationale est justement que les mêmes mesures de protection s'appliquent partout en Europe. Imaginez que nous ayons des mesures de contrôle renforcé à Roissy, mais que de telles mesures ne soient pas prises à l'identique en Allemagne ou à Bruxelles ! Le passager infecté qui descendrait d'avion à Bruxelles et louerait une voiture pour aller en France pourrait donc entrer sur notre territoire sans avoir été détecté. La fermeture des frontières à titre temporaire est une possibilité... M. Jean Michel BOUCHERON : Quelles frontières ? Celles de la France ou celles de Schengen ? M. Xavier BERTRAND : Nous sommes bien dans une logique européenne. Je parle de l'ensemble des frontières de l'Union européenne. Pour pouvoir organiser la réponse sanitaire à une situation pandémique en Asie du Sud-Est, il faut savoir gagner du temps, afin de préparer notre système de santé. Quelqu'un qui arriverait, malade, sur le territoire devra pouvoir y être traité dans les meilleures conditions. Là encore, il faut que nous ayons tous le même niveau de réponse. Ce matin, dans une conférence de presse, le commissaire européen a indiqué qu'il ne donnerait que vers le 10 ou le 12 décembre l'ensemble des résultats de l'exercice du 30 juin dernier. Mais je peux vous dire d'ores et déjà que la question du contrôle aux frontières est une question centrale, qui a été révélée par l'exercice. M. le Président : L'objectif, en fermant, le cas échéant, nos frontières est bien de retarder - l'empêcher serait impossible - l'arrivée de la pandémie en France. Je repose donc la question : le gouvernement veut-il instaurer un contrôle aux frontières Schengen, Union européenne, ou, à défaut, aux frontières nationales ? M. Xavier BERTRAND : Nous disons la même chose que l'OMS : l'objectif est de gagner du temps et de retarder au maximum la propagation du virus. Le plan français prévoit des mesures de contrôle aux frontières, qui seront adoptées prochainement. Au niveau européen, je souhaite que les mesures de contrôle les plus rigoureuses possibles soient prises, avec une détection sanitaire aux aéroports - où se trouve le principal risque - et sur les frontières des vingt-cinq pays de l'Union. Soyons clairs : je parle de l'Union européenne, et donc des frontières de l'ensemble des États membres. M. Jérôme BIGNON : Le gouvernement semble craindre que le niveau de conscience ou d'exigence ne soit pas partout le même. M. le Président : Pour ma part, je poserais la question inverse : le gouvernement ne redoute-t-il pas une réaction de « sur-précaution » de certains pays ? M. Xavier BERTRAND : Si nous voulons être efficaces, il faut que, dans l'ensemble des aéroports de l'Union européenne, les mêmes messages soient passés aux passagers, que les équipages, personnel navigant et personnel au sol, aient bénéficié du même type d'information et de formation sur la conduite à tenir si un passager en provenance d'un pays qui connaîtrait une situation pandémique a été contaminé ou présente des risques de suspicion très forts. Nous souhaitons qu'on institue un mode de contrôle - caméras thermiques ou thermomètres auriculaires - et qu'on soit capable d'isoler les passagers contagieux et de les soumettre immédiatement à un suivi médical. Si nous voulons être efficaces, il faut que l'ensemble des pays réagisse exactement de la même manière. Si nous n'en étions pas capables, il faudrait bien que le gouvernement français en tire les conclusions - et cela fera partie du plan. M. le Président : Comment réagiriez-vous si un pays déclarait vouloir fermer ses frontières ? M. Xavier BERTRAND : Cela me gênerait moins qu'un pays qui refuserait de les fermer. A ce propos, je remarque qu'il faudra résoudre le problème des transfrontaliers. Je m'en suis d'ailleurs entretenu avec M. Mars Di Bartolomeo, le ministre de la santé luxembourgeois. Aujourd'hui, l'objectif prioritaire est de mettre en place un même niveau de protection sur l'ensemble des frontières. M. Alain CLAEYS : Y a-t-il une prise de conscience parmi les Vingt-Cinq ? Certains pays sont-ils en retard par rapport aux autres ? Comment la Commission et le Conseil des ministres articulent-ils leurs positions respectives ? M. Xavier BERTRAND : Il est vrai que le niveau de préparation n'est pas le même selon les États. Mais je ne distribuerai pas de bons et de mauvais points. Markos Kyprianou avait écrit à l'ensemble des pays membres pour leur demander quel était leur niveau de préparation. Tous les pays ne lui ont pas répondu. Il faut commencer par communiquer entre nous et jouer carte sur table. Autrement, certains pourraient, en cas de pandémie, dire que, finalement, ils n'ont pas de stocks et demanderaient à être aidés. Il faut anticiper. Le plan français repose sur une logique d'anticipation. Je demande que l'ensemble des pays européens adopte la même logique. Markos Kyprianou, le commissaire européen, est très sensible, depuis longtemps, à cette nécessité d'anticipation d'une crise pandémique. Je précise qu'entre le Conseil des ministres et la Commission, il n'y a pas de différence de position. La seule chose à laquelle il faut veiller, c'est que la logique européenne s'impose par rapport aux logiques nationales. Le dernier sommet a été très intéressant. Nous y avons entendu une intervention de Mme Margaret Chan, sous-directrice à l'OMS. Son franc-parler n'a pas manqué de provoquer une prise de conscience chez certains, si elle ne s'était pas encore produite. Dans un premier temps les pays ont constitué des stocks de moyens de protection - masques, antiviraux et vaccins. Maintenant, il faut aller au-delà et imaginer, si possible dans le détail, comment utiliser ces moyens. Même quand nous aurons réussi à obtenir des informations sur ces moyens, il faudra s'assurer de leur utilisation opérationnelle. Enfin, il ne faut pas oublier un autre aspect, qui est essentiel : la communication. M. François GUILLAUME : Il est surprenant, depuis le temps qu'on parle d'une possible pandémie, que le Conseil des ministres, sur proposition de la Commission, n'ait pas adopté les mesures nécessaires pour mettre en place dans tous les pays des systèmes de prévention. C'est étonnant qu'on n'aille pas plus vite. Vous avez signalé que l'Union européenne envisageait de constituer des stocks de Tamiflu. Mais attention à ce que cette initiative n'incite certains pays à ne pas faire trop d'efforts, comptant, en cas de crise, sur l'aide européenne. Ne faudrait-il pas, par exemple, dédier ces stocks à l'aide aux pays qui seront les premiers touchés, ceux d'Europe de l'Est notamment ? M. Pierre HELLIER : Y a-t-il eu une réflexion, au niveau européen, sur la surveillance des oiseaux migrateurs ? Il est indispensable de coordonner toutes les actions à ce niveau. La France, qui semble relativement bien préparée, pourrait servir d'exemple. Quand les oiseaux reviendront, nous risquons d'assister à des contaminations croisées et multiples. Or la pandémie sera d'autant plus grave qu'il y aura eu davantage d'animaux malades. M. Jean-Pierre DOOR, rapporteur : Quels sont les moyens envisagés au plan européen pour combattre le problème étiologique ? Il ne faut pas attendre que le mal continue de se développer. Quels sont les moyens envisagés au plan européen pour surveiller ce qui se passe en Afrique, où sont arrivés, pour l'hiver, les oiseaux migrateurs, et d'où ils vont repartir au printemps ? M. Marc JOULAUD : Monsieur le ministre, vous avez évoqué des différences de niveau de préparation entre les pays de l'Union. S'expliquent-elles, selon vous, par un degré de sensibilisation différent au sujet ou par les difficultés financières de certains pays ? Dans ce cas, est-ce que l'Union peut envisager d'intervenir financièrement pour aider à cette préparation ? Avez-vous le sentiment que l'ensemble des pays de l'Union, s'il en avait la volonté, pourrait se doter de stocks susceptibles de protéger l'ensemble de la population européenne ? La capacité de production industrielle en Europe et dans le monde serait-elle suffisante ? M. Gabriel BIANCHERI : La vaccination des volailles a-t-elle été envisagée ? Est-elle réalisable ou non ? On sait bien que plus vite on enrayera l'épizootie, plus grandes seront les chances de limiter le risque pandémique. M. le Président : J'ai appris que l'Autriche avait annoncé son intention de fermer ses frontières. Si tel devait être le cas, que penseraient les Français si leur gouvernement se contentait, dans le même temps, de renforcer les contrôles dans les aéroports et les infrastructures portuaires, en considérant ces mesures suffisantes pour la santé publique, sans aller jusqu'à fermer les frontières ? Nos concitoyens pourraient penser que nous ne prenons pas toutes les mesures nécessaires. Rappelez-vous l'affaire du confinement des poulets : les citoyens français se sont demandé si le Gouvernement avait pris les bonnes mesures. M. Xavier BERTRAND : Avant même de nous demander quelle interprétation l'opinion publique pourrait tirer du fait que tel pays ferme ses frontières alors que tel autre ne les ferme pas, nous devons nous interroger sur ce qu'il y a à faire au nom du principe de précaution. Ce qui me semble, à cet égard, essentiel, c'est que tout le monde prenne, dès le début, des mesures rigoureuses, même si ces mesures, par exemple de fermeture des frontières, peuvent n'avoir qu'un caractère transitoire. Il pourrait aussi s'agir de mesures restrictives applicables pas seulement à l'arrivée dans les pays, mais aussi au départ. C'est un point sur lequel j'ai sensibilisé le docteur Li et le docteur Chan, de l'OMS. L'OMS a aussi un rôle important à jouer pour empêcher la propagation du virus au niveau mondial. Nous réfléchissons pour l'Europe, mais il est évident que l'Amérique et les autres continents seront tout aussi concernés par cette question. Je me doute d'ailleurs de ce que ferait le continent australien, pour m'en être entretenu avec un certain nombre de dirigeants à Hong Kong. Jouons la carte de la coopération européenne. Si tout le monde ne le faisait pas, il faudrait en tirer les conclusions. Je répondrai à Gabriel Biancheri que nous sommes, effectivement, dans une logique d'épizootie. Il faut remettre les choses à leur juste place : aujourd'hui, aucun cas de transmission de l'homme à l'homme n'a été recensé nulle part sur la planète. Mais à partir du moment où le risque existe, il faut absolument que nous soyons capables d'en parler de façon transparente et, surtout, de nous y préparer. Un certain nombre de mesures de protection des volailles ont déjà été prises au niveau européen. La vaccination est une option possible. Aujourd'hui, les recommandations des experts vétérinaires n'ont pas amené la France à l'adopter. Il en a été de même au niveau européen. En revanche, la Chine et le Vietnam appliquent à la fois des mesures d'abattage et de vaccination. Mais il faut savoir que ces vaccinations obligent à des manipulations quasi individuelles de chaque volaille, que les vaccins qui peuvent exister ne produisent pas les mêmes effets sur tel ou tel type de volaille, et que la vaccination risque de masquer la présence du virus. On sait aussi qu'elle peut conduire à l'apparition de résistances. Ce qui est sûr, c'est que nous devons prévoir l'éventualité que les experts vétérinaires recommandent la vaccination. Je précise que la vaccination qui est recommandée est celle dite en anneau : elle est effectuée dans un certain rayon autour du foyer épizootique, tandis qu'au cœur de ce rayon, c'est la mesure d'abattage qui s'impose. La Chine, le Vietnam et Hong Kong ont, eux, choisi la vaccination systématique. Marc Joulaud a insisté sur le niveau de sensibilisation et de préparation de chaque pays. Il s'est demandé si ce niveau était identique et, sinon, pour quelle raison. Il m'est très difficile de répondre à cette question. Si tout le monde voulait se mettre au même niveau, chacun des pays pourrait-il le faire ? Compte tenu des nouvelles capacités de production annoncées par le laboratoire Roche, qui estime être en mesure de produire en année pleine 300 millions de traitements de Tamiflu, ce serait théoriquement possible. Encore faudrait-il savoir à quel moment ces traitements seront disponibles. Le laboratoire Roche s'est dit prêt à accorder des licences pour permettre à d'autres laboratoires de produire du Tamiflu. N'oublions pas le Relenza, l'autre antiviral disponible contre la grippe, et dont l'efficacité est, pour l'OMS, de même niveau que celui du Tamiflu. M. Alain CLAEYS : Je rappelle que Roche détient l'exclusivité de la fabrication du Tamiflu. La législation sur les brevets et la propriété intellectuelle ne constitue-t-elle pas un frein à l'augmentation des capacités de production ? Quelles initiatives pourraient être prises auprès de l'OMC à cet égard ? M. Xavier BERTRAND : C'est l'OMS qui est compétente. Selon les accords de Doha, c'est elle qui décrète la situation de pandémie, et qui permet ensuite d'en tirer les conclusions sur le droit des brevets. Mais avant même la question des brevets, c'est de la capacité de production dont il faut se préoccuper. Si Roche, comme il l'a annoncé, est prêt à accorder des licences, qui va pouvoir répondre à cet appel et être en mesure de fabriquer du Tamiflu ? Ce n'est pas le tout d'accorder des licences : il faut avoir les moyens de production pour aller au-delà de 300 millions de traitements. Autre problème : la protection par antiviraux ne peut pas être l'apanage des seuls pays riches. Dans quel pays vivrions-nous si nous n'étions pas capables de faire preuve de solidarité internationale et de faire en sorte que dans tous les pays du monde, on puisse avoir accès aux médicaments ? Et c'est valable aussi pour les vaccins. La vraie question est donc celle de l'accès au traitement, qu'il soit médicamenteux ou vaccinal. Je le dis avec d'autant plus de force que la France est certainement considérée par l'OMS comme l'un des pays qui se sont le mieux préparés. Mais nous ne pouvons pas nous contenter d'assurer la protection de la santé des seuls Français, qu'ils soient sur le territoire métropolitain ou à l'étranger. L'accès au traitement doit se faire de façon globalisée, au niveau européen comme au niveau international. M. le Président : Je ne comprends pas la position du laboratoire Roche. Au mois de septembre, ses représentants m'assuraient que le processus de fabrication du Tamiflu était tellement compliqué et tellement dangereux que seul Roche savait le maîtriser. Quelques semaines plus tard, Roche se dit prêt à accorder des licences secondaires, notamment au Vietnam et en Indonésie. Or ces pays, que je connais et que je respecte, n'ont pas une industrie chimique des plus poussées. Alors, je m'interroge et je comprends d'autant moins que, dans le même temps, on apprend que Taïwan, dont le niveau de développement est nettement supérieur, n'est pas jugé capable, par Roche, de fabriquer du Tamiflu ! Quelle est votre opinion, Monsieur le Ministre ? D'autre part, peut-on raisonnablement espérer, en augmentant sensiblement la production d'antiviraux, assurer une protection efficace des populations, alors que l'on sait que l'efficacité du Tamiflu dépend des conditions dans lesquelles on l'emploie ? M. Xavier BERTRAND : Roche a dit que Cipla, laboratoire indien, n'arriverait pas à fabriquer le générique. En même temps, nous avons entendu dire que le Tamiflu pourrait être fabriqué au Vietnam. Ces deux déclarations ne me semblent pas très cohérentes, en effet. De son côté, Cipla explique que ce n'est pas si compliqué de produire du Tamiflu, le problème étant plutôt de pouvoir disposer de la matière première, la badiane ou anis étoilé, dont on extrait l'acide shikimique. Ce qui est délicat, en réalité, c'est la phase suivante, la phase explosive, que tout le monde ne maîtrise pas. M. Alain CLAEYS : Est-ce que le gouvernement français envisage de sécuriser le marché de cette matière première ? M. Xavier BERTRAND : Aujourd'hui, nous avons déjà des stocks sur le territoire national. Je ne sais pas comment Cipla a pu sécuriser là-bas - c'est-à-dire en Inde - la matière première. Ce qui est sûr, c'est qu'on ne saurait accepter que telle ou telle firme réserve la matière première à son seul bénéfice. Celle-ci doit profiter à l'ensemble de la planète. Les différents process de fabrication devraient permettre à d'autres laboratoires dans le monde de fabriquer du Tamiflu. Cela dit, j'ai le sentiment que l'on a beaucoup parlé du Tamiflu, et pas assez du Relenza, ni non plus d'autres médicaments. Le laboratoire Pasteur, à Hong Kong, a intégré dans son programme de recherche la préparation et la conception de nouvelles thérapeutiques. Il nous faut en effet imaginer de nouveaux traitements médicamenteux et de nouveaux antiviraux. Cela peut prendre du temps, mais je pense que nous aurions tout intérêt à doper les moyens de recherche pour y parvenir. Et n'oublions pas les autres moyens de protection, comme les masques. La France a voulu se doter de stocks importants de masques. Nous savons que dans certains pays, notamment lors de la crise du SRAS, les masques ont été la première et la meilleure des protections. Enfin, des règles d'hygiène et de vie sociale adaptées sont tout aussi protectrices, comme le rappelle régulièrement l'OMS. Jean-Pierre Door et Pierre Hellier ont évoqué les moyens européens pour lutter contre l'épizootie. Nous avons en effet besoin d'une action européenne en la matière. La France a choisi de jouer la carte des organisations internationales, car il faut, par exemple, surveiller ce qui se passe aujourd'hui en Afrique, où des quantités impressionnantes d'oiseaux migrateurs se sont retrouvés aux abords du lac Tanganyika et du lac Debo. Nous voudrions savoir s'il y a, aux abords de ces deux lacs, une mortalité anormale chez les oiseaux migrateurs. Il faudrait pouvoir procéder à des prélèvements, car on se demande si certains oiseaux ne pourraient pas être porteurs du virus H5N1 sans en être pour autant les victimes. Faire de telles recherches pendant l'hiver serait intéressant : en effet, les flux migratoires, à partir de février/mars, vont directement repasser au-dessus des pays européens, notamment la France. Les Américains travaillent eux aussi, en Afrique, à la surveillance des oiseaux migrateurs et font des analyses. François Guillaume a parlé de la stratégie et de la position de la Commission européenne. Comme je l'ai déjà dit, la santé n'est pas une compétence propre de l'Union européenne. La Commission a un rôle de coordination, d'impulsion, de sensibilisation, mais elle ne peut pas directement imposer des orientations ou des choix. C'est d'ailleurs pourquoi, je vous l'ai indiqué, la France reprendra la proposition du commissaire européen Kyprianou de constituer des stocks européens, en plus des stocks nationaux. M. le Président : J'aimerais connaître la position du Gouvernement français sur la polémique entre l'OIE et l'OMS à propos de ce qu'il aurait fallu faire ou ne pas faire au début de l'épizootie. M. Xavier BERTRAND : La position du gouvernement français est de ne pas rentrer dans la polémique ! Cela dit, il faut rappeler qu'aujourd'hui, c'est sur la santé animale que nous pouvons être efficaces. M. le Rapporteur : Quels enseignements avez-vous tirés de votre récent voyage en Chine ? Que pensez-vous de la transparence des informations données par la Chine sur l'épizootie dans le pays ? Quels moyens les Chinois ont-ils engagés ? Ils ont déclaré qu'ils allaient vacciner 5 milliards de volailles ? Cela paraît difficile, sur le plan technique comme sur le plan financier. M. Marc LE FUR : Je reviens d'un voyage au Cambodge, organisé dans le cadre du groupe d'amitié France-Cambodge. J'en ai profité pour regarder ce qui se passait en matière de lutte contre la grippe aviaire. Les personnes que j'ai rencontrées, qu'il s'agisse de nos diplomates ou des responsables de l'institut Pasteur, étaient très mobilisées. Il y a eu au Cambodge quatre malades, qui sont décédés. Mes interlocuteurs sont convaincus du caractère saisonnier de la maladie. Les derniers décès étant intervenus en mai, ils considèrent qu'à partir de février, on rentrera à nouveau dans une phase très délicate, où l'on pourrait avoir des décès dus à l'épizootie. Ils s'y préparent. Le secrétaire américain à la santé a fait une tournée générale au Cambodge. Il est venu dans l'intention de mettre beaucoup d'argent sur la table. Nous avons là bas un institut Pasteur qui fonctionne bien, avec des personnels remarquables. Or cet institut Pasteur a un laboratoire classé P2. Les personnels considèrent qu'il serait tout à fait indispensable qu'il passe à un niveau P3, afin de pouvoir faire des examens d'échantillons dans des conditions satisfaisantes au moment où la pandémie se déclarerait. Ils considèrent que les examens devront se faire sur place pour pallier une éventuelle désorganisation du pays -interdiction de transports, etc. Je signale que le coût d'une telle transformation est assez limité, de l'ordre d'un million d'euros. M. Xavier BERTRAND : Si je suis allé au Vietnam et en Chine, c'était pour y mesurer l'état d'esprit, ainsi que l'état de préparation et l'état des besoins, en particulier de nos ressortissants sur place. En effet, la façon dont nous préparons la prise en charge de nos ressortissants permettra à notre opinion d'apprécier notre capacité à réagir face à un risque pandémique sur le territoire national. Il est donc très important de bien mesurer le niveau de besoin de nos ressortissants à l'étranger, auprès de nos postes diplomatiques. Les organisations internationales, le réseau Pasteur, qui est très développé et très apprécié là-bas, et les autorités gouvernementales peuvent nous renseigner. A Hanoï, à Shanghai ou à Hong Kong, j'ai rencontré à chaque fois les ministres de la santé et les représentants de l'Institut Pasteur. Les besoins qui ont été exprimés ne sont pas d'ordre financier. Ces pays demandent des moyens supplémentaires pour la veille sanitaire, la veille épidémiologique, pour améliorer leurs capacités d'analyse et surtout pour mener des travaux de recherche. Ils ont besoin, en fait, de chercheurs. L'Université de Hong Kong a fait un travail très important. Je pense notamment aux chercheurs qui ont travaillé sur le SRAS et réussi à concevoir le vaccin. Pasteur travaille sur la grippe aviaire. Son travail est remarquable, mais repose sur deux personnes seulement. Si nous pouvions doter chacun des postes de Pasteur de tout ce qu'il y a dans le réseau RESPARI en Asie du Sud-Est, nous pourrions faire progresser la recherche à grand pas. On nous demande des collaborations et des chercheurs supplémentaires. Je pense qu'il serait bon que nous puissions le faire au niveau européen. Je rencontrerai vendredi les responsables de l'institut Pasteur pour évaluer les moyens que nous pourrions trouver. La France s'est singularisée par sa capacité à mettre en place des forces d'action rapide à caractère humanitaire. Nous devons aussi être capables de mettre en place de façon préventive des forces d'action rapide à caractère sanitaire et épidémiologique. C'est de cela que ces pays ont besoin. Si nous étions capables de nous mobiliser au plan international, on pourrait sans doute limiter le développement de la crise. S'agissant du caractère saisonnier de la grippe aviaire, M. Joseph Domenech, de la FAO, a effectivement dit qu'il pouvait y avoir un lien de cause à effet entre le cycle de culture du riz et le déplacement des canards domestiques, ce qui pourrait expliquer le caractère saisonnier de la grippe. Je serai très prudent. On nous avait dit que c'était plutôt en phase hivernale qu'on pouvait assister à une recrudescence. Mais je note que les cas successifs de transmission à l'homme ont été de moins en moins virulents. Est-ce dû à une meilleure prise de conscience du problème par les éleveurs touchés ? Vont-ils se faire soigner plus rapidement ? Le virus devient-il moins pathogène lorsqu'il passe à l'homme ? Les chercheurs sont en train de travailler sur ces sujets. Vous voyez tout l'intérêt qu'il y a à envisager de chercher, comme le fait Pasteur à Hong Kong, les critères de transmission à l'homme du virus H5N1. Mais il faut aussi envisager l'hypothèse que la contamination humaine pourrait résulter d'une autre souche. Il ne faudrait pas être totalement désarmés dans ce cas-là. On peut renforcer les moyens en hommes, mais aussi en dotations. C'est vrai qu'à Shanghai, comme au Cambodge, les chercheurs souhaiteraient disposer d'un laboratoire P3. La difficulté, c'est que, lorsque les laboratoires sont situés en territoire urbain, les autorités locales sont très attentives au respect des normes de sécurité. Il faudrait trois autorisations pour que le laboratoire de Shanghai passe du niveau P2 au niveau P3. J'ai obtenu l'accord du ministre de la santé chinois et l'accord de la municipalité de Shanghai ; il nous reste à solliciter et à obtenir l'accord du ministère chinois de la recherche. Le ministre de la santé, M. Gao Qiang, m'a assuré qu'il interviendrait auprès de son collègue. Il sera ainsi possible de faire, sur place, des travaux de recherche sans être obligés de les transmettre, ensuite, à d'autres laboratoires situés ailleurs. Vous savez qu'un laboratoire P4 est prévu à Wuhan. Mais il faut aussi qu'il y ait des laboratoires de proximité. J'ai apporté aux autorités chinoises des garanties en termes de sécurité. J'ai rappelé que le responsable du laboratoire de Shanghai a travaillé au sein du laboratoire P4 de Lyon, ce qui est tout de même une référence. M. le Président : Qui construit le P4 chinois ? M. Xavier BERTRAND : C'est une collaboration franco-chinoise, mais avec, à la base, l'expertise française. Il faudra aussi réfléchir à la création de laboratoires P3 mobiles. Si nous voulons être capables de réagir de façon encore plus efficace, il faut pouvoir déplacer un certain nombre de laboratoires. Je m'adresserai à nos spécialistes en France pour savoir quel en serait le coût et pour envisager les conditions d'une mutualisation au niveau européen. Si nous développons les capacités de recherche, nous ferons gagner un temps précieux à l'industrie qui produira le vaccin pandémique. J'ai été frappé par la sérénité de nos ressortissants, qui ont vécu l'épisode du SRAS et pour lesquels, aujourd'hui, la grippe aviaire reste encore un problème de santé animale. Il en est de même des autorités locales, qui en ont néanmoins bien mesuré le risque. Les autorités chinoises et vietnamiennes sont décidées à communiquer dans la plus grande transparence et à prendre des mesures très rigoureuses, notamment en matière d'abattage. Ainsi, les élevages qui étaient autour de Hanoï ont disparu quasiment en une semaine. Aujourd'hui, sur les marchés, il n'y a plus de volailles vivantes. Je me suis entretenu pendant une heure et demie avec le ministre chinois. Je l'ai interrogé et j'ai obtenu de lui des réponses très claires. Les Chinois ont bien conscience qu'ils doivent faire preuve aujourd'hui de la plus grande transparence et la plus grande rigueur. Deux événements mondiaux majeurs auront lieu en Chine : en 2008 les Jeux Olympiques, en 2010 l'Exposition internationale à Shangaï. Les Chinois ont donc à cœur de montrer que, s'agissant de la grippe aviaire, ils sont décidés à prendre les choses avec le plus grand sérieux et le plus tôt possible. L'épisode du SRAS a marqué les esprits, aussi bien chez les responsables politiques que chez les responsables sanitaires. Ils ont bien conscience que si la pandémie était là, le système de santé comme le système économique et social rencontreraient bien des difficultés. C'est pourquoi ils sont déterminés à trouver, le plus vite possible, les solutions les plus efficaces. Je sais bien que des observateurs s'interrogent sur le niveau d'engagement des autorités concernées et sur la précision des réponses aux questions posées. Mais j'ai pu mesurer qu'elles avaient bien conscience des risques existants pour la santé humaine. M. le Rapporteur : A la conférence des donateurs qui doit avoir lieu à Pékin au mois de janvier, la France sera-t-elle représentée ? M. Xavier BERTRAND : La France sera représentée au niveau ministériel. Cette conférence de Pékin devrait permettre de faire le point, à la suite de l'appel aux donateurs lancé à Kuala Lumpur en juillet dernier et à la suite de la conférence de Genève du mois de novembre dernier. Deux questions devraient y recevoir une réponse précise : qui fait quoi ? Qui donne quoi ? M. Gerard DUBRAC : Est-ce que les Chinois utilisent le Tamiflu ? Les cas sporadiques de contamination humaine pourraient être l'occasion de tester l'efficacité de ce produit : qu'en pensez-vous ? M. le Président : Début janvier 2005, une délégation de députés membres de la commission des affaires sociales de notre Assemblée s'est rendue en Chine. Nous avons visité, à Pékin, le CDC, Center for Disease Control, le centre de lutte contre les maladies infectieuses. Nos entretiens, sur place, ont mis en évidence les limites de la capacité des autorités chinoises à dire les choses telles qu'elles sont, qu'il s'agisse du SRAS, de la grippe aviaire ou du sida. Il y a un décalage entre ce que disent les élites scientifiques du pays, qui ont pris conscience du problème, et ce que disent les autorités politiques, qui maintiennent un système totalement opaque. On a bien vu que, pendant dix mois, alors que l'épizootie se répandait au Cambodge, au Vietnam, en Birmanie, provinces qui ont des liens avec la Chine du sud et de l'ouest, on nous disait qu'il n'y avait pas de grippe aviaire en Chine. Maintenant, on s'aperçoit qu'il y en a en Chine du sud et qu'elle s'est répandue dans des endroits où l'on ne pensait pas la voir si rapidement, notamment au nord est. A tel point qu'on s'est demandé comment il pouvait y avoir autant de grippe aviaire chez les animaux sans cas d'infection chez les humains. Puis on apprend récemment qu'il y a eu un cas humain ! Compte tenu de l'immensité de la Chine, on se dit qu'on ne sait peut-être pas tout. Ne serait-ce pas, simplement, parce que les informations ne remontent pas toutes aux autorités chinoises centrales ? Ce n'est pas la première fois que la Chine décide de vacciner les animaux. Elle avait déjà mené une première campagne de vaccination mais qui n'a visiblement pas marché. Nous devons donc être vigilants. La conférence de Pékin est d'autant plus importante qu'elle est le signe d'une prise de conscience de la Chine. Il reste que la situation est potentiellement explosive dans cette région du monde. M. Xavier BERTRAND : Si je m'étais rendu en Chine il y a dix mois, je ne suis pas certain que je vous aurais donné la même réponse. Or je m'y suis rendu après la révélation de trois cas de transmission à l'homme. Lors de mes entretiens sur place, j'ai compris que sur le plan de l'épizootie, la Chine était loin de tout maîtriser dans certains endroits du territoire. Mes interlocuteurs chinois ont dit qu'ils avaient bien conscience que, dans un certain nombre de campagnes isolées ou reculées, les capacités de réaction et d'isolement rapides n'étaient pas du même niveau que celui constaté à Pékin et à Shanghai. Je tiens à vous préciser qu'au moment où je me suis rendu en Chine, il y avait 74 foyers épizootiques dans neuf provinces. Le fait que nous soyons au courant est une preuve de transparence. J'ai aussi appris que les Chinois avaient l'intention de renforcer leur législation : il deviendra obligatoire de déclarer aux autorités nationales, sous peine de sanction, tous les cas constatés dans les quatre heures suivant leur découverte. S'agissant du Tamiflu, les Chinois disposent de stocks, mais je ne pense pas que ce soit à hauteur du taux de couverture de la population recommandé par l'OMS, soit 25 %... Je remarque par ailleurs que, depuis des années, le Japon utilise massivement le Tamiflu, notamment pour la grippe saisonnière. Il est sûrement le premier consommateur au monde de Tamiflu. M. le Président : Dans une publication de l'institut Pasteur du Vietnam, j'ai lu que le H5N1 avait muté. Que savez-vous sur ce point ? M. Xavier BERTRAND : On parle davantage d'évolution que de mutation, ce qui expliquerait sa moindre virulence aujourd'hui. Fort heureusement, car les taux de mortalité étaient jusqu'à présent de 50 %. Cela dit, comme il y a aussi une meilleure prise de conscience du problème et un meilleur accès à des traitements de qualité, dans des délais raccourcis, il est difficile de se prononcer. M. le Président : J'aimerais faire une suggestion. Il existe une structure internationale, qui s'appelle l'ASEM40, qui rapproche les pays ASEAN41 de l'Europe. Elle a été lancée par la France il y a sept ou huit ans, puis reprise par l'Europe, mais tourne un peu en rond aujourd'hui. Elle pourrait constituer un cadre intéressant pour organiser une conférence, à la fois parce que c'est l'Europe, mais aussi parce que c'est l'ASEAN plus trois pays, dont le Japon et Singapour, qui ont de l'argent et des moyens techniques. Lorsque je me suis rendu aux États-Unis, je me suis rendu compte que les Américains considéraient la question de la grippe aviaire comme une question de souveraineté nationale mais aussi internationale : nationale pour la défense de leur territoire, internationale pour l'image des États-Unis. Plus généralement, ce sont l'image de chacun d'entre nous et notre capacité à prendre le leadership au plan international qui sont en jeu. La France a fait le choix du multilatéralisme vis-à-vis de l'OMS. Est-ce que cela la prive de relations bilatérales avec les États-Unis ? Dans des pays comme le Vietnam ou le Cambodge, les États-Unis ont une volonté très forte de s'appuyer sur les structures françaises existantes. Comment tous ces éléments d'ordre international pourraient-ils, selon vous, s'articuler ? M. Xavier BERTRAND : Nous avons déjà songé à organiser une conférence internationale. L'idée d'en organiser une dans le cadre de l'ASEM est bonne. Je vais voir avec le ministère des affaires étrangères si l'ASEM constituerait un cadre adapté. J'ai rencontré, il y a quelques mois, l'ambassadeur américain à Paris, M. Craig Stapleton. Force est de reconnaître que les Américains sont impliqués dans la coopération avec les organisations internationales plus substantiellement que ce qu'ils semblaient avoir l'intention de faire il y a quelques mois. J'ai, par ailleurs, constaté que les moyens financiers n'étaient pas la demande prioritaire des pays touchés. Ainsi, la ministre de la santé du Vietnam m'a demandé une aide en personnes et en moyens, ainsi qu'une aide pour les situations d'urgence - matériel médical, vêtements, ambulances, respirateurs. Nous allons inviter des entreprises françaises installées là-bas à aider les autorités nationales. Et donc, bien qu'engagée dans les organisations internationales, la France n'exclut évidemment pas l'éventualité de passer des accords bilatéraux avec les pays concernés. S'agissant des États-Unis, nous avons rencontré à Rome des experts du Center for Disease Control, le CDC. Les Américains sont très intéressés par ce qui se passe en Afrique. S'ils veulent contribuer à renforcer la coopération internationale, notamment au Cambodge et dans tout le réseau RESPARI, nous devons nous garder de nous placer en concurrents. Complémentarité oui, concurrence non. Cela suppose que la France et l'Europe soient présentes là-bas. L'enjeu est d'aider ces pays. En les aidant, nous nous protégeons. Mais pour nous protéger, il faut aussi être capables de mener des travaux de recherche sur le vaccin, ce qui n'est pas secondaire. S'agissant de l'Afrique, nous n'avons pas encore été sollicités. Toutefois, nous avons anticipé la demande car elle risque d'arriver. Force est de reconnaître que les niveaux de veille sanitaire ne sont pas les mêmes dans tous les pays africains. Si nous avons vraiment une force d'action rapide en matière vétérinaire à installer, ce sera en Afrique. On sait que l'Afrique est un foyer potentiel d'épizootie. Mais le poids économique et culturel des élevages n'est pas le même en Afrique qu'en Asie du Sud-Est. Il n'y a pas la même proximité entre les élevages et les humains, et la place du poulet dans l'alimentation n'est pas non plus la même qu'en Asie. Cela dit, le niveau des services vétérinaires demanderait certainement à être renforcé sur l'ensemble du continent africain. M. le Rapporteur : Nous n'avons pas encore auditionné l'Institut de recherche pour le développement (IRD). Son audition aura lieu dans une quinzaine de jours. Quel serait son rôle en Afrique ? M. Xavier BERTRAND : La question n'a pas encore été abordée. Aujourd'hui, c'est davantage avec la FAO et l'OIE que j'ai eu des contacts. M. le Président : D'après vous, quels sont les pays africains les plus sensibles ? M. Xavier BERTRAND : Je n'ai pas d'idée précise. Une étude a montré qu'un certain nombre de pays africains seront, dans quelques années, sur le plan économique, l'équivalent des dragons asiatiques. On peut donc penser qu'ils auront un niveau de réactivité supérieur. C'est en tout cas ce qu'on a dit du Kenya et de l'Afrique du Sud. Mais je n'ai pas à porter de jugement sur l'état de préparation de ces pays. M. le Président : Ma question visait plutôt les pays qui, au départ, risqueraient d'être plus touchés par l'épizootie ? M. Xavier BERTRAND : Aujourd'hui, même la FAO n'est pas en mesure de répondre précisément à cette question. Mais bien évidemment, les pays de l'Afrique subsaharienne seraient plus directement concernés. M. le Président : Merci, monsieur le ministre. ---------- N 2833 - Rapport de M. Jean-Pierre Door fait au nom de la mission d'information sur la grippe aviaire : mesures préventives - Tome I : menace de pandémie grippale : préparer les moyens médicaux - auditions 1 Chef du service de pneumologie et de réanimation à l'hôpital de La Pitié-Salpêtrière - audition du 26 octobre 2005 2 C'est un point important, dans la mesure où les vaccins anti-grippaux sont produits à partir d'œufs (cf.infra). 3 Directeur de la santé animale et du bien-être des animaux de l'AFSSA - audition du 26 octobre 2005 4 Responsable du département maladies infectieuses de l'Institut de veille sanitaire - audition du 26 octobre 2005 5 Chef de l'unité de recherche génétique et moléculaire des virus respiratoires (GMVR) de l'Institut Pasteur - audition du 26 octobre 2005 6 The Writing Committe of the World Heath Organisation, Consultation on Human Influenza A/H5. England journal of medicine.353, 1374-1385 (2005) 7 Emerging Infectious Disease Vol.11, n°11, november 2005, Family Clustering of Avian Influenza A( H5N1) 8 Docteur Margaret CHAN, sous-directrice générale à l'Organisation mondiale de la santé (OMS) - audition du 24 novembre 2005 9 (1) cf www.pasteur.fr 10 Directeur général de l'Institut Pasteur 11 Professeur d'université 12 Chef du service des maladies infectieuses et tropicales à l'hôpital de La Pitié-Salpêtrière - audition du 23 novembre 2005 13 Directeur général de la santé au ministère de la santé et des solidarités - délégué interministériel à la lutte contre la grippe aviaire - audition du 2 novembre 2005 14 Président du laboratoire Roche France - audition du 8 novembre 2005 15 Président du laboratoire GlaxoSmithKline France - audition du 8 novembre 2005 16 Union des groupements d'achats publics 17 Président de Sanofi Pasteur MSD - audition du 16 novembre 2005 18 Directeur général délégué de Sanofi Pasteur - audition du 16 novembre 2005 19 Directeur industriel de 3M France - audition du 16 novembre 2005 20 Agence française de sécurité sanitaire des produits de santé 21 Chef de projet chez Sanofi Pasteur - audition du 16 novembre 2005 22 Guiding Principles for Highly Pathogenic Avian Influenza Surveillance and Diagnostic Networks in Asia - FAO expert meeting on surveillance and diagnosis of Avian Influenza in Asia, Bangkok, 21-23 july 2004. 23 Comment faire face à la menace d'une pandémie de grippe aviaire : mesures stratégiques recommandées - OMS, 2005 24 DG « Sanco » : Direction générale « Santé et protection des consommateurs » 25 Direction générale de l'alimentation 26 Système de surveillance sanitaire de la faune sauvage nationale 27 Secrétariat général de la défense nationale 28 Union des groupements d'achats publics 29 Inspecteur général des affaires sanitaires 30 Agence européenne de sécurité des aliments 31 Aspects des droits de propriété intellectuelle qui touchent au commerce. 32 Affections de longue durée 33 Direction générale de la santé 34 Agence française de sécurité sanitaire des produits de santé 35 Union des groupements d'achats publics 36 Institut national de prévention et d'éducation pour la santé 37 Juillet 2003 38 Union des groupements d'achats publics 39 Agence française de sécurité sanitaire des produits de santé 40 Asia-Europe Meeting 41 Asian Nations | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
