__________ OFFICE PARLEMENTAIRE D'ÉVALUATION DES POLITIQUES DE SANTÉ __________ RAPPORT sur la maladie d'Alzheimer et les maladies apparentées, par Mme Cécile GALLEZ, Députée
Cet Office est composé de : MM. Jean-Michel Dubernard, président, Mme Jacqueline Fraysse, MM. Jean-Marie Le Guen, Jean Bardet, Jacques Domergue, Gérard Bapt, Marc Bernier, Mme Maryvonne Briot, MM. Paul-Henri Cugnenc, Claude Evin, Mme Cécile Gallez, M. Jean-Luc Préel, députés MM. Nicolas About, premier vice-président, Gilbert Barbier, Jean-François Picheral, Jean-Pierre Godefroy, Alain Vasselle, Paul Blanc, Bernard Cazeau, Gérard Dériot, Jean-Claude Etienne, Guy Fischer, Dominique Leclerc, Alain Milon, sénateurs. INTRODUCTION 15 A. LA SAISINE DE L'OFFICE PARLEMENTAIRE D'ÉVALUATION DES POLITIQUES DE SANTÉ (OPEPS) VISE À RÉPONDRE À UN ENJEU MAJEUR DE SANTÉ PUBLIQUE ET DE SOCIÉTÉ 15 1. La nécessité pour le Parlement de disposer d'une expertise approfondie sur la maladie d'Alzheimer 16 a) Un défi majeur pour la politique de santé publique 16 b) La volonté de suivre la mise en œuvre des lois de financement de la sécurité sociale et de réformes récentes 16 2. La saisine de l'OPEPS et la méthode retenue pour l'élaboration de l'étude 17 a) Les conditions de la saisine de l'office 17 b) L'élaboration du cahier des charges 17 B. L'ÉTUDE SOULIGNE PLUSIEURS INSUFFISANCES DANS LE DISPOSITIF ACTUEL DE DÉPISTAGE ET DE PRISE EN CHARGE DE LA MALADIE 18 1. Une pathologie insuffisamment diagnostiquée 18 a) L'importance majeure de la détection précoce de la maladie compte tenu des traitements actuels 18 b) Un recours aux soins pourtant tardif, voire inexistant 19 2. Une offre de soins inadaptée à l'ensemble des besoins des personnes malades et de leurs proches 19 a) Une prise en charge médicale et médico-sociale très variable et faiblement coordonnée 19 b) L'isolement et l'épuisement des familles 20 3. Une charge financière lourde et croissante 21 C. LA MISE EN œUVRE D'UNE SÉRIE DE PROPOSITIONS PERMETTRAIT D'AMÉLIORER SIGNIFICATIVEMENT LA QUALITÉ DE VIE DES MALADES ET DE LEURS PROCHES 21 1. Faciliter l'établissement d'un diagnostic précoce pour ralentir l'évolution de la maladie 22 a) Un préalable : changer le regard porté sur la maladie 22 b) Développer les structures chargées du dépistage et envisager la mise en place d'un dépistage systématique 22 2. Promouvoir une prise en charge globale et de proximité des personnes malades et de leurs proches 22 a) Renforcer la coordination des soins par la création d'un « case manager » et adapter les institutions aux spécificités de la maladie 23 b) Aider les aidants et garantir un financement pérenne et équitable de la prise en charge des malades 23 3. Pour ne pas subir l'avenir, développer la recherche et agir sur les facteurs de prévention 24 a) Une piste à explorer : mettre en œuvre une large politique de prévention 24 b) Une urgence : engager un vaste programme de recherche clinique et fondamentale 24 TRAVAUX DE L'OFFICE 27 ÉTUDE 33 I.- OBJECTIF DE L'ÉTUDE 35 II.- QUELLES SONT LES STRATÉGIES ACTUELLES DE DÉPISTAGE ET DE DIAGNOSTIC ? 37 A. DIAGNOSTIC DE LA MALADIE D'ALZHEIMER EN FRANCE EN 2005 38 1. Critères diagnostiques de maladie d'Alzheimer 38 2. Diagnostic des autres démences 38 3. Applications des procédures diagnostiques en pratique 38 4. L'annonce du diagnostic 41 B. CAUSES DU SOUS-DIAGNOSTIC DES DÉMENCES 41 1. Causes liées aux difficultés propres de la reconnaissance de la maladie pour le malade, pour sa famille, pour le médecin consulté en raison de ses caractéristiques séméiologiques 41 2. Causes liées à l'image de la maladie dans la population 43 3. Causes liées à l'attitude des médecins face à la maladie 44 4. Causes liées au manque de lien et de coordination entre le champ social, le champ judiciaire et le champ sanitaire 45 C. CONSÉQUENCES DU SOUS-DIAGNOSTIC DES DÉMENCES ET INTÉRÊT D'UNE DÉTECTION PRÉCOCE SYSTÉMATIQUE 46 1. Conséquences du sous-diagnostic de la maladie d'Alzheimer et des autres démences 46 2. Un dépistage systématique de la maladie d'Alzheimer au stade précoce est-il justifié ? 47 a) Importance de la maladie 48 b) Adéquation de la durée de la phase précoce 48 c) Performances des tests diagnostiques 48 d) Efficacité de la prise en charge après la détection précoce 48 e) Acceptabilité par le système de santé 48 f) Acceptabilité pour la population 49 III.- QUELLE EST L'INCIDENCE ET LA PRÉVALENCE DE LA MALADIE D'ALZHEIMER ET DES MALADIES APPARENTÉES EN FRANCE ? 50 A. PRÉVALENCE ET INCIDENCE DE LA MALADIE 50 1. Estimation de la prévalence 50 2. Estimation de l'incidence 53 3. Confrontation avec les données nationales 54 B. PROJECTIONS POUR LES PROCHAINES ANNÉES 55 1. Projections réalisées à partir des données de prévalence 55 2. Confrontation avec les projections pour l'allocation personnalisée d'autonomie 58 1. Dépendance 60 2. Attribution de l'allocation personnalisée d'autonomie (APA) 61 3. Entrée en institution 61 F. PISTES DE PRÉVENTION 63 1. Les facteurs de risques vasculaires 63 2. Autres facteurs 64 3. Essais thérapeutiques de prévention 65 4. Trouble cognitif léger 67 5. Synthèse concernant la prévention 68 G. SYNTHÈSE 68 IV.- MODALITÉS DE TRAITEMENT 71 A. LES MÉDICAMENTS DES TROUBLES COGNITIFS DE LA MALADIE D'ALZHEIMER 71 1. Les inhibiteurs de la cholinestérase 74 a) Le donepezil 74 b) La rivastigmine 75 c) La galantamine 76 d) Autres propriétés thérapeutiques des inhibiteurs de la cholinestérase 77 2. La mémantine 77 a) Efficacité de la mémantine sur la cognition 78 b) Efficacité de la mémantine sur l'état global 78 c) Tolérance de la mémantine 78 a) Thérapeutiques anti-amyloïdes 79 b) Thérapeutiques « neuroprotectrices » 79 B. LES MÉDICAMENTS DES TROUBLES NON COGNITIFS DE LA MALADIE D'ALZHEIMER 80 1. Le traitement des troubles de l'humeur 80 2. Le traitement des troubles du comportement 81 3. Synthèse 82 C. LE TRAITEMENT MÉDICAMENTEUX DES AUTRES DÉMENCES 82 1. Le traitement de la démence vasculaire 82 2. Le traitement de la démence à corps de Lewy 83 3. Le traitement de la démence associée à la maladie de Parkinson 83 4. Le traitement de la démence fronto-temporale 84 5. Synthèse 84 D. PRINCIPAUX TRAITEMENTS NON MÉDICAMENTEUX UTILISÉS DANS LA MALADIE D'ALZHEIMER 84 1. Thérapeutiques non médicamenteuses cognitives 85 a) Les ateliers mémoire 85 b) Les référentiels pour l'exercice mnésique 85 c) La revalidation cognitive 85 2. Thérapeutiques non médicamenteuses non cognitives - approches psychosociales 86 a) Les rééducations de l'orientation 86 b) Les thérapies par évocation du passé 86 c) Les thérapies par l'empathie 87 3. Thérapeutiques non médicamenteuses non cognitives - autres approches 87 E. EFFICACITÉ DES THÉRAPEUTIQUES NON MÉDICAMENTEUSES DANS LA MALADIE D'ALZHEIMER 87 1. Thérapeutiques non médicamenteuses cognitives 88 2. Thérapeutiques non médicamenteuses non cognitives 88 3. Autres approches thérapeutiques non médicamenteuses 89 4. Synthèse 90 F. L'AIDE AUX AIDANTS 90 G. L'UTILISATION DES TRAITEMENTS MÉDICAMENTEUX DE LA MALADIE D'ALZHEIMER EN 2005 91 1. Le traitement médicamenteux des malades d'Alzheimer en France 92 2. Le traitement médicamenteux des malades d'Alzheimer en Europe 93 3. Synthèse 94 V.- QUELLE EST L'OFFRE DE SOINS ? 95 C. RÉSULTATS 101 1. L'information, la coordination, le diagnostic, les réseaux gérontologiques et les aides aux aidants 102 a) Information et coordination 102 b) Réseaux gérontologiques 103 c) Les centres mémoire de ressources et de recherche (CMRR) et les consultations mémoire de proximité (CMP) 103 d) Aides aux aidants 105 2. La prise en charge en ville 105 a) La médecine libérale 105 b) Les services de soins infirmiers à domicile (SSIAD) 106 c) Les structures d'accompagnement et de répit 107 a) Les services d'aide à domicile 108 b) La prise en charge en institution : équipement et personnel 110 D. CONCLUSION 113 VI.- L'OFFRE INSTITUTIONNELLE EST-ELLE SATISFAISANTE ? 115 A. INTRODUCTION 115 B. LE DISPOSITIF LÉGISLATIF RÉGLEMENTAIRE ET LES PLANS 117 1. Le cadre législatif, réglementaire et de l'action du gouvernement 117 a) Le volet sanitaire 118 b) Le volet social et médico-social 118 2. L'action gouvernementale 119 a) Le plan Alzheimer 2001 120 b) Le plan Alzheimer de 2004 121 C. LES INSTITUTIONS 123 a) Les directions régionales des affaires sanitaires et sociales (DRASS) et les directions départementales des affaires sanitaires et sociales (DDASS) 124 b) Les agences régionales de l'hospitalisation (ARH) 125 3. Les financeurs 126 a) L'assurance maladie 126 b) La Caisse nationale de solidarité pour l'autonomie 127 4. Les collectivités territoriales 129 a) Les communes 129 b) Les conseils généraux 129 c) Vers une action intégrée et coordonnée 130 d) La coordination et les schémas départementaux. 130 5. Les comparaisons internationales 131 a) Un besoin reconnu de coordination entre institutions 131 b) Une tendance générale : la compensation individualisée et la gestion de proximité 132 c) La place de plus en plus centrale réservée à la compensation individualisée 132 d) Une gestion de proximité privilégiée 132 D. LA COORDINATION AUTOUR DE LA PERSONNE ET DE SON ENTOURAGE 133 1. Le besoin de coordination 133 2. Evaluation des coordinations 134 3. Quel type de coordination privilégier ? 136 a) Une coordination en réseau 136 b) Un territoire restreint 136 c) Pilotée par les infirmières coordinatrices 137 E. LES ASSOCIATIONS 139 F. LES DIFFICULTÉS DES FAMILLES ET LES AIDES 141 a) Les caractéristiques des aidants 142 b) Les aides aux familles et la charge en soins 143 c) Les aides reçues 144 d) Les personnes touchées et les familles doivent faire face à de nombreuses difficultés 147 3. L'évaluation des prises en charge alternatives 148 1. Une formalisation d'un guichet unique ou d'un correspondant unique ou désignation d'un responsable de la coordination 150 2. Une action localisée par territoire 150 3. Le passage vers des plans d'aide définis dans un ensemble de soins intégrés réalisés par des professionnels 150 4. Une articulation plus grande domicile - institution 151 5. La prise en compte des demandes des familles au sein des points de contact 152 6. La formation d'aides à domicile et de coordinateurs. 152 VII.- COMMENT ADAPTER LE FINANCEMENT AUX BESOINS ? 153 A. INTRODUCTION 153 B. LES DÉPENSES MÉDICALES ET MÉDICO-SOCIALES 154 1. Méthode 154 a) Principes de calcul 154 b) Populations de références 155 2. Dépenses médicales 155 a) Dépenses prises en compte 155 b) Consultations 156 c) Médicaments 157 d) Hospitalisations 158 e) Soins à domicile 159 f) Total des dépenses médicales directes agrégées 159 g) Total des dépenses médicales directes par individu 160 3. Dépenses médico-sociales 161 a) A domicile 161 b) En institution 164 4. Total dépenses médico-sociales agrégées 166 a) Total des dépenses 166 b) Répartition des dépenses par financeur 167 c) Total des dépenses médico-sociales par individu 167 5. Coût direct et coût indirect de la maladie d'Alzheimer par niveau de sévérité 170 a) Coût médical par niveau de sévérité 170 b) Coût en institution en fonction de la gravité 172 C. COMPARAISON EUROPÉENNE, COMPARAISON AVEC D'AUTRES PATHOLOGIES ET SYNTHÈSE 173 1. Comparaison des dépenses 173 a) Comparaison européenne 173 b) Comparaison avec le cancer 174 2. Synthèse des dépenses 175 D. PROSPECTIVES 176 1. Construction d'un scénario 176 a) Hypothèses 176 b) Méthode 177 2. Résultats 177 a) En 2020 177 b) En 2040 179 c) Validité des résultats 179 E. L'ASSURANCE DÉPENDANCE, LES ASSURANCES PRIVÉES 180 1. La complémentarité public-privé 180 2. La situation du marché 181 3. Les types de contrats 181 4. Les questions du choix par les individus 182 5. Les risques d'une couverture élargie 182 F. RECOMMANDATIONS 183 VIII.- QU'ATTENDRE DE LA RECHERCHE ? 185 A. LE DÉVELOPPEMENT DE LA RECHERCHE SUR LA MALADIE D'ALZHEIMER AU COURS DES VINGT DERNIERES ANNÉES 185 B. LA RECHERCHE CLINIQUE EN FRANCE EN 2005 187 C. LE FINANCEMENT DE LA RECHERCHE CLINIQUE SUR LA MALADIE D'ALZHEIMER : VERS UN DÉSENGAGEMENT DES POUVOIRS PUBLICS ? 189 IX.- SYNTHÈSE ET RECOMMANDATIONS 191 ANNEXES 197 ANNEXE 1 : RÉFÉRENCES 198 ANNEXE 2 : CRITÈRES DSM IV DE DÉMENCE 223 ANNEXE 3 : RECOMMANDATIONS DE L'AGENCE NATIONALE D'ACCRÉDITATION ET D'ÉVALUATION EN SANTÉ (ANAES) 225 ANNEXE 4 : MINI MENTAL STATUS 229 ANNEXE 5 : RÉPARTITION DÉPARTEMENTALE DU NOMBRE DE PERSONNES DE 75 ANS ET PLUS ATTEINTES DE DÉMENCE. 231 ANNEXE 6 : RÉPARTITION RÉGIONALE DU NOMBRE DE PERSONNES DE 65 ANS ET PLUS ATTEINTES DE DÉMENCE 233 ANNEXE 7 : RÉPARTITION RÉGIONALE DU TAUX DE PERSONNES DE 65 ANS ET PLUS ATTEINTES DE DÉMENCE POUR 1 000 HABITANTS 235 ANNEXE 8 237 ANNEXE 9 241 ANNEXE 10 243 ANNEXE 11 245 ANNEXE 12 247 ANNEXE 13 249 ANNEXE 14 251 ANNEXE 15 255 Les membres de l'OPEPS étudient chaque année deux problèmes de santé importants pour l'avenir de nos concitoyens et le financement de la sécurité sociale. Cette année, M. Gérard Dériot, sénateur se penche sur l'obésité et j'ai été chargée d'approfondir les connaissances actuelles de la maladie d'Alzheimer. Je remercie les présidents des commissions chargées des affaires sociales de l'Assemblée nationale et du Sénat, M. Jean-Michel Dubernard et M. Nicolas About, de m'avoir fait confiance. Enfin, je suis admirative devant le rapport complet, simple mais précis du professeur Dartigues et de ses collaborateurs que je remercie ici de tout cœur. Cécile Gallez « Une vague de trente mètres de haut que personne ne voit véritablement venir ». C'est en ces termes que M. Philippe Douste-Blazy, alors ministre des solidarités, de la santé et de la famille, qualifiait en septembre 2004 (1) la progression inexorable d'une maladie aussi répandue qu'elle est finalement peu connue aujourd'hui : la maladie d'Alzheimer. En découvrant en 1907 les lésions cérébrales caractéristiques de cette maladie neurodégénérative, un neuropsychiatre allemand du nom d'Aloïs Alzheimer pouvait-il en effet imaginer qu'un siècle plus tard près de 25 millions de personnes en seraient atteintes dans le monde ? En choisissant d'aborder un enjeu aussi essentiel en termes de santé publique, l'Office parlementaire d'évaluation des politiques de santé (OPEPS) a souhaité par ce troisième rapport faire le point sur la maladie d'Alzheimer, qui constitue la cause principale de démence, ainsi que sur les maladies apparentées (2) afin d'améliorer la prise en charge des malades et de leurs proches. A. LA SAISINE DE L'OFFICE PARLEMENTAIRE D'ÉVALUATION DES POLITIQUES DE SANTÉ (OPEPS) VISE À RÉPONDRE À UN ENJEU MAJEUR DE SANTÉ PUBLIQUE ET DE SOCIÉTÉ A titre liminaire, il convient de rappeler qu'à l'initiative du président de la commission des affaires culturelles, familiales et sociales de l'Assemblée nationale, M. Jean-Michel Dubernard, la loi de financement de la sécurité sociale pour 2003 a créé l'OPEPS dans le but « d'informer le Parlement des conséquences des choix de santé publique afin d'éclairer ses décisions » et de « contribuer au suivi des lois de financement de la sécurité sociale » (3). Pour cela, l'office met en oeuvre des programmes d'études et procède à des évaluations. Assistée dans ses travaux par un conseil d'experts indépendants, cette délégation parlementaire est composée des présidents des commissions chargées des affaires sociales de l'Assemblée nationale et du Sénat, des rapporteurs de ces commissions en charge de l'assurance maladie dans le cadre des lois de financement de la sécurité sociale ainsi que de dix députés et dix sénateurs désignés de façon à assurer une représentation proportionnelle des groupes politiques. 1. La nécessité pour le Parlement de disposer d'une expertise approfondie sur la maladie d'Alzheimer Le choix d'inscrire la maladie d'Alzheimer et les syndromes apparentés au programme de travail de l'office s'est imposé pour plusieurs raisons. a) Un défi majeur pour la politique de santé publique La maladie d'Alzheimer est définie par l'association d'un syndrome démentiel, soit la détérioration progressive des fonctions cognitives avec un retentissement significatif sur les activités sociales et professionnelles du malade, et l'existence de lésions cérébrales spécifiques. Il s'agit en fait d'un peptide issu d'une protéine et produit anormalement, qui provoque la formation de plaques séniles et qui, en s'accumulant entre les neurones, les détruit petit à petit. En France, la maladie d'Alzheimer et les syndromes apparentés frappent environ 855 000 personnes et l'on estime à plus de 225 000 le nombre de nouveaux cas chaque année. Si l'on inclut l'entourage familial, ce sont ainsi près de trois millions de personnes qui sont directement touchées par la maladie d'Alzheimer. Entraînant une diminution de l'espérance de vie qui s'accroît avec l'âge des personnes atteintes, la durée de survie moyenne est estimée à cinq ans à partir de l'établissement du diagnostic. La démence touche également davantage les femmes et constitue la principale cause d'entrée en institution. Or, du fait principalement du vieillissement de la population et de l'amélioration du diagnostic, les projections pour les années à venir sont très inquiétantes. Ainsi, si les choses n'évoluent pas, notamment au niveau de la recherche, 1,3 million de personnes en seraient atteintes dès 2020. b) La volonté de suivre la mise en œuvre des lois de financement de la sécurité sociale et de réformes récentes L'assurance maladie est le principal financeur des soins médicaux dispensés aux patients atteints de la maladie d'Alzheimer. A travers les lois de financement de la sécurité sociale sont en effet financées les dépenses liées aux consultations et aux médicaments (enveloppe médecine de ville), aux établissements de santé ou encore aux établissements d'hébergement des personnes âgées et services de soins et d'aide à domicile (objectif médico-social). Les réseaux gérontologiques sont pour leur part financés dans le cadre de la dotation nationale de développement des réseaux (DNDR) ainsi que par le Fonds d'aide à la qualité des soins de ville (FAQSV). Le montant total des seules dépenses médicales directement liées à la maladie d'Alzheimer est ainsi estimé à près d'un milliard d'euros par an, dont plus de 97 % financés par l'assurance maladie. Il est donc important d'assurer le suivi de ce poste de dépenses croissant de la sécurité sociale. L'objectif n° 63 figurant dans le rapport annexé à la loi n° 2004-806 du 9 août 2004 relative à la politique de santé publique est de « limiter la perte d'autonomie des personnes atteintes de la maladie d'Alzheimer et son retentissement sur leurs proches ». A ce titre, il sera décliné au niveau régional en lien avec les groupements régionaux de santé publique (GRSP) qui seront mis en place dès publication des décrets d'application. Comme le prévoit expressément la loi du 9 août 2004, il est donc apparu opportun d'évaluer sa mise en œuvre (4). De nombreuses réformes ont de plus été engagées au cours de ces dernières années afin d'améliorer les conditions de prise en charge des personnes âgées, à travers notamment la création de la Caisse nationale de solidarité pour l'autonomie (CNSA) (5) ou le plan «Vieillissement et solidarités », annoncé par le Premier ministre en novembre 2003. Surtout, après que l'office a décidé de se saisir de ce sujet, un ambitieux « Plan Alzheimer 2004-2007 » a été présenté par le ministre de la santé en septembre 2004, dont l'importance justifie d'évaluer les orientations et d'accompagner la mise en œuvre. 2. La saisine de l'OPEPS et la méthode retenue pour l'élaboration de l'étude a) Les conditions de la saisine de l'office Le 24 février 2004, l'office a décidé de vérifier la faisabilité d'une étude sur la maladie d'Alzheimer et les maladies apparentées, qui a été confirmée le 2 juin 2004 sur le rapport du Pr Françoise Forette, gériatre et membre du conseil d'experts. Soulignant qu'il est « essentiel d'améliorer les techniques de prise en charge des malades, et en particulier de développer les actions de prévention et de dépistage » et que « l'action des familles doit être encouragée et le financement ajusté aux besoins », la saisine de l'OPEPS par la commission des affaires culturelles, familiales et sociales en septembre 2004 avait pour objet de « faire le point sur ces pathologies » et d' « obtenir des recommandations pour l'action publique articulées, argumentées et chiffrées ». b) L'élaboration du cahier des charges Préalablement au lancement d'un appel d'offres pour la réalisation de l'étude, un cahier des charges a été établi par la rapporteure, avec l'aide du Pr Françoise Forette. Le cahier des clauses particulières comportait une série de huit questions portant sur l'ensemble des dimensions de la maladie d'Alzheimer : la prévalence, les stratégies de dépistage et de diagnostic, les modalités de traitement, l'organisation institutionnelle, l'offre de soins, le financement, la recherche et les propositions pour l'action publique. Lors de sa réunion du 26 octobre 2004, les membres de l'office ont choisi de confier cette étude à l'Institut de santé publique, d'épidémiologie et de développement (ISPED) de l'université Victor Segalen Bordeaux II, en raison notamment de la qualité des travaux scientifiques et de la renommée du Pr Jean-François Dartigues, coordonnateur de l'étude. Conformément aux souhaits de l'office, il est d'ailleurs important de souligner que l'étude ne procède pas à une simple compilation de la littérature scientifique, mais présente également des analyses originales ainsi que des recherches en cours. La méthode générale de l'étude L'étude a été conduite en quatre étapes. 1. Synthèse de la littérature sur les différents aspects de la maladie abordés. 2. Analyse complémentaire de données d'enquêtes actuellement en cours en France et en Europe, mais non publiées. 3. Réalisation d'études spécifiques et d'auditions d'experts destinées à actualiser et compléter les connaissances existantes. 4. Premier bilan présenté à un panel d'experts français pour analyse critique, puis à un panel d'experts étrangers francophones (essentiellement du groupe formé par « the Geneva association's research programme on health and aging ») pour avis et commentaires ; l'étude remise au Parlement tient compte de l'ensemble de ces avis. B. L'ÉTUDE SOULIGNE PLUSIEURS INSUFFISANCES DANS LE DISPOSITIF ACTUEL DE DÉPISTAGE ET DE PRISE EN CHARGE DE LA MALADIE 1. Une pathologie insuffisamment diagnostiquée a) L'importance majeure de la détection précoce de la maladie compte tenu des traitements actuels Si la maladie d'Alzheimer demeure une maladie que l'on ne guérit pas, il est cependant possible de la soigner ou tout du moins de freiner son évolution. Contrairement au sentiment de fatalité qui prévaut souvent à l'annonce du diagnostic, surtout lorsque le sujet est âgé, il existe en effet des traitements médicamenteux, principalement les inhibiteurs de l'acétylcholinestérase (IAC) et la mémantine, dont l'action sur les troubles cognitifs et l'évolution générale du patient ont été démontrées. Les IAC, dont le coût moyen s'élève à 100 euros, ne sont cependant efficaces que s'ils sont administrés précocement, puisqu'ils sont indiqués pour les cas légers à modérés de la maladie. Outre ces traitements spécifiques, les médicaments psychotropes présentent également un intérêt réel pour les troubles de l'humeur et du comportement, comme l'agressivité ou le délire, qui sont une autre caractéristique, moins connue, de la maladie particulièrement difficile à vivre par l'entourage du malade, a fortiori lorsque le diagnostic de la maladie n'a pas encore été établi. Compte tenu de l'absence de traitement curatif, le diagnostic précoce est donc le seul moyen de ralentir l'évolution de la maladie et la perte d'autonomie et ainsi d'améliorer la qualité de vie des malades et de leurs proches. b) Un recours aux soins pourtant tardif, voire inexistant Alors qu'il existe des critères opérationnels de diagnostic de la maladie d'Alzheimer, validés par de nombreuses études et par la pratique clinique, l'étude souligne que dans les faits le diagnostic n'est établi que pour une personne atteinte de la maladie sur deux et seulement une sur trois au stade précoce de la démence. En France, on estime qu'il s'écoule en moyenne une période de deux ans entre les premiers symptômes caractéristiques et le moment où la maladie est diagnostiquée, contre par exemple seulement dix mois en Allemagne. Il existe à cela plusieurs raisons ayant trait notamment à la confusion entre le syndrome démentiel et le vieillissement cérébral normal, à l'absence d'informant fiable lors de la consultation, puisque la présence d'une personne proche du malade permet d'établir le diagnostic dans de bonnes conditions. Contribuent également à ce phénomène le déni des troubles, lié au fait que les malades et les proches ont peur du verdict et n'osent pas consulter, ainsi que le manque de temps des médecins, en particulier les généralistes, et de formation, en particulier pour la dimension psychologique ou sociologique de la maladie. Outre qu'il prive la personne atteinte de la possibilité de ralentir l'évolution de la maladie, le sous-diagnostic présente également des risques indirects pour celle-ci, tels que les accidents domestiques ou iatrogènes. Surtout, cette absence d'explication plonge souvent les familles dans la détresse et l'incompréhension. 2. Une offre de soins inadaptée à l'ensemble des besoins des personnes malades et de leurs proches a) Une prise en charge médicale et médico-sociale très variable et faiblement coordonnée L'étude met en évidence l'existence de fortes disparités territoriales dans l'offre de prise en charge des personnes atteintes de la maladie d'Alzheimer, qu'il s'agisse des lieux de diagnostic, comme les consultations mémoire de proximité (CMP) et les centres mémoire de ressources et de recherches (6) (CMRR), les lieux d'information et de coordination ainsi que les structures de soins, d'accompagnement et de répit et les établissements d'hébergement des personnes âgées (EHPA) et dépendantes (EHPAD). Il manque en particulier des places en institution qui soient spécifiquement dédiées aux personnes atteintes de la maladie d'Alzheimer. Cette situation se traduit ainsi par des délais d'attente importants dans certaines régions et présente des risques réels en termes d'égalité d'accès de tous aux soins. Or ces hétérogénéités ne sont pas seulement géographiques mais concernent également les modalités de prise en charge médicale et médico-sociale des malades, ce qui s'explique en partie par l'absence de recommandations de bonne pratique pour le suivi et le traitement des patients. Des thérapeutiques non médicamenteuses de la maladie sont par exemple fréquemment mises en œuvre, comme les actions de stimulation de la mémoire ou encore sensorielles, par exemple la musicothérapie, sans que leur impact sur la maladie et leur intérêt en comparaison d'autres traitements n'aient été réellement évalués jusqu'à présent. Ces difficultés sont enfin accrues par le manque de coordination entre le secteur sanitaire et le secteur médico-social et de façon générale entre les différents acteurs intervenant dans la prise en charge de la maladie. Cette situation ne semble donc pas de nature à garantir une prise en charge de qualité, qui réponde à l'ensemble des besoins des malades et de leur entourage. b) L'isolement et l'épuisement des familles C'est une maladie pénible pour la personne elle-même avant qu'elle ne perde conscience de son état mais plus encore pour son entourage, car les troubles du comportement, comme l'agitation ou le délire, ont lieu de jour comme de nuit. La personne la plus proche doit sans cesse être sur le qui-vive et la famille perd toute relation avec les voisins, les amis, et présente également des signes d'épuisement physique et psychologique. Malgré cela, peu de familles placent le malade en milieu hospitalier ou en institution par peur de culpabiliser. Il est vrai que différents types d'aides aux familles ont été mis en place au cours de ces dernières années, mais il faut aujourd'hui aller plus loin. Récemment, en Vendée, un retraité de 78 ans a tué sa femme atteinte de la maladie d'Alzheimer avant de se suicider. On aurait pourtant tort de croire que cette situation est exceptionnelle. Si elles n'en viennent pas toujours à une aussi tragique extrémité, les familles, lorsqu'elles ne sont pas accompagnées et soutenues, sont constamment sur le fil, voire en état de crise, particulièrement aux stades aigus de la maladie et il ne serait pas tolérable de les laisser continuer à porter seules ce fardeau. 3. Une charge financière lourde et croissante Outre la répartition encore insuffisante de l'offre de soins sur le territoire, la maladie d'Alzheimer et les troubles apparentés exposent particulièrement aux risques d'inégalités aux soins du fait des charges financières très importantes qu'elles induisent. Tout en soulignant les difficultés de présenter une estimation fiable de la valeur de l'ensemble des ressources employées pour prendre en charge la maladie d'Alzheimer, les auteurs de l'étude estiment en effet à 22 099 euros en moyenne les dépenses totales annuelles par personne atteinte, dont 5 791 euros de dépenses médicales et 16 307 euros de dépenses médico-sociales. Près de 55 % du coût total resteraient ainsi à la charge des familles, dont la très grande partie provient des dépenses médico-sociales, soit au total 12 146 euros par individu (7), ce qui représente une charge très lourde. Au niveau national, l'ensemble de ces dépenses représenterait ainsi 9,9 milliards d'euros. Selon les projections établies par les auteurs de l'étude, la progression de ce coût risque par ailleurs d'augmenter très rapidement, puisque le nombre de personnes atteintes de la maladie d'Alzheimer pourrait s'accroître de 54 % en 2020 par rapport à 2004 et représenter une dépense totale d'environ 20 milliards d'euros. Si plusieurs mesures, en particulier la création de l'allocation personnalisée d'autonomie (APA) et de la Caisse nationale de solidarité pour l'autonomie (CNSA), ont permis d'apporter un réel soutien aux familles et aux proches, il reste nécessaire de prévoir dès à présent des mesures pour garantir la prise en charge des malades au cours des prochaines années. c. la mise en œuvre d'une sÉrie de propositions permettrait d'amÉliorer significativement la qualitÉ de vie des malades et DE LEURS proches Les auteurs de l'étude formulent dix recommandations (cf. infra, page 195 du présent rapport), qui s'inscrivent pleinement dans le « Plan Alzheimer 2004-2007 », dont les objectifs expriment selon eux « un consensus sur ce qu'il serait souhaitable de réaliser ». Parmi ceux-ci, la rapporteure juge particulièrement prioritaire de faciliter l'établissement d'un diagnostic précoce, d'aider les familles et enfin de soutenir davantage les chercheurs. Il apparaît tout d'abord essentiel d'engager une vaste campagne d'information à destination du grand public afin de dédramatiser la maladie, qui cristallise toutes les peurs liées au vieillissement mais demeure finalement peu connue. Celle-ci pourrait par exemple rappeler l'existence de traitements, à tous les stades de la maladie, et permettre de mieux détecter les premiers signes d'alerte de la maladie, souvent banalisés, concernant par exemple l'utilisation des transports, la prise de médicaments ou encore la gestion du budget. La formation initiale et continue des professionnels de santé doit par ailleurs être améliorée afin que ceux-ci soient mieux sensibilisés aux différents syndromes démentiels, ce qui pourrait permettre de réduire le délai moyen de douze mois qui sépare la première consultation de l'établissement du diagnostic. A cet égard, il faut souligner le rôle essentiel du médecin généraliste dans le repérage les premiers symptômes de la maladie et l'orientation des patients dans une filière de soins adaptée. b) Développer les structures chargées du dépistage et envisager la mise en place d'un dépistage systématique L'étude souligne également la nécessité de développer les consultations mémoire de proximité (CMP) et les centres mémoire de ressources et de recherche (CMRR) implantés en milieu hospitalier afin que ces structures soient accessibles à tous dans des délais raisonnables. Il faut donc saluer l'engagement pris par M. Philippe Douste-Blazy, alors ministre des solidarités, de la santé et de la famille, de créer 100 nouvelles structures d'ici 2007, pour un budget de 15 millions d'euros. L'expérimentation de structures de diagnostic telles que la « Clinique de la mémoire », créée à Paris par le Pr Jérôme Blin, pourrait également être soutenue. La mise en place d'un dépistage systématique de la maladie d'Alzheimer pourrait enfin être envisagée, même si les auteurs de l'étude soulignent ne pas être en mesure d'apporter la preuve directe de son efficacité, en raison de l'absence de recherches engagées sur ce sujet. Il serait donc très opportun, malgré son coût assez élevé, d'engager une étude permettant d'évaluer l'intérêt d'un tel dispositif. Parce que la situation de chaque personne atteinte de la maladie d'Alzheimer et de son entourage est différente, une palette très large d'aides et de modes de prise en charge doit être proposée afin que l'offre de soins soit tout à la fois locale, coordonnée et réellement adaptée aux spécificités de la maladie. a) Renforcer la coordination des soins par la création d'un « case manager » et adapter les institutions aux spécificités de la maladie Pour maintenir les malades dans leur milieu de vie, il est tout d'abord important de favoriser le développement des réseaux dans la mesure où la prise en charge des malades requiert la coordination de professionnels aux compétences très variées (médecins traitants gériatres, neurologues, psychologues, infirmières, psychologues et auxiliaires de vie). Dans cet objectif d'amélioration de la coordination des soins, les auteurs de l'étude proposent d'identifier un correspondant unique, ou « case manager », qui serait responsable de la prise en charge globale des patients. Il pourrait s'agir par exemple de l'infirmière coordinatrice des soins à domicile, qui recevrait une formation spécifique et conclurait un contrat avec le patient et son entourage pour préciser le cadre de son action. Parallèlement, il apparaît particulièrement urgent de renforcer l'offre de soins afin de répondre aux besoins importants de lits en EHPAD, dont les effectifs devraient également être renforcés. Selon Mme Arlette Meyrieux, présidente de France Azheimer, le ratio de soignant par personne malade devrait en effet s'élever à un pour assurer une prise en charge de qualité. Il est également nécessaire de prendre en compte les spécificités des patients jeunes, qui nécessitent une prise en charge personnalisée, concernant notamment le reclassement professionnel ou la structure d'accueil. Des recommandations de bonne pratique concernant le suivi des patients doivent enfin être établies et diffusées afin d'homogénéiser les pratiques et améliorer la qualité de leur prise en charge. b) Aider les aidants et garantir un financement pérenne et équitable de la prise en charge des malades La formation des aidants, professionnels ou familiaux, doit tout d'abord être renforcée, en particulier les soins infirmiers donnés par les aides-soignants spécifiquement formés pour ce type de maladie, car le simple fait de saisir les mains du malade peut être considéré par lui comme une agression. Le coût d'une session de formation consacrée à l'accompagnement des démences séniles de type Alzheimer s'élève par exemple à 720 euros pour cinq jours. Le soutien psychologique, l'information et l'éducation des proches doivent également être promus, dès l'annonce du diagnostic, à travers notamment les groupes de parole. Les structures de répit et d'accompagnement sont par ailleurs essentielles pour permettre aux aidants de « souffler » un peu et favoriser ainsi le maintien à domicile du patient. L'hébergement temporaire, c'est-à-dire la possibilité de placer le malade une semaine, un mois ou plus en cas d'indisponibilité ou de maladie de l'accompagnant, ou les accueils de jour, qui permettent d'occuper la personne par des activités appropriées, pourraient ainsi être encouragés. Des chambres ou des unités spécifiques doivent également être créées pour cela en EHPAD. Dans le Valenciennois, le tarif moyen d'un accueil de jour sur la base de cinq résidents est par exemple de 47,53 euros par jour, de 41,73 euros pour l'accueil de nuit et de 33,54 euros pour une place d'hébergement temporaire. Pour alléger la charge des familles, il faut enfin leur apporter une aide financière plus importante, à travers notamment l'allocation personnalisée d'autonomie (APA). Compte tenu des perspectives démographiques, de la diminution à venir des aidants naturels, liée notamment à l'évolution sociologique de la famille, et des perspectives financières, les auteurs de l'étude formulent plusieurs propositions qui méritent d'être prises en considération. La souscription d'une assurance complémentaire pourrait tout d'abord être encouragée, même si le financement de la dépendance doit se fonder principalement sur un système par répartition afin de garantir la solidarité inter et intra-générationnelle. Une meilleure définition de plans d'aide par le « case manager » pourrait également avoir pour objectif de laisser à la charge des familles une participation proportionnelle à leurs revenus. Le meilleur moyen de ne pas subir l'avenir est encore de le faire. C'est pourquoi il est particulièrement important d'engager dès à présent deux types d'actions qui pourraient permettre de contribuer à l'infléchir très sensiblement. Si l'étiologie de la maladie d'Alzheimer demeure peu connue, il existe néanmoins plusieurs pistes de prévention primaire et secondaire, même si leur impact sur les syndromes démentiels n'a pas encore été clairement établi, à l'exception toutefois des facteurs de risque cardiovasculaires, en particulier l'hypertension artérielle, voire le diabète. Conserver des activités cognitives stimulantes, lutter contre la solitude, pratiquer la marche ou encore adopter un régime alimentaire varié pourraient également contribuer à prévenir l'apparition de la maladie. Les chercheurs de l'ISPED, qui ont fait un travail remarquable, ont tout d'abord été très sensibles au fait que les membres de l'office s'intéressent à ce problème de santé publique. Ils sont épaulés par les laboratoires pharmaceutiques mais souhaitent être aidés pour poursuivre leurs recherches. D'importants efforts restent en effet à accomplir dans ce domaine. A titre d'exemple, les auteurs de l'étude soulignent que la place de la recherche française dans le monde est supérieure pour le sida que pour la maladie d'Alzheimer alors que la prévalence de cette dernière est beaucoup plus importante en France. La création de l'Agence nationale de la recherche (ANR) devait permettre de combler ce retard, mais celle-ci n'a pas retenu comme priorité le vieillissement, qui ne fait pas l'objet d'un appel d'offres spécifique. Il est donc proposé de lancer un programme ambitieux de recherche, à travers le lancement d'un appel d'offre en 2006, qui serait cofinancé par l'ANR, la CNSA et l'assurance maladie. Quant aux perspectives à plus long terme, une première expérience de vaccin thérapeutique a été menée en 2001, après que des résultats probants ont été observés sur des souris, mais a dû être suspendue suite aux décès de plusieurs patients par encéphalite. C'est tout de même une piste, qui ne se concrétisera malheureusement pas avant au mieux une dizaine d'années. * Au-delà de la nécessité de préserver la dignité et la qualité de vie des personnes malades, au-delà de la solitude et de la détresse des familles, au-delà de la charge financière importante qu'elles représentent pour les années à venir, la maladie d'Alzheimer doit également être combattue parce qu'elle soulève des interrogations qui nous concernent tous. Celles-ci concernent en particulier la qualité et l'égal accès de tous au système de soins, l'insuffisance des moyens de la recherche ou encore la solidarité que nous souhaitons ou non préserver entre générations. C'est d'ailleurs sans doute pourquoi la maladie d'Alzheimer et les maladies apparentées sont restées trop longtemps ignorées des malades, de leurs proches, des professionnels de santé, des médias et des décideurs politiques. Ce déni n'est au fond que le miroir d'une société qui a peur de vieillir, au risque de cesser de s'interroger sur le sens de ce qu'elle vit, comme le souligne très justement le sociologue Michel Billé (8). Pour répondre à ce problème majeur de santé publique, qui est également un fléau social, le plan Alzheimer constitue un pas très important en avant. Il faudra donc veiller d'ici à 2007 à ce que les crédits soient effectivement mis en œuvre et que les échéances prévues pour les différentes mesures soient respectées. La rapporteure tient enfin à saluer la qualité de cette étude et le réel effort pédagogique accompli par ses auteurs, qui en font un document complet s'adressant à un large public et dont on ne peut que souhaiter qu'il puisse être utilisé au mieux par le Parlement, dans la perspective notamment de l'examen des prochains projets de loi de financement de la sécurité sociale. L'office s'est réuni, le mercredi 6 juillet 2005, à l'Assemblée nationale, sous la présidence de M. Jean-Michel Dubernard, député, président, pour examiner le rapport de Mme Cécile Gallez, députée, sur la maladie d'Alzheimer et les maladies apparentées. Un débat a suivi l'exposé de Mme Cécile Gallez, rapporteure. Après avoir rappelé qu'elle avait attiré l'attention des membres de l'office sur cette question importante lors de la définition des sujets d'étude de l'OPEPS pour 2005, le président Jean-Michel Dubernard, député, a félicité la rapporteure pour sa présentation synthétique, qui met bien en perspective les différentes actions à mener et les objectifs que doit se donner le Parlement s'agissant d'un problème tant médical que social. M. Gérard Dériot, sénateur, a également remercié la rapporteure pour la qualité et la clarté de son exposé, avant de souligner que l'établissement du diagnostic est souvent tardif en raison des difficultés des familles et de l'entourage des personnes atteintes à déceler les premiers signes de la maladie d'Alzheimer. S'agissant des modalités de prise en charge des malades, il semble préférable de répartir les lits qui leur sont réservés sur l'ensemble des structures d'accueil, en particulier les établissements hébergeant des personnes âgées dépendantes (EHPAD), plutôt que de les regrouper en un seul lieu, ce qui permet également d'alléger la tâche du personnel soignant qui doit faire face à des soins très lourds. Sur ce dernier point, la rapporteure a jugé important, dès lors que l'hospitalisation complète est nécessaire, que les malades soient regroupés dans des unités spécifiques situées à proximité de leur entourage, ainsi que l'a notamment suggéré la présidente de l'association France Alzheimer, Mme Arlette Meyrieux. Il est également important que les malades soient accueillis dans des lieux agréables, si possible pourvus d'espaces verts, et qui soient adaptés aux spécificités de la maladie, en particulier la déambulation. A ce propos, il semble d'ailleurs que peindre les portes en noir suffise à réduire significativement, et à moindre coût, les tentatives fréquentes d'évasion de ces patients ! Enfin, il serait bon d'aboutir à un ratio d'un soignant par malade. Saluant l'intérêt du rapport, M. Alain Vasselle, sénateur, a tout d'abord considéré nécessaire de s'appuyer sur un réseau de proximité, permettant aux familles de rester proches des patients et de maintenir ceux-ci dans leur cadre de vie habituel. S'agissant du financement, la CNSA rencontre déjà des difficultés à financer la compensation du handicap et la dépendance des personnes âgées. Le manque de moyens ne lui permettra pas d'abonder les ressources destinées à lutter contre la maladie d'Alzheimer de façon pleinement satisfaisante, à moins que la rapporteure n'ait reçu des assurances en ce sens de la part du gouvernement. La rapporteure a répondu que pour garantir une prise en charge de qualité et surtout de proximité, l'objectif idéal serait de développer dans les maisons de retraite au moins deux chambres par étage réservées aux patients atteints de la maladie d'Alzheimer ou de maladies apparentées. Après avoir rappelé l'intérêt et l'importance des travaux de l'OPEPS, M. Marc Bernier, député, a remercié la rapporteure pour son exposé très clair sur un sujet particulièrement préoccupant et qui peut à terme concerner chacun. Il est d'ailleurs intéressant de noter que le premier rapport de l'OPEPS sur les résultats du dépistage du cancer du sein continue à faire l'objet d'un intérêt soutenu. En effet, avec l'assistance du conseil d'experts, l'OPEPS choisit d'approfondir des sujets de société, qui permettent d'améliorer l'information du Parlement et de contribuer au suivi des lois de financement de la sécurité sociale. Les chiffres fournis par la rapporteure soulignent l'acuité des besoins de financement, besoins que la CNSA ne pourra combler. Il faut donc mettre en place rapidement les moyens nécessaires pour réaliser un diagnostic précoce de la maladie, dédramatiser l'annonce du diagnostic et engager un réel effort de formation des personnels médicaux et surtout para-médicaux. En outre, on peut se demander si l'égalité d'accès aux soins est aujourd'hui assurée sur l'ensemble du territoire. Enfin, s'agissant de la recherche, il est à noter que l'Agence nationale de la recherche (ANR) n'a pas retenu le vieillissement comme sujet d'étude. Dans ces conditions, la France peut sembler en retard au niveau international, notamment par rapport aux pays anglo-saxons. La rapporteure a indiqué que la France n'est pas en retard au niveau européen, en particulier pour le traitement de la maladie. Par aileurs, l'étude réalisée par l'ISPED comporte d'importants développements sur le caractère hétérogène de la répartition des structures de diagnostic et de soins sur l'ensemble du territoire. M. Paul Blanc, sénateur, a souhaité avoir des précisions sur les chiffres donnés par la rapporteure, qui semblent en contradiction avec l'évaluation de 2,4 millions de personnes atteintes de la maladie d'Alzheimer en 2020, avancée par le professeur Jean-François Dartigues lors de son audition par l'office. Concernant la question du financement, il faut rappeler que la CNSA a été créée pour compenser le handicap. Or les crédits dévolus au handicap tendent à diminuer, si bien que l'on peut se poser la question de la création à terme d'un éventuel « mardi de la Pentecôte » ! Dans ce contexte, il apparaît indispensable de développer l'assurance dépendance, à défaut de quoi le problème financier posé par la maladie d'Alzheimer risque de submerger l'ensemble du système. Le président Jean-Michel Dubernard, député, a rappelé que la CNSA a pour vocation non seulement de financer la compensation du handicap mais aussi la dépendance des personnes âgées. La rapporteure a précisé que, selon les projections réalisées par les auteurs de l'étude, et si rien n'est fait d'ici là, notamment dans le domaine de la recherche, la maladie d'Alzheimer pourrait concerner environ 2,1 millions de personnes en 2040 et absorber environ 7 % des dépenses de santé. Après avoir déclaré que les propos tenus par la rapporteure sont tout à fait corroborés par l'expérience du terrain, Mme Maryvonne Briot, députée, a souligné l'importance de distinguer deux phases pour la prise en charge des personnes atteintes de la maladie d'Alzheimer. Au cours de la première, les familles aident, autant qu'elles le peuvent, le malade à rester à son domicile. Puis, au bout d'un certain temps, les familles, qui sont épuisées et dépassées par la situation, ne voient guère d'autre solution que de placer la personne malade en institution. Or il manque aujourd'hui de structures adaptées ; en conséquence, le patient est alors souvent hospitalisé dans un service de médecine générale, alors que les personnels des services sont peu formés à la prise en charge de ces malades, ou finalement en hôpital psychiatrique, ce qui ne devrait en aucun cas être leur place. Il est donc essentiel, d'une part, de créer des places supplémentaires dans les structures d'accompagnement et d'hébergement temporaire et, d'autre part, de prévoir lors de la deuxième phase de la maladie la création de centres spécifiques, ce qui est indispensable pour prendre en compte l'ensemble des caractéristiques de cette maladie. Il convient enfin de souligner le problème aigu de formation dans les hôpitaux dits de proximité dans la mesure où, comme l'a souligné la rapporteure à juste titre, la prise en charge de cette maladie exige des gestes et des attitudes spécifiques. Dès lors, si la recherche revêt une importance réelle, les problèmes de formation n'en méritent pas moins une très grande attention. M. Alain Vasselle, sénateur, a rappelé qu'il avait déposé en 1998 une proposition de loi sur ce sujet, qui n'a malheureusement pas été inscrite à l'ordre du jour de l'Assemblée nationale après son adoption par le Sénat en janvier 1999. Les ministres en charge de cette question, M. Bernard Kouchner et Mme Martine Aubry, avaient alors jugé inutile d'adopter ce texte, en arguant, d'une part, du caractère réglementaire des diverses mesures nécessaires et en soulignant, d'autre part, que de nombreuses initiatives avaient déjà été engagées sur ce sujet. Quelques années plus tard, il serait donc très intéressant de disposer d'un bilan précis des mesures règlementaires effectivement prises depuis lors. Certes, quelques unités de diagnostic et de soins se sont créées. Il subsiste cependant des problèmes importants en matière de formation des personnels et de diversité des structures d'accueil. Si un tel bilan existe, il devrait être annexé au rapport. En outre, il faudrait élaborer une programmation des moyens engagés pour atteindre les objectifs recherchés. Les recommandations du rapport ne doivent pas rester des vœux pieux mais trouver un écho lors de la discussion du prochain projet de loi de financement de la sécurité sociale. Après avoir souligné l'intérêt de cette proposition, la rapporteure a indiqué que le bilan des mesures réglementaires n'a pas été réalisé dans le cadre de l'étude de l'ISPED. Après être convenu que les mesures à prendre dans ce domaine relèvent effectivement en grande partie du domaine réglementaire, le président Jean-Michel Dubernard, député, a jugé important que les parlementaires disposent de ce bilan et s'appuient de manière générale sur les travaux de la rapporteure lors de la discussion du prochain projet de loi de financement de la sécurité sociale. M. Gilbert Barbier, sénateur, vice-président, a souligné que, malgré l'impératif d'une formation adaptée, les efforts engagés dans les facultés et les écoles d'infirmières sont dépendants du bon vouloir des instructeurs, alors qu'il faudrait un plan de formation cohérent et volontariste. A cet effet, il serait intéressant de se pencher sur la question des programmes, qui relève bien du domaine réglementaire. La rapporteure a jugé en effet nécessaire de développer les formations à l'accompagnement des démences séniles de type Alzheimer à l'intention des personnels soignants, en particulier d'infirmières, comme c'est le cas par exemple dans le Valenciennois. Le président Jean-Michel Dubernard, député, a estimé qu'il faut envisager de manière globale le problème de la formation des professionnels de santé. Il faudrait se tourner vers les expériences étrangères, comme celle de l'université d'Harvard aux Etats-Unis. Il est donc nécessaire d'engager une réflexion approfondie sur la formation des professionnels de santé, laquelle risque de se heurter à certaines réticences, voire à l'expression de corporatismes. La rapporteure a rappelé que le plan Alzheimer 2004-2007 comporte de nombreuses dispositions destinées à renforcer la formation des professionnels de santé, en particulier dans les EHPAD. Mme Maryvonne Briot, députée, a jugé indispensable de renforcer la formation continue des personnels paramédicaux, en associant projet de service et projet professionnel et en s'appuyant également sur les associations, telles que France Alzheimer, qui dispose de nombreux relais locaux. On ne peut pas en effet demander aux infirmières d'être des spécialistes dans les différents domaines de la médecine, comme par exemple la cardiologie. M. Jean Bardet, député, secrétaire, a approuvé la mise en place d'une politique tendant à améliorer la formation continue des infirmières afin qu'elles disposent de compétences approfondies dans un domaine particulier, ce qui permettrait d'améliorer significativement la qualité de la prise en charge des patients. Or, dans de nombreux établissements, et en particulier à l'Assistance publique-hôpitaux de Paris (AP-HP), les personnels infirmiers sont de fait interchangeables d'un service à un autre ; une infirmière formée en cardiologie peut donc être mutée dans un service d'oto-rhino-laryngologie. Cette gestion des personnels est d'autant plus regrettable qu'il faudrait au contraire encourager les infirmières formées dans des spécialités médicales à rester dans les services concernés. Le président Jean-Michel Dubernard, député, a indiqué avoir dressé le même constat dans les hôpitaux de Lyon, tout en soulignant que les chefs de service résistent souvent à cette pratique administrative. L'urologie, par exemple, présente des spécificités nécessitant une formation à des gestes très particuliers ; aux Etats-Unis, il existe des infirmières spécialisées dans cette discipline mais elles sont de ce fait davantage rémunérées que leurs collègues, ce qui semble a priori difficile à mettre en œuvre en France. M. Paul Blanc, sénateur, a indiqué que les travaux de la commission d'enquête sur la maltraitance envers les personnes handicapées, dont la présidence lui avait été confiée, avaient permis de mettre en évidence deux causes principales de maltraitance : le manque de formation professionnelle des personnels soignants et l'application de la législation relative à la réduction du temps de travail. * A l'unanimité, l'office a autorisé le dépôt du rapport en vue de sa publication. Cette étude a été réalisée par l'Institut de santé publique, d'épidémiologie et de développement (ISPED) de l'Université Victor Segalen Bordeaux 2 : - M. Jean-François Dartigues, professeur des universités-praticien hospitalier, épidémiologiste (ISPED) ; - M. Yves-Antoine Flori, professeurs des universités, économiste (ISPED) ; - Mme Catherine Helmer, chargée de recherche à l'Institut national de la santé et de la recherche médicale (INSERM), épidémiologiste (ISPED) ; - Mme Florence Pasquier, professeur des universités-praticienne hospitalière, neurologue (fédération des centres mémoire de ressources et de recherche - CMRR) ; - M. Arnousse Beaulière, post-doctorant, économiste (ISPED) ; - M. Antoine Pariente, interne de santé publique (ISPED). L'objectif de notre étude est de répondre aux huit séries de questions du cahier des clauses particulières annexé à l'appel d'offre de l'Office parlementaire d'évaluation des politiques de santé (OPEPS) sur la maladie d'Alzheimer et les maladies apparentées. La méthode générale de l'étude a été conduite en quatre étapes. La première étape a été une synthèse de la littérature sur les différents aspects de la maladie abordés. La seconde étape a été une analyse complémentaire de données d'enquêtes actuellement en cours en France et en Europe, mais non publiées. La troisième étape a été la réalisation d'études spécifiques, et d'auditions d'experts destinées à actualiser et compléter les connaissances existantes. A l'issue de cette démarche, la quatrième étape a été entreprise avec un premier bilan présenté à un panel d'experts français pour analyse critique, puis à un panel d'experts étrangers francophones (essentiellement du groupe formé par « the Geneva association's research programme on health and aging ») pour avis et commentaires. L'étude remise au Parlement tient compte de l'ensemble de ces avis. Les questions de l'OPEPS étaient les suivantes : Question 1 : Quelles sont l'incidence et la prévalence de la maladie d'Alzheimer et des maladies apparentées en France ? Question 2 : Quelles sont les stratégies actuelles de dépistage et de diagnostic ? Question 3 : Quelles sont les modalités de traitement ? Question 4 : Quelle est l'offre de soins ? Question 5 : L'organisation institutionnelle est-elle suffisante ? Question 6 : Comment adapter le financement aux besoins ? Question 7 : Qu'attendre de la recherche ? Question 8 : Synthèse et propositions de recommandations pour l'action publique La logique de l'étude est de passer de l'épidémiologie et de l'évaluation médico-économique à la prospective. Cependant, les difficultés du diagnostic de maladie d'Alzheimer en l'absence d'informant valide (c'est-à-dire d'une personne fiable, capable de fournir une anamnèse précise des troubles) ou en situation de dépistage (c'est-à-dire dans le cadre d'une démarche systématique notamment en l'absence de recours spontané au système de soins) sont un problème déterminant pour le repérage des malades, tant pour les praticiens que pour les acteurs sociaux et les institutions, et donc pour les estimations épidémiologiques. Toutes les projections concernant l'évolution de cette pathologie et les besoins générés sont conditionnés par la qualité de ce repérage. Dans un souci de cohérence et de lisibilité, il a donc été décidé de consacrer au problème du diagnostic et de la détection de la maladie le premier chapitre de l'étude. De ce fait, la question 2 de l'OPEPS devient la question 1, et inversement. Par contre il nous a paru plus logique de traiter la prévention avec le chapitre suivant sur l'épidémiologie. Le plan de notre rapport d'étude suit ensuite l'ordre des questions posées par l'OPEPS. Nous avons regroupé les recommandations pour chaque chapitre dans la synthèse finale du rapport d'étude. II.- QUELLES SONT LES STRATÉGIES ACTUELLES DE DÉPISTAGE ET DE DIAGNOSTIC ? Question 2 : « Quelles sont les stratégies actuelles de dépistage et de diagnostic ? » Présenter les moyens actuels de dépistage, de diagnostic de la maladie. Développer les aspects relatifs à la dimension éthique de la maladie, notamment en ce qui concerne l'annonce du diagnostic et l'image de la maladie. Intégrer à la réponse l'évaluation du dispositif et des propositions d'amélioration. La démence, ou plutôt le syndrome démentiel, est caractérisée par une détérioration progressive des fonctions cognitives dont la mémoire, le langage, l'attention, les fonctions visuo-spatiales, les fonctions exécutives (c'est-à-dire les fonctions d'anticipation, d'initiation et de planification des tâches), la conscience de soi et de son environnement, les praxies (capacités gestuelles) et les gnosies (capacités à reconnaître les êtres vivants et les objets) avec un retentissement significatif sur les activités sociales et professionnelles du malade. Le retentissement des troubles est particulièrement et précocement marqué sur certaines activités de la vie quotidienne comme l'utilisation des moyens de transport, la conduite automobile, la prise de médicaments, la gestion du budget, l'utilisation du téléphone, la communication avec autrui en général [1]. La maladie d'Alzheimer (MA) est définie par l'association d'un syndrome démentiel et à l'examen histologique du cerveau l'existence d'une perte neuronale et la présence de plaques amyloïdes et de dégénérescences neuro-fibrillaires. La maladie d'Alzheimer est la cause principale de syndrome démentiel et en représente au moins deux tiers des cas [2]. Les autres causes principales de syndrome démentiel sont la démence vasculaire, la démence à corps de Lewy, la démence compliquant la maladie de Parkinson et la démence fronto-temporale. Une faible proportion des démences, environ 1,5 % des cas, est de cause curable, comme une déficience en vitamine B12 ou une hypothyroïdie [3]. L'évolution de la maladie d'Alzheimer comme celle de la plupart des démences est le plus souvent progressive avec une aggravation des troubles cognitifs, apparition de nouveaux troubles notamment au niveau du comportement des malades et de leur personnalité, aggravation de la dépendance avec au stade sévère, altération des activités essentielles de la vie quotidienne (toilette, habillage, alimentation, locomotion). Cette aggravation progressive avec une dépendance de plus en plus marquée dans tous les actes de la vie, avec un comportement de moins en moins supportable pour les familles (fugue, délire, hallucinations, etc.) fait toute la spécificité de la maladie d'Alzheimer et des démences. La dépendance fait partie de la maladie et contribue à la définir. Dans la plupart des autres causes de dépendance même lourde, l'évolution n'est pas de ce type, ou en général elle est beaucoup moins longue, moins insidieuse, moins chronique. La souffrance des familles est donc à son paroxysme avec un sentiment fréquent de culpabilité de ne pouvoir aider convenablement un être cher. Nous ne pouvons pas détailler ici la clinique de la maladie d'Alzheimer et des syndromes apparentés. L'objet de ce chapitre est surtout de décrire l'application pratique des procédures diagnostiques et de souligner les difficultés et les dysfonctionnements s'ils existent. 1. Critères diagnostiques de maladie d'Alzheimer Le diagnostic de démence est un diagnostic clinique. La nature de la cause de cette démence, (le plus souvent une maladie d'Alzheimer pure ou associée à une pathologie vasculaire ou d'une autre atteinte dégénérative chez les personnes âgées) est certifiée par l'examen du cerveau au décours immédiat du décès, la biopsie cérébrale du vivant des malades n'étant pas éthique en raison du rapport bénéfice - risque défavorable de ce geste invasif. Des critères opérationnels de diagnostic qui font l'objet d'un consensus général de la communauté scientifique existent pour le syndrome démentiel (les critères du Diagnostic and Statistical Manual of Mental Disorder (DSM) IV [4]) comme pour la maladie d'Alzheimer avec les critères du National Institute of Neurological and Communicative Disorders and Strokes -Alzheimer'rs Disease and Related Disorders Association (NINCDS-ADRDA) [5]. Ils sont reproduits en annexe 2. Ces critères ont été validés par de nombreuses études et par la pratique clinique, et leur application ne pose pas de problèmes majeurs quand le malade consulte un médecin compétent pour des troubles cognitifs, en présence d'une personne (informant) susceptible de fournir des informations fiables. 2. Diagnostic des autres démences Le diagnostic des autres causes de démence a fait également l'objet de critères de consensus, par exemple les critères NINDS-AIREN pour les démences vasculaires [6], les critères de Mc Keith [7] pour les démences à corps de Lewy, les critères de Neary pour les démences fronto-temporales [8]. L'application de ces critères est complexe et le recours à un spécialiste pour porter un diagnostic d'autre démence est indispensable. 3. Applications des procédures diagnostiques en pratique L'utilisation des critères précités notamment pour la maladie d'Alzheimer a fait l'objet de recommandations pratiques par l'Agence nationale d'accréditation et d'évaluation en santé (annexe 3) [9]. L'ANAES recommande en particulier un avis spécialisé avec un bilan neuropsychologique et une imagerie cérébrale. L'application de ces recommandations a été évaluée en France dans les cas où un inhibiteur de l'acéthylcholinestérase (IAC), premier médicament ayant obtenu en France leur autorisation de mise sur le marché pour l'indication MA, a été prescrit [10]. L'enquête a été réalisée dans 9 régions de France par les médecins conseils de l'assurance maladie entre décembre 2000 et février 2001 auprès de 3 510 patients. Elle montre que les procédures diagnostiques de MA et les conditions de prescriptions initiales des IAC sont dans l'ensemble conformes aux recommandations officielles avec un recours au spécialiste dans plus de 94,7 % des cas, un score au MMS (test psychométrique universellement reconnu pour aider au diagnostic et mesurer la sévérité de la démence, annexe 4) dans 85,5 % des cas, une imagerie cérébrale réalisée dans 84,9 %. Quand le malade a recours au système de soins et que le médecin considère qu'un bilan diagnostique est justifié, les procédures recommandées sont donc relativement bien appliquées. Par contre, des dysfonctionnements importants apparaissent en cas d'absence de recours des malades au système de soins ou en cas de plainte au médecin, quand celui-ci ne programme pas le bilan diagnostique. Ainsi dans l'étude des 3 Cités [11], lors du recueil initial des données de la cohorte en 1999 et 2000 réalisé dans 3 villes de France, Bordeaux, Dijon et Montpellier, 201 sujets ont été classées « déments prévalents » par un panel d'experts spécialistes, c'est-à-dire présentant une démence au moment du recueil des données. Parmi ceux-ci, 61,4 % seulement avaient consulté un médecin pour des troubles cognitifs et 32,9 % avaient vu un spécialiste (données non publiées). Un diagnostic précis a été annoncé au malade ou à sa famille dans 29,6 % des cas. Ces proportions sont très variables en fonction de l'âge des sujets (tableau II.1). La plainte au médecin diminue nettement avec l'âge et le recours au spécialiste s'effondre après 80 ans passant de 55 % à 19,7 %. Tableau II.1. Proportions de consultations d'un médecin généraliste pour troubles cognitifs et de recours au spécialiste chez les sujets présentant une démence prévalente dans l'étude des 3 Cités. (N=201)
Ces résultats montrent que 4 malades sur 5 après 80 ans n'ont pas eu accès aux procédures diagnostiques recommandées officiellement, soit parce qu'ils n'ont pas eu recours au système de soins (dans 45 % des cas, pas de plainte au médecin généraliste), soit parce qu'ils se sont plaint au médecin de troubles cognitifs, mais que le médecin n'a pas initié de bilan diagnostique. Ces résultats ne sont pas spécifiques à la France. Ainsi dans une étude réalisée en Finlande, Lopponen et al [12] ont montré que 48,2 % seulement des sujets déments détectés par l'étude avaient été diagnostiqués par un médecin auparavant. La proportion de sujets déments connus était liée à la sévérité de la démence (évaluée à partir du score au MMS) de 73 % pour les démences sévères (MMS < 10) à 33 % pour les démences légères (MMS > 20). Ceci signifie qu'au début de la démence, un malade sur trois seulement était diagnostiqué, et que même en fin de maladie, près d'un malade sur quatre était ignoré. A l'inverse, quand le diagnostic de démence avait été porté avant l'enquête par les médecins traitants, il a été confirmé dans la plupart des cas (91,5 %). Bien d'autres études partout dans le monde ont montré une importante proportion de cas non diagnostiqués dans la population en Suède [13], en Angleterre [14], au Canada [15], aux Etats-Unis [16]. Ces données sont corroborées par la « Facing dementia survey » [17], vaste enquête européenne d'opinion réalisée par interview dirigé dans 6 pays (France, Grande-Bretagne, Allemagne, Italie, Espagne et Pologne) auprès de 618 aidants familiaux (l'aidant est la personne non professionnelle qui aide le malade dans ses activités de la vie quotidienne, le plus souvent son époux ou un de ses enfants), de 96 malades, de 605 médecins généralistes, de 1 200 personnes de la population générale et de 60 décideurs politiques. Cette enquête a été menée par Alzheimer International (qui réunit les Associations des familles d'Alzheimer dont France Alzheimer) et les Laboratoires Pfizer. Elle montre que selon les médecins, seuls 4 malades sur 10 consultent pour la première fois à un stade de démence légère, 54 % à un stade modéré et 7 % ne consultent qu'à un stade sévère [18]. La France a les mêmes résultats que la moyenne européenne. Selon les aidants, le délai entre les premiers signes inquiétants et la première consultation médicale pour trouble cognitif a été en moyenne de 10 mois, et le délai entre cette consultation et le diagnostic également de 10 mois soit au total 20 mois quand le diagnostic est fait. En France, le délai est un peu plus long que la moyenne européenne : il est au total de 24 mois, soit le délai le plus long après la Grande-Bretagne (32 mois). On notera que le délai le plus court est en Allemagne (avec 10 mois seulement) où la part de la dépendance prise en charge par le financement public est la plus importante, et en Italie (avec 14 mois) où le nombre de médecins est le plus important. Au total, la maladie d'Alzheimer et les autres démences sont souvent ignorées dans la population générale notamment après 80 ans. Ce sous-diagnostic concerne environ un malade sur deux. Il est particulièrement fréquent au stade précoce de la démence, où un malade sur trois seulement est détecté. Il est lié à la fois à un défaut de recours aux soins par les malades et leurs familles, et à un défaut de mise en place de procédures diagnostiques par le médecin en cas de plainte cognitive. Cependant, quand les procédures diagnostiques sont initiées, elles le sont de manière satisfaisante avec peu d'erreurs diagnostiques par excès. Nous avons vu que moins de 30 % des déments prévalents ou de leurs proches dans l'étude 3C connaissaient leur diagnostic. L'annonce du diagnostic qui est théoriquement une obligation légale, est loin d'être la règle dans cette maladie. Ces résultats confirment les tendances retrouvées dans la littérature : moins d'un psychiatre sur deux annoncent le diagnostic en Ecosse [19] ou en Angleterre [20]. Cette difficulté à annoncer le diagnostic se comprend compte tenu du caractère dramatique de la maladie. Le nom de « démence » majore certainement la stigmatisation des malades et doit être rejeté. Un colloque a été organisé à Lille en 2004 dans le cadre du plan Alzheimer 2004-2008 sur les aspects éthiques de l'annonce du diagnostic (www.sante.gouv.fr). Nous pouvons en tirer les conclusions suivantes : L'annonce du diagnostic est nécessaire non seulement parce que c'est le droit des patients, mais parce que c'est du diagnostic que dépend le traitement et le plan de soins, une meilleure attitude de l'entourage, l'anticipation des périodes de crises, le choix des décisions auquel le patient peut participer. De plus, l'indication des traitements est inscrite sur la notice des boîtes de médicaments. Les patients sont le plus souvent capables de comprendre les explications au moins en début de maladie et les erreurs diagnostiques par excès sont rares. Le risque de réaction catastrophique est très limité et le suicide est exceptionnel. Toutefois un accompagnement psychologique après l'annonce du diagnostic pour le malade et l'aidant serait tout à fait souhaitable. Il est malheureusement le plus souvent impossible en raison du manque de moyens et de temps. Cet accompagnement permettrait de limiter le sentiment d'isolement des patients. La Facing Dementia Survey a révélé que l'isolement était selon les malades capables de répondre, la principale conséquence de leur maladie. Les causes du sous-diagnostic des démences dans la population sont multiples. Elles sont superposables en grande partie aux causes des dysfonctionnements dans la prise en charge des malades. C'est la raison pour laquelle nous les développerons en détail. Elles peuvent être regroupées en quatre ensembles : 1. Causes liées aux difficultés propres de la reconnaissance de la maladie pour le malade, pour sa famille, pour le médecin consulté en raison de ses caractéristiques séméiologiques La principale difficulté est due au fait d'une confusion entre démence débutante et vieillissement, la fréquence du déclin pathologique ayant pu faire penser qu'il n'était qu'une variante du vieillissement normal. Or le vieillissement n'est responsable que d'un ralentissement du traitement de l'information qui se manifeste à de degrés divers par des difficultés d'attention partagée, d'accès aux noms propres, à un ralentissement de l'apprentissage (sans oublis plus sévères ni plus fréquents) sans retentissement sur les activités quotidiennes du fait du caractère très lents, continu, permettant une adaptation progressive à ces modifications physiologiques. Dans la Facing Dementia Survey, 86 % des aidants, 93 % des médecins et 81 % des sujets de la population générale considèrent que c'est la cause principale de retard au diagnostic [21]. Il n'existe malheureusement pas de test diagnostic simple permettant de différencier précocement le normal du pathologique et seul un bilan clinique et neuropsychologique permet de trancher. Habituellement, les malades, les familles et les médecins préfèrent temporiser en cas d'incertitude, et observer une dégradation avant d'intervenir. Une autre difficulté provient du fait que la maladie survient surtout chez des sujets âgés, ayant plusieurs maladies (polypathologie), avec souvent des troubles sensoriels (auditifs ou visuels) qui altèrent par eux mêmes les performances cognitives et compliquent donc l'anamnèse et l'examen clinique des malades. Dans le même ordre d'idées, le déclin des performances cognitives par rapport à un niveau antérieur est essentiel au diagnostic, mais cette notion est parfois prise en défaut notamment en cas de très bas niveau d'études des sujets concernés (les performances ont alors toujours été faibles, ou certaines fonctions comme la lecture ou le calcul n'ont jamais été acquises), ou pour d'autres raisons culturelles, professionnelles ou familiales. Les mêmes difficultés se rencontrent dans l'évaluation du retentissement du déclin cognitif sur la vie sociale, certains sujets n'ayant jamais accompli les activités de la vie quotidiennes qui permettent de faire le diagnostic comme la gestion du budget ou la conduite automobile. Par ailleurs, la maladie d'Alzheimer est particulièrement fréquente chez les sujets très âgés, qui sont souvent isolés soit parce qu'ils sont veufs sans enfants, soit parce qu'ils sont éloignés de leurs familles. Dans ce cas, le manque d'informant fiable susceptible de fournir une anamnèse valide est évident. Mais c'est aussi le cas quand le sujet vit en collectivité, en établissement d'hébergement pour personnes âgées, car souvent le personnel soignant connaît mal le passé de la personne. Enfin le déni des troubles, c'est-à-dire le fait que le malade refuse de les reconnaître est très fréquent en début de maladie. La maladie d'Alzheimer a dans la population générale une image catastrophique de mort cérébrale lente et de dépendance qui conduit les sujets à développer des mécanismes de défenses psychologiques dont le principal est le déni de la maladie et des troubles cognitifs. Ce mécanisme n'est pas spécifique de la maladie d'Alzheimer, mais il y est particulièrement fréquent. Ce déni existe non seulement chez les sujets eux-mêmes, mais aussi dans leur entourage proche, en raison de l'angoisse de la perte prochaine de la vie de relation avec un être cher. Toutes ces raisons font que l'interrogatoire des sujets et des aidants des troubles sont souvent peu fiables notamment en l'absence de recours spontané aux soins. Les deux points clés du diagnostic que sont la mise en évidence d'un déclin des performances cognitives et le retentissement de ce déclin sur les activités de la vie quotidienne ne peuvent être obtenues que par un interrogatoire fiable. L'importance de l'évaluation de l'incapacité est cruciale pour l'établissement du diagnostic de la maladie, mais également pour l'élaboration des réponses à apporter pour la prise en charge des malades. A ce jour, il existe des outils standardisés d'évaluation des incapacités, mais leur utilisation, est loin d'être opérationnelle et répandu. L'évaluation du statut du patient dépend donc de l'expertise du soignant qui, pour ce faire, applique des outils et des seuils différents en fonction de sa qualification, mais aussi du contexte dans lequel est vécu la maladie et des convictions de chacun des acteurs. Ceci conduit à une grande variabilité pour l'accès au diagnostic. 2. Causes liées à l'image de la maladie dans la population La maladie a été longtemps complètement ignorée dans la population et chez les décideurs politiques. Ainsi aucune mention n'est faite sur la maladie d'Alzheimer et les syndromes apparentés dans le rapport du Haut comité de la santé publique en 1998 sur la santé des Français [22], alors que plus de 500 000 personnes en étaient déjà atteintes et que les démences représentaient déjà de très loin la cause principale de dépendance et d'entrée en institution du sujet âgé. Les choses ont évolué depuis et la maladie est enfin reconnue comme problème majeur de santé publique puisqu'elle a fait l'objet d'un chapitre spécial dans le dernier rapport de ce même Comité. Cependant l'image de la maladie dans la population reste loin d'être favorable à sa médicalisation. L'attitude des aidants et des malades eux-mêmes reste très fataliste face à une affection considérée comme irréversible [21]. La crédibilité des traitements médicamenteux ou non médicamenteux est également mise en cause. Dans la Facing Dementia Survey, 30 % des aidants et 24 % des sujets de la population générale seulement considéraient que ces traitements sont efficaces. Or « en l'absence de solution mieux vaut ignorer le problème ». Enfin et surtout la maladie est considérée par les décideurs politiques comme une maladie touchant des sujets âgés ou très âgés qui ont profité de la vie et qui ne travaillent plus [23]. Comme ils ne font plus partie des masses laborieuses susceptibles de faire progresser notre produit intérieur brut, les affections qui les touchent ne sont pas au même niveau de priorité que des maladies qui touchent les adultes plus jeunes. Ceci amène les décideurs à limiter les moyens affectés à ces maladies pour les soins et pour la recherche et, selon Rimmer et al [23] cet état de fait crée un cercle vicieux qui conduit à la méconnaissance et la mauvaise prise en charge de ces maladies, de ces malades et de leurs familles (figure II.1). Figure II.1 : Cercle vicieux qui perpétue le financement inadéquat des soins et de la recherche dans la maladie d'Alzheimer (MA). D'après Rimmer et al (23).
Faibles financements Faible sensibilisation et pour la recherche et les soins faible soutien pour la MA
MA sous diagnostiquée Défaut de formation Manque de spécialistes
3. Causes liées à l'attitude des médecins face à la maladie Une étude canadienne [15] a analysé les raisons du sous-diagnostic de la démence par les médecins. La principale raison est le manque de temps, la deuxième raison est la peur de choquer le patient ou sa famille et la troisième, la peur d'un effet néfaste de l'annonce du diagnostic. Ces trois raisons sont liées : si le médecin avait assez de temps, il pourrait informer clairement les patients et leurs familles et prévenir ainsi toute réaction péjorative. On peut ajouter à ces raisons le manque de crédibilité de l'efficacité des traitements médicamenteux ou non, puisque 41 % des médecins seulement considèrent qu'il existe un traitement efficace de la maladie [18]. Cet argument est surtout déterminant chez les sujets de plus de 80 ans en raison de la polymédication des malades et de la crainte d'accident iatrogène. A l'opposé de cet argument, certains médecins généralistes considèrent au contraire comme injuste le fait de ne pas pouvoir prescrire en première intention les médicaments contre la maladie d'Alzheimer, et y voit un obstacle à sa médicalisation. Par ailleurs la formation des médecins généralistes a été dans le passé très insuffisante sur la maladie d'Alzheimer ou les syndromes apparentées en regard de la fréquence actuelle du problème, puisqu'elle se limitait à quelques heures de cours pendant toutes les études médicales. Depuis l'essor de la gériatrie en tant que discipline, la formation des médecins est devenue plus étoffée. Cependant, les aspects psychologiques, sociologiques et de santé publique de la maladie ne sont que rarement abordés. Ceci explique en partie le manque d'intérêt que reconnaissent certains médecins pour la prise en charge de ces malades et le manque de valorisation ressentie quand ils s'occupent de leurs problèmes. En même temps et de manière un peu paradoxale, certains médecins ont des difficultés à déléguer certaines tâches lors de la prise en charge initiale des malades ou lors du suivi, même si un réseau est constitué, parce qu'ils n'ont pas vraiment appris à le faire. Tout ceci conduit les aidants et la population générale à douter de la compétence des médecins pour résoudre leurs problèmes. Dans la Facing dementia survey, 65 % des aidants et 62 % des sujets de la population doutaient de l'aptitude des médecins généralistes à pouvoir résoudre les problèmes posés par une MA, et ces proportions étaient encore de 42 % et 40 % pour les spécialistes. Un autre cercle vicieux plus local, qui concerne la relation médecin malade, peut alors être décrit (figure II.2). Figure II.2. Cercle vicieux qui perpétue les dysfonctionnements dans la relation médecin-malade dans la maladie d'Alzheimer pour le diagnostic comme pour la prise en charge.
Pas de confiance du malade ou de Pas de recours au l'aidant dans l'aptitude du médecin à médecin régler les problèmes liés à la maladie
Pas d'intérêt pour le médecin Pas d'action de la part à s'occuper des problèmes des des médecins malades ou des aidants
4. Causes liées au manque de lien et de coordination entre le champ social, le champ judiciaire et le champ sanitaire Cette cause semble surtout notable dans notre pays si on en croit la Facing dementia survey puisqu'elle n'est mentionnée que par les professionnels français [18]. En fait le manque de coordination existe aussi dans d'autres pays comme en Suède [24]. Si ce manque de coordination est surtout un obstacle à la prise en charge des malades, il l'est aussi pour le diagnostic. En effet, les structures sociales comme les centres communaux d'actions sociales (CCAS) ou même les centres locaux d'information et de coordination gérontologique (CLIC), sont souvent alertés par les conséquences de la MA, même précocement, par exemple chez un sujet âgé qui ne paie plus ses factures. Mais ces alertes ne sont le plus souvent pas répercutées au niveau sanitaire par manque de coordination. Le même problème se pose pour les structures judiciaires au niveau des demandes de tutelle ou de curatelle des sujets âgés. Pourtant 43 % des médecins interrogés dans l'étude suédoise reconnaissent l'intérêt de pouvoir travailler avec un coordinateur non médecin spécialement formé à la démence. En France en particulier, les médecins ont une profonde culture du secret médical, et la transmission d'informations notamment au niveau du diagnostic doit obéir à des règles strictes, ce qui limite autant les possibilités de coopération. A l'intérieur même du champ sanitaire, la coordination entre généralistes et spécialistes est parfois imparfaite, notamment en l'absence de réseau. Les conséquences réelles du sous diagnostic des démences sont mal connues et l'intérêt d'un dépistage systématique, y compris en situation de déni, a fait l'objet de très peu de travaux originaux dans la littérature. Des obstacles méthodologiques importants expliquent ce manque : nécessité d'études prospectives chez des sujets âgés et fragiles pour lesquels l'absence d'intervention est éthiquement contestable, nécessité d'un accord de participation en situation fréquente de déni, lourdeurs et coûts des études, etc. Ceci explique que les recommandations nationales pour une détection précoce de la démence et de la maladie d'Alzheimer en France [9], aux Etats-Unis [25] ou au Canada [26] se soient appuyées essentiellement sur un consensus d'opinion d'experts. 1. Conséquences du sous-diagnostic de la maladie d'Alzheimer et des autres démences Si on admet que les traitements médicamenteux et la prise en charge non médicamenteuse des malades, notamment l'information et le soutien à l'aidant, sont efficaces sur l'évolution de la maladie (ce qui sera discuté en détail au chapitre IV du présent rapport), tout retard ou défaut de diagnostic peut être considéré comme une perte de chance pour les malades. Il en est de même en cas de cause de démence potentiellement curable qui resterait méconnue (déficit en vitamine B12, hypothyroïdie, effet secondaire de la prise de médicaments -iatrogénie). De plus l'ignorance du diagnostic expose le malade à des risques liés à ses difficultés dans les activités de la vie quotidiennes (erreurs dans la prise de médicaments, accidents iatrogènes, difficultés dans la conduite automobile, risque d'accidents domestiques par exemple par oublis du gaz, erreurs de gestion financière). Une autre conséquence importante est probablement le recours plus ou moins anarchique et inadapté au système de soins et en particulier à l'hospitalisation d'urgence. Dans une enquête non encore publiée, réalisée au CHU de Lille, 100 patients de plus de 65 ans admis aux urgences ont été ont été examinés consécutivement. 51 % présentaient un « déclin cognitif significatif » compatible avec le diagnostic de démence (alors que la prévalence est de 5 à 8 %). Parmi ces 51 malades, 4 seulement étaient connus comme déments. La détérioration cognitive ignorée pourrait donc chez le sujet âgé contribuer de manière importante au blocage et à la crise des services d'urgence. On peut également penser que ce recours au système de soins génère des coûts importants qui pourraient être en partie évités. Enfin, l'absence de diagnostic et donc de prise en charge, laisse les familles livrées à elles mêmes, dans le doute et la détresse et sans prévention des situations de crises, sans anticipation des problèmes liées à la dépendance. Schulz et al [27] rapportent que le risque de mort chez les sujets aidant un patient dont la maladie est « stressante » est majorée de 63 % par rapport à des sujets non aidant. Or nous avons vu que la maladie d'Alzheimer est certainement une des maladies les plus éprouvantes pour le conjoint ou les enfants en raison de la dégradation intellectuelle lente et progressive d'un être cher, de troubles du comportement particulièrement pénibles et de la dépendance de tous les instants. Et le fardeau ne cesse pas, bien au contraire, avec l'entrée en institution puisqu'il s'y ajoute le sentiment de culpabilité de n'avoir pu préserver la liberté de choix du patient. 2. Un dépistage systématique de la maladie d'Alzheimer au stade précoce est-il justifié ? Habituellement, le dépistage se définit comme l'application systématique d'un test à une population pour détecter précocement une anomalie inapparente [28]. C'est cette définition qui est retenue par la plupart des médecins généralistes notamment dans le cas de cancer, d'anomalie métabolique ou de maladies infectieuses. Dans le cas de la maladie d'Alzheimer, il existe effectivement une phase de la maladie peu apparente cliniquement, caractérisée par des troubles cognitifs légers, le « Mild Cognitive Impairment » (MCI) qui ne fait pas actuellement l'objet d'un consensus sur sa définition, et qui est source de multiples controverses. Cette phase très précoce de la maladie est encore du domaine de la recherche et ne justifie pas actuellement un dépistage. Par contre, nous avons vu qu'au stade précoce de la maladie avérée, alors que le malade a les critères de démence, un cas sur trois seulement était diagnostiqué. Il y a donc un problème de détection de la maladie à ce stade, alors que les signes cliniques sont déjà apparents. Le terme dépistage est probablement mal adapté dans le cas de la maladie d'Alzheimer car il peut être mal compris. Nous parlerons donc de détection précoce (ou de repérage) car seule une attitude active et systématique permet de détecter la maladie. Nous n'avons pas la démonstration directe de l'intérêt de la mise en place d'une détection systématique de la maladie d'Alzheimer dans la population ou en consultation de médecine générale. Aucune étude randomisée comparant l'efficacité et les inconvénients d'une détection active par rapport à une absence de détection n'a été publiée. Un raisonnement indirect peut cependant conduire à des recommandations. Il s'appuie sur les critères d'indication d'un programme de dépistage [28]. La maladie est une maladie fréquente, grave et représente un coût très important pour la société (ces points seront détaillés dans les chapitres suivants du rapport). Ce critère est donc validé. b) Adéquation de la durée de la phase précoce Nous verrons que la maladie d'Alzheimer évolue sur plusieurs années, la phase précoce elle-même, qu'on peut définir empiriquement jusqu'à un MMS de 20, s'étalant sur un à trois ans. Cette durée laisse largement le temps de réaliser une détection. Ce critère est donc validé. c) Performances des tests diagnostiques Nous avons vu qu'il existait des critères cliniques et des tests neuropsychologiques dont les performances en terme de sensibilité, de spécificité et de valeur prédictive sont très satisfaisantes [29]. Cependant en situation de détection précoce et notamment en l'absence de recours aux soins spontané ou d'informant fiable, l'application de ces critères est difficile. Ce critère est validé sous réserve d'un recours spontané au système de soins. d) Efficacité de la prise en charge après la détection précoce Les traitements médicamenteux et non médicamenteux améliorent au moins à court terme le pronostic des malades quand ils sont diagnostiqués. La découverte d'une cause curable de démence est également à mettre au crédit de la détection précoce, même si ces causes sont rares. Enfin, le diagnostic devrait permettre d'éviter les conséquences d'un non diagnostic déjà décrites. Cependant, aucun essai n'a été réalisé en l'absence de recours aux soins. Ce critère est validé sous réserve d'un recours spontané au système de soins. e) Acceptabilité par le système de santé La détection précoce des troubles pouvant se faire par le médecin généraliste, le système de santé a la capacité d'atteindre les sujets ciblés, à condition que la charge de travail accrue soit prise en compte. Cependant, en début des troubles, un bilan neuropsychologique et un avis spécialisé sont souvent indispensables pour établir un diagnostic. Nous verrons au chapitre de l'offre de soins que l'accès au bilan neuropsychologique n'est pas facile, voire possible partout, et que son financement ne fait pas toujours l'objet d'une cotation spécifique pour un remboursement de l'acte. Ce critère est validé sous réserve d'un accès à l'expertise diagnostique. f) Acceptabilité pour la population En cas de déni et de non recours spontané aux soins, les malades peuvent ne pas accepter les procédures de détection. Ils peuvent également refuser le recours au spécialiste en cas de suspicion à confirmer. Nous ne connaissons pas les éventuelles conséquences néfastes d'une détection précoce systématique, cependant, l'expérience d'études de cohortes comme Paquid ou 3C au cours desquelles une recherche systématique des cas est pratiquée, montrent que les effets négatifs sont extrêmement rares, puisque nous n'avons pas noté de réactions catastrophiques après la détection de plus de 500 cas. Le vrai problème est l'annonce et l'accompagnement du diagnostic pour les malades et leurs familles. Ce critère est validé sous réserve d'un accompagnement du malade et de sa famille au moment du diagnostic. En conclusion, en cas de recours spontané au système de soins, c'est-à-dire en pratique en cas de plainte cognitive au médecin ou de tout autre signe d'alerte comme un accident iatrogène ou une hospitalisation, et si l'accès à l'expertise diagnostique et à l'accompagnement des malades et des aidants sont possibles avec mise en place d'un plan de soins et d'aide, les critères d'une détection précoce systématique sont réunis. Par contre en l'absence de recours aux soins ou de possibilité diagnostique, ou d'accompagnement, la détection précoce ne peut pas être recommandée en l'état des connaissances et devrait faire l'objet d'étude d'intervention adéquate. III.- QUELLE EST L'INCIDENCE ET LA PRÉVALENCE DE LA MALADIE D'ALZHEIMER ET DES MALADIES APPARENTÉES EN FRANCE ? Question 1 : « Quelle est l'incidence et la prévalence de la maladie d'Alzheimer et des maladies apparentées en France ? » Après une brève introduction consacrée à la nature et à l'étiologie de la pathologie, faire le point sur la progression de la maladie d'Alzheimer et des maladies apparentées en France, avec une projection sur les vingt prochaines années. Intégrer des développements sur : - la répartition territoriale de la maladie ; - des comparaisons avec des pays européens ; - la durée de la maladie ; - le risque d'entrée en établissement d'hébergement des personnes âgées dépendantes (EHPAD). 1. Estimation de la prévalence La majorité des cas de démences se rencontre après 65 ans, et même après 75 ou 80 ans. Ce sont ces cas, nombreux, qui constituent un réel problème de santé publique, et les données épidémiologiques seront présentées uniquement sur ces tranches d'âges. La maladie existe bien sûr avant 65, et même avant 60 ans. Si individuellement une maladie survenant précocement est tragique, ces démences précoces représentent une faible proportion de cas. Pour ces cas plus jeunes, les problèmes posés sont différents de ceux rencontrés pour les cas plus âgés, et nous ne disposons pas de données épidémiologiques vraiment fiables. Des estimations réalisées par le groupe EURODEM (réunissant les données de plusieurs études de cohortes européennes) en 1991 donnaient une prévalence de démence à 0,5 % chez les femmes et 1,6 % chez les hommes entre 60 et 64 ans, et à 0,1 % chez les femmes et 0,2 % chez les hommes avant 60 ans [30], soit une estimation de 32 000 personnes de moins de 65 ans présentant une démence en 2004 en France. Ces démences précoces arrivent le plus souvent jusqu'au diagnostic même si on peut supposer que le délai de diagnostic est parfois long, en raison notamment de la non reconnaissance du diagnostic du fait de la rareté de survenue à ces âges. Pour ces cas précoces, le problème principal est le manque de structures adaptées pour prendre en charge ces sujets relativement jeunes, les structures d'hébergement pour personnes âgées étant réservées aux 60 ans et plus. En raison du sous diagnostic de la maladie d'Alzheimer et des syndromes apparentés, ainsi que des difficultés pour le diagnostic de ces maladies en population (problèmes abordés à la question précédente), des données fiables concernant son épidémiologie ne peuvent être obtenues qu'à partir d'études longitudinales en population, dans lesquelles un diagnostic actif de démence est réalisé. Devant les écarts entre les différentes estimations concernant la prévalence et l'incidence de cette maladie, un rapport récent de l'OCDE [31] préconisait de se baser sur les estimations fournies par le groupe EURODEM [32]. Cependant, le diagnostic de démence a évolué considérablement depuis quelques années, en partie lié à la commercialisation des premiers inhibiteurs de l'acetylcholinestérase qui a favorisé une prise de conscience vis à vis de cette maladie. Or, les estimations fournies par EURODEM ont été réalisées pour la plupart au début des années 90, à partir de données transversales le plus souvent, et nécessitent à notre avis d'être réactualisées. De plus, une évolution réelle de la prévalence de la démence ne peut être exclue (évolution de l'espérance de vie, meilleure prise en charge ...). Du fait de la durée et du coût pour la mise en place d'études longitudinales en population, peu de publications récentes existent concernant la prévalence de la maladie d'Alzheimer et des syndromes apparentés. Les estimations les plus récentes ont été publiées en 2003 (pour la France) [2], 2004 (pour les Etats-Unis) [33] et 2005 (pour l'Italie) [34] (tableau III.1). Ces estimations montrent une grande disparité, avec des prévalences de maladie beaucoup plus faibles dans EURODEM, et beaucoup plus élevées dans la Cardiovascular Health Study aux Etats-Unis. Devant la disparité de ces chiffres, les raisons citées précédemment pouvant expliquer les faibles prévalences retrouvées dans EURODEM, et la similarité des estimations retrouvées en France et en Italie, il nous a semblé raisonnable de se baser sur les données de PAQUID pour fournir des estimations françaises de prévalence et d'incidence de démence après 75 ans. Les données entre 65 et 74 ans ont été estimées à partir des données italiennes. Tableau III.1. Prévalence de la maladie d'Alzheimer et des syndromes apparentés
D'après Lobo et al., Ramaroson et al., Fitzpatrick et al., et De Ronchi et al. [2, 32-34] Globalement, chez les sujets de 75 ans et plus, la prévalence est estimée à 13,2 % pour les hommes et à 20,5 % pour les femmes dans PAQUID. Dans l'étude italienne, ces chiffres sont respectivement de 11,7 % chez les hommes et 15,4 % chez les femmes ; la prévalence globale estimée chez les 65 ans et plus est bien sûr beaucoup plus faible, 6,1 % chez les hommes et 8,9 % chez les femmes. En rapportant ces chiffres à la population métropolitaine française fournie par l'INSEE pour 2004 [35], on peut estimer le nombre de sujets déments en France métropolitaine à 856 662 chez les personnes de 65 ans et plus (tableau III.2). Ces cas surviennent pour 72 % chez des femmes et pour 73 % chez des personnes de 80 ans et plus. Tableau III.2. Estimation du nombre de personnes
D'après Ramaroson et al. et De Ronchi et al. [2] [34] Nous avons vu que l'estimation du nombre de cas de démence peut varier selon les études. Il est probable que les variations dans les estimations portent surtout sur les cas les plus difficiles à diagnostiquer, notamment ceux qui sont au stade de début de la maladie. Il existe moins d'imprécision sur les cas à un stade plus avancé. Dans PAQUID, le degré de sévérité de la démence a été évalué grâce au MMS. Ce test global d'évaluation des fonctions cognitives est côté de 0 à 30, et les sujets ayant un score inférieur ou égal à 15 sont considérés comme ayant une démence à un stade modérément sévère ou sévère. Chez les 75 ans et plus, 43,4 % des démences sont à un stade au moins modérément sévère. En appliquant cette proportion au nombre de cas estimés de démence, on peut estimer que 332 628 personnes de 75 ans et plus présentaient une démence à un stade modérément sévère ou sévère en France en 2004. La prise en compte de ce stade de sévérité est importante car, si 57 % de l'ensemble des démences présentent une dépendance pour les activités de base de la vie quotidienne (cf. paragraphe Conséquences), cette proportion de dépendants est de 89 % pour les démences à un stade modérément sévère ou sévère. Comme pour les données de prévalence, les estimations d'incidence sont très variables dans les données publiées jusque là (tableau III.3). Devant ces différentes estimations, nous avons réanalysé l'incidence de la démence sur les 13 années de suivi de PAQUID avec des modèles biostatistiques adaptés, permettant de prendre en compte les différent biais rencontrés dans les études de cohorte pour l'estimation de l'incidence. Les résultats sont présentés dans la figure III.1. Figure III.1. Incidence des démences. PAQUID 1988-2001
En appliquant ces données d'incidence à la population française de 2004, le nombre de nouveaux cas annuels de démences peut être estimé à 225 263, alors qu'il était estimé à 186 586 à partir des données initiales de PAQUID (tableau III.4). Tableau III.4. Estimation du nombre de nouveaux cas annuels de démence
Tableau III.3. Incidence de la maladie d'Alzheimer et des syndromes apparentés
D'après Fratiglioni et al., Fitzpatrick et al., Ravaglia et al. et PAQUID (sur 10 années de suivi, données non publiées) [33, 36, 37] 3. Confrontation avec les données nationales Afin de confirmer la réalité de nos estimations, nous les avons confrontées aux données nationales de l'allocation personnalisée d'autonomie (APA). Les données publiées montrent que 837 000 personnes étaient bénéficiaires de l'APA en septembre 2004 [38]. Dans PAQUID, nous avons fait passer la grille AGGIR à toutes les personnes participantes en 1998-99, que ces personnes aient ou non fait par ailleurs une demande d'APA. Au moins en institution, la répartition des groupes iso-ressources (GIR) que nous observons est proche des données publiées par la DRESS au niveau national [39]. D'après les données de PAQUID (cf. paragraphe ci-dessous relatif aux conséquences), 72,3 % des bénéficiaires potentiels de l'APA sont déments et 41,6 % des déments ne sont pas classés en GIR 1 à 4, c'est-à-dire dans les GIR pouvant donner droit à l'attribution de l'APA. En appliquant ces proportions aux 837 000 bénéficiaires de l'APA, le nombre estimé de personnes atteintes de démences en France est de 1 036 217 (relativement proche des 856 662 estimés à partir des données de prévalence). 1. Projections réalisées à partir des données de prévalence Des projections sur le nombre de personnes atteintes de la maladie d'Alzheimer et de syndromes apparentés dans les prochaines années peuvent être réalisées en partant des projections de populations fournies par l'INSEE [35]. Les scénarios démographiques de l'INSEE montrent une augmentation de la population totale de la France pour les prochaines années, mais surtout une augmentation de la proportion des personnes âgées. A titre d'exemple, selon le scénario central de projection de population, la proportion de personnes de 65 ans et plus, qui était de 16,5 % en 2004, passera à 21 % en 2020 et 28 % en 2040 ; pour les 75 ans et plus, les chiffres sont encore plus impressionnants puisque ces proportions devraient passer respectivement de 8,0 % à 9,6 % et 16,1 %. Nous avons choisi de considérer trois scénarios de projections de population : le scénario central, le scénario de fécondité haute et celui de fécondité basse. Dans l'hypothèse d'une prévalence constante de la maladie, le nombre de personnes atteintes en 2020 et 2040 est présenté dans le tableau ci-dessous (tableau III.5). Selon ce scénario, le nombre absolu de démences aura augmenté dans le futur, mais également la répartition de l'âge des malades ; alors que 73 % des déments avaient 80 ans ou plus en 2004, cette proportion augmentera à 79,4 % en 2020 et 83,1 % en 2040. Tableau III.5. Estimation du nombre de personnes atteintes de démence
Estimations réalisées sous l'hypothèse d'une prévalence constante de la démence
Estimations réalisées sous l'hypothèse d'une prévalence constante de la démence Du fait des scénarios choisis (basés sur une variation de la fécondité), le nombre absolu de personnes atteintes n'est pas différent selon le scénario jusqu'en 2040. Le taux pour 1 000 habitants par contre variera. Ce taux, de 14,5 pour 1 000 en 2004 devrait être de 21,3 en 2020 et 36,3 en 2040 selon l'hypothèse de fécondité basse, et de 20,3 en 2020 et 31,9 en 2040 selon l'hypothèse de fécondité haute. Sous l'hypothèse d'une répartition constante de la sévérité des démences, les estimations pour les démences à un stade modérément sévère ou sévère chez les 75 ans et plus seraient de 500 330 cas en 2020 et 877 910 (soit plus que le nombre de démences actuellement) en 2040. Deux choses doivent être abordées à propos des projections pour le futur : Tout d'abord, il n'est pas sûr qu'il soit raisonnable de proposer des estimations jusqu'en 2040. On peut en effet espérer que d'ici 2040, des progrès auront été réalisés et un traitement curatif efficace découvert. Si tel est le cas, ces estimations seront totalement dépassées. Les récents essais concernant le "vaccin", bien qu'interrompus en raison d'effets secondaires importants, ont fait naître des espoirs dans ce sens [40]. D'autre part, les estimations précédentes ont été réalisées dans l'hypothèse d'une prévalence constante de la maladie, alors qu'il est difficile de savoir si, même en dehors de thérapeutiques innovantes, la prévalence sera constante sur les prochaines années. Dans l'étude PAQUID, à âge égal, la prévalence est plus élevée 10 ans après le début de l'étude (1998-99) qu'à la phase d'inclusion de cette étude (1988-89) [41]. Comme cela a été abordé en début de question, et bien qu'il s'agisse d'une évolution au sein de la même étude de recherche, nous ne pouvons pas exclure que cette augmentation de prévalence soit en partie expliquée par une meilleure sensibilisation au diagnostic de démence ; de plus, les estimations de prévalence réalisées en 1998-99, après dix ans de suivi des performances cognitives des personnes, reposent sur un diagnostic probablement plus précis qu'à l'inclusion. Néanmoins, les récentes données d'incidence publiées sur une cohorte italienne présentent des chiffres d'incidence, obtenus entre 1999 et 2004, bien plus élevés que ceux publiés jusqu'à maintenant [37]. Ces chiffres pourraient refléter une augmentation réelle de l'incidence des démences. Plusieurs hypothèses peuvent être formulées concernant l'évolution de l'incidence, et donc de la prévalence des démences : - on peut supposer que, grâce à une évolution du mode de vie (meilleure prise en charge de l'état de santé, meilleur contrôle des facteurs de risque, meilleure hygiène de vie - cf. paragraphe ci-dessous relatif aux pistes de prévention -), l'âge de début de maladie sera plus tardif, et donc la prévalence diminuera. En 1998, Brookmeyer et al avaient réalisé des estimations sur la population américaine, montrant que si on reculait l'âge de début de maladie de 1 an, la prévalence diminuerait de 7,3 % au bout de 10 ans et de 8,9 % au bout de 50 ans [42]. En plus de l'incidence et de l'âge de début de maladie, la durée de la maladie doit également être prise en compte pour prédire prévalence ; si l'on s'occupe mieux des malades, cette durée pourrait augmenter dans les années futures. Néanmoins, la prise en charge doit avoir pour objectif d'augmenter la durée à la phase précoce de la maladie, avant l'apparition des complications. - d'un autre côté, il est possible qu'une meilleure prise en charge des autres pathologies, et notamment des maladies cardio-vasculaires, entraîne au contraire, pour un âge donné, une augmentation de prévalence des démences. Un des facteurs de risque intervenant dans la maladie d'Alzheimer est un allèle (ε4) de l'apolipoprotéine E (protéine codant pour le transport des lipides). Les personnes présentant un ou deux allèles ε4, sont plus à risque de développer la maladie que celles ayant la forme allélique ε2 [43]. Ce gène est également un facteur de risque de maladie cardio-vasculaire [44]. Or, les progrès de la chirurgie cardiaque ces dernières années (pontage, dilatation), permettre de faire vivre des personnes qui, certains facteurs de risque étant communs aux deux maladies, sont probablement plus à risque de développer une démence dans le futur. Le même raisonnement peut être appliqué à d'autres facteurs de risque potentiels, comme les facteurs de risque vasculaire notamment, et pourrait aussi être vrai pour d'autres maladies comme le cancer par exemple. En raison de la difficulté de réaliser des hypothèses réalistes dans le sens d'une augmentation ou au contraire d'une diminution de prévalence, nous proposons de considérer une fourchette de + 10 % et - 10 % de variation de prévalence dans laquelle la prévalence a de grandes chances de se situer dans les années futures (sauf bien sûr si un traitement curatif est découvert). Le tableau suivant indique les bornes inférieures et supérieures du nombre estimé de personnes atteintes de démences, ainsi que les taux par rapport à la population pour 2020 et 2040 (tableau III.6). Tableau III.6. Estimation de bornes inférieures et supérieures
2. Confrontation avec les projections pour l'allocation personnalisée d'autonomie Les projections réalisées pour le nombre de bénéficiaires de l'APA (données fournies par l'INSEE) donnent une estimation du nombre de personnes classées en GIR 1 à 4 égale à 954 000 pour 2020 et 1 231 000 pour 2040. En appliquant le même raisonnement que celui utilisé au paragraphe A.3., sous l'hypothèse que ces proportions seront identiques dans le futur (c'est-à-dire en considérant que 72,3 % des bénéficiaires potentiels de l'APA sont déments et 41,6 % des déments ne sont pas classés en GIR 1 à 4), le nombre estimé de personnes atteintes de démences en France à partir des projections de l'APA serait de 1 181 000 en 2020 et de 1 524 000 en 2040. On constate que ces estimations sont proches de celles réalisées à partir des données de prévalence pour 2020, mais très inférieures pour 2040. Cela montre bien la difficulté de réaliser des projections à si long terme, qui seront peut-être totalement dépassées en 2040. Néanmoins, les données les plus récentes sur l'incidence des démences [37] vont plutôt dans le sens d'une augmentation et les projections à partir de l'APA pourraient être sous-estimées. Nous avons vu qu'il était difficile, long et coûteux d'avoir de bonnes estimations des démences. Ces estimations sont obtenues à partir d'études de recherche "isolées", et non pas réalisées sur l'ensemble du territoire. Il n'est donc pas possible de savoir si la maladie est plus ou moins importante selon les différentes régions de France. On ne peut que faire des hypothèses, en fonction de la prévalence de différents facteurs de risque potentiels de la maladie. Une indication des variations inter-régions pourrait être obtenue grâce à l'attribution de l'APA (cf. paragraphe ci-dessous relatif aux conséquences). Néanmoins, l'APA n'étant pas directement liée à la présence d'une démence, mais dépendant aussi de ses conditions d'attribution, n'est qu'un reflet indirect. Si l'on fait l'hypothèse que, dans toutes les régions françaises, la proportion de déments parmi les bénéficiaires de l'APA est similaire à ce que l'on observe dans PAQUID, alors, on peut estimer une répartition départementale du nombre de personnes de 75 ans et plus atteintes de démence. Ces données sont présentées sur la carte dans l'annexe 5. En l'absence d'éléments concrets, l'hypothèse que la répartition de la maladie ne varie pas sur le territoire peut être faite ; dans ce cas, seule la densité de population et la proportion de personnes âgées rentrent en compte dans le calcul, et les différences observées en nombre de personnes atteintes de maladie d'Alzheimer ou syndromes apparentés représentent les différences de population entre régions. Ces répartitions sont présentées sur les cartes en annexe, pour 2004, 2020 et 2030 en nombre absolu (annexe 6) et en taux de personnes atteintes pour 1000 ha (annexe 7). La majorité des études s'accordent sur le fait que la démence diminue l'espérance de vie des personnes [45-47]. Néanmoins, les données de la littérature concernant la durée de survie des sujets déments sont très variables ; ces données, obtenues souvent à partir d'échantillons très sélectionnés de déments, suivis dans des centres spécialisés, sont fréquemment surestimées, mettant en évidence des durées de survie pouvant aller de cinq jusqu'à dix ans. Pour évaluer correctement la durée de survie, il est nécessaire de se baser sur des études en populations. Dans la Canadian study of aging, la médiane de survie a été estimée à 3,3 ans (2,7 - 4,0) [45-47]. Cette durée de vie des personnes démentes varie bien sûr en fonction de l'âge de la démence. Cette durée de vie en fonction de l'âge a été estimée à partir des 13 années de suivi de PAQUID et comparée aux données publiées par Larson et al. aux Etats-Unis [48] (tableau III.7). Les résultats sont très proches, avec des espérances de vie supérieures chez les femmes, et nettement plus faibles comparées à celles de la population française. Tableau III.7. Espérance de vie selon l'âge
D'après Larson et al. et PAQUID (données non publiées) [48] Néanmoins, du fait de l'évolution du diagnostic et de la considération apportée à cette maladie, il n'est pas possible aujourd'hui de préciser de façon fiable si la survie des personnes démentes a réellement augmenté ou pas dans les dernières années. Nous venons de voir qu'une des conséquences majeures de la démence était la réduction de la durée de vie. Au préalable, la démence entraîne également des conséquences en terme de dépendance et d'entrée en institution, d'autant plus fréquentes que la maladie est à un stade avancé. La définition du syndrome démentiel inclut un retentissement significatif sur les activités sociales et professionnelles du malade. Au début, ce retentissement est léger et peut être évalué sur les activités instrumentales de la vie courante [49]. De fait, la dépendance fait partie intégrante de la définition des démences. Il existe cependant différents degrés de sévérité de dépendance. De plus, contrairement à de nombreuses maladies (par exemple les cancers) où une période de dépendance le plus souvent courte est fréquente, dans les démences au contraire la dépendance est présente pendant une grande partie de la maladie. Dans l'étude PAQUID, nous avons évalué la dépendance pour les activités de base de la vie quotidienne (toilette, habillage, locomotion, alimentation, aller au WC) parmi les personnes de 75 ans et plus. La réalisation de ces activités est indispensable à la vie de tous les jours, et la dépendance pour une seule d'entre elles nécessite l'intervention d'une aide extérieure. Parmi les déments, 57 % avaient une dépendance pour au moins une de ces activités et 14 % avaient une dépendance lourde (dépendance pour 3 sur 4 des activités toilette, habillage, locomotion, alimentation). Sur l'ensemble de l'échantillon de PAQUID, près de 14 % des personnes de 75 ans et plus présentaient une dépendance pour au moins une activité. La part de la démence dans cette dépendance était très importante puisque les ¾ des personnes dépendantes étaient démentes. Pour l'indicateur de dépendance lourde, sur 2,8 % des personnes présentant une dépendance à ce stade, 88 % étaient des personnes démentes. Dans le PHRC REAL.fr, incluant des sujets présentant une maladie d'Alzheimer venant consulter dans un centre hospitalier (sujets le plus souvent à un stade de début de maladie lors de l'inclusion), la définition utilisée pour la dépendance variait un peu de celle de PAQUID et la proportion globale de dépendance chez les sujets Alzheimer était de 11 % de sujets nécessitant une aide totale pour au moins un des items et de 39 % de sujets nécessitant une aide partielle. Cette dépendance variait bien sûr selon le stade de sévérité de la maladie (évalué ici sur le MMS), passant pour la dépendance totale de 5 % pour le stade léger (MMS>20), à 14 % pour le stade modéré (MMS entre 16 et 20), et à 25 % pour le stade modérément sévère (MMS entre 10 et 15). Ces chiffres étaient respectivement de 26 %, 46 %, et 65 % pour la dépendance partielle. 2. Attribution de l'allocation personnalisée d'autonomie (APA) Du fait de sa part importante dans la survenue de dépendance chez les personnes âgées, on peut s'attendre à ce que la démence ait également une part importante dans l'attribution de l'APA. Dans PAQUID, environ 14 % des personnes de 75 ans et plus étaient classées dans les GIR 1 à 4. La part de la démence était très importante puisque 72,3 % des personnes classées en GIR 1 à 4 présentaient une démence (cette proportion de déments étant même de 100 % dans le GIR 1). La démence constitue la principale cause de l'entrée en institution des personnes âgées [50, 51]. Dans une étude suédoise (Kungsholmen project), la définition utilisée pour les institutions étant un peu plus large que la définition française, 46 % des personnes atteintes de maladie d'Alzheimer vivaient en institution [50]. Dans l'étude PAQUID, près de 40 % des déments vivent en institution, cette proportion de déments en institution étant d'autant plus élevée que la démence est à un stade sévère (tableau III.8) [2]. Tableau III.8. Distribution du lieu de vie selon la sévérité de la démence.
* RPA : Résidence pour Personnes Agées ; FL : Foyer- Logement Le poids de la démence dans les institutions est très important. Déjà en 1994, en Suède, 73 % des résidents d'institution présentaient une démence [50]. Ce résultat est similaire à celui observé dans PAQUID, avec 72 % des résidents d'institution qui présentent une démence en 1998-99, ces déments étant en général à un stade plus avancé que ceux à domicile. Les entretiens réalisés auprès de différentes personnes (notamment directeurs de maison de retraite ou médecin coordonnateur) montrent qu'aujourd'hui, ce chiffre est probablement encore plus élevé avec 80 à 90 % des résidents d'institution atteints de démence. L'incidence de l'entrée en institution a été ré-analysée à partir des données de PAQUID. Les courbes suivantes présentent le taux d'entrée en institution, pour les personnes démentes et non démentes, par sexe (figure III.2). Figure III.2. Taux d'entrée en institution, pour les personnes démentes et non démentes, selon le sexe. PAQUID 1988-2001
Il faut cependant être conscient que les taux d'institutionnalisation des sujets déments dépendent bien évidemment de l'offre en terme de places en institution disponibles et non pas uniquement du besoin réel d'institutionnalisation. Le moment d'entrée en institution dépend beaucoup de la résistance de l'aidant [52, 53] ; cette entrée pourrait donc être retardée par l'information et l'aide à apporter aux familles. Dans un essai randomisé d'intervention aux Etats-Unis, Mittelman et al avaient montré que le risque d'entrée en institution de patients Alzheimer était significativement plus faible quand l'aidant recevait des séances de soutiens socio-psychologiques [54]. Mais l'entrée en association dépend également du stade de sévérité de la maladie et de son évolution. Dans l'étude REAL.fr, les sujets déclinant rapidement en six mois (perte d'au moins six points à l'ADAS-cog) étaient plus à risque d'entrer en institution dans les deux années suivantes, alors qu'aucune différence n'était notée pour une variation plus faible de ce score. De nombreux facteurs de risque ont été incriminés dans la survenue de la maladie d'Alzheimer. Parmi les principaux, l'âge, l'allèle ε4 de l'apolipoprotéine E et le sexe ne sont bien évidemment pas accessibles à la prévention. D'autres facteurs potentiels ont également été évoqués et des pistes de prévention, passant par le contrôle de ces facteurs de risque peuvent être envisagées. Il ne s'agit que de pistes, qui, actuellement, ne sont pas confirmées. Néanmoins, pour la plupart d'entre elles, les recommandations qui peuvent être faites devraient aussi entraîner un bénéfice pour d'autres pathologies, et participer à une meilleure qualité de vie des personnes âgées. 1. Les facteurs de risques vasculaires Plusieurs facteurs de risque vasculaire, notamment à l'âge moyen de la vie, pourraient être des facteurs de risque de démence et notamment de maladie d'Alzheimer : hypertension artérielle [55-57], diabète [58-60], hypercholestérolémie [57], tabagisme [61-63], alcoolisme chronique [61], surpoids [64], accidents vasculaires cérébraux (AVC) [65-71], fibrillation auriculaire [72], athérosclérose [73], hyperhomocystéinémie [74, 75]. Des études d'observation ont montré que les patients hypertendus traités semblaient avoir moins de risque de démence que les hypertendus non traités [56, 76-79], de même que les patients hypercholestérolémiques traités semblaient avoir moins de risque de démence que les hypercholestérolémiques non traités [80-82]. Cependant actuellement, seul le traitement de l'hypertension a confirmé une efficacité sur la prévention de la démence dans des études prospectives randomisées (Etudes SYST-EUR [83, 84] et PROGRESS [85]). Outre ces facteurs de risque environnementaux, le facteur de prédisposition génétique le plus important dans la maladie d'Alzheimer est la présence d'un allèle e4 sur le gène de l'apolipoprotéine E, qui est aussi un facteur de risque vasculaire. Par ailleurs, non seulement les AVC sont un facteur de risque de démence, mais la démence est un facteur de risque d'AVC [86-88]. L'incidence des AVC et celle de la démence sont liées chez les personnes de plus de 85 ans [89]. Une démence préexistante à un AVC (présente chez environ 15 % des patients de plus de 40 ans hospitalisés pour un AVC [90-93]) est associée à un risque de confusion mentale [94], de symptômes dépressifs [95], d'épilepsie tardive (au-delà de 3 mois) [96], de moins bon pronostic fonctionnel [97], de récidive [98], et de mortalité à 3 ans (indépendamment du risque de récidive) [99]. Or la démence (qui est le plus souvent de nature dégénérative de type maladie d'Alzheimer) [100, 101] n'est pas diagnostiquée dans la plupart des cas au moment de l'AVC, et la prévention des complications secondaires n'est pas mise en place. On ne connaît pas l'influence de la démence sur la tolérance des traitements de la phase aigue de l'AVC (thrombolyse, antiplaquettaires), pas plus que de la prévention secondaire (antiplaquettaires, chirurgie carotidienne). Certaines indications tendent à montrer que le contrôle des facteurs de risque vasculaires aurait un effet bénéfique sur la cognition (comme la fibrillation auriculaire [102] ou l'hypercholestérolémie [103]). A lésions « Alzheimer » (plaques amyloïdes, dégénérescences neurofibrillaires) équivalentes dans le cerveau, la démence est plus sévère, ou s'exprime plus vite, chez les patients ayant également des lésions lacunaires (de nature vasculaire) dans le cerveau, même s'ils n'ont jamais présenté d'AVC [104, 105]. Chez les sujets âgés, les lésions Alzheimer sont rarement isolées, les lésions vasculaires étant associées de façon significative chez au moins un 1/3 des patients [106-108]. Chez les patients atteints de maladie d'Alzheimer avérée, la présence de petites lésions vasculaires ne semble pas influencer le déclin cognitif [109-111], mais est associée à des troubles moteurs (de type parkinsonien) et de la marche [112, 113], des symptômes psychologiques et comportementaux (dont des symptômes dépressifs) [114], et une dysautonomie cardiovasculaire (hypotension orthostatique, hypersensibilité vagale) [115]. Les facteurs favorisant le maintien d'activités cognitives stimulantes sont probablement une autre voie d'action préventive possible. Il a en effet été trouvé que les personnes ayant un haut niveau d'éducation et celles pratiquant certaines activités de loisirs développeraient la maladie plus tardivement [116, 117]. La promotion d'une vie active et de la pratique d'activités après la retraite pourrait aider à lutter contre l'apparition d'une démence. De même, l'environnement social des personnes âgées semble très important et les personnes célibataires ou ayant un faible entourage social semblent plus à risque de développer une démence [36, 118]. Là encore, il semble nécessaire de favoriser les contacts sociaux chez les personnes âgées. La dépression pourrait aussi être un facteur favorisant la survenue d'une démence [119] et une prise en charge adaptée de la dépression, souvent négligée chez les personnes âgées, pourrait être bénéfique. L'alimentation pourrait aussi jouer un rôle. Une consommation modérée de vin, une consommation régulière de poisson, ainsi qu'une consommation suffisante de fruits et légumes, pourraient être associées à un risque moindre de développer la maladie [120-122]. Plusieurs mécanismes sous-jacents, passant par des effets anti-oxydants, vasculaires, ou anti-inflammatoires peuvent expliquer ces résultats. Les bénéfices observés ne sont peut-être pas uniquement dus à ce que nous mangeons mais également à tout ce qui accompagne les repas, allant du choix des aliments, à l'environnement dans lequel nous mangeons, en passant par la convivialité des repas. Néanmoins, les recommandations faites dans le cadre du programme national nutrition santé (PNNS) semblent adaptées également pour la prévention du risque de démence [123]. Enfin, trois études récentes ont mis en évidence que la pratique de la marche ou du sport pourrait aussi être associée à un risque moindre de développer une démence [124-126]. L'activité physique pourrait en effet jouer un rôle par différents mécanismes. Quel que soit le mécanisme impliqué (que l'activité physique agisse directement ou en favorisant les contacts sociaux entre les personnes), de tels résultats devraient inciter à conseiller aux personnes âgées la pratique d'une ou plusieurs activités physiques adaptées à leur âge. 3. Essais thérapeutiques de prévention En plus de ces pistes de prévention visant à mieux prendre en charge des facteurs de risque ou à inciter à la pratique d'activités préventives, un effet préventif de certains traitements a été évoqué. Pour l'instant, aucun essai thérapeutique n'a pu confirmer l'efficacité réelle d'un traitement préventif (hormis le traitement de l'hypertension artérielle), mais toutes les conditions n'étaient pas réunies pour apporter une réponse définitive. - Hypolipémiants. In vitro, le cholestérol favorise la formation de peptide bêta-amyloïde [127, 128] et accélère le développement de la pathologie amyloïde chez l'animal transgénique [129, 130]. Une étude autopsique a aussi montré un lien entre cholestérol, dépôts amyloïde et dégénérescence neurofibrillaire [131]. De plus l'hypercholestérolémie est associée à une augmentation de l'activation de la microglie et une infiltration leucocytaire telle qu'on en trouve dans les plaques amyloïdes. Cette activation microgliale contribuerait à la neurodégénérescence via la production de cytokines et de radicaux libres [132]. Les statines réduisent le niveau intracellulaire de cholestérol et ont un effet inhibiteur sur la production de bêta-amyloïde dans les cultures cellulaires [133, 134]. Les statines ont également des effets pleiotropes qui pourraient ralentir la progression de la maladie [135]. Des études observationnelles ont montré un effet bénéfique sur le déclin cognitif [80-82]. Deux essais thérapeutiques n'ont pas pu confirmer l'efficacité des statines pour la prévention des démences [136, 137] ; ces essais n'ont pas mis en évidence d'effet statistiquement significatif sur la cognition, l'un avec la pravastatine [136], et l'autre avec la simvastatine, mais analysée comme critère secondaire [137]. - Oestrogènes. Les données épidémiologiques montrent que les femmes ont un risque plus élevé de maladie d'Alzheimer que les hommes après 80 ou 85 ans. La diminution des oestrogènes endogènes post-ménopausique pourrait être liée à ce risque. Les oestrogènes exerceraient des effets neuroprotecteurs sur le cerveau âgé, dont l'inhibition de la formation de peptides bêta-amyloïde [138], la stimulation de l'activité cholinergique, et la diminution des lésions cellulaires liées au stress oxydatif [139]. Plusieurs études ont cherché si le traitement hormonal substitutif (THS) était lié à un risque moindre de maladie d'Alzheimer chez les femmes âgées. Les résultats sont mitigés. Une méta-analyse incluant dix études observationnelles dont huit études cas-témoins et deux études prospectives a montré que le risque de maladie d'Alzheimer chez les femmes ménopausées ayant été traitées par oestrogènes était réduit de 29 % par rapport aux femmes qui n'avaient jamais reçu d'oestrogènes [140]. Cependant, dans ces études observationnelles, les femmes sous THS pourraient avoir un niveau d'éducation, un statut économique et un accès aux soins médicaux meilleurs que les autres. L'étude prospective CACHE study montre que le THS est surtout utile au moment de la ménopause, au moment où la déplétion en œstrogène pourrait avoir les conséquences les plus importantes sur les neurones [141]. Deux autres études vont dans le même sens d'un rôle neuroprotecteur d'autant plus efficace que le traitement est appliqué longtemps avant l'apparition des signes cliniques de maladie d'Alzheimer [142, 143]. Les oestrogènes ne se montrent d'ailleurs pas efficaces lorsque la maladie est installée [144-146]. L'étude négative de la Women's health initiative memory study (WHIMS) [147, 148], réalisée avec des oestrogènes équins, non utilisés en France, n'est pas concluante dans la mesure où les femmes ont été traitées à l'âge de 65 ans et plus, alors que c'est au moment de la ménopause (chute brutale en œstrogène), que le traitement serait le plus pertinent [149]. Cette étude ne doit pas mettre un frein à l'exploration de cette voie thérapeutique [150]. Il est aussi possible que le polymorphisme génétique rende les effets des oestrogènes différents selon les femmes [151]. Il a par exemple été montré que les traitements par oestrogènes avaient un effet sur la cognition des femmes différent selon qu'elles soient porteuses ou non d'un allèle e4 de l'APOE [152, 153]. La génétique, outre un intérêt de recherche fondamentale, aurait donc un intérêt clinique non seulement diagnostique, mais aussi potentiellement pour déterminer les traitements ou les associations de traitements de prévention les plus favorables, à l'échelon individuel ou d'une population. A juste titre, un rapport d'orientation sur ce sujet réalisé par l'ANAES ne recommande pas la prise d'un traitement hormonal substitutif pour la prévention des démences à l'heure actuelle. - Anti-inflammatoires non stéroïdiens (AINS). Les essais par AINS reposant sur l'observation que les sujets ayant reçu des anti-inflammatoires au long cours ont moins de risque de démence que les sujets n'en ayant pas reçu, n'ont pas confirmé l'efficacité des AINS et un essai sur le sujet ("Alzheimer's disease anti-inflammatory prevention trial" ou étude ADAPT) a été interrompu en raison d'une augmentation des effets secondaires cardio-vasculaires dans le groupe traité. Un certain nombre de sujets consultent pour une plainte cognitive, le plus souvent un trouble de mémoire, quasi isolé, objectivée par les tests cognitifs mais sans retentissement sur la vie quotidienne. Chez ces personnes, le risque d'évoluer vers un syndrome démentiel (trouble de mémoire associé à au moins un autre trouble cognitif, retentissant dans la vie quotidienne et entraînant une baisse d'autonomie) est d'environ 12 à 15 % par an (contre 1 à 2 % chez les sujets témoins). A cinq ans, ces personnes sont plus souvent entrées en institution, et la mortalité est plus importante [154]. En six ans, 80 % de ces sujets deviennent déments. Il n'est cependant pas certain que tous les patients ayant un trouble coginitif léger - Mild Cognitive Impairment (MCI) - évoluent vers une démence. Ainsi, actuellement, le symptôme prédictif le plus sensible de démence et notamment de maladie d'Alzheimer est le déclin cognitif. Un déclin cognitif peut être détecté plus de dix ans avant que le diagnostic de démence ne puisse être posé selon les études épidémiologiques (étude de population de Fragmingham). Les facteurs de risque établis d'évolution vers la démence sont l'âge et les performances neuropsychologiques (plus elles sont faibles, plus le risque d'évoluer vers la démence est grand). On connaît en revanche mal les facteurs de rapidité d'évolution de la démence. Les facteurs de risque vasculaires sont aussi liés au troubles cognitifs non démentiels [155]. Traitements visant à différer l'évolution des MCI vers la démence : Les premiers essais d'inhibiteurs de l'acétylcholinestérase (IAChE), traitements symptomatiques cholinergiques indiqués dans la maladie d'Alzheimer au stade léger à modéré, ne sont pas très concluants. Au mieux, ils diffèrent de quelques mois l'entrée dans la démence [156, 157], mais ne diminuent pas le nombre de patients évoluant vers la démence en fin d'étude. Ces résultats ne sont pas totalement inattendus, compte tenu de l'hétérogénéité des patients des études et du mode d'action de ces molécules. Un essai récemment publié n'a pas non plus mis en évidence d'efficacité de la prise de vitamine E (vitamine anti-oxydante) sur l'évolution vers une démence dans une population de sujets ayant un MCI [157]. Enfin, d'autres essais, dont les résultats apporteront peut-être de nouveaux éléments dans la prévention des démences, sont actuellement en cours dans différents pays : - l'essai PreADVISE (The prevention of Alzheimer disease with vitamin E and selenium) testant l'efficacité de la vitamine E et du selenium, - deux essais testant l'efficacité des acides gras omega 3, - deux essais testant l'efficacité d'un extrait de Ginkgo Biloba aux Etats-Unis et en Europe (études GuidAge et GEM, Ginkgo evaluation of memory). 5. Synthèse concernant la prévention Il est donc clair que le contrôle des facteurs de risque vasculaires est un enjeu majeur de prévention de la démence et notamment de la maladie d'Alzheimer. De plus, à un stade plus tardif, l'influence du contrôle de ces facteurs chez les patients déjà déments n'est pas étudiée, que ce soit sur la progression de la démence, la qualité de vie, la survie, ou même la tolérance des traitements et donc le rapport bénéfice-risque. Le stade pré-démentiel (ou MCI) est une étape importante, car c'est à ce stade qu'un traitement prévenant le déclin serait le plus utile, au mieux un traitement étiologique (à condition d'être suffisamment fiable dans le diagnostic précoce du type étiologique de démence). La maladie d'Alzheimer et les syndromes apparentés concernent donc aujourd'hui 855 000 personnes, avec chaque année plus de 225 000 nouveaux cas. Si les choses n'évoluent pas, 1 300 000 personnes seront atteintes en 2020. Les études de cohorte sont indispensables pour suivre l'évolution de cette maladie. Les personnes participant à la cohorte PAQUID ont maintenant vieillies (elles ont aujourd'hui 82 ans et plus), ce qui rendra impossible le suivi de cette maladie chez les plus jeunes dans les années à venir. Dans un futur proche, la cohorte des 3 Cités, même si elle n'est pas représentative de la population des personnes âgées, pourra fournir des indications, notamment sur l'adéquation entre APA et démence. Néanmoins par la suite, il semble nécessaire de se donner les moyens de surveiller cette maladie à plus long terme, en mettant en place et en suivant des cohortes de grande envergure, représentatives de la population des personnes âgées. Idéalement, afin d'assurer une meilleure représentativité et un meilleur suivi, ces cohortes pourraient être développées à partir de l'assurance maladie. Enfin, afin de tester l'efficacité de stratégies préventives, la mise en place d'essais d'intervention de grande taille, associant des actions sur plusieurs facteurs de risque serait nécessaire. Question 3 : « Quelles sont les modalités de traitement ? » Exposer les stratégies pharmacologiques et non pharmacologiques, en indiquant le nombre de patients traités, leur mode de traitement et la répartition entre la prise en charge en établissement ou à domicile. Prendre en compte les difficultés de nature éthique liées au traitement de la maladie. Intégrer l'évaluation du dispositif et des propositions d'amélioration. Nous réaliserons dans ce chapitre une description des traitements médicamenteux et non médicamenteux pour chaque type de démence du sujet âgé et une revue de la littérature sur l'efficacité de ces thérapeutiques. Nous avons privilégié, quand elles étaient disponibles, l'étude des méta-analyses pour cette revue. Les méta-analyses présentaient l'avantage d'utiliser souvent des méthodes identiques pour étudier l'efficacité des thérapeutiques d'une même classe, ce qui permettait d'apporter une plus grande cohérence dans la présentation des résultats. La répartition entre prise en charge en établissement et à domicile a été traitée au chapitre épidémiologique. Il a été observé rapidement que la maladie d'Alzheimer s'accompagnait d'une baisse d'activité cholinergique cérébrale, l'acétylcholine étant un des neurotransmetteurs le plus rapidement et massivement touché au cours de la maladie. Plusieurs approches cholinergiques ont été tentées, mais la plus efficace et la mieux tolérée est le maintien de l'activité cholinergique par diminution de la dégradation de l'acétylcholine. La mise sur le marché de la tacrine en 1994 (prix fixé en 1995), premier inhibiteur d'acétylcholinestérase (IAChE) - enzyme dégradant l'acétylcholine - a été une vraie révolution : il était montré pour la première fois un effet symptomatique, une amélioration des fonctions cognitives dans la maladie d'Alzheimer, plus ou moins notable selon les patients (que l'on dit « répondeurs » ou « non répondeurs » selon le seuil d'amélioration fixé). Ce médicament avait l'inconvénient d'être toxique pour le foie nécessitant des prélèvements sanguins réguliers, et d'entraîner souvent des troubles digestifs obligeant un bon nombre de patients à interrompre le traitement. La prescription de ce médicament en France était purement hospitalière, ce qui n'a pas favorisé l'implication des médecins généralistes et spécialistes libéraux dans la prise en charge de la maladie. Cependant, le traitement a contribué à changer l'image de la maladie d'Alzheimer, trop souvent associée au vieillissement (elle a longtemps été désignée comme la « démence sénile » voire la « sénilité ») et donc au fatalisme. Elle prenait un statut de « maladie », traitable sinon curable. Les IAChE de 2e génération (donépézil et rivastigmine AMM 1997, prix fixés en 1998, puis galantamine AMM 2001) bien mieux tolérés et non toxiques, donc ne nécessitant pas de contrôle biologique, ont conduit au retrait de la tacrine. Les trois IAChE disponibles ont des propriétés pharmacologiques un peu différentes et surtout n'ont pas d'intolérance croisée : si un patient a des effets indésirables avec un produit (principalement troubles digestifs généralement transitoires - nausées, diarrhée... -, parfois bradycardie, crampes ou rhinorrhée...), il est possible de lui en proposer un autre, qui pourra être mieux toléré. L'efficacité de ces trois produits n'a pas été comparée formellement, mais semble être globalement similaire. Il a été convenu que pour montrer l'efficacité d'un traitement symptomatique, il fallait comparer en double-aveugle le produit à un placebo pendant six mois. Pour être enregistrée, une molécule doit montrer un effet favorable sur la cognition, le comportement, l'autonomie dans les activités quotidiennes et l'impression globale de changement évaluée par un observateur extérieur. Initialement, des essais ont comparé le donépézil au placebo pendant un an [158], et ont démontré la persistance de l'efficacité pendant cette période. Les essais contre placebo d'une telle durée ne sont plus considérés comme éthique actuellement, puisque l'efficacité des produits est démontrée. On compare donc, au-delà de ce terme, la courbe d'évolution naturelle des patients sans traitement à celle des patients traités, et l'on a montré la persistance de l'efficacité de ces traitements au-delà de cinq ans [159-161]. Certes, les patients continuent à se dégrader, mais moins vite que les patients non traités. Les études montrent un maintien des fonctions cognitives et de l'autonomie [162-165], un allongement du délai d'apparition des troubles du comportement, une diminution de leur fréquence et de leur intensité [166, 167] et une entrée en institution plus tardive [168]. Il y a une hétérogénéité de progression de la maladie selon les patients et une variabilité des réponses au traitement. Certains patients peuvent ne pas voire d'amélioration spectaculaire au moment de l'initiation du traitement (« non répondeurs ») qui peut pourtant ralentir le déclin et prévenir l'apparition de troubles du comportement. Il a également été montré que l'interruption au-delà de trois semaines [169], ou six semaines [170] d'un traitement par donépézil s'accompagne d'un déclin cognitif tel que le patient retrouve l'état cognitif qu'il aurait eu sans avoir jamais été traité (confirmant l'action essentiellement symptomatique du produit), et qu'il ne retrouvait pas, après reprise du traitement, l'état cognitif antérieur à l'interruption de six semaines [170]. Ces produits sont indiqués dans les formes légères à modérées de la maladie d'Alzheimer (MMS compris entre 10 et 26). Le bénéfice n'a pas été démontré dans les formes plus légères (voir MCI) mais le bénéfice se maintient même à des stades plus sévères [171, 172]. La prescription doit être faite par un spécialiste (neurologue, gériatre ou psychiatre). Le renouvellement peut-être fait par un médecin généraliste dans l'année qui suit la prescription. D'autres molécules IAChE sont en cours d'évaluation, visant une meilleure tolérance, une efficacité supérieure et plus prolongée. Les IAChE ont montré leur efficacité dans d'autres démences qui s'accompagnent d'un déficit cholinergique : les démences à corps de Lewy et les démences parkinsoniennes [173-176], les démences vasculaires ou mixtes [177]. Une étude commanditée par les financeurs du système de santé britannique, publiée dans le Lancet en juin 2004 a remis en cause l'intérêt médico-économique des IAChE que plusieurs études concordantes tendaient à montrer [178]. Cette étude, si elle avait comme louable objectif d'être indépendante de l'industrie pharmaceutique, souffrait de nombreux biais. Les patients étaient hétérogènes, ne répondaient pas aux critères de maladie d'Alzheimer tels que recommandés par l'ANAES notamment (pas d'imagerie cérébrale). Les prescripteurs devaient douter fortement que le traitement par IAChE puisse apporter un quelconque bénéfice au patient (s'ils pensaient que les patients pouvaient en tirer profit, ils n'entraient pas dans l'étude) - c'est ainsi qu'aucun centre spécialisé dans la démence n'a pu accepter de participer à l'étude -. Le calcul d'effectif recommandait d'inclure 3 000 patients, il n'a été possible d'inclure que 566 patients dont seulement 482 ont reçu plus de 13 semaines de traitements. Une autre étude était conduite simultanément sur les mêmes patients avec de l'aspirine, dont il n'a pas été tenu compte dans les résultats alors que ce traitement peut contribuer aux effets indésirables, voire aux sorties d'études. Une première randomisation était faite après une période de traitement par donépézil de 12 semaines, une deuxième après une période sans traitement de 6 semaines, et, après 126 semaines d'étude, une troisième interruption de traitement de 4 semaines était prévue avant la reprise du protocole (or les effets délétères d'une interruption de traitement prolongée sont démontrés). Les sorties d'étude ont été extrêmement nombreuses car les patients voulaient recevoir le produit actif. Malgré toutes ces conditions défavorables, si la moindre fréquence d'entrée en institution (observée dans les études antérieures) n'a pas pu être confirmée, le déclin cognitif restait significativement moindre dans le groupe traité, et les indicateurs d'autonomie étaient en faveur du traitement, bien que n'atteignant pas le seuil de significativité. Des études observationnelles reprenant l'histoire naturelle des patients avant les traitements et depuis les IAChE de deuxième génération sont en cours. Une autre classe thérapeutique agissant sur un autre neurotransmetteur ayant un effet neurotoxique, le glutamate, a montré une efficacité dans les formes modérées à sévères de la maladie d'Alzheimer (MMS entre 14 et 2) [179, 180]. La mémantine, modulateur des récepteurs NMDA, a reçu l'AMM en 2002 (prix fixé en 2003). Les critères de jugement d'efficacité de ce produit sont les mêmes que ceux des IAChE, mais les échelles utilisées sont différentes, compte tenu de la plus grande sévérité de la démence. Ces critères ont été choisis en accord avec les agences du médicament (FDA aux Etats-Unis et EMEA européenne). Il a été montré une moindre fréquence d'entrée en institution chez les patients traités par rapports aux patients sous placebo. L'effet se maintient pendant au moins douze mois. Une étude a montré, pour les formes modérées, une potentialisation des effets de la mémantine et du donépézil [181]. 1. Les inhibiteurs de la cholinestérase Les IAChE ont obtenu l'AMM dans la MA légère à modérée. La définition de la démence légère à modérée retenue lors de la mise sur le marché des IAChE concerne les sujets déments pour lesquels le score au MMS est compris entre 10 et 26. C'est l'IAChE le plus vendu en France (55 % de parts de marché). Il est conditionné en comprimés de 5 mg et 10 mg. La posologie recommandée est de 5 à 10 mg en une prise quotidienne. Efficacité du donepezil sur la cognition dans la MA légère à modérée Le donepezil est l'IAChE le plus évalué dans le traitement de la MA légère à modérée. Son efficacité sur la cognition, comme pour les autres IAChE, a été évaluée sur l'échelle ADAS-cog. Cette échelle d'exploration globale de la cognition permet d'obtenir un score d'évaluation pour le sujet de 0 à 60 points. Trois méta-analyses [163, 182, 183] mesurent l'effet spécifique du donepezil vs. placebo, à 12 et 24 semaines. Pour une posologie de 5 mg/jour, la taille d'effet à 12 semaines varie de -2,1 à -2,5 points et celle à 24 semaines de -2,0 à -2,5 points en faveur du donepezil. Cet effet est majoré, mais non significativement, pour une posologie de 10 mg/jour. Lanctôt et al. ont évalué, pour les IAChE vs. placebo, la proportion de sujets considérés répondeurs selon la définition de la FDA (sujets améliorés de 4 points ou plus sur l'échelle ADAS-cog) [184]. La différence de proportion de répondeurs est estimée à 10 % en faveur des IAChE. L'analyse regroupe des études sur des médicaments, des posologies et des temps de recul différents. Une étude a estimé le nombre de sujet à traiter par IAChE (Number needed to treat, NNT), pour observer au moins un sujet amélioré sur la cognition [182]. Les estimations ont été réalisées à partir des données individuelles issues des essais thérapeutiques. Pour observer au moins un répondeur sur l'échelle ADAS-cog après 24 semaines de traitement par donepezil, le NNT varie de 10 sujets pour une posologie de 5 mg/jour, à 4 sujets une posologie de 10mg/jour. Les essais retenus dans ces méta-analyses évaluaient l'efficacité du donepezil à 6 mois au maximum. D'autres essais ont pu mettre en évidence une efficacité du donepezil sur la cognition à un an, mais leurs méthodes sont parfois moins robustes [158, 159, 185, 186]. Efficacité du donepezil sur l'état global dans la MA légère à modérée L'effet du donepezil sur l'état global des patients a été évalué le plus souvent sur l'échelle CIBIC-plus (interrogatoire d'évaluation de l'état global du sujet par le médecin). Trois méta-analyses mesurent sur l'échelle CIBIC-plus l'effet du donepezil vs. placebo [163, 183, 187], exprimé sous forme d'un rapport de cotes (RC) pour un meilleur score sur la CIBIC-plus. Ce RC est en faveur du donepezil et varie de 1,8 à 2,1 à 12 semaines et de 2,0 à 3,3 à 24 semaines pour une posologie de 5mg/jour. Cet effet n'était pas différent pour une posologie de 10 mg/jour. Lanctôt et al. [184], dans l'étude présentée précédemment, évaluait les IAChE vs. placebo sur la proportion de sujets répondeurs au traitement sur la CIBIC-plus ou la CGIC (autre échelle du même type), c'est-à-dire la proportion de sujets améliorés sur l'une de ces échelles. La différence de proportion de répondeurs était estimée à 9 % en faveur des IAChE. Le nombre de sujets à traiter pendant 24 semaines par donepezil pour observer au moins un sujet amélioré sur la CIBIC-plus était estimé entre 7 et 8 en fonction de la posologie [182]. Enfin, un essai non pris en compte dans ces méta-analyses retrouvait une efficacité significative du donepezil sur l'état global à 1 an [186]. Tolérance du donepezil La fréquence des effets indésirables sous donepezil apparaît légèrement supérieure à celle rencontrée sous placebo dans les essais thérapeutiques (fréquence accrue de 2 à 9 % selon les études). Les effets indésirables graves, essentiellement des troubles du rythme cardiaque, sont rares. L'essentiel des effets indésirables comprend troubles digestifs, pertes de poids, céphalées et asthénies [184, 188, 189]. La rivastigmine (EXELON®) a reçu l'AMM en France en 1998. Elle est conditionnée en gélules de 1,5mg, 3mg, 4,5mg et 6mg, et en solution buvable à 2mg/mL. La posologie recommandée est de 6 à 12 mg en deux prises quotidiennes. Efficacité de la rivastigmine sur la cognition dans la MA légère à modérée Deux méta-analyses portent spécifiquement sur l'efficacité de la rivastigmine sur la cognition. La première est déjà ancienne [190] et ses résultats ne sont donc pas présentés ici. La deuxième est la méta-analyse de la Cochrane library [162]. Trois autres méta-analyses portent sur les IAChE en général [182-184]. Dans la méta-analyse du NICE [183], la taille de l'effet de la rivastigmine vs. placebo, à 6 mois, sur l'échelle ADAS-cog, est évaluée à -1,2 points pour une posologie quotidienne de 1 à 4 mg. Elle est estimée entre -2,1 et -3,1 points pour une posologie de 6 à 12 mg/jour [162, 183]. La rivastigmine était évaluée dans la méta-analyse de Lanctôt et al. [184] dont les résultats, en faveur des IAChE, sont présentés dans le chapitre sur le donepezil. Une méta-analyse réalisée portait uniquement sur l'efficacité de la rivastigmine dans le traitement de patients avec une MA modérément sévère [191]. Elle retrouvait une efficacité significative de la rivastigmine à 6 mois vs. placebo, en différence d'évolution comme en proportion de patients non détériorés sur l'ADAS-cog. Efficacité de la rivastigmine sur l'état global dans la MA légère à modérée Trois études mesuraient l'effet spécifique, sur l'échelle CIBIC-plus, de la rivastigmine vs. placebo à 6 mois [192-194]. Deux retrouvaient une efficacité significative de la rivastigmine pour ce critère [192, 194], uniquement pour les posologies les plus élevées (6 à 12 mg par jour). La rivastigmine était évaluée dans la méta-analyse de Lanctôt et al. [184] dont les résultats, en faveur des IAChE, ont été présentés dans le chapitre sur le donepezil. Le nombre de sujets à traiter (NNT) pendant 6 mois par rivastigmine pour observer au moins un sujet amélioré sur la CIBIC-plus a été estimé entre 6 et 12 pour une posologie de 6 à 12 mg/jour [182]. Tolérance de la rivastigmine Les effets indésirables de la rivastigmine sont du même ordre que ceux du donepezil. Il s'agit essentiellement de céphalées, d'asthénie et de troubles digestifs. Leur fréquence serait supérieure de 1 à 10 % à celle observée sous placebo [184, 188, 189]. La galantamine (REMINYL®) a reçu l'AMM en France en 2000. Elle est conditionnée en comprimés de 4 mg, 8 mg et 12 mg, et en solution buvable dosée à 4 mg/mL. La posologie recommandée est de 16 à 24 mg par jour en deux prises. Efficacité de la galantamine sur la cognition dans la MA légère à modérée Dans la méta-analyse effectuée par le NICE, pour une posologie quotidienne de 24 mg, la taille de l'effet de la galantamine vs. placebo est évaluée à -3,0 points à 3 mois en faveur de la galantamine sur l'échelle ADAS-cog. A 6 mois, elle est estimée entre -3,4 et -3,1 points [165, 183]. Toujours à 6 mois, mais pour une posologie de 32 mg/jour, elle est estimée à -3,3 points, et à -1,7 points pour une posologie de 24 à 32 mg/jour [183]. La galantamine était évaluée dans la méta-analyse de Lanctôt et al. [184] dont les résultats, en faveur des IAChE, ont été présentés dans le chapitre sur le donepezil. Efficacité de la galantamine sur l'état global dans la MA légère à modérée La méta-analyse réalisée par le NICE [183] ne retrouve pas d'effet significatif de la galantamine sur l'état global jugé sur l'échelle CIBIC-plus. La méta-analyse de la Cochrane [165] considérait la proportion de patients répondeurs sur l'état global, quelle que soit l'échelle utilisée, et retrouvait une efficacité significative de la galantamine à 6 mois sur l'état global uniquement pour des posologies quotidiennes de 16 mg et plus. La galantamine était évaluée dans la méta-analyse de Lanctôt et al. [184] dont les résultats, en faveur des IAChE, ont été présentés dans le chapitre sur le donepezil. Tolérance de la galantamine Les effets indésirables de la rivastigmine sont comparables à ceux du donepezil. Il s'agit essentiellement de céphalées, d'asthénie et de troubles digestifs. Leur fréquence serait supérieure de 7 à 18 % à celle observée sous placebo [184, 188, 189]. d) Autres propriétés thérapeutiques des inhibiteurs de la cholinestérase Différents essais ont mis en évidence une efficacité à 24 semaines des IAChE sur les performances fonctionnelles des sujets traités [163, 165]. Deux méta-analyses [164, 195] et 6 essais thérapeutiques randomisés supplémentaires [196-201] ont étudié l'évolution des troubles du comportement chez les patients déments placés sous IAChE, en l'absence d'autre traitement spécifique de ces troubles. Ces études concluent à une efficacité modérée mais significative des IAChE sur les troubles du comportement du patient dément. La mémantine (EBIXA) a reçu l'AMM en France en 2002. Son mécanisme d'action est différent de celui des IAChE. Elle est indiquée dans la MA modérément sévère à sévère et est conditionnée en comprimés de 10 mg et en solution buvable à 10 mg/g. La posologie recommandée est de 20 mg par jour en deux prises. a) Efficacité de la mémantine sur la cognition Deux essais cliniques randomisés sont recensés sur le traitement de la MA modérément sévères à sévère par mémantine sont recensés. Tous les deux ont été considérés pour le rapport du NICE. Dans les deux études, l'efficacité de la mémantine sur la cognition à six mois a été mise en évidence sur l'échelle SIB (échelle d'évaluation de la cognition employée dans la démence sévère). b) Efficacité de la mémantine sur l'état global Winblad et al. [202] ont mis en évidence une efficacité significative de la mémantine sur l'état global des patients à 6 mois. Cette efficacité était jugée sur l'échelle CGIC. Cette efficacité n'a pas été retrouvée par Reisberg et al. [203], qui utilisait comme critère l'échelle CIBIC-plus (malgré des tests extrêmement proches du seuil de signification). La proportion de sujets améliorés à la fois sur l'échelle SIB et sur l'échelle CIBIC-plus était cependant significativement plus élevée sous mémantine que sous placebo. A partir de ces résultats, le nombre de sujets avec une MA modérément sévère à sévère devant être traités par mémantine pendant six mois pour observer au moins un sujet amélioré à la fois sur l'échelle CIBIC-plus et sur l'échelle SIB a été estimé à 11 [204]. Un essai a montré l'intérêt de l'association de mémantine au traitement par donepezil sur la cognition, les activités de la vie quotidienne et l'état global à six mois de patients atteints de MA modérément sévère à sévère [181]. La mémantine est assez bien tolérée. Ses effets indésirables principaux sont à type de vertige, céphalée et asthénie, plus rarement d'hallucination et de confusion. 3. Synthèse des traitements existants Quatre médicaments ont donc à ce jour obtenus l'AMM avec l'indication maladie d'Alzheimer parce qu'ils ont démontré leur efficacité sur la cognition et sur l'appréciation globale de l'évolution des malades. Ces médicaments ont aussi montré une efficacité sur les échelles fonctionnelles, sur le comportement ou sur le fardeau ressenti par l'aidant, c'est-à-dire pratiquement toutes les conséquences de la maladie. L'impact réel des médicaments en termes médico-économiques à long terme reste discuté. Pourtant, la mise sur le marché de ces médicaments a été le catalyseur de l'émergence de la maladie d'Alzheimer en tant que problème de santé publique et la surveillance des traitements a révélé pour beaucoup l'intérêt d'un suivi des patients pour prévenir les situations de crise. Dans les consultations mémoire et chez les spécialistes libéraux intéressés par la maladie, la majorité des praticiens sont convaincus de l'efficacité et de l'utilité de ces produits. Il est indispensable que des études se développent sur l'efficacité à long terme, jugée sur des critères crédibles, cliniquement pertinents, comme par exemple la survie sans démence sévère. Enfin il est également important de savoir s'il faut, et quand arrêter ces médicaments. 4. Traitements étiologiques : prospective Les lésions observées dans la maladie d'Alzheimer sont d'une part une dégénérescence (dite neurofibrillaire) des neurones, corrélée au déclin cognitif, et d'autre part un dépôt d'une substance amyloïde, extracellulaire, qui provient de la fragmentation d'une protéine physiologique (l'APP) en peptides A-bêta 40 et 42 qui s'agrègent et seraient neurotoxiques. Si les dépôts amyloïdes ne sont pas directement liés au déclin cognitif, ils sont assurément liés à la maladie car les rares formes génétiques de la maladie impliquent toute la formation de ces peptides. a) Thérapeutiques anti-amyloïdes Une voie pharmacologique logique est donc celle qui vise à éliminer les dépôts amyloïdes. L'immunisation contre le peptide amyloïde [205, 206] (« vaccination » par injection sous-cutanée produisant des anticorps qui, après avoir traversé la barrière hémato-encéphalique vont éliminer les dépôts amyloïdes) s'avère efficace sur la diminution de la charge en substance amyloïde dans le cerveau (prouvée par les examens autopsiques des patients décédés depuis l'essai). Cependant, cette première stratégie a provoqué des effets dépassant leur but chez 5 % des patients traités, qui ont développé dès la deuxième injection une encéphalite immuno-allergique [207] et l'essai a été interrompu. Le nombre d'injections prévu n'ayant pas été réalisé, il n'a pas été possible de juger de l'efficacité clinique, sur les fonctions cognitives, de cette réduction de la charge amyloïde. Toutefois certains tests psychométriques se sont avérés meilleurs dans le groupe traité [208]. De nouvelles stratégies, dans cette même voie visant à diminuer la charge amyloïde, sont en cours : - immunisation passive (injection directement d'anti-corps évitant la production non contrôlée d'anti-corps par les patients eux-mêmes), et immunisation contre un fragment seulement des peptides amyloïdes ; - réduction de la production des peptides amyloïdes en agissant sur les enzymes (sécrétases) qui fractionnent l'APP en peptides amyloïdes. b) Thérapeutiques « neuroprotectrices » L'autre voie de recherche est celle qui vise à réduire la dégénérescence neurofibrillaire et la mort neuronale. La protéine tau, protéine constitutive du cytosquelette du neurone, est modifiée au cours de la maladie d'Alzheimer, ce qui contribue à provoquer la mort cellulaire. Une hyperphosphorylation de cette protéine a été observée, qui semblerait être plus une conséquence qu'une cause de la perte fonctionnelle de la protéine. La recherche fondamentale cherche à élucider les étapes qui conduisent à la mort cellulaire. Certaines de ces étapes sont communes à de nombreuses maladies neurodégénératives ne s'exprimant d'ailleurs pas nécessairement par des démences au premier plan. Les stratégies pharmacologiques qui en découlent peuvent donc avoir potentiellement des retombées thérapeutiques très importantes. La maladie d'Alzheimer peut s'accompagner de troubles de l'humeur et de troubles du comportement à type d'agitation, d'agressivité, d'hallucinations et de délire. Les IAChE diffèrent la survenue des troubles du comportement et contribuent à les améliorer, en particulier l'apathie, les hallucinations, les symptomes dépressifs et l'anxiété. Ceci a été montré dans la maladie d'Alzheimer [166, 209], de même que dans la démence à corps de Lewy et l'arrêt de ces traitements n'est pas recommandé [174]. Les principaux médicaments disponibles pour le traitement de ces troubles sont présentés brièvement ici, avec une analyse de la littérature concernant leur efficacité. Des recommandations ont été établies par l'American psychiatric association [210]. 1. Le traitement des troubles de l'humeur Les imipraminiques ne sont pas le premier choix, essentiellement en raison de leurs effets anticholinergiques, outre certains effets potentiellement graves chez le sujet âgé (arythmie, hypotension orthostatique). Ces effets peuvent entraîner une dégradation des performances cognitives ou une diminution de l'efficacité des IAChE dans la maladie d'Alzheimer. Les inhibiteurs sélectifs de la recapture de la sérotonique (ISRS) sont aussi efficaces et beaucoup mieux tolérés [211, 212]. De plus ils sont plus efficaces sur les symptômes psychotiques et les troubles du comportement chez les patients déments non déprimés [213]. Les ISRS apparaissent donc plus adaptés pour le traitement de la dépression des sujets présentant une MA. Les ISRS ont non seulement une action sur les symptômes dépressifs mais aussi sur l'agitation, les idées délirantes [214], l'anxiété, l'irritabilité, l'instabilité motrice [215]. La fluoxetine et la paroxetine ont un effet inhibiteur sur le métabolisme des IAChE et les autres traitements de la classe sont préférables dans ce cas. La méthode utilisée dans les essais évaluant des antidépresseurs dans le cadre de la démence varie considérablement concernant la définition de la démence ou du trouble cognitif. Il existe également une hétérogénéité dans l'objectif de ces essais et les échantillons étaient souvent de petite taille [216-219]. L'état des connaissances demande des améliorations [220, 221]. 2. Le traitement des troubles du comportement Tout changement rapide de comportement doit faire rechercher un syndrome confusionnel et sa cause. Le traitement d'une maladie ou un inconfort intercurrent, la correction d'un déficit sensitif, l'évaluation d'une interaction médicamenteuse ou d'effets secondaires d'un traitement récemment introduit ou un changement thérapeutique inopportun doivent être recherchés. Dans la majorité des situations, le contrôle de la douleur, le soutien à l'entourage qui peut ne pas avoir l'attitude adaptée, l'aménagement de l'environnement, l'apport d'aide, l'utilisation de répit (accueil de jour, hébergement temporaire) sont d'une aide considérable. Les neuroleptiques ne doivent plus être utilisés dans la démence. Les bénéfices modestes doivent être reconsidérés à la lumière des effets secondaires délétères [222]. Beaucoup de ces effets secondaires, comme le syndrome parkinsonien, les vertiges, les dyskinésies tardives et l'acathysie sont connus depuis leur utilisation dans la schizophrénie, mais sont plus fréquent et plus sévères chez les patients déments, comme la sédation, l'hypotension orthostatique, les effets anticholinergiques comme la constipation. Le risque parait moindre avec les nouveaux antipsychotiques [223]. D'autres effets indésirables sont à craindre comme le risque de chute [224], l'accélération du déclin cognitif [225], la survenue d'accident vasculaire cérébral et l'augmentation de la mortalité, l'allongement du Q-T sur l'ECG et surtout l'hypersensibilité aux neuroleptiques qui survient chez 30-50 % des patients ayant une démence à corps de Lewy, même avec de faibles doses et même avec les nouveaux antipsychotiques [226, 227]. Cette hypersensibilité se manifeste par une sédation brutale, une augmentation de la confusion, une hypertonie, une acathysie, une mortalité importante en quelques jours ou semaines [226]. Or ces variantes à corps de Lewy ne sont pas toujours diagnostiquées, justifiant de toujours éviter ces traitements. Six essais cliniques portants sur l'évaluation des antipsychotiques atypiques dans le traitement des troubles du comportement dans la MA ont été retrouvés [228-233]. Ces essais mettent en évidence une efficacité significative, mais modeste, de l'olanzapine et de la risperidone, sur les troubles du comportement considérés globalement. Pour les posologies modérées, cette efficacité s'accompagne de peu d'effets indésirables [234]. Les neuroleptiques atypiques ont fait l'objet, en mars 2004, d'une mise en garde de l'AFSSAPS suite à la découverte, dans plusieurs études, d'une augmentation du risque d'accidents vasculaires cérébraux associée à leur utilisation chez les sujets déments [230, 235, 236]. Ce risque bien authentifié n'apparaît cependant pas différent entre neuroleptiques atypiques et neuroleptiques classiques d'après les résultats d'une étude récente [237]. Les neuroleptiques atypiques semblent donc offrir un meilleur profil de tolérance et être plus adapté à une utilisation chez la personne âgée, du fait de la fréquence supérieure de syndromes parkinsoniens observés sous neuroleptiques classiques. La mise en place de ces traitements doit cependant faire considérer attentivement les bénéfices et les risques à attendre pour chaque patient. La recherche sur le substatum neurochimique et neuropathologique des troubles du comportement dans les démences se concentre essentiellement sur les systèmes de neurotransmission serotoninergique (5-HT) et noradrenergiques [238], et sur le système cholinergique [209]. La mise en évidence de l'interférence des neuroleptiques avec le système sérotoninergique [239] contribue à déconseiller leur utilisation dans les démences. Le système cholinergique est impliqué dans la psychose [240] et des corrélations ont été trouvées entre le noyau basal de Meynert et la dépression [241]. Les anticonvulsivants (carbamazépine, acide valproïque) ont montré un intérêt dans l'agitation et l'hostilité. Les traitements spécifiques de la maladie d'Alzheimer, sont désormais les traitements de première intention dans les troubles du comportement dans les démences. Les psychotropes ont des indications précises, et un intérêt réel dans certaines circonstances. Ils ne peuvent être prescrits qu'après un bilan clinique permettant de préciser l'origine des troubles. On comprend donc que si le diagnostic n'a pas été porté, si les aidants du patient ne sont pas correctement informés, ces traitements peuvent être non seulement inutiles mais délétères. Il en est de même pour le traitement des autres comorbidités de la maladie d'Alzheimer. Comment équilibrer correctement un diabète, un traitement anticoagulant ou une hypertension artérielle chez un dément, si on n'a pas fait le diagnostic, ou si on n'informe pas correctement l'aidant ? Le médicament devient ici inséparable de la prise en charge des familles et ne peut se concevoir sans elle. 1. Le traitement de la démence vasculaire Deux essais cliniques randomisés ont évalué l'efficacité de la mémantine dans le traitement des troubles cognitifs de la démence vasculaire [242, 243]. Une efficacité modérée mais significative de la mémantine a été retrouvée, avec une taille de l'effet à 28 semaines dans les deux essais de -2 points sur l'échelle ADAS-cog. La première étude retrouvait de plus une efficacité significative de la mémantine sur l'état global, au contraire du deuxième essai. Les IAChE ont fait l'objet de plusieurs études, soit dans le cadre des démences vasculaires, soit dans le cadre des MA associées à des lésions vasculaires et des démences mixtes [196, 244, 245]. Donepezil et galantamine semblent efficaces sur les troubles cognitifs de la démence vasculaire. L'efficacité de la galantamine reste significative à 1 an d'après les résultats d'études ouvertes prolongeant l'essai thérapeutique initial [246]. L'efficacité de la rivastigmine dans cette indication reste à démontrer. 2. Le traitement de la démence à corps de Lewy L'évaluation des traitements a porté à la fois sur des échelles d'évaluations de la cognition et sur des échelles d'évaluation des troubles du comportement (échelle NPI-4), étant donné leur gravité dans la démence à corps de Lewy. Comme pour la MA et la démence vasculaire, le traitement de la démence à corps de Lewy repose sur les IAChE. Tous semblent efficaces dans cette indication, avec une efficacité supérieure à celle obtenue dans la MA. L'IAChE le plus évalué dans cette indication est la rivastigmine [199, 247], pour laquelle un essai thérapeutique de 20 semaines retrouvait une efficacité significative sur les troubles cognitifs dans toutes les analyses et une efficacité significative sur les troubles du comportement dans les deux analyses sur trois [199]. Si les IAChE ne suffisent pas à contrôler les troubles du comportement, l'association à d'autres traitements est possible. La notion d'hypersensibilité aux neuroleptiques dans cette maladie, à l'origine de syndromes extrapyramidaux parfois gravissimes ne doit alors pas être oubliée. Les benzodiazépines peuvent être associées aux IAChE en première intention dans le traitement des troubles anxieux et de l'agitation, mais ces molécules sont moins performantes que les antipsychotiques classiques pour le traitement des symptômes plus sévères. Le recours aux neuroleptiques peut être envisagé en considérant préférentiellement les neuroleptiques atypiques et en les utilisant avec la plus grande précaution [248, 249]. La symptomatologie dépressive est fréquente dans la démence à corps de Lewy. Son traitement, comme dans la MA et la démence vasculaire, fait préférentiellement appel aux ISRS. Les études évaluant ces thérapeutiques dans les démences à corps de Lewy sont cependant insuffisantes. Aucun médicament n'a à ce jour fait l'objet d'une demande d'autorisation de mise sur le marché pour le traitement de la démence à corps de Lewy. 3. Le traitement de la démence associée à la maladie de Parkinson Les personnes atteintes de maladie de Parkinson peuvent présenter des troubles cognitifs et des troubles du comportement à type d'apathie, de changement de la personnalité ou d'hallucinations visuelles. Il n'y a pas, à l'heure actuelle, de traitement recommandé dans le traitement de la démence associée à la maladie de Parkinson (Parkinson disease dementia, PDD). La mise en évidence d'un déficit cholinergique chez les patients atteints de PDD a amené à étudier les IAChE dans cette indication [250, 251]. L'IAChE le mieux évalué dans cette indication est la rivastigmine, pour laquelle un essai récent a retrouvé une efficacité significative à 6 mois sur la cognition et l'état global dans la démence associée à la maladie de Parkinson [175]. Ces études apportent également des arguments en faveur d'une efficacité des IAChE sur les troubles du comportement dans le cadre de la PDD. Par ailleurs, l'arrêt du donepezil chez des patients traités pour une démence liée à une maladie de Parkinson a été associé à une recrudescence importante des troubles cognitifs et comportementaux [252]. 4. Le traitement de la démence fronto-temporale La démence fronto-temporale (DFT) se distingue des autres formes de démence par la prédominance clinique de troubles du comportement, classiquement à type de désinhibition. La transmission cholinergique paraît normale dans la DFT, ce qui limite l'intérêt des IAChE dans cette indication. La rivastigmine a cependant fait l'objet d'une étude non comparative dans la DFT, montrant une amélioration de la symptomatologie comportementale des patients après 12 mois de traitement [253]. La transmission sérotoninergique a été mise en cause dans certains cas de DFT. Les ISRS ont été évalués dans cette indication, avec des résultats variables. La trazodone et la paroxetine pourraient être efficaces dans la DFT [254-256]. La réalisation d'études plus longues portant sur des effectifs plus importants apparaît indispensable pour progresser sur le traitement de la DFT, qui reste la démence la plus négligée par la recherche pharmaceutique. Le traitement des autres démences les plus fréquentes, pour lesquelles le recours au diagnostic d'un spécialiste est indispensable, repose donc sur les IAChE (et la mémantine pour les démences vasculaire) à l'exception notable de la démence fronto-temporale où ils peuvent aggraver les troubles. Ils sont particulièrement efficaces dans la maladie des corps de Lewy où on peut presque parler, dans certains cas, de « lune de miel » par analogie avec la L-DOPA dans la maladie de Parkinson. A l'inverse, la prescription inadaptée de neuroleptiques pour des hallucinations dans cette même affection peut être catastrophique. On peut vraiment parler ici de perte de chance quand le diagnostic n'est pas correctement fait. Les médicaments occupent une place prépondérante dans la prise en charge de la maladie d'Alzheimer et des maladies apparentées en France. Leur efficacité reste cependant limitée et ne peut être optimisée que s'ils sont intégrés dans une démarche globale de prise en charge du patient. De nombreuses techniques de prise en charge non médicamenteuses sont employées chez le sujet dément. Elles peuvent faire appel aux processus cognitifs préservés des sujets déments ou s'appuyer sur leurs capacités de réserve cognitive. Le recours à ce type d'approche est croissant en France. Pour autant, la justification et l'intérêt clinique de ces actes ne sont pas unanimement reconnus. L'ANAES a publié en 2003 un rapport sur la prise en charge non médicamenteuse de la maladie d'Alzheimer et des troubles apparentés. Ce chapitre réalise une actualisation de ce rapport. 1. Thérapeutiques non médicamenteuses cognitives Cette prise en charge est une des plus ancienne modalité de stimulation de la cognition dans la démence. L'amélioration espérée de la fonction cognitive du patient passe par la réalisation d'exercices répétés et indifférenciés. Cette technique a fait l'objet de vives critiques et pourrait être responsable de contre-performance et de détérioration chez certains sujets déments. b) Les référentiels pour l'exercice mnésique Cette prise en charge consiste à enseigner aux sujets déments des moyens mnémotechniques destinés à les aider à retenir les nouvelles informations. Certains aspects du fonctionnement cognitif des patients peuvent être sélectivement et profondément affectés tandis que d'autres sont préservés. Cette hétérogénéité dans les atteintes est aujourd'hui prise en compte dans l'approche cognitive de la maladie d'Alzheimer, qui met en évidence les aptitudes préservées et tente d'analyser les mécanismes sous-jacents aux troubles observés. La revalidation cognitive s'inscrit dans cette démarche en réalisant une prise en charge extrêmement individualisée. L'étude d'une tâche précise sera effectuée pour un sujet chez lequel sa réalisation est déficiente. Quels sont les processus impliqués pour la réalisation de cette tâche? Quelles sont les difficultés rencontrées par le sujet pour sa réalisation ? Comment réapprendre au sujet à réaliser cette tâche en se servant de ses capacités les mieux préservées pour pallier ses déficits ? Il s'agit d'une approche voisine de la rééducation accordée aux patients présentant des déficits fonctionnels, mais où la rééducation porte sur des troubles cognitifs. Ces approches reposent souvent sur la méthode d'apprentissage sans erreur. Cette notion résulte de l'observation chez le sujet dément d'une bonne préservation de la mémoire implicite, mais d'une altération souvent profonde de la mémoire explicite. Confronté à plusieurs reprises à une même situation, le sujet dément reconnaît la situation (mémoire implicite) mais ne se souvient pas de l'erreur commise (mémoire explicite) et aura tendance à reproduire le premier comportement adopté face à cette situation, avec le risque de perpétuer l'erreur initiale. L'apprentissage chez le patient dément doit donc prendre garde à minimiser la fréquence des erreurs. L'apprentissage de la réponse dans une tâche donnée peut se faire par exposition répétée à la bonne réponse. La restitution de la réponse peut ensuite se faire selon le principe de la récupération espacée. 2. Thérapeutiques non médicamenteuses non cognitives - approches psychosociales a) Les rééducations de l'orientation Les traitements relevant de thérapie par rééducation de l'orientation consistent à adapter l'environnement du patient dément afin de pallier à ces déficits et en particulier à ses difficultés à s'orienter dans l'espace et dans le temps. La variété de techniques mises en oeuvre est large. Toutes reposent sur la présentation répétée d'informations ayant pour but d'améliorer la compréhension du sujet dément de son environnement favorisant une plus grande impression de contrôle et une meilleure estime de soi. Ce type de prise en charge nécessite une formation spécifique des soignants incités à remémorer le plus fréquemment possibles aux sujets pris en charge le jour, la date, le lieu ou l'identité et la qualité des personnes rencontrées. Ces techniques s'appuient également sur des sessions intensive de rééducation, organisées parfois quotidiennement, pouvant durer une demi-heure à une heure, et s'adressant à des groupes de 3 à 6 sujets. Ces techniques sont préférentiellement destinées aux sujets pris en charge en institution ou en unité de long séjour. Tous les membres de l'équipe soignante respectent certaines directives prédéfinies dans leur approche des personnes, en fonction de leur personnalité et de leurs besoins, afin de garantir une cohérence dans l'approche des patients. Cette méthode de répétition verbale des informations a fait l'objet de critiques, ce qui l'a amenée à évoluer. L'information présentée en continue est fournie non seulement par répétition verbale mais s'appuie également sur d'autres modalités de présentation telle que la présence de signalisation visuelle. Le bénéfice observé chez les sujets suivant une rééducation de l'orientation pourrait être expliqué indirectement par le renforcement de la communication, des contacts sociaux, de l'attention et du comportement. b) Les thérapies par évocation du passé Les thérapies par évocation du passé (reminiscence therapy) font appel aux souvenirs anciens autobiographiques du sujet, longtemps préservés au cours de la démence. Un travail sur ces souvenirs est effectué classiquement au cours de séances de groupe suivant un rythme hebdomadaire, mais ces thérapies peuvent aussi être organisées en sessions individuelles. Au cours de ces séances, le sujet évoque des évènements, des expériences ou des activités passées de sa vie. Ce rappel des évènements passés s'appuie généralement sur des supports tels que des photographies, objets, musiques, enregistrements familiaux... La prise de parole des sujets lors des séances de travail est censée devenir de plus en plus active au fil des séances. Les aidants familiaux sont souvent très impliqués dans la préparation de ces séances ayant recours à l'évocation du passé. Ce type d'approche permettrait d'améliorer la qualité de vie et les capacités de socialisation résiduelles du sujet dément. c) Les thérapies par l'empathie Les approches relevant des thérapies par l'empathie (validation therapy) visent à améliorer la compréhension des besoins et des émotions des sujets déments. Le principe de ces approches est de comprendre, soutenir et reconnaître les sentiments des sujets déments, qu'elle qu'en soit la réalité. Ces thérapies s'attachent donc à identifier les émotions que les patients essaient de faire passer par différents moyens de communication et à les entériner (les valider) verbalement ou non verbalement. Elles essaient également d'exploiter les stéréotypies de comportement conservées par les patients déments afin d'augmenter chez les sujets la sensation de contrôle et d'adaptation à l'environnement et aux situations. Ces approches nécessitent une formation très poussée du personnel soignant dans le domaine de la communication non verbale. Ces thérapies sont actuellement essentiellement mises en œuvre par des équipes soignantes très spécialisées, soit dans un cadre individuel soit en groupe. Leur mise en œuvre nécessite d'accorder beaucoup de temps de soignant pour chaque patient, ce qui pose des problèmes d'effectifs et doit amener à identifier précisément quels sont les sujets les plus susceptibles de bénéficier de telles approches. 3. Thérapeutiques non médicamenteuses non cognitives - autres approches D'autres approches ont été employées dans le traitement non médicamenteux de la démence. Ces approches comprennent la stimulation comportementale, l'exercice physique, la musicothérapie, la luminothérapie, les stimulations sensorielles et multisensorielles, l'aromathérapie. L'exhaustivité de ce recensement apparaît difficile à garantir tant la variété des interventions employées est grande. Les données permettant d'évaluer l'efficacité des thérapeutiques non médicamenteuses dans le cadre de la démence sont peu nombreuses. La mise en place d'études randomisées pour l'évaluation de ces techniques pose de nombreux problèmes de faisabilité. Le nombre nécessaire de patients à traiter est souvent difficile à réunir et la mise en œuvre chez un grand nombre de sujets de ces thérapeutiques parfois très lourdes implique de disposer d'un effectif important de soignants. Dans ce contexte, les évaluations concernant les thérapeutiques non médicamenteuses ont souvent porté sur des cas uniques ou sur des nombres limités de patients. Le niveau de preuve apporté par ces études est insuffisant pour déterminer l'efficacité des thérapeutiques. La grande majorité des interventions évaluées combinaient différentes approches thérapeutiques (interventions cognitives employant à la fois des techniques de référentiel et de groupes de suivi par exemple). Il est donc souvent difficile de se prononcer sur l'efficacité propre de chaque technique. Ceci ne constitue pas un obstacle majeur à l'évaluation des thérapeutiques non médicamenteuses dans le cadre de la démence où les interventions employées tendent à devenir de plus en plus complexes. Le nombre d'études randomisées dans ce domaine est en augmentation. Pour autant, les études portant sur de grands nombres de patients sont encore trop rares. 1. Thérapeutiques non médicamenteuses cognitives Une revue de la littérature a été effectuée récemment par la Cochrane library [257] pour évaluer les approches de stimulation et de rééducation cognitive dans le traitement de la maladie d'Alzheimer aux stades léger et modéré. Cette étude a retenu six essais. Les auteurs concluent qu'aucune de ces études ne permet de démontrer une efficacité significative de ces approches, bien que des effets modérés mais non significatifs puissent être observés dans de nombreux domaines de la cognition. Cette conclusion doit cependant être pondérée en raison du très faible nombre d'essais disponibles. Dans un essai randomisé postérieur à cette revue comparant, chez des patients atteints de MA légère à modérée, une intervention associant approche psychosociale et stimulation cognitive et motrice à une approche psychosociale simple, le groupe bénéficiant de la stimulation cognitive et motrice a présenté un bénéfice significativement supérieur sur la cognition à six mois [258]. 2. Thérapeutiques non médicamenteuses non cognitives Une revue de la littérature a été réalisée par la Cochrane library en 2000 [259] pour évaluer l'efficacité des techniques de rééducation de l'orientation (Reality orientation therapy) dans la démence. Six études étaient exploitables pour cette revue, qui met en évidence une efficacité significative de ces techniques sur les troubles cognitifs et sur les troubles du comportement durant la période de traitement. Le maintien du bénéfice après la fin de l'intervention apparaît plus difficile à estimer. Cinq essais ont été inclus dans la revue réalisée par la Cochrane Library en 2005 [260] sur la Reminiscence therapy. A l'issue de cette revue, les thérapies par évocation semblent avoir une efficacité significative sur la cognition - surtout sur la mémoire autobiographique - et l'humeur tout au long du suivi des sujets. Elles semblent aussi avoir une efficacité significative sur les troubles du comportement, mais celle-ci serait limitée à la durée de l'intervention. Les interventions évaluées apparaissaient très hétérogènes. Une revue de la Cochrane library portant spécifiquement sur l'évaluation des thérapies par empathie dans le traitement de la démence et des troubles cognitifs a été réalisée en 2003 [261]. Trois études ont pu être incluses dans cette revue, portant sur 116 patients au total. Ces approches semblent présenter une efficacité sur le comportement après 6 semaines et sur la dépression à 1 an. Les données d'évaluations de ces techniques sont cependant très insuffisantes pour permettre de statuer sur leur efficacité. 3. Autres approches thérapeutiques non médicamenteuses Une revue récente de la littérature [262] a été publiée concernant l'efficacité de l'exercice physique chez les patients déments ou présentant des troubles cognitifs. La qualité méthodologique des essais retenus dans était faible (seuls 6 essais sur 30 avaient recours à l'insu), et les interventions évaluées très hétérogènes. Cette revue retrouve une efficacité possible de l'exercice physique sur la cognition, les aptitudes fonctionnelles et les troubles du comportement. La conduite d'autres études est encore indispensable avant de pouvoir se prononcer sur l'efficacité réelle de ces techniques. La pratique de la marche associée à d'autres mesures pourrait également s'avérer efficace dans le traitement des troubles du sommeil du patient dément [263]. L'aromathérapie a fait l'objet d'une revue récente de la Cochrane library [264] et pourrait avoir une efficacité sur l'agitation et les symptômes neuropsychiatriques (application biquotidienne de mélisse sur les bras et le visage pendant 4 semaines). Pour autant, ces études présentent des limites, la confusion liée à l'utilisation de traitements médicamenteux visant à réduire les troubles du comportement n'a pas été contrôlée. Des techniques très variées de stimulations sensorielles sont employées dans la démence au sein desquelles peuvent être individualisées la musicothérapie, la luminothérapie, les techniques dites de Snoezelen et de stimulations multi-sensorielles. La Cochrane library a publié une revue portant sur l'évaluation des techniques de musicothérapies dans la démence en 2003 [265]. La solidité méthodologique des études retenues pour cette revue était insuffisante pour permettre une évaluation valide de l'efficacité de ces techniques. Une revue concernant le Snoezelen a également été réalisée [266]. Deux études ont été retenues dans cette revue, qui ne met pas en évidence d'efficacité des techniques de stimulation sensorielle de Snoezelen dans la démence. Les données de littérature sont cependant insuffisantes pour évaluer l'efficacité de ces techniques. Un essai randomisé en cross-over postérieur à cette revue a comparé le Snoezelen à une approche psychosociale d'évocation par le passé [267] et un autre essai randomisé a comparé la stimulation multi-sensorielle à un suivi par groupes d'activités [268]. Ces essais n'ont pas mis en évidence de différence entre les techniques comparées, et l'absence de groupe de contrôle « placebo » ne permettait pas de juger de l'efficacité de ces techniques. Les essais portant sur l'utilisation de barrières subjectives pour prévenir la déambulation des patients déments et sur le recours à des interventions multidisciplinaires dans le traitement du délire des sujets avec troubles cognitifs chroniques offrent des perspectives intéressantes, mais leur qualité méthodologique est trop faible pour permettre de statuer sur l'efficacité de ces techniques. Les thérapeutiques non médicamenteuses de la maladie d'Alzheimer sont donc multiples, mais leur efficacité n'est pas clairement démontrée. Pourtant, ces traitements sont appliqués partout en France, dans les consultations mémoire, dans les accueils de jour, dans les EHPAD, dans les cabinets d'orthophonie ou dans d'autres structures sur des milliers de malades d'une manière extrêmement hétérogène sans qu'on puisse définir leur intérêt autre que celui de s'occuper d'un patient. Cette hétérogénéité contribue largement au manque de crédibilité de l'efficacité de la prise en charge des malades. Il est indispensable de développer une évaluation rigoureuse de ces traitements afin que des recommandations d'application puissent être proposés. Si ces traitements sont efficaces, il faut les financer ; s'ils sont inefficaces, il ne faut pas les appliquer. L'aide aux aidants est d'un autre registre que les thérapeutiques précédentes, parce qu'elle ne s'adresse pas directement au patient mais à ses proches et qu'elle comporte une part quasi incontournable d'information de l'aidant (qui est même un droit) et une part modulable qui est le soutien psychologique. La démence frappe le sujet, mais également ses proches. La personne qui vit aux côtés du sujet dément, qui est amenée à le prendre en charge ou à le suppléer dans la vie quotidienne, supporte une charge qui n'a pas toujours été prise en compte. Dans une enquête réalisée aux USA auprès de 217 familles, la moitié déclarait, dans l'année précédant le décès de leur proche dément, avoir exercé un soutien au moins 48 heures par semaine pour les activité de la vie quotidienne, avoir eu le sentiment d'être de service 24 heures sur 24 et avoir dû réduire leur activité professionnelle [269]. Devant la détresse et l'observation d'une prévalence accrue de dépression chez les aidants, des initiatives destinées à alléger le fardeau des aidants ont été mises en place. Une revue de la littérature visant à évaluer l'efficacité des interventions psychosociales menées chez les aidants familiaux de patients déments a été conduite en 2003 [270]. Cette revue portait sur des essais contrôlés, qui n'avaient pas tous fait l'objet d'une randomisation. La grande diversité des critères de jugement employés rendait difficile l'évaluation globale de ces techniques, mais leur efficacité semblait significative sur la détresse de l'aidant et les troubles de l'humeur des sujets déments. Quatre études, parmi les sept ayant analysé le délai avant entrée en institution des patients déments, rapportaient un allongement significatif de ce délai pour les sujets déments dont les aidants avaient bénéficié d'une prise en charge psychosociale. D'autres essais réalisés postérieurement ont démontré une efficacité d'interventions cognitivo-comportementales sur l'anxiété des aidants à 6 semaines [271], d'interventions de gestion de l'adaptation de l'aidant au stress sur la qualité de vie et la symptomatologie dépressive de l'aidant après 24 mois d'intervention [272] et d'intervention de soutien et de conseil aux aidants sur la réaction des aidants face aux troubles du comportement [273]. L'efficacité d'interventions de soutien et de conseils menées auprès d'aidants et de patients déments semble, en plus d'une efficacité immédiate sur la symptomatologie dépressive des aidants, permettre d'obtenir un bénéfice sur la symptomatologie dépressive de l'aidant pouvant être soutenu jusqu'à 3 ans après l'intervention et postérieurement à la mise en institution du sujet dément [274]. L'intérêt des interventions d'aide à l'aidant paraît indéniable, en particulier concernant la dépression très fréquente chez les aidants familiaux. Les résultats récents faisant état d'un retard d'entrée en institution pour les déments dont les aidants ont pu bénéficier d'une prise en charge sont également encourageants. L'effort de recherche dans ce domaine doit cependant se poursuivre afin d'identifier quels sont les sujets les plus à mêmes de bénéficier de ces interventions. En effet, certaines études ont mis en évidence des sous-groupes d'aidants chez lesquels une prise en charge lourde multidisciplinaire n'apportait pas plus de bénéfices qu'une prise en charge habituelle et d'autres, chez lesquels cette prise en charge alourdie était très bénéfique [275]. Par ailleurs, un effort d'homogénéisation des pratiques doit être effectué afin de pouvoir comparer l'efficacité des différentes techniques et éventuellement, d'identifier l'indication préférentielle de chaque type de technique qui aura démontré son efficacité. Les données de ventes pharmaceutiques ou de la sécurité sociale ne peuvent donc être utilisées dans l'étude du traitement de la maladie d'Alzheimer que concernant les médicaments pour laquelle elle constitue une indication presque exclusive, les inhibiteurs de l'acétylcholinestérase et la mémantine. 1. Le traitement médicamenteux des malades d'Alzheimer en France Les inhibiteurs de l'acétylcholinestérase ont été mis sur le marché à dater du milieu des années 90 (tacrine en 1994, donepezil en 1997, rivastigmine en 1998, galantamine en 2000) et leur prescription initiale est réservée aux seuls spécialistes. L'adoption de ces traitements apparaît lente au regard des données issues des cohortes étudiant le vieillissement en France. En 2001, la proportion de patients atteints de maladie d'Alzheimer, dont le diagnostic était connu depuis au moins 2 ans, et faisant l'objet d'un traitement par anticholinestérasique, n'était que de 4,9 % dans Paquid. Elle était de 38 % parmi les sujets de la cohorte urbaine des 3 Cités. L'évolution de cette proportion est détaillée en annexe 8. Son augmentation assez lente concorde avec l'évolution des données de vente, assez linéaire pour les anticholinestérasiques. Cette augmentation linéaire des ventes peut refléter l'efficacité de la restriction de la prescription initiale aux seuls spécialistes, qui visait à contrôler l'emploi de ces médicaments. Une des explications possibles pour expliquer la différence de proportion de sujets traités entre les deux cohortes Paquid et 3C pourrait être la différence d'âge existant entre les sujets des deux études. Il semble que les sujets déments les plus âgés soient moins susceptibles de recevoir un traitement par anticholinestérasiques, même quand leur démence n'est pas plus sévère que celle de sujets plus jeunes et traités. Cette hypothèse est confortée par l'analyse des données de ventes en fonction de l'âge des sujets (figure 1). La proportion de sujets présentant une maladie d'Alzheimer et traités atteindrait 62 % dans la tranche d'âge des 75 à 79 ans, ne serait plus que de 22,9 % dans la tranche d'âge des 85 à 89 ans et seulement de 10,2 % dans celle des sujets âgés de 90 ans et plus. Figure IV.1. Prévalence et traitement de la maladie d'Alzheimer en France en 2004. Distribution par tranche d'âge 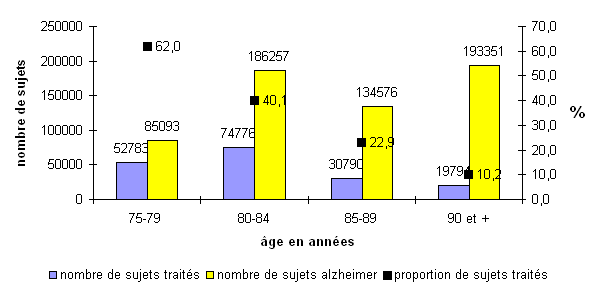 Fin 2004, on estimait à environ 50 000 le nombre de sujets traités par mémantine. Parmi ces sujets, environ 60 % faisaient l'objet d'une prescription en association de mémantine et d'IAChE. Il existe des disparités régionales pour le traitement des sujets atteints de maladie d'Alzheimer. La proportion de patients traités varie en fonction des régions (annexe 9). Cette observation pourrait être consécutive aux disparités régionales concernant l'offre de soins. Les conséquences d'une offre limitée en spécialistes et en structures spécialisées sont majorées dans le cadre de la MA par la restriction de la prescription médicamenteuse initiale aux seuls spécialistes. 2. Le traitement médicamenteux des malades d'Alzheimer en Europe Les données de ventes d'inhibiteurs de l'acétylcholinestérase, rapportées aux estimations de prévalence de la maladie d'Alzheimer selon l'étude Eurodem, ont été comparées entre différents pays d'Europe. La France présente la plus forte proportion de sujets traités par anticholinestérasiques parmi les sujets atteints de maladie d'Alzheimer. Moins d'un tiers des sujets atteints de maladie d'Alzheimer seraient cependant traités en France (figure 2). Cette avance relative et modérée de la France dans le traitement de la maladie d'Alzheimer pourrait s'expliquer en partie par une amélioration du diagnostic et du dépistage de la maladie d'Alzheimer consécutive à la mise en place suite au plan Alzheimer 2001 des centres mémoire de ressources et de recherche et des consultations mémoire de proximité. Figure IV.2. Prévalence et traitement de la maladie d'Alzheimer en France 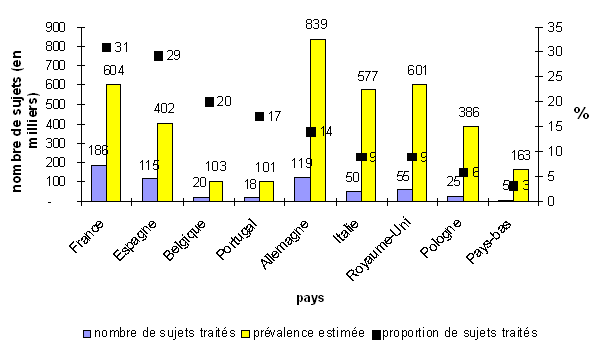 Un malade sur trois environ présentant une maladie d'Alzheimer est traité en France par un traitement spécifique. C'est plus que le reste de l'Europe, mais deux malades sur trois ne sont pas traités. Comme l'accès au spécialiste, ces chiffres montrent que l'accès au traitement est très lié à l'âge, neuf malades sur dix après 90 ans n'étant pas traité, alors qu'avant 80 ans, l'accès au traitement est presque à son maximum compte tenu des problèmes de tolérance des produit et de leur abandon en phase sévère. Question 4 : « Quelle est l'offre de soins ? » Donner un bilan de l'offre de soins (comprenant le dépistage et le diagnostic). Evaluer le système de repérage par les médecins généralistes et les consultations mémoire de proximité (CMP), étudier le fonctionnement des centres mémoire de ressources et de recherche (CMRR), les ressources d'aide à domicile et les ressources d'institutionnalisation, comme les établissements d'hébergement des personnes âgées dépendantes (EHPAD) et les unités de soins. Donner une évaluation du délai moyen séparant le diagnostic de l'entrée en établissement et les moyens engagés pour le prolonger. Consacrer un développement aux politiques de formation des acteurs de soins. Intégrer l'évaluation du dispositif et des propositions d'amélioration. L'objectif de ce chapitre est de présenter un bilan avant tout quantitatif de l'offre de soins. Le problème du repérage des cas par le médecin généraliste a été traité en grande partie dans le chapitre II avec le diagnostic et le dépistage. Le risque et le délai d'entrée en institution ont été traités au chapitre III avec les conséquences de la maladie, et les moyens engagés pour le prolonger avec les traitements au chapitre IV. Le cadre d'analyse de ce chapitre est celui fixé par la circulaire du 16 avril 2002 relative à la mise en œuvre du programme d'actions pour les personnes souffrant de la maladie d'Alzheimer ou de maladies apparentées (9) et par la circulaire de mai 2005 faisant suite à l'annonce du plan Alzheimer 2004-2007. Un de nos objectifs est de mettre en évidence les différences inter et intra-régionales de l'offre pour la prise en charge des personnes atteintes de la maladie d'Alzheimer. Autant que faire se peut, les éléments quantitatifs seront mis en regard avec des éléments qualitatifs. La description de l'offre de soins est basée sur un certain nombre de données et une méthode d'analyse. Une grande partie de ces données provient notamment des administrations chargées de la prise en charge des personnes âgées (encadré 1). Encadré 1. Sources des données Les données utilisées sont celles de la direction de la recherche, des études, d'évaluation et des statistiques (DREES), de l'Institut national de la statistique et des études économiques (INSEE), de l'Institut de recherche et documentation en économie de la santé (IRDES) - bases de données Eco-santé, de la direction de l'hospitalisation et de l'offre de soins (DHOS), de la direction générale de l'action sociale (DGAS), des directions régionales des affaires sanitaires et sociales (DRASS) des régions métropolitaines et de la Fédération nationale des observatoires régionaux de santé (FNORS) en relation avec la Fédération Médéric Alzheimer. Enfin une enquête a été réalisée par la Fédération nationale des CMRR auprès des CMRR et des CMP. · Les données de l'INSEE sont celles relatives à un certain nombre d'indicateurs qui ne sont pas directement disponibles dans les autres enquêtes. C'est le cas, par exemple, des données qui portent sur le recensement de la population française en 2002 ; · Les données de l'IRDES-Eco-santé, il s'agit d'un ensemble d'informations centralisées qui concernent tous les secteurs de la santé en France. On y trouve aussi bien des données relatives aux activités et aux personnels du secteur public que du secteur privé ; · Les données issues de la DHOS et des DRASS proviennent, d'une part, de différentes circulaires (30 août 2004, 18 février 2005) ou de projets de circulaire (février et mars 2005), et, d'autre part, des régions comme l'Aquitaine et le Limousin ; · Les données de la FNORS, dont l'harmonisation et la vérification se sont effectuées dans l'ensemble des régions au 31 mars 2003, sont recueillies par questionnaires et entretiens auprès des structures et services de prise en charge de la maladie d'Alzheimer et maladies apparentées et correspondent aux déclarations de ces derniers. L'analyse porte principalement sur la France métropolitaine au niveau régional et départemental (encadré 2). Encadré 2. Méthode L'idée est non seulement de mettre en évidence des disparités géographiques très importantes dans la structuration du diagnostic, de la coordination et de la prise en charge médico-sociale de la maladie d'Alzheimer, mais également de voir si ces disparités intradépartementales ou intrarégionales se compensent ou se cumulent. Pour ce faire, nous distinguons quatre groupes de structures ou services : (i) les lieux de diagnostic, les lieux d'information et/ou de coordination, les réseaux gérontologiques et les structures d'aide aux aidants ; (ii) les modes de prise en charge en ville par la médecine libérale et les structures d'accompagnement et de répit ; (iii) les modes de prise en charge en établissements d'hébergement pour personnes âgées (EHPA) ou en établissements d'hébergement pour personnes âgées dépendantes (EHPAD), et par l'allocation personnalisée d'autonomie (APA) (10) (GIR 4) ; et (iv) l'hôpital. Les lieux de diagnostic comprennent les consultations mémoire, les centres mémoire de ressources et de recherche (CMRR) et d'autres lieux de diagnostic, dont les neurologues libéraux, les services hospitaliers. Les lieux d'information et/ou de coordination gérontologiques sont les centres locaux d'information et de coordination (CLIC). L'intérêt de ce dernier dispositif pour les conseils généraux réside dans « sa valeur ajoutée dans le dispositif APA et l'évaluation des situations individuelles car il regroupe des partenaires divers qui possèdent une bonne connaissance de la population âgée » [276]. Ainsi, le conseil général et l'Etat attribuent aux CLIC un niveau de label (1, 2 ou 3) selon l'étendue de leurs missions et des services offerts (encadré 3). Encadré 3. Labellisation des CLIC · Le label 1 est attribué aux CLIC qui assurent des missions d'accueil, d'écoute, d'information, de conseil et de soutien aux personnes et à leur entourage ; · Le label 2 est attribué aux CLIC qui prolongent les missions de niveau 1 par l'évaluation des besoins des personnes et l'élaboration d'un plan d'aide personnalisé ; · Le label 3 est attribué aux CLIC qui mettent en œuvre, suivent et adaptent un plan d'aide personnalisé. D'autres lieux d'information et de coordination existent également. Ce sont les réseaux et coordinations gérontologiques (encadré 4). En fait, la prise en charge en réseau constitue « une réponse pertinente à la prise en charge spécifique et au suivi des personnes âgées et plus particulièrement des patients atteints de la maladie d'Alzheimer ou maladies apparentées » (Plan Alzheimer 2004-2007, p. 9) [277]. Encadré 4. Réseaux et coordinations gérontologiques · Les réseaux gérontologiques ont pour objectif de répondre aux besoins des personnes âgées par une amélioration de l'efficacité du service rendu. Ils sont constitués de professionnels médico-sociaux et d'institutions (d'hébergement et à domicile) de compétences complémentaires. Ces professionnels jouent le rôle de facilitateurs de l'ajustement rapide des réponses en fonction de l'évolution des besoins des personnes prises en charge ; · Les coordinations gérontologiques visent à mutualiser les ressources en termes d'information des usagers, de formation des professionnels, d'équipements et de services sur un même territoire [278]. A côté des réseaux et coordinations gérontologiques, les structures d'aides aux aidants, dont la plupart sont souvent associatives, jouent aussi un rôle important dans la prise en charge de la maladie. De par leur rôle dans le diagnostic, dans les modes de traitement et dans les soins prodigués, les médecins de ville constituent des acteurs importants dans la prise en charge des malades. La médecine de ville englobe, ici, d'une part, des généralistes et des spécialistes (neurologues, psychiatres et neuropsychiatres) (11) libéraux, et, d'autre part, des infirmiers libéraux. Si les généralistes jouent un rôle fondamental dans l'initiation du processus diagnostique de la maladie d'Alzheimer [279], les spécialistes sont les responsables de la première prescription et les régulateurs de la demande de médicament. Par ailleurs, les infirmiers libéraux sont les coordonnateurs des services de soins infirmiers à domicile (SSIAD) [280]. La prise en charge en ville intègre également les structures d'accompagnement et de répit que sont l'accueil de jour (12) et l'hébergement temporaire. En effet, dans la mesure où la maladie d'Alzheimer retentit sur la vie quotidienne et sociale des personnes malades et de leur entourage, ces structures constituent des alternatives au maintien à domicile. La prise en charge médico-sociale est assurée à deux niveaux : d'une part, au niveau des services d'aide à domicile et, en particulier, les services d'aide aux personnes âgées à domicile (SAPAD) [281] (encadré 5) ; d'autre part, dans les établissements d'hébergement pour personnes âgées (EHPA) ou dans les établissements d'hébergement pour personnes âgées dépendantes (EHPAD). Enfin, la prise en charge à l'hôpital s'opère soit dans des établissements hospitaliers comme les centres hospitaliers universitaires, soit dans certaines maisons de retraite rattachées à l'hôpital. Encadré 5. Services à domicile Le but des SAPAD est de permettre aux personnes âgées de vivre chez elles le plus longtemps possible, même lorsqu'une aide extérieure s'avère nécessaire [281]. Cette perspective se matérialise par la mise à disposition de ces personnes d'un personnel d'aidants professionnels dont le rôle principal est : · d'accomplir certaines activités de la vie quotidienne à leur place ; · ou de les accompagner dans ces tâches (le ménage, la lessive, le repassage, le raccommodage, ou la toilette, l'habillage, l'aide à la prise des repas ou des médicaments, etc.). En fait, en 1999, les EHPA, anciennement séparés en unités de soins de longues durées (USLD), en maisons de retraite (MDR) », en maisons d'accueil pour personnes âgées (MAPAD) » et en maisons d'accueil rurales pour personnes âgées (MARPA), plus ou moins médicalisées, ont été fusionnés dans le cadre unique des établissements d'hébergement pour personnes âgées dépendantes (EHPAD) [282] (encadré 6). Encadré 6. Etablissement d'hébergement pour personnes âgées dépendantes (EHPAD) Un EHPAD est un établissement ayant signé une convention tripartite (13) avec l'Etat et le conseil général dans le cadre de la nouvelle organisation mise en œuvre progressivement depuis 2000. Cette réorganisation s'accompagne d'une réforme de la tarification applicable aux résidents et surtout de dispositions organisationnelles dont l'objectif est d'améliorer la prise en charge sanitaire, notamment dans les maisons de retraite. Dans ce contexte, un EHPAD : · assure un hébergement collectif en chambres individuelles ou doubles ainsi que des services obligatoirement fournis comme l'entretien ménager et le blanchissage ; · a pour objectif d'offrir un hébergement permanent avec une prise en charge globale, dans un cadre de vie communautaire. D'autres structures de prise en charge existent : - les services psychiatriques où sont particulièrement hébergés des sujets jeunes. Du fait du faible effectif de personnes hébergées dans ces structures, elles ne seront pas prises en compte ici ; - les familles d'accueil. Aucune synthèse précise n'existe à l'heure actuelle dans ce domaine. Les autres établissements comme les logements-foyers constituent un ensemble de logements autonomes (parfois aussi des chambres (14) avec des locaux collectifs à vocation sociale (accueil, animation, restauration, blanchissage du linge, surveillance, etc.) et à usage facultatif [39, 283]. Pour mieux analyser la répartition des différentes structures présentées précédemment, les indicateurs utilisés, dans ce chapitre, sont exprimés sous forme de ratios par population cible (encadré 7). Encadré 7. Indicateurs de prise en charge de la maladie d'Alzheimer · Taux d'équipement : nombre de structures ou de places (15) installées pour 1 000 personnes âgées de 75 ans ou plus ou pour 1 000 malades d'Alzheimer ; · Taux d'encadrement : nombre de professionnels libéraux pour 1 000 personnes âgées de 75 ans ou plus · Nombre de personnes âgées de 75 ans ou plus ou de malades d'Alzheimer pour une structure ou une place (un lit). Les deux premiers indicateurs sont d'une grande utilité dans le sens qu'ils permettent d'examiner plus directement la répartition de l'offre de soins destinée aux populations concernées. Le dernier indicateur offre également la possibilité d'analyser non seulement les prévisions relatives à la création de structures comme les consultations mémoire, tel qu'il est envisagé par les circulaires de février et de mars 2005, mais également de mettre en lumière le phénomène dit de « file d'attente ». Ce phénomène apparaît dès lors que l'offre de soins est insuffisante par rapport aux besoins des personnes âgées de 75 ans ou plus ou des malades [284, 285]. Avant de procéder à une analyse de l'offre de soins en termes de disparités géographiques (région, département), il est très utile de mettre en perspective, tout d'abord, la répartition de la population française (en métropole) âgée de 75 ans et plus et, ensuite, celle des bénéficiaires de l'APA âgés de 75 ans et plus (sous forme de taux). La France compte, au 1er janvier 2002, 4 499 097 personnes âgées de plus de 75 ans (INSEE, 2002). La part de cette population dans la population générale n'est pas identique selon les régions (carte en annexe 9). Les régions où la part de personnes âgées de 75 ans et plus est la plus élevée, sont celles du Sud et du Centre, avec un taux dépassant les 110 pour 1 000 de la population totale. De même, l'Alsace, l'Île-de-France et le Nord-Pas-de-Calais figurent parmi les régions les plus jeunes en ce qui concerne les personnes âgées de 75 ans et plus (avec des taux inférieurs à 70 pour 1 000). Le nombre de personnes atteintes de la maladie d'Alzheimer ou de troubles apparentés a été estimé à partir de l'étude Paquid chez les personnes âgées de 75 ans ou plus (cf. Chapitre III). La distribution régionale de cet indicateur laisse apparaître de profondes disparités géographiques. Le nombre de bénéficiaires de l'APA peut être considéré comme un indicateur du taux de dépendance par département. Plus précisément, la répartition par GIR de la grille AGGIR reflète en partie la répartition par degré de sévérité de la maladie d'Alzheimer [286]. Depuis sa mise en place à la suite de la PSD, en 2002, la montée en charge de l'APA s'est tout d'abord faite à un rythme soutenu puis semble maintenant se stabiliser avec un rythme d'entrée proche de celui de sortie [287-289]. Ce qui serait un indicateur de la maturité du système. Outre sa capacité à décrire la dépendance, c'est-à-dire de fournir un indicateur de besoins que l'on peut mettre en regard de l'offre, l'APA en tant que prestation financière solvabilise une demande et, de ce fait, a un effet sur l'offre de soins tant en institution qu'à domicile (graphique 1 en annexe 10). Entre le premier trimestre 2002 et le dernier trimestre 2004, on est passé de 131 000 bénéficiaires de l'APA évalués en GIR 1 à 4 à 865 000, avec une moyenne de 643 727. Par ailleurs, au dernier trimestre 2004, on comptait 59 % de bénéficiaires de l'APA (GIR 1 à 4) à domicile, contre 41 % en établissement (graphique 2 en annexe 10). En outre, il existe de profondes disparités départementales dans l'attribution de l'APA [290]. Le nombre de bénéficiaires de l'APA varie de 100 à 300 pour mille habitants de 75 ou plus entre les départements extrêmes de la France métropolitaine, une variabilité plus forte étant observée pour l'APA attribuée aux personnes évaluées en GIR 4. En effet, les résultats des enquêtes de la DREES montrent que, pour dix départements, dont ceux de la région parisienne, la population de bénéficiaires rapportée à la population âgée est inférieure à 124 et pour dix autres - principalement du Sud-ouest ou du Centre - elle est supérieure à 225 (cartes 2a et 2b en annexe). Jeger fait remarquer par ailleurs que la dispersion pour l'APA à domicile est plus forte que la dispersion pour l'APA en établissement (16). Ces variations s'expliquent à plus de 60 % par la structure sociodémographique des départements. En effet, le nombre de bénéficiaires de l'APA est plus élevé dans les départements à forte population rurale, et dans ceux où la part des agriculteurs et des ouvriers dans la population active a été grande. Il est également important dans les départements où il existe une forte proportion de retraités percevant le minimum vieillesse (Ibid). En référence aux malades d'Alzheimer, le nombre de bénéficiaires de l'APA (GIR 4) pour 1 000 patients s'élève à 510,88, pour une médiane de 505,19. En effet, le rapport entre le département le moins bien - Essonne (258,72) - et le mieux classé - Ariège (757,76) - est de 3. Par ailleurs, on dénombre en moyenne 2,06 malades d'Alzheimer pour un bénéficiaire de l'APA (GIR 4). La distribution du taux de bénéficiaires de l'APA (GIR 4) selon le lieu de vie (domicile ou établissement) présente les mêmes caractéristiques que la distribution globale. Ainsi, il existe en moyenne 270,77 bénéficiaires de l'APA (GIR 4) à domicile pour 1 000 malades d'Alzheimer, pour une médiane égale à 267,75. En établissement, ils sont en moyenne 132,83, avec une médiane de 131,35. En outre, il faut compter 3,88 malades d'Alzheimer pour un bénéficiaire de l'APA (GIR 4) à domicile, contre 7,92 en établissement. Après cette mise en perspective nécessaire, il convient de passer maintenant à l'analyse proprement dite. 1. L'information, la coordination, le diagnostic, les réseaux gérontologiques et les aides aux aidants a) Information et coordination A la fin novembre 2004, en France métropolitaine, 504 CLIC avaient été répertoriés par la DGAS (synthèse des évaluations des 25 CLIC expérimentaux, 2004), soit en moyenne 5,48 par département par niveau de label. Par rapport à la population de référence, on trouve, en France métropolitaine, 0,13 CLIC installés en moyenne pour 1 000 personnes âgées de 75 ans ou plus, pour une médiane égale à 0,12. La répartition des CLIC par personnes âgées de 75 ans ou plus décrit de fortes différences départementales. C'est ainsi que le rapport entre le taux d'équipement du département le mieux doté - l'Ariège (0,70) - et celui du département le moins doté - les Pyrénées-Orientales (0,02) - s'élève à 35. A la fin 2004 ont été répertoriés 143 CLIC de niveau 1 (30 %), 109 de niveau 2 (23 %) et 225 de niveau 3 (45 %). A ce titre, compte tenu de leurs missions, ils sont les plus à même de développer des activités d'information spécialisées à destination des personnes concernées par la maladie d'Alzheimer. En effet, il existe, en France métropolitaine, en moyenne 0,06 CLIC de niveau 3 par département pour 1 000 personnes âgées de 75 ans ou plus, avec une médiane de 0,03. Dans ce contexte, l'écart entre la Lozère (0,38) - département le plus équipé en CLIC 3 - et le Var, la Seine-Maritime, l'Hérault, le Nord et les Bouches-du-Rhône - départements les moins équipés en CLIC 3 (0,01) - va de 1 à 38. En termes de personnels, le profil des professionnels composant les équipes d'un CLIC est très variable d'un territoire à l'autre. Toutefois, du bilan des 25 CLIC expérimentaux, il ressort les principales professions suivantes : médicale, paramédicale, administrative, travailleur social, ingénierie sociale ou DESS social et d'autres compétences différentes et non précisées. Ce qu'il faut noter c'est que, dans certains CLIC, il n'y a ni professionnel médical ni professionnel paramédical. C'est le cas notamment dans les CLIC de niveau 3 à Brive (Corrèze), à St-Rémy-de-Provence (Bouches-du-Rhône) et à Rennes (Ille-et-Vilaine). A partir de là, il devient difficile de médicaliser complètement les CLIC, ce qui plaide en faveur d'un travail d'uniformisation de leur fonctionnement (tableau en annexe 11). En France métropolitaine, il existe au total 104 réseaux gérontologiques, soit 0,04 en moyenne pour 1 000 personnes âgées de 75 ans ou plus, avec une médiane de 0,03. On dénombre, pour un réseau gérontologique, 64 560,48 personnes âgées de 75 ans ou plus, pour une médiane de 40 468,67. Si la plupart des réseaux gérontologiques ne sont pas spécialisés, au moins 1 (réseau mémoire dans la région Nord-Pas-de-Calais) est dédié, en relation avec les consultations mémoire et le CMRR, à la prise en charge des malades d'Alzheimer. Ces réseaux associent à la fois des structures de soins, des établissements d'hébergement et des services de soins infirmiers. Ils mettent donc en relation des institutions sanitaires et médico-sociales. Ils sont financés soit dans le cadre du Fonds d'aide à la qualité des soins des villes (FAQSV), soit dans celui de la Dotation régionale de développement des réseaux (DRDR). A côté de ces réseaux gérontologiques financés par la DRDR, d'autres réseaux thématiques existent ; parmi eux, le réseau Méotis du Nord-Pas-de-Calais et celui de la région parisienne. c) Les centres mémoire de ressources et de recherche (CMRR) et les consultations mémoire de proximité (CMP) En 2003, la France métropolitaine comptait 232 consultations mémoire labellisées, soit 0,05 pour 1 000 personnes âgées de 75 ans ou plus, avec une médiane de 0,04. La répartition entre régions est fortement différentiée, le rapport entre la région la mieux - Lorraine (0,13) - et la moins dotée - Limousin (0,01) - en consultations mémoire est égal à 13. Une enquête d'activité a été réalisée par la Fédération nationale des CMRR auprès des centres mémoire de ressources et de recherche (CMRR) et des consultations mémoires de proximité (CMP) créés à la suite du Plan Alzheimer 2001. La description de leur activité est basée sur les données fournies par 19 CMRR et 38 CMP. Le nombre médian de nouveaux patients vus au cours de l'année 2004 dans les CMRR était de 719 (ce qui signifie que 50 % des CMRR ont vu moins de 719 patients et 50 % ont vu plus de 719 patients), pour un nombre médian du total de patients vu au cours de l'année (file active) de 1332. Les CMP ont, en médiane, pris en charge 147 nouveaux patients sur pour une médiane de file active de 204 patients au total vus au cours de l'année 2004. Parmi ces nouveaux patients, près de 8 % étaient pris en charge à un stade sévère (MMS < 10), 28 % à un stade modéré (MMS compris entre 10 et 20) et 64 % à un stade léger (MMS > 20) dans les CMRR, contre respectivement 7 %, 26 % et 67 % dans les CMP. Parmi l'ensemble des patients vus en CMRR en 2004, 57 % étaient habituellement suivis en consultation simple (par un médecin spécialiste), 27 % en consultation « alourdie » multidisciplinaire (comprenant habituellement une ou deux consultations spécialisés, un bilan neuropsychologique, un bilan socio-psychologique avec l'aidant) et 17 % en hôpital de jour. Pour autant, les pratiques étaient très variables selon les CMRR et les CMP. De même la durée de ces consultations et hospitalisations était très variable. La durée médiane d'une consultation alourdie dans un CMRR en 2004 était de 115 minutes, avec des extrêmes de 45 à 240 minutes. De même dans les CMP, ces consultations avaient une durée médiane de 120 minutes, avec des extrêmes de 45 à 240 minutes. Le nombre médian de consultations par an pour un sujet était de 2 dans les CMRR (extrêmes de 1 à 4) et 2,2 dans les CMP (extrêmes de 1 à 9). Le suivi des patients déments apparaît donc très hétérogène en pratique, l'absence de recommandations en la matière laissant les praticiens confrontés pour leur choix de suivi à leur seule expérience. Le nombre de médecins-équivalent-temps-plein (médecins-ETP) exerçant en CMRR en 2004 était de 2,6 mais inférieur ou égal à 1,5 dans un quart des CMRR. Dans les CMP, le nombre de médecins-ETP en 2004 était de 0,5 et inférieur ou égal à 0,25 dans un quart des centres. 20 % des CMP ne disposaient pas de neuropsychologue et 63 % de psychologue dans leur effectif, contrairement à ce qui est prévu dans le cahier des charges de la circulaire du 16 mars 2002. Les CMRR apparaissaient « mieux » dotés en neuropsychologues (au minimum 0,1 ETP), mais 74 % étaient dépourvus de psychologue. Enfin, le délai médian pour obtenir une première consultation mémoire dans un CMRR en 2004 était de 60 jours, mais supérieur à 102 jours pour un quart des centres, avec un délai maximum de 240 jours, soit huit mois. Ce délai médian était de 60 jours dans les CMP, supérieur à 120 jours dans un quart des centres, pour un maximum de 200 jours, soit jusqu'à 7 mois d'attente pour une consultation dite de proximité. Un tableau détaillant les délais d'obtention de différents actes liés à la pratique d'une consultation mémoire est présenté en annexe. Au regard des effectifs et des délais rencontrés dans la pratique, les moyens dont disposent actuellement les CMP et les CMRR semblent insuffisants pour leur permettre de remplir leur mission. Il semble cependant très difficile de chiffrer ce manque en l'absence de recommandations concernant la conduite du suivi des patients déments, qui permettrait, outre une homogénéisation des pratiques, d'estimer le volume de soins générés par ces patients pour leur suivi et de rapporter ce volume aux moyens dévolus localement pour assurer ce suivi. Les structures d'aide aux aidants sont au nombre de 237 en France métropolitaine. Dans ce cadre, le taux d'équipement moyen par rapport aux personnes âgées de 75 ans ou plus est de 0,06 pour 1 000, avec une médiane égale à la moyenne. Le rapport entre la région la mieux dotée - Limousin (0,12) - et les régions les moins dotées - Languedoc-Roussillon (0,02), Pays-de-la-Loire (0,02), Poitou-Charentes (0,02) et PACA (0,02) - est de 6. La répartition régionale des structures d'aides aux aidants de malades d'Alzheimer présente les mêmes caractéristiques que celle associée aux personnes âgées de 75 ans ou plus. Avec une moyenne de 0,36 structures pour 1 000 malades, l'écart entre la région la moins (Pays-de-la-Loire, 0,12) et la mieux équipée (Limousin, 0,72) va de 1 à 6. Pour une structure d'aides, il y a 3 094 malades, contre 18 984 personnes de 75 ans et plus. 2. La prise en charge en ville Au 1er janvier 2005, on dénombrait en France, selon la base de données d'Eco-santé, 114 227 médecins libéraux [291]. Les généralistes et les spécialistes sont au total 61 678 : 54 405 généralistes et 7 273 spécialistes (763 neurologues, 6 510 psychiatres et neuropsychiatres) [291]. Le taux de généralistes par personne âgée de plus de 75 ans est en moyenne de 11,83 pour 1 000, avec une médiane égale à la moyenne. La distribution de cet indicateur met en lumière certaines disparités régionales, le rapport entre la région la plus dotée - Alsace (15,87) - et la région la moins dotée - Centre (9,35) - étant de 1,70. Pour un médecin généraliste, on compte en moyenne 63,00 personnes de 75 ans ou plus, ou 9,94 personnes atteintes de la maladie d'Alzheimer. Or, un médecin généraliste suit en moyenne 5 cas de démence dont 4 patients d'Alzheimer [279]. En d'autres termes, comme le souligne l'étude IMAGINE, le nombre de cas vus par les médecins généralistes est très faible [292]. La densité des neurologues libéraux est égale, pour la France, à 0,97 pour 1 000 malades d'Alzheimer, avec une médiane à 0,91. Les différences régionales liées à la répartition des neurologues sont plus importantes que celles relatives aux généralistes. En effet, le rapport entre la région la mieux (Corse, 1,85) et la moins pourvue en neurologues par malades d'Alzheimer (Basse-Normandie, 0,49) est de 3,78. Par ailleurs, pour un neurologue, on dénombre en moyenne 7 164,78 personnes de 75 ans et plus, et 1 159,84 malades d'Alzheimer. Le nombre de psychiatres et neuropsychiatres pour 1 000 malades d'Alzheimer est de 6,89, avec une médiane à 5,96. Comme pour les neurologues, la distribution du taux de psychiatres et neuropsychiatres par malades présente une plus grande hétérogénéité que celle qui prévaut pour les généralistes. Ainsi, l'écart entre la région la moins - Nord-Pas-de-Calais (3,48) - et la plus dotée - l'Île-de-France (19,70) - va de 1 à 5,66. Il faut compter, pour un psychiatre et un neuropsychiatre, en moyenne 1 102,97 personnes âgées de 75 ans ou plus, et 178,09 malades d'Alzheimer. On constate ainsi que noté par ailleurs que la répartition des spécialistes et des généralistes n'est pas uniforme. Il n'y a pas substitution entre généraliste et spécialiste. Enfin, au sein des régions, il existe des grands écarts dans la densité de médecins (spécialistes ou généralistes). Compte tenu des évolutions opposées de la démographie médicale et de celle de la maladie d'Alzheimer, l'insuffisance de l'offre va perdurer. Les incitations financières à la prise en charge des malades âgées ne suffiront sans doute pas à améliorer la prise en charge. C'est donc vers des fonctions de coordination ou de conseil qu'il convient de former les praticiens en déléguant des soins à des professions paramédicales. b) Les services de soins infirmiers à domicile (SSIAD) La France métropolitaine compte au total 80 643 places de SSIAD (17), soit un taux d'équipement moyen de 18,25 places pour 1 000 personnes âgées de 75 ans ou plus, et une médiane de 17,93. La distribution de cet indicateur est assez convergente, les écarts entre les régions étant faibles [285]. En effet, le rapport entre le taux d'équipement le plus - 22,30 (Limousin) - et le moins élevé - 16,11 (Haute-Normandie) - est de 1,38. Par ailleurs, pour une place de SSIAD, le nombre de personnes âgées de 75 ans ou plus s'élève à 55,22, et le nombre de malades d'Alzheimer à 8,95. Dans les deux cas, ces résultats mettent en lumière la nécessité de renforcer le secteur des SSIAD en direction des personnes âgées et a fortiori de celle des personnes atteintes de la maladie d'Alzheimer. A cet égard, les mesures récemment prises par le gouvernement en matière de services à domicile semblent répondre à ces besoins. D'autre part, la création de 3 895 places de SSIAD en 2003 et 4 250 places en 2004 était de nature à combler ces déficits liés à l'offre de soins à domicile. Enfin, c'est dans cette optique que 5 400 places, dont 4 978 en France métropolitaine, sont prévues pour l'année 2005 afin d'aider au soutien à domicile des personnes âgées. c) Les structures d'accompagnement et de répit Il existe 263 accueils de jour et 1 096 places, soit une moyenne de 4,85 places pour 1 000 personnes souffrant de la maladie d'Alzheimer, avec une médiane de 0,07. La répartition de cet indicateur au niveau régional présente de profondes disparités. C'est ainsi que l'écart entre la région la moins - Aquitaine (0,07) - et la plus équipée - Haute-Normandie (34,94) - est de 1 à 500. Dans ce contexte, le nombre de personnes atteintes de la maladie d'Alzheimer, pour une place en accueil de jour, est égal à 2 215,91. D'autre part, on dénombre 8590 lits d'hébergement temporaire, soit un taux d'équipement moyen de 11,69 pour 1 000 malades, et une médiane à 10,73. Dans ce cas, le rapport entre la région la mieux - Bourgogne (24,12) - et la moins équipée - Haute-Normandie (3,60) - est de 6,7. Enfin, pour un lit en hébergement temporaire, on compte 105,49 malades d'Alzheimer. Ce qu'il faut noter dans cette analyse, c'est que le déficit de certaines régions en termes d'accueil de jour et d'hébergement temporaire ne s'explique pas toujours par un manque de structures ou de places. Il arrive en fait que certaines DRASS détiennent des crédits suffisants pour la création de ces structures, et que le problème soit un manque de promoteurs pour répondre aux appels d'offre. Ce manque de promoteurs peut s'expliquer de deux manières : d'une part, la plupart des promoteurs sont réticents par rapport à l'accueil de jour et à l'hébergement temporaire car il faut transformer les structures existantes, s'adapter... ; d'autre part, ils ont peur que l'hébergement temporaire devienne de l'hébergement permanent. Par ailleurs, les places en accueil de jour et en hébergement temporaire ne sont pas toujours pourvues, parce que les DRASS ont du mal à utiliser le nombre de places disponibles. C'est le cas, par exemple, des régions Aquitaine et Limousin. L'offre de soins à l'hôpital porte sur 15 % des urgences et 16 400 séjours de plus de 24 heures, avec une durée moyenne d'hospitalisation à 11 jours. Par ailleurs, on note 11 400 séances hors consultations. Comme l'indique le graphique en annexe 12, il existe des différences importantes dans les indices d'hospitalisation (18) selon les régions. Cela varie du simple au double. Ces disparités sont dues en partie à des pratiques différentes selon les hôpitaux. Le taux d'hospitalisation augmente très rapidement à partir de 65 ans. Ainsi, de 437 pour 1 000 chez les 65-74 ans, il passe à 577 pour 1 000 chez les 75-84 ans et à 616 pour 1 000 pour les personnes de plus de 84 ans [293]. L'offre médico-sociale sera analysée, d'une part, sous l'angle des services d'aides à domicile et, d'autre part, selon la prise en charge en institution. a) Les services d'aide à domicile Comme l'indique le tableau en annexe 13, la quasi-totalité des bénéficiaires de services d'aide aux personnes âgées à domicile (SAPAD), soit 95 %, sont aidés pour les tâches ménagères et les petits travaux. En fait, les deux tiers de ces personnes ne sont aidés que pour les tâches ménagères. Par ailleurs, environ 30 % des personnes sont aidées pour les actes essentiels de la vie quotidienne. Il est à noter que 93 % d'entre elles bénéficient conjointement d'une aide pour les tâches ménagères. Il peut s'agir alors de personnes dépendantes et même très dépendantes physiquement [281]. Et parmi ces personnes potentiellement dépendantes, certaines souffrent parfois de démence et de la maladie d'Alzheimer. Ainsi que le souligne le Commissariat général au Plan [294], face à l'augmentation du nombre de services mandataires et prestataires d'aide à domicile, se pose la question de leur qualité et de la confiance qu'on peut leur accorder, ce qui a trait aux problèmes de la compétence des intervenants et de l'encadrement. Alors qu'on observe une multiplication de textes réglementaires, on reste souvent au sein du secteur du maintien au domicile dans un cadre caritatif, où le conseil d'administration est parfois décalé des problèmes du terrain. Aucun financement n'est prévu pour les fonctions logistiques et pour la coordination des interventions. Le personnel d'encadrement de ces services est trop souvent centré sur une gestion administrative du service et passe peu de temps à encadrer les intervenants. L'encadrement devrait pouvoir bénéficier d'une formation technique, mais aussi d'un accompagnement réflexif et d'analyse de pratiques. Le rôle de la direction est fondamental car il doit permettre de donner un sens aux actions accomplies. Pour l'assurance qualité, l'enjeu est de savoir s'il faut suivre le modèle issu de l'industrie, d'abord basé sur le savoir faire technique, ou miser sur une approche plus « relationnelle », intégrer les spécificités de l'aide à l'évaluation de la qualité en se fondant sur la « culture » et le savoir-faire des professionnels. Il existe également un enjeu majeur à décrire la réalité du travail auprès des personnes âgées fragiles, qui va bien au-delà du simple entretien du logement. Cela peut parfois consister à trouver des astuces pour que la personne se déplace plus aisément dans son logement. Il y a un déficit quantitatif de professionnels pour le maintien au domicile. Les personnes sont souvent embauchées du jour au lendemain, sans expérience auprès des personnes âgées, sans formation, et commencent sans formation. La sélection se fait a posteriori, par les démissions ou les licenciements (parfois pour fait de maltraitance, difficile à évaluer en ce domaine). Mais les personnes recrutées sont de moins en moins des personnes en difficulté. On observe un rajeunissement très net du personnel aidant ayant suivi une formation. L'un des soucis reste celui du modèle actuel de formation, jugée inadaptée aux enjeux actuels et futurs de la prise en charge à domicile. Néanmoins, le risque actuel, du fait de l'image négative de ces emplois, et des conditions de travail (notamment des horaires fractionnés) est que ce soit le secteur de la prise en charge institutionnel qui bénéficie de la formation. Les récentes mesures de revalorisation de la convention collective de la branche de l'aide à domicile qui ont permis une augmentation des salaires d'environ 23 % mais aussi la signature d'accords sur la valorisation des acquis de l'expérience dans le secteur public, les mesures fiscales et le financement par la CNSA du fonds de modernisation de l'aide à domicile devraient rendre plus attrayant l'accès aux emplois de services à domicile et renforcer leur professionnalisation. Il reste que la formation des aides à domicile ne comprend pas à l'heure actuelle de module sur la prise en charge spécifique de la maladie d'Alzheimer, ce qui tendrait, comme le souligne le Commissariat général au Plan, à ce que les auxiliaires de vie deviennent des auxiliaires médico-professionnels. Enfin, si le secteur des services à domicile constitue un gisement d'emploi important et que dans cette perspective, il est prévu en principe par le plan Alzheimer de créer 30 000 places sur trois ans, la réalisation de tels objectifs est loin d'être certaine que ce soit pour les emplois d'aide à domicile ou des emplois de soins à domicile. En effet, selon l'UNEDIC (2005), un grand nombre d'offres restent insatisfaites. De plus, la professionnalisation devrait conduire à un risque d'explosion des coûts ; enfin, les établissements d'hébergement de personnes âgées pourraient recruter ce personnel formé. Une dernière question est celle de la formation des personnels chargés de la logistique de l'aide qui n'est pas encore assurée. b) La prise en charge en institution : équipement et personnel L'équipement Selon l'enquête EHPA 2003 réalisée par la DREES auprès des gestionnaires d'établissements, on a 10 526 établissements avec 671 000 places, soit 6 376 maisons de retraites (436 300 places) ; 2 975 logements-foyers (152 900 places) et 1 044 USLD (79 300 lits) (tableau V.1). Sur le total de places installées, 107 000 places, c'est-à-dire, 160 pour 1 000, sont réservées aux personnes atteintes de détérioration intellectuelle, la plupart de ces dernières pouvant être considérés comme des malades d'Alzheimer à un stade sévère ou des personnes souffrant de troubles du comportement. A cet égard, il est à noter qu'il n'existe pas en établissement une tarification spécifique Alzheimer, et que l'information relative aux personnes démentes est basée sur des sources déclaratives [39, 283]. Si l'on ne tient pas compte, au tableau 1, des places en résidence d'hébergement temporaire, on aboutit à peu près aux mêmes données fournies par la FNORS (2003). Dans ces conditions, la France métropolitaine compte 10 350 établissements pour 669 102 places, dont 6 256 maisons de retraite (424 554 places), 3 051 logements-foyers (161 043 places) et 1 043 USLD (83 505 lits) (tableau 2 en annexe). Le taux d'équipement moyen des maisons de retraite s'élève à 99,00 pour 1 000 personnes âgées de 75 ans ou plus, avec une médiane de 100,04. Le rapport entre la région la plus - Limousin (208,58) - et la moins équipée - Corse (29,84) - est de 7, ce qui traduit de fortes disparités régionales. Le nombre de personnes âgées de 75 ans ou plus, pour une place en maison de retraite, est de 11,39. Tableau V.1. Places réservées aux personnes atteintes de détérioration intellectuelle
Source : DRESS (2005) Le nombre de places en maison de retraite par personnes souffrant de la maladie d'Alzheimer est égal à 610 pour 1 000. Or, le tableau en annexe 13 permet de voir que la proportion de places réservées (19) aux malades d'Alzheimer, en maison de retraite, par rapport au total des places, est de 194 pour 1 000. Par conséquent, on peut avancer que, bien que les maisons de retraite soient les premiers établissements d'accueil des personnes atteintes de la maladie d'Alzheimer en termes de capacité, elles n'utilisent pas complètement les places disponibles. En outre, le nombre de malades en maison de retraite, pour une place installée, est en moyenne de 1,84. De ce fait, l'argument relatif à une certaine forme de sous-utilisation des places disponibles doit être nuancé pour deux raisons. D'une part, les chiffres montrent que les maisons de retraite enregistrent un fort taux d'occupation en ce qui concerne l'hébergement des malades d'Alzheimer. D'autre part, comme on le verra ci-dessous, le processus de conversion des maisons de retraite en EHPAD permet d'augmenter considérablement le nombre de places réservées aux personnes dépendantes, dont les malades d'Alzheimer représentent plus de 80 %. Enfin, on notera que la répartition régionale du nombre de places en maison de retraite par malades d'Alzheimer suit logiquement celle relative aux personnes âgées de 75 ans ou plus. Par ailleurs, le taux d'équipement moyen en logements-foyers est de 34,95 pour 1 000 personnes âgées de 75 ans ou plus, avec une médiane à 32,94. L'écart entre la région la moins - Corse (11,78) - et la plus équipée - Haute-Normandie (78,39) - va de 1 à 6,65. Dans ce type d'établissement, pour une place installée, il faut compter 34,35 personnes âgées de 75 ans ou plus. Par rapport aux patients atteints de la maladie d'Alzheimer, les logements-foyers présentent un taux d'équipement moyen de 216 pour 1 000 patients, avec une médiane de 204. Comparativement aux maisons de retraite, les logements-foyers comportent très peu de places par personnes atteintes de la maladie d'Alzheimer et de troubles apparentés (26,16 pour 1 000). Cela s'explique par le fait que ce n'est pas leur vocation première, bien qu'ils abritent sans doute certains patients qui ignorent leur maladie faute de diagnostic. En logements-foyers, on dénombre 5,57 malades pour une place installée. En USLD, le taux d'équipement moyen s'établit à 20 pour 1 000 personnes âgées de 75 ans ou plus. Le rapport entre la région la plus - Alsace (37,69) - et la moins équipée - PACA (9,22) - s'élève à 4. De par leur degré de médicalisation, les USLD sont les établissements qui devraient abriter le plus de malades d'Alzheimer. Pourtant, le nombre de places en USLD par patients Alzheimer est de 124 pour 1 000, alors que le nombre de places réservées en USLD aux malades d'Alzheimer est de 230 pour 1 000. Cette différence est sans doute à imputer à un biais de déclaration. En 2004, on compte au total, 666 997 places en EHPAD, un chiffre qui montre que de nombreuses conventions tripartites ont été signées entre l'Etat, le conseil général et les établissements. En effet, en 2004, 1 225 conventions ont été signées par les régions de la France métropolitaine, soit 61,8 % de réalisations par rapport aux prévisions pour cette année. En outre, depuis l'année 2000, 3 700 conventions ont été signées. Le rythme de signature ne devrait pas ralentir même si l'objectif fixé de 100 % ne devrait pas être atteint en 2005 mais plutôt en 2006. Le taux d'équipement moyen des EHPAD est de 150 pour 1 000 personnes âgées de 75 ans ou plus, la médiane étant de 154. L'allure de la répartition régionale de ce taux présente une certaine hétérogénéité, l'écart entre la région la moins - Corse (51,64) - et la plus équipée - Haute-Normandie (203,45) - étant de 1 à 3,94. Par ailleurs, pour une place installée, on a 7,20 personnes de 75 ans ou plus. En référence aux patients Alzheimer, l'ensemble des EHPAD présente un taux d'équipement moyen de 927 pour 1 000, avec une médiane de 942. Le nombre de malades pour une place en EHPAD est de 1,17. Par conséquent, cette situation met en évidence le phénomène de « file d'attente ». Ainsi, du fait de la montée en puissance des conventions tripartites, les EHPAD, qui abritent essentiellement des patients d'Alzheimer, fonctionnent en surrégime, ce qui pose un véritable problème en termes d'équipement. A cet égard, la création de l'équivalent de 60 nouvelles maisons de retraite en 2004 - un objectif qui passe à 100 maisons de retraite en 2005 [293] - et 5 000 places en EHPAD en 2005 (20), devrait permettre une certaine amélioration. Parallèlement à ce problème d'équipement, cette situation pose également un problème de personnel. Le personnel Au 31 décembre 2003, près de 350 000 personnes (299 000 équivalents-temps plein ou ETP) travaillaient dans les établissements, dont une forte proportion de femmes - 87 % [39]. Ainsi, le taux d'encadrement « global » s'élève à 45 pour l'ensemble du secteur, ce qui traduit une augmentation de 14 points depuis 1996. En fait, ce taux passe de 45 à 57 dans les établissements ayant signé une convention tripartite en vue de devenir EHPAD. Le taux « hors administration et services généraux » suit la même évolution. Dans ce contexte, le personnel paramédical et soignant compte pour 39 % (en ETP) de l'ensemble des effectifs employés par les établissements (dont 27 % pour les aides-soignants, et 8 % pour les infirmiers), un pourcentage qui reste encore faible vu l'importance des enjeux en cours. Toutefois, la poursuite de la médicalisation des établissements s'accompagne de la signature de 1 500 nouvelles conventions tripartites représentant 12 000 créations d'emplois médicaux et paramédicaux, ce qui constitue une véritable avancée. Par ailleurs, dans le cadre du développement de la VAE (validation des acquis de l'expérience) et de la campagne de promotion des métiers sanitaires et sociaux auprès des personnes âgées, il est prévu la formation de 30 000 aides-soignants supplémentaires, soit 10 000 chaque année pendant trois ans. Le problème qui se pose est que, si des places en formation sont prévues, il n'est pas certain qu'elles soient satisfaites. En effet, selon certaines DRASS, il existe un fort besoin en personnel qualifié auquel elles ne peuvent pas répondre. Elles ont besoin du temps pour former le personnel. C'est ce qui arrive dans certaines régions comme le Limousin. Pour elles, la solution réside dans le développement de la politique de VAE. Enfin, concernant la formation, dans la mesure où il est plus confortable pour certains aides-soignants, par exemple, de travailler à l'hôpital, il existe un certain risque que les gens formés pour travailler en institution aillent à l'hôpital. Cependant, ce risque est contourné par la formation du personnel en place et par la VAE. A partir du bilan qui vient d'être dressé, pour chacune des composantes de la prise en charge des personnes âgées de 75 ans ou plus et de celles atteintes de la maladie d'Alzheimer, on observe d'importantes disparités géographiques de l'offre de soins rapportée à la population cible. De plus, ces disparités existent non seulement entre les régions, mais également à l'intérieur de ces dernières au niveau départemental. C'est ainsi que certains départements ou régions cumulent des handicaps, tandis que d'autres sont plutôt bien équipés. Il existe donc, comme il est souligné dans le « Plan Alzheimer 2004-2007 », une forte hétérogénéité dans le maillage du territoire aussi bien au niveau de l'information, de la coordination, du diagnostic, de la prise en charge en ville et de la prise en charge médico-sociale de ces catégories de personnes [277]. Dans ce contexte, l'offre de soins se révèle inadaptée. De plus, les efforts actuels ne combleront pas encore les écarts et les besoins. Au niveau de l'information et de la coordination, on constate que ce ne sont pas les départements les plus riches qui possèdent le plus de CLIC, mais ceux qui comptent le plus de personnes âgées. En ce qui concerne le diagnostic, notamment au niveau des CMRR, il convient de dépasser la norme existante et de développer davantage de structures. A cet égard, dans la mesure où les CMRR sont liées aux CHU, la question qui se pose est de savoir pourquoi l'on ne crée pas un CMRR au moins dans chaque CHU. Il serait opportun d'évaluer combien coûterait un CMRR par département, ou de définir des structures intermédiaires entre les CMP et les CMRR, toutes les structures départementales n'ayant pas vocation à réaliser des travaux de recherche (qui font partie des missions des CMRR). Au niveau de la prise en charge sanitaire et médico-sociale, le choix de privilégier le maintien à domicile ne ressort pas de l'offre. Il y a un balancement entre la volonté de construire des établissements médicalisés et de développer des structures intermédiaires et l'emploi à domicile. Il convient donc de professionnaliser l'offre. Plusieurs recommandations peuvent être faites : 1. Réduire les écarts interrégionaux dans les taux d'équipement en EHPAD. A cet égard, les créations de places prévues pour 2005 grâce notamment au financement par la CNSA devraient répondre à cet objectif. Ces créations visent à réduire les inégalités entre régions en tenant compte aussi bien de leur taux d'équipement que de leur population âgée de plus de 75 ans. 2. Renforcer la création de places dédiées aux malades d'Alzheimer ou aux personnes lourdement dépendantes. Les précisions données dans la circulaire budgétaires 2005 vont dans ce sens, en fournissant une incitation à la création de places spécifiques. Il serait souhaitable que les DRASS ou les DDASS soient attentives à ce point lors de l'instruction des dossiers de conventions. Cette recommandation par ailleurs implique sans doute une plus grande concentration du marché et un recours plus grand aux opérateurs privés. Il faut également réfléchir à des structures d'accueil dédiées aux malades les plus jeunes. 3. S'il convient de limiter la création de places à la prise en charge des démences lourdes, l'accent doit être mis sur la création de petites unités locales pour l'hébergement temporaire en redéployant une partie de l'offre existante en ce sens. Mais aussi, en s'appuyant sur le décret relatif aux petites unités et la création de structure d'accueil de jour. 4. Cet ensemble n'est réalisable sans le renforcement des services d'aide à domicile. Les accords passés sur la valorisation des acquis d'expérience et la professionnalisation sont une première étape. Le renforcement de ces services d'aide à domicile doit se faire par l'appui aux grandes associations d'aide à domicile, des incitations fiscales aux recours aux services des prestataires plutôt qu'à l'emploi direct. Ce qui permettrait à la fois une professionnalisation et donc une amélioration qualitative de l'offre, une maîtrise des coûts par les financeurs et un maintien dans l'emploi par l'amélioration des relations et des conditions de travail. 5. Etudier les possibilités de travail en commun au sein des réseaux des professionnels de la santé en analysant la possibilité de déléguer des tâches médicales aux infirmières. 6. Permettre la prescription aux généralistes afin de rendre plus attrayant le suivi des malades et de réduire la charge des spécialistes. 1 () Dans un entretien accordé au journal Le Monde, dans son édition du mardi 14 septembre 2004. 2 () Il s'agit d'autres formes de démence, par exemple les démences vasculaire, à corps de Lewy, fronto-temporale ou encore celle associée à la maladie de Parkinson. 3 () Article 6 octies de l'ordonnance n° 58-1100 du 17 novembre 1958 relative au fonctionnement des assemblées parlementaires, tel qu'inséré par l'article 2 de la loi n° 2002-1487 du 20 décembre 2002 de financement de la sécurité sociale pour 2003. 4 () Aux termes de l'article 2 de la loi précitée, « la mise en oeuvre de cette loi et des programmes de santé qui précisent son application (...) peut à tout moment faire l'objet d'une évaluation globale ou partielle par l'Office parlementaire d'évaluation des politiques de santé ». 5 () Créée par la loi n° 2004-626 du 30 juin 2004 relative à la solidarité pour l'autonomie des personnes âgées et handicapées. 6 () Les CMP font appel à plusieurs spécialistes médicaux et para-médicaux afin d'établir un diagnostic et bâtir un projet de soins pour le patient, en liaison avec le médecin traitant. Les CMRR ont un rôle de recours pour les diagnostics complexes, de recherche clinique et de formation et de réflexion éthique. 7 () Il s'agit bien entendu d'ordres de grandeurs et non de résultats exacts. 8 () La chance de vieillir, essai de gérontologie sociale, Michel Billé, éditions L'Harmattan, 2004. 9 () Dans ce chapitre, le terme « Alzheimer » fait référence à la maladie d'Alzheimer ou maladies apparentées. 10 () L'APA a remplacé au 1er janvier 2002 la prestation spécifique dépendance (PSD). 11 () La description est fondée sur l'architecture des données disponibles dans Eco-santé. 12 () Il existe également l'accueil de nuit. 13 () Toutefois, il arrive que certaines maisons de retraite qui étaient complètement médicalisées avant cette réorganisation soient de facto EHPAD. 14 () Environ 12 % des logements-foyers proposent un hébergement en chambre en plus de logements (Tugores, 2005). 15 () Ou de lits suivant les structures. 16 () Cela s'explique par le fait que l'entrée en établissement d'une personne âgée résulte le plus souvent d'un état de dépendance sévère, dont la prise en compte dépend moins de la politique propre du département que l'attribution de l'APA à domicile. 17 () Au 31 décembre 2004 (circulaire du 18 février 2005 relative à la campagne budgétaire). 18 () Indice d'hospitalisation calculé par rapport à une population totale de référence. 19 () Hormis les places en résidence d'hébergement temporaire. 20 () Circulaire du 18 février 2005. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||