N° 3441
______
ASSEMBLÉE NATIONALE
CONSTITUTION DU 4 OCTOBRE 1958
QUATORZIÈME LÉGISLATURE
Enregistré à la Présidence de l’Assemblée nationale le 26 janvier 2016.
RAPPORT D’INFORMATION
DÉPOSÉ
en application de l’article 145-7 du Règlement
PAR LA COMMISSION DES AFFAIRES SOCIALES
sur la mise en application de la loi n° 2013-442 du 30 mai 2013
portant réforme de la biologie médicale,
ET PRÉSENTÉ PAR
MM. Jean-Louis TOURAINE et Arnaud ROBINET,
Députés.
——
INTRODUCTION 7
I. LES TEXTES D’APPLICATION : ÉTAT DES LIEUX 11
1. L’application de la loi de 2013 11
2. L’application de l’ordonnance de 2010 12
3. Des textes très attendus et parfois contestés 12
II. LA MÉDICALISATION DE LA BIOLOGIE MÉDICALE : DES PRINCIPES À LA RÉALITÉ 13
A. LA NOTION D’EXAMEN DE BIOLOGIE MÉDICALE : UN PÉRIMÈTRE STABILISÉ 14
B. LE RÔLE INCONTESTÉ DU BIOLOGISTE MÉDICAL 18
1. Le rôle clé du biologiste médical 19
a. La notion de biologiste médical 19
b. L’application des recommandations de bonne pratique 19
c. La situation particulière des examens en situation d’urgence 20
2. La notion de biologiste responsable 21
3. Le biologiste et la question des examens situés en dehors du laboratoire 22
C. L’ACCÈS À LA PROFESSION DE BIOLOGISTE MÉDICAL : DES DISPOSITIFS QUI RESTENT À PRÉCISER 27
1. Les dispositions prévues par les textes en vigueur 27
a. Les personnes justifiant d’un titre de formation 28
b. Les autres possibilités d’accès à la profession de biologie médicale 29
2. Des mesures d’application contestées 31
D. LES DÉROGATIONS À L’INTERDICTION DES RISTOURNES CONSTITUENT ENCORE UNE PIERRE D’ACHOPPEMENT 34
1. Le régime de l’interdiction de la ristourne 34
2. Une question qui fait encore débat 36
3. Le régime juridique issu de la loi de 2013 doit être préservé 37
III. LA PÉRENNITÉ DE L’OFFRE DE BIOLOGIE MÉDICALE DE PROXIMITÉ : UN ENJEU MAJEUR 38
A. LA MODIFICATION DU PAYSAGE DE LA BIOLOGIE MÉDICALE 38
1. Les facteurs du regroupement 38
2. Une dynamique de restructuration encore inachevée 39
B. L’ENCADREMENT DE LA FINANCIARISATION : UN OBJECTIF EN DEVENIR 42
1. Le contrôle des ARS : des pouvoirs limités ? 42
2. L’application des dispositions contrariée par la publication tardive des textes. 44
3. L’exploitation des laboratoires de biologie médicale privés 47
a. Les formes d’exploitation 47
b. Les sociétés d’exercice libéral 47
C. LES PERSPECTIVES 50
1. La financiarisation : une question éminemment sensible 50
2. Des mesures d’application attendues 52
3. Des pistes complémentaires 53
IV. LA « QUALITÉ PROUVÉE » : UN DÉFI QU’IL RESTE À RELEVER 54
A. LA DÉMARCHE D’ACCRÉDITATION : UNE MISE EN PLACE POUSSIVE 54
1. Une démarche inédite 55
a. Une mise en œuvre progressive 55
b. Le champ de l’accréditation est balisé 57
c. L’accréditation repose sur un système de normes 57
d. Le rôle majeur joué par le Cofrac 60
2. Un bilan en demi-teinte 61
a. Une démarche acceptée par les parties prenantes 61
b. Une visibilité accrue du nombre de laboratoires 63
c. Des défis sont encore à relever 63
d. Le rôle du Cofrac dans la mise en œuvre de la réforme 77
B. LES CONTRÔLES DE QUALITÉ DES LABORATOIRES DE BIOLOGIE MÉDICALE 79
C. LES INSPECTIONS MENÉES PAR LES ARS 81
TRAVAUX DE LA COMMISSION 83
ANNEXES : 97
ANNEXE 1 : DÉCRETS PRÉVUS PAR LOI DU 30 MAI 2013 RELATIVE À LA BIOLOGIE MÉDICALE 97
ANNEXE 2 : ARRÊTÉS PRÉVUS PAR LA LOI DU 30 MAI 2013 PORTANT RÉFORME DE LA BIOLOGIE MÉDICALE 99
ANNEXE 3 : DÉCRETS PRÉVUS PAR L’ORDONNANCE DU 13 JANVIER 2010 RELATIVE À LA BIOLOGIE MÉDICALE 100
ANNEXE 4 : ARRÊTÉS PRÉVUS PAR L’ORDONNANCE DU 13 JANVIER 2010 RELATIVE À LA BIOLOGIE MÉDICALE 102
ANNEXE 5 : EXEMPLE DE COURRIER D’ACCUSÉ DE RÉCEPTION PAR LE COFRAC D’UNE DEMANDE D’ACCRÉDITATION 105
ANNEXE 6 : LISTE DES PERSONNES AUDITIONNÉES PAR LE RAPPORTEUR 107
Initiée avec le rapport Ballereau (1), la réforme de la biologie médicale intègre aujourd’hui les nouvelles exigences de la médecine ainsi que celles du droit communautaire. Elle avait notamment suivi un rapport de l’inspection générale des affaires sanitaires portant un « état des lieux de la biologie médicale, 30 ans après la publication de la loi du 11 juillet 1975 » (2). En effet, l’organisation de ce secteur datait de 1975 et n’apparaissait plus adaptée aux nombreux défis contemporains (financiarisation, règles communautaires applicables au secteur de la santé, mondialisation).
Dans cette optique, l’article 69 de la loi du 21 juillet 2009 portant réforme de l’hôpital et relative aux patients, à la santé et aux territoires (HPST) (3) a autorisé le Gouvernement, dans les conditions prévues par l’article 38 de la Constitution, à prendre par ordonnance, dans un délai de six mois à compter de la publication de la loi, toutes mesures relevant du domaine législatif, réformant les conditions de création, d’organisation et de fonctionnement des laboratoires de biologie médicale (LBM). Cet ordonnance visait à :
– harmoniser les dispositions applicables aux LBM publics et privés ;
– mieux garantir la qualité des examens de biologie médicale, notamment en mettant en place une procédure d’accréditation des laboratoires ;
– définir les missions du biologiste, du LBM et du personnel technique dans le cadre du parcours de soins du patient, en assurant 1’efficacité des dépenses de santé ;
– instituer les mesures permettant d’assurer la pérennité de l’offre de biologie médicale dans le cadre de 1’organisation territoriale de 1’offre de soins ;
– éviter les conflits d’intérêts et garantir l’autorité du biologiste responsable sur l’activité du LBM ;
– adapter les missions et prérogatives des agents habilités à effectuer 1’inspection des LBM ;
– adapter le régime des sanctions administratives et pénales ;
– disposer que les LBM privés doivent être exploités en nom propre ou sous la forme d’organismes à but non lucratif, de sociétés civiles professionnelles régies par la loi n° 66-879 du 29 novembre 1966 relative aux sociétés civiles professionnelles, de sociétés d’exercice libéral (SEL) régies par la loi n° 90-1258 du 31 décembre 1990, ou de sociétés coopératives régies par la loi n° 47-1775 du JO septembre 1947.
Ratifiée par la loi du 30 mai 2013 (4), l’ordonnance du 13 janvier 2010 relative à la biologie médicale (5) s’est attachée à atteindre ces objectifs en réformant en profondeur la biologie médicale. Plusieurs axes ont ainsi été identifiés :
– l’affirmation du caractère médical de la profession au travers de la nouvelle définition de l’examen de biologie médicale, de la qualification du biologiste médical et de l’importance du dialogue entre ce dernier et le médecin-clinicien ;
– la garantie de la même qualité d’examens à tous nos concitoyens sur l’ensemble du territoire national au travers de l’accréditation à 100 %. Les laboratoires, publics comme privés, ont jusque 2020 pour se mettre en conformité avec cette exigence, différents jalons ayant été fixés entre 2013 et ce terme ;
– la lutte contre la financiarisation du secteur au travers de la préservation des droits des biologistes en exercice, la définition de règles prudentielles et la mise en place de contrôles exercés par les agences régionales de santé (ARS).
Les rapporteurs ont souhaité réinvestir ces trois enjeux dans le cadre du rapport d’application.
À cinq mois du troisième anniversaire de la publication de la loi, un peu de plus de cinq ans après l’entrée en vigueur de l’ordonnance, le bilan de son application apparaît mitigé.
En effet, le dispositif de la réforme de la biologie médicale n’est pas complètement stabilisé alors que l’on observe une réorganisation en profondeur du paysage des laboratoires de biologie médicale privés comme public. Les principaux textes d’application n’ont pas encore tous été publiés laissant l’ensemble des acteurs dans une situation inconfortable.
L’accès à la fonction de biologiste médical n’est pas complètement stabilisé faute de texte applicable ou de consensus sur leur rédaction.
Au regard des bouleversements à venir portant sur la biologie médicale, le choix, opéré par le législateur, d’exclure du champ de l’accréditation les actes d’anatomie et de cytologie pathologiques est aujourd’hui, plus que jamais, source d’interrogation.
La mise en œuvre de l’accréditation arrive également à un tournant. Une première étape avait été fixée en novembre 2013, les laboratoires ayant à faire la démonstration de l’entrée effective dans la démarche d’accréditation. Les acteurs s’accordent à penser que cette étape a été franchie avec succès tout en soulignant le caractère relativement formel et léger de cette obligation. La réalisation du prochain objectif, consistant à accréditer 50 % des examens de biologie médicale et au moins un examen par famille au 31 octobre 2016, nourrit aujourd’hui beaucoup d’inquiétudes. Cette étape suppose que les laboratoires puissent affronter de concert les restructurations et la réorganisation qu’implique la démarche d’accréditation. Elle interroge aussi la capacité de l’instance nationale d’accréditation, le comité français d’accréditation (Cofrac) à traiter l’ensemble des dossiers d’accréditation. La route est encore longue et les obstacles sont encore nombreux comme en témoigne la difficulté à recruter des biologistes médicaux pour procéder aux nécessaires évaluations techniques. Or, cette réforme, novatrice, est très scrutée par nos voisins européens. Son aboutissement fera de la France le seul pays ayant engagé une vaste démarche d’accréditation dans la biologie médicale. Il importe d’être à la hauteur de cet enjeu.
Enfin, au regard de la réorganisation importante des laboratoires de biologie médicale, la mission de régulation des ARS se révèle plus que jamais nécessaire. Cette mission est aujourd’hui malmenée faute de dispositif d’application. Cette situation nuit à l’esprit de la réforme, en ce qui concerne notamment le volet de lutte contre la financiarisation.
I. LES TEXTES D’APPLICATION : ÉTAT DES LIEUX
1. L’application de la loi de 2013
L’état des lieux de la publication des textes d’application nécessite de prendre en compte non seulement ceux qui relèvent de la loi du 30 mai 2013 mais également les mesures relevant de l’ordonnance, elle-même ratifiée par l’article premier.
Les annexes précisent l’état des lieux selon le périmètre retenu et s’attachent, au-delà des décrets, à recenser les mesures d’application nécessitant un arrêté.
Pour la seule loi de 2013, trois articles correspondant à sept items distincts nécessitaient la parution de décrets (articles 8, 11 et 13).
Deux décrets ont déjà été publiés relatifs au remplacement des biologistes médicaux à titre temporaire (6) et aux modalités d’exercice des biologistes médicaux (7). Deux autres décrets doivent encore être publiés.
De nombreuses dispositions relatives aux conditions de réalisation des examens de biologie médicale sont intégrées dans un texte conséquent dont la publication est imminente. Ce décret en Conseil d’État relatif à la biologie médicale est très attendu par l’ensemble des acteurs.
Enfin, un dernier décret en Conseil d’État s’attache à préciser les modalités spécifiques de la procédure d’accréditation des laboratoires de biologie médicale en outre-mer. Ce texte, finalisé, n’attend plus que la sortie du décret précédemment cité pour paraître.
S’agissant plus particulièrement des arrêtés, quatre articles supposaient la parution de cinq arrêtés. Deux d’entre eux sont en attente de publication.
L’article 7, insère un nouveau L. 6213-2 au sein du code de la santé publique, et prévoit les conditions d’exercice des fonctions de biologiste médical au sein des CHU par des professionnels non titulaires du diplôme d’études spécialisées de biologie médicale. Un arrêté doit encore être pris à cet effet. Sa publication nécessitait, au préalable la publication du décret précité relatif aux modalités d’exercice des biologistes médicaux.
L’article 9, qui insère un nouvel article L. 6211-8-1 dans le code de la santé publique, prévoit la parution d’un arrêté listant les examens réputés urgents.
2. L’application de l’ordonnance de 2010
Sur les six articles que compte l’ordonnance de 2010, trois nécessitaient la publication de décrets simples ou en Conseil d’État.
Quatre textes avaient été publiés dans la foulée de la rédaction de l’ordonnance et donc avant l’adoption de la loi de 2013. Ils ont trait aux règles liées à l’exercice de la profession de technicien de laboratoire médical.
Quatre autres textes devaient encore être publiés à la date d’adoption de la loi portant réforme de la biologie médicale. Ils concernent les articles premier, 2 et 3 de l’ordonnance.
Le décret précité, relatif aux modalités d’exercice de la biologie médicale, permet l’application de certaines mesures relevant de l’article premier de l’ordonnance.
Plusieurs dispositions relevant également de l’article premier nécessitent encore la parution d’un décret en Conseil d’État :
– les conditions de réalisation des examens de biologie médicale, notamment la transmission des échantillons entre laboratoires, sont intégrées dans le décret Conseil d’État relatif à la biologie médicale, dont la publication est imminente ;
– les dispositions relatives aux sociétés exploitant les laboratoires, qui incluent des orientations visant à lutter contre la financiarisation du secteur, relèvent d’un texte dont la publication est également imminente ;
– les dispositions relatives aux sanctions administratives applicables en matière de biologie médicale, qui constituent le levier d’action des ARS, tardent à être publiées. Un projet de texte est en rédaction, le ministère espérant une publication au cours du premier trimestre 2016.
3. Des textes très attendus et parfois contestés
De nombreux acteurs, parmi lesquels les rapporteurs, regrettent l’important laps de temps qui a été pris pour rédiger les textes d’application. Un constat amer s’impose : près de trois ans après la réforme, les textes les plus attendus n’ont toujours pas été publiés. Il en est ainsi des dispositions relatives aux règles prudentielles, qui visent à juguler la financiarisation du secteur, largement débattues et approuvées par le législateur.
Les rapporteurs regrettent également que la volonté de concertation n’ait pu aboutir, dans certains cas, à la recherche d’un consensus. Sitôt publié, le décret relatif aux modalités d’exercice de la biologie médicale, précédemment cité, a ainsi fait l’objet d’une vive contestation de la part des représentants de biologistes médicaux, quelques organisations ayant manifesté leur souhait d’engager un contentieux. Le ministère a toutefois accédé aux revendications exprimées mais au prix d’un texte modificatif, retardant d’autant la publication d’arrêtés d’application tout aussi importants. Le décret prévoit notamment l’institution d’une instance, la commission nationale de biologie médicale, dont l’installation est aujourd’hui retardée en raison de divergences portant sur la composition d’une de ses formations. Or, la parution d’arrêtés comme l’examen de dossiers d’accès à la profession de biologiste médical supposent l’installation effective de la commission.
On le voit, l’application de la réforme de la biologie médicale est aussi débattue qu’elle l’a été au sein du Parlement. C’est évidemment le signe de l’intérêt que les acteurs portent porte à ces nouvelles orientations. C’est aussi la manifestation de leurs grandes attentes qui ne doivent pas être déçues.
Les rapporteurs se félicitent des efforts de dialogue entre les biologistes médicaux et les services du ministère de la santé et les encouragent à persévérer dans cette voie constructive pour éviter d’inutiles, longs et lourds contentieux.
II. LA MÉDICALISATION DE LA BIOLOGIE MÉDICALE : DES PRINCIPES À LA RÉALITÉ
Face à la tentation de réduire la biologie médicale à une simple analyse, la mission conduite par M. Ballereau a souhaité insister sur le caractère prégnant de la dimension médicale. Considérant que cette discipline consistait en premier ressort à apporter une réponse à une question clinique par un examen approprié, la mission Ballereau a tracé les contours de la réforme. Elle a notamment souligné l’importance du dialogue permanent entre biologistes et cliniciens à chaque étape de l’examen de biologie médicale. La réforme opérée par l’ordonnance de 2010 s’inscrit dans le cadre de ces recommandations de bon sens.
L’ordonnance de 2010 a ainsi renforcé le caractère médical des examens de biologie en réaffirmant plusieurs fondements.
Elle a tout d’abord posé comme principe qu’un biologiste médical est, en France, soit un médecin, soit un pharmacien, disposant en outre d’un diplôme de spécialité en biologie médicale ou d’une qualification délivrée par l’Ordre des médecins ou des pharmaciens.
Elle a ensuite précisé la notion d’examen médical selon un déroulement en trois phases (phase pré-analytique, phase analytique et phase post-analytique).
Elle a enfin précisé les catégories de professionnels de santé autorisés à réaliser, hors du laboratoire de biologie médicale, les prélèvements d’échantillons biologiques aux fins d’un examen de biologie médicale et la phase analytique de l’examen de biologie médicale en vue d’une décision thérapeutique en urgence.
Les rapporteurs, qui ont souhaité réinvestir cet enjeu, s’accordent à penser que les objectifs sont en passe d’être remplis. Quelques ajustements doivent encore être opérés.
A. LA NOTION D’EXAMEN DE BIOLOGIE MÉDICALE : UN PÉRIMÈTRE STABILISÉ
Un examen de biologie médicale est un acte médical qui concourt à la prévention, au dépistage, au diagnostic ou à l’évaluation du risque de survenue d’états pathologiques, à la décision et à la prise en charge thérapeutiques, à la détermination ou au suivi de l’état physiologique ou physiopathologique de l’être humain.
L’ordonnance de 2010 a circonscrit le périmètre de l’examen de biologie médicale en précisant ce que la notion recouvre. La base juridique de l’examen de biologie médicale est aujourd’hui stabilisée et n’est pas contestée. Des doutes demeurent sur la légitimité des exclusions souhaitées par le législateur :
– dans une décision rendue le 4 avril 2014, le Conseil constitutionnel a clos le débat portant sur tests, recueils et traitements de signaux biologiques à visée de dépistage, d’orientation diagnostique ou d’adaptation thérapeutique immédiate ;
– la question de l’encadrement des examens d’anatomie cytologie pathologiques reste encore pendante et mériterait de trouver une clarification à la lumière des évolutions constatées aujourd’hui dans l’exercice de la biologie médicale.
● Un acte médical
En premier lieu, le législateur a entendu affirmer que l’examen de biologie médicale ne saurait se réduire à une simple phase analytique. Jusqu’à la ratification de l’ordonnance de 2010, une certaine confusion existait entre la notion d’analyse de biologie médicale et celle d’examen de biologie médicale.
L’article L. 6211-2 fait reposer l’examen de biologie médicale sur un triptyque : une phase pré-analytique, une phase analytique, et une phase post-analytique. À chacune de ces phases, l’interaction entre les éléments cliniques et le travail du biologiste est importante.
La phase pré-analytique permet ainsi de recueillir les éléments cliniques pertinents. Au cours d’un dialogue avec le patient et, le cas échéant, avec le clinicien, le biologiste cerne les éléments indispensables à la réalisation de l’analyse de biologie médicale à proprement parler.
Lors de la phase post-analytique, l’interprétation du résultat, qui s’effectue en fonction du contexte clinique, doit déboucher sur la formulation d’un conseil auprès du patient ou même du clinicien.
L’ensemble de ces éléments vise à positionner la biologie médicale comme une activité de santé et non de service comme l’a rappelé le rapport Ballereau.
Article L. 6211-2 du code de la santé publique
« Un examen de biologie médicale se déroule en trois phases :
1° La phase pré-analytique, qui comprend le prélèvement d’un échantillon biologique sur un être humain, le recueil des éléments cliniques pertinents, la préparation, le transport et la conservation de l’échantillon biologique jusqu’à l’endroit où il est analysé ;
2° La phase analytique, qui est le processus technique permettant l’obtention d’un résultat d’analyse biologique ;
3° La phase post-analytique, qui comprend la validation, l’interprétation contextuelle du résultat ainsi que la communication appropriée du résultat au prescripteur et, dans les conditions fixées à l’article L. 1111-2, au patient, dans un délai compatible avec l’état de l’art. »
● L’exclusion des actes des actes d’anatomie et de cytologie pathologiques (ACP)
L’article 4 de loi portant réforme de la biologie médicale a explicitement exclu de la définition des examens de biologie médicale les actes d’anatomie et de cytologie pathologiques pratiqués par des médecins spécialistes de ce domaine.
Cette précision, inspirée de la version de l’article L. 6211-1 antérieure à l’ordonnance du 13 janvier 2010, permet de clarifier la définition de la biologie médicale : bien que différente de l’anatomie et de la cytologie pathologiques, ces disciplines restent encore confondues.
Les deux disciplines jouent par ailleurs un rôle important en matière de diagnostic et de détermination des décisions thérapeutiques. Selon le rapport Ballereau, « l’objet principal de l’anatomie et la cytologie pathologiques est d’établir un diagnostic de maladie. Les « pathologistes » déterminent la nature et la forme de la maladie à partir d’un prélèvement de cellules ou de tissus. Les « pathologistes » posent un diagnostic précis, rédigent un compte rendu, et permettent au clinicien de prescrire un traitement médical ou chirurgical adapté à la maladie et au patient ».
Sans exclure à terme un rapprochement des deux disciplines, le rapport excluait provisoirement l’anatomie et la cytologie pathologiques des mesures proposées pour la biologie médicale. Il était en effet difficile de replacer les actes d’anatomie et de cytologie pathologiques sous forme des trois phases pré-analytique, analytique et post-analytique, le traitement des prélèvements se révélant encore actuellement le plus souvent individualisé et non automatisé.
Cette disposition a fait l’objet d’échanges lors du passage du texte au Parlement. En effet, certains examens d’anatomie et de cytologie pathologiques pourraient offrir des garanties de qualité différentes selon le laboratoire. Le législateur a finalement choisi de ne pas inclure cette discipline sauf dans le cas où un examen est réalisé dans un LBM : dans ce dernier cas, l’accréditation s’impose.
Pour quelques acteurs, cette exclusion ne trouve aujourd’hui plus de justification. Deux raisons sont ainsi avancées.
La Haute Autorité de santé (HAS) insiste ainsi sur les mutations importantes qui affectent aujourd’hui le secteur de la biologie médicale avec la part de plus en plus importante accordée à la biologie moléculaire. Appelée à devenir la discipline de droit commun de la biologie médicale, la biologie moléculaire efface quelque peu les frontières entre les disciplines de biologie médicale et d’anatomie et de cytologie pathologiques. Compte tenu de l’hétérogénéité des résultats liés à la qualité des examens qui sont pratiqués, la HAS considère comme préoccupant le fait que la biologie moléculaire, qui techniquement entre dans le champ de l’anatomie et la cytologie pathologiques, ne soit pas concernée par la réforme instaurant la démarche d’accréditation.
Les agences régionales de santé soulignent, quant à elles, le fait qu’aucun texte ne puisse être opposé pour contrôler les actes d’anatomie et de cytologie pathologiques effectués en dehors de LBM alors qu’elles réceptionnent des signalements de fonctionnement dangereux. Selon les ARS, il importe de réinvestir ce domaine par des textes appropriés aux spécificités de cette discipline médicale.
En pratique, les services du ministère chargé de la santé ont indiqué que le système d’information est d’ores et déjà paramétré pour intégrer, dès que cela sera prévu par les textes, les laboratoires d’anatomie et de cytologie pathologiques.
Pour être engagée, cette démarche suppose cependant des fondements d’ordre législatif.
Proposition n° 1 :
Engager une démarche d’accréditation pour les actes d’anatomie et de cytologie pathologiques.
● L’exclusion des tests, recueils et traitements de signaux biologiques à visée de dépistage, d’orientation diagnostique ou d’adaptation thérapeutique immédiate
L’article L. 6211-3 du code de santé publique exclut également du champ des examens de biologie médicale les tests, recueils et traitements de signaux biologiques à visée de dépistage, d’orientation diagnostique ou d’adaptation thérapeutique immédiate.
Il prévoit qu’un arrêté du ministre chargé de la santé, pris après avis du directeur de l’Agence nationale de sécurité du médicament (ANSM) et d’une commission composée notamment de professionnels de santé, établisse la liste exhaustive de ces actes, mais aussi des personnes pouvant les réaliser ainsi que les conditions de leur réalisation.
Un arrêté a effectivement été pris le 11 juin 2013 (8).
Liste des tests, recueils et traitements de signaux biologiques qui ne constituent pas un examen de biologie médicale aux termes de l’arrêté du 11 juin 2013
L’article premier de l’arrêté précise la liste des tests, recueils et traitements de signaux biologiques qui ne constituent pas un examen de biologie médicale. Il s’agit :
– des tests pratiqués dans le cadre du diagnostic biologique de l’infection à virus de l’immunodéficience humaine (VIH 1 et 2), du test rapide d’orientation diagnostique dans les situations d’urgence ;
– des tests ou recueils et traitements de signaux biologiques réalisés par le public, au moyen de dispositifs destinés par le fabricant à être utilisés comme autodiagnostics, dans le cadre d’un environnement domestique, conformément au 3° de l’article R. 5221-4 du code de la santé publique ;
– des tests, recueils et traitements de signaux biologiques réalisés par les infirmiers (certains tests urinaires et test capillaire d’évaluation de la glycémie) ;
– des tests, recueils et traitements de signaux biologiques réalisés par les sages-femmes (certains tests urinaires, test capillaire d’évaluation de la glycémie, mesures transcutanées des paramètres d’oxygénation, etc..) ;
– des tests, recueils et traitements de signaux biologiques réalisés par les médecins ou sous leur responsabilité par un autre professionnel de santé (certains tests urinaires, test capillaire d’évaluation de la glycémie, mesures transcutanées des paramètres d’oxygénation, test oro-pharyngé d’orientation diagnostique des angines à streptocoque du groupe A, test naso-pharyngé d’orientation diagnostique de la grippe, test capillaire de détection de l’état immunitaire vis-à-vis du tétanos, etc..) ;
– des tests, recueils et traitements de signaux biologiques réalisés par les pharmaciens d’officine dans un espace de confidentialité (test capillaire d’évaluation de la glycémie, test oro-pharyngé d’orientation diagnostique des angines à streptocoque du groupe A, test naso-pharyngé d’orientation diagnostique de la grippe).
L’arrêté dispose que les tests ou recueils et traitements de signaux biologiques constituent des éléments d’orientation diagnostique sans se substituer au diagnostic réalisé au moyen d’un examen de biologie médicale. Le texte prévoit aussi que « le patient en est explicitement informé par le professionnel de santé qui les réalise » et qu’ « il est également informé des moyens de confirmation par un examen de biologie médicale si la démarche diagnostique ou thérapeutique le justifie ».
Le Conseil d’État a cependant été saisi par le syndicat national des médecins biologistes (SNMB) aux termes d’une requête sommaire et d’un mémoire complémentaire enregistrés en août et novembre 2013 afin d’annuler l’arrêté précité pour excès de pouvoir.
Différents griefs étaient mis en avant à l’appui de ce recours, tenant notamment à l’irrégularité de la procédure ainsi qu’à l’extension de la réalisation des actes à d’autres personnes que les biologistes médicaux.
À l’occasion de ce recours, le SNMB a soulevé une question prioritaire de constitutionnalité au motif d’incompétence négative du législateur affectant le droit à la protection de la santé garanti par la Constitution. Il contestait la rédaction de l’article L. 6211-3 du code de la santé publique dont le dispositif renvoyait à un arrêté la liste des actes concernés ainsi que les catégories de personnes pouvant réaliser ceux-ci. En opérant ce renvoi, le législateur aurait méconnu sa propre compétence. Jugeant sérieux l’argument soulevé par le SNMB, le Conseil d’État (9) a saisi le Conseil constitutionnel qui a finalement jugé cet article conforme à la Constitution le 4 avril 2014 : « l’article L. 6211-3 n’a pas habilité le pouvoir réglementaire à adopter des dispositions qui mettent en cause des règles ou des principes fondamentaux que la Constitution place dans le domaine de la loi » (10).
Le Conseil d’État n’en a pas moins annulé l’arrêté pris en 2013 en raison d’une irrégularité de procédure (11), la commission prévue par l’article L. 6211-3 n’ayant pas été consultée faute de base réglementaire (12). En effet, à la date de la parution de l’arrêté, le décret en Conseil d’État déterminant, en application des dispositions de l’article L. 6213-12, la composition de cette commission n’était pas encore intervenue. Le même arrêt a mis à la charge de l’État la somme de 3 000 euros à verser au syndicat requérant au titre des dispositions de l’article L. 761-1 du code de justice administrative.
Le décret relatif à la commission est aujourd’hui publié mais aucun nouvel arrêté n’a encore été pris (13). Selon les informations transmises aux rapporteurs, un nouvel arrêté strictement identique sera publié dès l’installation de la commission. Le décret portant institution de la commission, bien que publié, fait encore l’objet de quelques divergences qui devraient être levées avec la publication d’un décret modificatif (cf. infra).
B. LE RÔLE INCONTESTÉ DU BIOLOGISTE MÉDICAL
Le biologiste médical est investi d’une importante responsabilité en étant amené à interpréter les résultats des examens qu’il réalise et à répondre de leur qualité. La réforme de la biologie médicale, qui s’inscrit autour de la médicalisation de l’examen de biologie, a précisé le rôle du biologiste, sa responsabilité ainsi que les conditions d’exercice de cette profession de santé.
1. Le rôle clé du biologiste médical
a. La notion de biologiste médical
L’article L. 6211-7 repositionne le biologiste médical au centre du dispositif en disposant que l’examen de biologie médicale « est réalisé par un biologiste médical ou, pour certaines phases, sous sa responsabilité ». La portée de la responsabilité est aussi précisée par l’article L. 6211-11 avec la qualification juridique du biologiste-responsable du laboratoire.
L’article L. 6211-7 confie tout d’abord au biologiste médical la réalisation de l’examen médical ou, pour certaines phases, la responsabilité de leur exécution. Il s’agit d’un élément clé du dispositif qui constitue avec le dialogue biologico-clinique un aspect majeur de la médicalisation de la biologie médicale. Ces principes conditionnent aujourd’hui l’exercice de la mission du biologiste médical.
Le dialogue clinico-biologique, c’est-à-dire l’échange d’informations entre le médecin et le biologiste médical, se manifeste aussi bien durant la phase pré-analytique (recueil des éléments cliniques pertinents) que durant la phase post-analytique où le biologiste doit assurer une interprétation contextuelle du résultat (14). Il se caractérise en outre au stade de la prescription dans la mesure où selon l’article L. 6211-8 l’examen de biologie médicale est réalisé sur le fondement d’une prescription qui contient les éléments cliniques pertinents du patient. À cet égard, rappelons que, lorsqu’il l’estime approprié, le biologiste médical peut proposer au clinicien de modifier la prescription.
b. L’application des recommandations de bonne pratique
C’est dans ce contexte que le biologiste médical est invité à suivre les recommandations de bonne pratique émises par la haute Autorité de santé. L’article L. 6211-9 dispose que, sauf avis contraire du prescripteur, les recommandations de bonne pratique édictées par la Haute Autorité de santé (HAS) s’imposent au biologiste médical qui assure la conformité des examens à celles-ci.
Selon les informations transmises aujourd’hui aux rapporteurs, il existe actuellement 32 recommandations de la HAS susceptibles de permettre l’adaptation de la prescription.
Tous les acteurs s’accordent à reconnaître que les biologistes médicaux sont suffisamment outillés pour appliquer les recommandations de bonne pratique émises par la HAS. Plusieurs difficultés doivent cependant être soulignées.
Le conseil national de l’ordre des pharmaciens (CNOP) estime que les recommandations de bonnes pratiques pourraient être mieux mises en valeur compte tenu de l’importance du dialogue clinico-biologique. Selon le CNOP, l’absence d’application des recommandations peut provenir des difficultés de recueillir ces éléments cliniques pertinents et/ou de recommandations parfois en décalage tant avec l’état de l’art médical qu’avec le point de vue des sociétés savantes nationales ou internationales.
De leur côté, les ARS estiment que dans le cadre de la juste prescription et de la lutte contre les surprescriptions, l’application des recommandations de la HAS n’est pas suffisamment optimisée. Les ARS soulignent que les échanges avec les médecins prescripteurs sont plus difficiles à organiser dans le secteur libéral.
c. La situation particulière des examens en situation d’urgence
L’article 9 de la loi portant réforme de la biologie médicale a enfin introduit une nouvelle disposition énoncée à l’article L. 6211-8-1 qui prescrit aux biologistes médicaux la responsabilité des examens dans des délais compatibles avec l’état de l’art, y compris dans les situations d’urgence.
Il confie aussi aux ARS la responsabilité de prendre en compte les situations d’urgence dans l’organisation territoriale des soins. En conséquence, les ARS doivent s’assurer de l’organisation d’un maillage territorial suffisant de sites dotés d’un plateau technique réalisant des examens réputés urgents.
Le texte prévoit que la liste des examens réputés urgents est fixée par arrêté.
La communication des résultats d’examen dans les situations d’urgence et dans des délais compatibles avec l’état de l’art et les besoins cliniques des patients constitue à cet égard un enjeu essentiel. Il ne peut être dissocié de celui du regroupement des LBM, de la multiplication des sites et de l’éloignement entre sites pré et post-analytiques et sites analytiques (cf. III).
L’éloignement peut s’avérer incompatible avec la prescription de l’article L. 6211-8-1 surtout en cas d’urgence. Cette question peut constituer une véritable pierre d’achoppement.
Or, l’arrêté relatif aux examens couplés aux situations urgentes n’est toujours pas publié à ce jour. Selon les informations transmises aux rapporteurs, « la rédaction de cet arrêté n’est pas aisée car ce sont le plus souvent les situations cliniques qui sont urgentes et pas les examens en tant que tels ». Pour les acteurs auditionnés, cet arrêté a peu de chance d’être publié rapidement, en raison des controverses qu’il suscite ainsi que des prises de responsabilité qu’il engendre.
Conscients des enjeux portés par cet arrêté, les services du ministère de la santé ont indiqué que l’application de la réforme de la biologie médicale supposait de se concentrer au préalable sur la parution des décrets régissant la réforme de la biologie médicale. De fait, les cycles de concertation avec les professionnels du secteur ont principalement concerné ces textes dont la publication est imminente. La prochaine étape sera l’engagement d’une concertation sur les dispositions nécessitant un simple arrêté. Au surplus, la parution de cet arrêté nécessite également la consultation de la commission nationale de biologie médicale dont l’installation n’est pas encore effective (cf. infra).
Dans cette attente, les ARS indiquent que les conditions de prise en charge de ces situations d’urgence s’appuient sur celles définies par le volet biologie médicale du schéma régional d’organisation des soins (SROS) des ARS (délais notamment de transport des échantillons prélevés devant être très restreints, voire nuls).
Proposition n° 2 :
Engager la concertation avec les professionnels sur les examens réputés urgents ainsi que les conditions de réalisation et de rendu des résultats.
2. La notion de biologiste responsable
Le droit en vigueur comporte aussi un volet important consacré au biologiste-responsable.
Aux termes de l’article L. 6213-7 du code de la santé publique, le biologiste-responsable est un biologiste médical exerçant la direction d’un laboratoire de biologie médicale. L’article L. 6213-9 dispose, en outre, qu’il en est le représentant légal, à l’exception des laboratoires à but non lucratif.
Pour mémoire, il existe, dans certaines structures, la possibilité d’avoir des biologistes-coresponsables, dans la mesure où elles permettent l’existence de plusieurs responsables légaux. Ce cas de figure est prévu par l’article L. 6213-9.
Comme le prévoyait le rapport Ballereau, le biologiste-responsable est investi de plusieurs missions.
L’article L. 6211-11 dispose qu’il « conserve la responsabilité de l’ensemble des phases de l’examen de biologie médicale, y compris lorsque l’une d’elles […] est réalisée, en tout ou en partie, par un autre laboratoire de biologie médicale que celui où il exerce, ou en dehors d’un laboratoire de biologie médicale ». Cette responsabilité est double puisqu’elle concerne à la fois le suivi de l’acte médical (cf. supra) et du dialogue avec le clinicien mais également le suivi de la procédure d’accréditation engagée par le laboratoire (cf. IV).
Pour mémoire, il est enfin rappelé que le biologiste responsable veille enfin au bon fonctionnement du laboratoire dont il exerce la direction :
– en sa qualité de représentant légal, c’est lui, qui au terme de l’article L. 6222-1, dépose la déclaration d’ouverture auprès de l’agence régionale de santé. Il lui communique également l’attestation provisoire délivrée par l’instance d’accréditation établissant qu’il satisfait aux critères d’accréditation (cf. IV). Enfin, il déclare à l’ARS toute modification relative à l’organisation générale du laboratoire ou à sa structure juridique et financière ;
– l’article L. 6213-11 prévoit également que le biologiste-responsable informe le directeur général de l’agence régionale de santé « lorsque des décisions prises par la personne physique ou morale qui exploite le laboratoire de biologie médicale apparaissent au biologiste-responsable comme de nature à mettre en cause la santé des patients et la santé publique ou les règles de fonctionnement du laboratoire » ;
– l’article L. 6221-7 prévoit en outre que le biologiste-responsable du laboratoire de biologie médicale déclare immédiatement tout événement affectant son fonctionnement et susceptible d’entraîner un risque majeur pour la santé des patients. Cette déclaration est transmise à la Haute Autorité de santé, à l’Agence nationale de sécurité du médicament et des produits de santé, à l’Agence de la biomédecine et à l’agence régionale de santé.
3. Le biologiste et la question des examens situés en dehors du laboratoire
Des dérogations au principe du déroulement de l’examen au sein du laboratoire de biologie médicale sont prévues par la loi. Les conditions restent strictes étant précisé que la responsabilité du biologiste médical du laboratoire auquel le patient s’adresse est toujours en jeu. Ces règles ont été précisées par les textes d’application.
● Les articles L. 6211-13 à L. 6211-15 encadrent les conditions du prélèvement d’un examen de biologie médicale réalisé dans un autre lieu que le laboratoire. L’opération de prélèvement, qui relève de la phase pré-analytique, peut être réalisée dans un établissement de santé, au domicile du patient ou dans tout autre lieu en permettant la réalisation.
Deux cas de figure sont prévus par les articles L. 6211-14 et L. 6211-15 :
– lorsqu’il n’est pas réalisé dans un établissement de santé, le prélèvement, pour être effectué, s’inscrit dans le cadre d’une convention établie entre le laboratoire et le professionnel de santé ou le représentant légal de la structure à laquelle il appartient ;
– lorsque le prélèvement est réalisé par un professionnel de santé exerçant au sein du même établissement de santé que celui dont relève le laboratoire de biologie médicale, les procédures sont déterminées avec le biologiste responsable du laboratoire concerné. Selon les informations transmises aux rapporteurs, un projet de décret en Conseil d’État préciserait que les procédures feraient l’objet d’une inscription dans un « manuel unique ».
Le second alinéa de l’article L. 6211-13 dispose enfin que la catégorie des professionnels de santé et les lieux permettant la réalisation du prélèvement sont fixés par voie d’arrêté. Ce dernier a été publié en août 2014 (15) et devrait prochainement faire l’objet d’une modification. Un projet d’arrêté rectificatif a fait l’objet d’un avis favorable du Haut Conseil des professions paramédicales le 25 juin dernier. Il doit également faire l’objet d’un avis de la Commission nationale de biologie médicale créée par le décret n° 2015-1152 du 16 septembre 2015 mais non encore constituée (cf. infra).
L’article premier précise les catégories de professionnels de santé concernées. Comme attendu, ce champ couvre les professions médicales (médecins, chirurgiens-dentistes et sages-femmes) et les auxiliaires médicaux (infirmiers, techniciens de laboratoire médical ou manipulateurs d’électroradiologie médicale). Selon les informations transmises aux rapporteurs, le projet d’arrêté modificatif devrait inclure les masseurs-kinésithérapeutes parmi les professionnels de santé habilités à faire des prélèvements à la demande de ces derniers.
Les articles 2 et 3 précisent dans quels lieux, autres que le site d’un laboratoire de biologie médicale, l’établissement de santé ou le domicile du patient, le prélèvement d’un échantillon biologique peut être réalisé.
Il s’agit bien entendu des cabinets médicaux ou d’infirmiers, des lieux d’interventions d’aide médicale urgente mais aussi d’autres structures (santé au travail, établissements ou services médico-sociaux, centres de rétention administrative).
Il s’agit aussi de certaines structures de santé habilitées à effectuer des consultations particulières (maladies infectieuses transmissibles, addictologie).
Liste des lieux autorisés à réaliser des prélèvements d’échantillon biologique
« Article 2. Lorsque le prélèvement d’un échantillon biologique ne peut être réalisé ni au site d’un laboratoire de biologie médicale, ni dans un établissement de santé, ni au domicile du patient, il peut l’être dans :
1) Les cabinets médicaux et les cabinets de sages-femmes ;
2) Les cabinets d’infirmiers ;
3) Les cabinets de chirurgie dentaire ;
4) Le lieu d’intervention d’aide médicale urgente sur une personne justifiant des soins immédiats ;
5) Les véhicules sanitaires lors d’un transport sanitaire médicalisé, en cas d’urgence ;
6) Les lieux d’exercice du service de santé au travail ;
7) Les centres de santé définis à l’article L. 6323-1 du code de la santé publique ;
8) Les maisons de naissance mentionnées par la loi no 2013-1118 du 6 décembre 2013 ;
9) Les établissements ou services médico-sociaux cités aux 6°, 7° et 9° de l’article L. 312-1 du code de l’action sociale et des familles ;
10) Les hôpitaux d’instruction des armées, les services médicaux d’unité et les centres médicaux des armées ;
11) Les centres de rétention administrative. »
« Article 3. Le prélèvement d’un échantillon biologique peut également être réalisé dans :
1) Les centres d’examen de santé pratiquant les examens périodiques de santé mentionnés aux articles L. 321-3 et R. 321-5 du code de la sécurité sociale ;
2) Les services de consultations de dépistage anonyme et gratuit prévues à l’article L. 3121-2 du code de la santé publique ;
3) Les établissements ou organismes habilités en tant que centre d’information, de dépistage et de diagnostic des infections sexuellement transmissibles prévus à l’article L. 3121-2-1 du même code pour le dépistage des maladies infectieuses transmissibles ;
4) Les centres de soins, d’accompagnement et de prévention en addictologie prévus à l’article L. 3411-4 pour le diagnostic des hépatites virales. »
Dans tous les cas, le prélèvement est effectué par un professionnel de santé conformément à des procédures déterminées avec le biologiste responsable du laboratoire.
Cette exigence est motivée par l’accréditation, qui couvre toutes les phases de l’examen de biologie médicale. S’agissant d’une démarche orientée vers le respect des référentiels de qualité et des procédures de mise en œuvre de la démarche de qualité, il importe en effet que, dans l’intérêt du patient, le processus soit réalisé en bonne intelligence avec la démarche du laboratoire.
● L’article L. 6211-18 encadre les conditions dans lesquelles la phase analytique d’un examen peut être réalisée en dehors d’un laboratoire en cas d’urgence. Celle-ci peut être réalisée par des professionnels de santé habilités soit dans un établissement de santé soit dans un lieu déterminé. Les catégories de professionnels concernés et les lieux sont déterminés par voie d’arrêté.
Si la lecture des résultats est assurée par le médecin, la validation des résultats revient toujours au biologiste médical, cette phase constituant le cœur de la discipline médicale.
L’arrêté du 13 août 2014 précité fixe en ses articles 4 et 5 les professionnels de santé concernés et les lieux.
L’article 4 dispose que les catégories de professionnels de santé habilités à réaliser, en dehors du laboratoire de biologie médicale, la phase analytique des examens de biologie médicale en vue d’une décision thérapeutique en urgence, sont les médecins, les sages-femmes, les infirmiers, les techniciens de laboratoire médical et les personnes autorisées à exercer ces fonctions en application des articles L. 4352-3-1 (16) et L. 4352-3-2 (17) du code de la santé publique.
L’article 5 circonscrit les lieux aux véhicules sanitaires lors d’un transport sanitaire médicalisé.
Dans tous les cas, la phase analytique ne peut s’effectuer sans l’établissement de procédures déterminées par, ou en lien avec, le biologiste responsable.
● L’article L. 6211-19 prévoit le cas dans lequel un laboratoire de biologie médicale n’est pas en mesure de réaliser un examen de biologie médicale. Dans cette hypothèse, il peut transmettre à un autre laboratoire de biologie médicale les échantillons biologiques à des fins d’analyse et d’interprétation. Cette transmission ne peut toutefois excéder, pour une même année civile, un pourcentage fixé par la voie réglementaire et compris entre 10 % et 20 % du nombre total d’examens réalisés par le laboratoire.
L’article 6 du décret du 10 octobre 2011 (18) a fixé le taux à 15 %. Il précise par ailleurs le champ du dénominateur qui comprend les examens de biologie médicale mentionnés à l’article 2 du même décret soit :
– le nombre d’examens effectués à partir de prélèvements réalisés par le laboratoire ou réalisés sous sa responsabilité et dont la phase analytique a été soit effectuée par celui-ci soit effectuée sous sa responsabilité en application de l’article L. 6211-18 du code de la santé publique ;
– le nombre d’examens effectués à partir de prélèvements réalisés par le laboratoire ou réalisés sous sa responsabilité et transmis à un autre laboratoire de biologie médicale à des fins d’analyse et d’interprétation ;
– le nombre d’examens effectués à partir de prélèvements transmis par un autre laboratoire de biologie médicale à des fins d’analyse et d’interprétation.
La question du taux retenu a bien évidemment été abordée dans le cadre des auditions menées par les rapporteurs. Le choix de ce taux constitue un levier du regroupement des LBM. Il concerne en réalité les examens que les LBM ne peuvent pratiquer compte tenu de leur faible volumétrie : certains examens pointus nécessitent en effet une expertise et une qualification spécifiques associées à des équipements adaptés.
Certains acteurs ont émis l’idée de porter le taux à 25 % afin de favoriser l’accès à l’innovation et l’excellence des examens de biologie médicale. Il n’est pas surprenant que cette demande émane des laboratoires multisites dont la taille autorise une concentration des moyens. Cette revendication est à mettre au regard des règles prudentielles édictées dans le cadre de la réforme de la biologie médicale, en particulier l’obligation de détention de la majorité du capital social par des biologistes en exercice ainsi que la localisation des sites de laboratoires au plus sur trois territoires de santé (cf. III). La combinaison du taux de 15 % et de ces deux dernières mesures limiterait en effet l’extension des laboratoires. Si les rapporteurs sont sensibles aux mesures permettant d’encourager l’innovation, ils se montrent plutôt réservés quant à une modification inappropriée du taux alors que ses premiers effets n’ont pas encore été mesurés. Au demeurant, le choix du taux reflète la recherche d’un équilibre entre concentration des moyens et maintien d’une activité de proximité envers les patients.
D’après les informations transmises aux rapporteurs, le décret relatif à la biologie médicale qui serait prochainement publié laisserait ce taux de 15 % inchangé.
● Deux autres dispositifs prévoient enfin la possibilité de retransmettre un échantillon biologique à un laboratoire tiers.
L’article L. 6211-19 permet la retransmission vers un laboratoire de référence dont la liste fait l’objet d’un arrêté.
Les services du ministère chargé de la santé indiquent qu’un décret visant à définir ce qu’est un laboratoire de référence sera prochainement pris à cet effet. Il prévoirait à cet effet un cahier des charges en vue d’un appel d’offres. La publication de ce décret est un préalable nécessaire à l’établissement de la liste par voie d’arrêté. Ce décret est rédigé mais n’est pas encore complètement finalisé. Une phase de concertation sera ensuite lancée pour en consolider le périmètre.
Interrogé sur ces dispositions, l’établissement français du sang (EFS) a fait valoir les spécificités de son activité et souhaiterait pouvoir inclure certains de ses laboratoires dans la liste de référence même si les rapporteurs conviennent que la transfusion sanguine constitue sa mission principale. En effet, L’EFS a concentré les analyses complexes de biologie moléculaire (Marseille, Brest et Henri Mondor) et de dosage pondéral (Lille) dans certains laboratoires. L’EFS indique que « pour certaines analyses complexes et/ou rares, il est essentiel de permettre à l’EFS de centraliser l’expertise sur un nombre limité de ses laboratoires » qui doivent ainsi être identifiés comme « laboratoires de référence ». Faute de reconnaissance, l’organisation souhaitée ne pourra être mise en place « puisque ces laboratoires, qui interviennent tous systématiquement en seconde intention, n’auront pas le droit de leur retransmettre l’échantillon ».
Proposition n° 3 :
Tenir compte des spécificités de l’établissement français du sang dans l’élaboration de la liste des laboratoires de référence
– l’article L. 6211-20 permet la retransmission vers un autre laboratoire dans le cas particulier des contrats de coopération. Prévus par l’article L. 6212-6, des contrats de coopération peuvent être signés en vue de mutualiser les moyens. Ils sont conclus entre plusieurs laboratoires situés soit sur un même territoire de santé, soit sur des territoires limitrophes. Cette disposition n’a, pour le moment, pas été investie par les LBM la priorité ayant été d’abord mise sur le regroupement par fusion ou acquisition dans le secteur libéral ou par le biais des groupements hospitaliers de territoire dans le secteur public.
C. L’ACCÈS À LA PROFESSION DE BIOLOGISTE MÉDICAL : DES DISPOSITIFS QUI RESTENT À PRÉCISER
Aux termes de l’article L. 6213-1 du code de la santé publique, le biologiste médical regroupe les médecins biologistes et les pharmaciens biologistes. Au 1er janvier 2015, on dénombre 7 495 pharmaciens biologistes et 2 814 médecins biologistes en 2014, soit un total de 10 300. Rapporté à une population de 65 millions d’habitants, on compte ainsi un biologiste pour 6 500 habitants.
1. Les dispositions prévues par les textes en vigueur
La loi du 30 mai 2013, en ratifiant l’ordonnance relative à la biologie médicale, consacre le rôle clé du biologiste médical, responsable de l’examen. Elle consacre ainsi l’abandon des termes de « directeur de laboratoire » au profit d’une appellation plus adapté à la nature des examens pratiqués. Cette évolution témoigne de l’intérêt qu’il convient de porter au caractère proprement médical de la fonction de biologiste. Cette raison justifie que l’accès à la profession ne puisse se faire que sur présentation de titres ou de diplômes et que les dérogations soient strictement encadrées :
– les dispositions couvrent les personnes justifiant d’un diplôme ou d’un titre permettant d’exercer la fonction, qu’ils soient ressortissants nationaux ou étrangers ;
– des dispositions particulières ont également été introduites pour tenir compte de la situation particulière de certaines personnes non qualifiées en biologie médicale, soit qu’elles disposent d’une expérience à faire valoir, soit qu’elles ont commencé une formation non encore sanctionnée par un diplôme à la date de publication de l’ordonnance ;
– enfin, les textes prévoient la possibilité de remplacer le biologiste médical à titre temporaire.
a. Les personnes justifiant d’un titre de formation
Il peut s’agir d’un médecin titulaire de l’un des titres de formation mentionnés à l’article L. 4131-1 ou d’un pharmacien titulaire de l’un des titres de formation mentionnés aux articles L. 4221-2, L. 4221-4 et L. 4221-5.
Dans les deux cas, les articles visent le diplôme français d’État, qui constitue l’un des titres de formations dûment mentionnés si l’intéressé est ressortissant d’un État membre de l’Union européenne ou partie à l’accord sur l’espace économique européen.
En plus de ces exigences minimales, l’impétrant doit aussi justifier d’une compétence en biologie médicale sanctionnée :
– soit par un diplôme de spécialité dont la liste est fixée par arrêté du ministre chargé de la santé. Un arrêté du 10 juin 2010 (19) précise que l’intéressé doit être titulaire du diplôme d’études spécialisées de biologie médicale, cette exigence s’appliquant aux médecins et aux pharmaciens. Le même arrêté prévoit aussi que cette spécialisation est également reconnue aux médecins ressortissant de l’Union européenne ou d’un État membre de l’espace économique européen justifiant par une attestation d’un titre de formation obtenu dans la spécialité de biologie clinique ;
– soit par la délivrance d’une qualification délivrée par l’ordre des médecins ou par l’ordre des pharmaciens, dans des conditions déterminées par décret en Conseil d’État.
S’agissant de l’ordre des médecins, la délivrance de la qualification est encadrée par un décret daté de 2004 (20).
Au moment de la réforme de la biologie médicale, il a été constaté que seul l’ordre des médecins avait obtenu, par la loi, la possibilité de qualifier un médecin dans toutes les spécialités médicales. Aussi, les textes prévoient-ils désormais que l’ordre des pharmaciens puisse également remplir cette mission.
En application de la loi, un décret daté du 12 octobre 2010 (21) prévoit la reconnaissance d’une qualification médicale aux pharmaciens ne disposant pas d’un diplôme de spécialité en biologie médicale.
L’article 2 du décret dispose que « l’obtention de la qualification en biologie médicale relève de la compétence de l’ordre national des pharmaciens », la décision étant prise « par le conseil central gérant la section G de l’ordre des pharmaciens, après avis de la commission de première instance de qualification en biologie médicale ». Cette décision peut faire l’objet d’un appel devant le « conseil national de l’ordre des pharmaciens, qui statue après avis de la commission d’appel de qualification en biologie médicale constituée auprès de lui ».
Pour se voir reconnaître cette qualification, le pharmacien doit justifier d’une formation et d’une expérience répondant aux exigences requises pour l’obtention du diplôme d’études spécialisées en biologie médicale.
L’article 5 dispose enfin que la composition des commissions de première instance et d’appel de qualification en biologie médicale ainsi que la procédure d’examen des dossiers sont fixées par arrêté du ministre chargé de la santé, pris après avis du Conseil national de l’ordre des pharmaciens. Cet arrêté a été pris le 1er mars 2012 (22).
Depuis le 17 septembre 2012, le conseil national de l’ordre des pharmaciens indique avoir traité 114 dossiers et rendu 48 décisions favorables.
b. Les autres possibilités d’accès à la profession de biologie médicale
Les intéressés peuvent être appelés à exercer en raison d’une autorisation ministérielle ou du suivi d’une formation antérieure et non sanctionnée par un diplôme à la publication de l’ordonnance.
● Il peut s’agir d’un médecin autorisé à exercer la biologie médicale en application des articles L. 4111-2 et L. 4131-1-1 ou d’un pharmacien autorisé à exercer la biologie médicale en application des articles L. 4221-9, L. 4221-12, L. 4221-14-1 et L. 4221-14-2. Les dispositions visent les autorisations individuelles délivrées par le ministre chargé de la santé pour l’exercice de la profession de médecin ou de pharmacien par des ressortissants ressortissant d’un État de l’Union européenne, d’un État partie à l’espace économique européen ou d’un État tiers.
● L’article L. 6213-2 reconnaît par ailleurs la qualification de biologiste médical dans certaines circonstances :
– pour les personnes qui, à compter de l’entrée en vigueur de l’ordonnance du 13 janvier 2010, remplissent les conditions d’exercice de la biologie médicale ou qui ont exercé la biologie médicale pendant une durée équivalente à deux ans au cours des dix années antérieures dans un établissement de santé (public, privé d’intérêt collectif ou de transfusion sanguine). La validation peut être autorisée par le ministre chargé de la santé après avis d’une commission, instituée à l’article L. 6213-12, dont l’installation est notamment conditionnée par la publication d’un arrêté (23) ;
– pour les vétérinaires qui ont commencé une formation de spécialité avant la date de publication de l’ordonnance et qui ont obtenu une spécialisation en biologie médicale au plus tard six ans après la date de publication de l’ordonnance ;
– pour les directeurs ou directeurs adjoints des centres nationaux de référence pour la lutte contre les maladies transmissibles mentionnés aux articles L. 1413-4 et L. 1413-5, par autorisation du ministre chargé de la santé, après avis de la commission prévue à l’article L. 6213-12 (1).
● L’article 7 de la loi ouvre une nouvelle disposition, insérée à l’article L. 6213-2-1. Il prévoit une procédure de recrutement pour les professeurs des universités-praticiens hospitaliers (PU-PH). Il accorde la possibilité à certains médecins ou pharmaciens non titulaires du diplôme d’études spécialisées (DES) de biologie médicale d’accéder à des postes hospitalo-universitaires.
Cette voie de recrutement concerne les centres hospitaliers universitaires et les établissements qui leur sont liés par convention. Une décision ministérielle est requise après avis de la commission prévue à l’article L. 6213-12.
La mise en œuvre de la procédure de recrutement pour les professeurs des universités-praticiens hospitaliers pose ainsi plusieurs difficultés.
Cette voie de recrutement spécifique pose ainsi problème pour les syndicats de jeunes biologistes pour lesquels « prévoir un diplôme d’études spécialisées et considérer que celui-ci n’est pas forcément nécessaire pour obtenir un poste en CHU n’inciterait pas les internes en médecine à choisir la biologie médicale ».
Pour d’autres acteurs, au contraire, cette voie de recrutement ne doit pas être tarie dans la mesure où la biologie médicale constitue, dans les CHU, la plaque tournante de l’articulation entre la discipline clinique et la recherche fondamentale. Si l’on souhaite positionner la biologie médicale française à un haut degré d’expertise et d’innovation, il importe de maintenir un vivier de chercheurs susceptibles de décrypter les évolutions de la discipline et de diffuser les nouvelles techniques par leur enseignement. Cette voie permet ainsi de maintenir un certain degré de connaissance quant aux évolutions frappant la biologie médicale ce que le programme de DES ne permet pas aujourd’hui.
À cet égard, les représentants hospitalo-universitaires ont regretté le retard pris dans la publication des textes d’application et notamment de la commission chargée d’émettre un avis sur les nominations envisagées.
Comme cela a déjà été souligné, les textes nécessaires à l’installation de la commission prévue par l’article L. 6213-12 n’ont été publiés qu’en septembre 2015 mais font l’objet de contestations. En l’absence de décret, la jurisprudence autorisait toutefois l’application du régime d’autorisation antérieur à la publication de l’ordonnance. Le Conseil d’État a ainsi enjoint au ministre en charge de la santé de réexaminer dans un délai limité une demande d’autorisation d’exercer la biologie à laquelle il avait refusé de répondre. Cette injonction a ainsi été assortie d’une astreinte de 500 euros par jour de retard (24).
● Le remplacement à titre temporaire
L’article L. 6213-10-1 du code de la santé publique prévoit, par dérogation, le remplacement du biologiste médical à titre temporaire par dérogation aux articles L. 6213-1 et L. 6213-2. À cet effet, le biologiste médical est tenu d’aviser l’ARS de ce remplacement au moins quinze jours avant son caractère effectif.
Selon les représentants des internes, les remplacements de biologistes médicaux sont assez fréquents et nombre de certificats sont délivrés par les ordres. Néanmoins, il apparaît, selon les ARS, que les biologistes responsables ne respectent pas leur obligation d’aviser les ARS concernées dans le délai imparti.
2. Des mesures d’application contestées
Un décret daté du 16 septembre 2015 (25) précise la procédure permettant d’obtenir la reconnaissance d’un exercice de biologie médicale dans un domaine de spécialisation. Le texte prévoit aussi les conditions dans lesquelles les directeurs ou directeurs adjoints des centres nationaux de référence pour la lutte contre les maladies transmissibles, et les médecins et pharmaciens des centres hospitaliers non qualifiés en biologie médicale, peuvent exercer la fonction de biologiste médical.
Le texte institue également la tant attendue commission prévue à l’article L. 6213-12, à savoir la commission nationale de biologie médicale dont le régime est codifié aux articles R. 6213-15 à R. 6213-28 du code de la santé publique.
Placée auprès du ministre chargé de la santé, elle est consultée sur les projets d’arrêtés et de décisions en lien avec la biologie médicale. Elle peut aussi être consultée sur les projets de décret relatifs aux conditions et modalités d’exercice des biologistes médicaux et peut être saisie, pour avis, par le ministre chargé de la santé sur toutes autres questions portant sur cette matière.
La commission est présidée par un professeur d’université-praticien hospitalier (PU-PH) biologiste médical, désigné par arrêté du ministre chargé de la santé pour une durée de cinq ans renouvelable. Un vice-président, également PU-PH biologiste médical, est nommé dans les mêmes conditions.
Composition de la commission nationale de biologie médicale
« Art. R. 6213-17. – I.- Sont membres de droit de la commission :
« 1° Le directeur général de l’offre de soins ;
« 2° Le directeur général de la santé ;
« 3° Le directeur général pour l’enseignement supérieur et l’insertion professionnelle.
« II.- Sont également membres de la commission :
« 1° Le directeur général de l’Agence nationale de sécurité du médicament et des produits de santé ou son représentant ;
« 2° Le président du collège de la Haute Autorité de santé ;
« 3° Le directeur général de l’Agence de la biomédecine ;
« 4° Le directeur général du Comité français d’accréditation ;
« 5° Le directeur général de l’Union nationale des caisses d’assurance maladie ;
« 6° Le président de la conférence des présidents de commission médicale d’établissement de centre hospitalier universitaire ;
« 7° Le président de la conférence des directeurs généraux de centre hospitalier universitaire. »
« Art. R. 6213-18. – Sont membres de la commission, nommés par arrêté du ministre chargé de la santé, pour une durée de cinq ans renouvelable :
« 1° Un biologiste médical désigné par l’Académie nationale de médecine ;
« 2° Un biologiste médical désigné par l’Académie nationale de pharmacie ;
« 3° Un biologiste médical désigné par le Conseil national de l’ordre des médecins ;
« 4° Un biologiste médical désigné par le Conseil national de l’ordre des pharmaciens ;
« 5° Un représentant de la conférence des doyens des facultés de médecine ;
« 6° Un représentant de la conférence des doyens des facultés de pharmacie ;
« 7° Un représentant des directeurs ou directeurs adjoints des centres nationaux de référence ;
« 8° Un représentant de la Fédération nationale des syndicats de praticiens biologistes hospitaliers et hospitalo-universitaires ;
« 9° Un représentant de chacune des autres organisations syndicales de biologistes médicaux salariés ;
« 10° Un représentant de chacune des organisations syndicales de biologistes médicaux libéraux reconnues représentatives en application de l’article L. 162-33 du code de la sécurité sociale.
« Un représentant des organisations syndicales représentatives des internes en biologie médicale siège à titre consultatif.
« Le secrétariat est assuré par la direction générale de la santé du ministère chargé de la santé.
La commission constitue en son sein un « comité de suivi » chargé d’analyser la synthèse annuelle publiée par l’Agence nationale de sécurité du médicament et des produits de santé (ANSM) à partir des rapports réalisés par les organismes d’évaluation externe de la qualité. Ce comité propose aussi « toutes mesures destinées à améliorer la démarche d’accréditation et de contrôle qualité des laboratoires de biologie médicale ». Le décret du 16 septembre 2015 précité abroge les dispositions relatives au remplacement temporaire en les réintégrant au sein du code de la santé publique. Ainsi, le biologiste médical peut se faire remplacer par un interne en médecine ou en pharmacie inscrit au diplôme d’études spécialisées de biologie médicale. Les précédentes dispositions prévoyaient la validation de quatre semestres obligatoires du niveau I de la formation pratique et un semestre du niveau II. Les nouvelles dispositions ont été toilettées pour s’adapter aux exigences universitaires et prévoient désormais la validation des cinq premiers semestres de la formation.
La parution de ce décret a soulevé de nombreuses protestations. Plusieurs difficultés ont été mises en exergue par les représentants des biologistes médicaux.
Les représentants des syndicats de biologistes nourrissent quelques inquiétudes quant à la composition de la commission nationale de biologie médicale et souhaiteraient une parité de la représentation syndicale entre libéraux et hospitaliers-universitaires. Est notamment contestée la formation restreinte de la commission, où ne siègent que les représentants des biologistes de CHU, qui est chargée d’examiner les demandes d’autorisation d’exercice des professionnels de santé non diplômés.
Le décret ne respecterait pas l’esprit de la réforme de la biologie médicale s’agissant plus particulièrement de l’uniformisation des conditions d’exercice de la biologie médicale à travers la médicalisation de l’exercice de la profession. Le décret prévoit les modalités de remplacement temporaire des biologistes : les internes en pharmacie ne peuvent remplacer par exemple que les pharmaciens biologistes. Ces dispositions établissent une distinction entre les médecins et les pharmaciens biologistes et limitent l’exercice professionnel des pharmaciens biologistes.
La rédaction du décret poserait enfin quelques difficultés d’interprétation. De l’avis des représentants de LBM, le texte limiterait les conditions d’exercice des directeurs et directeurs adjoints de laboratoires de biologie médicale dont la formation a été sanctionnée par la délivrance de quatre certificats d’études spéciales (26). Aux termes du décret, ils ne pourraient réaliser que deux prélèvements contrairement au droit antérieur qui les plaçaient sur un pied d’égalité avec les titulaires de DES.
Sur l’ensemble de ces éléments, les services du ministère de la santé ont indiqué avoir tenu compte des remarques et inquiétudes des biologistes médicaux. Il est ainsi prévu de modifier le décret sur ces trois points :
– un rééquilibrage entre les formations représentants les biologistes médicaux serait opéré en restreignant les compétences de la formation restreinte, qui n’inclut pas les biologistes libéraux, au profit de la formation plénière. La formation restreinte n’examinerait plus que les demandes liées à l’exercice de la biologie médicale par les directeurs ou directeurs adjoints de centres nationaux de référence ainsi que les voies de recrutement des CHU (27) ;
– la nouvelle rédaction décloisonnerait les modalités de remplacement en permettant à un pharmacien biologiste de remplacer un médecin biologiste et réciproquement ;
– le texte serait enfin revu pour permettre aux titulaires des certificats d’études spéciales d’opérer les mêmes prélèvements que les titulaires de diplômes d’études spécialisés. Sur ce point, le ministère de la santé a souhaité préciser que son intention ne visait pas à revenir sur le droit existant mais a reconnu que la rédaction méritait d’être modifiée pour éviter toute erreur d’interprétation.
D. LES DÉROGATIONS À L’INTERDICTION DES RISTOURNES CONSTITUENT ENCORE UNE PIERRE D’ACHOPPEMENT
L’article 6 de la loi de mai 2013, modifiant l’article L. 6211-21 du code de la santé publique, visait à interdire la pratique des ristournes consenties par les laboratoires aux établissements de santé publics comme privés sous réserve de certaines dérogations.
1. Le régime de l’interdiction de la ristourne
L’interdiction des ristournes en matière d’examens de biologie médicale est la conséquence de la médicalisation de la biologie voulue par la réforme : il s’agit d’un acte médical et non d’une prestation de service tels l’informatique ou la blanchisserie.
Le principe de l’interdiction des remises sur le prix des examens réalisés par un laboratoire prestataire de services pour un autre laboratoire de biologie médicale ou pour un établissement de santé est issu de la loi n° 75-626 du 11 juillet 1975 relative aux laboratoires d’analyses de biologie médicale et à leurs directeurs et directeurs adjoints.
Cette interdiction de principe avait toutefois été assortie de dérogations. Les laboratoires de biologie médicale, relevant ou non d’un établissement de santé, pouvaient conclure des accords comportant des remises tarifaires avec les établissements de santé publics ou privés.
La ristourne permettait en effet aux établissements de santé de réaliser des économies en sous-traitant des examens biologiques à des laboratoires tiers. Motivée par un souci de bonne gestion des deniers publics, cette pratique foulait au pied le sacro-saint principe de la tarification des actes médicaux. Il reléguait également au second plan la dimension médicale inhérente aux examens de biologie pour les réduire à de simples prestations de service. Cette possibilité heurtait de plein fouet la portée de la réforme visant à affirmer la « médicalisation » de l’acte de biologie. Le rapport Ballereau soulignait ainsi que « le choix, indispensable pour le patient et l’efficience des dépenses de biologie médicale, de retenir l’option de la biologie médicale et non de la seule analyse de laboratoire, conduit à être homogène avec l’approche retenue pour les autres disciplines médicales, disciplines pour lesquelles il est de doctrine constante que les actes médicaux ne donnent pas lieu à des ristournes (même s’il existe parfois des dépassements) ».
Dans sa rédaction initiale l’ordonnance relative à la biologie médicale ne prévoyait aucune dérogation conformément aux orientations préconisées dans le rapport précité. Cette initiative avait été toutefois contrecarrée par l’adoption d’une disposition réintroduisant des mesures dérogatoires dans le cadre de la loi de financement de la sécurité sociale (LFSS) pour 2012 (28).
La loi du 30 mai 2013 a maintenu la possibilité de déroger à la tarification issue de la nomenclature générale des actes professionnels (NGAP) mais dans des conditions plus restrictives que celles prévues par la LFSS pour 2012. Elle interdit notamment aux laboratoires de biologie médicale, qu’ils soient publics ou privés, de proposer aux hôpitaux des ristournes sur leurs prestations. Hormis les dérogations, les examens de biologie médicale doivent ainsi être facturés au tarif de la nomenclature des actes de biologie médicale pris en application des articles L. 162-1-7 et L. 162-1-7-1 du code de la sécurité sociale.
Les dérogations prévues par l’article L.6211-21 du code de la santé publique
Les dérogations au principe de l’interdiction des remises sur le prix s’appliquent :
– aux établissements de santé coopérant entre eux dans le domaine de la biologie médicale dans le cadre de conventions ;
– aux établissements de santé coopérant dans le domaine de la biologie médicale dans le cadre de groupements de coopération sanitaire ;
– aux établissements publics de santé coopérant dans le domaine de la biologie médicale dans le cadre de communautés hospitalières de territoire (29) ;
– aux laboratoires privés ayant signé des contrats de coopération.
2. Une question qui fait encore débat
Selon l’association pour le progrès de la biologie médicale (APBM) et le syndicat des laboratoires de biologie clinique (SLBC), les dérogations à l’interdiction des ristournes favoriserait les laboratoires intégrés à un établissement de santé public. Ceux-ci remporteraient systématiquement les appels d’offres au détriment des laboratoires privés, en raison de ces dérogations qui constituent un avantage concurrentiel déloyal et une atteinte à la liberté d’entreprendre.
L’APBM a fait part de cas d’hôpitaux qui, ayant l’habitude de sous-traiter leur activité de biologie à un laboratoire privé de la même ville, seraient amenés à privilégier un partenariat avec un hôpital plus éloigné au détriment de la qualité des soins, de la rapidité du transport des échantillons et de la communication des résultats. Cette tendance conduirait à une dégradation de l’offre de soins, certains plateaux techniques devenant ainsi simples centres de prélèvement, et semble contraire à l’esprit de la réforme, qui cherchait à harmoniser l’ensemble des dispositifs applicables aux LBM publics et privés.
Sur ce sujet, les laboratoires Biomnis et Cerba rejoignent la position exprimée par l’APBM et le SLBC. Les dérogations à l’interdiction des ristournes conduiraient à une dégradation de la qualité des examens de biologie médicale menés dans les laboratoires des établissements de santé. Les laboratoires auditionnés plaident ainsi pour une équité entre public et privé : les ristournes devraient être autorisées pour tous ou interdites pour tous.
La Fédération nationale des syndicats des biologistes pharmaciens hospitaliers et hospitalo-universitaires (FNSPBHU), la Fédération hospitalière de France (FHF) et le syndicat national des biologistes des hôpitaux (SNBH) rappellent, pour leur part, que cette disposition a été prise afin d’améliorer la coopération entre établissements de santé. Selon eux, lorsque les ristournes étaient légales, elles pouvaient amener à une différence de prix importante sur les examens simples, allant parfois jusqu’à 50 % du prix. Enfin, les « petits laboratoires de proximité » qui s’estiment lésés par cette disposition feraient en réalité souvent partie de grands groupes.
Au demeurant, les services du ministère de la santé indiquent qu’il n’y a pas eu à ce jour de saisines portant sur des difficultés rencontrées par les LBM de ville en raison de conventions passées avec des établissements hospitaliers prévoyant des ristournes.
3. Le régime juridique issu de la loi de 2013 doit être préservé
Les rapporteurs n’estiment pas nécessaire de revenir sur une disposition dont les enjeux ont été largement débattus lors de l’examen de la loi de 2013. Ils souhaitent à cet égard insister sur l’éclairage apporté par le Conseil constitutionnel.
L’article L. 6211-21 a en effet été contesté dans le cadre d’un contentieux porté devant la plus haute juridiction administrative (30) et a été l’objet d’une question prioritaire de constitutionnalité (31). Dans le cadre d’une réponse à des appels d’offres, la société à l’origine du contentieux, un laboratoire, considérait qu’il se trouvait dans une situation défavorable par rapport à ses concurrents, des laboratoires intégrés à des établissements de santé ou parties à des contrats de coopération entre laboratoires. Il se voyait appliquer l’interdiction des ristournes quand ces derniers étaient autorisés à négocier des prix sensiblement inférieurs aux tarifs issus de la NGAP. L’atteinte à la liberté d’entreprendre et à l’objectif de valeur constitutionnel de bon emploi des deniers publics faisait notamment partie des griefs invoqués.
Ces griefs ont été écartés par le Conseil constitutionnel qui a ainsi jugé que si l’atteinte à la liberté d’entreprendre était constituée, elle n’était pas disproportionnée au regard des objectifs poursuivis par le législateur. Le commentaire de la décision du Conseil constitutionnel rappelle ainsi que la rédaction retenue était motivée par le souci de maintenir des compétences en biologie médicale dans les établissements de santé et sur l’ensemble du territoire ainsi que de favoriser les contrats de coopération entre les laboratoires de biologie médicale aux fins de mutualisation. Les différences de traitement étaient ainsi en rapport direct avec l’objet de la loi.
Les rapporteurs souhaiteraient aussi souligner que la ristourne s’applique également aux laboratoires privés ayant signé des contrats de coopération. Le secteur libéral est, du point de vue de la coopération, placé sur un pied d’égalité avec le secteur privé. Il ne peut être tiré du constat du faible nombre de coopérations impliquant des laboratoires privés une conclusion tendant à empêcher les laboratoires publics d’engager des synergies et des mutualisations de moyens.
Il a été par ailleurs rapporté que l’interdiction des ristournes pouvait être contournée par les laboratoires privés de deux manières.
Certains marchés publics conclus avant l’entrée en vigueur de la loi courent toujours : de facto, les établissements de santé bénéficient toujours des ristournes préalablement négociées. Cette situation tend à se normaliser au fur et à mesure des renouvellements de marchés.
Les établissements de santé bénéficieraient parfois de cadeaux en nature (matériel, formations, etc.) permettant aux laboratoires privés de remporter les marchés publics. Rien ne justifie à cet égard ces remises déguisées via la gratuité des matériels et de la logistique. Aucun élément de preuve n’a toutefois été porté à la connaissance des rapporteurs à l’appui de ces allégations. Interrogé sur ces affirmations, le ministère de la santé affirme ne pas avoir été alerté à ce sujet.
Dans ces cas de figure, les rapporteurs estiment qu’il revient aux organes d’inspection de faire appliquer le droit en vigueur et ne peuvent qu’inciter le ministère de la santé à diligenter des contrôles appropriés.
Proposition n° 4 :
Remettre au Parlement une synthèse portant sur les conclusions tirées du contrôle de l’interdiction des ristournes.
III. LA PÉRENNITÉ DE L’OFFRE DE BIOLOGIE MÉDICALE DE PROXIMITÉ : UN ENJEU MAJEUR
A. LA MODIFICATION DU PAYSAGE DE LA BIOLOGIE MÉDICALE
Les informations transmises aux rapporteurs font état d’une profonde restructuration du paysage des laboratoires de biologie médicale. Le regroupement entre laboratoires est aujourd’hui plus avancé dans le secteur privé que dans le secteur public.
1. Les facteurs du regroupement
Plusieurs raisons peuvent expliquer ces opérations de restructuration.
Le regroupement répond en premier lieu à un enjeu de réorganisation dans un contexte de baisse tarifaire. Rappelons à cet égard que plusieurs diminutions tarifaires ont été décidées de façon successive entre 2010 et 2013. Elles sont aujourd’hui associées à des actions de maîtrise médicalisée par le protocole d’accord triennal sur la biologie médicale, qui s’applique sur la période 2014-2016. Dans le secteur libéral, le regroupement de plusieurs laboratoires associé à la mise en commun d’un plateau technique constitue une stratégie permettant de limiter les effets de la diminution des tarifs.
Le regroupement permet en deuxième lieu de faire face aux exigences requises par la démarche d’accréditation. Les laboratoires doivent en effet disposer d’une masse critique suffisante pour absorber les coûts induits par l’accréditation. La sollicitation des équipes est telle qu’il est nécessaire de mener de front la diffusion de la démarche qualité et les travaux habituels du laboratoire. Le franchissement des trois prochaines étapes de l’accréditation obligatoire (2016, 2018 et 2020) requiert un investissement en temps et en personnel plus conséquent que la justification d’une entrée effective dans la démarche d’accréditation.
Le regroupement répond en troisième lieu à la mise en place de stratégies financières de grands groupes. Le secteur de la biologie médicale est en pleine expansion. Il est également porteur de nombreuses innovations. Pour financer l’extension de leur réseau, mettre en place leur accréditation, juguler les coûts d’exploitation et la baisse tarifaire, les groupes ont des besoins en trésorerie importants. L’appel à des partenaires financiers afin d’opérer des opérations de regroupements est aujourd’hui une réalité qu’il serait vain de dissimuler.
Cette recomposition est également facilitée par les évolutions juridiques prévues par la loi portant réforme de la biologie médicale. L’article L. 6212-1 du code de la santé publique prévoit ainsi la possibilité pour un laboratoire d’être implanté sur un ou plusieurs sites. Auparavant limité à 5, le verrou du nombre de sites est aujourd’hui ouvert et constitue un outil au service d’une recomposition importante du paysage des laboratoires de biologie médicale.
Enfin, dans le cas particulier des laboratoires publics, le regroupement est bien évidemment lié à la réorganisation des établissements publics de santé avec la mise en place des groupements hospitaliers de territoire (GHT).
Ces enjeux requièrent un suivi particulier des ARS. C’est la raison pour laquelle la loi leur a conféré un rôle particulier en matière de contrôle de l’application des normes prudentielles édictées par le législateur.
2. Une dynamique de restructuration encore inachevée
Depuis 2011, les LABM ont connu beaucoup de transformations, notamment dans le secteur libéral. Cette transformation fait apparaître une diminution conséquente du nombre de laboratoires sans qu’il soit constaté par ailleurs une baisse du nombre de sites.
Le Conseil de l’ordre des pharmaciens constate ainsi une diminution du nombre de sociétés inscrites au tableau de l’ordre mais souligne que le nombre d’établissements (sites et laboratoires) reste identique.
Les laboratoires d’analyse de biologie médicale (LABM) privés existants avant la réforme se sont transformés en laboratoires de biologie médicale (LBM) le plus souvent multisites par le biais de rachats ou de fusions et de quelques fermetures : selon l’observatoire des métiers des professions libérales, on dénombrait 4 000 laboratoires en 2010 et 2 400 en 2012. L’évolution du nombre de laboratoires fait aujourd’hui l’objet d’un suivi par le ministère chargé de la santé dans le cadre d’un système d’information dédié, dénommé Biomed. Il comptabilise à ce jour environ 1 100 laboratoires de biologie médicale, parmi lesquels 300 structures publiques. Au 31 mai 2015, le nombre de sites s’élève à 4 647. Cette évolution est retracée dans le tableau ci-après.
ÉVOLUTION DU NOMBRE DE LABORATOIRES D’ANALYSE MÉDICALE
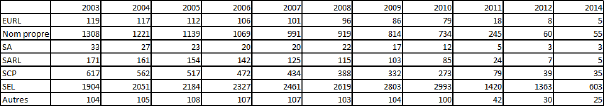
Sources : Données du Conseil national de l’ordre des pharmaciens (2003-2012) et SI Biomed (2014)
La réforme de la biologie médicale rend toutefois les comparaisons difficiles.
Les données recueillies entre 2003 et 2010 révèlent le nombre de laboratoires d’analyse de biologie médicale et permettent d’en déduire le nombre de sites d’exploitation. En effet, jusqu’à la publication de l’ordonnance de 2010, chaque société ne pouvait exploiter qu’un seul LABM à l’exception des SEL (sociétés d’exercice libéral) qui pouvaient exploiter jusqu’à 5 d’entre eux. En outre, un LABM ne pouvait comporter qu’un seul site géographique.
En revanche, les données recueillies entre 2011 et 2014 révèlent le nombre de LBM sans considération du nombre de sites d’exploitation. Rappelons à cet effet que, depuis la réforme, toute société, y compris les SEL, ne peut exploiter qu’un seul LBM mais celui-ci peut comporter plusieurs sites sans limitation en nombre.
Dans le secteur libéral, le phénomène de regroupement est plus facilement mesurable en retraçant l’évolution du nombre de SEL. Ce nombre est en croissance constante jusqu’en 2011 et décroît depuis 2012-2013. Le nombre de SEL s’élève à 603 en 2014 contre 1 363 en 2012.
ÉVOLUTION DU NOMBRE DE SEL EXPLOITANT
LES LABORATOIRES DE BIOLOGIE MÉDICALE
![]()
Source : Ministère des affaires sociales, de la santé et des droits des femmes.
La réforme a pour effet un regroupement des sociétés par fusion mais non une diminution du nombre d’établissements. Le laboratoire s’organise ainsi autour d’un site-plateau technique et de sites périphériques (activités pré-analytiques et post-analytiques) avec un biologiste responsable ou des biologistes coresponsables (pour les laboratoires exploités par des sociétés).
S’agissant des établissements hospitaliers, le système d’information Biomed ne permet pas, à ce jour, de suivre les restructurations en cours. S’il recense 269 laboratoires hospitaliers, il ne précise pas s’ils sont déclarés sous la forme juridique de groupements de coopération sanitaire (GCS) exploitant un LBM.
Auditionnée par les rapporteurs, la fédération hospitalière de France précise que les LBM se sont déjà engagés dans des coopérations même si elles ne sont pas encore nombreuses. Plusieurs outils de coopération sont effectivement à la disposition des établissements de santé pour regrouper leur activité de biologie médicale : la mutualisation des moyens relève ainsi de l’instrument conventionnel ou de la création d’une personne morale.
Selon les informations transmises aux rapporteurs, l’observatoire des recompositions hospitalières recenserait aujourd’hui une vingtaine de GCS ayant notamment pour objet la biologie médicale. Deux voies sont ainsi utilisées :
– le GCS de moyens permettant la mutualisation de certains moyens de plusieurs laboratoires en vue de rationaliser leurs dépenses ;
– le GCS de moyens exploitant un laboratoire en propre pour le compte de ses membres comme prévu par l’article L. 6223-2 du code de la santé publique.
Quelques exemples de coopération, mis en lumière par l’agence régionale de santé d’Île-de-France, indiquent à cet égard la mise en place de coopérations reposant notamment sur des GCS : 4 GCS exploitent aujourd’hui un LBM commun à plusieurs établissements, deux autres groupements étant en cours de constitution.
La loi de modernisation de notre système de santé prévoit un nouvel outil de mutualisation, le groupement hospitalier de territoire (GHT). Selon le ministère des affaires sociales, de la santé et des droits des femmes, cette organisation permettra de répondre aux exigences de l’accréditation, de conserver une biologie médicale de proximité tout en développant la biologie médicale de recours. Ce regroupement permettra d’inscrire les biologistes dans une pratique territorialisée et collective avec l’harmonisation des protocoles et des pratiques, la mutualisation de certaines techniques, et le développement de la recherche clinique.
À la différence du secteur libéral pour lequel il est constaté une plus forte concentration de l’offre de services, la restructuration des LBM hospitaliers est en devenir. Elle dépendra du nouvel outil de coopération que constituent les GHT.
Pour le moment, les rapporteurs se félicitent du maintien de l’offre de proximité avec la stabilité du nombre de sites. Cela étant, il importera de suivre de près les évolutions à venir et demeurer aussi fermes que vigilants tant sur le maillage territorial que sur la qualité et la sécurité des soins.
B. L’ENCADREMENT DE LA FINANCIARISATION : UN OBJECTIF EN DEVENIR
1. Le contrôle des ARS : des pouvoirs limités ?
Le regroupement des laboratoires s’inscrit dans les limites imposées par l’ordonnance portant réforme de la biologie médicale. Elle édicte plusieurs règles encadrant la liberté d’installation ou l’implantation territoriale. De l’avis des personnes auditionnées, ces règles principalement motivées par le souci de limiter la financiarisation de la biologie médicale se révèlent aujourd’hui inopérantes faute de texte applicable. Cette situation de vide juridique serait mise à profit par les grands groupes pour accroître leur emprise en contradiction avec l’esprit de la réforme.
● Les outils à la main des ARS
L’ordonnance met à la disposition des ARS plusieurs outils pour contrôler l’offre de service des laboratoires de biologie médicale sur le territoire. En pratique, les ARS disposent d’un système d’information permettant d’assurer le suivi des règles qui ont été fixées.
Ces limites tiennent à l’encadrement de la liberté d’installation des LBM ou de leurs sites. L’ordonnance prévoit trois règles prudentielles principalement applicables aux LBM du secteur libéral.
Selon l’article L. 6222-2, le directeur général d’une ARS peut s’opposer à l’ouverture d’un nouveau laboratoire de biologie médicale ou d’un nouveau site si cette ouverture a pour effet de porter le total de l’offre de biologie médicale à un niveau supérieur à 25 % aux besoins de la population tels qu’ils sont fixés par le schéma régional d’organisation des soins pour le territoire de santé considéré.
Selon l’article L. 6222-3, le directeur général d’une ARS peut s’opposer à une acquisition ou une fusion de LBM si celle-ci a pour effet de conduire le LBM ainsi créé à dépasser les 25 % du total des examens de biologie médicale sur le territoire de santé. Ce refus doit reposer sur un motif tenant au risque d’atteinte à la continuité de l’offre de soins.
L’article L. 6223-4 formule également une interdiction de principe pour toute personne physique ou morale d’acquérir des parts sociales d’un LBM si cette acquisition lui permet de contrôler plus de 33 % de l’offre de biologie médicale sur un territoire de santé.
Selon les informations transmises aux rapporteurs, le projet de décret relatif à la biologie médicale précise les modalités de détermination de ces taux. Il serait notamment précisé que le nombre total d’examens est obtenu en additionnant, pour chaque laboratoire, le nombre d’examens unitaires dont le résultat découle d’une phase analytique.
Dans le cas particulier de l’article L. 6222-2, l’offre d’examens de biologie médicale serait appréciée en tenant compte des prélèvements réalisés sur le territoire de santé. À cet effet, seraient pris en compte :
– les examens effectués à partir de prélèvements réalisés par un laboratoire et dont la phase analytique a été effectuée par lui-même ou sous sa responsabilité ;
– les examens effectués à partir de prélèvements réalisés par un laboratoire et transmis à d’autres laboratoires à des fins d’analyse et d’interprétation.
● Des limites tiennent au maintien de l’offre territoriale de soins
Selon l’article L. 6222-5 du code de la santé publique, les sites de laboratoires doivent être localisés soit sur un même territoire de santé, soit au plus sur trois territoires de santé sauf dérogation accordée par l’ARS ou dérogation spécifique.
Le 1° du III de l’article 7 de l’ordonnance de 2010 prévoit ainsi des dérogations pour les laboratoires liés par une coopération antérieure à la publication de l’ordonnance.
La règle de territorialité n’est pas non plus applicable aux établissements de transfusion sanguine qui effectuent « des examens d’immuno-hématologie dits « receveurs » et des examens complexes d’immuno-hématologie ». Cette dérogation était notamment justifiée par l’organisation territoriale particulière des établissements de transfusion sanguine qui répond avant tout à un impératif de santé publique et de sécurité transfusionnelle des patients : la possibilité d’offrir des services de santé de base sur des sites de proximité n’est pas très compatible avec l’application d’une règle de territorialité. Le projet de décret porté à la connaissance des rapporteurs, maintient cette précision pour les examens d’immuno-hématologie.
De la même manière, l’article L. 6211-16 dispose que « le prélèvement d’un échantillon biologique est réalisé dans l’un des territoires de santé infrarégionaux d’implantation du laboratoire de biologie médicale, sauf dérogation pour des motifs de santé publique et dans des conditions déterminées par décret en Conseil d’État ».
Le projet de décret porté à la connaissance des rapporteurs précise les modalités de dérogation. Elle bénéficierait notamment aux LBM des hôpitaux d’instruction des armées, aux LBM de centres d’examens de santé des organismes d’assurance maladie ou aux centres de dépistage néonatal.
● Les modalités pratiques du contrôle effectué par les ARS
Les opérations de contrôle sont effectuées, au sein des ARS, par un référent biologie. Pharmacien inspecteur de santé publique dans la majorité des cas, ce référent traite de toutes les questions ayant trait à la biologie médicale en collaboration avec un référent pour l’application informatique Biomed.
L’application permet d’obtenir un tableau de suivi résumant les données administratives des laboratoires et les données déclarées en termes d’activité et de nombre d’examens réalisés sous accréditation par chaque LBM.
Concernant les restructurations et la réorganisation des laboratoires ainsi que l’évaluation du respect des règles prudentielles dans le respect du volet biologie médicale du schéma régional d’organisation des soins, le ministère chargé de la santé précise que l’application Biomed permet la gestion des divers « mouvements » opérés par les LBM. Il est ainsi possible de disposer, en temps réel, d’une liste de LBM à jour tenant compte des divers mouvements opérés. L’application permet de s’assurer du respect des règles prudentielles associées spécifiquement à chaque mouvement. Les arrêtés ou décisions, une fois signés, sont insérés dans la fiche informatisée du LBM, l’ensemble des opérations effectuées est bien évidemment totalement tracé.
Selon le ministère de la santé, ce dispositif devrait faciliter les restructurations notamment dans les établissements publics de santé et permet, à tout moment, d’avoir une vision d’ensemble de la situation des LBM d’une région.
2. L’application des dispositions contrariée par la publication tardive des textes.
Dans la pratique, les ARS ne disposent pas de la totalité des outils juridiques mis à leur disposition pour appliquer les textes.
● S’agissant des règles de territorialité mentionnées à l’article L. 6222-5, des difficultés subsistent
Faute de texte d’application, les dérogations accordées par les ARS se révèlent à ce jour inopérantes. Le projet de décret devrait leur permettre d’appliquer les dispositions mais force est de constater que la publication tardive des mesures d’application a pu porter préjudice aux mesures d’organisation décidées par les ARS.
Proposition n° 5 :
Procéder à la publication des textes d’application.
De l’avis des ARS, l’application de ces dispositions pose en outre problème. L’absence de limitation du nombre de sites conjuguée aux dérogations légales a conduit à une forte croissance de LBM multisites, « implantés sur de très grandes superficies » en particulier en Île-de-France. Le regroupement se traduit en effet par la mise en place de sites pré et post-analytiques en lien avec le plateau technique en charge de l’examen analytique. Il s’ensuit un temps d’acheminement des échantillons biologiques entre les sites de prélèvement et le plateau technique. Le temps de transport peut excéder une demi-heure et atteindre parfois deux heures dans certaines zones rurales. Selon les ARS, ce fait est « porteur de risque que le LBM ne puisse pas répondre à une situation d’urgence clinique ou organisationnelle ».
Interrogé sur l’application des règles de territorialités, le directeur général de l’ARS Ile-de-France indiquait, lors de son audition, que les règles de territorialité d’implantation des sites de LBM et de prélèvements « devraient être évaluées également en distance et temps de transport maximum des échantillons biologiques entre les sites pré et post-analytiques et les sites analytiques. Ces références distance et temps de transport des échantillons biologiques prendraient davantage en considération la cohérence de la zone d’implantation des sites du LBM. De plus, elles sécuriseraient la réponse aux situations d’urgence tant en milieu urbain qu’en milieu rural. En effet, ces paramètres pré-analytiques, distance entre sites et temps de transport des échantillons biologiques, sont directement liés aux délais de communication des résultats obtenus ».
Ce souci est bien évidemment partagé par le ministère de la santé qui renvoie aux dispositions de la loi de modernisation de notre système de santé. Son article 158 prévoit que les ARS sont chargées de procéder à la délimitation des zones donnant lieu à l’application aux LBM des règles de territorialité précédemment définies. Le décret d’application, en cours de préparation, encadrerait la définition des zones territoriales de biologie médicale par le respect des critères de sécurité, d’accessibilité et de la prise en compte des situations d’urgence. Ces critères permettraient de satisfaire la proposition émise par l’ARS d’Île-de-France.
Pour le ministère de la santé, il n’est donc pas opportun de définir des objectifs uniformes applicables à toutes les ARS sans tenir compte des réalités locales. Il leur revient de définir elles-mêmes la cohérence des zones d’implantations en tenant compte des critères prévus par le décret.
Les rapporteurs souhaitent insister sur cette dimension et forment le vœu que la délimitation des zones de biologie médicale puisse inclure des références en termes de distance et de temps.
Proposition n° 6 :
Dans la définition des zones donnant lieu à l’application des règles de territorialité, permettre aux ARS d’apprécier la cohérence des zones d’implantation des sites de LBM à partir de références liées à la distance et au temps de transport des échantillons biologiques.
● S’agissant des règles prudentielles, les limites posées par l’ordonnance ne sont pas appliquées dans des conditions satisfaisantes
C’est notamment le cas des contrôles effectués à l’occasion de l’ouverture d’un LBM ou d’un site mais surtout celui des contrôles portant sur la concentration des LBM.
Le contrôle à l’ouverture d’un LBM ou d’un site est difficile à mettre en œuvre. En effet, les déclarations annuelles d’activité des LBM ne seraient pas exhaustives et ne permettraient pas d’avoir une vision précise de l’offre de soins sur le territoire de santé. Dans ces conditions, il est particulièrement délicat d’apporter la preuve d’un excès d’offre. Par ailleurs, les ARS ne seraient pas en mesure, faute de texte d’application, d’infliger des sanctions administratives aux LBM n’ayant pas fait de déclaration ou ayant effectué de fausses déclarations (32).
Les projets de texte d’application dont les rapporteurs ont pris connaissance visent à préciser les éléments faisant l’objet de la déclaration annuelle d’activité. Cela étant aucun levier n’est prévu pour s’assurer de la fiabilité ou de l’exhaustivité des informations. Interrogés sur l’état d’avancement des mesures d’applications relatives aux sanctions, les services du ministère de la santé ont indiqué que la publication du texte interviendrait au cours du premier trimestre 2016.
Proposition n° 7 :
Accélérer le processus de publication du décret d’application mentionné à l’article L. 6241-6 du code de la santé publique.
Au cours des auditions, il a aussi été indiqué aux rapporteurs, sans élément de preuve à l’appui, que l’appréciation des règles pouvait varier d’une ARS à l’autre. Constatant qu’aucun contentieux n’était en cours, et en l’absence de preuves étayées, les rapporteurs estiment que l’application des règles ne semble pas avoir souffert de divergences d’appréciation entre ARS. Sollicités par les rapporteurs, les services du ministère de la santé n’ont pas fait état d’une application distincte des règles de territorialité.
Pour autant, les rapporteurs estiment que l’édiction d’une doctrine claire portant sur l’application des règles de territorialité, tenant compte des mesures d’application de la loi de modernisation de notre système de santé, constituerait un signal positif adressé aux biologistes médicaux en faveur de l’égalité de traitement.
La prochaine fusion des ARS nécessite la fixation d’un cap dont le maintien ne doit pas souffrir de la réorganisation administrative. La mise en place d’une doctrine serait de nature à lever les inquiétudes exprimées par certains des représentants de biologistes médicaux.
Proposition n° 8 :
Afin de favoriser l’égalité de traitement entre laboratoires de biologie médicale, établir une doctrine d’application des règles de territorialité.
3. L’exploitation des laboratoires de biologie médicale privés
Un laboratoire de biologie médicale privé peut être exploité sous différentes formes ainsi que le prévoit l’article L. 6223-1 du code de la santé publique :
– en nom propre ;
– association, fondation ou autre organisme à but non lucratif ;
– société civile professionnelle régie par la loi n° 66-879 du 29 novembre 1966 relative aux sociétés civiles professionnelles ;
– société d’exercice libéral régie par la loi n° 90-1258 du 31 décembre 1990 relative à l’exercice sous forme de sociétés des professions libérales soumises à un statut législatif ou réglementaire ou dont le titre est protégé et aux sociétés de participations financières de professions libérales ;
– société coopérative régie par la loi n° 47-1775 du 10 septembre 1947 portant statut de la coopération.
b. Les sociétés d’exercice libéral
La principale forme d’exploitation est constituée par la société d’exercice libéral (SEL) régie par la loi du 31 décembre 1990 modifiée qui fixe les conditions de détention des droits de vote et du capital social.
Le législateur a entendu limiter les risques que pouvait occasionner une ouverture du capital de ces sociétés à des tiers investisseurs. L’un des objectifs de la loi du 30 mai 2013 consistait à encadrer le régime juridique et financier des laboratoires de biologie médicale afin d’éviter une concentration excessive du secteur au sein de grands groupes au détriment des structures plus modestes.
Pour les SEL exploitant les laboratoires de biologie médicale, un régime particulier a été défini par le législateur. Il combine les règles fixées aux articles 5 et 6 de la loi du 31 décembre 1990 précitée et celle fixée par l’article 10 de la loi de 2013.
● La détention par les biologistes médicaux de la moitié du capital social et des droits de vote
Selon le I de l’article 10 de la loi du 30 mai 2013, plus de la moitié du capital social et des droits de vote d’une société d’exercice libéral de biologistes médicaux doit être détenue, directement ou par l’intermédiaire d’une société de participations financières de professions libérales, par des biologistes médicaux en exercice au sein de la société (33) .
Les sociétés de participations financières de professions libérales
Les sociétés de participation financières peuvent être constituées entre des personnes physiques ou morales qui exercent une ou plusieurs professions libérales soumises à un statut législatif ou réglementaire ou dont le titre est protégé.
Elles doivent avoir pour objet principal, la détention des parts ou d’actions de sociétés mentionnées à la rubrique précédente.
Plus de la moitié du capital et des droits de vote doit être détenue par des personnes exerçant la même profession que celle exercée par les sociétés faisant l’objet de la détention des parts ou actions. Le complément peut être détenu par les personnes mentionnées aux 2°, 3° et 5° de l’article 5 de la loi n° 90-1258 du 31 décembre 1990.
Des décrets en Conseil d’État, propres à chaque profession, peuvent interdire la détention, directe ou indirecte, de parts ou d’actions représentant tout ou partie du capital social à des catégories de personnes physiques ou morales déterminées, lorsqu’il apparaîtrait que cette détention serait de nature à mettre en péril l’exercice de la ou des professions concernées dans le respect de l’indépendance de ses membres et de leurs règles déontologiques propres.
● Les autres participations autorisées
Le complément, soit moins de la moitié du capital, peut être détenu par les personnes mentionnées au B du I de l’article 5 de la loi du 31 décembre 1990 à savoir d’anciens associés médecins (ou pharmaciens) ayant exercé dans cette SEL pendant 10 ans au maximum, les ayants droit des personnes précédemment citées pendant 5 ans maximum après le décès de l’associé, ou toute personne physique ou morale exerçant la profession de biologiste médical (34) .
Enfin, l’article R. 6212-82 du code de la santé publique, pris en application du III de l’article 6 de la même loi, dispose que le capital est ouvert à toute personne physique ou morale dans une limite de 25 % à toute personne physique ou morale. Néanmoins, l’article R. 6212-83 du même code, pris en application du 4° du IV du même article 6, indique qu’en sont exclues les autres professions libérales de santé réglementées ainsi que les fournisseurs et prestataires de services dans le secteur de la médecine, organismes d’assurance, prévoyance et protection sociale (35).
● Le renforcement des règles de détention du capital social par la loi portant réforme de la biologie médicale
En outre, l’article 10 de la loi du 30 mai 2013 prévoit, en son II, qu’il ne peut être fait application de la mesure dérogatoire prévue par le premier alinéa de l’article 5-1 de la loi du 31 décembre 1990 (36). Cette mesure dérogatoire concerne les règles de détention du capital social.
Introduit par l’article 32 de la loi du 11 décembre 2001 (37) dite loi « MURCEF », l’article 5-1 (38) prévoit ainsi que plus de la moitié du capital social des SEL peut également être détenue par des personnes physiques ou morales exerçant la profession constituant l’objet social de la SEL ou des sociétés de participations financières de professions libérales.
En d’autres termes, pour les laboratoires de biologie médicale, il est formellement exclu que la majorité du capital d’une SEL puisse être détenue par des personnes morales ou des personnes physiques qui n’y exercent pas ou des sociétés de participations financières de professions libérales lorsque celles-ci sont majoritairement détenues en capital et en droit de vote par des biologistes exerçant dans la SEL. Cette règle est codifiée à l’article L. 6223-8 du code de la santé publique.
Cela étant, le principe défini à l’article 10 ne s’applique pas aux sociétés d’exercice libéral de biologistes médicaux créées antérieurement à la date de promulgation de la loi du 30 mai 2013.
Ces sociétés ont ainsi la faculté de bénéficier de la dérogation prévue à l’article 5-1 (39). Mais, afin de limiter les effets de la financiarisation, le texte prévoit que la cession des parts sociales ou actions puisse se faire prioritairement au bénéfice des biologistes exerçant dans ces sociétés (40). À défaut, la cession peut avoir lieu au bénéfice de toute personne physique ou morale exerçant la profession de biologiste médical ou de toute société de participations financières de profession libérale de biologistes médicaux.
● Des craintes persistantes
Il ressort des auditions que la mise en place de ce dispositif n’aurait pas produit les effets escomptés.
La loi de mai 2013 a figé une situation à un instant t en actant la prise de participations d’une part du secteur de la biologie médicale par des groupes financiers. Elle a entendu en limiter les effets en prévoyant la cession des parts sociales ou actions prioritairement au bénéfice des biologistes en exercice.
Il a notamment été rapporté, à plusieurs reprises, que la pression financière était telle que les prix d’acquisition proposés, représentant jusqu’à 200 % du chiffre d’affaires du laboratoire, exerçaient un effet dissuasif sur toute cession au profit des biologistes en exercice incapables de rivaliser faute de ressources financières suffisantes.
Enfin, les prises de participations financières dans les sociétés mères, parfois étrangères, échappent au contrôle des ARS et des ordres professionnels. Face à des fonds d’investissement aux placements plutôt volatils, plusieurs interlocuteurs plaident en faveur d’outils appropriés pour juguler la mise en place d’oligopoles et préserver l’exercice de proximité. Sur ce dernier point, les rapporteurs estiment qu’une distinction doit être opérée entre l’application des règles de concurrence dont la régulation ressortit à l’Autorité de la concurrence et l’application des normes prudentielles dans le ressort territorial des ARS. Il n’appartient pas aux ARS de se placer en régulateur de la concurrence mais de s’assurer que l’implantation des laboratoires ne contrevient pas localement aux règles définies par les textes réformant la biologie médicale.
1. La financiarisation : une question éminemment sensible
Ces développements témoignent de la sensibilité extrême des interlocuteurs sur la question de la financiarisation. Les réactions oscillent entre l’incompréhension face au peu d’effet des dispositions supposées limiter la financiarisation et la frustration de ne pouvoir lutter à armes égales face aux grands groupes. Face à une tendance de fond, le risque est grand de vouloir se doter des mêmes outils que les groupes financiers.
À quelques reprises, a été suggérée l’idée de revenir dans le droit commun de la dérogation prévue à l’article 5-1 de la loi précitée. Pour les rapporteurs, cette solution n’est pas tenable. Elle ne ferait qu’aggraver voire précipiter une situation dont le législateur a entendu limiter les effets.
L’intérêt des financiers pour la biologie médicale constitue en effet une tendance de fond qu’il ne faut pas sous-estimer. Le secteur est encore rentable, et présente un niveau de risque limité et des perspectives de croissance. Le rapport de la Cour des comptes de 2013 sur la sécurité sociale, dans son chapitre III relatif à la biologie médicale, indique ainsi que « le montant des prix de cession des laboratoires, qui s’établit désormais à environ 150 % du chiffre d’affaires annuel, voire 200 % et plus, démontre une rentabilité élevée » (41). Le payeur principal étant l’assurance maladie, la prise de risque est somme toute assez limitée. Enfin, le marché de la biologie médicale est en croissance en raison tant du vieillissement de la population que de la plus grande prévalence des maladies chroniques.
La réforme a pour effet un regroupement des sociétés par fusion mais non une diminution du nombre d’établissements. Cette réalité mérite d’être appréhendée sous un autre angle.
Pour des raisons de maîtrise des coûts, on observe la transformation de sites en simples sites pré-analytiques – post-analytiques, la phase analytique n’étant mise en œuvre que sur un site distant de 30 minutes voire beaucoup plus, entraînant soit une prise en charge différée du patient, soit une absence totale de prise en charge à partir d’une certaine heure. Ces situations sont incompatibles avec de nombreux besoins du patient et l’organisation de l’offre de soins française qui privilégie l’offre de premier recours basée sur l’intervention de professionnels au plus proche du patient (infirmière, médecin, biologiste). Il en découle un risque important de perte de chances pour le patient. C’est la raison pour laquelle les rapporteurs insistent pour que la délimitation des zones de biologie médicale prenne effectivement appui sur les critères liés à la sécurité, l’accessibilité et la prise en compte de situation d’urgence (cf. proposition n° 6). Cette situation emporte d’autres effets à plus long terme sur l’attractivité du métier de biologiste médical.
Avant la réforme, le biologiste pouvait maîtriser toute l’organisation de son laboratoire en termes de ressources humaines, de choix de matériel, de réactifs, de stratégie de développement et de gestion de son entreprise. Dans le contexte actuel, le biologiste médical exerce une présence sur un site pré et post-analytique dont il n’assume plus aucune des fonctions antérieures. Ce dernier peut ne pas être associé aux structures de décision, et se voit contraint d’assumer des choix collectifs auxquels il n’adhère que par esprit de cohésion. Ce mode d’exercice n’est pas motivant pour un professionnel de santé.
L’exercice des biologistes au sein d’un site uniquement pré et post analytique ne constitue pas non plus une activité gratifiante et ne permet pas l’exercice de toutes les compétences du biologiste médical à la différence d’un exercice sur un site analytique. Ce faisant, l’exercice d’une activité sur un site éloigné du patient prive ce dernier d’une relation de proximité. Or, l’un des axes de la réforme consistait notamment à favoriser la relation entre le patient, son médecin traitant et le biologiste médical.
Ce phénomène n’a pu être évalué par les rapporteurs. Il serait toutefois opportun de mesurer les effets du regroupement sur la répartititon des tâches de biologie médicale entre sites.
Proposition n° 9 :
Évaluer les conséquences du regroupement des laboratoires sur l’exercice de la profession de biologie médicale.
2. Des mesures d’application attendues
Les textes réglementaires ont vocation à préciser l’intention du législateur. Les rapporteurs regrettent qu’au 31 décembre 2015, soit plus de 30 mois après l’adoption de la loi portant réforme de la biologie médicale, aucune publication ne soit intervenue.
Les rapporteurs se sont toutefois procurés un projet de décret dont la publication serait imminente. Il préciserait notamment le régime des SEL et des sociétés de participations financières de profession libérale de biologistes médicaux.
S’agissant des SEL, le projet de décret préciserait la règle du plafonnement à 25 % de la détention du capital social par les personnes physiques ou morales autres que biologistes médicaux.
Le texte clarifierait en outre les règles de cession du capital prévues par le II de l’article L. 6223-8 du code de la santé publique. Rappelons que ces dispositions ont vocation à encadrer la cession des parts sociales ou actions pour les laboratoires de biologie médicale ressortissant du régime de la loi MURCEF. Afin de limiter les effets de la financiarisation, la loi prévoit que la cession des parts sociales ou actions puisse se faire prioritairement au bénéfice des biologistes exerçant dans ces sociétés et, faute de repreneur, à toute personne physique ou morale. Le texte d’application introduirait une précision bienvenue s’agissant des règles de cession. Le cédant ne peut leur vendre ses parts, à des conditions ou à un prix plus avantageux, sans avoir au préalable fait une nouvelle offre aux biologistes médicaux exerçant dans la société.
Le projet de décret préciserait également le régime des sociétés de participations financières de profession libérale (SPFPL) de biologistes médicaux.
Celles-ci pourront être constituées par des personnes physiques ou morales exerçant la profession de biologiste médical. Peuvent y être associés pendant 10 ans les anciens associés médecins (ou pharmaciens) ayant exercé dans une SEL dont le capital est détenu par la société de participations financières, ou les ayants droit des personnes précédemment citées pendant 5 ans maximum après le décès de l’associé. Le capital de la SPFPL ne pourrait être détenu par une personne physique ou morale exerçant une autre profession de santé.
Le texte astreindrait également les SPFPL à un contrôle portant sur les règles de détention de capital ou sur leurs activités. Ce contrôle serait exercé par le conseil de l’ordre dont relève la société.
Enfin, les SPFPL de biologistes médicaux en exercice disposeraient d’un délai de deux ans à compter de la publication du décret pour se mettre en conformité avec ces dispositions.
Les rapporteurs ne peuvent que se féliciter de ces précisions utiles.
Au regard de l’ensemble de ces éléments, les rapporteurs aimeraient mettre en avant plusieurs pistes.
Les rapporteurs estiment qu’il n’est pas tenable de revenir dans le droit commun de la dérogation prévue à l’article 5-1 de la loi précitée, pas plus qu’il est opportun d’encourager les biologistes médicaux à affronter les groupes financiers avec leurs armes. Il importe au contraire de permettre l’application des règles existantes.
Les moyens de régulation des ARS devraient être renforcés en appliquant les principes juridiques existants. Les règles prudentielles devraient être réévaluées à l’aune de l’impérieuse nécessité de santé publique. Les regroupements auxquels nous assistons présentent un caractère irréversible. Il n’en va pas de même de l’exercice de la biologie médicale. Rappelons, à cet égard, la salutaire jurisprudence européenne reconnaissant la spécificité française de cette discipline centrée autour de la médicalisation. Le droit européen autorise l’invocation du motif de santé publique pour encadrer la prestation des services de santé. Il importe de revisiter les règles prudentielles à l’aune de ce principe qu’il s’agisse de l’installation, du regroupement ou du transfert d’activités. La formulation d’une doctrine sur les règles de territorialité permettrait de répondre à cet enjeu (cf. proposition n° 8).
Les rapporteurs estiment en outre indispensable de renforcer l’effectivité des mesures prudentielles. L’article L. 6223-8 du code de la santé publique formule une obligation de priorité de cession des parts sociales ou actions au bénéfice des biologistes exerçant dans la société. Il conviendrait de s’assurer que cet objectif a réellement été recherché. La piste de la mise en place d’une infraction soumise à une sanction administrative proportionnée pourrait être creusée. Cette proposition nécessiterait de définir une infraction par la loi.
Proposition n° 10 :
Évaluer les effets de la mise en place d’une infraction aux obligations définies à l’article L. 6223-8 du code de la santé publique.
Enfin, les textes de loi consacrent la répartition des rôles entre les ARS, chargées d’appliquer les règles prudentielles, et les ordres professionnels, auprès desquels les sociétés exploitant un laboratoire sont inscrites.
Il importe, dès lors, que chacun des acteurs dispose de collaborateurs dûment formés pour assurer sa mission. Il serait sans doute opportun de définir un plan de formation pour accompagner la montée en charge des missions exercées par ces acteurs.
Proposition n° 11 :
Formaliser un plan de formation pour accompagner la montée en charge des missions exercées notamment par les ARS et les ordres professionnels.
L’enjeu de l’articulation des missions entre les ARS les ordres professionnels mérite aussi d’être soulevé. Cette réflexion renvoie à la mise en place d’un pilotage adapté et partagé, fondé sur un partenariat ouvert et éclairé. Se pose alors la question d’une gouvernance appropriée tant à l’échelle nationale qu’au niveau territorial.
Proposition n° 12 :
Préciser la gouvernance du contrôle des sociétés exploitant les laboratoires de biologie médicale assuré par les ARS et les ordres professionnels.
IV. LA « QUALITÉ PROUVÉE » : UN DÉFI QU’IL RESTE À RELEVER
Tous les acteurs interrogés par les rapporteurs ont souligné l’importance du travail accompli pour la mise en place de l’accréditation. Personne n’a ménagé ses efforts pour respecter les délais impartis par les textes. Le calendrier d’accréditation prévoit ainsi plusieurs étapes depuis la preuve de l’entrée effective dans la démarche jusqu’à sa progressive mise en place, par paliers successifs. À terme, 100 % des actes, actes innovants mis à part, seront concernés.
Les rapporteurs se félicitent de l’implication des acteurs tout en constatant que les efforts doivent être maintenus pour honorer la prochaine échéance fixée au 1er novembre 2016. Plusieurs conditions doivent être en effet réunies pour y parvenir : force est de constater qu’à ce jour, quelques inconnues demeurent.
A. LA DÉMARCHE D’ACCRÉDITATION : UNE MISE EN PLACE POUSSIVE
Le rapport Ballereau a souligné la nécessité d’engager une politique d’accréditation des laboratoires de biologie médicale. Partant du constat d’une grande disparité des garanties de qualité selon les laboratoires, le rapport formule l’exigence d’une accréditation obligatoire et assise sur des référentiels européens et internationaux.
Cette orientation tranche avec l’organisation antérieure à l’adoption de l’ordonnance portant réforme de la biologie médicale. Jusqu’à cette date, l’activité des laboratoires reposait sur un système d’autorisation. Dans son ancienne rédaction, l’article R. 1131-13 du code de la santé publique disposait que les laboratoires de biologie médicale susceptibles de pratiquer des examens y étaient autorisés sous certaines conditions :
– tenant à la disposition des équipements nécessaires à la réalisation des examens dont la liste est arrêtée par le ministre chargé de la santé après avis de l’Agence de la biomédecine ;
– tenant au respect de conditions d’implantation et de conditions techniques de fonctionnement.
Les nouvelles règles prévues substituent au régime d’autorisation celui d’une simple déclaration assortie d’une accréditation.
Parallèlement, l’article L. 6221-1 dispose qu’un laboratoire de biologie médicale ne peut réaliser d’examen de biologie sans accréditation.
a. Une mise en œuvre progressive
Cette démarche implique que chaque laboratoire soit en mesure de produire des résultats justes, reproductibles et traçables. Il est en effet nécessaire de s’assurer de la qualité technique et médicale des examens pratiqués sur les patients. À cet effet, l’accréditation suppose de reconsidérer le « management » au sein des laboratoires à l’aune de l’organisation du travail des équipes, de la transmission de l’information, de la production de données et de leur contrôle. Les organisations auditionnées, représentantes du secteur privé comme du public, conviennent à cet égard que la démarche d’accréditation se révèle un véritable outil de management des équipes dont les conséquences se font ressentir tant sur l’appréhension du métier que sur l’organisation des processus de travail.
L’accréditation porte sur les trois phases afférentes aux examens de biologie médicale (phases pré-analytique, analytique et post-analytique) ainsi que, le cas échéant, sur les activités biologiques d’assistance médicale à la procréation ou sur les examens d’anatomie et de cytologie pathologique.
L’article 8 de la loi portant réforme de la biologie médicale prévoyait une progressive montée en charge du dispositif avec un objectif de taux d’accréditation à 100 % fixé au 31 octobre 2020.
Jusqu’à cette date, les laboratoires de biologie autorisés à exercer devront satisfaire à certaines obligations prévues par l’article 7 de l’ordonnance n° 2010-49 du 13 janvier 2010 relative à la biologie médicale.
L’article L. 6222-1 du code de la santé publique dispose que l’ouverture d’un laboratoire de biologie médicale est subordonnée au dépôt d’une déclaration auprès de l’agence régionale de santé dont le contenu est fixé par la voie réglementaire. Jusqu’à cette même date, le guide des bonnes exécutions de l’analyse est ainsi opposable aux LBM non encore accrédités dans des conditions fixées par arrêté ministériel (42).
Dans cet intervalle, différents jalons ont été définis et approuvés par le législateur.
● Une première étape a été fixée au 1er novembre 2013, les laboratoires devant apporter la preuve de leur entrée en accréditation avant cette date. L’article 8 de l’ordonnance précitée dispose ainsi qu’ « aucun laboratoire de biologie médicale non accrédité au sens de l’article L. 6221-1 du code de la santé publique ne peut fonctionner après le 1er novembre 2013 sans respecter les conditions définies par arrêté du ministre chargé de la santé justifiant de son entrée effective dans une démarche d’accréditation ».
Un arrêté daté du 17 octobre 2012 (43) a défini les conditions justificatives de l’entrée effective dans la démarche d’accréditation. Deux options avaient alors été définies.
Une première option (option A) faisait reposer l’entrée effective sur une démarche d’accréditation partielle de certains examens couplée au dépôt d’un dossier relatif aux examens pratiqués en dehors du champ d’accréditation. La preuve de l’entrée effective devait être déterminée sur le fondement de l’ensemble des documents fournis, la date limite ayant été fixée au 31 mai 2013.
Une seconde option (option B) consistait en l’envoi, avant le 31 mai 2013, d’une demande de vérification d’entrée effective dans la démarche d’accréditation. Pour ce faire, ils devaient apporter la preuve qu’ils possédaient la qualification délivrée par l’association « Bioqualité ».
● Deux étapes ont par ailleurs été définies afin d’atteindre l’objectif d’un taux d’accréditation de 100 % en 2020 :
– une obligation d’accréditation portant sur 50 % des examens réalisés au 1er novembre 2016. À cet effet, les LBM ont déposé au comité français d’accréditation (Le Cofrac) un dossier au plus tard le 30 avril 2015 ;
– une obligation d’accréditation portant sur 70 % des examens réalisés au 1er novembre 2018, un dossier devant être déposé au Cofrac au plus tard le 30 avril 2017 ;
– pour 2020, un dossier doit être déposé au Cofrac le 30 avril 2019 au plus tard.
b. Le champ de l’accréditation est balisé
L’accréditation ne porte pas sur les examens de biologie médicale innovants hors nomenclature avant leur évaluation clinique ou médico-économique par la Haute Autorité de santé (HAS) comme le rappelle l’article 7 de l’ordonnance précitée. En outre, les accréditations portent sur chacune des familles d’examens de biologie médicale, la famille désignant une « activité à compétence technique cohérente et identifiée par le Cofrac dont les limites sont usuellement reconnues et acceptées par les pairs » (44). Ces familles sont répertoriées dans l’annexe 1 de l’arrêté du 17 octobre 2012.
En revanche, les laboratoires installés dans certains territoires et départements (la Guadeloupe, la Guyane, la Martinique, Mayotte, Saint-Barthélemy, Saint-Martin et Saint-Pierre-et-Miquelon) seront soumis à une procédure d’accréditation dont les modalités d’aménagement seront prévues dans un décret. Les laboratoires réunionnais ne sont pas concernés par cette disposition. Ce décret est aujourd’hui prêt sa publication étant liée à celle du décret relatif à la biologie médicale.
c. L’accréditation repose sur un système de normes
Selon le rapport Ballereau, l’accréditation «est un processus par lequel un organisme indépendant vérifie la conformité d’une structure à des exigences spécifiques, avec la mise en œuvre d’un système d’assurance qualité et les compétences techniques nécessaires ».
La norme ISO/CEI 17000 définit l’accréditation comme une « attestation délivrée par une tierce partie, ayant rapport à un organisme d’évaluation de la conformité (45), constituant une reconnaissance formelle de la compétence de ce dernier à réaliser des activités spécifiques d’évaluation de la conformité ».
L’accréditation doit être distinguée de la certification. Cette dernière consiste en une attestation réalisée par une tierce partie relative à des produits, des processus, des systèmes ou des personnes. L’accréditation est une procédure plus poussée : outre la reconnaissance de la conformité du système à un référentiel préétabli, l’accréditation vise aussi à reconnaître la compétence technique des personnels des laboratoires de biologie médicale.
Aux termes de l’article L. 6221-2, l’accréditation du laboratoire de biologie médicale est délivrée lorsqu’il est satisfait « aux critères définis par les normes harmonisées en vigueur applicables aux laboratoires de biologie médicale, dont les références sont fixées par un arrêté des ministres chargés de la santé et de l’industrie, pris après avis de la Haute Autorité de santé ».
Aux termes d’un arrêté daté du 5 août 2010 (46), les normes d’accréditation en vigueur applicables aux laboratoires de biologie médicale sont la norme NF EN ISO 15189 pour les activités et examens mentionnés à l’article L. 6221-1 et la norme NF EN ISO 22870 pour les examens de biologie médicale mentionnés à l’article L. 6211-18 (47).
● L’accréditation prend principalement appui sur la norme NF EN ISO 15189 (48) qui combine des normes européennes (EN) et internationales (ISO), retranscrites dans le système français par l’association française de normalisation (Afnor).
La norme comporte deux parties s’attachant d’une part à la mise en place d’un système de management de la qualité, d’autre part aux exigences techniques spécifiques aux laboratoires de biologie médicale.
Cette norme se distingue par son but ultime consistant en l’instauration d’une véritable démarche qualité au sein des laboratoires. Cette systématisation doit permettre une harmonisation des pratiques et suppose une profonde modification des méthodes de travail et d’organisation.
L’organisme accrédité doit ainsi démontrer que son activité répond à des exigences de qualité. Il doit aussi justifier de la mise en place d’un système de management de la qualité requérant une revue régulière des processus, et une dynamique d’amélioration continue et de maîtrise de la qualité.
Elle repose ainsi sur l’existence d’un système documentaire (manuel d’assurance de la qualité notamment) où sont décrites les procédures (diffusion, organisation, classement et révisions) et d’un management des ressources. Cet objectif requiert une gestion appropriée du personnel, la mise en place d’une méthode d’évaluation des procédures ou encore la diffusion des informations.
Elle suppose enfin l’instauration d’une cellule qualité au sein du laboratoire associée à une diffusion de la démarche qualité auprès de chacun des membres du personnel depuis le secrétaire jusqu’au biologiste. Pour chacune des activités, il importe de connaître la documentation de référence et les modes opératoires. La mise en application doit par ailleurs être validée auprès d’un référent. Des niveaux de compétence sont ainsi définis et évalués. Cette organisation suppose donc la mise en place de formations adaptées pour chaque membre du personnel.
● Dans le cas particulier de la biologie médicale délocalisée, c’est-à-dire, la réalisation d’examen en dehors des laboratoires de biologie médicale, la norme de référence est complétée par la norme spécifique NF EN ISO 22870 (49). Véritable exception à la règle de la tenue d’examens au sein des laboratoires, elle concerne le milieu hospitalier dans des cas particuliers (urgences, soins intensifs, bloc opératoire).
Article L. 6211-18 du code de la santé publique
« I. – La phase analytique d’un examen de biologie médicale ne peut être réalisée en dehors d’un laboratoire de biologie médicale qu’au cas où elle est rendue nécessaire par une décision thérapeutique urgente. Dans ce cas, la phase analytique est réalisée :
1° Soit dans un établissement de santé ;
2° Soit, pour des motifs liés à l’urgence, dans des lieux déterminés par arrêté du ministre chargé de la santé.
La lecture du résultat nécessaire à la décision thérapeutique est alors assurée par le médecin. Le biologiste médical conserve toutefois la responsabilité de la validation des résultats obtenus.
Les catégories de professionnels de santé habilités à réaliser la phase analytique en dehors d’un laboratoire de biologie médicale sont fixées par arrêté du ministre chargé de la santé.
II. – Les lieux de réalisation de l’examen et les procédures applicables, lorsque le laboratoire de biologie médicale relève de l’établissement de santé, sont déterminés par le biologiste-responsable. Le directeur de l’établissement veille à leur application.
Lorsque le laboratoire de biologie médicale ne relève pas de l’établissement de santé, une convention déterminant les lieux de réalisation de l’examen et fixant les procédures applicables est signée entre le représentant légal du laboratoire de biologie médicale, le représentant légal de l’établissement de santé et, le cas échéant, pour les établissements de santé privés, les médecins qui réalisent la phase analytique de l’examen de biologie médicale ».
● Ces références normatives se distinguent du guide de bonne exécution des analyses de biologie médicale (GBEA) qui formalise actuellement la démarche qualité des laboratoires de biologie médicale (50). Ce guide décrit les règles et les recommandations nécessaires à la réalisation des examens de biologie médicale dans de bonnes conditions. Il précise aussi les procédures à suivre pour chacune des étapes de l’examen de biologie médicale, du prélèvement jusqu’à la remise du résultat. Le GBEA présente de nombreuses similarités avec les référentiels normatifs portant accréditation mais les règles qu’il fixe restent toutefois en deçà de leurs exigences. Le rapport Ballereau avait ainsi conclu à l’abandon progressif du GBEA au profit du nouveau système d’accréditation.
d. Le rôle majeur joué par le Cofrac
Aux termes de l’article L. 6221-2, l’accréditation est délivrée par l’instance nationale d’accréditation mentionnée au I de l’article 137 de loi de modernisation de l’économie (51).
Cet article institue une instance nationale d’accréditation, seule habilitée à délivrer les certificats d’accréditation en France. Il dispose qu’un décret en Conseil d’État désigne cette instance et fixe ses missions.
Aux termes de l’article premier du décret du 19 décembre 2008 (52), l’instance nationale d’accréditation est le Comité français d’accréditation (Cofrac), placé sous le régime de la loi du 1er juillet 1901.
L’article 3 du même décret dispose que le Cofrac fixe « les conditions devant être remplies par tout organisme demandant son accréditation » et que « l’appréciation du respect de ces conditions est faite par des évaluateurs et des experts choisis par le comité, lequel en assure la formation et la qualification ».
Enfin, l’article 4 fixe les conditions de contrôle de l’accréditation. Il est assuré par le directeur général du Cofrac sur place et sur pièces. En cas de manquement, il peut prendre toutes les mesures appropriées pour restreindre, suspendre ou retirer l’accréditation conformément au III de l’article L. 6221-2 du code de la santé publique.
L’accréditation des laboratoires de biologie médicale est suivie au sein d’une des quatre sections spécialisées de l’association, la section « santé humaine ».
Présentation du Cofrac
Le Cofrac est une association de droit privé à but non lucratif créée en 1994. Il exerce une mission d’intérêt général en sa qualité d’unique instance nationale d’accréditation. En complément, et pour une part seulement de ses activités d’accréditation, lorsque l’accréditation est obligatoire, le Cofrac est chargé de l’exécution d’un service public administratif aux termes de la jurisprudence du Conseil d’État (CE, 23 décembre 2010).
Pour assurer sa mission d’accréditation, le Cofrac s’appuie sur trois instances de concertation composées chacune de représentants de toutes les parties intéressées, sans prédominance d’aucune, permettant ainsi de préserver l’objectivité et l’impartialité des décisions. Ces trois instances sont : le conseil d’administration, les comités de section et les commissions techniques d’accréditation :
– le conseil d’administration, qui compte 21 membres, est l’instance de pilotage stratégique, chargée de déterminer les orientations de l’activité et de veiller à leur mise en œuvre. Il approuve les tarifs, arrête les comptes et fixe le budget annuel. Il décide de l’organisation des activités du Cofrac et nomme les membres des comités de section.
– les quatre sections d’accréditation du Cofrac dont trois sont chargés d’un domaine d’accréditation (laboratoires, inspection, certifications) et une d’un secteur (Santé Humaine) s’appuient chacune sur un comité de section. Ils sont chargés de définir les règles spécifiques d’accréditation applicables dans leur domaine ou secteur, de créer des commissions techniques d’accréditation et de veiller à leur bon fonctionnement, de valider les propositions de tarifs et d’examiner les recours en première instance. Le comité de section de la santé humaine compte 20 membres dont 6 représentants de laboratoires de biologie médicale privés et hospitaliers ;
– les commissions techniques d’accréditation sont chargées d’examiner les rapports d’évaluation des organismes et d’émettre un avis sur les suites à donner, ainsi que de participer au recrutement des évaluateurs techniques. Pour la section santé humaine, elle est actuellement composée de 32 membres dont 21 représentants des laboratoires de biologie médicale publics ou privés.
Source : Cofrac.
a. Une démarche acceptée par les parties prenantes
De l’avis de l’ensemble des acteurs, l’entrée dans la démarche d’accréditation, souhaitée par les parties prenantes, est un succès indéniable. C’est aussi la conviction de vos rapporteurs. Relever ce premier défi a nécessité un engagement inconditionnel des biologistes en exercice ainsi que des organismes tels que le Cofrac. Cet investissement sans faille est à mettre au crédit de la réforme.
Selon les informations transmises aux rapporteurs, l’ensemble des laboratoires de biologie médicale a obtenu la preuve d’entrée effective dans la démarche d’accréditation au sens de l’arrêté du 17 octobre 2012, à l’exception notable de deux d’entre eux. Pour ce faire, les laboratoires devaient déposer un dossier auprès du Cofrac soit pour une première accréditation (voie A) soit pour apporter la preuve qu’ils possédaient le label délivré par un organisme privé « Bioqualité » (voie B).
Au 31 octobre 2013, 1 384 LBM avaient fait la preuve de leur entrée dans la démarche, 48 % selon l’option A et 52 % selon l’option B. 26 % d’entre eux étaient des laboratoires publics de santé.
Depuis, le nombre de LBM n’a cessé de baisser, essentiellement du fait des regroupements de laboratoires dans le secteur privé.
S’agissant de la prochaine étape fixée au 1er novembre 2016, les laboratoires de biologie médicale ne pourront fonctionner sans disposer d’une accréditation portant sur 50 % des examens de biologie médicale qu’ils réalisent avec au moins un examen accrédité par famille. Un décret daté du 23 février 2015 (53) a enjoint les LBM à transmettre au plus tard le 30 avril 2015 leur dossier et au plus tard le 30 juillet 2015 les pièces complémentaires utiles pour étudier cette demande.
Au 31 décembre 2015, le Cofrac recense 1 051 LBM entrés dans la démarche d’accréditation (54). 608 d’entre eux sont accrédités et 78 voient leur démarche d’accréditation en cours d’instruction, soit 65 % du stock.
À la première échéance de la loi, soit le 31 octobre 2016, le Cofrac estime que le nombre de LBM se stabilisera autour de 1 000.
ÉTAT D’AVANCEMENT DE LA DÉMARCHE D’ACCRÉDITATION AU 31 DÉCEMBRE 2015
Accréditations effectives |
Processus d’accréditation en cours (évaluation initiale réalisée) |
Demandes initiales d’accréditation reçues à traiter |
Total |
Nombre de laboratoires de biologie médicale au 31 octobre 2013 | |
Nombre de laboratoires de biologie médicale |
608 |
78 |
365 |
1 062 |
1 384 |
Dont LBM « hospitaliers » |
187 |
33 |
102 |
324 |
359 |
Dont LBM privés et publics non hospitaliers |
421 |
45 |
263 |
738 |
1 025 |
Source : Cofrac.
Deux enseignements peuvent en outre être tirés de ce bilan :
– le principe même de l’accréditation est accepté par les parties prenantes. Le Cofrac souligne à cet égard que « cette évolution est un point d’appui important à préserver pour l’atteinte de l’objectif imposé par la réforme de la biologie médicale » ;
– Il n’existe pas de différence notable entre laboratoires publics et privés du point de vue de l’entrée effective dans la démarche ni du processus d’accréditation.
Cela étant, le Cofrac souligne « que les laboratoires hospitaliers ont éprouvé plus de difficultés à déployer leur système de management de la qualité, en raison de ressources déjà très sollicitées ou de lourdes restructurations ». À ce titre, ils ont souvent eu besoin d’un accompagnement spécifique.
Du côté des ARS, il est souligné que les laboratoires hospitaliers ont majoritairement opté pour la voie A (demande d’accréditation initiale) quand les LBM du secteur libéral se sont principalement engagés dans la voie B. Les LBM hospitaliers porteraient aujourd’hui la dynamique de la réforme compte tenu de la différence de voie d’engagement et des regroupements observés dans le secteur libéral.
Des efforts considérables ont ainsi été accomplis dans un contexte difficile de réforme et de restructuration par les laboratoires de biologie médicale, tant publics que privés.
b. Une visibilité accrue du nombre de laboratoires
Cette étape a également permis d’avoir une meilleure appréhension du panorama de la biologie médicale, en particulier le nombre de laboratoires et leur activité. Les services du ministère de la santé ont ainsi développé un outil de recensement des laboratoires publics comme privés, Biomed. Il permet de suivre les divers « mouvements » opérés par les laboratoires et d’avoir en temps réel une liste de laboratoires à jour.
c. Des défis sont encore à relever
Ces résultats, faut-il le répéter, ont été atteints grâce à l’implication des acteurs. Pour déterminante qu’elle soit, cette implication ne doit pas masquer certaines insuffisances.
● La nécessaire révision du référentiel applicable aux LBM
Aux termes de l’article L. 6221-1 du code de la santé publique, le guide de bonne exécution est opposable aux LBM non encore accrédités, au sens de l’article 6221-1 du code de la santé publique c’est-à-dire à 100 %, sur la partie non encore accréditée. Cette opposabilité ne fait pas débat mais la question de l’actualisation du référentiel a été soulevée.
Le guide de bonne exécution des analyses (GBEA) repose aujourd’hui sur un arrêté daté de 1999 qui ne tient pas compte des nouvelles dispositions introduites par la réforme (55).
Les dispositions du GBEA nécessitant d’être actualisées comprennent aussi bien des modifications d’ordre sémantique (biologiste-responsable, biologiste médical, laboratoire de biologie médicale, examen et comptes rendus de résultats de biologie médicale) que des changements de fond (modification de la définition de la validation biologique, sous la responsabilité d’un biologiste médical, insertion de l’obligation de participer à des contrôles externes de qualité, intégration de la nécessité d’identifier le patient et son échantillon biologique par notamment son nom de famille appelé aussi nom de naissance, etc.).
En définitive, le GBEA demeure le référentiel opposable de bonnes pratiques pour tous les LBM non accrédités sur l’ensemble de leur activité. Aussi son absence de révision depuis plus de 10 ans a-t-elle un impact défavorable qui n’est pas circonscrit aux seules ARS.
Proposition n° 13 :
Procéder à la révision de l’arrêté relatif à la bonne exécution des analyses.
● La recomposition de l’offre de biologie : un bilan en demi-teinte
La mise en place de la démarche d’accréditation implique de reconsidérer le travail du biologiste médical à l’aune des normes qualitatives. L’intérêt de l’accréditation consiste en effet à s’assurer, sous le contrôle des pairs, que les actes de biologie médicale soient accomplis non seulement dans les « règles de l’art » mais aussi dans le souci constant ne pas porter atteinte à la santé des patients.
Du fait des mécanismes de contrôle qu’elle implique, la mise en place de l’accréditation suppose que chaque laboratoire dispose des ressources nécessaires en personnel et en connaissances pour justifier du respect des normes d’accréditation. Cet impératif est plus aisément atteint lorsque le laboratoire dispose d’une taille critique suffisante pour y répondre sans compromettre ni la sécurité des patients ni son développement économique.
Pourtant, de l’avis de certains acteurs, professionnels en exercice comme représentants de l’ordre des pharmaciens, l’entrée en accréditation n’a, dans certains cas, pas été suffisamment réfléchie. Elle a pu constituer pour certains acteurs un leitmotiv suffisant en soi mais sans considération sur les perspectives stratégiques tenant à la viabilité du laboratoire.
La preuve de l’entrée en accréditation est en effet une condition nécessaire pour maintenir l’activité d’un laboratoire. Rappelons à cet égard que l’article L. 6221-1 du code de la santé publique requiert qu’un LBM ne puisse réaliser d’examens de biologie médicale sans accréditation. L’entrée en accréditation n’est toutefois pas suffisante si l’on se donne la peine de reconsidérer la réforme d’un point de vue plus global. Il semble en effet que la démarche d’accréditation ait parfois pris le pas sur la restructuration.
De l’avis du conseil national de l’ordre des pharmaciens, il aurait été préférable de différer la mise en place de la démarche d’accréditation au bénéfice d’une recomposition préalable de l’offre de biologie et d’une réflexion sur les rapprochements ou les coopérations. Il s’ensuivra une déperdition de temps et d’énergie. Les dossiers d’accréditation des structures non organisées, en instance au Cofrac, devront de toute façon être retirés au profit d’une nouvelle demande d’accréditation adaptée à la nouvelle structure.
Le Cofrac relève que le mouvement continu de restructuration peut poser des difficultés passagères pour la mise en œuvre de l’accréditation. Toutefois, il estime que le télescopage entre restructuration et accréditation est d’une ampleur plutôt limitée même si la perspective de mener de front ces deux mouvements peut être vécue comme anxiogène par les laboratoires. Une distinction doit de toute façon être opérée entre les secteurs publics et privés. Le Cofrac estime en effet que la vague de restructuration des laboratoires privés est d’ores et déjà passée alors qu’il n’en est pas de même pour le secteur public. Les restructurations dépendent pour beaucoup de la mise en place des groupements hospitaliers de territoire et de leur encadrement par la loi de modernisation de notre système de santé. La conjonction de cette incertitude et de la prochaine étape fixée au 1er novembre 2016 est source de tensions.
Cette absence de vision stratégique, imputable aux professionnels en exercice, ne doit pas non plus masquer les insuffisances constatées dans le domaine du contrôle de l’accréditation. Les rapporteurs aimeraient à cet égard souligner plusieurs points.
La non-publication de certains textes a ainsi pesé sur la mise en œuvre de la réforme. L’absence de normes ou de règles de conduite a pesé sur la mise en place de la démarche d’accréditation et a pu en résulter en une interprétation erronée des textes. Il en est ainsi de l’article L. 6222-6 du code de la santé publique relatif à la présence des biologistes sur site.
Les auditions ont mis en lumière une certaine hétérogénéité dans l’interprétation de la disposition. Le Cofrac a ainsi anticipé la parution du décret afférent en énonçant ses propres règles. Dans un certain nombre de cas, il a été rapporté que la présence permanente d’un biologiste sur chacun des sites aux horaires d’ouverture était requise en contradiction avec la lettre de la disposition adoptée par le législateur.
Selon le syndicat des laboratoires de biologie clinique et l’association pour la promotion de la biologie médicale, la loi est claire et ne fait pas débat parmi les professionnels. Le biologiste responsable du site peut effectuer certaines actions à distance (validation biologique, suivi des urgences, dialogue avec le clinicien, prestation de conseil, etc.), ce qui permet de suivre des formations, de participer à des réunions scientifiques, ou même de réaliser des audits pour le compte du Cofrac.
Interrogé sur ce point, le Cofrac estime, qu’en l’absence de publication des textes, une doctrine a effectivement été formulée par le comité de la section « santé humaine ». L’article L. 6222-6 du code de la santé disposant que sur « sur chacun des sites, un biologiste du laboratoire doit être en mesure de répondre aux besoins du site et, le cas échéant, d’intervenir dans des délais compatibles avec les impératifs de sécurité des patients », le Cofrac estime qu’au moment de la visite d’accréditation un biologiste doit être effectivement présent. Au demeurant, le Cofrac souligne qu’il est souvent attribué à la structure permanente du Cofrac d’imposer des prises de position qui résultent en fait des représentants mêmes de la profession au sein des instances du Cofrac.
Interrogé sur cet aspect, le ministère de la santé reconnaît qu’une certaine confusion des rôles a pu prévaloir. Le rôle du Cofrac consistant à s’assurer du respect des normes d’accréditation, il importe que les évaluateurs accomplissent leur mission à l’aune de ces références. Il revient par contre aux ARS de s’assurer du respect des normes législatives et réglementaires. C’est la raison pour laquelle, le Cofrac a été invité par le ministère de la santé à actualiser ses documents pour tenir compte de cette séparation des rôles. Un texte remanié devrait pouvoir être publié au cours du premier trimestre 2016. Les rapporteurs se félicitent de ces clarifications bienvenues.
La question de la pertinence des contrôles effectués par le Cofrac a aussi été soulevée par certains acteurs. Plusieurs points ont ainsi été relevés.
L’acculturation du Cofrac aux enjeux médicaux n’est pas encore effective. Historiquement centrée sur l’accréditation industrielle, l’action du Cofrac nécessite aujourd’hui de prendre davantage en considération les impératifs sanitaires liés à la biologie médicale. La création d’une section spécifique « santé humaine » chargée du suivi de l’accréditation est un grand pas qui a été accompli. Cette orientation doit toutefois être confortée par un renforcement des connaissances et des compétences en santé. Or, de l’avis des professionnels, cet impératif n’a pas été suffisamment anticipé par le Cofrac et s’est traduit par un resserrement du contrôle sur la maîtrise métrologique, qui constitue de l’accréditation industrielle, sans pouvoir apprécier l’activité de biologie médicale dans son intégralité. Cette situation pèse sur les professionnels en exercice qui regrettent d’être sursollicités pour des « contrôles tatillons ». Elle se traduirait par une relative démotivation des équipes qui se sont beaucoup impliquées dans la démarche.
L’édiction d’une feuille de route ou d’un cahier des charges des audits permettrait de davantage encadrer l’exercice et de répondre aux préoccupations exprimées par les professionnels du secteur de la biologie médicale.
● La connaissance des coûts doit être affinée
La mise en place d’une démarche d’accréditation n’est pas neutre pour les LBM qui s’y astreignent. Elle emporte des coûts directs, liés au contrôle de l’accréditation, et des coûts indirects induits par les nécessaires mesures de réorganisation.
Les frais d’accréditation se répartissent en 3 catégories : les frais d’instruction, les frais d’évaluation et la redevance annuelle correspondant au maintien du service public d’accréditation.
Les frais d’instruction sont destinés à couvrir les coûts liés à l’enregistrement de la demande et l’examen du dossier par le Cofrac jusqu’à sa recevabilité. Ils sont forfaitaires et actuellement de 1 333 euros pour une demande initiale d’accréditation et 923 euros pour une demande d’extension d’accréditation.
Les frais liés à l’évaluation englobent les frais logistiques engagés par l’équipe d’évaluation, la rémunération de l’équipe d’évaluation, les ressources engagées pour le traitement du rapport d’évaluation et la notification de la décision d’accréditation. Ils dépendent de la taille du laboratoire (nombre de sites notamment) et de la portée présentée à l’accréditation (nombre de familles et d’examens de biologie médicale au sein de ces familles notamment). Pour un laboratoire de taille moyenne ces frais s’élèvent à environ 18 000 euros pour une évaluation initiale, y compris la phase d’expertise documentaire préalable. Ils sont inférieurs pour les évaluations de suivi ou de renouvellement à portée constante d’accréditation.
Une fois accrédités, les LBM paient une redevance annuelle. Les frais de redevance sont destinés à couvrir les différentes opérations nécessaires au maintien du service public d’accréditation afin de satisfaire tous les acteurs concernés, duquel découle le droit d’usage de la marque Cofrac. Le coût dépend de la taille du laboratoire et de la portée d’accréditation : pour un laboratoire de taille moyenne (4 sites, 8 familles couvertes), ces frais de redevance annuels sont d’environ 6 000 euros.
Selon le Cofrac, l’ensemble ces coûts représente en moyenne et par année 0,25 à 0,5 % du chiffre d’affaires d’un laboratoire de biologie médicale.
Notons que plus la taille du laboratoire est importante, moins le coût rapporté au chiffre d’affaires est important. Cette démarche implique nécessairement une réorganisation du secteur des LBM.
La qualité des pratiques et des techniques engendre des coûts qui ne peuvent être rapportés directement à l’accréditation.
Enfin, les pratiques liées à la démarche qualité sont antérieures à la réforme de 2010 comme en témoigne l’application du guide de bonne exécution des analyses de biologie médicale.
Cela étant, la démarche d’accréditation implique des frais supplémentaires. Selon la direction générale de la santé, les coûts engendrés par le recrutement de qualiticiens et les techniques de métrologie sont évalués entre 1 et 1,5 % du chiffre d’affaires du laboratoire. Ce chiffrage ne fait cependant pas l’unanimité.
Le coût de l’accréditation représenterait, selon la fédération hospitalière de France, jusqu’à 5 % du chiffre d’affaires la première année, puis 0,8 % les années suivantes. La métrologie constitue un poste important pour la remise à niveau. Ce coût serait toutefois compensé par l’amélioration de l’organisation, la redéfinition des postes de travail ainsi qu’une meilleure efficience du service rendu. En tout état de cause, la question du coût, pour importante qu’elle soit, doit être mise au regard de l’amélioration de la sécurité et la qualité des examens. La dépense n’est pas inaccessible pour l’immense majorité des laboratoires et fait l’objet d’un amortissement après quelques années d’exercice.
Une étude permettrait de porter un regard objectif sur les bénéfices attendus de la réforme selon les laboratoires. Dans le cas des hôpitaux publics, elle pourrait également s’attacher à évaluer les effets de la coopération entre établissements dans le domaine de la biologie médicale.
Proposition n° 14 :
Procéder à une évaluation des coûts et des avantages de la démarche d’accréditation pour les laboratoires publics et privés.
● La question de la formation des biologistes
La qualification des biologistes médicaux constitue un autre enjeu de la réforme.
Un premier constat positif peut être tiré de l’accréditation effective de plus de 600 LBM. Ce chiffre indique que les professionnels ont les moyens d’appliquer les normes qui ont été fixées.
Selon le Cofrac, certains laboratoires ont dû renforcer les ressources en charge du pilotage du système de management de la qualité et leurs connaissances en matière de management de la qualité en participant à des formations diplômantes ou en faisant appel à un accompagnement pour la mise en place de la démarche.
La Fédération hospitalière de France (FHF) estime qu’il existe encore trop peu de formations validantes, malgré les efforts de mise en place de diplômes universitaires et de nombreuses sessions lors de congrès sur l’accréditation. Compte tenu du calendrier, la FHF estime qu’il est désormais indispensable de faire accompagner les hôpitaux publics par un consultant lorsqu’ils se sont tardivement engagés dans la démarche d’accréditation.
Le diplôme d’études spécialisées de biologie médicale ne comprend toujours pas de module d’accréditation permettant de sensibiliser les futurs professionnels aux enjeux de médicalisation, de qualité, de gestion des risques ou de management des personnels.
Or, cette insuffisance pèse d’une certaine façon sur le recrutement par le Cofrac des évaluateurs techniques. La ressource interne des LBM n’est pas immédiatement mobilisable pour la participation à l’évaluation faute de qualification.
Proposition n° 15 :
Instaurer un module d’accréditation dans le cadre du diplôme d’études spécialisées de biologie afin de sensibiliser les futurs professionnels aux enjeux de médicalisation, de qualité, de gestion des risques ou de management des personnels.
● Le maintien du cap pour 2016, 2018 et 2020
Plusieurs étapes doivent être franchies avant d’atteindre l’objectif d’un taux accréditation de 100 % en 2020.
Les avis divergent quant à l’atteinte de la première étape. L’ordonnance du 13 janvier 2010 impose à tous les laboratoires de biologie médicale français d’être accrédités au plus tard au 31 octobre 2016 à hauteur de 50 % des examens de biologie médicale qu’ils réalisent sous peine de ne plus pouvoir fonctionner.
Le décret n° 2015-205 du 23 février 2015 (56) a prévu le dépôt au Cofrac d’un dossier d’accréditation au plus tard le 30 avril 2015, soit 18 mois avant la date‐butoir, et de le compléter au plus tard le 30 juillet 2015. La fixation de cette date a déjà suscité quelques crispations.
Le syndicat national des médecins biologistes a ainsi dénoncé la date retenue : ce choix aurait en effet mis gravement en difficulté les laboratoires qui étaient en cours d’accréditation.
Selon le syndicat des biologistes, le choix de cette date aurait été motivé par le manque d’évaluateurs techniques et par la crainte du Cofrac de ne pas pouvoir assurer dans les délais le traitement de tous les laboratoires. Le syndicat a d’ailleurs saisi le Conseil d’État sur le décret précité (57) .
Cela étant, tous partagent la même crainte : celle ne pas atteindre le palier de 2016, faute de décision d’accréditation rendue en temps utile par le Cofrac. Cette crainte est attestée par le courrier accusant réception du dépôt du dossier d’accréditation par les LBM. Ce courrier, qualifié au mieux de « peu diplomatique », indique que le Cofrac n’est pas en mesure de garantir à tous une accréditation au 31 octobre 2016.
Le courrier appelle l’attention sur le manque d’évaluateurs techniques « seuls habilités en tant que pairs à procéder aux évaluations d’accréditation, qui ont accepté de remplir ces missions ». Le même courrier précise qu’ « il est possible que le Cofrac ne puisse proposer la signature d’une convention que plusieurs mois après sa décision favorable de recevabilité administrative de votre demande, faute d’évaluateurs techniques disponibles ». Il indique à cet effet que « la décision relative à l’accréditation sollicitée pourrait être notifiée postérieurement au 31 octobre 2016. ».
Les représentants des ARS estiment qu’il est impératif de tenir ce délai. Pour des motifs tenants aux impératifs de continuité de l’offre de soins de biologie médicale, il n’est pas envisageable de fermer les LBM non accrédités à 50 % de leur activité au 31 octobre 2016.
Or, force est de constater que la tâche à accomplir est encore conséquente.
Selon ses dernières estimations, le Cofrac estime qu’au 31 octobre 2016 environ 300 LBM ne répondront pas aux critères de la loi. Ce chiffre comprend des structures n’ayant pas encore été accréditées ou possédant une accréditation partielle.
Un effort considérable doit en effet être entrepris en termes d’évaluation pour accréditer les « nouveaux entrants » et étendre la portée d’accréditation des LBM déjà accrédités. Selon le Cofrac, 90 % des LBM déjà accrédités ont ainsi déposé une demande d’extension.
L’extension de l’accréditation
L’extension de l’accréditation est un processus d’élargissement de la portée de l’accréditation. Elle revient à élargir la liste des compétences du laboratoire de biologie médicale. L’extension de l’accréditation peut également revenir à augmenter le nombre de sites couverts par la portée.
Le Cofrac indique que le processus d’évaluation est sensiblement le même que celui d’une demande initiale. Toutefois, le système de management de la qualité du laboratoire ayant déjà été évalué, la durée de l’évaluation est diminuée.
Cet effort doit en outre être accompli en sus des évaluations de suivi et de renouvellement que le Cofrac doit réaliser au titre des accréditations qu’il a déjà délivrées, ce qui réduit d’autant les disponibilités des évaluateurs.
En effet, le cycle de surveillance et de renouvellement des accréditations est fixé par les règles internationales. Elles reposent sur trois principes que le Cofrac n’a pas manqué de souligner lors de son audition :
– le Cofrac doit démontrer que les activités de surveillance et de renouvellement qu’il réalise sont suffisamment rapprochées pour vérifier que l’organisme accrédité continue de satisfaire aux exigences d’accréditation ;
– les activités de surveillance doivent être réparties de telle sorte que des échantillons représentatifs de la portée des organismes accrédités (LBM) sont examinés de manière régulière ;
– l’intervalle entre les évaluations sur site d’un organisme accrédité doit être fonction de la stabilité démontrée à laquelle sont parvenus les services de l’organisme accrédité. La stabilité de l’organisme est ainsi appréciée au cas par cas.
La mise en application de ces principes est en outre encadrée par des limites maximums de délai à respecter. L’intervalle entre deux évaluations sur site ne peut excéder deux ans et il est recommandé de réaliser la première évaluation de surveillance sur site de l’organisme dans un délai de 12 mois à compter de la date d’accréditation initiale.
Ce simple constat amène à s’interroger sur la question de la responsabilité juridique des acteurs.
Pour les LBM, le défaut d’examen des demandes d’accréditation ne doit pas porter préjudice au maintien de leur activité. En l’absence d’accréditation, les laboratoires se trouvent dans une situation juridique instable puisque le maintien de l’activité est juridiquement conditionné au respect des normes d’accréditation. Pour les rapporteurs, il n’est pas concevable de pénaliser des structures qui se seraient acquittées de toutes leurs obligations en raison d’une défaillance de l’organisme d’accréditation.
Aucun support juridique ne permet aujourd’hui au directeur général d’une ARS de maintenir en activité un LBM potentiellement accréditable mais n’ayant pas reçu son accréditation du Cofrac. Dès lors, rien n’empêcherait le développement de contentieux susceptibles de mettre en jeu la responsabilité d’un directeur général d’ARS.
Une mise en cause de la responsabilité du Cofrac assortie à des demandes d’indemnisation n’est pas à exclure. Ce cas de figure porterait un sérieux coup d’arrêt à sa mission ainsi qu’à l’activité des nombreux industriels dont l’activité est subordonnée aux accréditations délivrées par l’organisme.
Différentes solutions ont été émises depuis les conditions requises pour obtenir l’accréditation jusqu’au report des échéances.
Un premier scénario consistait à revoir à la baisse les exigences d’accréditation. Cette solution n’est pas souhaitable et porterait un sérieux coup d’arrêt aux standards de qualité et de sécurité élevés des examens qui constituent le cœur de la réforme.
Un deuxième scénario avait semblé s’esquisser durant les travaux des rapporteurs. Elle consistait à reporter les prochaines étapes sans passer par la voie parlementaire. Il s’agissait en effet de déclasser certaines dispositions parmi lesquelles les prochaines dates butoirs. Cette piste a finalement été écartée après que les rapporteurs s’en sont inquiétés. Plusieurs motifs avaient justifié de ne pas s’y attacher.
La première justification à ce refus s’attache au respect des prérogatives du Parlement. Si les étapes ont été fixées par voie d’ordonnance, ce n’est qu’en vertu d’une délégation autorisée par le Parlement. Au demeurant, le Parlement a consacré la valeur législative des dispositions de l’ordonnance en la ratifiant expressément.
La deuxième raison pour opposer un refus tient à la nature du risque encouru par les laboratoires en cas de non-respect des dates butoirs. Les dispositions adoptées sont claires. Un laboratoire qui ne respecterait pas les exigences requises pour être accrédité doit être fermé. Cette atteinte à la liberté d’entreprendre ne peut être limitée que par le législateur. Ainsi, le Conseil constitutionnel a jugé qu’il est loisible au législateur d’apporter à la liberté d’entreprendre des limitations liées à des exigences constitutionnelles ou justifiées par l’intérêt général, à la condition qu’il n’en résulte pas d’atteintes disproportionnées au regard de l’objectif poursuivi. En résumé, fixer de nouvelles dates butoirs par la voie réglementaire ne présenterait pas toutes les garanties de sécurité juridique qui s’attachent à cette réforme.
La troisième raison tient à l’objectif recherché par le législateur : la qualité et la sécurité des actes de biologie médicale. Un report aurait porté une sérieuse atteinte à la crédibilité de la réforme et aurait miné les efforts entrepris par de nombreux laboratoires qui se sont investis avec sérieux dans cette démarche.
C’est donc un troisième scénario qui a été adopté. Esquissé par l’inspirateur de la réforme, il consiste à optimiser le dispositif existant sans réduire les exigences d’accréditation ni reporter les délais.
Une première orientation a consisté à réduire, en vue de la prochaine date butoir, le nombre de familles d’examens en fonction des techniques mises en œuvre. Cette solution permettrait de préserver les ressources en évaluateurs techniques et réduirait les coûts des évaluations. Un nouvel arrêté a été pris afin de modifier l’annexe des familles répertoriées à l’annexe 1 de l’arrêté du 17 octobre 2012 précité. Trois familles ont ainsi été définies contre 8 auparavant.
La réduction du nombre de familles d’examens faciliterait la démarche d’accréditation, sans la remettre en cause. Le regroupement des 8 familles en 3 grandes familles permettrait aux LBM de revoir leur demande en concentrant leurs efforts sur les examens les plus courants.
Ce regroupement allégerait en outre la démarche d’évaluation en n’obligeant pas à intégrer à l’équipe d’évaluation des évaluateurs plus spécialisés.
Cette solution, vivement souhaitée par vos rapporteurs, nécessite toutefois l’adhésion des LBM pour produire ses effets. Les dossiers ayant été déposés selon les anciennes règles, il importe en effet que les LBM soient disposés à reformuler leur demande d’accréditation ou d’extension en se limitant à une compétence sur chacune des familles. Au 13 janvier 2016, 46 % des LBM ont reformulé leur demande d’accréditation ou d’extension en se limitant à une compétence sur chacune des grandes familles. Environ un tiers des LBM sollicités a préféré maintenir la demande initiale, la réponse tenant au respect de la trajectoire définie pour une accréditation à horizon 2020 ou au maintien de leur activité (58).
Une seconde orientation a consisté à optimiser le nombre d’évaluateurs techniques pour faire face au calendrier des auditions.
La section « santé humaine » du Cofrac s’appuie aujourd’hui sur des évaluateurs techniques et des évaluateurs qualiticiens.
L’évaluateur qualiticien a la charge d’évaluer la pertinence et la conformité du système de management et de l’organisation générale du laboratoire en regard des exigences du référentiel d’accréditation.
La réalisation des audits, quant à elle, est confiée aux évaluateurs techniques qui ont la charge d’expertiser la compétence technique du laboratoire au regard des exigences du référentiel d’accréditation. L’accréditation étant basée sur une évaluation par les pairs, les évaluateurs techniques en biologie médicale sont, en France, exclusivement des biologistes médicaux. Au 13 janvier 2016, le Cofrac indique qu’il dispose d’un vivier de 280 évaluateurs contre 193 au 1er janvier 2015 et 148 au 1er janvier 2014.
Compte tenu du nombre de dossiers à traiter, les besoins en évaluateurs techniques avaient été évalués à 400 début 2016 pour faire face à l’échéance du 31 octobre 2016 qui s’impose à la totalité des laboratoires de biologie médicale. Il y a donc aujourd’hui un déficit d’au moins 120 évaluateurs techniques.
La ressource dépend de l’intérêt des biologistes médicaux pour cette mission et de la bonne volonté des laboratoires privés ou publics de biologie médicale à les mettre à disposition auprès du Cofrac.
Le vivier d’évaluateurs est par ailleurs insuffisamment représentatif du panel des laboratoires. Sur les 280 évaluateurs, seuls 18 % viennent du milieu hospitalier public alors que les laboratoires hospitaliers représentent près de 30 % du total des laboratoires et disposent en outre de compétences spécifiques qui ne sont pas disponibles dans les laboratoires privés. Le même rapport existe pour certains laboratoires privés de grande taille comportant plus d’une centaine de sites et plusieurs dizaines voire une centaine de biologistes médicaux. En définitive, la ressource disponible s’appuie principalement sur les laboratoires de taille moyenne. Proportionnellement au nombre de LBM, ce déficit est plus important en biologie hospitalière qu’en biologie libérale. Les biologistes du secteur public doivent davantage être sollicités. Sur les 120 évaluateurs manquants, un contingent de 80 biologistes médicaux issus des LBM publics est en effet nécessaire.
Le Cofrac a indiqué qu’il mettait toute en œuvre pour favoriser l’intérêt des biologistes médicaux pour ces missions d’évaluation, mais qu’il ne disposait d’aucun moyen pour imposer aux biologistes médicaux, actifs ou retraités, privés ou publics, de devenir évaluateurs. Il souligne en outre que l’obligation d’accréditation pouvait jouer contre le Cofrac, les biologistes médicaux susceptibles de devenir évaluateurs techniques étant aujourd’hui prioritairement employés à mettre à niveau leur laboratoire.
De son côté, la direction générale de la santé souligne le panel d’actions mis en œuvre en lien avec le Cofrac pour faciliter le volontariat : « optimisation et simplification de la procédure d’accréditation, instructions aux ARS, lettres aux directeurs des établissements de santé et aux biologistes pour attirer des candidatures, information des ordres et des syndicats, suivi rapproché avec les ARS et le Cofrac ».
S’agissant des laboratoires privés, la doctrine formulée par le Cofrac les dissuade d’accepter des missions d’évaluation compte tenu des risques qu’ils encourent en cas d’absence de leur site.
S’agissant des laboratoires publics, de nombreuses dispositions ont été prises pour faciliter le concours des biologistes médicaux. Malgré cela, force est de constater le relatif désintérêt ou le manque de disponibilité des biologistes médicaux hospitaliers pour cette mission. Les employeurs devraient être davantage sensibilisés à cette importante étape.
Les regroupements de LBM ont un impact marginal sur ces besoins en évaluateurs vu que le nombre de sites ne se réduit pas notablement, un même laboratoire couvrant désormais plus de sites en moyenne.
Le manque d’évaluateurs est dommageable selon les professionnels en exercice qui reprochent au Cofrac le non-respect des calendriers d’audits. Il ne serait pas rare d’observer de fréquentes révisions à la baisse des portées d’accréditation ou des annulations d’audits de dernière minute. Ces impondérables pèsent sur l’activité des laboratoires tout autant que sur la motivation des professionnels dont les équipes se sont beaucoup mobilisées.
Pour l’heure, le Cofrac a mis en place des actions susceptibles d’optimiser le travail du vivier actuel d’évaluateurs techniques.
Il leur a notamment été demandé d’augmenter sensiblement le nombre de missions qu’ils accepteront de faire sur le premier semestre 2016. Au 2 décembre 2015, 89 % des biologistes évaluateurs qualifiés ont répondu en acceptant en moyenne de réaliser chacun 5 missions d’évaluation entre janvier et juillet 2016, contre 3,5 en moyenne en 2015.
Proposition n° 16 :
Procéder à un suivi régulier de l’objectif moyen, fixé à 5 missions d’évaluation par évaluateur, en explicitant, le cas échéant, les écarts constatés.
Le rapport d’évaluation, auquel contribue l’évaluateur technique à la fin de sa mission, a été simplifié et allégé, afin de permettre aux évaluateurs de disposer de davantage de temps pour réaliser les évaluations sur site.
Enfin, le cycle de surveillance, qui intervient après le 1er renouvellement de l’accréditation, est allégé pour les LBM ayant démontré leur stabilité au regard des exigences de l’accréditation : une évaluation sur site est supprimée au profit d’une surveillance documentaire, moins consommatrice de ressources. Les premiers allégements démarrent début 2016. Une réflexion est entamée pour la dernière surveillance de la première période d’accréditation.
Ces mesures permettent d’augmenter le ratio entre le nombre de LBM accrédités et le nombre d’évaluateurs qualifiés. Mais elles présentent des limites. En tout état de cause, elles ne permettraient pas d’atteindre l’objectif fixé au 1er octobre 2016 tant le retard à combler est important.
Une troisième orientation a consisté à demander au Cofrac d’établir une priorité dans l’examen des demandes d’accréditation afin de se concentrer sur la situation des LBM qui n’auraient pas encore été accrédités. Les rapporteurs sont conscients que cette priorisation ne permettra pas de réduire le nombre de LBM ne satisfaisant pas aux critères requis au 1er novembre 2016 mais elle aura le mérite d’établir une certaine homogénéité entre les LBM demandeurs d’accréditation. À l’heure actuelle, la majorité des dossiers susceptibles de ne pas être évalués par le Cofrac au 1er novembre 2016 concerne des demandes d’accréditation initiale. Avec la priorisation, le stock resterait inchangé mais on retrouverait davantage de dossiers porteurs d’extension d’accréditation.
Une dernière orientation avait été esquissée mais n’a finalement pas été retenue. Le scénario consistait à revoir le cycle d’accréditation des LBM compte tenu de la spécificité du secteur de la santé.
Le rythme actuel que s’est fixé par le Cofrac n’apparaît pas infondé pour le secteur industriel mais ne correspondrait pas aux enjeux de la santé.
Un desserrement du cycle d’accréditation pour les laboratoires de biologie médicale aurait été opportun et aurait permis au Cofrac de se concentrer sur les nouvelles accréditations.
Cependant, le Cofrac n’envisage pas une telle hypothèse sauf à enfreindre les principes sur lesquels il est évalué par ses pairs. Dans une réponse apportée aux rapporteurs, le Cofrac indique que “ce serait pour lui un écart majeur qui mettrait en jeu sa reconnaissance” tout en soulignant qu’une évaluation par les pairs est prévue en juin 2016.
Au surplus, le Cofrac souligne qu’il dispose que de peu de recul sur les LBM accrédités pour apprécier le critère de stabilité. Il repose au mieux sur la première évaluation. Il lui apparaît hasardeux d’envisager un cycle dérogatoire alors que les conditions de stabilité des LBM ne sont pas démontrées. Le Cofrac a toutefois procédé à l’identification des conditions de stabilité à respecter et a identifié les LBM qui pourraient bénéficier d’un report de visite sur site au maximum du délai prévu par les règles. Selon ses estimations, 35 d’entre eux seraient éligibles.
En définitive, entre 200 et 300 laboratoires ne pourraient pas se voir délivrer leur accréditation au 1er novembre 2016.
Comme il n’est pas souhaitable de reporter la date butoir prévue au 30 octobre 2016, il importe a minima de sécuriser leur activité.
Cette solution consisterait à autoriser l’activité des laboratoires ayant déposé une demande d’accréditation ou d’extension le 30 avril 2015 le temps que le Cofrac délivre l’accréditation. Ce temps serait nécessairement restreint pour ne pas obérer la mise en place des deux prochaines étapes prévues en 2018 et en 2020.
Il reste toutefois à déterminer la façon la plus opportune de parvenir à stabiliser la situation juridique des LBM sans desserrer le calendrier.
Une modification d’ordre législatif pourrait être envisagée. Cette solution nécessiterait le dépôt, l’examen et l’adoption d’un texte dans un délai relativement court dans un contexte de forte sollicitation du Parlement. En tout état de cause, le texte portant modification doit être adopté avant le 30 octobre 2016. Cette solution pourrait également se traduire par le dépôt d’un amendement mais se pose alors la question du vecteur législatif à privilégier. À ce stade, aucun texte, en cours d’examen à l’Assemblée, n’est susceptible d’accueillir une telle initiative.
Une seconde solution d’ordre réglementaire, en cours d’examen par les services du ministère de la santé, consisterait à prévoir un droit d’ouverture provisoire des LBM ayant déposé une demande d’accréditation et sur laquelle le COFRAC n’aurait pas encore statué au 1er novembre 2016.
Proposition n° 17 :
Sécuriser la situation juridique des LBM qui ne seraient pas accrédités au 30 octobre 2016 bien qu’ayant accompli les obligations légales liées à la démarche d’accréditation.
Les rapporteurs regrettent, qu’à quelques mois d’une échéance importante, une telle solution puisse être envisagée. Si tout a été mis en œuvre pour parvenir aux objectifs fixés, il ne reste pas moins vrai qu’une certaine inertie a pu prévaloir au cours des premiers mois qui ont suivi l’entrée en vigueur de la réforme de la biologie médicale. Pour que l’objectif final d’une accréditation à 100 % puisse être tenu, il importe de maintenir le cap que se sont fixé les parties prenantes. Le vivier de 400 évaluateurs techniques apparaît comme une condition sine qua non de la réussite du projet. Les efforts qui ont été opérés pour favoriser le recrutement de biologistes évaluateurs doivent être maintenus. Il appartient aux professionnels de répondre à cet impératif, principalement ceux du secteur public.
En tout état de cause, il n’apparaît pas souhaitable de modifier les échéances de 2018 et 2020. Ce serait un sérieux coup d’arrêt à l’implication des acteurs, en particulier les laboratoires, et à la crédibilité d’une réforme dont la portée est très scrupuleusement analysée par nombre d’observateurs chez nos voisins européens.
Proposition n° 18 :
Développer la participation des biologistes médicaux, principalement hospitaliers, aux missions d’évaluation réalisées par le Cofrac.
d. Le rôle du Cofrac dans la mise en œuvre de la réforme
Plusieurs actions ont été définies pour respecter la prochaine échéance. Les rapporteurs se félicitent de l’engagement des parties prenantes à la réussite de cette importante étape. Ils souhaiteraient également établir un premier bilan de l’état d’avancement de la réforme en abordant la question de l’investissement du Cofrac. Les auditions ont permis de révéler la persistance d’un certain malaise entre le Cofrac d’une part, les acteurs de la biologie médicale et l’administration du ministère de la santé d’autre part. Ce malaise doit pouvoir être dépassé dans l’intérêt de la réussite de la réforme.
Comme les laboratoires, le Cofrac est tenu par les délais qui ont été fixés par le législateur. Diverses causes entraînent le retard dans l’accomplissement de l’échéance, comme la trop lente montée en charge du nombre d’évaluateurs. Les rapporteurs conviennent donc que la responsabilité ne peut être imputée au seul Cofrac. Cela étant, il lui appartenait d’anticiper sur les éventuelles difficultés, sa mission devant être accomplie dans le cadre des délais légaux.
À cet égard, l’envoi du courrier avertissant que le Cofrac ne pourrait pas garantir une accréditation au 31 octobre 2016 ne constituait ni un signal positif, ni le stimulant le plus approprié pour une profession qui n’a pas ménagé son investissement. Très légitimement, la tonalité du courrier n’a pas reçu un accueil chaleureux des biologistes médicaux.
Se pose également la question d’un pilotage plus pragmatique des dossiers d’accréditation au regard des exigences légales et réglementaires. Pour 2016, un afflux exceptionnel de dossiers est enregistré correspondant à des accréditations initiales, à des demandes d’extensions, et dont la portée varie d’un LBM à l’autre (50 % de taux d’accréditation voire plus). Les rapporteurs se félicitent que, parmi les mesures prises, la priorité dans l’examen des demandes d’accréditation constitue aujourd’hui une piste de travail mais s’interrogent sur les raisons pour lesquelles cette mesure n’a pas été pas envisagée plus tôt.
La question du déclassement des dispositions relatives aux étapes fixées par le législateur reste également symptomatique de la difficulté à envisager la mise en œuvre d’une réforme autrement qu’en reportant les échéances. Il est heureux que la piste du report n’ait pas abouti mais il n’en apparaît pas moins troublant qu’une telle hypothèse ait pu être envisagée sans avoir, au préalable, étudié d’autres pistes de travail. Rappelons que les rapporteurs se sont émus de cette initiative malheureuse et qu’ils ont porté un grand intérêt à ce que des mesures plus appropriées soient décidées dans l’intérêt de toutes les parties prenantes.
Afin de parvenir à un dialogue plus apaisé et constructif, il a été souligné à de nombreuses reprises que l’acculturation du Cofrac à la culture médicale pourrait être mieux recherchée. Sans nier la qualité du travail accompli par l’institution et l’ensemble de ses collaborateurs, il pourrait être opportun de s’interroger sur l’adaptation du Cofrac aux enjeux de santé. L’accréditation des LBM répond à des normes exigeantes et précises, internationalement acceptées, mais doit pouvoir être éclairée à la lumière des spécificités du monde médical.
Parmi les pistes évoquées, il a aussi été préconisé de favoriser, au sein de la structure permanente du Cofrac, la représentation des acteurs de la biologie médicale. Cette place est aujourd’hui assurée au sein du conseil d’administration et de la section « santé humaine » mais ne semble pas suffisante au regard du poids que représentent désormais les laboratoires (un tiers des entités accréditées selon le dernier rapport d’activité (59)).
Se pose parallèlement la question de l’adéquation du statut du Cofrac à la mission qui lui a été confiée. Il a été confié aux rapporteurs qu’une association de type loi 1901 ne constituerait pas une structure juridique suffisamment adaptée en raison de l’extension de sa mission aux 1 000 laboratoires de biologie médicale. En l’absence de solutions transitoires, la non-délivrance d’accréditations au 31 octobre 2016 pourrait se traduire par l’engagement de la responsabilité du Cofrac à l’initiative des laboratoires qui s’estimeraient lésés. Le Cofrac ne dispose pas des ressources nécessaires pour répondre à d’éventuelles indemnisations si sa responsabilité venait à être reconnue, sauf à remettre en question sa mission d’accréditation. Or, le maintien de l’activité de nombreux laboratoires industriels est subordonné à la délivrance d’accréditations. Les rapporteurs n’ont pas exploré la piste d’une autre structure mais estiment qu’une évaluation pourrait être réalisée afin de davantage consolider la mission d’accréditation de biologie médicale.
D’autres voix se sont enfin exprimées en soulignant qu’il serait plus opportun de confier l’évaluation de l’accréditation des LBM à une autre instance, telle que la Haute autorité de santé (HAS) dont l’action en matière d’accréditation a été progressivement reconnue. Là encore, cette piste n’a pas été explorée par les rapporteurs mais une évaluation pourrait être menée par les services du ministère de la santé pour en déterminer le bien-fondé (60).
Proposition n° 19 :
Pour favoriser l’acculturation de l’instance d’accréditation aux enjeux de santé :
– favoriser la représentation des acteurs de la biologie médicale au sein de la structure permanente du Cofrac ;
– établir un bilan avantage/inconvénient de l’évolution du statut du Cofrac au regard de la mission d’accréditation des LBM ;
– étudier la faisabilité d’une accréditation des LBM par la Haute autorité de santé.
B. LES CONTRÔLES DE QUALITÉ DES LABORATOIRES DE BIOLOGIE MÉDICALE
Les contrôles de qualité des laboratoires de biologie médicale permettent la validation continue de la phase analytique des examens menés par un laboratoire de biologie médicale, après que l’accréditation lui ait été délivrée. Il existe différents types de contrôles de qualité.
Indépendamment des contrôles internes de qualité, le contrôle peut être assuré par des organismes extérieurs aux laboratoires.
Selon l’article L. 6221-9 du code de la santé publique, un laboratoire de biologie médicale doit faire procéder au contrôle de la qualité des résultats des examens de biologie médicale qu’il réalise par des organismes d’évaluation externe de la qualité. La portée de cet article devrait être précisée par la publication prochaine d’un décret portant application de ces dispositions.
Des contrôles externes des automates de biologie médicale sont ainsi réalisés par des organismes d’évaluation externe de la qualité qui représentent une dizaine d’acteurs (structure associative ou commerciale). Ces organismes proposent des « programmes d’abonnement » d’évaluations externes de qualité dans les divers domaines de la biologie médicale. Chaque LBM signe à cet effet des contrats avec ces organismes d’évaluation externe de la qualité, français ou européens voire internationaux, en fonction de ses besoins. Lors d’une évaluation pour l’accréditation de certains examens de biologie médicale au sein d’un LBM, il est notamment vérifié que le LBM est abonné aux programmes utiles à la réalisation de ces examens.
Cette évaluation externe de la qualité est conduite au moyen d’une comparaison interlaboratoire et d’échantillons de contrôles inconnus. Le Cofrac recommande de l’effectuer au moins une fois par trimestre.
Lorsqu’une défaillance de nature à entraîner un risque majeur pour la santé des patients est détectée, les organismes d’évaluation externe la signalent immédiatement à l’agence régionale de santé (ARS), après en avoir informé le laboratoire de biologie médicale concerné (61).
Le contrôle national de qualité est organisé exclusivement par l’Agence nationale de sécurité du médicament et des produits de santé (ANSM) dans les conditions prévues par l’article L. 6221-10 du code de la santé publique. L’agence a, dans ce cadre, une activité semblable à celles des structures d’évaluation externe de qualité mais dans un but complémentaire aux programmes d’évaluation externe de la qualité. Ces contrôles s’adressent en effet aux laboratoires réalisant des examens rares, des examens pour lesquels une inscription à la nomenclature des actes de biologie médicale a été demandée, des examens inclus dans des plans de santé publique, des contrôles non proposés par les structures d’évaluation externe de la qualité notamment.
Selon les informations transmises aux rapporteurs, le contrôle national de qualité a évolué depuis la mise en place de la réforme de la biologie médicale. Complémentaire à la procédure d’accréditation, ce dispositif est plutôt destiné à une exploitation nationale qu’à un usage individuel du LBM.
Les campagnes du contrôle national de qualité ne sont pas assez fréquentes pour se substituer à un programme d’abonnement pris auprès d’une structure organisatrice d’évaluation externe de qualité. Dès lors, le contrôle national de qualité trouve tout son intérêt dans la connaissance nationale des pratiques des LBM, des techniques utilisées par ceux-ci, des performances comparées de ces diverses techniques.
Le contrôle national de qualité permet également de s’assurer de la compétence des LBM français à réaliser tel ou tel examen rare, nouveau ou essentiel dans le cadre d’un plan de santé publique. Au final, au-delà d’un intérêt individuel pour chaque laboratoire lui permettant de se confronter à ses pairs, le contrôle national de qualité présente, selon la direction générale de la santé, beaucoup d’avantages dans l’exploitation nationale qu’il est possible d’en faire.
Le contrôle interne de qualité
Imposé par la norme NF EN ISO 15189 de 2012, le contrôle interne de qualité (CIQ) est réalisé au sein du laboratoire au moyen d’échantillons de contrôles, lors de la mesure d’échantillons biologiques de patients. Les indicateurs de performance et les limites d’acceptabilité y étant associés doivent être choisis préalablement au contrôle de qualité.
Le CIQ permet de vérifier la maîtrise du processus analytique, de s’assurer de la qualité des résultats et, le cas échéant, de détecter des anomalies dans les processus de traitement des échantillons, des prescriptions, des analyses, des comptes rendus, etc.
C. LES INSPECTIONS MENÉES PAR LES ARS
L’article L. 6231-1 du code de la santé publique rend les inspecteurs de santé publique compétents pour inspecter les laboratoires de biologie médicale, les lieux de réalisation d’examens de biologie médicale et les organismes d’évaluation externe de la qualité. En revanche, ils ne peuvent inspecter l’Agence nationale du médicament et des produits de santé (ANSM).
Ces inspecteurs disposent d’un droit d’accès aux dossiers d’accréditation du Cofrac, et les médecins et pharmaciens inspecteurs ont accès à toutes les données personnelles nécessaires à l’accomplissement de leur mission.
Avant la mise en place de la réforme de la biologie médicale, la régulation de l’activité biologique par les ARS était mal assurée puisque, en moyenne, un laboratoire était inspecté tous les 20 ans.
Avec l’obligation d’accréditation, l’action des ARS s’en trouve modifiée. Tout en conservant l’intégralité de leurs missions de contrôle, les ARS n’ont plus à réaliser les inspections de routine mais seulement en cas de nécessité ou d’alerte. La direction générale de la santé indique que ces inspections sont actuellement motivées par des signalements de diverses natures : plaintes de patients ou de professionnels de santé cliniciens, signalements effectués par l’ANSM dans le cadre du contrôle national de qualité ou des campagnes d’inspection.
Les inspections peuvent aussi être suscitées par la volonté de suivre la mise en place d’une politique de santé publique : par exemple des inspections ont été réalisées courant octobre 2013 afin d’élucider la situation de certains laboratoires de biologie médicale qui n’avaient pas déposé de dossier au Cofrac dans le cadre du respect de l’arrêté du 17 octobre 2012.
Pour suivre le respect des exigences d’accréditation de l’étape 2016, une demande nationale d’inspection des LBM, en 2016, est en cours d’instruction.
Ces missions d’inspection, complémentaires aux évaluations effectuées par le Cofrac, doivent être maintenues. Toutefois, les rapporteurs estiment qu’il importe de davantage tenir compte des besoins exprimés par les ARS.
Ces demandes visent tout d’abord à mieux coordonner les actions des ARS et du Cofrac.
Les ARS relèvent des cas de LBM évalués et accrédités par le Cofrac alors même qu’ils ne sont pas déclarés auprès de leur ARS ou déclarés selon une forme juridique différente. À cet effet, le Cofrac doit s’assurer du statut juridique de la structure avant d’engager une mission d’évaluation. Il est ainsi recommandé de s’appuyer sur les données administratives déclarées et non sur les déclarations des biologistes évalués.
Pour éviter un télescopage entre des missions d’inspection inopinées diligentées par les ARS et des missions d’évaluations par le Cofrac, les ARS souhaiteraient pouvoir disposer du calendrier des évaluations du Cofrac.
Afin de mieux identifier les structures en difficulté, les ARS souhaiteraient recevoir une synthèse des résultats des évaluations menées.
Proposition n° 20 :
Faciliter les échanges entre ARS et Cofrac pour mieux coordonner les missions d’inspection et d’évaluation.
La Commission des affaires sociales examine, en application de l’article 145-7 alinéa 1 du Règlement, le rapport de MM. Jean-Louis Touraine et Arnaud Robinet sur la mise en application de la loi n° 2013-442 du 30 mai 2013 portant réforme de la biologie médicale, lors de sa séance du mardi 26 janvier 2016.
Mme la présidente Catherine Lemorton. Le contrôle de l’application de la loi est un exercice que nous n’avons pas l’habitude de faire. Arnaud Robinet et moi-même avons néanmoins rendu un rapport d’application de la loi sur le médicament votée en décembre 2011. Jean-Marc Germain a également remis un rapport d’information sur la mise en œuvre de la loi portant création des emplois d’avenir. De même, Jean-Patrick Gille et Gérard Cherpion ont commencé leurs travaux de contrôle de l’application de la loi relative à la formation professionnelle et à la sécurisation de l’emploi.
Nous examinons aujourd’hui le rapport, rédigé par Jean-Louis Touraine et Arnaud Robinet, d’application de la loi portant réforme de la biologie médicale, adoptée dans un climat consensuel. Compte tenu du mécontentement des biologistes dans certains de nos territoires, la présentation de ce rapport devrait nous permettre d’y voir plus clair quant aux effets de cette loi votée, je le rappelle, à l’unanimité.
M. Jean-Louis Touraine, rapporteur. Près de trois ans après l’adoption de la loi portant réforme de la biologie médicale, notre commission examine aujourd’hui le rapport d’application qu’Arnaud Robinet et moi-même vous proposons d’adopter. Si nous y formulons une vingtaine de propositions, il nous semble moins utile de toutes les aborder en détail que d’insister sur certains points saillants de notre mission.
Il m’apparaît tout d’abord nécessaire de rappeler le sens général de la loi définitivement adoptée le 30 mai 2013. Préparée en 2008 par le rapport Ballereau, la réforme de la biologie médicale rénove en profondeur, et de façon ambitieuse, un secteur dont l’organisation, datant de 1975, n’apparaissait plus adaptée aux nombreux défis contemporains. La loi, qui procède principalement à la ratification d’une ordonnance de 2010 relative à la biologie médicale, vise plusieurs objectifs.
Premier objectif : l’affirmation du caractère médical de l’acte de biologie. Citons ainsi la spécificité de la fonction de biologiste médical, le déroulement de l’examen en trois phases – pré-analytique, analytique et post-analytique – et le dialogue constant entre biologiste et clinicien.
Deuxième objectif : garantir la même qualité d’examens à tous nos concitoyens sur l’ensemble du territoire national. Les laboratoires, publics comme privés, ont jusqu’en 2020 pour se voir délivrer une accréditation à 100 %, deux jalons intermédiaires ayant été fixés en 2016 et 2018.
Troisième objectif : la proximité et la pérennité de l’offre de biologie médicale.
Quatrième objectif, et non des moindres : la lutte contre la financiarisation du secteur, par la préservation des droits des biologistes en exercice, la définition de règles prudentielles et la mise en place de contrôles exercés par les agences régionales de santé (ARS).
Au regard de ces objectifs, j’aimerais insister sur plusieurs points.
Tout d’abord, la mise en œuvre de l’accréditation constitue un pari important pour l’avenir de la biologie médicale. Il s’agit d’une démarche inédite dont les effets sont attentivement suivis par nos voisins européens. Le défi de la qualité prouvée a été relevé par l’ensemble de la profession comme en témoigne l’entrée effective dans la démarche d’accréditation de la totalité des laboratoires, à deux exceptions près. Il faut s’en féliciter !
La réalisation du prochain objectif, consistant à accréditer 50 % des examens de biologie médicale et au moins un examen par famille au 31 octobre 2016, nourrit cependant beaucoup d’inquiétudes. Cette étape suppose que les laboratoires puissent affronter de concert les restructurations et la réorganisation qu’implique la démarche d’accréditation. On peut aussi s’interroger quant à la capacité du comité français d’accréditation (COFRAC) de traiter l’ensemble des dossiers. Des obstacles demeurent comme en témoigne la difficulté à recruter des biologistes médicaux pour procéder aux nécessaires évaluations.
J’insiste avec une fermeté particulière sur l’importance qu’il y a à tenir les délais de 2016, 2018 et 2020. Nous nous sommes émus qu’il ait été question de les reporter, et avons porté une attention particulière à ce que des actions plus énergiques soient décidées afin de rester dans le cadre défini par la loi. Il n’en demeure pas moins que, au 31 octobre 2016, 200 à 300 laboratoires ne disposeront pas de l’accréditation, faute d’évaluations organisées par le COFRAC. Or, les textes sont clairs : pas d’accréditation, pas d’activité. Plusieurs pistes sont à l’étude pour stabiliser la situation juridique des laboratoires concernés, en leur conférant une autorisation dérogatoire d’exercice pendant quelques mois, le temps que le processus d’accréditation à 50 % soit achevé. Nous devons rester plus que jamais attentifs à ce sujet et demander au COFRAC d’optimiser les ressources humaines mises à sa disposition pour atteindre cet objectif.
Les auditions ont révélé la persistance d’une autre inquiétude, liée à la financiarisation du secteur de la biologie médicale. Les réactions oscillent entre l’incompréhension, face au peu d’effet des dispositions adoptées, et la frustration de ne pouvoir lutter à armes égales face aux grands groupes. Il importe à cet effet de permettre l’application des règles existantes.
Plusieurs mesures s’avèrent nécessaires.
Il serait opportun de publier sans plus attendre les textes d’application de la loi, en particulier ceux qui ont trait aux sanctions administratives. On pourrait d’ailleurs s’interroger quant à l’élargissement de ces sanctions. L’article L. 6223-8 du code de la santé publique impose une priorité de cession des parts sociales ou actions au bénéfice des biologistes exerçant dans la société. Il conviendrait de s’assurer que cet objectif a réellement été recherché avec la piste de la mise en place d’une infraction soumise à une sanction administrative proportionnée.
Il faudrait aussi envisager les règles prudentielles à l’aune du principe de santé publique. Il ne serait pas normal que l’installation, le regroupement ou le transfert d’activités soient opérés en méconnaissance des enjeux de santé publique. Certains regroupements sont souhaitables, s’agissant de structures devenues trop petites pour assurer à elles seules la garantie de qualité et de sécurité aujourd’hui exigée. Mais, pour autant, les nouvelles structures ne doivent pas nourrir une ambition de gigantisme financier, qui serait préjudiciable aux patients comme aux biologistes exerçant dans ces laboratoires. La formulation d’une doctrine sur l’application des règles prudentielles, notamment celles liées à la territorialité, permettrait de répondre à cet enjeu.
Il importe enfin que les ARS, chargées d’appliquer les règles prudentielles, et les ordres professionnels, auprès desquels les sociétés exploitant un laboratoire sont inscrites, conviennent d’un pilotage adapté pour assurer leurs missions de façon complémentaire. Il convient aussi qu’ils disposent de collaborateurs dûment formés pour assurer leurs missions. À cet effet, il nous semble utile qu’un plan de formation soit défini pour accompagner la montée en puissance de ces missions.
Je terminerai mon intervention en insistant sur les évolutions affectant la biologie médicale. Le choix, opéré par le législateur, d’exclure du champ de l’accréditation les actes d’anatomie et de cytologie pathologiques ne semble plus justifié. Il serait opportun d’étendre l’accréditation à ces examens dans l’intérêt de la santé des patients et de leur égal accès à des examens de qualité.
M. Arnaud Robinet, rapporteur. M. Touraine a abordé des enjeux importants et je partage ses interrogations. Je souhaiterais, pour ma part, apporter des éclairages complémentaires en axant mes propos sur trois éléments.
Un premier constat, amer, peut être dressé : près de trois ans après la réforme, les textes les plus attendus n’ont toujours pas été publiés. De nombreuses dispositions relatives aux conditions de réalisation des examens de biologie médicale sont intégrées dans un texte conséquent dont la publication est imminente, d’après ce qu’on nous dit. Ce décret en Conseil d’État relatif à la biologie médicale est très attendu par l’ensemble des acteurs et conditionne l’organisation de la profession. Les dispositions relatives aux sociétés exploitant les laboratoires, qui incluent des orientations visant à lutter contre la financiarisation du secteur, seraient portées par un autre décret en Conseil d’État, dont la publication est également imminente. Mais d’autres dispositions tardent à être appliquées : les sanctions administratives, la publication du décret relatif aux laboratoires de référence et les dispositions relatives à l’outre-mer. Sur ce dernier point, le ministère de la santé nous assure que le texte est prêt et n’attend plus que la publication du décret relatif à la biologie médicale.
S’agissant toujours de la publication des textes attendus, un important décret relatif aux modalités d’exercice de la biologie médicale, publié en septembre 2015, a fait l’objet d’une vive contestation de la part des représentants de biologistes médicaux, quelques organisations ayant même manifesté leur souhait d’engager un contentieux. Le ministère a toutefois accédé aux revendications exprimées mais au prix d’un texte modificatif, retardant d’autant la publication d’arrêtés d’application tout aussi importants.
En second lieu, j’aimerais insister sur l’importance de la modification du paysage de la biologie médicale. On assiste aujourd’hui à un important mouvement de regroupement des laboratoires : quatre mille laboratoires en 2010, un peu plus d’un millier à ce jour. Ce regroupement correspond à une logique d’optimisation visant à contrecarrer les effets des baisses tarifaires ou à engager la démarche d’accréditation avec une masse critique suffisante pour en absorber les coûts. La recomposition est également facilitée par les évolutions juridiques : le verrou du nombre de sites est aujourd’hui ouvert et permet à un laboratoire de s’implanter sur plusieurs sites.
Quatre remarques peuvent être faites à ce propos.
Tout d’abord, le regroupement s’opère parallèlement à une démarche d’accréditation nouvelle. Les acteurs doivent aborder de front deux enjeux. Il s’agit donc d’un réel exploit !
Ensuite, le regroupement entre laboratoires est aujourd’hui plus avancé dans le secteur privé que dans le secteur public. La mise en place des groupements hospitaliers de territoire devrait permettre, à terme, de réduire cet écart.
Par ailleurs, si le nombre de laboratoires a durablement été réduit, il n’en est pas de même s’agissant du nombre de sites qui resterait stable. Sur ce point, notre vigilance se doit d’être constante, les regroupements n’ayant pas encore produit tous leurs effets.
Enfin, il semble que le regroupement s’opère parfois au prix d’une spécialisation des sites et d’une plus grande transmission d’échantillons : les sites de proximité sont orientés vers les phases pré-analytique et post-analytique tandis que les sites centraux sont dédiés à la phase analytique. Nous disposons encore de peu de recul sur la réalité de cet enjeu, mais il nous semble nécessaire qu’une attention particulière soit portée au respect des exigences de santé publique. C’est pourquoi nous plaidons pour que la spécialisation ne se traduise pas par une perte de qualité des examens en raison des conditions de transport d’échantillons. Il nous semblerait ainsi utile d’évaluer les effets de la spécialisation sur l’attractivité de la profession de biologiste médical. Tout l’intérêt de la réforme a été de valoriser la profession en insistant sur la médicalisation de l’examen, la proximité avec le patient et le dialogue avec le clinicien. Il ne faut pas perdre de vue ces objectifs.
Troisième et dernier élément de ma réflexion, j’aimerais insister sur un aspect relatif à l’exercice de la profession de biologiste médical. Le décret de septembre 2015, qui fait l’objet d’une contestation, prévoit notamment la création d’une instance, la commission nationale de biologie médicale. Une des pierres d’achoppement a trait à la composition d’une de ses formations. Des modifications répondant aux souhaits exprimés par les représentants des biologistes seront opérées mais on peut regretter qu’un consensus n’ait pu être dégagé plus tôt. Tant que le décret modificatif ne sera pas publié, l’installation de cette commission ne sera pas effective et d’importants arrêtés, nécessitant un avis de la commission, ne pourront être pris. Je pense notamment à l’arrêté portant définition des tests, recueils et traitements de signaux biologiques, à visée de dépistage, d’orientation diagnostique ou d’adaptation thérapeutique immédiate ne constituant pas des examens de biologie médicale.
M. Michel Liebgott. Sujet complexe, la biologie médicale est l’un des éléments fondamentaux de la chaîne thérapeutique. De nombreux malades, après avoir été hospitalisés, reviennent à domicile, suivent des traitements, tels que des chimiothérapies, et doivent donc faire l’objet de contrôles biologiques réguliers. Il me paraît donc important de renforcer dans ce domaine une transparence qui reste encore insuffisante aujourd’hui.
J’ai pu constater par moi-même que certains actes n’étaient pas forcément accomplis, parce qu’il y avait rupture dans la chaîne reliant le médecin hospitalier, le laboratoire et l’infirmier – qui ne se concertent pas toujours. Les patients revenaient ensuite à l’hôpital avec des examens insuffisants pour que leur traitement puisse être poursuivi dans de bonnes conditions. Il y a là un problème de coordination entre les différentes structures et de connaissance par la population du fonctionnement de celles-ci. J’ai moi-même connaissance de laboratoires clairement identifiés comme étant la propriété de biologistes tandis que d’autres ne sont en fait que des centres de prélèvements et non d’examens
– sans qu’on le sache pour autant.
Compte tenu de la chute du nombre de sites, il nous faut insister pour que le territoire reste parfaitement couvert, conformément à la politique voulue par le Gouvernement et par nous-mêmes. Il serait paradoxal que l’on essaie de créer des maisons médicales de santé pour occuper le terrain laissé vacant par les hôpitaux de proximité et que les laboratoires ne soient plus des outils de proximité. Comme vous l’avez souligné, il n’y a pas de médecine sans analyses biologiques.
M. Jean-Sébastien Vialatte. Je commencerai par indiquer que je suis moi-même biologiste, de façon à ne pas être soupçonné de conflit d’intérêts.
Ce n’est pas tant du mécontentement que cette loi a provoqué, comme M. Touraine l’a affirmé, qu’une véritable sidération chez les biologistes, seule profession médicale régulièrement soumise à ce type de textes. Après la sidération est venue une phase de résignation. Modernes, les biologistes ont pris les choses à bras-le-corps et ont essayé de répondre aux exigences de la loi. Certains des objectifs du texte sont pratiquement atteints, comme la médicalisation de la profession et la garantie d’égale qualité des examens sur tout le territoire.
Dans certains secteurs, les regroupements de laboratoires entraînent un manque d’offre de proximité, non qu’il n’y ait plus de sites, mais parce que ceux-ci ne sont parfois que des sites de prélèvement, qui ne peuvent assumer d’examens d’urgence dans la journée, le plateau technique étant trop éloigné. Est-il possible qu’un laboratoire du littoral varois envoie ses analyses au mois d’août dans le haut pays niçois et reçoive des résultats dans un délai normal, voire d’urgence ? Un décret sur les examens d’urgence devait être pris, mais ne l’a pas été : il est nécessaire qu’il soit publié rapidement.
La lutte contre la financiarisation est un échec total. On assiste au regroupement de laboratoires de plus en plus gigantesques, échappant à tout contrôle, et dont une partie des capitaux sont étrangers. Cela pose deux problèmes : celui de l’indépendance des biologistes quant au choix du matériel et des techniques utilisés – les gros financiers n’ayant comme seul objectif que la rentabilité – et celui de l’impossibilité, à terme, pour les pouvoirs publics d’intervenir efficacement face à des groupes en passe de devenir gigantesques.
La principale préoccupation des biologistes est aujourd’hui celle de l’accréditation. Les règles qui ont été fixées, prévoyant 50 % d’accréditation en 2016, sont absolument intenables – non pas pour la profession des biologistes qui est pratiquement prête, mais par le COFRAC. Je vous donnerai l’exemple de ma propre expérience. Le dépôt de ma demande d’accréditation initiale a eu lieu en juillet 2014. L’audit du COFRAC a été effectué le 19 janvier 2015. J’ai reçu une réponse de la commission d’accréditation le 15 mai suivant. Dans cette lettre, il m’était demandé des explications complémentaires, que j’ai fournies, et j’ai finalement obtenu mon accréditation en octobre 2015, soit quinze mois après le dépôt de ma demande. Manifestement, le COFRAC n’est pas en mesure de répondre aux demandes des laboratoires. Il en est d’ailleurs conscient et l’a écrit aux biologistes.
Cette situation a conduit la ministre de la santé à prendre deux arrêtés successifs. Le premier a imposé aux laboratoires de déposer, avant le 30 avril 2014, leur demande d’accréditation pour 2016. Le second vise à simplifier les demandes et à réduire à trois le nombre de familles qui doivent être accréditées, ce qui va nous faciliter la tâche. Ce premier arrêté a entraîné une charge de travail considérable pour les laboratoires qui doivent, examen par examen, fournir un dossier ; or, il y a des dizaines d’examens à accréditer. Les laboratoires ont effectué ce travail pour le 30 avril 2014 et, en novembre, le ministère a finalement décidé que les laboratoires pourraient faire plus simple.
Il faudrait donc fusionner les échéances de 2016 et de 2018. Je ne vois pas comment on peut prendre une disposition dérogatoire à la loi pour autoriser des laboratoires qui n’auraient pas obtenu leur accréditation. D’autre part, la loi prévoit, après la visite initiale d’accréditation, une visite de suivi tous les ans : cette dernière ne pourrait-elle être provisoirement suspendue afin que le COFRAC se consacre essentiellement à l’objectif de 50 % de laboratoires accrédités en 2016 ?
Le rapport de nos collègues Touraine et Robinet aborde l’ensemble des problèmes qui se posent aux biologistes, mais je voudrais les inciter à revoir leurs chiffres. Ils affirment en effet que le marché de la biologie médicale est en croissance continue. Or, il s’avère qu’en 2015 le nombre d’actes de biologie a diminué, à tel point que l’assurance maladie a renoncé à modifier l’arrêté fixant la nomenclature des actes de biologie médicale cette année. Les laboratoires sont donc, en plus, confrontés à des problèmes financiers. Le coût de l’accréditation initiale s’élève entre 15 000 et 20 000 euros pour un laboratoire moyen, sans compter l’inscription obligatoire au COFRAC, de l’ordre de 3 000 euros pour un mono-site. Enfin, chaque visite est facturée par le COFRAC, sans compter les coûts indirects car aucun laboratoire – mono-site ou multi-sites – ne peut arriver à obtenir son accréditation sans embaucher un qualiticien ou faire appel à des sociétés de conseil spécialisées qui coûtent 1 000 euros hors taxes par jour de présence dans le laboratoire.
M. Bernard Perrut. Face à un sujet complexe, lorsqu’on n’appartient pas à la profession médicale, on analyse les choses avec plus de recul. On mesure toutefois sur le terrain combien les laboratoires de biologie médicale ont une place importante dans le parcours de soins. Notre priorité est à la fois la proximité géographique pour le patient et la présence de professionnels compétents. Nous avons entendu les remarques, critiques et points positifs qui ont été soulignés par les rapporteurs. Arnaud Robinet évoquait tout à l’heure les groupements hospitaliers de territoire : en quoi peuvent-ils permettre de mieux prendre en considération le rôle des laboratoires de biologie médicale ?
Mme la présidente Catherine Lemorton. Il est vrai que cette proposition de loi avait été écrite pour lutter contre la financiarisation du secteur. Des inquiétudes se font donc sentir à cet égard. Je suis cependant étonnée que M. Vialatte affirme que les biologistes ont été sidérés par le texte, car nous avions beaucoup travaillé avec tous les syndicats – tant ceux représentant les biologistes libéraux que les syndicats de biologistes hospitaliers. Et il m’avait semblé, lors du vote de la loi, qu’ils étaient en accord avec le texte.
M. Jean-Sébastien Vialatte. Ils n’ont pas été sidérés par la loi de 2013, mais par le temps nécessaire à la préparation de l’ordonnance de Mme Bachelot !
Mme la présidente Catherine Lemorton. Je comprends mieux et vous rejoins sur ce point. Lorsque l’ordonnance a été publiée, nous avons tous vivement réagi dans l’hémicycle.
S’agissant de la financiarisation, nous pensions pouvoir limiter les dégâts en votant cette loi, mais cela ne semble pas être le cas. Qu’en pensent les rapporteurs ? Comment les syndicats de biologistes se sont-ils exprimés sur le sujet en audition ?
M. Jean-Sébastien Vialatte. Sur ce point, les très grands laboratoires spécialisés effectuant des actes extrêmement rares et pointus, qui existaient auparavant chez nous – tels que Biomnis, le successeur du laboratoire Mérieux –, sont aujourd’hui en très grande difficulté.
M. Jean-Louis Touraine, rapporteur. Je voudrais insister à nouveau sur le fait que la proposition de loi « mettait la barre » très haut. L’ambition était de porter la biologie médicale en France, en termes de qualité sur tout le territoire, au meilleur niveau mondial. Je ne crois pas qu’aucun autre pays se soit fixé une ambition aussi élevée : l’accréditation de la totalité des laboratoires et de la totalité des examens. Cet objectif est sur le point d’être atteint en un petit nombre d’années. J’en suis très reconnaissant aux biologistes qui, comme l’a souligné M. Vialatte, ont peiné au début parce que cela représentait une révolution, une montagne à gravir. Une fois passées les phases d’adaptation qui ont été décrites, ils ont accepté de contribuer à la réalisation de cet objectif si bien que la preuve va pouvoir être donnée que la France offre les résultats les plus fiables possible, au vu des connaissances actuelles, pour la totalité des examens biologiques. Ce résultat est tellement encourageant qu’il me semble nécessaire qu’on fasse de même pour les examens d’anatomie et de cytologie pathologique – domaines dans lesquels il est tout aussi important d’éviter de méconnaître des diagnostics de cancer, comme risquent de le faire des laboratoires non accrédités ni certifiés.
Face à cette ambition, on aurait pu ne laisser dispersés sur le territoire que des sites de prélèvement, les sites d’examen étant regroupés dans un très petit nombre de lieux centraux. Cette solution, retenue dans certains pays européens, aurait également permis d’assurer une bonne qualité des examens même si le déplacement peut nuire à certaines explorations. Elle aurait cependant pu entraîner des délais supplémentaires et, surtout, le service de proximité n’aurait plus été assuré. Nous avons la chance en France d’avoir un nombre important de biologistes capables de conseiller le patient, de lui donner la compréhension des résultats qui lui sont transmis et de lui proposer un suivi dans la durée si nécessaire – tout cela en concertation avec le médecin clinicien. Nous avons donc fait le choix de ne pas retenir de solution de facilité mais de maintenir notre équipement sur tout le territoire.
Dans le même temps est survenu un autre phénomène qui n’a rien à voir avec cette réforme et qui existe dans tous les secteurs de la santé : la tendance aux regroupements, y compris financiers. On a pu le constater dans les cliniques également – parce que les trop petites structures ne peuvent faire face aux exigences actuelles. Ces regroupements remettent en cause cette logique de maintien de structures de proximité. Il est donc nécessaire, grâce à la loi, d’assurer la persistance d’un pourcentage minimum de biologistes. La loi de 2013 oblige tout laboratoire de biologie à faire en sorte que, à tout moment, un biologiste soit mobilisable pour répondre à un patient sur ses examens.
Compte tenu de l’ambition du projet, il est évident qu’il reste des mesures complémentaires à prendre : tous les décrets n’ont pas encore été publiés, dont certains limiteront davantage l’évolution vers la financiarisation ; un décret doit également être pris concernant l’outre-mer.
M. Vialatte a dit qu’on ne pourrait atteindre l’objectif de 50 % de laboratoires accrédités au 1er novembre prochain. Pourtant, tous les biologistes ont fait des efforts. Tous, sauf deux, ont demandé l’accréditation à leur laboratoire. Et tous les laboratoires, publics et privés, sont d’accord pour que certains de leurs collaborateurs se rendent disponibles pour être les évaluateurs du COFRAC. Ce dernier nous dit qu’il n’arrivera pas à atteindre l’objectif parce qu’il ne dispose pas d’assez d’évaluateurs : ce n’est qu’à moitié vrai. Au début, les évaluateurs ne se sont pas précipités mais actuellement, beaucoup de biologistes, y compris dans les laboratoires publics, demandent au COFRAC de pouvoir faire ces évaluations. Nous avons donc l’impression que ce sont plutôt l’organisation et l’optimisation du travail qui font défaut. Je note par exemple que certains évaluateurs nous écrivent, surpris, après s’être portés volontaires, de continuer à attendre qu’on les mobilise – ou qu’on les mobilise davantage. On ne peut donc pas dire que ces évaluateurs, qui sont l’arme au pied, prêts à intervenir et à atteindre avant le mois de novembre prochain l’objectif, n’existent pas aujourd’hui. Il faudrait pouvoir mieux organiser leurs interventions pour qu’un nombre croissant de laboratoires soit évalué, même si, même avec cette optimisation et malgré la diminution du nombre de familles à évaluer, on n’atteindra pas tout à fait 100 % de laboratoires évalués pour 50 % des examens.
Que faire ? Il est effectivement possible de veiller à ce que les visites de suivi soient plus espacées. D’autres missions moins prioritaires du COFRAC peuvent elles aussi être différées. Nous l’avons conseillé aux représentants de ce comité, qui ont, je crois, compris quelle était la priorité. Il est possible d’atteindre un objectif qui soit proche de celui fixé. Il est également possible de faire bénéficier d’un système de dérogations les quelque 200 ou 300 laboratoires qui n’auront pas terminé tous leurs examens au 31 octobre prochain, à condition de garantir la sécurité juridique dudit système. Les laboratoires qui ont fait eux-mêmes en temps opportun une demande d’accréditation, qui se sont engagés dans le processus et que le COFRAC n’a pas été capable d’examiner dans les délais escomptés, sont vertueux et méritent qu’on leur accorde la possibilité de travailler pendant quelques mois supplémentaires sans accréditation, le temps que le COFRAC ait terminé leur évaluation. On évitera ainsi d’avoir à reporter l’échéance et, partant, celles du 1er novembre 2018 et du 1er novembre 2020. Si l’on décale ces dates, on ne saura pas quand 100 % des examens seront accrédités ni quand on atteindra une fiabilité parfaite sur l’ensemble du territoire.
Il est vrai, monsieur Vialatte, que le nombre d’examens a diminué en 2015, mais je ne suis pas sûr qu’il s’agisse là d’une tendance lourde. J’ai plutôt l’impression que c’est un bienfait résultant de l’introduction de la pertinence des prescriptions. Dans le passé, nombre d’examens ont été prescrits, en secteur libéral comme en secteur public, par groupes d’examens, quelquefois de façon excessive. Récemment, il a été conseillé à tous les prescripteurs de ne pas abuser des prescriptions inutiles. Il fut par exemple un temps où le dosage de l’antigène prostatique spécifique (PSA) était systématiquement prescrit à tous les hommes de cinquante ans ou plus, dès qu’ils rencontraient un médecin. On s’est ensuite rendu compte de l’absurdité de la chose. Ce dosage, comme beaucoup d’autres, ne fait donc plus l’objet de demandes systématiques, mais uniquement de demandes motivées. Cela aboutit à diminuer quelque peu le nombre d’examens biologiques. Sont par contre en augmentation la diversité de ces examens, de même que le nombre d’examens très sophistiqués et à haute valeur ajoutée, par exemple en génétique. Je ne crois donc pas que les biologistes aient à craindre de manquer de travail demain. Les examens seront de plus en plus variés, sophistiqués et complexes et continueront à croître en nombre, parce que les progrès de la connaissance biologique comme de la connaissance thérapeutique sont une tendance lourde.
M. Arnaud Robinet, rapporteur. Je réponds à M. Liebgott qu’il n’y a pas eu de chute du nombre de sites sur l’ensemble du territoire. Ce nombre est stable aujourd’hui. Mais, comme l’a souligné Jean-Louis Touraine, nous assistons aujourd’hui à une optimisation et à une spécialisation des sites en pré ou en post-analytique. Cela peut expliquer que l’on ait l’impression d’une baisse du nombre de sites.
Monsieur Vialatte, la réforme est globalement acceptée. Selon les représentants et les syndicats, l’accréditation va dans le bon sens, celui de la qualité de la biologie française. Il faut s’en féliciter. Il y a consensus sur la nécessité de mettre en valeur la qualité et le professionnalisme de nos biologistes. Concernant le regroupement et l’offre de proximité, nous partageons votre analyse. Mais il nous semble nécessaire que les textes soient publiés, ce qui n’est pas encore le cas aujourd’hui, et nous avons formulé une proposition sur la référence temps-distance pour évaluer les implantations des sites. L’important pour les patients est de trouver un laboratoire de prélèvement près de chez eux. Peu importe si l’analyse se fait sur le site de prélèvement : ce n’est pas leur préoccupation. Par contre, il est vrai que pour certains examens, la distance entre le site de prélèvements et le site d’analyse de l’échantillon peut poser un problème de qualité des résultats obtenus et de conditions dans lesquelles l’échantillon est transporté.
S’agissant de la financiarisation, les outils n’existent pas, car les textes d’application n’ont pas encore été publiés. Nous recommandons donc d’accélérer cette publication pour que les agences régionales de santé puissent disposer des leviers nécessaires.
Nous avons bien sûr des interrogations quant à la capacité du COFRAC à conduire la réforme. Eu égard au nombre d’évaluateurs, le comité nous a dit rencontrer quelques difficultés notamment vis-à-vis d’évaluateurs venant du service public et des hôpitaux. J’ai fait moi-même la promotion, il y a quinze jours, de cette fonction d’évaluateur auprès des biologistes du centre hospitalier universitaire (CHU) de Reims : la grande difficulté est que beaucoup de CHU sont dans une phase de regroupement et que les premiers services à être regroupés sont ceux des biologistes. Ces derniers ont donc d’autres préoccupations que de se porter candidats pour être évaluateurs.
S’agissant des coûts, nous mentionnons dans notre rapport le coût moyen à la charge d’un laboratoire disposant de quatre sites. Je rappelle que notre proposition n° 14 plaide en faveur d’une évaluation complète des coûts et des avantages de la démarche d’accréditation pour les laboratoires publics et privés.
M. Perrut m’a interrogé sur les groupements hospitaliers de territoire. Le CHU de Reims, dont je préside le conseil de surveillance, a anticipé les regroupements avec les établissements publics de Châlons-en-Champagne, Épernay, Vouziers et Rethel. Les premiers services à être impliqués dans ces regroupements sont ceux de biologie. Il va y avoir mutualisation des compétences – le service public assurera une mission que les laboratoires privés ne peuvent pas toujours assumer pour diverses raisons –, des ressources et des plateaux techniques. De ce fait, il n’y aura qu’un dossier d’accréditation à déposer au lieu de quatre ou cinq pour tel ou tel examen. On ne limite donc pas le nombre de sites mais le nombre de plateaux techniques.
Enfin, Mme la présidente nous a interrogés sur la financiarisation. Il convient de bien distinguer le droit de la concurrence du droit de la santé. L’application des règles définies en matière de santé a vocation à être contrôlée sur le territoire par les Agences régionales de santé (ARS). Il faut donc développer les outils de contrôle. Les textes d’application doivent encore être publiés. Ce qui relève du droit de la concurrence n’est pas régi par la loi de 2013. Toutefois, il nous faudrait sans doute réfléchir davantage à la question des prises de participations des grands groupes, mais ce travail relève à notre sens d’une autre mission que celle qui nous a été confiée. Il est aujourd’hui très difficile de se faire une idée des prises de participations des grands groupes mais l’on peut examiner les conséquences de cette financiarisation. Vous avez cité, monsieur Vialatte, l’exemple d’un groupe rencontrant de grandes difficultés : il n’est pas le seul, ce qui prouve bien que la santé n’est pas un bien ou une marchandise comme les autres ; cette financiarisation a sûrement ses limites, compte tenu de l’importance de la qualité des examens. La financiarisation et la politique de grands groupes ne sont pas forcément adaptées à notre modèle de santé.
M. Jean-Sébastien Vialatte. Je comprends les difficultés du COFRAC à recruter des évaluateurs car il doit aussi fournir un gros effort pour assurer une certaine harmonisation de leurs pratiques.
M. Arnaud Robinet, rapporteur. Cela nous a effectivement été indiqué en audition, et cela pose quelques difficultés. Nous avons également été alertés du fait que les évaluateurs du COFRAC outrepassaient parfois leur mission.
Concernant la date butoir de novembre 2016 pour atteindre 50 % d’examens accrédités, il n’y a pas trente-six solutions. Jean-Louis Touraine a proposé de permettre aux laboratoires ayant entrepris cette démarche d’accréditation mais n’ayant pu être accrédités par manque d’évaluateurs de continuer à fonctionner sans cette accréditation. Autrement, le Gouvernement peut décider de reculer cette date de quelques mois : j’ignore si cela aurait des conséquences sur les dates de 2018 et 2020. On peut effectivement aussi se poser la question de la pertinence de la réévaluation annuelle.
M. Jean-Pierre Door. S’il y a des problèmes avec le COFRAC, la Haute Autorité de santé (HAS) ne peut-elle pas jouer un rôle d’accréditation, tout comme elle accrédite actuellement les établissements hospitaliers ?
M. Jean-Louis Touraine, rapporteur. La HAS peut tout à fait réaliser des accréditations. C’est d’ailleurs elle qui en définit les critères. Le choix a été fait de confier cette mission au COFRAC, mais si une difficulté survient, la HAS, peut-être plus habituée aux questions de santé, peut tout à fait prendre le relais. On ne va évidemment pas passer en permanence d’un système à l’autre, mais la HAS peut le faire, à condition qu’on lui en donne les moyens.
M. Arnaud Robinet, rapporteur. La proposition n° 19 vise précisément à étudier la faisabilité de l’accréditation des laboratoires par la Haute autorité de santé.
M. Jean-Louis Touraine, rapporteur. Sur le plan légal, la HAS peut le faire, mais il faut vérifier si elle en a la possibilité pratique et si ce serait bénéfique ou pas.
M. Jean-Sébastien Vialatte. Il est certain que dans un premier temps, les laboratoires étaient inquiets de n’avoir qu’un interlocuteur unique. Ils auraient préféré être face à deux organismes au moins.
M. Arnaud Robinet, rapporteur. La HAS définit les bonnes pratiques. Aujourd’hui, nous demandons dans notre rapport que soit évaluée la capacité pratique de la HAS à remplir cette mission. Après, n’y aura-t-il pas de différence entre un laboratoire évalué par le COFRAC et un autre par la HAS ?
M. Jean-Pierre Door. Je rappelle que l’on veut actuellement réduire le nombre d’agences.
M. Arnaud Robinet, rapporteur. Certes, mais je ne suis pas sûr que, en missionnant la seule HAS pour accréditer les laboratoires, on réglera le problème du nombre d’évaluateurs.
M. Jean-Sébastien Vialatte. Les biologistes ont pris l’habitude d’avoir affaire au COFRAC et commencent à comprendre comment il fonctionne. Les faire changer d’interlocuteur n’est donc pas forcément une bonne chose. Il faut être conscient que les biologistes se plient aux exigences du COFRAC. J’ai l’exemple précis d’un biologiste sortant de l’Institut français du sang et interprétant un arrêté ministériel fixant les modalités d’examen de groupes sanguins d’une façon différente de celle de l’évaluateur du COFRAC. La position du biologiste est validée par un des plus grands chefs de service de l’Établissement français du sang (EFS), mais ce dernier conseille au biologiste, pour être accrédité, de faire ce que le COFRAC lui demande. Je poserai une question écrite à la ministre de la santé à ce sujet.
M. Jean-Louis Touraine, rapporteur. Si l’on confiait cette mission à la HAS, ce seraient les mêmes évaluateurs qui feraient le travail. Mais il est vrai que l’organisation du travail appartient à l’organisme lui-même. Un organisme à fonction sanitaire comme la HAS ne serait-il pas plus à même d’arbitrer de façon plus adaptée, surtout lorsque l’on sait que l’évaluation va évoluer dans les cinq à dix ans qui viennent ? Qui peut mieux connaître les subtilités de ces évolutions que la HAS, qui définit les bonnes pratiques en la matière ? Le COFRAC est réputé internationalement pour la qualité de son fonctionnement, mais ses évaluations portent sur des domaines extrêmement divers, parfois écartés de la culture sanitaire. Il convient donc de déterminer s’il serait bénéfique qu’un organisme sanitaire effectue ces évaluations à la place du COFRAC.
*
* *
La commission autorise, à l’unanimité, le dépôt du rapport sur la mise en application de la loi n° 2013-442 du 30 mai 2013 portant réforme de la biologie médicale, en vue de sa publication.
ANNEXE 1 :
DÉCRETS PRÉVUS PAR LOI DU 30 MAI 2013
RELATIVE À LA BIOLOGIE MÉDICALE
Article |
Base légale |
Type de décret |
Objet |
Observations |
Article 8 |
Art. L. 6211-12 du code de la santé publique |
Décret |
Conditions dans lesquelles le biologiste médical réalise des examens lui permettant de s’assurer de la cohérence entre les données du dispositif médical (de diagnostic in vitro ou non) et du résultat de l’examen de biologie médicale, lorsque le parcours de soins suivi par le patient comporte des tests, recueils et traitements de signaux biologiques ayant fait l’objet d’une prescription et nécessitant un appareil de mesure |
Dispositions intégrées dans le décret relatif à la biologie médicale examiné le 22 décembre 2015 par la section sociale du Conseil d’État. (en cours de publication) |
Article 8 |
Art. L. 6213-10-1 du code de la santé publique |
Décret |
Conditions dans lesquelles, par dérogation aux articles L. 6213-1 et L. 6213-2, les biologistes médicaux peuvent se faire remplacer à titre temporaire |
Décret n° 2015-1152 du 16 septembre 2015 relatif aux conditions et modalités d’exercice des biologistes médicaux et portant création de la Commission nationale de biologie médicale |
Article 8 |
Art. L. 6231-3 du code de la santé publique |
Décret en Conseil d’État |
Conditions dans lesquelles le directeur général de l’agence régionale de santé prononce l’interruption immédiate, totale ou partielle, du fonctionnement des moyens techniques nécessaires à la réalisation de l’activité de biologie médicale, en cas d’urgence tenant à la sécurité des patients ou du personnel |
Dispositions intégrées dans le décret relatif à la biologie médicale examiné le 22 décembre 2015 par la section sociale du Conseil d’État. (en cours de publication) |
Article 8 |
Art. 9 ordonnance relative à la biologie médicale du code de la santé publique |
Décret |
Conditions dans lesquelles le ministre chargé de la santé décide d’autoriser les personnes en ayant fait la demande à exercer les fonctions de biologiste médical |
Décret n° 2015-1152 du 16 septembre 2015 relatif aux conditions et modalités d’exercice des biologistes médicaux et portant création de la Commission nationale de biologie médicale |
Article 11 |
Art. L. 6211-19 du code de la santé publique |
Décret |
Conditions de transmission de la déclaration annuelle des examens de biologie médicale par les laboratoires de biologie médicale au directeur de l’ARS |
La disposition réglementaire visée existait préalablement à la publication de la loi (décret n° 2011-1268 du 10 octobre 2011 fixant les règles permettant d’apprécier l’activité d’un laboratoire de biologie médicale et le pourcentage maximum d’échantillons biologiques pouvant être transmis entre laboratoires de biologie médicale) |
Article 11 |
Art. L. 6222-5 du code de la santé publique |
Décret en Conseil d’État |
Conditions des dérogations, accordées par le directeur général de l’ARS, au principe selon lequel les laboratoires de santé multisites peuvent être localisés sur trois territoires de santé infrarégionaux limitrophes au maximum |
Dispositions intégrées dans le décret relatif à la biologie médicale examiné le 22 décembre 2015 par la section sociale du Conseil d’État. (en cours de publication) |
Article 13 |
Art. L. 6213-6-1 du code de la santé publique |
Décret en Conseil d’État |
Modalités spécifiques de la procédure d’accréditation des laboratoires de biologie médicale prévue à l’article L. 6221-1 pour la Guadeloupe, la Guyane, la Martinique, Mayotte, Saint-Barthélemy, Saint-Martin et Saint-Pierre-et-Miquelon |
La section sociale du CE s’est prononcée sur ce projet le 27 juillet 2015. La publication est liée à celle du décret relatif à la biologie médicale |
ANNEXE 2 :
ARRÊTÉS PRÉVUS PAR LA LOI DU 30 MAI 2013
PORTANT RÉFORME DE LA BIOLOGIE MÉDICALE
Article |
Base légale |
Type d’arrêté |
Objet |
Observations |
Article 5 |
Art. L. 6211-13 du code de la santé publique |
Arrêté du ministre chargé de la santé |
Liste des catégories de professionnels de santé autorisés à réaliser un prélèvement et des lieux de sa réalisation lorsque le prélèvement d’un examen de biologie médicale ne peut pas être réalisé dans un laboratoire de biologie médicale |
Arrêté du 13 août 2014, publié au JO du 26 août 2014 fixant les catégories de professionnels de santé autorisés à réaliser des prélèvements d’échantillons biologiques aux fins d’un examen de biologie médicale et la phase analytique de l’examen de biologie médicale en dehors d’un laboratoire de biologie médicale, ainsi que les lieux de réalisation de ces phases. Cet arrêté doit être modifié pour notamment inclure les masseurs kinésithérapeutes parmi les professionnels de santé habilités à faire des prélèvements, à la demande de ces derniers : le projet d’arrêté rectificatif a fait l’objet d’un avis favorable du Haut Conseil des professions paramédicales le 25 juin dernier. Il doit également faire l’objet d’un avis de la Commission nationale de biologie médicale créée par le décret n° 2015-1152 du 16 septembre 2015 mais non encore constituée. |
Article 7 |
Article L. 6213-2-1 du code de la santé publique |
Arrêté du ministre chargé de la santé et du ministre chargé de l’enseignement supérieur et de la recherche |
Définition des disciplines mixtes et biologiques qui correspondent aux domaines de spécialisation des professionnels non titulaires du diplôme d’études spécialisées de biologie médicale, exerçant des fonctions de biologiste médical dans les CHU |
Arrêté à prendre |
Article 8 |
Article L. 6211-18 du code de la santé publique |
1) Arrêté du ministre chargé de la santé 2) Arrêté du ministre chargé de la santé |
1) Liste des lieux autres qu’un laboratoire d’analyse médicale où la phase analytique d’un examen de biologie médicale peut être réalisée pour des motifs liés à l’urgence 2) Liste des catégories de professionnels de santé habilités à réaliser la phase analytique en dehors d’un laboratoire d’analyse de biologie médicale |
Arrêté du 13 août 2014, publié au JO du 26 août 2014 fixant les catégories de professionnels de santé autorisés à réaliser des prélèvements d’échantillons biologiques aux fins d’un examen de biologie médicale et la phase analytique de l’examen de biologie médicale en dehors d’un laboratoire de biologie médicale, ainsi que les lieux de réalisation de ces phases. Même remarque que précédemment. |
Article 9 |
Art L. 6211-8-1 du code de la santé publique |
Arrêté du ministre chargé de la santé |
Liste des examens réputés urgents et conditions de réalisation et de rendu des résultats |
En attente de publication |
ANNEXE 3 :
DÉCRETS PRÉVUS PAR L’ORDONNANCE
DU 13 JANVIER 2010 RELATIVE À LA BIOLOGIE MÉDICALE
Article |
Base légale |
Type de décret |
Objet |
Observations |
Article 1er |
Art. L. 6211-4 du code de la santé publique |
Décret |
Liste des examens réalisés en des lieux éloignés de tout laboratoire de biologie médicale afin de diagnostiquer et prendre en charge des maladies mentionnées à l’article L. 3114-5 qui, dans les départements mentionnés au même article, ne sont pas soumis aux dispositions du livre II de la sixième partie du CSP |
Dispositions intégrées dans le décret relatif à la biologie médicale examiné le 22 décembre 2015 par la section sociale Conseil d’État. En cours de publication |
Article 1er |
Art. L. 6211-16 du code de la santé publique |
Décret en Conseil d’État |
Conditions dans lesquelles le prélèvement d’un échantillon biologique peut, par dérogation, ne pas être réalisé dans l’un des territoires de santé infrarégionaux d’implantation du laboratoire de biologie médicale |
Dispositions intégrées dans le décret relatif à la biologie médicale examiné le 22 décembre 2015 par la section sociale Conseil d’État. En cours de publication |
Article 1er |
Art. L. 6211-19 du code de la santé publique |
Décret |
Pourcentage de transmission d’échantillons biologiques d’un laboratoire de biologie médicale à un autre à des fins d’analyse et d’interprétation |
Décret n° 2011-1268 du 10 octobre 2011 fixant les règles permettant d’apprécier l’activité d’un laboratoire de biologie médicale et le pourcentage maximum d’échantillons biologiques pouvant être transmis entre laboratoires de biologie médicale. |
Article 1er |
Art. L. 6213-1 du code de la santé publique |
Décret en Conseil d’État |
Conditions dans lesquelles une qualification en biologie médicale, délivrée par l’ordre des médecins ou l’ordre des pharmaciens, peut permettre à ces médecins et pharmaciens de revendiquer le titre de biologiste médical |
Décret du 16 septembre 2015 relatif aux conditions et modalités d’exercice des biologistes médicaux et portant création de la Commission nationale de biologie médicale |
Article 1er |
Art. L. 6213-6 du code de la santé publique |
Décret en Conseil d’État |
Définition des modalités d’exercice et des règles professionnelles de la biologie médicale, ainsi que des conditions dans lesquelles le biologiste médical est soumis à une mesure de compensation |
Décret du 16 septembre 2015 relatif aux conditions et modalités d’exercice des biologistes médicaux et portant création de la Commission nationale de biologie médicale |
Article 1er |
Art. L. 6213-12 du code de la santé publique |
Décret en Conseil d’État |
Définition de la composition, des conditions de consultations et des attributions de la commission consultée pour avis aux articles L. 6211-3, L. 6211-22, L. 6211-23, L. 6213-2 et L. 6213-3 |
Décret du 16 septembre 2015 relatif aux conditions et modalités d’exercice des biologistes médicaux et portant création de la Commission nationale de biologie médicale |
Article 1er |
Art. L. 6221-10 du code de la santé publique |
Décret |
Définition des catégories d’examens de biologie médicale soumis au contrôle national de la qualité des résultats de l’ANSM |
Dispositions intégrées dans le décret relatif à la biologie médicale examiné le 22 décembre 2015 par la section sociale Conseil d’État. En cours de publication |
Article 1er |
Art. L. 6223-1 du code de la santé publique |
Décret en Conseil d’État |
Dispositions réglementaires relatives aux sociétés exploitant un LBM prises en application du L. 6223-1 CSP issu de l’ordonnance 2010-49 mais surtout en application de : – Pour les SEL, la loi 90-1258 ; – Pour les SCP, la loi 66-879 ; – Pour les Coopératives, la loi 47-1775. |
Texte examiné par la section sociale du Conseil d’État le 22 décembre 2015 En cours de publication |
Article 1er |
Art. L. 6241-6 du code de la santé publique |
Décret en Conseil d’État |
Définition des modalités d’application du chapitre relatif aux sanctions administratives applicables en matière de biologie médicale |
Projet actuellement soumis à la direction des affaires juridiques du ministère de la santé. Publication attendue pour le 1er trimestre 2016 |
Article 2 |
Art. L. 4352-1 du code de la santé publique |
Décret en Conseil d’État |
Conditions dans lesquelles les techniciens de laboratoire réalisent des prélèvements |
Décret n° 2012-461 du 6 avril 2012 relatif aux conditions de réalisation des prélèvements sanguins effectués par les techniciens de laboratoire médical modifié par le décret n° 2014-1042 du 12 septembre 2014 relatif au sang humain |
Article 2 |
Art. L. 4352-9 du code de la santé publique |
Décret en Conseil d’État |
Définition des modalités d’exercice et des règles professionnelles auxquelles sont soumis les techniciens de laboratoire ; de la composition et du fonctionnement de la commission mentionnée à l’article L. 4352-6 ; des conditions dans lesquelles l’intéressé est soumis à une mesure de compensation ; des modalités de vérification des qualifications professionnelles mentionnées à l’article L. 4352-7 ; et enfin, des modalités d’application de l’obligation de transmission des informations mentionnées à l’article L. 4352-5 du CSP |
Décret n° 2010-334 du 26 mars 2010 relatif à la reconnaissance des qualifications professionnelles requises des ressortissants des États membres de l’Union européenne ou des autres États parties à l’accord sur l’Espace économique européen pour l’exercice des professions médicales, pharmaceutiques et paramédicales et à la formation des aides-soignants, auxiliaires de puériculture et ambulanciers |
Article 3 |
Art. L. 5232-4 du code de la santé publique |
Décret en Conseil d’État |
Modalités d’application du signalement sans délai à l’Agence nationale de sécurité du médicament (ANSM) de tout incident mettant en cause ces produits susceptibles d’entraîner des effets néfastes pour la santé des personnes, par les professionnels de santé qui utilisent des produits de santé mentionnés aux 18° et 19° de l’article L. 5311-1 |
Décret n° 2011-1448 du 7 novembre 2011 relatif à la vigilance exercée sur les produits de santé mentionnés aux 18° et 19° de l’article L. 5311-1 du code de la santé publique. |
ANNEXE 4 :
ARRÊTÉS PRÉVUS PAR L’ORDONNANCE DU 13 JANVIER 2010
RELATIVE À LA BIOLOGIE MÉDICALE
Article |
Base légale |
Type d’arrêté |
Objet |
Observations |
Article 1er |
Art. 6211-3 du code de la santé publique |
Arrêté du ministre chargé de la santé |
Définition des tests, recueils et traitements de signaux biologiques, à visée de dépistage, d’orientation diagnostique ou d’adaptation thérapeutique immédiate ne constituant pas des examens de biologie médicale ; des catégories de personnes pouvant réaliser ces tests, recueils et traitements de signaux biologiques ainsi que, le cas échéant, leurs conditions de réalisation |
En attente de publication L’arrêté correspondant a été annulé par décision n° 371236 du 8 avril 2015 du Conseil d’État statuant au contentieux : arrêté du 11 juin 2013 déterminant la liste des tests, recueils et traitements de signaux biologiques qui ne constituent pas un examen de biologie médicale, les catégories de personnes pouvant les réaliser et les conditions de réalisation de certains de ces tests, recueils et traitements de signaux biologiques Le nouvel arrêté a reçu l’avis favorable du Haut conseil des professions paramédicales le 24 novembre 2015. Il doit être soumis à l’avis de la commission nationale de la biologie médicale, créé par le décret n° 2015-1152 du 16 septembre 2015 mais qui n’est pas encore installée. |
Article 1er |
Art. 6211-18 du code de la santé publique |
1) Arrêté du ministre chargé de la santé 2) Arrêté du ministre chargé de la santé |
1) Liste des lieux, autres qu’un laboratoire d’analyse médicale, où la phase analytique d’un examen de biologie médicale peut être réalisée pour des motifs liés à l’urgence 2) Liste des catégories de professionnels de santé habilités à réaliser la phase analytique en dehors d’un laboratoire d’analyse de biologie médicale. |
Arrêté du 13 août 2014, publié au JO du 26 août 2014, fixant les catégories de professionnels de santé autorisés à réaliser des prélèvements d’échantillons biologiques aux fins d’un examen de biologie médicale et la phase analytique de l’examen de biologie médicale en dehors d’un laboratoire de biologie médicale, ainsi que les lieux de réalisation de ces phases Cet arrêté doit être modifié pour notamment inclure les masseurs kinésithérapeutes parmi les professionnels de santé habilités à faire des prélèvements, à la demande de ces derniers : le projet d’arrêté rectificatif a fait l’objet d’un avis favorable du Haut Conseil des professions paramédicales le 25 juin dernier. Il doit être soumis à l’avis de la commission nationale de la biologie médicale, créé par le décret n° 2015-1152 du 16 septembre 2015 mais qui n’est pas encore installée. |
Article 1er |
Art. 6211-19 du code de la santé publique |
Arrêté du ministre chargé de la santé |
Liste des laboratoires de référence pour des examens de biologie médicale ou pour des pathologies déterminés |
En attente de publication Un projet de décret en Conseil d’État, définissant ce qu’est un laboratoire de référence, est actuellement rédigé mais n’est pas encore finalisé. Il sera publié préalablement à l’arrêté fixant la liste des laboratoires. |
Article 1er |
Art. 6211-22 du code de la santé publique |
Arrêté du ministre chargé de la santé |
Conditions de réalisation de certains examens de biologie médicale susceptibles de présenter un risque particulier pour la santé publique |
En attente de publication |
Article 1er |
Art. 6211-23 du code de la santé publique |
Arrêté du ministre chargé de la santé |
Liste des examens de biologie médicale, des activités biologiques d’assistance médicale à la procréation et des examens d’anatomie et de cytologie pathologique qui présentent un danger particulier ; liste des critères de compétence des laboratoires et des personnes habilitées à les effectuer |
En attente de publication |
Article 1er |
Art. 6213-1 du code de la santé publique |
Arrêté du ministre chargé de la santé |
Définition des diplômes de spécialité en biologie médicale permettant soit à un médecin titulaire de l’un des titres de formation mentionnés à l’article L. 4131-1, soit à un pharmacien titulaire de l’un des titres de formation mentionnés aux articles L. 5221-2, L. 4221-4 et L. 4221-5, de revendiquer le titre de biologiste médical |
Arrêté du 10 juin 2010, publié au JO du 20 juin 2010, fixant la liste des diplômes de spécialités en biologie médicale en application de l’article L. 6213-1 (1°, a) du code de la santé publique |
Article 1er |
Art. 6221-2 du code de la santé publique |
Arrêté des ministres chargés de la santé et de l’industrie |
Définition des références des normes applicables aux laboratoires de biologie médicale dans le processus d’accréditation |
Arrêté du 5 août 2010, publié au JO le 1er septembre 2010, fixant les références des normes d’accréditation applicables aux laboratoires de biologie médicale |
Article 1er |
Art. 6221-9 du code de la santé publique |
Arrêté du ministre chargé de la santé |
Définition du contenu des rapports transmis chaque année par les organismes d’évaluation externe de la qualité à l’ANSM |
En attente de publication Cet arrêté sera pris après publication du décret relatif à la biologie médicale |
Article 2 |
Art. L. 4252-2 du code de la santé publique |
Arrêté des ministres chargés de la santé et de l’enseignement supérieur |
Liste des titres de formations dont le programme d’enseignement théorique et clinique est équivalent à celui du diplôme d’État de technicien de laboratoire médical, permettant à leurs titulaires de revendiquer le titre de technicien de laboratoire et d’en exercer la profession |
En attente de publication. La réingénierie de la profession de technicien de laboratoire médical est interrompue depuis 2012. La liste des diplômes reconnus comme équivalents au diplôme d’État ne pourra donc être publiée qu’une fois le travail de réingénierie achevé. |
Article 2 |
Art. 4252-3 du code de la santé publique |
Arrêté du ministre chargé de la santé |
Liste des diplômes qui, si obtenus avant la date de la publication de l’ordonnance n° 2010-49 du 13 janvier 2010 relative à la biologie médicale, permettent à leurs titulaires de revendiquer le titre de technicien de laboratoire et d’en exercer la profession |
Arrêté du 21 octobre 1992 modifié fixant la liste des titres exigés des personnes employées en qualité de technicien dans un laboratoire d’analyses de biologie médicale. Arrêté du 4 novembre 1976 fixant la liste des titres ou diplômes exigés des personnes employées en qualité de techniciens dans un laboratoire d’analyses de biologie médicale → (on se réfère à cet arrêté si le diplôme a été délivré avant le 31 décembre 1995). |
Article 2 |
Art. 4352-7 du code de la santé publique |
Arrêté du ministre chargé de la santé |
Liste des pièces justificatives devant être jointes à la déclaration préalable permettant aux professionnels de santé, ressortissants d’un État membre de l’Union européenne ou d’un autre État partie à l’accord sur l’Espace économique européen et établis en France, d’exécuter des actes professionnels de manière temporaire et occasionnelle |
Arrêté du 24 mars 2010 relatif à la déclaration préalable de prestation de services pour l’exercice de la profession de technicien de laboratoire médical (la liste des pièces à fournir figure en annexe de l’arrêté). |
Article 8 |
– |
Arrêté du ministre chargé de la santé |
Conditions dans lesquelles un laboratoire de biologie médicale non accrédité au sens de l’article L. 6221-1 du code de la santé publique justifie de son entrée effective dans une démarche d’accréditation, afin de continuer à fonctionner |
Arrêté du 21/10/2013, modifiant l’arrêté du 17/10/2012 définissant les conditions justificatives de l’entrée effective d’un laboratoire de biologie médicale dans une démarche d’accréditation |
Article 7 |
– |
Arrêté du ministre chargé de la santé |
Arrêté relatif à la bonne exécution des actes de biologie médicale, qui détermine les conditions dans lesquelles un laboratoire de biologie médicale, non-accrédité au sens de l’article L. 6221-1 du code de la santé publique, peut fonctionner jusqu’au 31 octobre 2020 |
En attente de publication |
ANNEXE 5 :
EXEMPLE DE COURRIER D’ACCUSÉ DE RÉCEPTION PAR LE COFRAC
D’UNE DEMANDE D’ACCRÉDITATION


ANNEXE 6 :
LISTE DES PERSONNES AUDITIONNÉES PAR LE RAPPORTEUR
(par ordre chronologique)
Ø Audition commune :
– Association pour le progrès de la biologie médicale – M. Alain Le Meur, président, M. Stéphane Eimer, Mme Olivia de Roubaix, et M. Éric Ecouelle, membres
– Syndicat des laboratoires de biologie clinique – M. Jean Philipp, président, Mme Hala Sarmini Abdulac et M. Thierry Bouchet, vice-présidents
Ø Collège des directeurs généraux des agences régionales de santé (ARS) – M. Claude Evin, directeur général de l’ARS d’Île-de-France, et Mme Isabelle Jayet, chargée de projet
Ø Audition commune :
– Conseil central de la section des pharmaciens biologistes du Conseil de l’ordre des pharmaciens * – M. Philippe Piet, président, Mme Anne Gruson-Rauwel, membre du bureau du conseil central de la Section G, et Mme Françoise Memmi, chef de service, juriste
– Ordre national des Pharmaciens – M. Jean-Charles Rochard, secrétaire général
Ø Audition commune :
– Laboratoire Biomnis – Mme Anne Ebel, présidente, et M. Charles Woler, directeur général exécutif
– Laboratoire Cerba – Mme Sylvie Cado, présidente directeur général, et Mme Catherine Courboillet, présidente du directoire
Ø Audition commune :
– Syndicat des biologistes (SDB) – M. François Blanchecotte, président, MM. Bruno Rousset-Rouvière, Richard Fabre et Jean-Louis Pons, vice-présidents
– Syndicat des jeunes biologistes médicaux (SJBM) – M. Thomas Nenninger, président
– Syndicat national des médecins biologistes – Dr Claude Cohen, président, et Dr Jean-Claude Azoulay, secrétaire général-adjoint
Ø Comité français d’accréditation (Cofrac) – M. Bernard Doroszczuk, directeur général, et Mme Hélène Méhay, directrice de la section santé humaine
Ø Audition commune :
– Fédération hospitalière de France (FHF) – M. René Caillet, responsable du pôle Organisation sanitaire et médico-social, et M. Bernard Gouget, conseiller sur les questions de santé publique
– Fédération nationale des syndicats des praticiens biologistes hospitaliers et hospitalo-universitaires (FNSPBHU) – M. Jean-Gérard Gobert, président, et M. Rémy Couderc, membre du conseil d’administration et chef du service de biochimie de l’hôpital Trousseau
– Syndicat national des biologistes des hôpitaux (SNBH) – Mme Carole Poupon, présidente, et M. Vincent Estève, vice-président
Ø Haute Autorité de santé (HAS) – M. Dominique Maigne, directeur, M. Denis-Jean David, adjoint au chef du service Évaluation des actes professionnels, et M. Thomas Leludec, directeur de l’amélioration de la qualité et de la sécurité des soins
Ø Audition commune :
– Fédération nationale des syndicats de pharmaciens et biologistes assistants des hôpitaux (FNSPBAH) – M. Julien Fonsart, vice-président
– Fédération nationale des syndicats d’internes en pharmacie et biologie médicale (FNSIP-BM) – Mme Eugénie Duroyon, coprésidente Biologie médicale, M. Julien Monier et Mme Alice Fournier, vice-présidents Biologie médicale
Ø Centre de biologie et de pathologie Est – Laboratoire de bactériologie et microbiologie – Pr Jérôme Etienne
Ø Conseil national de l’ordre des médecins (CNOM) – Dr Jean Canarelli, président de la commission nationale de biologie, et M. Francisco Jornet, directeur des services juridiques
Ø Établissement français du sang (EFS) – M. François Toujas, président, Mme Karine Bornarel, directrice adjointe des affaires juridiques, et Mme Laurence Ferney-Nahum, responsable du département biologie médicale
Ø Le Noble Age – M. Michel Ballereau, conseiller auprès du président
Ø Audition commune :
– Ministère des affaires sociales, de la santé et des droits des femmes – Direction générale de la santé (DGS) – M. Benoît Vallet, directeur général, et M. Jean-Yves Lacoste, adjoint du chef du bureau qualité des pratiques et recherches biomédicales
– Cofrac – M. Bernard Doroszczuk, directeur général, et Mme Hélène Méhay, directrice de la section Santé humaine
* Ce représentant d’intérêts a procédé à son inscription sur le registre de l’Assemblée nationale, s’engageant ainsi dans une démarche de transparence et de respect du code de conduite établi par le Bureau de l’Assemblée nationale.
1 () « Rapport pour un projet de réforme de la biologie médicale » présenté par M. Michel Ballereau et remis à Mme Roselyne Bachelot-Narquin, ministre de la santé, de la jeunesse, des sports et de la vie associative, le 23 septembre 2008.
2 () « La biologie médicale libérale en France : bilan et perspectives », inspection générale des affaires sociales, rapport n° 2006-045 (2006).
3 () Loi n° 2009-879 du 21 juillet 2009 portant réforme de l’hôpital et relative aux patients, à la santé et aux territoires
4 () Loi n° 2013-442 du 30 mai 2013 portant réforme de la biologie médicale.
5 () Ordonnance n° 2010-49 du 13 janvier 2010 relative à la biologie médicale.
6 () Décret n° 2014-606 du 6 juin 2014 relatif aux conditions de remplacement des biologistes médicaux par des internes en médecine et en pharmacie.
7 () Décret n° 2015-1152 du 16 septembre 2015 relatif aux conditions et modalités d’exercice des biologistes médicaux et portant création de la Commission nationale de biologie médicale.
8 () Arrêté du 11 juin 2013 déterminant la liste des tests, recueils et traitements de signaux biologiques qui ne constituent pas un examen de biologie médicale, les catégories de personnes pouvant les réaliser et les conditions de réalisation de certains de ces tests, recueils et traitements de signaux biologiques.
9 () Conseil d’État, 1re et 6e sections, décision de renvoi, n° 371236, 6 février 2014.
10 () Décision n° 2014-389 QPC du 4 avril 2014.
11 () Conseil d’État, 1re et 6e sections, arrêt n° 371236, du 8 avril 2015.
12 () Il s’agit en réalité de la Commission nationale de biologie médicale dont l’article L. 6213-12 prévoit l’institution par décret en Conseil d’État.
13 () Décret n° 2015-1152 du 16 septembre 2015 relatif aux conditions et modalités d’exercice des biologistes médicaux et portant création de la Commission nationale de biologie médicale.
14 () Article L.6211-2 et L. 6211-8 du code de la santé publique.
15 () Arrêté du 13 août 2014 fixant les catégories de professionnels de santé autorisés à réaliser des prélèvements d’échantillons biologiques aux fins d’un examen de biologie médicale et la phase analytique de l’examen de biologie médicale en dehors d’un laboratoire de biologie médicale ainsi que les lieux de réalisation de ces phases.
16 () Il s’agit des « personnes qui exerçaient, à la date du 29 novembre 1997, les fonctions de technicien de laboratoire médical dans un établissement de transfusion sanguine sans remplir les conditions exigées mais qui justifient, à la date du 23 mai 2004, d’une formation relative aux examens de biologie médicale réalisés dans un établissement de transfusion sanguine ».
17 () Il s’agit des « personnes qui exerçaient, à la date de promulgation de la loi n° 2013-442 du 30 mai 2013 portant réforme de la biologie médicale, les fonctions de technicien de laboratoire médical et qui ne sont pas titulaires d’un des diplômes ou titres de formation prévus aux articles L. 4352-2 et L. 4352-3. »
18 () Décret n° 2011-1268 du 10 octobre 2011 fixant les règles permettant d’apprécier l’activité d’un laboratoire de biologie médicale et le pourcentage maximum d’échantillons biologiques pouvant être transmis entre laboratoires de biologie médicale.
19 () Arrêté du 10 juin 2010 fixant la liste des diplômes de spécialités en biologie médicale en application de l’article L. 6213-1 (1°, a) du code de la santé publique.
20 () Décret n° 2004-252 du 19 mars 2004 relatif aux conditions dans lesquelles les docteurs en médecine peuvent obtenir une qualification de spécialiste.
21 () Décret n° 2010-1208 du 12 octobre 2010 relatif aux conditions de délivrance d’une qualification en biologie médicale par l’ordre des pharmaciens.
22 () Arrêté du 1er mars 2012 relatif à la composition des commissions de qualification et à la procédure de qualification des pharmaciens en biologie médicale.
23 () Il s’agit de la fameuse commission nationale de biologie médicale instituée par un décret en Conseil d’État publié en septembre 2015 qui se trouve contesté par les représentants des biologistes médicaux.
24 () Conseil d’État, 26 novembre 2012, Mme B., req. n° 35506.
25 () Décret n° 2015-1152 du 16 septembre 2015 relatif aux conditions et modalités d’exercice des biologistes médicaux et portant création de la Commission nationale de biologie médicale.
26 () La formation des biologistes médicaux est aujourd’hui sanctionnée par la délivrance d’un diplôme d’études spécialisées. En l’espèce, les craintes exprimées par les biologistes médicaux concernent les professionnels dont la qualification relève de l’ancienne formation.
27 () La rédaction actuelle prévoit un spectre de décision plus large pour la formation restreinte. Sa compétence couvre le champ des articles L. 6213-2 et L. 6213-2-1 et du V de l’article 9 de l’ordonnance n° 2010-49 du 13 janvier 2010 relative à la biologie médicale qui concerne l’ensemble des biologistes. La nouvelle rédaction calibrerait la nature des dossiers à la composition de la formation restreinte.
28 () Loi n° 2011-1906 du 21 décembre 2011 de financement de la sécurité sociale pour 2012.
29 () La loi de modernisation de notre système de santé a substitué aux communautés hospitalières de territoire les groupements hospitaliers de territoire.
30 () Conseil d’État, 1er octobre 2014, Sté Laboratoires de biologie médicale Bio Dôme Unilabs : req. n° 382500.
31 () Conseil Constitutionnel, 5 décembre 2014, n° 2014-434 QPC.
32 () L’article L. 6241-1 du code de la santé publique prévoit en son 15° des sanctions administratives « en cas de méconnaissance de l’une des obligations de déclaration et de communication auprès de l’agence régionale de santé prévues à l’article L. 6222-1 ».
33 () Le régime juridique antérieur était prévu par l’article 5-1 de la loi du 31 décembre 1990, lui-même issu de la loi n°2001-1168 du 11 décembre 2001. La majorité du capital d’une SEL exploitant un laboratoire de biologie médicale pouvait être détenue par des biologistes personnes physiques n’y exerçant pas ou par des personnes morales ayant pour objet social l’exercice de cette profession. Précisons également que ces dernières pouvaient être des sociétés étrangères non soumises aux mêmes règles de détermination du capital et des droits de vote que les SEL françaises et ainsi être potentiellement détenues entièrement par des non-biologistes.
34 () Y compris celle légalement établie dans un autre État membre de l’Union européenne ou partie à l’accord sur l’Espace économique européen ou dans la Confédération suisse qui exerce dans l’un de ces États.
35 () La rédaction de cet article a d’ailleurs été reprise par l’article L. 6223-5 du code de la santé publique issu de l’ordonnance de 2010 relative à la biologie médicale.
36 () Précisons que l’article 5-1 a été abrogé par la loi n° 2015-990 du 6 août 2015 pour la croissance, l’activité et l’égalité des chances économiques. Le dispositif a cependant été repris au sein du 2° du I de l’article 6 de la loi du 31 décembre 1990.
37 () Loi n° 2001-1168 du 11 décembre 2001 portant mesures urgentes de réformes à caractère économique et financier.
38 () Il s’agit aujourd’hui du 2° du I de l’article 6 de la loi du 31 décembre 1990.
39 () Cf. note précédente.
40 () Il s’agit plus précisément du II de l’article 10 qui modifie l’article L. 6223-8 du code de la santé publique.
41 () Cour des comptes, rapport sur l’application des lois de financement de la sécurité sociale, « Chapitre XIII : les dépenses de biologie médicale », septembre 2013.
42 () Arrêté du 26 novembre 1999 relatif à la bonne exécution des analyses de biologie médicale.
43 () Arrêté du 17 octobre 2012 définissant les conditions justificatives de l’entrée effective d’un laboratoire de biologie médicale dans une démarche d’accréditation.
44 () Cofrac, « Portées-types d’accréditation », SH INF 50, Révision 01.
45 () Laboratoire, organisme de certification ou organisme d’inspection.
46 () Arrêté du 5 août 2010 fixant les références des normes d’accréditation applicables aux laboratoires de biologie médicale.
47 () Pour mémoire, cet article couvre le champ de la phase analytique d’un examen de biologie médicale réalisé en dehors d’un laboratoire de biologie médicale en cas d’urgence.
48 () Norme NF EN ISO 15189 « laboratoires d’analyses de biologie médicale – exigences particulières concernant la qualité et la compétence ».
49 () Norme NF EN ISO 22870 « analyses de biologie délocalisées – exigences concernant la qualité et la compétence ».
50 () Arrêté du 26 novembre 1999 relatif à la bonne exécution des analyses de biologie médicale.
51 () Loi n° 2008-776 du 4 août 2008 de modernisation de l’économie.
52 () Décret n° 2008-1401 du 19 décembre 2008 relatif à l’accréditation et à l’évaluation de conformité pris en application de l’article 137 de la loi n° 2008-776 du 4 août 2008 de modernisation de l’économie.
53 () Décret n° 2015-205 du 23 février 2015 relatif aux modalités de dépôt des demandes d’accréditation des laboratoires de biologie médicale prévues en application du I de l’article 7 de l’ordonnance n° 2010-49 du 13 janvier 2010 relative à la biologie médicale.
54 () Le nombre de 1012 moins élevé qu’au 31 octobre 2013 est imputable au processus de concentration des laboratoires de biologie médicale.
55 () Arrêté du 26 novembre 1999 relatif à la bonne exécution des analyses de biologie médicale.
56 () Décret n° 2015-205 du 23 février 2015 relatif aux modalités de dépôt des demandes d’accréditation des laboratoires de biologie médicale prévues en application du I de l’article 7 de l’ordonnance n° 2010-49 du 13 janvier 2010 relative à la biologie médicale.
57 () Saisi en référé par le syndicat des biologistes en vue de suspendre l’exécution du décret du 23 février 2015, le Conseil d’État a conclu que le non-respect de la date butoir du dépôt des dossiers d’accréditation du 30 avril n’exposait pas les laboratoires à des sanctions : « il ne résulte pas du décret litigieux que les laboratoires qui n’auraient pas respecté les échéances mentionnées ci-dessus seraient tenus de cesser leur activité à compter du 1er novembre 2016 du fait que leur demande d’accréditation n’aurait pas pu être examinée à temps » (Conseil d’État, n° 389018, SCP ROUSSEAU, TAPIE, avocats, 15 avril 2015).
58 () Les LBM sont susceptibles de répondre à des appels d’offres exigeant une accréditation pour les examens auxquelles ils postulent. Renoncer à l’accréditation pour certains examens revient dès lors à se priver d’une ressource indispensable au maintien de l’activité.
59 () Rapport d’activité 2014.
60 () Les rapporteurs précisent que cette question n’a pas été abordée lors de l’audition des représentants de la HAS.
61 () Article L. 6221-9 du code de la santé publique.
© Assemblée nationale
