Les enjeux économiques, environnementaux, sanitaires et éthiques
des biotechnologies à la lumière des nouvelles pistes de recherche
TOME I : Rapport
![]()
Comptes rendus et annexes sur
par
M. Jean-Yves LE DÉAUT, député, et Mme Catherine PROCACCIA, sénateur
par M. Jean-Yves LE DÉAUT, Président de l’Office |
par M. Bruno SIDO, Premier vice-président de l’Office |
Composition de l’Office parlementaire d’évaluation des choix scientifiques
et technologiques
Président
M. Jean-Yves LE DÉAUT, député
Premier vice-président
M. Bruno SIDO, sénateur
Vice-présidents
M. Christian BATAILLE, député M. Roland COURTEAU, sénateur
Mme Anne-Yvonne LE DAIN, députée M. Christian NAMY, sénateur
M. Jean-Sébastien VIALATTE, député Mme Catherine PROCACCIA, sénatrice
|
DÉputés |
SÉnateurs |
M. Bernard ACCOYER M. Gérard BAPT M. Christian BATAILLE M. Alain CLAEYS M. Claude de GANAY Mme Françoise GUÉGOT M. Patrick HETZEL M. Laurent KALINOWSKI Mme Anne-Yvonne LE DAIN M. Jean-Yves LE DÉAUT M. Alain MARTY M. Philippe NAUCHE Mme Maud OLIVIER Mme Dominique ORLIAC M. Bertrand PANCHER M. Jean-Louis TOURAINE M. Jean-Sébastien VIALATTE |
M. Patrick ABATE M. Gilbert BARBIER Mme Delphine BATAILLE M. Michel BERSON M. François COMMEINHES M. Roland COURTEAU Mme Catherine GÉNISSON Mme Dominique GILLOT M. Alain HOUPERT Mme Fabienne KELLER M. Jean-Pierre LELEUX M. Gérard LONGUET M. Pierre MÉDEVIELLE M. Franck MONTAUGÉ M. Christian NAMY M. Hervé POHER Mme Catherine PROCACCIA M. Bruno SIDO |
SOMMAIRE
___
Pages
SAISINE 11
RÉSUMÉ 13
INTRODUCTION 19
I. LA RECHERCHE EN BIOTECHNOLOGIES A RÉALISÉ DES AVANCÉES MAJEURES DEPUIS LE DÉBUT DES ANNÉES 2000 25
A. LES TECHNIQUES DE MODIFICATION CIBLÉE DU GÉNOME (GENOME EDITING) ONT RÉVOLUTIONNÉ LES BIOTECHNOLOGIES 26
1. Les précurseurs : trois catégories et quatre générations de techniques 26
2. CRISPR-Cas9 : un couteau suisse, une révolution dans la biologie, une épopée avec ses héros et ses guerres 28
3. Une évolution qui conduit à une révolution CRISPR : souvenir… souvenir 33
B. LES AUTRES NOUVELLES BIOTECHNOLOGIES 39
1. La liste établie par la Commission européenne 39
2. Les autres ruptures technologiques 43
C. LES PRINCIPALES TENDANCES DE LA RECHERCHE EN BIOTECHNOLOGIES 47
1. L’explosion des recherches après la découverte de CRISPR-Cas9 47
a. Le recensement des publications 47
b. Applications de modification ciblée du génome 51
2. La France est-elle en train de perdre sa capacité de recherche et d’innovation ? 53
a. Bien que la France soit à l’origine de la découverte de CRISPR-Cas9, elle prend du retard… 53
b. …en raison de la faiblesse de la recherche appliquée 55
c. Le cas particulier du Genopole d’Évry 55
d. CRISPR-Cas9 dans les laboratoires français 58
II. L’ESPOIR DES BIOTECHNOLOGIES APPLIQUÉES À LA MÉDECINE HUMAINE 61
A. LES POTENTIELS DES DIFFERENTES BIOTECHNOLOGIES APPLIQUEES A LA MEDECINE 61
1. Présentation des différentes biotechnologies en matière de médecine humaine 61
a. La thérapie génique 61
b. Rappel des technologies de modification ciblée du génome 62
c. Le diagnostic préimplantatoire (DPI) 64
2. Essais et applications à travers le monde : un espoir considérable en matière de santé 65
a. Essais cliniques en cours ou envisagés utilisant la modification ciblée du génome 66
b. Une application sur l’homme réussie par la technique des TALEN : le cas de Layla 67
c. Recherches en matière de maladies utilisant CRISPR-Cas9 68
3. CRISPR et effets hors cible 71
B. LA DIMENSION ÉTHIQUE DES MODIFICATIONS GÉNIQUES APPLIQUÉES À L’HOMME 74
1. L’interdiction française d’intervenir sur les cellules germinales doit demeurer intangible, mais les recherches doivent se poursuivre 75
a. Les recommandations du comité d’éthique de l’INSERM ont évolué à l’aune des avancées des techniques 75
b. L’Académie nationale de médecine française souhaite le développement de la recherche y compris sur les cellules germinales 76
c. Certaines associations comme Alliance Vita réclament un moratoire sur la recherche fondamentale sur les cellules germinales 77
2. Les positions des autres pays et des organisations internationales 77
a. La Commission européenne : pas de moratoire sur la recherche fondamentale 77
b. Au Royaume-Uni : le pays européen le plus permissif 78
c. L’Allemagne reste très conservatrice mais souhaite un débat de fond 79
d. Suisse : recherches interdites sur embryons et cellules germinales 81
e. États-Unis : pas de moratoire, mais une autorégulation 82
f. Brésil : une commission pour évaluer les recherches 83
g. Le cas de la Chine 84
3. Moratoire ou liberté de recherche ? 85
C. FAUT-IL MODIFIER LES LÉGISLATIONS ? 88
1. La convention d’Oviedo 89
2. Présentation des principales lois françaises sur la bioéthique 91
3. Un exemple de législation restrictive : Allemagne 92
4. Deux pays à législation intermédiaire : Royaume-Uni et États-Unis 93
5. Législation permissive : la Chine 98
6. Position des organisations internationales et européennes 101
a. L’Union européenne ne dit rien sur la lignée germinale 101
b. L’Organisation des Nations unies pour l’éducation, la science et la culture (UNESCO) : pour une interdiction temporaire 102
c. L’Organisation mondiale de la santé (OMS) : pas de recommandations 102
7. Un accord international est-il possible ? 102
8. Quels enseignements pour la révision de la loi française relative à la bioéthique prévue en 2018 ? 104
9. Quelles modifications de la loi bioéthiques en 2018 ? 112
III. LES BIOTECHNOLOGIES APPLIQUÉES À LA LUTTE BIOLOGIQUE ET AU DÉVELOPPEMENT DURABLE 113
A. LA LUTTE CONTRE LES MALADIES A TRANSMISSION VECTORIELLE 113
1. La modification des propriétés génétiques des vecteurs 115
a. Empêcher le moustique de transmettre la maladie 115
b. Le contrôle des populations de moustiques 115
2. Le biocontrôle par la bactérie wolbachia 117
3. L’utilisation des technologies CRISPR et les potentialités du forçage génétique (gene drive) 118
4. Position de l’OMS sur les techniques de lutte génétique contre les maladies à transmission vectorielle 122
5. Les pays en pointe sur les technologies de modification du génome des vecteurs 123
6. Conclusion sur les biotechnologies appliquées à la lutte biologique 127
B. LES BIOTECHNOLOGIES BLANCHES POUR DES MODES DE PRODUCTION DURABLES 129
C. L’IMPACT DES NOUVELLES TECHNIQUES DE SÉLECTION VÉGÉTALE SUR LA BIODIVERSITE 134
1. Position des scientifiques 135
2. Pour les militants écologistes, les nouvelles techniques de sélection végétale (NBT) sont des OGM qui portent atteinte à la biodiversité 135
3. Avis des académiciens 136
IV. LES BIOTECHNOLOGIES APPLIQUÉES À L’AGRICULTURE : L’ÈRE POST-OGM 141
A. HISTOIRE DES OGM EN FRANCE ET DANS LE MONDE EN QUELQUES DATES 143
1. Le temps des découvertes, des premières interrogations et de la confiance totale dans les biotechnologies () 143
2. La naissance de la controverse sur les aliments transgéniques 144
3. La première conférence des citoyens sur les organismes génétiquement modifiés (OGM) 145
4. La bataille juridique commence. 146
5. Le temps des faucheurs volontaires 147
6. Les démissions et les compromissions des responsables politiques 148
7. La loi de 2008, une loi pour rien ? 150
8. L’affaire Séralini 151
9. La situation des plantes transgéniques dans le monde en 2016 154
B. NOUVELLES BIOTECHNOLOGIES ET NOUVELLES PRODUCTIONS VÉGÉTALES 156
1. La sélection des plantes, constante de l’histoire de l’humanité 156
2. Les avantages de la modification ciblée du génome, par rapport à la mutagenèse aléatoire et à la transgenèse 158
a. Mutation aléatoire ou mutation dirigée 158
b. Accélération de la vitesse de détection 160
c. Moyens de détection du processus de modification du génome 160
d. Nouvelles biotechnologies et nouveaux défis 161
e. Un plus pour l’agriculture biologique 162
f. Complémentarité entre agroécologie et biotechnologie 164
3. Les produits de la modification ciblée du génome : OGM or not OGM ? 168
a. La définition européenne des OGM 168
b. La position européenne sur les nouvelles biotechnologies 170
i. Le processus décisionnel européen 170
ii. Un processus de décision bloqué 172
iii. L’incertitude prévaut depuis dix ans 174
iv. L’Agence européenne de sécurité des aliments (EFSA) 176
c. La position française sur les nouvelles biotechnologies : le rôle du Haut Conseil des biotechnologies (HCB) et de l’Agence nationale de sécurité sanitaire de l’alimentation, de l’environnement et du travail (ANSES) 180
d. La qualification des nouvelles biotechnologies dans les autres pays 184
e. Le positionnement d’autres pays qui utilisent les nouvelles biotechnologies 186
f. La saisine de la Cour de justice de l’Union européenne (CJUE) : une nouvelle démission des responsables politiques 191
4. Les enjeux économiques dans un contexte de concurrence internationale 194
a. Le retard de la France et de l’Union européenne 194
b. Les rapports avec les pays du sud 201
c. La position de l’Organisation des Nations unies pour l’alimentation et l’agriculture (FAO) 202
5. Les positions des pays développés et des pays émergents 207
a. Les États-Unis, un pays pionnier 207
b. L’Allemagne, l’exemple de la timidité européenne 209
c. La Suisse, précurseur des votations et de la consultation citoyenne 210
d. Le Brésil et l’Argentine, la confiance dans les technologies 210
e. La Chine va développer du blé génétiquement modifié 216
6. La nécessité de donner un nouvel élan aux recherches sur les biotechnologies végétales 216
a. Le rapport « Agriculture – Innovation 2025 » 216
b. Le projet « Genius » de l’Institut nationale de la recherche agronomique (INRA) 217
c. Un soutien accru à la recherche et au développement 219
C. NOUVELLES BIOTECHNOLOGIES ET NOUVELLES PRODUCTIONS ANIMALES 221
D. ÉVALUATION SANITAIRE ET ENVIRONNEMENTALE DES BIOTECHNOLOGIES VERTES 225
1. L’évaluation sanitaire 226
2. L’évaluation environnementale 228
a. Plantes à propriété insecticide 228
b. Résistance aux herbicides 229
c. Contournements de résistance 229
d. Nouvelles biotechnologies vertes : moins ou autant d’incertitudes qu’avec les OGM ? 231
1. Les vignes résistantes à l’oïdium et au mildiou 237
a. La demande de M. André Chassaigne, député, président du groupe GDR 238
b. L’amélioration des résistances des cépages au mildiou et à l’oïdium 239
c. Pourquoi l’INRA n’a pas commercialisé ces cépages ? 240
d. L’inscription et le classement des variétés de l’INRA en 2018 241
e. Diminuer les produits phytosanitaires et les sulfates de cuivre 242
f. La demande des viticulteurs 244
g. Des modifications réglementaires européennes 246
h. La modification ciblée du génome sur les vignes ? 247
2. Les huîtres triploïdes 249
a. La demande d’évaluation issue du débat au Sénat en mai 2015 250
b. La position de l’IFREMER sur les huîtres triploïdes en mai 2016 251
c. Audition collective et contradictoire sous la forme de table ronde de l’OPECST sur les huîtres triploïdes 252
d. Conclusions et propositions 256
V. LES ENJEUX JURIDIQUES ET SÉCURITAIRES 259
A. LA PROPRIÉTÉ INTELLECTUELLE DES BIOTECHNOLOGIES 259
1. Le différend sur la propriété intellectuelle initiale de CRISPR-Cas9 259
a. La décision de l’USPTO du 15 février 2017 261
b. Ce différend ne devrait pas gêner la recherche 262
2. Le nombre des dépôts de brevets explose depuis 2013 263
3. Que peut-on breveter dans le corps humain ? 268
4. La dualité de la protection des plantes par brevet et certificat d’obtention végétale (COV) 269
5. La question des semences replantables et « Terminator » 271
B. LA BIOSÉCURITÉ 273
1. La « biologie de garage » 273
2. Un risque accru de bioterrorisme ? 275
VI. L’ÉVALUATION DES RISQUES ET LE DÉBAT PUBLIC 281
A. L’ÉVALUATION DES RISQUES SANITAIRES ET ENVIRONNEMENTAUX 281
1. Le Haut Conseil des biotechnologies (HCB) 281
2. La crise d’identité du Haut Conseil des biotechnologies 283
3. Le rôle de l’Agence nationale de sécurité sanitaire de l’alimentation, de l’environnement et du travail (ANSES) : la sécurité alimentaire des produits autorisés à l’importation 285
B. LA DIFFICULTÉ DU DÉBAT PUBLIC SUR LES BIOTECHNOLOGIES 286
C. INSTAURER LES CONDITIONS D’UN DÉBAT PUBLIC RENOUVELÉ 290
1. Ce que révèle l’analyse sémantique 290
2. Les autres pays font-ils mieux ? 295
D. UN DÉBAT PUBLIC EST-IL POSSIBLE ? 299
CONCLUSION 303
RECOMMANDATIONS 305
EXAMEN DE L’ÉTUDE DE FAISABILITÉ LE 3 MARS 2016 316
EXAMEN DU RAPPORT LE 28 MARS 2017 330
COMPOSITION DU COMITÉ DE PILOTAGE 352
LISTE DES PERSONNES AUDITIONNÉES 354
L’Office parlementaire d’évaluation des choix scientifiques et technologiques (OPECST) a été saisi, à titre principal, le 11 février 2015, par M. Jean-Paul Chanteguet, président de la commission du développement durable de l’Assemblée nationale, d’une « demande portant sur les enjeux économiques et environnementaux des biotechnologies », […] « en raison de l’intérêt d’effectuer un point sur l’état des recherches en matière de biotechnologies et d’organismes génétiquement modifiés ».
Avant de débuter son travail, l’Office d’évaluation avait souhaité attendre la publication du rapport « Agriculture – Innovation 2025 », qui était en cours d’élaboration et qui a été présenté le 22 octobre 2015 par M. François Houllier, président de l’INRA, M. Jean-Marc Bournigal, président de l’Institut national de recherche en sciences et technologies pour l’environnement et l’agriculture (IRSTEA), M. Philippe Lecouvey, directeur général du réseau des instituts des filières animales et végétales (ACTA), et M. Pierre Pringuet, président du conseil d’administration d’AgroParisTech à M. Stéphane Le Foll, ministre de l’agriculture, M. Thierry Mandon, secrétaire d’État chargé de l’enseignement supérieur et de la recherche, et Mme Axelle Lemaire, secrétaire d’État chargée du numérique.
Le 24 novembre 2015, l’OPECST a désigné M. Jean-Yves Le Déaut, député, et Mme Catherine Procaccia, sénateur, comme rapporteurs de cette étude.
Par la suite, cette saisine a été complétée par deux demandes d’étude qui, sans être directement liées aux récents développements de la modification ciblée du génome, sont le fruit de l’utilisation de méthodes biotechnologiques. Le bureau de l’Office a décidé d’en confier l’évaluation aux mêmes rapporteurs et de traiter ces sujets dans le cadre de ce rapport.
Le 25 mars 2016, M. Claude Bartolone, président de l’Assemblée nationale, a relayé la demande de M. Claude Chassaigne, président du groupe de la Gauche démocrate et républicaine (GDR), d’une étude sur « les moyens de réduire l’utilisation des produits phytosanitaires en agriculture, plus particulièrement dans le secteur de la viticulture » (1).
Le 12 mai 2016, lors d’une séance tenue au Sénat autour des risques inhérents à l’exploitation de l’huître triploïde, au cours de laquelle M. Joël Labbé, sénateur, émit quelques réserves et inquiétudes, il a été demandé que le sujet des huîtres triploïdes soit ajouté à l’étude en cours de l’OPECST sur les nouvelles biotechnologies. M. Alain Vidalies, secrétaire d’État auprès de la ministre de l’écologie, du développement durable et de l’énergie, chargé des transports, de la mer et de la pêche, s’y est exprimé dans les termes suivants :
« Sans empiéter sur les prérogatives du Parlement, je ne verrais que des avantages à ce que le bureau du Sénat, ou la commission chargée du développement durable, saisisse l’Office parlementaire d’évaluation des choix scientifiques et technologiques, ou OPECST. L’indépendance de l’expertise de cette délégation des deux assemblées, garantie par son statut, nous permettrait de disposer d’une analyse complète de cette question, sur la base des travaux les plus récents, et d’apporter dans la transparence et la rigueur scientifique les réponses attendues par l’ensemble des parties intéressées, notamment les professionnels de la conchyliculture et les consommateurs. Je crois savoir que l’OPECST va entreprendre une étude sur les enjeux économiques et environnementaux des biotechnologies, la question des huîtres triploïdes pourrait, me semble-t-il, être utilement examinée dans ce cadre » (2).
L’OPECST a également souhaité, lors de sa réunion du 3 mars 2016 approuvant l’étude de faisabilité de l’étude (3), élargir la question posée par le président de la commission du développement durable de l’Assemblée nationale en demandant aux rapporteurs d’évaluer non seulement les enjeux économiques et environnementaux, mais également les enjeux sanitaires et éthiques posés par le développement des nouvelles biotechnologies, et notamment celles regroupées sous le vocable de modification ciblée du génome (genome editing).
L’OPECST a été saisi par la commission du développement durable de l’Assemblée nationale d’une demande portant sur les enjeux économiques et environnementaux des biotechnologies qui lui a demandé d’effectuer un point sur l’état des recherches. L’OPECST a souhaité élargir la question aux aspects sanitaires et éthique et y a associé deux demandes complémentaires sur les vignes résistantes et les huîtres triploïdes.
Les biotechnologies ont fait récemment des progrès considérables, notamment avec les technologies de modification ciblée de génome (genome editing). Parmi elles, la découverte du système dénommé « CRISPR-Cas9 », par Emmanuelle Charpentier et Jennifer Doubna, en 2012, constitue une véritable rupture car elle est plus simple, plus rapide à mettre en œuvre, moins coûteuse et fonctionne sur tous les organismes vivants.
Les applications possibles sont très prometteuses en médecine humaine et dans l’agriculture (plantes et animaux). Une « ère post-OGM » s’annonce. Elles rendent possibles des procédés industriels respectueux de l’environnement. Les craintes sont à la hauteur des potentialités : des questions éthiques sur la modification de l’espèce humaine se posent bien sûr, mais il faut également procéder à une évaluation environnementale et sanitaire des nouvelles techniques de sélection végétale. Ces nouvelles techniques posent les questions de la propriété intellectuelle, de la biosécurité, de l’adéquation des règles actuelles au niveau national, européen et international.
La recherche en biotechnologies a réalisé des avancées majeures depuis le début des années 2000
Avec CRISPR-Cas9 notamment, le nombre de publications scientifiques a augmenté exponentiellement, les laboratoires du monde entier s’en sont emparés. Fruit de la recherche fondamentale, à partir du mécanisme de défense des bactéries contre les phages, CRISPR-Cas9 associe un ciseau moléculaire à un guide ARN qui permet des modifications précises au gène près. Les nouvelles biotechnologies ne se limitent pas aux techniques de modification ciblée du génome, la Commission européenne a recensé sept autres techniques.
La France possède une longue tradition d’excellence en matière de recherche en biotechnologies. Le rejet des OGM végétales depuis deux décennies a démobilisé les équipes et les laboratoires, la recherche française pointe maintenant en sixième position en nombre de publications avec un très fort impact, notre pays semble décrocher du peloton de tête.
L’espoir des biotechnologies appliquées à la médecine humaine
De nombreuses maladies ont des causes génétiques. « Réparer » le génome constitue un espoir et une piste thérapeutique prometteuse. Trois millions de personnes en France et 30 millions à l’échelle européenne sont concernées par les maladies génétiques.
La baisse du coût des recherches aves CRISPR a permis la multiplication des projets à travers le monde. Les premiers essais cliniques sur des patients sont attendus aux États-Unis en 2017 (cancer et amaurose congénitale de Leber). Une petite fille atteinte de leucémie aiguë incurable a été traitée à titre « compassionnel » et guérie au Royaume-Uni en 2016 grâce à la technique des TALEN mise au point par la société française Cellectis. L’OMS n’a malheureusement pas suffisamment mesuré l’enjeu de ces technologies et n’a pas réactivé son programme de génomique humaine.
Tous les scientifiques interrogés ont répondu que les effets hors cible avaient déjà considérablement baissé et étaient maintenant moins nombreux que les mutations naturelles constatées chez tous les organismes vivants.
Ces technologies posent cependant des questions éthiques et doivent conduire les États à s’interroger sur les règles. Il faut distinguer les interventions sur les cellules somatiques, qui ne concernent que le patient que l’on traite, de celles sur les cellules germinales, qui sont transmissibles à la descendance, et qui restent interdites par les pays signataires de la convention d’Oviedo. Le Royaume-Uni a autorisé, en 2015, le transfert mitochondrial, une réparation génétique sur une organelle de la cellule humaine.
Les rapporteurs estiment qu’il faut continuer les recherches, qu’un moratoire n’est ni souhaitable, ni possible. Ils pensent qu’il n’est cependant pas acceptable de modifier la lignée germinale humaine pour l’améliorer ou l’« augmenter », selon les thèses transhumanistes. Beaucoup de chercheurs pensent que, lorsque ces technologies seront demain très sûres, il sera difficile d’interdire des modifications héréditaires du génome humain, au cas par cas, afin de soigner une maladie grave ou incurable. Cette décision devra être prise après une nécessaire concertation élargie avec la société civile. L’OMS et l’UNESCO devraient à notre sens s’entourer d’un comité permanent d’experts sur le modèle du GIEC, qui aurait pour mission d’évaluer le degré de maturité des nouvelles thérapies, d’en apprécier les enjeux et de proposer des lignes directrices. Le réexamen de la loi de bioéthique prévu en 2018 doit être l’occasion de poser la question de la modification du génome mitochondrial.
Les biotechnologies appliquées à la lutte biologique et au développement durable
Les maladies transmises par les insectes sont responsables de centaines de milliers de décès par an. Le forçage génétique est une biotechnologie rendue possible avec CRISPR-Cas9 qui devrait devenir rapidement opérationnelle. Elle permet soit de modifier le gène de l’insecte pour le rendre résistant au virus qu’il transporte, soit d’éteindre l’espèce. Cette dernière possibilité pose un problème éthique et environnemental.
Les rapporteurs se prononcent pour la continuation des travaux, mais demandent l’instauration d’un mécanisme de réversibilité en cas d’effet non désiré et s’opposent à toute extinction d’une espèce vivante.
L’étude a montré que les nouvelles techniques de sélection végétale n’ont pas d’impact négatif sur la biodiversité. Au contraire, ces techniques augmentent le nombre de caractères d’intérêt pour l’agriculture et limitent l’usage de pesticides, dont certains sont susceptibles de détruire tous les insectes sans distinction.
Les biotechnologies blanches permettent de remplacer les composants chimiques polluants issus de la chimie traditionnelle par des produits plus durables.
Les biotechnologies appliquées à l’Agriculture, l’ère post-OGM
Les techniques de modification ciblée du génome pourraient avoir des applications révolutionnaires dans l’agriculture, permettant d’accélérer la vitesse de sélection. Elles représentent une rupture fondamentale par rapport aux « anciens » OGM, dans la mesure où ces modifications du génome sont précises et quasiment indétectables. Les traits recherchés ne concernent plus seulement la résistance aux herbicides ou l’amélioration de la productivité, comme pour les actuels OGM. Ils peuvent améliorer la qualité nutritionnelle, procurer une résistance accrue ou allonger la durée de conservation… Les plantes modifiées devraient permettre de diminuer l’utilisation de produits phytosanitaires toxiques.
Les nouvelles techniques de sélection végétale sont complémentaires des méthodes d’agroécologie, elles ont même un grand potentiel pour les agriculteurs bio.
Les OGM sont définis juridiquement au niveau européen dans la directive n° 2001/18. Au même titre que la mutagenèse chimique ou par radiation, les nouvelles techniques de sélection, plus précises, devraient être exclues du champ de cette directive et soumises à des règles de biovigilance.
Les biotechnologies vertes constituent une filière économique importante au niveau mondial. Avec la baisse de leur coût, elles constituent une occasion pour l’Europe de se la réapproprier.
Une méta-analyse de l’Académie des sciences américaine en 2016 montre qu’il n'y a jamais eu un seul cas confirmé de résultat négatif sur la santé humaine ou animale dû à la consommation d’OGM. Ni d’ailleurs de conséquence négative sur l’environnement ou la biodiversité. L’apparition de résistances à des produits phytosanitaires ou à des ravageurs par contre est avérée, mais il s’agit d’une lutte perpétuelle aussi ancienne que la vie et des pratiques agricoles inadaptées en sont sans doute la cause.
L’INRA a développé depuis trente ans, par sélection végétale classique, des variétés de vignes résistantes aux champignons oïdium et mildiou et conservant leurs qualités œnologiques. Ces variétés permettraient de réduire fortement l’utilisation des fongicides, notamment le sulfate de cuivre, dont l’impact sur les sols et la toxicité sont réels.
Les rapporteurs se prononcent pour un classement rapide des nouveaux cépages, afin de procéder à leur exploitation commerciale. Ils estiment que l’utilisation des techniques de modification ciblée du génome permettrait d’étendre rapidement les traits de résistance aux autres cépages, comme ceux utilisés dans le champagne ou le cognac.
L’IFREMER a développé la mise en culture d’huîtres triploïdes, résultat d’une modification génétique obtenue par sélection classique. Les critiques relatives à la surmortalité subie par ces huîtres ou à leur caractère invasif n’ont jamais été démontrées scientifiquement.
Les rapporteurs estiment que la coexistence des différentes façons de cultiver des huîtres, écloserie-nurserie et ostréiculture traditionnelle, n’est pas menacée par les huîtres triploïdes.
Les enjeux juridiques et sécuritaires
La propriété intellectuelle des biotechnologies constitue un enjeu économique important. Deux camps se disputent la propriété intellectuelle initiale de CRISPR-Cas9. On constate depuis 2012 un accroissement important des demandes de dépôts de brevets pour la propriété intellectuelle des applications de biotechnologies, principalement aux États-Unis et en Chine, l’Europe et les autres pays restant loin derrière.
Le développement et la facilité d’accès de la technique CRISPR-Cas9 devraient permettre à des petites structures de développer des semences qui, jusqu’à présent en raison de leur coût, restaient le monopole des grosses firmes agrochimiques, avec des redevances souvent excessives.
La biosécurité recouvre deux réalités : la sécurité au sein même des laboratoires et le bioterrorisme. La simplicité et le faible coût des techniques laissent craindre le développement d’une « biologie de garage ». Les utilisations potentiellement malveillantes des biotechnologies, comme la création d’un virus ou à la modification d’un moustique, deviennent possibles. Conscient de ces menaces, le Gouvernement français a créé en 2015 le Conseil national consultatif pour la biosécurité (CNCB).
Les rapporteurs préconisent un renforcement de la coordination des travaux de recherche civile et militaire, avec des moyens accrus sous le contrôle du Parlement.
L’évaluation des risques et le débat public
En France, c’est le Haut Conseil des biotechnologies (HCB) qui évalue les risques sanitaires et environnementaux liés à la culture d’OGM. Les risques liés aux aliments contenant des OGM sont évalués par l’Agence nationale de sécurité sanitaire de l’alimentation (ANSES). Or le HCB traverse des crises à répétition avec la démission de plusieurs de ses membres.
Les rapporteurs recommandent le transfert de toutes les missions confiées aujourd’hui au comité scientifique du HCB à l’ANSES, qui dispose d’une expertise reconnue et d’un appui technique. Le HCB serait constitué d’un collège unique reprenant les compétences de son actuel comité économique, éthique et social.
L’arrivée des nouvelles biotechnologies nécessite un large débat public. Force est de constater les difficultés du débat public en France, sur ce sujet comme sur d’autres domaines technologiques.
Les rapporteurs estiment qu’il faut engager dès maintenant ce débat, même si ces biotechnologies sont encore à un stade expérimental, faute de quoi il risquerait d’être confisqué par ses opposants systématiques. Ils proposent que les terminales S de tous les lycées de France débattent du thème « génétique et évolution ».
L’Office parlementaire d’évaluation des choix scientifiques et technologies (OPECST) s’est intéressé de près aux biotechnologies depuis le début des années 1990, avec la transposition de la première directive européenne n° 90/220/CE sur les OGM. Cette transposition a été votée par la Parlement français le 13 juillet 1993 dans l’indifférence générale, alors que cette loi autorisait les expérimentations en plein champ des OGM après avis de la commission du génie biomoléculaire (CGB) (4).
Le premier rapport (5) a été présenté en décembre 1990 par M. Daniel Chevallier, député, sur « Les applications des biotechnologies à l’agriculture et à l’industrie agroalimentaire », dans le cadre de la transposition de la première directive européenne. En juillet 1998, un autre rapport présenté par M. Jean-Yves Le Déaut, député, intitulé « De la connaissance des gènes à leur utilisation – Première partie : l’utilisation des organismes génétiquement modifiés dans l’agriculture et dans l’alimentation » faisait le point sur la polémique naissante sur les organismes génétiquement modifiés (OGM). C’est dans ce cadre que l’OPECST a tenu la première conférence de citoyens qui ait été organisée en France.
L’OPECST a ensuite présenté en janvier 2005 un rapport de M. Jean-Yves Le Déaut, député, sur « La place des biotechnologies en France et en Europe » ; Puis MM. Bruno Sido, sénateur, et Jean-Yves Le Déaut ont organisé une audition publique et contradictoire le 19 novembre 2012 sur « Les tests d’intoxication des rats : un débat scientifique sur les OGM est-il possible ? », dont le rapport a été publié en décembre 2012.
Parallèlement, une mission d’information présidée par M. Jean-Yves
Le Déaut, publiait en avril 2005 le rapport de M. Christian Ménard, député, sur « Les enjeux des essais et de l’utilisation des organismes génétiquement modifiés (OGM) ». Tous ces travaux venaient nourrir la réflexion en amont de l’adoption de la loi n° 2008-595 du 25 juin 2008 relative aux organismes génétiquement modifiés (OGM).
On peut également citer trois rapports récents sur des sujets très proches : « Les enjeux de la biologie de synthèse » présenté en février 2012 par Mme Geneviève Fioraso, députée, « Les progrès de la génétique, vers une médecine de précision ? Les enjeux scientifiques, technologiques, sociaux et éthiques de la médecine personnalisée », présenté en janvier 2014 par MM. Alain Claeys et Jean-Sébastien Vialatte, députés, et « Les enjeux et les perspectives de l’épigénétique dans le domaine de la santé », également présenté en octobre 2016 par MM. Alain Claeys et Jean-Sébastien Vialatte.
Depuis les réalisations d’ingénierie génomique à partir des nucléases, au début des années 2000, les biotechnologies ont fait des progrès immenses. Ces technologies de modification ciblée de génome (genome editing) ont constitué une avancée majeure des biotechnologies. Parmi elles, la découverte de la technologie CRISPR-Cas9 (6), par Mmes Emmanuelle Charpentier (Française, directrice de l’Institut Max Planck d’infectiologie à Berlin) et Jennifer Doubna (université de Californie-Berkeley), qui a fait l’objet en 2012 d’une publication dans la revue scientifique américaine Science, a montré la simplicité, la puissance, la rapidité, l’universalité et le faible coût de cette nouvelle technique.
Mme Emmanuelle Charpentier, lors de son allocution à l’Académie des sciences française le 22 mars 2016, juste avant la remise de son prix L’Oréal/UNESCO pour les femmes et la science, retraçait l’histoire de la génétique depuis 1865, avec l’énoncé des lois de Mendel, et précisait que la découverte de CRISPR-Cas9 provenait de la volonté de comprendre le mécanisme de défense des bactéries.
L’histoire de la génétique, depuis soixante-cinq ans, peut être résumée dans le tableau ci-après, qui retrace les grandes étapes qui ont permis la compréhension du vivant.
LES GRANDES ÉTAPES DE LA BIOLOGIE MOLÉCULAIRE
Auteur |
Année |
Découverte |
Prix |
Francis Crick James Watson |
1953 |
Double hélice de l’ADN, support moléculaire de l’hérédité |
Nobel 1962 (médecine) |
Robert Holley Marshall Nirenberg Severo Ochoa |
1962 |
Code génétique |
Nobel 1968 (médecine) |
Werner Arber Daniel Nathan Hamilton Smiths |
1970 |
Les enzymes de restriction Ils ouvrent la voie à la manipulation de l’ADN in vitro |
Nobel 1978 (médecine) |
Paul Berg |
1971 |
ADN recombinant, naissance de l’ingénierie génétique, possibilité d’introduire du matériel d’un organisme dans l’ADN d’un autre organisme (transgenèse) |
Nobel 1980 (Chimie) |
Conférence d’Alisomar |
1975: les bactéries génétiquement modifiées risquent-elles de se propager dans l’environnement ? |
Moratoire de 6 mois pour les recherches sur le génome |
|
Kary B.Mullis(1) Michael Smith(2) |
1983 |
(1) Les techniques d’amplification de l’ADN ouvrent la voie au séquençage, à la caractérisation, à la manipulation du génome (2) Connaissance sur la mutagenèse |
Nobel 1993 (chimie) |
Mario Capecchi Martin Evans Olivier Smithies |
1989 |
Travaux sur des souris transgéniques grâce à la recombinaison homologue dans les cellules souches embryonnaires |
Nobel 2007 (médecine) |
Thomas Lindahl Paul L. Modrich Aziz Sancar |
1974 à 1983 |
Réparation de l’ADN et sauvegarde des informations génétiques contre les mutations |
Nobel 2015 (chimie) |
Francis Mojica ( ?) Rodolphe Barrangou ( ?) Philippe Horvath ( ?) Emmanuelle Charpentier ( ?) Jennifer Doudna ( ?) Georges Church ( ?) Fen Zhang ( ?) |
2011 à 2017 |
Modification ciblée du génome (genome editing) par des ciseaux moléculaire coupant dans les cellules l’ADN à un endroit précis |
Nobel 2017 ? Nobel 2018 ? Nobel 2019 ? Nobel 2020 ? |
Source : M. Jean-Yves Le Déaut.
S’en est suivi, à partir de 2012, une augmentation exponentielle de l’utilisation de ces technologies de modification ciblée du génome (genome editing), en recherche fondamentale, mais aussi dans des domaines d’application aussi divers que la médecine humaine (biotechnologies rouges), l’agriculture et l’élevage (biotechnologies vertes) et les secteurs industriels et environnementaux (biotechnologies blanches). Les chercheurs disposent maintenant d’outils permettant de modifier finement, au gène près, l’ADN de tout être vivant, que ce soit une bactérie ou un être humain, en passant par les plantes, les moustiques ou les animaux. Guérir le cancer et des maladies monogéniques ou créer un nouveau virus, semble être bientôt possible, les limites de ces technologies seront bientôt seulement celles de l’imagination des chercheurs…
Avec les techniques d’intervention ciblée sur le génome, le monde scientifique est à peu près dans la même situation que lors de la conférence d’Asilomar (Californie) organisée par M. Paul Berg en 1974, au début du développement du génie génétique : des scientifiques s’interrogent, et d’autres veulent continuer leurs recherches sans s’interroger… ou être empêchés de continuer ces recherches. La conférence d’Alisomar avait conclu à un moratoire sur certaines expériences de génie génétique, moratoire qui a été levé quelques mois plus tard au profit d’un encadrement strict des expériences de génie génétique, préfigurant une reprise générale des expérimentations (7).
En décembre 2015 à Washington, les académies des sciences des États-Unis, de Chine et du Royaume-Uni ont organisé, un sommet international sur la modification ciblée des gènes humains (human gene editing) (8). Les participants ont énoncé l’apport médical des connaissances acquises sur le génome humain et ses manipulations tout en reconnaissant l’existence d’interrogations, car leur vitesse de diffusion dans les usages médicaux soulève d’importantes questions éthiques, scientifiques et sociétales. Au bout de trois jours de réunion, ils n’ont pas estimé utile d’instaurer un moratoire sur la recherche. Ils ont cependant fixé une limite importante, s’interdire de toucher à la lignée germinale de l’homme, c’est-à-dire de modifier ou de corriger définitivement une lettre du génome. Les académies ont confirmé cette position par la suite, notamment en février 2017.
Les champs d’application des nouvelles technologies de modification ciblée du génome sont très prometteurs en thérapie génique, pour l’homme, ou en amélioration d’espèces végétales ou animales, pour l’alimentation, mais aussi dans d’autres domaines comme les matériaux, la chimie ou l’énergie. Le traitement de maladies jusqu’alors incurables va devenir possible. Les opérations de sélection variétale qui prenaient jusqu’à présent des décennies pourront bientôt être réalisées en quelques mois seulement. Les interrogations sur les risques éventuels de ces technologies ne manquent pas bien sûr de surgir, d’un point de vue économique, environnemental, sanitaire ou éthique.
Comme le disait Mme Jennifer Doudna aux rapporteurs de l’OPECST à l’université de Berkeley (San Francisco), il faut souligner l’aspect positif de cette technologie, mais aussi être responsable et comprendre l’importance de ce que l’on fait lorsque l’on se sert d’une technologie aussi puissante. Il s’agit donc d’être optimiste et en même temps d’avoir conscience de sa responsabilité.
Ces techniques évoluent tellement vite qu’il faut se féliciter que le Parlement français s’en saisisse. D’ailleurs, toutes les personnes rencontrées dans les autres pays, qu’il s’agisse de scientifiques, de comités d’éthique ou d’ONG, ont salué la démarche du Parlement français et des deux rapporteurs, car l’évaluation technologique (technology assessment) doit être faite en amont de la législation.
Afin de mener cette étude, les rapporteurs se sont entourés d’un comité scientifique dont la composition figure en annexe (9), qui les a aidé à définir le champ de leurs investigations.
Ils ont mené pendant quinze mois des auditions qui les a amenés à rencontrer plus de 220 personnes, en France et à l’étranger : scientifiques, médecins, universitaires, ministres, parlementaires, responsables administratifs, industriels, représentants de la société civile, comités d’éthiques, ONG de patients… Deux auditions publiques et contradictoires ont été organisées les 7 avril et 27 octobre 2016. Les rapporteurs se sont déplacés à Gruissan (Aude) pour visiter le site expérimental Pech Rouge de l’INRA, dédié aux vignes résistantes au mildiou et à l’oïdium, ainsi qu’au Génopole d’Évry. Ils ont effectué des missions au Royaume-Uni, aux États-Unis, en Allemagne, en Argentine et au Brésil et en Suisse. Ils ont également rencontré les responsables de plusieurs organisations internationales ou européennes : Organisation mondiale de la santé (OMS), Organisation des Nations unies pour l’alimentation et l’agriculture (FAO), Commission européenne, Office européen des brevets (OEB) et Agence européenne de sécurité des aliments (EFSA).
Ils ont en outre examiné l’adaptation des règles françaises et européennes, voire internationales, à l’émergence de ces nouvelles biotechnologies : celles sur la loi bioéthique française, les directives européennes sur les organismes génétiquement modifiés (OGM) alimentaires, ou encore à la « convention d’Oviedo » conclue dans le cadre du Conseil de l’Europe (10).
Le présent rapport étudiera successivement (I) la recherche en biotechnologies, (II) les applications des nouvelles biotechnologies à la médecine humaine, (III) les applications à l’environnement, (IV) les applications agricoles dites « nouvelles techniques de sélection » (New Breeding Techniques – NBT), (V) les enjeux juridiques et sécuritaires et (VI) les conditions du débat public.
I. LA RECHERCHE EN BIOTECHNOLOGIES A RÉALISÉ DES AVANCÉES MAJEURES DEPUIS LE DÉBUT DES ANNÉES 2000
Introduire dans des organismes vivants des nouveaux gènes n’est pas récent. Un grand virage a été fait dès les années 1970 avec la manipulation du génome des cellules, la possibilité d’insertion ou de suppression (deletion) d’éléments dans le génome, au moyen d’une technique dénommée « recombinaison homologue », mais qui restait très compliquée à mettre en œuvre. Les techniques d’insertion d’un gène choisi à un endroit choisi ont connu des débuts très longs, car la fréquence de ces événements était très faible.
Puis sont arrivés, au début des années 2000, un ensemble d’enzymes – les nucléases –, qui ont permis d’améliorer la modification de génome. Ces enzymes, qui sont décrites ci-après, agissent comme des ciseaux moléculaires, pour ajouter ou supprimer un des éléments de base du génome, pour couper et faire entrer, sortir ou remplacer un nouveau gène à un endroit précis du génome. La recherche en biotechnologies a alors connu une avancée considérable, avec l’invention des techniques de modification ciblée du génome (genome editing). Alors que les techniques précédentes généraient des modifications soit aléatoires (mutagenèse) soit associées à une introduction imprécise de matériel génétique (OGM végétaux et thérapies géniques), les nouvelles biotechnologies, et particulièrement la dernière génération d’entre elles, CRISPR-Cas9, permettent d’intervenir très précisément au niveau d’un ou plusieurs gènes spécifiques, en les détruisant, en les inactivant, en les remplaçant par un gène sain de la même espèce ou en substituant un gène d’une autre espèce apportant une caractéristique intéressante recherchée.
La définition communément donnée aux biotechnologies est riche de signification. Le Grand Robert écrit : « Technique qui met en œuvre les propriétés biochimiques d’êtres vivants pour améliorer la production agricole ou certaines fabrications industrielles. ». Le Grand Larousse propose une définition très proche : « Technique produisant par manipulations génétiques des molécules biologiques ou des organismes transgéniques, en vue d’applications industrielles (agroalimentaire, pharmacie, chimie, etc.) ». Nos dictionnaires, reflétant l’acception la plus largement répandue, assimilent biotechnologies aux manipulations transgéniques.
Or, étymologiquement, « biotechnologie » signifie « technique ou science du vivant ». À la suite du colloque tenu le 22 septembre 2016 à l’Assemblée nationale, l’INSERM et le CNRS, en partenariat avec l’INRA et le CEA, annoncent un livre blanc à paraître début 2017 sur « Les sciences du vivant », avec cinq thématiques : « Qu’est-ce qui est vivant ? L’histoire du vivant. La complexité du vivant. L’être vivant dans son environnement et comme environnement. Bio-inspiration et bio-exploitation ».
Si l’on prend les variétés végétales, cela fait près de 10 000 ans que les hommes ont inventé l’agriculture et les sélectionnent, récolte après récolte, pour améliorer leurs propriétés. Des plantes aussi courantes que le raisin, le maïs ou blé n’ont rien de naturel, les espèces naturelles dont elles dérivent n’étaient ni comestibles ni cultivables. Par un curieux retour de l’histoire, les nouvelles biotechnologies du XXIe siècle permettent de réaliser des modifications génétiques qui auraient pu arriver naturellement, compte tenu de la variabilité naturelle de tout organisme vivant, et qui sont en partie à la base de l’évolution darwinienne. Les utilisations en agronomie n’ont jamais suivi un processus de sélection naturelle, que cette sélection porte sur des espèces naturelles ou qu’elle soit associée à des modifications supplémentaires (par mutagenèse par exemple) ; l’homme ne fait là qu’accélérer le cours des choses. Il n’y a aucune raison, aucune fatalité, pour que les nouvelles biotechnologies aillent à l’encontre de la protection de l’environnement ou de la biodiversité. Bien au contraire, comme on le verra en partie IV du présent rapport, les outils fournis par les biotechnologies sont complémentaires de ceux fournis par l’agroécologie.
A. LES TECHNIQUES DE MODIFICATION CIBLÉE DU GÉNOME (GENOME EDITING) ONT RÉVOLUTIONNÉ LES BIOTECHNOLOGIES
La force des méthodes de modification ciblée du génome (genome editing) est de pouvoir couper l’ADN à un endroit très précis. On sait où couper grâce à la connaissance du génome complet, avec les techniques de séquençage. Par exemple, quand on connait la maladie que l’on veut soigner, on sait quel élément de base – le nucléotide – changer. Les méthodes précédentes étaient beaucoup plus rudimentaires, les mutations provoquées n’étaient pas très précises et on sélectionnait ensuite la mutation souhaitée, parmi un grand nombre d’occurrences.
1. Les précurseurs : trois catégories et quatre générations de techniques
Les techniques de modification ciblée des génomes sont classées en trois catégories par la Commission européenne :
– SDN1 (Site-Directed Nuclease 1) : inactivation d’un gène par coupure ciblée et réparation défectueuse (suppression ou insertion de quelques bases) ;
– SDN2 (Site-Directed Nuclease 2) : modification ciblée de quelques nucléotides dans un gène donné (gene editing) ;
– SDN3 (Site-Directed Nuclease 3) : insertion ciblée d’un ADN étranger à un site donné (landing pad).
Comme l’explique le rapport du comité scientifique du Haut Conseil des biotechnologies (HCB) (11), « le ciblage peut être obtenu par le biais de nucléases dirigées vers une séquence choisie de l’ADN. […] L’utilisation de ce ciblage peut être adaptée à trois objectifs différents :
– SDN1 : un objectif de mutation (insertion ou suppression) ponctuelle ou concernant un petit nombre de nucléotides, voire quelques dizaines, de nature aléatoire tout en étant ciblée vers un site particulier du génome, dit SDN1 ;
– SDN2 : un objectif de conversion allélique, consistant à modifier la séquence d’un gène donne sur toute ou partie de sa séquence, dit SDN2 ;
– SDN3 : un objectif d’intégration ciblée d’une séquence d’ADN, dit SDN3. »
Des quatre outils dont on dispose actuellement, qui permettent de faire ces modifications ciblées du génome (SND1, SDN2 et SDN3), l’un n’est plus utilisé, les méganucléases, il constitue la première génération d’outils, et trois le sont encore : nucléases à doigts de zinc (zinc finger), TALEN (Transcription Activator-Like Effector Nucleases) et, le plus récent, CRISPR-Cas9 (Clustered Regularly Interspaced Short Palindromic Repeats – CRISPR associated protein 9).
– Les nucléases à doigts de zinc
Cette seconde génération d’outils appelée nucléase à doigts de zinc (zinc finger), consiste à fabriquer une protéine avec ces acides aminés particuliers qui vont reconnaître une séquence particulière. Cette technique est complexe car toutes les espèces vivantes, les hommes, les poissons, les bactéries, les virus, les levures, les plantes… disposent de protéines avec des zinc finger. Les chercheurs ont pris toutes les séquences connues de zinc finger. Ils ont ensuite créé un logiciel qui, lorsqu’on cherche à cibler une séquence, dit s’il existe un zinc finger qui la reconnait. On connait des milliers de zinc finger et de séquences, mais si la séquence n’est pas reconnue par un zinc finger, elle ne peut pas être fabriquée. C’est la limite de cet outil qui a été notamment utilisé dans un essai contre le sida.
La troisième génération, vient d’une bactérie, elle est dénommée TALE nucléases ou TALEN (Transcription Activator-Like Effector Nucleases). Inventée par des équipes américaine et allemande, la technologie a été rachetée et brevetée par l’entreprise française Cellectis. Ce sont des protéines d’une bactérie du genre Xanthomomas, infectant notamment le riz. Elles produisent une protéine qui pénètre dans le noyau des cellules infectées et modifient l’expression d’une partie du génome du riz, pour inactiver les gènes de défense contre la bactérie, afin de le rendre moins sensible à un agent pathogène. Ces protéines sont faciles d’usage parce qu’elles ont des domaines avec seulement deux acides aminés qui peuvent être changés. Chaque duo d’acides aminés reconnait les bases de l’ADN C, A, T et G. Une nucléase peut être fabriquée pour n’importe quelle séquence. C’est très pratique et ça fonctionne très bien mais c’est long et compliqué, car il faut tester plusieurs nucléases pour être sûr que cela fonctionne et fabriquer une protéine pour chacune des séquences que l’on souhaite cibler.
Quelques entreprises se sont spécialisées dans cette ingénierie. Les TALEN sont des protéines qui ont deux parties importantes, la nucléase (ciseaux) et une autre partie qui lit l’ADN sur une séquence précise qu’on veut cibler (gène de l’insuline par exemple).
Ces trois générations de techniques basées sur l’utilisation de protéines permettent de manipuler des cellules, des organismes vivants en ciblant un organe, voire des cellules germinales ou des embryons, pour transmettre la mutation aux générations suivantes. Elles ont apporté beaucoup d’espoirs dans la manipulation du génome, mais elles sont restées très lourdes à mettre en œuvre, car faire de l’ingénierie des protéines est compliqué. À chaque fois qu’on cible une protéine, on doit fabriquer une nouvelle partie protéique. Ce sont des techniques longues et chères.
La quatrième génération d’outils de modification ciblée du génome, dénommée CRISPR-Cas9, est décrite ci-dessous.
2. CRISPR-Cas9 : un couteau suisse, une révolution dans la biologie, une épopée avec ses héros et ses guerres
Cela a été dit, le fonctionnement complet du système CRISPR-Cas9 (Clustered Regularly Interspaced Short Palindromic Repeats – CRISPR associated protein 9) a été décrit pour la première fois dans un article de juin 2012 de la revue américaine Science rédigé par deux chercheuses (12), l’une française, Emmanuelle Charpentier, actuellement directrice de l’Institut Max Planck de biologie infectieuse à Berlin (Allemagne), l’autre américaine, Jennifer Doudna, professeure de chimie et de biologie moléculaire et cellulaire à l’université de Californie-Berkeley. La primauté de l’invention est actuellement disputée par Feng Zhang, professeur d’ingénierie biomédicale au Broad Institute, commun au Massachusetts Institute of Technology (MIT) et à l’université d’Harvard de Boston ainsi que, à moindre titre, par George Church, généticien, ingénieur moléculaire et chimiste, également professeur au MIT et à Harvard, mais dans une autre équipe. Il s’en est suivi une bataille acharnée pour la propriété intellectuelle (brevets) et la levée de fonds… avec en toile de fond la forte espérance d’obtention du prix Nobel, ce qui semble logique au vu des découvertes et des récompenses obtenues depuis le prix Nobel de Watson et Crick pour la découverte de la double hélice de l’ADN (13).
PRINCIPES DE FONCTIONNEMENT DE CRISPR-CAS9
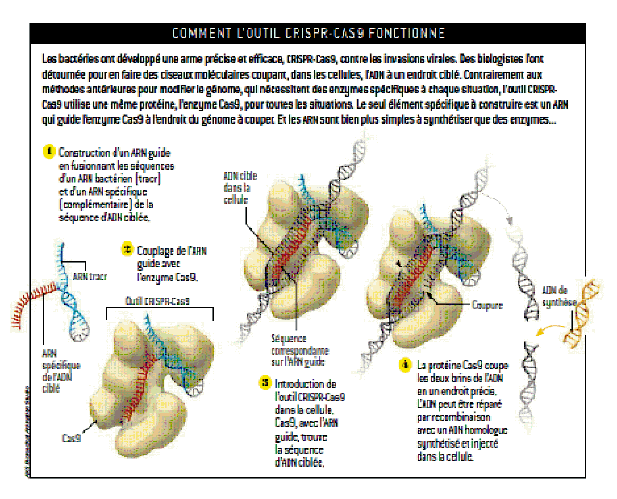
Source : Pour la Science n° 456, page 29, octobre 2015.
Dans cette histoire, il faut noter que la découverte de CRISPR-Cas9 est le fruit de la recherche fondamentale, et non d’une recherche appliquée. C’est, à l’origine, un pur objet de recherche, qui n’est qu’ensuite devenu une évolution technologique. Elle démarre d’Espagne et de l’Institut Pasteur de Paris, pour continuer à Berkeley et à Harvard. Enfin on découvre les stratégies incertaines de grandes firmes comme DuPont, qui ont eu la primeur des découvertes dans leurs laboratoires, mais n’en ont pas saisi l’importance à l’époque.
CRISPR-Cas9 s’est de fait façonné au fur et à mesure des recherches scientifiques depuis désormais trente ans. Cette épopée, qui découle d’un mélange entre la curiosité scientifique pour comprendre un processus biologique, des exigences militaires et une application industrielle, constitue un véritable puzzle où chaque équipe de recherche a participé à son élaboration. La course effrénée des publications et la bataille des brevets qui ont suivi démontrent tous les enjeux autour de cet outil qui, au départ, n’avait pas vocation à modifier le génome d’organismes vivants, encore moins à changer l’homme. Alors que la recherche se veut précurseur, CRISPR-Cas9 bouleverse la société en imposant un autre tempo. Des fondements de cet outil à l’avènement de ce dernier, la temporalité est bouleversée, entrainant une véritable révolution dans le monde scientifique et industriel.
L’histoire de CRISPR-Cas9 se conte en trois phases : la phase initiale d’établissement des fonctions biologiques, avec notamment l’équipe de Philippe Horvath (14) au sein de l’entreprise Danisco (groupe DuPont) ; ensuite, le passage de la science en technologie, avec les recherches universitaires de Jennifer Doudna et Emmanuelle Charpentier ; puis la troisième étape concerne l’utilisation de cette technologie, notamment sur l’être humain, avec les universitaires Feng Zhang, du Broad Institute à Boston et George Church à Harvard et au MIT. Maintes fois décrit, le narratif de cette histoire est maintenant bien établi, on peut se reporter, par exemple, à l’excellente série de six articles intitulés « La saga CRISPR-Cas9 » parus dans le journal Le Monde de juillet et août 2016 (15), ou encore à l’article, plus ardu, intitulé « The Heroes of CRISPR » publié par Eric Lander, également du Broad Institute, dans la revue Cell de janvier 2016 (16).
• Phase 1 : les fondements de l’outil CRISPR : né au Japon en 1987, baptisé en Espagne en 2002
La première observation remonte à 1987, sur la bactérie Escherichia coli (E.Coli), et a été publiée par des Japonais. Cependant le nom CRISPR est apparu en 2002 dans l’étude de Jansen et al., des Néerlandais qui travaillaient avec Francis Mojica (17) en Espagne. C’est l’année du baptême. C’était l’apogée du séquençage du génome bactérien et des archées (18), qui avait commencé dans les années 1990 et qui a connu de grandes avancées dans les années 2000. Au fur et à mesure du progrès de ce séquençage, ces chercheurs ont remarqué l’occurrence et la diversité des « loci » (19) de CRISPR dans le génome des archées et des bactéries. Ce n’est qu’en 2005 que la fonctionnalité des CRISPR fut comprise. Un CRISPR est un peu comme une main, avec des doigts et entre ceux-ci, des espaceurs (spacer), jusqu’à six cents de suite. En 2005, l’observation faite sur les espaceurs démontrait des homologies de séquences avec les ADN viro-bactériens, donc les phages qui attaquent les bactéries et les plasmides. Plusieurs équipes différentes travaillaient sur le sujet en observant des différentes bactéries. Alexandre Bolotin (20) à l’INRA, travaillait avec des bactéries lactiques, et Francis Mojica, précité, à Alicante, sur les archées, Christine Pourcel (21) et Gilles Vergnaud (22) à l’Université Paris-Sud (Orsay) faisaient la même découverte en étudiant les bactéries pathogènes dont Mycobacterium Tuberculosis et Yersinia pestis (responsable de la peste), tout cela en six mois environ. Gilles Vergnaud et Christine Pourcel avaient reçu commande du ministère français de la défense pour le classement des bactéries, c’était après le 11-septembre et les envois d’anthrax, dans la perspective d’une guerre biologique.
Six autres mois plus tard, en 2006, Eugene Koonin aux National Institutes of Health (NIH – Instituts nationaux de la santé aux États-Unis), démontre que CRISPR est l’équivalent de l’ARN-I chez les procaryotes, il émet alors l’hypothèse que CRISPR serait un système de défense immunitaire. En 2007, cette fois au sein d’une entreprise, Danisco (groupe DuPont), qui produit des yaourts et qui cherche à lutter contre les contaminations bactériennes, Philippe Horvath et Rodolphe Barrangou ont démontré que le rôle biologique naturel des systèmes CRISPR est de promouvoir l’immunité adaptative chez les bactéries. Ils ont montré que, quand les bactéries se vaccinent contre les bactériophages, elles acquièrent des nouveaux espaceurs issus du nouveau génome viral. Quand sont rajoutés des espaceurs, la bactérie est en quelque sorte « vaccinée » ; quand ils sont enlevés, elle n’est plus protégée. Et quand les espaceurs sont transplantés, la sensibilité aux phages des bactéries est échangée. Le rôle des gènes qui codent la protéine « Cas » dans la vaccination des bactéries a aussi été démontré.
• Phase 2 : l’avènement de CRISPR-Cas9 comme outil de modification ciblée du génome (genome editing)
Le premier brevet a été déposé aux États-Unis par l’entreprise américaine DuPont le 26 août 2005, quand les autres chercheurs publiaient. Le brevet a été converti en août 2006, puis DuPont autorisa la publication dans la revue scientifique Science, en février ou mars 2007. Un an plus tard la présence du PAM (proto-spacer adjacent motif), un motif qui permet à Cas9 de reconnaître l’ADN ciblé, a été démontrée. En 2009, Rodolphe Barrangou et Philippe Horvarth ont montré que le système pouvait être transféré dans une autre bactérie. En 2010 ils ont montré que Cas9 pouvait couper l’ADN viral et l’ADN plasmidique, puis, en 2011, la possibilité de reprogrammer le système immunitaire, sur la bactérie E. Coli. Mais le groupe DuPont ne saisit pas l’importance potentielle de ces découvertes, n’investit pas suffisamment dans ces recherches et… se fait doubler. Cette même année, Emmanuelle Charpentier qui travaillait sur l’ARN microbien avec Jörg Vogel et non sur CRISPR, rencontre Jennifer Doudna. En 2012, la scission d’ADN fut découverte à peu près en même temps par leur équipe et celle de Rodolphe Barrangou et Philippe Horvarth. Les deux chercheures ont montré que cela pouvait s’appliquer à l’être humain, pour réécrire une séquence d’ADN et la réparer. Un article de Jennifer Doudna et Emmanuelle Charpentier fut accepté le 8 juin 2012 par la revue Science et publié en ligne le 28 juin 2012. Par ailleurs, le chercheur lituanien, Virginijus Siksnys, propose sur le même sujet un article à la revue scientifique Cell le 6 avril 2012, celui-ci est refusé ; l’article est finalement accepté dans Proceedings the National Academy of Sciences le 21 mai 2012… mais publié le 4 septembre 2012.
• Phase 3 : les applications de CRISPR-Cas9
Le 5 octobre 2012, Feng Zhang dépose un article sur la modification ciblée du génome sur les mammifères dans Science, qui fut publié le 3 janvier 2013. Le 26 octobre 2012, George Church, le brillant et haut en couleur professeur des universités de Harvard et MIT, doté d’une vaste expertise en génomique et biologie de synthèse, qui a collaboré avec Feng Zhang, soumet un article sur la modification ciblée du génome (genome editing) avec CIRPSR-Cas9 chez les êtres humains, mais ouvrant aussi la voie au forçage génétique (gene drive) chez les insectes porteurs de maladies et à la production d’organes humains par des cochons. Il sera également publié par Science au début de l’année 2013.
Depuis, c’est l’explosion du nombre d’articles sur toutes les applications possibles de CRISPR dans les plantes, les animaux, les êtres humains... Toutes ces publications donnent à l’invention un impact global qui permet la diffusion de la technologie au niveau scientifique, mais aussi médiatique, puisqu’elle a fait l’objet de beaucoup d’articles dans la presse scientifique, économique et généraliste.
Avec l’arrivée de CRISPR, de nombreuses sociétés à but lucratif se sont créées. À la suite de la société américaine Sangamo BioSciences, qui en 2005 reconnait avoir fait une correction d’un gène mutant avec succès, ces découvertes suscitent à partir des années 2010 de nouvelles entreprises. C’est un raz-de-marée, et l’on a rarement assisté à un passage aussi rapide de la science à ses applications. De l’entreprise Caribou Biosciences, fondée par Jennifer Doudna en 2013, au trio des entreprises installées à Boston et travaillant sur CRISPR, CRISPR Therapeutices, fondée par Emmanuelle Charpentier, Editas Medicine, où l’on retrouve Feng Zhang, et Intellia Therapeutics, ou encore Precision Biosciences, les enjeux économiques pour la levée de fonds et juridiques concernant la propriété intellectuelle sont de taille. Il faudrait aussi mentionner Juno Therapeutics, Poseida Therapeutics, ainsi que les investissements de Novartis, Monsanto-Bayer – qui met deux fers au feu chez CRISPR Therapeutics et Editas Medicine –, Servier ou encore Pfizer… Des entreprises continuent cependant à travailler avec des méganucléases antérieures à CRISPR-Cas9, ainsi Cellectis, la société française qui a misé sur les brevets TALEN, et Sangamo avec les doigts de zinc. L’impact industriel est considérable. Cette technologie concerne autant les entreprises cotées en bourse que celles du second marché ou les toutes petites PME.
Comme l’évoque M. Rodolphe Barrangou, il est très rare qu’une technologie naissante ait un impact sur plusieurs industries en même temps. CRISPR-Cas9 intéresse les industries alimentaire, pharmaceutique, environnementale et biotechnologique, mais peut aussi servir pour des applications non thérapeutiques, avec l’entreprise Locus Biosciences.
3. Une évolution qui conduit à une révolution CRISPR : souvenir… souvenir
CRISPR-Cas9 est une dénomination un peu barbare qui regroupe le nom d’une grosse protéine, Cas9, et un acronyme un peu abscons CRISPR (Clustered Regularly Interspaced Short Palindromic Repeats), que l’on pourrait traduire par « courtes séquences palindromiques répétées, groupées et régulièrement espacées ». Comme cela a été dit, les séquences CRISPR sont connues depuis longtemps, mais leur rôle en tant que mécanisme d’immunisation des bactéries contre les phages, leur virus, n’a été compris que récemment. La bactérie apprend naturellement à reconnaitre des génomes de virus en captant un petit morceau de génome et en le mettant dans son propre chromosome. C’est un couteau suisse, car elle a plusieurs « séquences à son arc ». Si un virus ayant le même génome revient, la bactérie fabrique une protéine (Cas9) et un petit ARN guide la protéine vers le génome du phage et le ciseau moléculaire de Cas9 coupe le génome de celui-ci en morceaux. Face à l’intrusion d’un phage, une bactérie non seulement découpe son ADN, ce qui le détruit, mais encore recopie la séquence découpée dans son propre ADN, pour en garder le souvenir lors d’une prochaine agression.
Les inventeurs de CRISPR-Cas9 ont utilisé un système existant dans la nature pour faire de l’ingénierie de génome. L’association de la protéine Cas9, qui joue le rôle de ciseaux, et d’une petite séquence d’ARN, qui indique l’endroit exact où intervenir, permet de recréer un mécanisme qui se ressemble à la fonction « couper-coller » d’un logiciel de traitement de texte. Il devient ainsi très simple de modifier l’ADN d’un organisme vivant, de façon ciblée gène par gène.
La modification ciblée du génome est connue depuis le début des années 2000. CRISPR-Cas9, qui n’est que la quatrième génération, ne pose pas de problèmes nouveaux mais CRISPR-Cas9 représente une véritable rupture et constitue une découverte majeure, de par son efficacité, son universalité sur tous les types d’organismes vivants, sa facilité d’usage, sa rapidité de mise en œuvre et son coût modéré. On n’a besoin d’aucune connaissance en ingénierie des protéines. Ce qu’on faisait en deux ans ne nécessite plus désormais que quelques semaines. On trouve sur internet des kits prêts-à-monter (« do it yourself ») CRISPR-Cas9 pour quelques dizaines d’euros. On peut également y acheter des briques de guides ARN. La rapidité des modifications, l’accélération des mutations, constituent une révolution. Les publications foisonnent et augmentent de manière exponentielle. Les applications se multiplient en biotechnologies rouges (médecine), vertes (agriculture) et blanches (environnement, industrie).
L’échelle de temps change. La science progresse plus vite qu’il y a 30 ans. Les doigts de zinc ont été décrits en 1996, le premier essai chez l’animal a été effectué en 2003 et chez l’homme en 2009. Avec les TALE nucléases découvertes en 2010, les premiers essais chez le rat et les cellules humaines ont démarré deux ans après. Avec CRISPR-Cas9, découvert en 2012, les premiers essais sur les poissons zèbres et les cellules humaines ont eu lieu un an après, et depuis les essais se sont multipliés partout.
Le système CRISPR-Cas9 n’a qu’une seule protéine (Cas9), dispensant de faire une ingénierie de protéine. La seule chose que l’on doit fabriquer est un ARN guide. Des robots font très facilement la synthèse d’ARN. L’ARN guide est reconnu par la protéine Cas9 et il scanne le génome à modifier. Dès que l’ARN guide s’apparie avec le génome, les nucléases de la Cas9 coupent le génome à l’endroit souhaité. Une seule protéine et de l’ARN suffisent.
Entre 10 % et 80 % des bactéries et archées, qui sont une autre classe du vivant microbien, ont une enzyme endonucléase dénommée Cas9, qui joue le rôle de ciseaux. La grande nouveauté est qu’elle est guidée vers l’ADN cible, non pas par une partie protéique, mais par un petit ARN. Le couple ou la cassette CRISPR-Cas9 amène Cas9 à l’endroit désiré. Cette technologie très facile à mettre en œuvre, très puissante et pas chère, est maintenant en pleine explosion. Elle fonctionne sur tous les organismes vivants, ce qui n’était pas gagné d’avance : levures, plantes, poissons, amphibiens, mammifères, y compris chez l’homme. On peut introduire plusieurs mutations à la fois. Elle se prépare en à peine deux semaines.
CRISPR-Cas9 permet d’enlever ou de modifier un gène (mutation ou correction d’une mutation). Elle peut enlever plusieurs gènes en même temps. Cas9 couplé à une autre enzyme pourra provoquer l’expression d’un gène, éteindre un gène trop exprimé ou modifier l’épigénome de la région (au sens biologique : changement de l’environnement du gène, de son architecture tridimensionnelle), de telle sorte que son expression sera également changée. On pourra aussi faire de l’imagerie en fixant un fluorophore à Cas9. On pourra aussi contrôler dans le temps le moment où on souhaite que cette nucléase agisse ; on peut artificiellement couper la nucléase en deux, l’introduire à l’endroit indiqué dans les cellules, puis recoller les deux morceaux pour la réactiver au moment voulu.
Avant CRISPR-Cas9, pour modifier les gènes d’un organisme, par exemple une souris, il fallait dix-huit mois : il fallait prendre des cellules souches embryonnaires, faire de la recombinaison homologue, sélectionner les rares cellules où la recombinaison avait fonctionné, les réintroduire dans les embryons, remettre les embryons dans la souris, obtenir les souriceaux, sélectionner les embryons qui ont intégré la modification dans leur lignée germinale et faire deux nouvelles générations.
CRISPR-Cas9 est une révolution car il a simplifié ce dispositif universel. Il suffit de prendre une cellule de l’embryon, d’injecter la protéine Cas9 avec son ARN et de réimplanter. Aucun acide nucléique n’a été introduit, seule une protéine qui disparaitra par la suite a été introduite. Cette protéine va modifier le génome de l’embryon et permettra d’obtenir la descendance souhaitée.
CRISPR-Cas9 est encore en développement, la technique s’améliore mois après mois. Le coût d’une intervention par méganucléase coûtait de l’ordre de 50 000 euros, par méganucléases doigts de zinc 5 000 euros, par TALEN 1 000 euros, et par CRISPR-Cas9 seulement 10 euros…
Une autre caractéristique des interventions faites avec la technologie CRISPR-Cas9 est qu’elles sont peu ou pas traçables du tout. Le point est encore discuté parmi les scientifiques. Comme l’écrivait la revue Nature dans son numéro du 4 juin 2015 : « il sera difficile de détecter si quelque chose a été muté conventionnellement ou construit génétiquement » (23), ce qui fait que les détracteurs systématiques des biotechnologies les appellent déjà des « OGM cachés ».
On ne peut identifier la méthode d’obtention du produit avec les techniques SDN1 et SDN2, ni d’ailleurs avec la technique ODM (24). Ainsi par exemple, on ne pourra détecter dans la filière de transformation, dans les silos, si telle graine est obtenue par SDN1 ou par mutagenèse. Pour les techniques SDN2, ce n’est pas traçable sauf si, pour des raisons de brevets, le semencier a voulu étiqueter son invention.
Normalement, avec les techniques SDN3, on peut identifier les mutations ainsi obtenues quand il y a un apport d’ADN extérieur. Mais c’est souvent très difficile, ainsi avec la duplication dans le cadre de la cisgenèse ; il est alors difficile de dire si la mutation est le résultat de la sélection ou de la mutation SDN3.
Comme l’ont montré les prix Nobel 2015 Thomas Lindahl, Paul Modrich et Aziz Sancar, les cellules passent leur temps à réparer l’ADN, cassé en permanence. L’évolution n’aurait pas existé si les espèces avaient été créées sans les mécanismes de réparation de l’ADN. Nos cellules fonctionnent avec de l’oxygène, donc il y a des multiples coupures d’ADN. Les organismes ont des systèmes de réparation très puissants, pour éviter que ces cassures ne se terminent en lésions et en cancers.
Dans tous les cas où l’utilisation du système CRISPR-Cas9 aura eu lieu dans une cellule germinale, l’organisme modifié dérivant de cette cellule aura les mêmes traces éventuelles dans toutes ses cellules. Mais il pourrait aussi n’y avoir aucune trace « indel », ce qui signifie une insertion ou une suppression (deletion), s’il n’y a pas eu d’effets hors cibles et si la modification ne visait pas à introduire une « indel ». Des traces éventuelles seront différentes d’une cellule à l’autre (mosaïcisme) si l’utilisation de CRISPR-Cas9 a permis son activité au-delà du stade 1 cellule de l’embryon.
Les générations précédentes de modification ciblée du génome, notamment les doigts de zinc et les TALEN, continuent cependant à être utilisées. M. André Choulika, PDG de l’entreprise Cellectis, la seule entreprise française d’importance sur ces technologies, estime que la technologie TALEN, dont il détient les brevets et qu’il utilise sur plusieurs applications médicales et agricoles, n’est pas inférieure à CRISPR-Cas9 sur plusieurs points. CRISPR-Cas9 est encore essentiellement utilisé dans le monde de la recherche, car il met la modification ciblée du génome à la portée de tous les laboratoires. Le passage à la production (phase clinique pour les applications médicales, mise en culture pour les nouvelles variétés végétales) nécessite les mêmes compétences qu’avant, et surtout les mêmes temps d’évaluation réglementaires.
Comme le montre le graphique ci-dessous, obtenir une TALEN « précise » peut être plus aisé qu’avec le système CRISPR-Cas9, elle permet d’intervenir sur 6 paires de base, alors que CRISPR-Cas9 nécessite un ARN de 70 paires de bases, avec une région de reconnaissance de 20. La raison en est que CRISPR-Cas9 a des contraintes, des séquences de lettres à conserver, alors que TALEN n’en a pas. Certes avec TALEN il faut à chaque fois construire une protéine spécifique, mais ces molécules sont très plastiques et sont modelables ad libidum. En outre, selon la société Cellectis, la puissance de coupure de TALEN est proche de 80 %, performance qui n’est pas encore atteinte avec CRISPR-Cas9. D’autres chercheurs contestent ces chiffres en indiquant que l’efficacité des deux techniques est très variable selon les séquences cibles considérées. Les protéines TALEN existantes ont sans doute de beaux jours industriels à venir, mais ces constructions seront très vraisemblablement remplacées par les produits de type CRISPR-Cas9 ou par de nouvelles générations de ciseaux moléculaires.
PRÉCISION DE LA MODIFICATION CIBLÉE DU GÉNOME
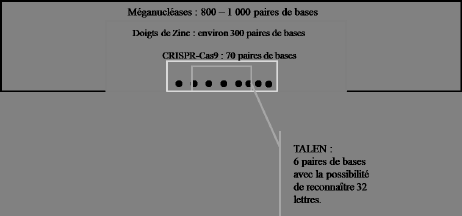
Source : Cellectis.
Le tableau ci-dessous, tel qu’ont pu le reconstituer les rapporteurs, montre que la technologie CRISPR-Cas9 est encore loin de détenir le monopole dans les laboratoires.
UTILISATION DES DIFFÉRENTES TECHNIQUES
DE MODIFICATION CIBLÉE DU GÉNOME
|
Kite Amgen UC Los Angeles |
Juno Editas |
Bluebird Bio Celgen |
Intrexon Ziopharm |
Novartis Intellia |
Sangamo |
Modification ciblée du génome |
Recombinaison homologue |
CRISPR |
MegaTAL |
Doigt de zinc ? |
CRISPR |
Doigt de zinc |
Phase clinique |
|
|
|
|
|
Phase II |
Pays |
États-Unis |
États-Unis |
États-Unis |
États-Unis |
Suisse |
États-Unis |
|
CRISPR Therapeutics |
Johnson & Johnson Poseida Therapeutics |
Precision Bio |
Regeneron Adicet Bio |
Cellectis Pfizer Servier |
Modification ciblée du génome |
CRISPR |
TALEN ? |
Mega ARCUS |
CRISPR |
TALEN MegaTAL Meganucléase |
Phase clinique |
|
|
|
|
|
Pays |
Suisse |
États-Unis |
États-Unis |
États-Unis |
France / États-Unis |
Source : OPECST.
La séquence chronologique présentée dans le graphique ci-dessous montre clairement que la modification ciblée du génome est encore majoritairement positionnée sur la technologie TALEN.
CHRONOLOGIE DES PREMIÈRES APPLICATIONS
DE MODIFICATION CIBLÉE DU GÉNOME
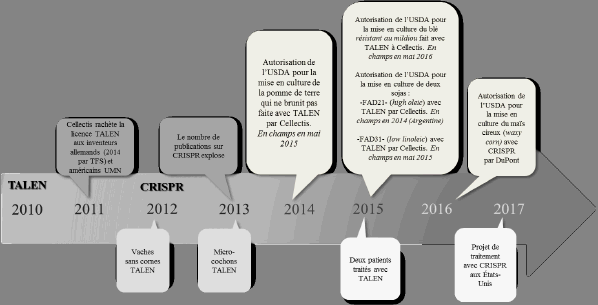
Source : OPECST.
Plus de dix patients ont déjà été traités et soignés avec une cellule modifiée par TALEN depuis 2015. La technologie CRISPR-Cas9 s’améliorera très certainement. Les premiers traitements de patients avec CRISPR sont attendus en 2017. Ils porteront peut-être sur l’amaurose congénitale de Leber, qui est une maladie génétique grave de la rétine, qui évolue vers la cécité (25), ou sur un lymphocyte modifié pour le récepteur PD1 (programmed cell death 1) dans l’immunothérapie des cancers.
Les chercheurs entendus par les rapporteurs confirment la continuité des différentes méthodes de modification ciblée du génome, tout en pointant rupture technologique constituée par la dernière génération d’outils, CRISPR-Cas9.
Pour Mme Jennifer Doudna, professeur à l’université de Californie-Berkeley, la technologie CRISPR-Cas9 est une révolution en ce qu’elle rend plus facile, plus rapide et moins coûteuse les modifications de l’ADN cellulaire, en particulier les changements précis du génome humain. Les technologies antérieures permettaient certes d’apporter des modifications à l’ADN, mais elles étaient plus difficiles, prenaient plus de temps et étaient plus couteuses.
Pour M. Rodolphe Barrangou, professeur associé, université de Caroline du Nord, les technologies de modification du génome de première génération ont un avenir industriel à court terme, car au niveau de la propriété intellectuelle, une liberté opératoire commerciale est permise. L’entreprise Cellectis a perdu la bataille des brevets avec d’autres entreprises américaines telles que Precision Biosciences. L’avantage des protéines doigts de zinc, des TALEN et des méganucléases, réside sur la commercialisation à court terme, jusqu’à 2018 voire 2019. Sur le long terme, au niveau financier, technologique et scientifique, la technologie CRISPR est supérieure.
M. George Church, professeur au département de génétique à la Harvard Medical School, relativise et ne pense pas que CRISPR-Cas9 soit si spécial, bien que son laboratoire ait joué un rôle important dans sa découverte. C’est, dit-il, « une des neuf façons possibles de faire de la modification du génome ». C’est l’une des différentes méthodes qu’il utilise, mais trois autres méthodes de modification ciblée du génome sont aussi bonnes. Dans son laboratoire, il a réussi à effectuer 62 modifications simultanées d’une cellule.
Les banques de données ouvertes facilitent l’utilisation de CRISPR-Cas9.
Ainsi, aux États-Unis, Addgene, association sans but lucratif, s’est fixée comme objet le dépôt et la mise à disposition de plasmides (molécule d’ADN destinée à la recherche). Le coût d’une livraison est de 85 dollars. Chaque mois, Addgene distribue 11 000 plasmides de par le monde. L’association a en catalogue près de 45 000 articles provenant de 2 800 laboratoires. Depuis l’arrivée de CRISPR-Cas9, 126 chercheurs ont déposé des plasmides avec cette technologie. Pour Mme Joanne Kamens, directrice générale d’Addgene, CRISPR-Cas9 est un outil différent des précédents. Les demandes pour CRISPR n’ont cessé d’augmenter, alors que les autres technologies, comme TALEN et les doigts de zinc, ont désintéressé les chercheurs, ainsi la distribution s’est faite de manière différente. CRISPR-Cas9 est maintenant beaucoup plus utilisé que les autres technologies.
B. LES AUTRES NOUVELLES BIOTECHNOLOGIES
La Commission européenne a, dès 2007, dressé une liste des nouvelles biotechnologies.
1. La liste établie par la Commission européenne
La liste de la Commission européenne contient les techniques suivantes : modification ciblée du génome (genome editing), mutagenèse dirigée par oligonucléotides (ODM), modulation de l’expression des gènes par RdDM, agro-infiltration, greffe végétale, cisgenèse/intragenèse, ségrégants négatifs, génomique synthétique.
Le comité scientifique du Haut Conseil des biotechnologies (HCB) a, dans un avis rendu le 16 janvier 2016, défini ces nouvelles biotechnologies (26) (27).
Nouvelles techniques de modification ciblée du génome :
– Nucléases dirigées (SDN (28), ZFN (29), MN (30), TALEN (31), CRISPR (32)/Cas). « Par rapport à la transgenèse "classique", le ciblage moléculaire des modifications génétiques dans le génome est le progrès le plus significatif apporté par certaines des nouvelles techniques. »
– Mutagenèse dirigée par oligonucléotides (ODM (33), RTDS (34)...). « Cette technique vise à l’introduction de mutations ponctuelles ciblées. Elle s’appuie sur l’utilisation d’une courte séquence d’acide nucléique quasi-identique à la séquence ciblée mais possédant la mutation recherchée. L’acide nucléique est introduit dans la cellule de l’hôte ou, selon un mode mal connu, les mécanismes de réparation physiologiques de la cellule pourraient favoriser la substitution de la séquence du génome par celle de l’oligonucléotide. Les oligonucléotides ne s’intègrent pas dans le génome, leur présence n’est donc que transitoire. »
Techniques exploitant les mécanismes épigénétiques :
– Modulation de l’expression des gènes par RdDM (35). « Certains ARN cellulaires agissent par un mécanisme appelé l’interférence induite par les ARN. Ce mécanisme physiologique initialement découvert chez un nématode modèle (petit ver retrouvé dans le sol) et chez les plantes, a été identifié dans la majorité des règnes, y compris les mammifères.
« L’interférence ARN est un phénomène par lequel une molécule d’ARN, généralement de petite taille, établit une liaison avec une autre molécule d’acide nucléique ou un complexe de protéines et d’acides nucléiques (ADN ou ARN) afin d’en modifier l’activité, le plus souvent par inhibition. Ces mécanismes sont naturels et ont une fonction de régulation cellulaire.
« La RdDM (RNA-dependent DNA Methylation) est le mécanisme cellulaire qui utilise de petits ARN interférents (siRNA) pour modifier l’expression de gènes par méthylation d’une séquence spécifique d’ADN, sans modifier sa séquence nucléotidique. C’est ce que l’on appelle un changement dit épigénétique. La technique de la RdDM, qui utilise ce mécanisme naturel, permet en particulier d’éteindre l’expression d’un gène spécifique. L’extinction du gène obtenue par méthylation peut être transmise à la descendance sur plusieurs générations, elle finit le plus souvent par être perdue. »
Prise en considération d’éléments annexes à l’utilisation de techniques de modification génétique quelles qu’elles soient :
– « Contextes particuliers d’utilisation de techniques de modification génétique : agro-infiltration. […] Agrobacterium tumefaciens est une bactérie classiquement utilisée en biotechnologies comme vecteur de transfert de matériel génétique dans le génome d’une plante. La bactérie est génétiquement modifiée (recombinante) afin de porter le gène d’intérêt, puis est mise en contact avec des cellules de plante dans lesquelles elle transfère le gène (transgène). Il est ensuite possible d’obtenir une plante génétiquement modifiée à partir de ces cellules.
« Cette bactérie peut aussi être utilisée avec un autre objectif : l’agro-infiltration. Dans ce cas, les bactéries recombinantes sont mises en contact, selon divers procédés, avec les cellules de tissus d’une plante (généralement les feuilles). En infectant ces tissus et en se multipliant, les bactéries font exprimer transitoirement au tissu végétal le ou les gènes d’intérêts. En pratique, cette technique est utilisée dans un objectif de production de protéines ou de molécules d’intérêt. Celles-ci sont le plus souvent purifiées après récolte et broyage des tissus de la plante. Cette technique permet aussi l’étude de la fonction de gènes inconnus. »
– « Contextes particuliers d’utilisation de techniques de modification génétique : greffe d’un scion (36) non-GM sur un porte-greffe GM ou d’un scion GM sur un porte-greffe non-GM. […] La greffe est utilisée couramment en arboriculture et horticulture. C’est une technique permettant de combiner les caractéristiques intéressantes de deux espèces distinctes ou de deux variétés d’une même espèce. Il s’agit souvent d’améliorer des caractéristiques agronomiques (résistance à des maladies, tolérance à des stress biotiques ou abiotiques, amélioration de la vigueur de la plante, de sa productivité, de son adaptation à des conditions pédoclimatiques, accélération de la mise a fruit…).
« La plante obtenue est la résultante d’un porte-greffe implanté dans le sol et d’un greffon (partie aérienne produisant tiges, feuilles, fleurs et fruits/graines). Au niveau de la greffe, des tissus vasculaires permettent les échanges entre greffon et porte-greffe. »
– « Nouveaux concepts associés à la nature de la séquence modifiée : cisgenèse/intragenèse. […] La cisgenèse correspond à un transfert de gène intact (sans modification) au sein d’une même espèce, ou entre espèces sexuellement compatibles (qui pourraient échanger des gènes par fécondation). Le gène transféré est non modifié fonctionnellement, même s’il peut contenir des variations de séquences (mutations ponctuelles) dans sa séquence codante, son promoteur, ses introns et son terminateur de transcription. »
La cisgenèse est d’ailleurs une méthode qui peut contourner la transgenèse dans la mesure où il y a une grande variabilité de gènes dans une même espèce. Il suffit donc de rechercher un gène d’intérêt dans une espèce pour le trouver.
« L’intragenèse correspond au transfert de séquences au sein d’une même espèce ou entre espèces sexuellement compatibles. Cependant les séquences transférées peuvent être réarrangées ou comporter différents éléments génétiques de la même plante. Elles peuvent correspondre à des séquences de gènes complètes ou partielles, ou à des éléments isolés de différents gènes d’espèces sexuellement compatibles. Par exemple, un gène peut être régulé par un promoteur et/ou un terminateur d’un autre gène de la même espèce ou d’une espèce sexuellement compatible. L’orientation de la séquence codante du gène peut être la même que celle de l’organisme donneur ou être inversée (permettant de cette façon l’expression ou l’extinction d’un gène). »
– « Considération de la descendance d’individus modifiés desquels l’outil moléculaire qui a permis la modification génétique a été éliminé par ségrégation : ségrégants négatifs, produits dans le cadre de stratégies de sélection innovantes (par exemple : Reverse breeding, diverses méthodes d’accelerated breeding, Seed Production Technology...). […] Lors de la production des gamètes, le patrimoine génétique des organismes à reproduction sexuée est « brassé », les chromosomes parentaux échangent du matériel génétique, ce qui permet de produire des gamètes différents. De ce fait, lors du croisement mettant en œuvre un OGM, il est possible d’obtenir dans la génération suivante des « individus » ne possédant pas le transgène. Ces individus sont dits « ségrégant négatifs ». Cette caractéristique peut être mise à profit pour éliminer le transgène d’une plante, une fois que sa présence n’est plus requise pour le caractère recherché. Ceci permet donc d’obtenir des plantes non génétiquement modifiées, mais ayant le caractère recherché, à partir de plantes génétiquement modifiées. La technique repose sur la possibilité d’éliminer toute modification introduite par simple croisement suivi de sélections. »
Une fiche supplémentaire de l’avis du comité scientifique du HCB est dédiée à la transgenèse « classique ». « La transgenèse chez les végétaux résulte du transfert, de l’insertion stable et héritable de gène(s) dans le génome de cellules végétales. Elle a pour objectif, par exemple, l’expression de caractères nouveaux dans une plante, ou la suppression de l’expression de certains caractères de la plante. En général, la plante transgénique est obtenue par transfert du gène (ou des gènes) dans des cellules végétales, suivie de la régénération d’une plante entière et de la sélection des plantes transformées. Le critère de sélection est la conservation des caractéristiques initiales de la plante associée à l’expression du caractère attendu.
« Trois éléments sont nécessaires pour générer une plante transgénique : un ou plusieurs gènes à transférer ; un vecteur permettant d’introduire l’ADN à transférer dans la cellule végétale ; une cellule végétale capable d’être régénérée en plante entière. »
En complément, on peut rappeler la définition de la mutagenèse, avec l’aide de l’Encyclopædia Universalis. Cette technique ne modifie pas le mécanisme génétique naturel qui conduit à l’apparition des mutations. Elle s’appuie sur le mécanisme naturel de réparation de l’ADN dont elle augmente la fréquence d’apparition. Elle ne requiert aucune utilisation d’ADN exogène et ne conduit pas à la formation de nouvelles combinaisons génétiques qui ne pourraient pas se produire naturellement. À ce titre, elle est donc exclue du champ d’application de la directive européenne n° 2001/18.
La mutagenèse consiste à provoquer des mutations naturelles. Les mutagènes connus se répartissent en deux groupes : les agents physiques (radiations ionisantes rayons X et rayons γ) et les agents chimiques (moutardes, esters sulfoniques, acide nitreux…). Bien que certains agents mutagènes produisent surtout des mutations géniques et d’autres surtout des mutations chromosomiques, on n’en connaît aucun qui agisse systématiquement sur un gène déterminé d’un organisme. Même amplifiée par l’utilisation d’agents mutagènes, la mutagenèse garde donc toujours un caractère aléatoire, non dirigeable.
La base de données gérée par la FAO et l’Agence internationale de l’énergie atomique (IAEA) recense plus de 3 200 variétés de plantes améliorées par mutagenèse, pour plus d’une cinquantaine d’espèces (37). Ce chiffre est en réalité sous-évalué puisque la base ne recense que les variétés obtenues directement par mutagenèse, et non celles qui ont été obtenues par rétrocroisements ultérieurs avec ces variétés obtenues pas mutagenèse. La plus ancienne variété enregistrée dans cette base de données date de 1950.
2. Les autres ruptures technologiques
– La réaction de polymérisation en chaîne (PCR, Polymerase Chain Reaction)
La technique d’amplification du matériel génétique (ADN ou ARN) est une des baguettes magiques de la biologie moléculaire. Elle permet de copier du matériel génétique à l’état de trace pour le multiplier jusqu’à un milliard de fois en une heure. Cette technique d’amplification dénommée PCR (polymerase chain reaction) a apporté une révolution dans la biologie moléculaire. Elle a permis le séquençage et la compréhension du génome humain et de nombreuses autres espèces de virus, de micro-organismes, de végétaux ou d’animaux.
Le fragment d’ADN double brin est dénaturé, déroulé, hybridé à une amorce. Il est ensuite dupliqué et les produits de la réaction servent à un nouveau cycle. Il peut être identifié grâce à une sonde génétique. Cette découverte formulée par Kary Bank Mullis en 1986, lui a valu le prix Nobel de chimie en 1993. Cette technologie de rupture a permis des progrès dans la connaissance des génomes, mais également elle joue un rôle majeur dans les progrès diagnostics, prénataux, des maladies héréditaires, dans la recherche de traces d’OGM, dans la caractérisation des agents pathogènes des plantes, des animaux, des virus, donnant par exemple la possibilité de vérifier la charge virale du virus VIH. Enfin ces technologies sont aujourd’hui à la base d’investigations policières tendant à confondre des meurtriers à partir des traces d’ADN laissées sur des scènes de crime. L’ADN est devenu un marqueur des organismes vivants et c’est parce qu’on peut amplifier et multiplier le nombre de molécules qu’on est aujourd’hui capable de ces prouesses technologiques.
– La protéine fluorescente verte (GFP – Green Fluorescent Protein)
La protéine fluorescente verte (GFP) a permis l’imagerie génétique. Elle est beaucoup utilisée avec le poisson zèbre, transparent, dans les travaux de recherche sur la régénération de tissus. Selon la définition de l’Encyclopædia Universalis, « Dans les laboratoires des sciences du vivant, la fluorescence est également très utilisée. Le prix Nobel de chimie 2008 a récompensé la découverte de la GFP (green fluorescent protein), une protéine fluorescente de la méduse Aequorea victoria. Comme il s’agit d’une protéine, elle est codée par un gène. Si l’on souhaite étudier comment un gène s’exprime dans une cellule, on lui adjoint le gène de la protéine fluorescente. À la protéine codée par le gène d’intérêt sera accolée, lors de la transcription, la GFP fluorescente. La protéine d’intérêt sera donc traçable dans l’organisme vivant. La détection de fluorescence est souvent couplée à une méthode de microscopie qui permet d’avoir des images de la fluorescence de cellules ou de tissus. Notons que les nanocristaux de semiconducteurs peuvent constituer de très bons marqueurs pour l’imagerie, car ils ne se détruisent pas lors d’expositions prolongées à la lumière d’excitation. »
• Quelles seront les prochaines étapes ?
– L’optogénétique
Le chercheur américain Feng Zhang, alors étudiant à l’université de Stanford, maintenant au MIT, a participé à l’équipe qui a été à l’origine de la découverte de l’optogénétique en 2005.
D’après un article de Futura Sciences (38) : « L’optogénétique correspond à un nouveau domaine de recherche et d’application, associant l’optique à la génétique. Cette technique est notamment utilisée pour identifier des réseaux neuronaux. Elle est principalement basée sur une protéine, la "channelrhodospine", qui possède la propriété d’être activée par la lumière bleue. Des cellules neuronales exprimant cette protéine, peuvent alors elles-mêmes être activées par de la lumière bleue, apportée par une fibre optique. Ainsi, des souris génétiquement modifiées pour exprimer la protéine dans des neurones particuliers et possédant une fibre optique reliée à leur cerveau, tournent frénétiquement à gauche lorsque la fibre optique envoie de la lumière bleue sur ces neurones. »
Les perspectives de l’optogénétique semblent considérables, par exemple pour mieux comprendre le fonctionnement du cerveau, imaginer de nouveaux traitements contre des maladies neurologiques (Parkinson) ou encore ouvrir des perspectives dans la restauration de la vision.
Comme le rapporte Sciences et Avenir (39), des chercheurs américains sont parvenus à restaurer la mémoire de souris rendues amnésiques en activant certains groupes de neurones par émissions lumineuses. « Selon une étude publiée en mai 2015 dans la revue américaine Science, "Cette recherche fait avancer la compréhension sur la nature de l’amnésie, une question très controversée en neurosciences", estime M. Susumu Tonegawa, professeur au centre de recherche sur l’apprentissage et la mémoire du Massachusetts Institute of Technology (MIT) et directeur du Riken Brain Science Institute au Japon, associé au MIT, qui a dirigé ces travaux. »
– CRISPR-Cpf1
Le service scientifique de l’ambassade de France à Berlin (40) explique que, « quelques années après sa découverte, la technique de génie génétique CRISPR-Cas9, adaptée du système immunitaire de bactéries, et qui permet de modifier de manière précise le génome de nombreux organismes, a révolutionné la biologie. Les chercheurs tentent depuis d’optimiser cette technique pour ses différentes applications. Des chercheurs de l’institut Max Planck de recherche sur les maladies infectieuses (Berlin), de l’université d’Umeå en Suède et du centre Helmholtz de recherche sur les maladies infectieuses (Brunswick, Basse-Saxe), dont l’équipe d’Emmanuelle Charpentier (co-découvreuse de la technique), ont découvert un mécanisme de défense immunitaire de certaines bactéries encore plus simple que CRISPR-Cas9 : CRISPR-Cpf1 (41).
« Le système CRISPR-Cas9 permet aux bactéries de se défendre face aux virus : l’enzyme Cas9 découpe l’ADN viral à une position déterminée par deux molécules d’ARN, nommées CRISPR RNA (crRNA) et tracrRNA. La molécule de crRNA est obtenue à partir de la molécule pre-crRNA grâce à l’action d’une autre molécule (la RNase III).
« Certaines bactéries utilisent une autre enzyme, appelée Cpf1, afin de sectionner l’ADN étranger. Cpf1 possède une caractéristique unique jusqu’à présent dans la famille d’enzymes Cas : elle coupe aussi bien l’ARN que l’ADN. De plus, le système CRISPR-Cpf1 est, par certains aspects, plus simple que le système CRISPR-Cas9 : physiologiquement, il ne nécessite aucune molécule supplémentaire pour transformer le pre-crRNA en crRNA, mais pour le système Cas9, il est possible de construire des ARN guides uniques. En outre, l’enzyme Cpf1 n’est guidé jusqu’à sa cible que par le crRNA, sans l’aide d’une molécule de tracrRNA. CRISPR-Cpf1 serait ainsi le système le plus minimaliste de cette famille décrit jusqu’à présent.
« Cependant, il n’est pas encore sûr que CRISPR-Cpf1 possède un réel avantage par rapport à CRISPR-Cas 9 en tant qu’outil pour la modification génétique. Les chercheurs continuent à étudier les autres systèmes de défense immunitaire des bactéries. »
Dans un article paru dans Nature Methods en août 2016 (42), résumant un article paru dans Nature Biotechnology (43), il est rappelé que « la plupart des modifications ciblées du génome avec le système CRISPR ont été réalisées à ce jour avec la nucléase de type II Cas9 de Streptococcus pyogenes. Récemment, une autre nucléase de type II, Cpf1, a été introduite avec des caractéristiques qui font défaut à SpCas9. Cpf1 requiert seulement un ARN CRISPR de 42-nt (crRNA) pour trouver sa cible, au lieu de l’ARN guide d’environ 100-nt pour SpCas9, et il reconnaît un motif adjacent à protospacer (PAM) qui est à 5’ au lieu de 3’ du site cible. Kleinstiver et al. ont comparé les deux nucléases et ont trouvé que Cpf1 était efficace et hautement spécifique dans les cellules humaines, avec une segmentation hors cible excellente. L’introduction systématique de mutations dans le crARN a montré que les mésappariements à l’extrémité 5’ ne sont pas tolérés, alors que les mésappariements à l’extrémité 3’ du crARN ont moins d’effets sur la segmentation. Cette spécificité élevée fait de Cpf1 un candidat pour des applications thérapeutiques. »
C. LES PRINCIPALES TENDANCES DE LA RECHERCHE EN BIOTECHNOLOGIES
1. L’explosion des recherches après la découverte de CRISPR-Cas9
a. Le recensement des publications
La découverte de CRISPR-Cas9 s’est accompagnée d’un accroissement exponentiel du nombre des recherches et des publications scientifiques.
• Étude de Mme Nicole Haeffner-Cavaillon, chercheure à l’INSERM, novembre 2016
Selon l’étude de Mme Nicole Haeffner-Cavaillon, chercheure à l’INSERM, de novembre 2016, 2 514 documents ont été publiés dans le monde depuis 2011 sur CRISPR-Cas9 (44). On peut décomposer ce total en fonction du nombre de laboratoires impliqués selon les pays :
– États-Unis : 289
– Chine : 122
– Japon : 67
– France : 57
– Allemagne : 46
– Angleterre : 29
– Italie : 27
Les disciplines de recherche impliquant CRISPR-Cas9 en fonction du nombre de publications (catégories Web of Science – une publication peut figurer dans plusieurs catégories) sont les suivantes :
– Biochimie et biologie moléculaire : 629
– Biotechnologie et microbiologie appliquée : 424
– Génétique et hérédité : 359
– Biologie cellulaire : 307
– Médecine, recherche et expérimentations : 194
– Méthodes de recherche biochimique : 178
– Sciences des plantes : 88
– Oncologie : 75
– Virologie : 66
– Biologie développementale : 64
– Ingénierie cellulaire et tissulaire : 62
– Hématologie : 52
– Microbiologie : 50
– Sciences multidisciplinaires : 48
– Immunologie : 41
– Biologie : 35
– Pharmacologie et pharmacie : 32
– Neurosciences : 30
– Neurophysique : 29
– Biophysique : 29
– Maladies artérielles périphériques : 13
Les disciplines impliquant CRISPR-Cas9 avec le plus d’impact (part de publications au « top 1 % » (45) des publications mondiales les plus citées par discipline) sont : les sciences des plantes (alors qu’elles arrivent en 7e position en nombre de publications, cette discipline a le plus fort impact avec 19,3 % des publications dans le top 1 %) ; la biotechnologie et la microbiologie appliquée ; l’ingénierie cellulaire et tissulaire ; la biochimie et la biologie moléculaire ; la biologie cellulaire ; et la médecine et la recherche expérimentale.
Parmi les 283 publications mondiales avec un très fort impact (top 1 %) sur CRISPR-Cas9, les pays qui ont le plus contribué sont les États-Unis (202), la Chine (48), l’Allemagne (22), le Japon (20), la Corée du Sud (13), la France (11), l’Angleterre (11), les Pays-Bas (10) et la Suède (9).
• L’étude d’Elsevier
Le graphique présenté ci-dessous, établi par le centre d’information néerlandais Elsevier (46), recense le nombre de publications concernant CRISPR-Cas9 dans le « top 10 % » (47) des journaux avec le plus d’impact. On y constate l’évolution exponentielle du nombre des publications pour les États-Unis et, dans une moindre mesure, pour la Chine. La tendance exponentielle, constatée depuis 2012, se poursuit en 2016. Ensuite trois pays sont très proches : Japon, Royaume-Uni et Allemagne. Ensuite encore, un troisième groupe de pays très proches également : France, Pays-Bas, Canada, Corée du Sud et Suisse. Alors que le nombre de publications françaises diminuait de façon inquiétante en 2015, il a cru à nouveau en 2016. Mais la France reste encore loin du groupe Japon, Royaume-Uni et Allemagne, duquel elle semble avoir décroché.
COMPARAISON PAR PAYS DU NOMBRE DE PUBLICATIONS
CONCERNANT LA TECHNOLOGIE CRISPR-CAS9
DANS LE PREMIER DÉCILE DE JOURNAUX AVEC LE PLUS D’IMPACT

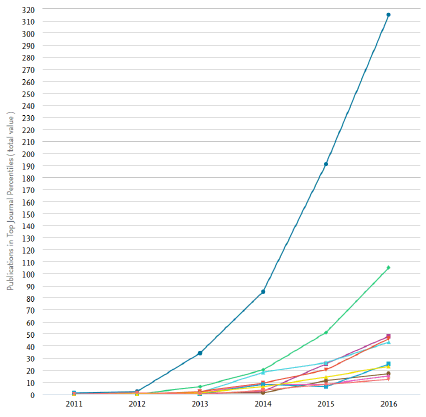
Source : Elsevier 26/01/2017.
• Le recensement des publications scientifiques françaises sur CRISPR-Cas9 (2011-2016)
À partir des données du service Web of Science extended, les rapporteurs ont recensé les articles scientifiques mentionnant « CRISPR » et publiés depuis 2011 dont au moins un auteur est affilié à une institution française (centre de recherche, université, entreprise…). Du 1er janvier 2011 au 1er février 2017, 265 articles ont ainsi été publiés (48).
Les deux tableaux ci-après présentent les institutions qui publient le plus et les principales thématiques traitées. Les articles ayant en général plusieurs auteurs, le nombre total de publications est largement supérieur à 265 et le pourcentage total très supérieur à 100.
ARTICLES SCIENTIFIQUES SUR CRISPR
PUBLIÉS PAR LES INSTITUTIONS FRANÇAISES (2011-2016)
– par institution –
Nombre |
% | |
CNRS |
147 |
55 |
INSERM |
114 |
43 |
Institut Pasteur |
54 |
20 |
ENS |
23 |
9 |
INRA |
22 |
8 |
Université d’Aix - Marseille |
19 |
6 |
Université de Strasbourg |
16 |
6 |
Université Sorbonne Paris Cité |
15 |
5 |
Université de Lyon |
14 |
5 |
ANSES |
11 |
4 |
AP-HP |
10 |
4 |
Université de Montpellier |
10 |
4 |
Source : OPECST, données issues du Web of Science extended.
ARTICLES SCIENTIFIQUES SUR CRISPR
PUBLIÉS PAR LES INSTITUTIONS FRANÇAISES (2011-2016)
– par thématique -
Nombre |
% | |
Microbiologie |
66 |
25 |
Biochimie et biologie moléculaire |
60 |
23 |
Biotechnologie et microbiologie appliquée |
49 |
18 |
Génétique et hérédité |
47 |
18 |
Sciences multidisciplinaires |
41 |
15 |
Méthodes de recherches en biochimie |
25 |
9 |
Médecine, recherche et expérimentation |
22 |
8 |
Biologie cellulaire |
16 |
6 |
Biologie évolutive |
9 |
3 |
Maladies infectieuses |
7 |
3 |
Biologie mathématique et computationnelle |
6 |
2 |
Biologie |
6 |
2 |
Virologie |
6 |
2 |
Ecologie |
6 |
2 |
Sciences végétales |
5 |
2 |
Source : OPECST, données issues du Web of Science extended.
Le graphique ci-dessous montre l’évolution par année. Comme ailleurs, on constate une augmentation exponentielle, la tendance continuant en 2016.
ARTICLES SCIENTIFIQUES SUR CRISPR
PUBLIÉS PAR LES INSTITUTIONS FRANÇAISES
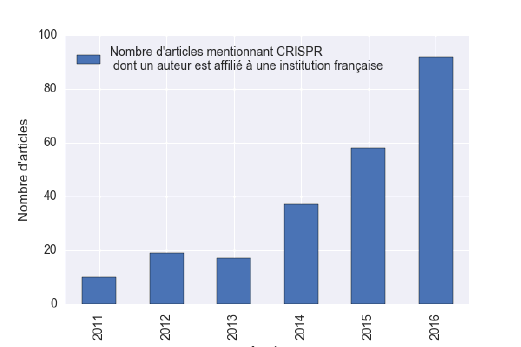
Source : OPECST, données issues du Web of Science extended.
b. Applications de modification ciblée du génome
Les deux tableaux suivants montrent des exemples d’applications de modification ciblée du génome et de chercheurs travaillant avec CRISPR-Cas9.
APPLICATIONS DE MODIFICATION CIBLÉE DU GÉNOME
Catégorie |
Exemples |
Recherche |
Génétique, génomique, modélisation de maladie, validation des médicaments ciblés (outils, kits, guides, enzymes, plasmides, lignée cellulaire, logiciel) |
Médecine |
Maladies génétiques, antiviraux, antimicrobien, médecine régénérative, xéno-transplantation, thérapie génique, thérapie cellulaire, macrobiote, maladies vectorielles (gene drive) |
Agriculture |
Plantes, animaux |
Industriel |
Bactérie, levure, algue, nourriture, bioproduction, soins domestiques, bioénergie |
Source : OPECST.
CHERCHEURS TRAVAILLANT À L’ÉTRANGER SUR OU AVEC CRISPR-CAS9 ET RENCONTRÉS
PAR LES RAPPORTEURS OU MENTIONNÉS LORS DE LEURS MISSIONS
Liste non exhaustive
M. Federik Lanner (Suède) |
Recherche sur des cellules souches embryonnaires et la médecine régénérative (obtient en 2016 l’autorisation pour effectuer des recherches sur des embryons humains) |
Mme Kathy Niakan (Royaume-Uni) |
Recherche sur l’embryon inférieur à 7 jours pour comprendre les causes de l’infertilité (obtient en février 2016 l’autorisation de la HFEA pour modifier génétiquement des embryons humains) |
MM. Ethan Bier et Valentino Gantz (Etats-Unis, UC San Diego) |
Recherche sur les maladies à transmission vectorielle, type Zika, malaria, dengue Recherche sur les maladies neurodégénératives (Alzheimer, Parkinson) |
M. Eric Marois (France) |
Recherche sur les moustiques avec la méthode de forçage génétique (gene drive) |
George Church (États-Unis) |
Multiples recherches dont biologie de synthèse, projet vétérinaire sur la lignée germinale, maladies polygéniques… |
M. Alex Marson (États-Unis) |
Recherche sur le contrôle des séquences génétique sur le système immunitaire |
M. Feng Zhang (Chine) |
Recherche sur des embryons et travail sur la myopathie de Duchenne et la tyrosénie sur des souris |
M. Jennifer Doudna (États-Unis) |
Recherche fondamentale sur CRISPR |
Mme Emmanuelle Charpentier (Allemagne) |
Recherche fondamentale sur CRISPR |
M. Patricio Yankilevich (Brésil) M. Lucas Pontel (Royaume-Uni) |
Analyse du génome humain pour la médecine personnalisée Travail sur les lignées cellulaires humaines pour insérer des knock out et positionner des tags. Recherches sur le métabolisme du cancer, l’anémie de Fanconi |
M. Marcello Bozza (Brésil) |
Programme de recherche sur la maladie de Chagas |
M. Ruth Heinz (Allemagne) |
Recherche appliquée – maladies des animaux avec micro ARN et séquençage. Essais sur les bovins porteurs de la maladie de la « vache folle ». Projet de s’intéresser au génome du fruit et la vitamine E |
M. Rodolphe Barrangou (États-Unis) |
Recherche fondamentale – Immunité adaptative chez les bactéries |
Source : OPECST.
Mme Jennifer Doudna, professeur à l’université de Californie-Berkeley, a élaboré un tableau qui présente une liste de tous les travaux en cours sur les organismes vivants génétiquement modifiés grâce à CRISPR-Cas9 (49). Elle a accepté d’en donner une version actualisée en août 2016 aux rapporteurs. Le tableau présente une longue liste de plantes mais aussi d’animaux, y compris des mammifères et un groupe important d’organismes d’intérêt dans la recherche pour les animaux ou d’organismes monocellulaires.
2. La France est-elle en train de perdre sa capacité de recherche et d’innovation ?
a. Bien que la France soit à l’origine de la découverte de CRISPR-Cas9, elle prend du retard…
Si la France se classe quatrième en nombre de laboratoires ayant le plus publié sur CRISPR-Cas9 depuis 2011, elle est sixième en nombre de publications mondiales ayant le plus fort impact (top 1 %), mais plus inquiétant, selon l’étude d’Elsevier (50) déjà citée, la France, est loin derrière les États-Unis et de la Chine, décroche du groupe de poursuiveurs formé par le Japon, le Royaume-Uni et l’Allemagne et fait partie du peloton constitué des Pays-Bas, le Canada, la Corée du Sud et la Suisse.
On a également vu dans l’étude d’Elsevier relative au nombre de publications en 2016 concernant CRISPR-Cas9 dans le « top 10 % » des journaux avec le plus d’impact, que la France, loin derrière les échappées des États-Unis et de la Chine, décroche du groupe de poursuiveurs formé par le Japon, le Royaume-Uni et l’Allemagne et fait partie du peloton constitué des Pays-Bas, le Canada, la Corée du Sud et la Suisse.
Tous les chercheurs rencontrés par les rapporteurs ont rappelé que la modification ciblée du génome a été inventée en France, que c’est une idée française, que ses principes ont été conçus en France.
Ce n’est pas un hasard si, parmi les inventeurs de CRISPR-Cas9, on trouve d’imminents chercheurs français : Mme Emmanuelle Charpentier, M. Rodolphe Barrangou, M. Philippe Hovarth, Mme Christine Pourcel, M. Gilles Vergnaud.
Nombreux sont d’anciens « pasteuriens ». Ainsi, la co-inventrice française de CRISPR-Cas9, Mme Emmanuelle Charpentier, après une thèse à l’Institut Pasteur, après plusieurs post-doctorats aux États-Unis, qui constitue un parcours obligé dans ce domaine de recherche, a dû s’expatrier en Suède puis en Allemagne, y trouvant de meilleures conditions de recherche que dans les instituts équivalents en France. Elle a indiqué aux rapporteurs qu’elle aurait adoré revenir en France, mais qu’elle pensait que cela faisait trop longtemps qu’elle était partie et qu’elle aurait l’impression d’être étrangère dans son propre pays. Selon elle, le problème est que la France perd ses chercheurs mais ne les récupère pas, ce qui n’est pas le cas en Allemagne ou en Suède. La France est incapable d’offrir aux chercheurs étrangers des conditions pour revenir y travailler, avec des responsabilités et des financements. Mme Charpentier précise qu’elle a été guidée dans ses choix par la liberté qu’on lui accordait dans ses recherches. Cette liberté existe en France, mais la bureaucratie, y est particulièrement lourde. Pour un scientifique, il est pénible de devoir justifier tout le temps ce qu’il fait. L’effort de simplification des procédures administratives que l’on constate en Suède ou en Allemagne pourrait avantageusement servir d’exemple en France. Mme Charpentier a en outre créé CRISPR-Therapeutics avec un siège social en Suisse et des laboratoires aux États-Unis, une jeune pousse (start-up), sur la base de ses brevets, qui travaille sur les thérapies sur l’homme avec CRISPR-Cas9. Pour elle, la localisation à Boston est la seule façon d’être compétitif.
M. Rodolphe Barrangou, est parti aux États-Unis, d’abord dans le groupe américain DuPont, puis maintenant à l’université de Caroline du Nord. M. Philippe Hovarth travaille pour le groupe américain DuPont à… Dangé-Saint-Romain, une commune de 3 000 habitants dans la Vienne, qu’il a fait rentrer dans la légende CRISPR-Cas9. Mme Christine Pourcel et M. Gilles Vergnaud sont restés fidèles à l’université Paris Sud. Quant à M. André Choulika, qui vient également de l’Institut Pasteur, il a fondé la société Cellectis, basée à Paris, mais ayant des établissements à New-York et à Minneapolis et des champs expérimentaux en Argentine et au Brésil.
Dans le domaine végétal, l’INRA était le leader mondial de la recherche en biotechnologies vertes dans les années 1980. L’institut n’a aujourd’hui plus qu’un seul programme de biotechnologies, Genius (51), et plus aucun champ en culture ni en France ni ailleurs. En 2017, la recherche en biotechnologies vertes est essentiellement développée par trois entreprises multinationales Monsanto/Bayer, DuPont/Dow Chemical/Pioneer et Syngenta/ChemChina, le semencier français Limagrain étant loin derrière (52). « La France a perdu sa capacité d’expertise internationale en biotechnologies », ont entendu les rapporteurs lors de leur mission à l’Organisation de l’agriculture et de l’alimentation (FAO). La querelle des années 1990 sur les OGM a fait des dégâts, elle a bouleversé les laboratoires. Dans l’inconscient collectif français, les biotechnologies ont une image négative.
b. …en raison de la faiblesse de la recherche appliquée
De nombreux chercheurs français ont dit aux rapporteurs qu’en biotechnologies, la recherche fondamentale française était très performante, mais que la recherche appliquée avait tendance à se délocaliser, aux États-Unis ou ailleurs. Cet état de fait n’est pas propre aux biotechnologies, il est malheureusement constaté dans d’autres domaines de recherche. Dans les biotechnologies, la France sert de fournisseur de brillants post-doctorants aux jeunes pousses (start-ups) californiennes ou bostoniennes… Selon M. Christian Vaisse, professeur à l’université de Californie – San Francisco, la vitalité des entreprises américaines est supérieure à celle des françaises. Aux États-Unis, l’échec dans la création d’entreprise n’est pas rédhibitoire, il est même valorisé. Pour M. Vaisse, en France, les polytechniciens sont formatés pour gagner le plus d’argent possible tout de suite dans une grande entreprise.
Les causes de la faiblesse de la recherche appliquée en France excèdent le périmètre du présent rapport (53). Les rapporteurs estiment que la stratégie nationale de recherche (SNR) française ne met pas assez l’accent sur la recherche en biotechnologies, en tous cas pas autant que d’autres pays occidentaux (États-Unis, Japon, Royaume-Uni…). Autant la recherche appliquée est foisonnante et attractive aux États-Unis, autant elle est contrainte en France (insuffisance des crédits, impossibilité de fait de cultiver des OGM en plein champ), voire dans d’autres pays d’Europe comme l’Allemagne (réticences fortes à modifier le génome des cellules humaines).
Le rejet du développement des biotechnologies conduit à une perte de compétitivité de la France. Il faut cependant distinguer l’agriculture, où la recherche en biotechnologies est maintenant délaissée, de la médecine humaine, où elle reste en en pointe. Un bon exemple en est constitué par le Genopole d’Évry.
c. Le cas particulier du Genopole d’Évry
Les rapporteurs ont visité, le 12 décembre 2016, le Genopole d’Évry. Ils y ont vu un lieu d’excellence de la recherche française en biotechnologies médicales (54).
Genopole regroupe à Évry différents acteurs autour de l’ADN et des biotechnologies afin de créer une émulation et se placer dans la compétition mondiale sur le plan économique autant que scientifique. Ce projet a fait l’unanimité des responsables politiques concernés et a attiré les investissements de grandes entreprises. Genopole dynamise la région d’Évry en se plaçant en acteur international incontournable en génomique, par la coordination de grands projets internationaux de recherche, et l’accueil de jeunes entreprises prometteuses. Les ambitions de Genopole, telles que le développement de la coopération entre l’université Paris-Saclay et le centre hospitalier sud francilien (CHSF), ou encore la création d’YposKesi, une plateforme industrielle de production de thérapie génique pour les maladies rares, permettent au cluster d’attirer les meilleurs scientifiques mondiaux.
Ce contexte permet à Genopole de mieux identifier les besoins de jeunes pousses françaises et de comprendre pourquoi l’Europe se comporte malheureusement en « incubateur des États-Unis ». En effet, M. Pierre Tambourin, directeur général de Genopole, alerte sur ce qu’il appelle une « nouvelle vallée de la mort », à une étape de 10 à 50 millions d’euros de levée de fonds pour les entreprises françaises. Il propose de consacrer une partie de l’épargne des français à investir dans des entreprises qui sont à ce stade de développement, qui représenterait un faible niveau de risque, afin que ces entreprises ne partent pas aux États-Unis.
La pierre angulaire de Genopole, est l’AFM-Téléthon, qui existe depuis 1958 en tant qu’Association française contre les myopathies et s’est allié au Téléthon en 1987. Grâce aux travaux de leurs chercheurs, en séquençage du génome notamment, l’AFM-Téléthon a permis de grandes avancées dans la compréhension des maladies rares, ainsi que sur des maladies plus fréquentes. L’AFM travaille en partenariat avec les établissements publics scientifiques et technologiques (EPST) français, ainsi que les meilleures équipes de recherche internationales grâce à leur processus d’appel d’offre. Leur fond d’amorçage permet de soutenir des jeunes pousses qui industrialisent les médicaments que leurs chercheurs mettent au point. M. Christian Cottet, directeur général de l’AFM-Téléthon, fait cependant remarquer que le dispositif de l’autorisation de mise sur le marché (AMM), n’est pas adapté à de nombreuses maladies rares, étant donnés que les personnes concernées peuvent être toutes ou presque toutes traitées dans les essais cliniques.
L’AFM-Téléthon concentre la moitié de ses moyens sur la recherche en thérapie génique et a déjà de bons résultats du fait de ses collaboration avec l’Italie, le Royaume-Uni ou encore les États-Unis. M. Serge Braun, directeur scientifique de l’AFM-Téléthon, estime que ces avancées permettent d’avoir des espoirs de traitement pour la myopathie de Duchêne, des maladies immunitaires, sanguines, osseuses, cérébrales, et même pour le sida. Les nouvelles biotechnologies comme les TALEN ou CRISPR-Cas9 participent à ces espoirs, mais leur nouveauté renvoie les espoirs de résultats pour dans une vingtaine d’années, quand la recherche aura atteint une maturité suffisante. Cependant, ces espoirs et ces technologies posent de nouvelles questions, comme la généralisation du diagnostic prénatal des maladies rares, aujourd’hui inutile en raison de l’absence de traitement. Le potentiel est énorme, mais les précautions normales sont à appliquer, comme le signale Mme Isabelle Richard, responsable de l’équipe de recherche de Généthon sur les dystrophies musculaires, qui complète en avertissant contre les conséquences destructrices que pourrait avoir un moratoire sur la recherche, surtout au regard du caractère prometteur de ces travaux.
L’I-Stem est l’un des laboratoires sur lequel s’appuie l’AFM-Téléthon. Créé en 2005, il a réussi faire revenir des États-Unis de jeunes chercheurs français prometteurs en leur offrant très tôt des postes de direction, grâce au passage du régime d’interdiction de la recherche sur les cellules avec dérogation à une autorisation encadrée. L’objectif de ce laboratoire est thérapeutique avec un axe sur les thérapies cellulaires et un autre sur les maladies monogéniques. C’est en partie le financement du Genopole et plus particulièrement du Téléthon avec 4 millions d’euros par an, qui a permis le succès de l’I-Stem, comme le rapporte M. Marc Pechanski, le directeur scientifique du laboratoire.
Genopole accueille de nombreux laboratoires et offre un environnement pour développer des jeunes pousses qui participeront à l’émulation du cluster. L’Institut des systèmes et de la biologie de synthèse (iSSB), dirigé par M. François Kepes, est l’un d’eux. Parmi les laboratoires qui publient le plus en biologie de synthèse en Europe, dans le monde et dans les meilleures revues scientifiques (Nature, Science, Genesis…), l’iSSB se positionne comme un acteur incontournable et très compétitif du domaine. Le diplôme de master qu’il propose permet d’attirer les étudiants les plus prometteurs qui créent souvent des entreprises innovantes à succès, après un doctorat dans les meilleures universités du monde telles que Cambridge.
De ce laboratoire, sont issues des entreprises qui proposent des solutions intéressantes de biotechnologies blanches : Global bioénergie fait de l’isobutane biosourcé (pour le caoutchouc par exemple), Enobraq à Toulouse recapture du carbone, Glowee fait de l’éclairage public en utilisant des réactions chimiques présentes dans la nature (lucioles, bactéries dans certains poissons des profondeurs)…
L’une de ces entreprises, Abolis, présidée par M. Cyrille Pauthenier, ambitionne de révolutionner la chimie industrielle traditionnelle, en mettant au point des processus de production chimique plus propres et écologiquement acceptables, grâce à la biologie de synthèse. Sans illusion quant à l’ampleur de la tâche, M. Pauthenier estime qu’il est nécessaire de réglementer intelligemment son domaine, afin d’empêcher un accident qui décrédibiliserait tout le domaine. Il propose, comme pour les médicaments, de vérifier que l’innovation apporte une amélioration par rapport à ce qui existe déjà. En lien avec les problématiques de son travail, le président d’Abolis encourage à réfléchir à un encadrement de l’usage des éléments génétiques mobiles, pour éviter les transferts accidentels de gènes entre espèces. Sa méthode est d’handicaper la souche utilisée comme véhicule de ces gènes pour la rendre perdante en cas de compétition avec des souches naturelles. Pour M. Pauthenier, la biologie de synthèse sera un des outils importants qui sculpteront les solutions de demain aux problématiques actuelles.
d. CRISPR-Cas9 dans les laboratoires français
Les rapporteurs ont envoyé, en novembre et décembre 2016, un questionnaire aux instituts de recherche et universités françaises, pour les interroger sur leur utilisation de la technologie CRISPR-Cas9 et dans quel but.
Les instituts de recherche, contactés par l’intermédiaire des alliances Aviesan et Allenvie, ont globalement tous répondu, avec des degrés variables de précision : le CNRS, l’Institut national de la santé et de la recherche médicale (INSERM), l’Institut national de la recherche agronomique (INRA), l’Agence nationale sécurité sanitaire alimentaire nationale (ANSES), le Centre de coopération internationale en recherche agronomique pour le développement (CIRAD), le Muséum national d’histoire naturelle (MNHN), l’Institut français du pétrole et des énergies nouvelles (IFPEN).
L’INSERM a transmis un document rédigé en novembre 2016 par Mme Nicole Haeffner-Cavaillon (55), docteure à l’INSERM, détaillant les études sur CRISPR-Cas9 qui ont eu un grand impact sur la communauté scientifique et auxquelles ont participé des chercheurs français. Ce document fait état de 57 laboratoires impliqués dans la recherche sur CRISPR-Cas9 en France, utilisant la technologie, dans des disciplines variées, comme la biologie et la biochimie moléculaire, la génétique, la microbiologie, ou les sciences végétales. Le document détaille aussi la répartition des recherches sur CRISPR-Cas9 entre les instituts français concernés. L’INSERM arrive en première place des publications (25 articles), avec notamment des recherches effectuées sur les poissons-zèbres, les moustiques ou divers pathogènes, puis le CNRS (21), l’université Paris Sciences et lettres (9), le MNHN (9), l’Institut curie (7), l’université Pierre et Marie Curie (5), l’INRA (5), l’université de Montpellier (4), l’université (COMUE) de Lyon (4) et l’université (COMUE) Languedoc Roussillon (4).
Il résulte du document de l’INSERM et des réponses au questionnaire que les recherches sur CRISPR-Cas9 impliquent des chercheurs de nombreuses structures : des universités (Lille, Sorbonne, Paris Diderot, Strasbourg, Montpelier…), des grandes écoles (École des Mines, ENS Lyon, Institut national des sciences appliquées (INSA) Toulouse…), des hôpitaux (Saint-Louis, Necker Enfants Malades, Robert Debré, Centre hospitalier universitaire (CHU) de Rouen…) et des instituts de recherche. Ces derniers sont d’ailleurs les pilotes de nombreuses recherches, d’après les réponses au questionnaire, les autres structures étant associées.
Ainsi, l’Institut Pasteur travaille sur diverses bactéries pathogènes, sur des souris, des mouches, des cellules eucaryotes, ou encore des poisson-zèbres ; l’IFPEN, de son côté, travaille sur des micro-organismes pour des carburants biosourcés ; le CIRAD fait des essais sur du riz et du café ; l’ANSES fait des recherches sur des virus ; le MNHN travaille aussi sur des poisson-zèbres, des huîtres ou encore des bactéries.
Par ailleurs, il semblerait que la technologie CRISPR-Cas9 soit déjà très répandue et utilisée en laboratoire. Ainsi l’Institut des sciences biologiques (INSB) du CNRS a indiqué qu’il estime que 50 % de ses laboratoires l’utilisent. L’INRA considère que 41 unités de recherches réparties dans 8 départements sont susceptibles de faire usage de CRISPR.
Par contre les universités, contactées par les rapporteurs par l’intermédiaire de la conférence des présidents d’université (CPU), ont été moins réactives, seules deux réponses sont parvenues, dont une seule positive. L’université de Lille dit réaliser quinze études impliquant CRISPR-Cas9, avec des chercheurs associés au CNRS, à l’INRA ou à l’INSERM. La seconde, l’université Paris-Est Créteil (UPEC) a répondu que leurs unités de recherche, sollicitées pour répondre au questionnaire, n’avaient pas déclaré utiliser CRISPR-Cas9, sans plus de précision… Les rapporteurs estiment regrettable que ni la conférence des présidents d’universités (CPU), ni l’université UPEC, soient capables de répondre à un questionnaire de l’OPECST envoyé suffisamment de temps à l’avance.
Recommandation n° 1 : Pour un effort de recherche accru sur les nouvelles biotechnologies
– Encourage le développement de la recherche sur la modification ciblée du génome (genome editing), afin de faire progresser les connaissances et pouvoir tirer profit des avancées qui seront ainsi obtenues en médecine humaine, en agriculture et dans les applications industrielles et environnementales ;
– Estime inapproprié tout moratoire sur ces recherches car, il faut faire progresser les connaissances pour fixer précisément les règles d’utilisation et les limites de ces technologies. Un tel moratoire serait inapplicable à l’échelle planétaire, car certains pays ne l’appliqueraient pas, il ferait prendre du retard à la recherche en France et en Europe et ferait fuir nos chercheurs ;
– Demande qu’en France, la stratégie nationale de recherche (SNR) prenne mieux en compte les biotechnologies, pour conserver une importance à la hauteur des enjeux et à des niveaux similaires à ceux des grands pays développés (États-Unis, Japon, Royaume-Uni…) ;
– Souhaite qu’un volet du programme d’investissements d’avenir PIA 3 soit consacré à ces thématiques.
II. L’ESPOIR DES BIOTECHNOLOGIES APPLIQUÉES À LA MÉDECINE HUMAINE
A. LES POTENTIELS DES DIFFERENTES BIOTECHNOLOGIES APPLIQUEES A LA MEDECINE
De nombreuses maladies humaines ont des causes génétiques. « Réparer » le génome constitue un espoir et une piste thérapeutique prometteuse. Les premières recherches sur le génome humain à buts thérapeutiques ont débuté à la fin des années 1990.
Après la démocratisation du séquençage du génome, après vingt ans de thérapies géniques, après les doigts de zinc et les TALEN, CRISPR-Cas9 complète la panoplie des techniques et fait renaître de grands espoirs pour soigner non seulement des maladies génétiques, mais aussi le cancer, le sida et d’autres maladies.
La baisse significative du coût de ces recherches a permis la multiplication des projets à travers le monde ; des essais cliniques sont même en cours et des patients ont déjà été guéris par l’utilisation de ces nouvelles biotechnologies.
Cependant, leur application – mais surtout leurs potentialités – posent des questions éthiques et doivent conduire les États à s’interroger sur une législation qui n’a pas pu forcément anticiper ces avancées de la science.
1. Présentation des différentes biotechnologies en matière de médecine humaine
La thérapie génique est apparue il y a vingt ans.
Si le concept de la thérapie génique – soigner ou prévenir des maladies en remplaçant un gène défectueux ou en régulant l’expression d’un gène altéré date des années 50, celle-ci ne s’est concrétisée que dans les années 1990, avec les premiers essais conduits sur l’homme. C’est le Dr Marina Cavazzana Calvo et le Pr Alain Fischer (de l’unité 429 de l’INSERM à l’hôpital Necker) qui, en 2000, a permis de les appliquer sur de très jeunes enfants atteints d’une forme de déficit immunitaire (DICS - X).
Présentée au début comme un moyen de lutte contre les maladies monogéniques, la recherche en thérapie génique s’est développée pour les maladies infectieuses (tétanos, sida), neurologiques (sclérose en plaque) ophtalmiques (glaucome, dégénérescence maculaire liée à l’âge) ou dégénératives comme Alzheimer et Parkinson.
Les trois-quarts des essais sont encore des études en phase I ou II. Ceux en phase III – qui permettent d’évaluer le rapport bénéfice/risque d’un nouveau traitement ne représentent que 4,5 % des études.
Plusieurs techniques de thérapie génique existent. Soit sont modifiées ex vivo des cellules prélevées chez le patient qui lui seront réinjectées une fois traitées et qui en proliférant vont contribuer à le soigner. Dans le cas où il est impossible de prélever des cellules (cf. neurones ou cellules cardiaques), un vecteur contenant le transgène est injecté in vivo.
Les résultats des thérapies géniques n’ont pas été à la hauteur des promesses dont on les a créditées, mais cela n’a rien d’étonnant puisque nous n’avons que quinze ans de recul, et qu’on a pu constater que des chercheurs, mais aussi des journalistes, se sont souvent emballés.
Et ce n’est que très récemment que l’Agence européenne des médicaments (EMA) a autorisé le lancement sur le marché deux premiers produits de thérapie génique. Le premier était commercialisé en Chine depuis 2004 pour le traitement du carcinome de la tête et du cou. Il s’agit d’un gène suppresseur véhiculé par un adénovirus. Le second – le Glybera – est européen, injectable par voie intramusculaire, il permet de traiter un déficit familial en lipoprotéine lipase (56).
Pour Mme Nicole Déglon, du laboratoire de neurothérapies cellulaires et moléculaires du centre hospitalier universitaire vaudois, auditionnée en Suisse, « il a certes fallu vingt ans pour arriver à réparer le génome mais désormais, les recherches vont s’accélérer. Les autres techniques de modification ciblée du génome vont bénéficier de ces avancées et il y aura des résultats avant cinq ans ».
b. Rappel des technologies de modification ciblée du génome
La partie I-A du présent rapport, traitait de la façon dont la modification ciblée du génome a révolutionné les biotechnologies.
Dans le domaine de la médecine humaine, les deux techniques, les nucléases à doigts de zinc (zinc finger) et les Talen (Transcription Activator-Like Effector Nucleases) prévalent à ce jour et vont continuer à cohabiter parallèlement au développement de la technologie CRISPR-Cas9.
C’est l’entreprise Sangamo BioSciences qui la première a fait des essais cliniques avec les nucléases à doigts de zinc sur le VIH, les hémophilies B et A et facteur 8 et la maladie de Hunter (sous ses formes, mucopolysacharidose de type 1 et 2, pour lesquelles il manque une protéine, elles nécessitent des injections de six heures toutes les semaines). Pour les nucléases de type TALEN, c’est l’entreprise française Cellectis qui détient le brevet dont l’application sur un être humain a prouvé l’efficacité (voir ci-après le cas de Layla).
Ces deux techniques, que l’on peut qualifier « d’anciennes » sont fondées sur des combinaisons artificielles de domaines de liaison à l’ADN et d’enzymes qui peuvent couper l’ADN à des endroits précis et modifier le gène à l’origine d’un dysfonctionnement. L’efficacité est donc conditionnée par un couplage entre l’ADN et la protéine. Or, la fabrication de ces nucléases reste longue et coûteuse.
Par contre, comme nous l’avons déjà vu, l’originalité de la technologie CRISPR tient au fait que la reconnaissance de l’endroit ciblé dans le génome est basée sur une reconnaissance de l’ADN par un ARN guide facile et rapide à fabriquer et peu coûteux. De plus, ce système est universel et fonctionne des bactéries à l’homme. Il faut, dans cette hypothèse, vérifier sur le génome que d’autres séquences d’ADN ne soient pas reconnues par la protéine et donc, que d’autres séquences d’ADN ne soient pas coupées alors qu’elles n’étaient pas ciblées. Il s’agit des effets hors cibles.
En cas d’utilisation de ces modifications du génome sur l’homme, les imprécisions dues aux effets hors cibles ne peuvent être tolérés. Ces techniques présentent donc des difficultés dès lors qu’il s’agit de les appliquer à l’homme.
Le tableau ci-dessous présente les difficultés qu’il faut surmonter pour réussir les applications de la modification ciblée du génome. Il montre que certaines opérations sont simples et que d’autres, au contraire, sont complexes et difficiles à réaliser.
TYPES DE MODIFICATION CIBLÉE DU GÉNOME CLASSÉS PAR DIFFICULTÉ CROISSANTE (DE HAUT EN BAS)
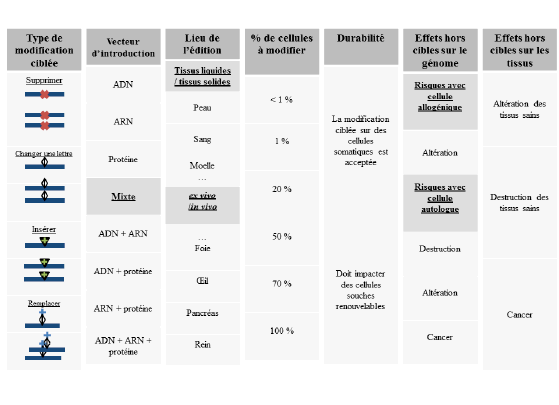 Note : Les colonnes se lisent individuellement, il n’y a pas de correspondances horizontales.
Note : Les colonnes se lisent individuellement, il n’y a pas de correspondances horizontales.
Source : OPECST, d’après données fournies par Cellectis.
En effet, supprimer purement et simplement un gène reste plus facile à réaliser que le remplacer. Le transport des matériaux génétiques vers les cellules à traiter s’avère d’autant plus complexe que les véhicules sont spécifiques et qu’ils contiennent des protéines. Il n’est pas étonnant que les premières applications médicales se sont portées sur les tissus les plus faciles à traiter par thérapie génique ex vivo (peau, sang, moelle…), alors que les organes ne pouvant être atteints qu’in vivo seront plus difficiles à traiter (foie, œil, pancréas, rein…). En outre, selon la pathologie à soigner, le pourcentage de cellules qu’il est souhaitable de modifier pour avoir un effet thérapeutique peut varier considérablement. Le risque d’effets hors cible augmente avec les cellules autologues, c’est-à-dire les cellules du patient qu’on lui prélève, dont on modifie le génome et qu’on lui réadministre ensuite (thérapie cellulaire).
Mme Emmanuelle Charpentier, co-inventrice de CRISPR-Cas9 et directrice de l’Institut Max Planck de biologie infectieuse, estime que le succès dépend tout autant des mécanismes de réparation de l’ADN que des techniques utilisées qui elles-mêmes peuvent connaître de nouveaux développements. L’outil CRISPR doit continuer à progresser.
c. Le diagnostic préimplantatoire (DPI)
Si le but est d’éviter la transmission à l’enfant d’une pathologie génétique, une question se pose : pourquoi modifier le génome humain alors qu’existe une technique alternative, le diagnostic préimplantatoire (DPI) ? Le DPI permet de détecter la présence d’éventuelles anomalies génétiques ou chromosomiques dans les embryons conçus par fécondation in vitro (FIV) et donc d’effectuer un tri d’embryons. Il permet de différencier les embryons atteints d’une maladie génétique de ceux qui portent un gène sain.
Le DPI a été voté dans la loi de bioéthique de 1994. Le débat avait été vif ; les partisans du diagnostic préimplantatoire souhaitaient le réserver à des couples porteurs d’anomalies génétiques graves susceptibles d’être transmises à leur enfant comme la mucoviscidose, la maladie de Huntington ou la myopathie de Duchenne. Ils réservaient la possibilité d’utiliser cette technique à des familles qui avaient déjà donné naissance à des enfants gravement atteints. Les opposants refusaient tout tri, car ils craignaient des dérives une évolution vers l’enfant « à la carte » où l’on choisirait ceux dont les caractéristiques correspondent aux attentes des parents. Vingt ans après, il n’y a pas eu de dérive constatée et le diagnostic préimplantatoire a permis de rendre plus d’un millier de familles heureuses, d’avoir pu donner naissance à des enfants en bonne santé. Le risque de dérive demeure toutefois, il faut rester vigilant, dans la mesure où certains pays comme les États-Unis permettent de choisir le sexe de l’enfant. Le débat d’aujourd’hui est donc de dire s’il y a lieu ou non de donner des possibilités de cellules germinales ou des zygotes, transmettant de fait une « correction du gène » à la descendance, alors que le diagnostic préimplantatoire permet aujourd’hui de l’éviter.
Il semble que, dans certains cas, le DPI ne permette pas d’assurer une naissance indemne de maladie ; c’est le cas quand l’un des parents est homozygote pour une maladie dominante ou les deux parents sont homozygotes pour une maladie récessive.
La question du DPI est traitée par la loi en France, mais des associations posent la question de la conservation ou de la destruction des embryons non sélectionnés pour une fécondation in vitro.
Le Pr George Church, de la Harvard Medical School, département de génétique, a décidé de se lancer dans des recherches visant à modifier le génome des spermatozoïdes humains. Cela permettrait à son avis d’éviter de modifier des embryons.
A l’opposé, le Pr Hank Greely, de la faculté de droit de l’Université de Stanford en Californie, estime qu’avec ces techniques, la société est irrésistiblement entraînée dans un cycle infernal de procréation médicalement assistée (PMA) (57). C’est une question que se posent également les rapporteurs.
2. Essais et applications à travers le monde : un espoir considérable en matière de santé
Les recherches fondées sur l’usage de toutes ces biotechnologies de modification ciblée du génome sont prometteuses et donnent l’espoir de traiter un grand nombre de maladies. D’ailleurs, les demandes d’essais en recherche appliquée (ou clinique) ne cessent de croître et ne concernent plus seulement les maladies rares ou monogéniques, mais aussi le cancer ou le sida. Il faut toutefois rester prudent, car le « tout génétique » est aujourd’hui contesté ; l’OPECST vient d’ailleurs de rendre un rapport sur l’épigénétique (58).
Comme le précisait M. Christian Cottet, directeur général de l’Association française contre les myopathies (AFM), lors de son intervention au cours de l’audition publique de l’OPECST du 27 octobre 2016, environ 7 000 maladies sont rares, dont plus de 80 % ont une origine génétique et monogénique. Les malades sont peu nombreux, mais le nombre de maladies est tel qu’il s’agit d’une véritable question de santé publique. Trois millions de personnes sont concernées en France et 30 millions à l’échelle européenne. La diversité des pathologies est grande. Toutes les fonctions biologiques et tous les organes sont susceptibles d’être affectés par ce type de maladie. La moitié touche des enfants. Une partie est lourdement invalidante, avec un impact sur le pronostic vital qui est variable. Le point le plus dramatiquement remarquable est que 95 à 99 % de ces maladies ne bénéficient à l’heure actuelle d’aucun traitement curatif.
Parmi les maladies génétiques rares, certaines font l’objet de recherches avancées comme la maladie d’Huntington (maladie neurodégénérative héréditaire grave se traduisant principalement par des mouvements anormaux et des troubles du comportement et altérant les capacités physiques et individuelles des individus), la dystrophie de Duchenne (maladie génétique provoquant une dégénérescence progressive de l’ensemble des muscles et de l’organisme) ou la mucoviscidose.
D’autres maladies génétiques concernent, elles, des populations nombreuses : ainsi la drépanocytose (59) et les diverses bêta-thalassémie (60) sont très présentes sur le pourtour méditerranéen (maladies génétiques héréditaires se traduisant par une anomalie des globules rouges et de l’hémoglobine).
Aucun traitement n’a, pour l’instant, été découvert.
Plusieurs équipes de chercheurs se sont penchées aussi sur la maladie deParkinson, sur la maladie d’Alzheimer qui touche entre 800 000 et 900 000 personnes et causent 100 000 décès par an en France, sur les cancers, sur le sida, sur le diabète et l’amaurose ou atrophie de Leber (entraînant une cécité).
Les travaux sur l’infertilité tentent de trouver une solution thérapeutique aux personnes devenues stériles à cause d’un traitement contre le cancer ou à améliorer le taux de réussite de l’implantation d’embryons. On peut aussi imaginer que ces découvertes permettront de développer des moyens contraceptifs plus efficaces pour permettre le contrôle des naissances.
a. Essais cliniques en cours ou envisagés utilisant la modification ciblée du génome
Le tableau présenté ci-après, qui n’est naturellement pas exhaustif, présente certains des essais cliniques utilisant les modifications ciblées du génome hors techniques CRISPR-Cas9.
ESSAIS CLINIQUES ET APPLICATIONS EN COURS (PHASE I À II)
OU ENVISAGÉES (2017-2018) AVEC MODIFICATION CIBLÉE DU GÉNOME
Utilisations |
Sociétés |
Protection des cellules contre l’infection du Sida |
Sangamo BioSciences, États-Unis (phase II) |
Cellule T – immunothérapie |
Cellectis, France (phase I), Université du Sichuan, Chine (phase I), Université de Pennsylvanie, États-Unis (2017) |
Hémophilie - Syndrome de Hurler |
Sangamo BioSciences, États-Unis (phase I) |
Amaurose congénitale de Leber |
Editas, États-Unis (2017) |
Drépanocytose |
CRISPR Therapeutics, États-Unis (2017) |
Hépatites |
Intellia Therapeutics, États-Unis (2017-2018) |
Source : Pr. Charles Gersbach, conférence Olivier Legrain « Sciences et Société, 17 janvier 2017.
L’entreprise américaine Sangamo Biosciences utilise les nucléases à doigt de zinc sur les cellules souches et la modification de cellules immunitaires à des fins thérapeutiques
La question de la disponibilité des nouveaux traitements est essentielle pour les patients. Mais ils doivent suivre les protocoles de test et de validation, avec les phases précliniques et cliniques (I et II) comme pour les autres traitements, sauf dans le cas d’un « usage compassionnel ».
b. Une application sur l’homme réussie par la technique des TALEN : le cas de Layla
En 2015, le London’s Great Ormond Street Hospital a été autorisé à administrer un traitement compassionnel à une petite fille Layla, âgée d’un an et atteinte d’une leucémie incurable.
Selon le règlement européen n° 726/2004 (titre V, article 83.2), « l’usage compassionnel » peut être envisagé pour un « groupe de patient souffrant d’une maladie invalidante, chronique ou grave, ou d’une maladie considérée comme mettant la vie en danger, ces patients ne pouvant pas être traités de manière satisfaisante par un médicament autorisé ». Ces médicaments sont alors utilisés seulement si une demande de mise sur le marché a été effectuée au préalable, ou s’ils sont issus d’essais cliniques en cours. La plupart des États membres de l’Union européenne disposent d’un système spécial pour permettre l’accès compassionnel aux médicaments.
Layla souffrait d’une leucémie lymphoblastique aiguë à cellules T (LLA-T) récidivante (relapsed acute lymphoblastic leukaemia – ALL). La leucémie était résistante à tous les traitements. N’ayant plus assez de cellules-T autologues, ce sont des cellules-T étrangères du nom d’« UCART 19 » (Universal Chimeric Antigen Receptor T cells. génétiquement modifiées à l’aide de la technologie TALEN mise au point par l’entreprise française Cellectis (technologie CAR-T) qui lui ont été injectées.
Ces cellules UCART 19 avaient été soumises à des modifications pour leur permettre, une fois administrées, de cibler des antigènes spécifiques des cellules cancéreuses du receveur notamment par la suppression des gènes immunitaires ou l’ajout de gène codant pour un récepteur qui cible l’antigène CD 19 sur les cellules cancéreuses du receveur
Ces cellules ont été injectées par voie intraveineuse, en une seule fois (1 millilitre, avec une procédure simple ne durant que dix minutes). Puis Layla a subi une chimiothérapie pendant trois mois au cours desquels elle fut placée dans une bulle ; après ces trois mois, une greffe de moelle osseuse a détruit les cellules UCART 19 allogéniques. La patiente n’a donc a priori plus de cellules génétiquement modifiées dans son organisme. Il semble que le traitement ait montré très rapidement son efficacité
Mais ce traitement compassionnel, même réussi, ne donne pas l’autorisation de lancer sur le marché un nouveau produit de santé. Celui-ci doit suivre le processus habituel des essais cliniques de phase 1 (safety) qui ont été lancés au Royaume-Uni dans le courant de l’année 2016 sur une petite dizaine de patients.
Le Royaume-Uni dispose pourtant d’une des législations nationales les plus souples qui a même été modifiée en 2015 pour permettre le transfert mitochondrial (61), ce qui n’est pas possible ailleurs. Ce point sera étudié un peu plus tard dans le présent rapport.
c. Recherches en matière de maladies utilisant CRISPR-Cas9
La facilité d’utilisation de CRISPR-Cas9 et son faible coût ont incité de nombreux chercheurs, universitaires ou dans des laboratoires privés à travailler sur les maladies actuellement sans solution thérapeutique.
La liste du tableau ci-après n’est pas exhaustive et correspond aux exemples cités lors des auditions effectuées par les rapporteurs (mentionnées entre parenthèse) (62).
• Les maladies potentiellement soignables
LISTE DE MALADIES SUSCEPTIBLES DE POUVOIR
ÊTRE TRAITÉES DANS L’AVENIR AVEC CRISPR-CAS9
Catégorie |
Maladie |
Maladies monogéniques |
Bêta-thalassémie (OMS, CRISPR-Therapeutics, Editas) ; Drépanocytose (OMS, Allemagne) ; Myopathie de Duchenne (maladies musculaires, Allemagne) ; Anémie de Fanconi (Allemagne) ; Athérosclérose (Allemagne) |
Maladies de l’œil |
Amaurose congénitale de Leber (Editas) ; Dégénérescence maculaire liée à l’âge (Allemagne) |
Maladies neuro-dégénératives |
Parkinson (Suisse, CRISPR-Therapeutics, UCSD) ; Alzheimer (Suisse, Allemagne, Royaume-Uni, Editas, UCSD) ; Maladie de Huntington (Suisse, Royaume-Uni, Editas, Mme Jenifer Doudna, M. Hank Greely) |
Maladies métaboliques multifactorielles |
Diabète (dont le diabète de type 2) (UCSF, Helmholtz Zentrum) ; Obésité (UCSF) |
Maladies intestinales et infectieuses |
Syndrome de Guillain-Barré (Fiocruz) |
Maladies à transmission vectorielle |
Zika (Royaume-Uni, USA, Mme Jenifer Doudna, M. Joao Trinidade Marques, Suisse) ; Malaria/Paludisme (Royaume-Uni, UCSD – M. Ethan Bier, M. Valentino Gantz, M. George Church, M. Anthony James, USA, M. Joao Trinidade Marques, Suisse, Allemagne) ; Dengue (M. Joao Trinidade Marques) ; Ebola (M. George Church) ; Maladie de Chagas (M. Marcelo Bozza) |
Cancer |
(Editas, Addgene, M. Ethan Bier, San Francisco, Mme Jenifer Doudna, M. Alex Marson, Allemagne, INCA, FioCruz, CONICET, Suisse, Commission européenne) |
Sida |
(M. Hank Greely, M. Alex Marson, M. Joao Trinidade Marques, Suisse, Royaume-Uni, USA, Allemagne, Brésil) |
Autres * |
Infections virales, immunothérapies, fibroses cystique, aveugle, glaucome, hémophilie, déficience d’enzyme, infection bactériale, immunodéficience, drépanocytose (cellule drépanocytaire), thalassémie, myopathie de Duchenne, épidermolyse bulleuse… |
* Conférence Olivier Legrain Sciences et Société, « L’ingénierie du génome. Entre espoirs et craintes », École normale supérieure, Paris, 17 janvier 2017.
Source : OPECST.
Les premiers essais cliniques sur certaines des maladies du tableau avec sont attendus aux États-Unis en 2017 (notamment cancer et amaurose congénitale de Leber). En Chine, des essais cliniques auraient été effectués en 2016 sur le cancer avec CRISPR-Cas9 (63).
Pour les leucémies à lymphocyte B les essais cliniques réalisés aux États-Unis, sur des patients résistants aux traitements conventionnels, sont très encourageants. On réinjecte aux patients leurs propres lymphocytes avec des cellules CAR-T. Le taux de rémission serait de 90 %, mais il reste bien sûr à étudier les effets secondaires, pouvant provoquer un œdème cérébral.
Les premières demandes d’autorisation de mise sur le marché (AMM) auprès de l’Agence européenne du médicament (EMA) sont attendues (64).
En ce qui concerne les immunothérapies contre le cancer les progrès sont rapides. M. Alex Marson, médecin et chercheur en génomique, université de Californie – San Francisco, estime « que la modification des cellules T avec CRISPR va très vite déboucher ». Il envisage des essais cliniques d’ici un ou deux ans.
• Les médicaments et les coûts
La plupart des experts consultés par les rapporteurs estiment l’arrivée des traitements dans des délais compris entre 5, pour les plus optimistes, 10 ans ou 15 ans, si on tient compte de la durée des essais cliniques, de l’obtention de l’AMM et des 20 ans qui ont été nécessaires pour mettre au point les premiers médicaments issus de la thérapie génique.
Pour certains, le coût des traitements constituera un avantage considérable qui ne pourra qu’être pris en compte.
Ainsi, pour M. Rodger Novak, PDG et fondateur, avec Mme Emmanuelle Charpentier, de CRISPR Therapeutics, le passage de la recherche fondamentale aux essais pourrait se faire courant 2018. L’entreprise a reçu l’autorisation de la FDA (Food and Drug Administration) aux États-Unis, pour utiliser CRISPR-Cas9 sur des patients atteints de bêta-thalassémie. Il est en attente d’un agrément en Allemagne.
Le PDG estime que CRISPR-Cas9 apportera un gain considérable en matière de coût de traitement : une personne atteinte de la drépanocytose a besoin de transfusions au moins six fois par an, ce qui revient à 300 000 dollars chaque année ; avec CRISPR-Cas9, ce sont trente ans de coût de transfusions qui seront gagnés. Pour les maladies rares très coûteuses demandant des remplacements d’enzymes tous les ans, un traitement unique avec CRISPR-Cas9 pourrait également avoir un énorme avantage financier.
M. Jacob Sherkow, Professeur associé, New York Law School, donne même des chiffres : 6 des 10 médicaments les plus vendus aux USA ont été fabriqués à partir d’anticorps monoclonaux et ont produit 52,7 milliards de dollars de revenus en 2015. Il estime que, dans vingt ans, le marché des médicaments découlant de CRISPR pourrait représenter 65 milliards de dollars aux États-Unis, d’autant que la technologie CRISPR apportera une solution aux maladies auto-immunes et aux maladies du sang.
Enfin, M. Rodolphe Barrangou, Professeur associé à l’université de Caroline du Nord, estime que la technologie CRISPR permet d’envisager la production d’antibiotiques du futur (voir les travaux de M. David Bikard à l’Institut Pasteur) …
En matière de santé, ces nouvelles technologies de modification du génome portent un potentiel considérable à moyen terme. Les rapporteurs insistent pour que des faux espoirs ne soient pas donnés trop rapidement aux patients, tant que des modes d’administration des traitements n’ont pas été mis au point et validés.
Cependant, M. Georges Church, volontiers provocateur, que les rapporteurs ont rencontré à Boston, a entrepris un projet de biologie de synthèse dénommé « Human Genome Project – Write », visant à recréer synthétiquement le génome d’un être humain immunisé du cancer et des virus, et pense que c’est une méthode dépassée.
Son projet permettrait potentiellement aux scientifiques de voir quelles séquences génétiques aboutissent à quels traits, processus pathologique ou fonction physiologique. Il pourrait aussi créer le génome de cochons qui permettrait à l’animal de servir de donneur d’organes humains. M. Georges Church a d’ailleurs déjà modifié des cochons avec CRISPR-Cas9 pour produire des organes humains.
Son projet a fait l’objet de débats dans la presse américaine, ce qui a provoqué une controverse dans les milieux scientifiques et dans la presse. « Des chercheurs se prennent pour Dieu », « Est-ce une bonne idée de recréer un génome humain ? », « Qui sera propriétaire du génome synthétique et pourrait en tirer des ressources ? ». Pour des raisons historiques étranges, le génome de référence est celui d’un seul individu, un homme de Buffalo (État de New York). Un tel génome peut-il prétendre représenter l’humanité toute entière ?
3. CRISPR et effets hors cible
Tout au long des auditions, la question des effets hors cible a été évoquée.
La question des effets hors cible (off target), c’est-à-dire les coupures d’ADN qui ne s’effectueraient pas à l’endroit voulu, malgré l’ARN guide, est essentielle car elle valide la « sélectivité » de la technique. Les rapporteurs ont systématiquement posé la question à tous les scientifiques qu’ils ont rencontrés.
Lors des premiers essais en laboratoire, des coupures à des endroits non désirés avaient été constatés, et notamment lors d’un essai mené par une équipe de l’université Sun Yat-Sen à Canton. Ces chercheurs ont modifié pour la première fois des embryons humains en corrigeant le gène de la bêta-thalassémie, une maladie génétique du sang qui provoque des anémies. Cette étude, publiée dans la revue « Protein Cell », a montré des effets hors cible. D’autre part, la communauté s’est inquiétée de la ligne rouge qui avait été franchie en modifiant des cellules germinales chez l’homme, ce qui pourrait avoir des conséquences dangereuses pour les générations suivantes. L’équipe chinoise a répondu que les embryons n’étaient pas viables et que, bien sûr, ils n’avaient jamais envisagé de modifier une cellule germinale pour qu’un caractère soit transmis à la génération suivante. Ces coupures indésirables, dont le nombre dépend de la séquence de la protéine ou de l’ARN guide choisi, sont potentiellement mutagènes. Cependant, en quatre ans de recherches avec CRISPR, la fiabilité de la technique s’est affinée, d’après la quasi-totalité des personnes que nous avons auditionnées, et les effets hors cibles seraient exceptionnels.
Dans la plupart des pays, les chercheurs et scientifiques estiment que les effets hors cibles sont marginaux, seront parfaitement maîtrisés d’ici quelques années et qu’ils ne sont pas supérieurs au taux des mutations naturelles.
La technique a progressé : auparavant avec une seule endonucléase Cas9, l’ADN était coupé deux fois. Maintenant un seul brin est coupé. L’ADN se répare tout seul. En outre, l’usage de deux ARN guides permet d’obtenir plus de spécificités et de précision.
Au Royaume-Uni, il y a consensus pour considérer que la question des effets hors cible sera réglée au moment des essais cliniques.
C’est ce qu’affirme M. Robin Buckle, directeur des programmes scientifiques au Medical Research Council MRC mais aussi M. Robin Lovell-Badge, professeur du laboratoire de biologie des cellules souches et de développement génétique au Francis Crick Institute. Les effets hors cible sont très rares, environ 1 sur 100 000, voire 1 sur 1 million.
Ce ratio permet de poursuivre les recherches sans s’en préoccuper et que ce faible ratio montre que CRISPR pourrait être aussi utilisé sans incidence sur les cellules embryonnaires.
L’Allemagne, pourtant très réticente à la modification ciblée du génome sur l’homme, va dans le même sens. M. Wolfgang Wurst, directeur du centre de recherche allemand pour la santé et l’environnement (HMGU), a constaté peu après, lors des essais sur les souris, aucun effet hors cible dans 99 % des cas.
M. Ralf Kühn, directeur d’un groupe de recherche au centre Max Delbrück de médecine moléculaire, constate lui aussi le faible nombre d’effets hors cible depuis qu’il utilise les nouveaux outils « Cas9 HS » (haute-fidélité).
Mme Emmanuelle Charpentier, que les rapporteurs ont rencontrée à Paris et à Berlin, résume parfaitement l’évaluation des risques d’effets hors cibles lorsqu’elle déclare « l’outil CRISPR-Cas9 ne fait que provoquer des coupures qui se produisent tous les jours au quotidien, par exemple avec l’exposition aux rayons ultraviolets ou au stress. Les efforts menés pour modifier Cas9 permettent à CRISPR-Cas9 de devenir très spécifique et l’utilisation de deux ARN séparés permet d’être plus efficace. En outre il y a moyen, grâce aux tests de toxicologie, au séquençage du génome, de mesurer s’il n’y a pas eu de modifications ailleurs que l’endroit que l’on avait ciblé ».
Tout comme Mme Charpentier, Mme Nicole Déglon, du laboratoire de neurothérapies cellulaires et moléculaires du centre hospitalier universitaire vaudois (Suisse), compare les effets hors cibles de CRISPR à celui de mutations naturelles : 10 000 coupures par jour pour une simple exposition au soleil. Les Suisses comparent aussi la fiabilité de cet outil avec celle d’un traitement médicamenteux. Mme Samia Hurst-Majno, membre de la commission nationale d’éthique dans le domaine de la médecine humaine (Suisse), fait référence à l’acceptabilité des effets secondaires des traitements de chimiothérapie qui pourtant « condamnent les patients en quinze ou vingt ans ».
Aux États-Unis, la problématique des effets hors cible de CRISPR-Cas9 en matière d’application à l’homme semble relever du passé, ou pour le moins en passe d’être résolue.
C’est ce qu’affirme M. George Church. Les méthodes expérimentales et appropriées qui sont maintenant utilisées produisent un nombre très faible d’effets hors cible quasiment indétectables. Ce que confirme Jennifer Doudna.
M. Rodger Novak, CRISPR Therapeutics compare les effets hors cible de CRISPR à ceux de la thérapie génique : ils seraient 10 000 fois moins élevés
M. Rodolphe Barrangou estime aussi que les effets hors cible sont moindres que ceux des autres technologies disponibles. Ils sont particulièrement moins présents sur des génomes compliqués comme le génome humain ou le génome de plantes.
*
* *
Au cours des quinze mois de leur étude, les rapporteurs ont acquis la conviction que la question des effets hors cible de CRISPR-Cas9 avait beaucoup progressé et que cette technologie semblait poser peu de difficultés. Il s’agit d’un processus normal propre à toute technologie naissante. Si la technologie CRISPR-Cas9 est maîtrisée, les effets hors cibles deviennent moins nombreux que les mutations naturelles qui affectent tout organisme vivant et ne seraient de ce fait plus détectables.
Les scientifiques rencontrés par les rapporteurs ont paru plus préoccupés par la vectorisation des traitements dans les différentes parties du corps humain que par les effets hors cible proprement dit.
B. LA DIMENSION ÉTHIQUE DES MODIFICATIONS GÉNIQUES APPLIQUÉES À L’HOMME
Soigner les hommes et les guérir est une quête permanente chez l’homme, dans toutes les civilisations, mais avec les nouvelles biotechnologies, c’est le génome humain qui va être modifié. Tout comme les précédentes thérapies géniques, la modification ciblée du génome humain pose la question éthique de savoir jusqu’où on peut aller dans la modification de l’homme.
Avant de faire un point sur les positions prises par différents pays, il faut au préalable rappeler la distinction entre modification des cellules somatiques et de cellules germinales.
Les cellules germinales et somatiques proviennent des cellules souches embryonnaires. Les cellules germinales sont à l’origine de la formation des cellules reproductrices, ou gamètes, les spermatozoïdes, chez l’homme, et les ovocytes, chez la femme. Les cellules somatiques représentent la totalité des cellules de l’organisme développé, excepté les cellules germinales et les cellules embryonnaires non différenciées.
On trouve les cellules somatiques donc dans les os, les tissus, la peau, les organes ou le sang. Elles peuvent muter, mais elles ne transmettent pas leur modification à une future descendance, ce qui n’est pas le cas pour les cellules germinales. La question éthique qui se pose est donc celle de décider si on peut modifier le génome nucléaire germinal à visée reproductive et transmettre ces modifications de façon héréditaire. A-t-on le droit de modifier la lignée germinale de l’homme ? N’y aura-t-il pas des effets héréditaires non intentionnels et non mesurables dans plusieurs générations?
Inversement, de nombreuses maladies ayant des causes génétiques et étant héréditaires, est-il acceptable de refuser une « réparation » des gènes déficients et éviter ainsi à un patient gravement atteint de transmettre sa maladie à ses descendants ? Certains philosophes vont même plus loin, puisqu’ils indiquent que, dans la mesure où la médecine a fait des progrès pour atténuer les effets de maladie génétique, que certains porteurs de gènes de maladie héréditaires qui seraient morts sans procréer, donc sans transmettre le gène d’une maladie peuvent maintenant procréer et « alourdir » l’héritage génétique de l’humanité et que la correction d’un gène transmissible permettrait d’éviter cette dérive génétique.
Les rapporteurs ont constaté tout au long de leurs entretiens un consensus auprès de quasiment tous leurs interlocuteurs : il est actuellement hors de question de modifier des cellules germinales de l’homme. Une divergence s’exprime entre ceux qui souhaitent un moratoire sur la modification des cellules germinales et ceux qui pensent que la recherche doit être autorisée. D’autres justifient toute interdiction en disant qu’il n’y a aucun besoin en terme médical, puisque le cas de transmission de graves maladies héréditaires serait évité en utilisant le DPI.
Ceux-là pensent que la question de l’intervention sur l’homme devra être reposée dans quinze ou vingt ans, lorsque la modification ciblée du génome aura montré son efficacité sur les maladies génétiques, les maladies rares, le cancer… Devra-t-on alors continuer à interdire toute modification des cellules germinales alors que la médecine pourrait permettre d’empêcher que des maladies invalidantes soient transmises aux générations futures et peut être d’éradiquer certaines ?
Les multiples entretiens menés sont intégrés en annexe au présent rapport. Cette partie résume les positions de différents pays.
1. L’interdiction française d’intervenir sur les cellules germinales doit demeurer intangible, mais les recherches doivent se poursuivre
Comme l’a indiqué M. Jean-Claude Ameisen, son président, lors de l’audition publique de l’OPECST du 7 avril 2016, le Comité consultatif national d’éthique pour les sciences de la vie et la santé (CCNE) a créé un groupe de travail sur « Les questions éthiques soulevées par les nouvelles techniques d’ingénierie génomique.
L’INSERM et l’Académie nationale de médecine ont aussi travaillé sur les aspects éthiques de la modification du génome humain.
a. Les recommandations du comité d’éthique de l’INSERM ont évolué à l’aune des avancées des techniques
Le PDG de l’Institut national de la santé et de la recherche médicale (INSERM), M. Yves Lévy, a saisi en juin 2015 son comité d’éthique sur ces questions. Ce comité d’éthique, présidé par M. Hervé Chneiweiss, a publié, en février 2016, une note initiale (65) décrivant le système CRISPR-Cas9 et formulant cinq recommandations par lesquelles il : encourage la recherche ; appelle au respect des règles de confinement et à la création de mesures de réversibilité ; rappelle l’interdiction de toute modification du génome nucléaire germinal à visée reproductive dans l’espèce humaine ; propose de participer à toute initiative nationale ou internationale sans restriction de nationalité ; attire l’attention sur les questions éthiques et philosophiques.
Le comité d’éthique de l’INSERM a ensuite organisé, en mars 2016, une réunion des principaux experts européens sur le thème « Encourager la recherche responsable avec CRISPR-Cas9 », à laquelle les rapporteurs ont participé, et qui a permis aux chercheurs de l’INSERM d’échanger leurs réflexions avec d’autres scientifiques français et étranger (66).
Dans une nouvelle prise de position de novembre 2016 sur le développement de la technologie CRISPR-Cas9, cette fois-ci dans une perspective européenne, le comité d’éthique, sous la signature entre autres de MM. Yves Lévy, François Hirsch et Hervé Chneiweiss, avec l’appui d’un certain nombre d’autres scientifiques européens, rappelle les problèmes éthiques et sociétaux relatifs à la recherche sur la modification ciblée du génome (67).
Il propose de rester opposé à toute demande de modification des règles de l’article 13 de la convention d’Oviedo (68), mais d’adapter l’interdiction de toute application clinique comportant des modifications génétiques sur la lignée germinale, au cas par cas pour un nombre réduit de maladies génétiques
– par exemple, pour la maladie de Huntington – et suggère de mettre en place un comité de pilotage européen. Il entend promouvoir un débat ouvert sur les aspects sociétaux, avant une nécessaire déclinaison dans les législations nationales et internationales.
b. L’Académie nationale de médecine française souhaite le développement de la recherche y compris sur les cellules germinales
L’Académie de médecine a adopté, en avril 2016, un rapport sur « Les modifications du génome des cellules germinales et de l’embryon humains » (69). Elle a formulé quatre recommandations :
– le maintien de la législation actuelle interdisant toute intervention sur la structure de l’ADN ayant pour conséquence de modifier le génome de la descendance ;
– le développement de la recherche utilisant les technologies permettant la modification ciblée du génome, y compris sur les cellules germinales et l’embryon humain ;
– l’adaptation des textes nécessaires au développement de ces recherches en France et en Europe, concernant en particulier l’interdiction de créer des embryons transgéniques, étant entendu que les embryons ainsi modifies ne donneront pas lieu à un transfert dans l’utérus en l’état actuel des connaissances et de la législation ;
– l’ouverture d’une réflexion pluridisciplinaire sur les questions posées par les techniques pouvant modifier de manière ciblée le génome germinal et embryonnaire, ce sujet devant être traite dans le cadre d’un débat plus large portant sur l’ensemble des technologies et interventions médicales réalisées lors de de l’assistance médicale à la procréation et pouvant avoir des conséquences sur le génome des enfants à naitre et éventuellement sur celui des générations suivantes.
c. Certaines associations comme Alliance Vita réclament un moratoire sur la recherche fondamentale sur les cellules germinales
Le Dr Blanche Streb a participé aux deux auditions publiques de l’OPECST du 7 avril et du 27 octobre 2016, pour y exprimer les positions (70) de l’association Alliance Vita, qui réclame un moratoire sur recherches fondamentales sur les cellules germinales (embryons et gamètes) pouvant devenir des recherches appliquées dans un futur proche. Pour l’association, chaque individu est unique, par conséquent le génome humain est singulier et propre à chacun, aucun essai préalable ne peut être validé pour des essais cliniques et applicables par la suite.
2. Les positions des autres pays et des organisations internationales
Les questions éthiques relatives aux thérapies géniques se posent de façon différente dans chaque pays. De nombreuses institutions ont lancé des réflexions et des comités éthiques sur ce sujet en 2016.
a. La Commission européenne : pas de moratoire sur la recherche fondamentale
Dans l’Union européenne, les règles éthiques sont de la compétence des États membres. La Commission européenne, cependant, gère les financements des programmes cadres de recherche et de développement (PCRD) et, dans ce contexte, a édicté certaines conditions éthiques pour en bénéficier. Il s’agit du programme Horizon 2020 qui fixe des principes éthiques à la recherche et exclut des financements les activités de recherche interdites dans l’ensemble des États membres comme le clonage humain à des fins de reproduction et la création d’embryons humains uniquement à des fins de recherche (71).
M. David Gancberg, responsable de projets scientifiques et techniques, direction générale de la recherche et de l’innovation (DG RTD), à la Commission européenne, déclare qu’il est contre un moratoire sur la recherche. Celle-ci ne se fait pas en Europe, elle se fera ailleurs. Le tourisme médical deviendra alors inévitable, comme existe aujourd’hui un tourisme procréactif. En Europe, il faut se fixer des règles et avancer.
En outre, la Commission européenne a développé une réflexion éthique horizontale au sein du groupe européen d’éthique en sciences et dans les nouvelles technologies (GEE) (72) en place depuis 26 ans, pour analyser l’ensemble des questions sociétales, éthiques, scientifiques et technologiques bioéthiques et biomédicaux.
Le (GEE) a publié trois documents sur les biotechnologies : déclaration (2016) sur « La modification ciblée des gènes (gene editing) » ; avis (2015) sur « Les enjeux éthiques des nouvelles technologies de la santé et la participation des citoyens » ; et avis (2009) sur « L’éthique de la biologie de synthèse ».
Sa déclaration de 2016 fait suite au vote au Royaume-Uni en février 2015 autorisant l’utilisation clinique du transfert mitochondrial. Le GEE explique l’importance de distinguer les interventions sur les cellules somatiques et germinales, et estime qu’il devrait y avoir un moratoire sur la recherche appliquée clinique sur la modification génétique ciblée (gene editing) d’embryons humains ou de gamètes.
La modification de la lignée germinale n’en est encore qu’à ses débuts et il y a de nombreux et importants obstacles techniques à surmonter avant que les applications cliniques deviennent une réalité viable. La question est de savoir si – oui ou non – l’ingénierie de la lignée germinale d’embryons humains serait suffisamment précise pour garantir que la transmission aux générations futures ne concerne que le seul gène ciblé et si elle serait acceptable pour le public.
b. Au Royaume-Uni : le pays européen le plus permissif
Le Royaume-Uni est sans doute l’État membre de l’Union européenne le plus permissif en matière d’éthique médicale. Les positions du parlement et du gouvernement britanniques reflètent bien l’état de l’opinion publique, très largement favorable aux avancées de la médecine génomique. Le Royaume-Uni n’a d’ailleurs pas ratifié la convention d’Oviedo (73), car il l’estime trop restrictive. Les experts britanniques rencontrés par les rapporteurs ont cependant souligné que la législation britannique, même permissive, était très précise, contrairement à la législation américaine, également permissive, mais établissant seulement des principes généraux et laissant une grande place pour les décisions au cas par cas. Le Royaume-Uni doit cependant tenir compte des positions de ses différentes communautés religieuses, très influentes et écoutées : Église anglicane, le conseil musulman, le consistoire juif…
Plusieurs institutions britanniques laïques ont pris publiquement position sur la modification ciblée du génome dans un contexte de médecine humaine. Le Hinxton Group souligne l’importance de continuer les recherches, y compris sur la modification des cellules germinales, mais recommande de ne pas encore passer à la phase clinique pour les interventions sur les cellules germinales dans le cadre thérapeutique de la procréation assistée (74).
Le Conseil de la recherche en biotechnologies et sciences biologiques (BBSRC), un groupe de conseil britannique sur les recherches scientifiques, soutient également les recherches utilisant CRISPR-Cas9, sur les cellules reproductives humaines ou sur des embryons humains, validée scientifiquement et éthiquement, sans modification de la loi de 2008, mais rappelle qu’une modification génétique transmise aux générations futures n’est, pour l’instant, pas permise au Royaume-Uni (75).
L’Académie de médecine britannique et une dizaine d’autres institutions ont publié une déclaration commune où elles rappellent que les thérapies géniques existent depuis plusieurs décennies et soutiennent la recherche sur la modification ciblée du génome humain, en soulignant que ces avancées médicales considérables feront progresser les lois vers plus de permissivité.
Une déclaration commune avait été signée le 2 septembre 2015 par l’Académie des sciences médicales, l’association de la recherche médicale, la recherche contre le cancer au Royaume-Uni, la BBSRC, le conseil de recherche de médecine, le programme d’éducation, le Wellcome Trust et l’Institut Sanger rattaché au Wellcome Trust. Cette déclaration veut permettre une discussion sur la modification ciblée du génome humain et ce qui en découle. Les signataires précisent que le concept n’est pas nouveau. L’arrivée de CRISPR-Cas9 rend la manipulation plus fiable et plus précise. Si l’utilisation sur des cellules somatiques (pour des enfants ou adultes) ne pose pas de problème, le débat doit porter sur les cellules germinales, au stade embryonnaire, la loi britannique autorisant les recherches sur des embryons jusqu’à 14 jours.
Ces recherches permettent de mieux comprendre le développement du processus biologique, la santé et les maladies génétiques, et d’avoir un impact significatif dans la médecine du futur, pour guérir ou prévenir des cancers, modifier ou éradiquer des gènes en mutation. C’est ainsi que les lois progresseront vers plus de permissivité.
c. L’Allemagne reste très conservatrice mais souhaite un débat de fond
Comme le Royaume-Uni, l’Allemagne n’a pas ratifié la convention d’Oviedo, mais pour des raisons opposées, parce qu’elle estime que cette convention n’est pas assez restrictive en matière d’éthique médicale ; sans doute faut-il y voir le poids de l’histoire, avec les idées eugénistes de sombre mémoire, développées et mises en pratique par les nazis.
La modification de la lignée germinale est interdite par la section 5 de la loi allemande sur la protection de l’embryon, dont le législateur a établi l’irréversibilité lors de la phase d’essai. Les débats au Bundestag sur ces sujets éthiques transcendent les partis politiques.
En Allemagne, le diagnostic préimplantatoire (DPI) était initialement interdit par la loi de protection des embryons, avec des sanctions pénales en cas d’infraction. Mais en 2010 la Cour constitutionnelle de Karlsruhe a jugé que le médecin qui s’est dénoncé lui-même pour avoir pratiqué un DPI ne devait pas être condamné. La loi, modifiée l’année suivante, autorise le DPI pour des familles lourdement touchées, dans des cas graves et isolés après qu’une commission ait donné son accord. Le débat actuel sur la modification ciblée du génome a fait évoluer les camps et les argumentaires : le DPI suffit et il n’est donc pas nécessaire de mener des recherches pour modifier le génome. En Allemagne les embryons surnuméraires des fécondations in vitro (FIV) ne peuvent ni être donnés à la recherche, ni détruits, mais des embryons peuvent être importés ! La discussion au sein de la société rejoint une la réflexion déjà évoquée : faut-il ou non épargner une souffrance à des parents qui vont transmettre à leurs enfants une maladie génétique grave (grâce au DPI ou à la modification ciblée du génome) ?
Plusieurs institutions se sont prononcées publiquement. Comme le Comité d’éthique (Deutschen Ethikrat) (76), les Académies des sciences et des technologies s’opposent à la modification de la loi, soutiennent un moratoire international en raison de l’impact que pourraient avoir les modifications sur la lignée germinale humaine et réclament un débat public.
L’Allemagne étant un pays fédéral, les länder de Berlin et Brandebourg ont leur propre académie des sciences (Berlin-Brandenburgische Akademie der Wissenschaften – BBAW qui elle aussi a un groupe de travail interdisciplinaire qui, régulièrement, propose des recommandations et présente ses résultats (77). Les questions concernant les applications possibles de l’ingénierie génétique permettant potentiellement d’accroître l’économie sont posées, tout comme les risques potentiels sur la santé, l’environnement et la cohésion sociale. Le troisième rapport du groupe de travail interdisciplinaire de la BBAW sur « La technologie génétique » analyse un secteur de pointe en Allemagne et accepte la recherche sur la thérapie des gènes des cellules somatiques et des cellules souches dans certains cas seulement, notamment pour traiter les globules et effectuer une transplantation. L’intervention sur la lignée germinale était en cours de discussion.
Dans un autre rapport de 2015 sur « La chirurgie du génome humain : vers une évolution responsable des nouvelles technologies » (78), legroupe de travail expliquait que les nouvelles méthodes de chirurgie dépendaient avant tout du contexte et non du but. Ainsi, une clarification sur les risques et les applications des nouvelles technologies doit être une priorité pour la sécurité. Le moratoire sur les expérimentations sur la lignée germinale humaine invite à débattre plus largement sur les enjeux éthiques et juridiques en lien avec la thérapie sur la lignée germinale.
Les rapporteurs ont également entendu des représentants de la société civile. Parmi ceux-ci, M. Christof Potthof, membre du Réseau pour l’éthique génétique (Gen-ethisches Netwerk e.V.), se prononce pour une interdiction des biotechnologies appliquées à la médecine humaine, au motif qu’elles seraient discriminatoires envers les personnes handicapées, une discrimination s’instaurerait entre des maladies génétiques qualifiées de viables et celles qui ne le seraient pas. D’après M. Potthof, CRISPR ou d’autres technologies de procréation, comme le DPI, peuvent être dangereuses, car on ne connait pas ses effets (79).
Les Allemands sont toutefois conscients que les recherches qui ne pourraient être faites en Allemagne le seront au Royaume-Uni ou en Suède, voire en Asie.
d. Suisse : recherches interdites sur embryons et cellules germinales
Les réflexions en cours en Suisse ont pour but d’aboutir à un débat public (80). La constitution et loi fédérale sur la procréation médicalement assistée interdisent les recherches et les interventions sur le patrimoine génétique des cellules germinales et des embryons.
La Commission nationale d’éthique dans le domaine de la médecine humaine (CNE) a publié en septembre 2016 un rapport intitulé : « Genome editing sur les embryons humains - état des lieux » (81). Elle a considéré la technique CRISPR-Cas9 comme une révolution pour les scientifiques, incitant à réfléchir aux usages de cette dernière dans le cadre de recherche fondamentale, préclinique et les applications cliniques possibles. Par ailleurs, l’application à des buts de thérapie somatique et la modification génétique ciblée de la lignée germinale sont également abordées.
La CNE indique qu’un débat public « intensif, critique, ouvert et transparent » est nécessaire. Le cadre juridique actuel interdit les interventions dans le patrimoine génétique des cellules germinales et des embryons (art. 119, al. 2, let. a, constitution ; art. 35, loi fédérale sur la procréation médicalement assistée – LPMA). Une partie de la commission est favorable au maintien absolu d’une interdiction Une autre partie reconnaît la nécessité d’un moratoire sur les interventions dans la lignée germinale, pour clarifier tout particulièrement les risques médicaux et les questions éthiques et pour réfléchir à une utilisation responsable du gene editing sur des embryons. Enfin, une autre partie de la commission veut exclure du moratoire la recherche fondamentale sur la lignée germinale embryonnaire.
Pour M. Yvan Arsenijevic, chef de l’unité de thérapie génique et de biologie des cellules souches au service ophtalmologie de l’université de Lausanne, les thérapies géniques pour soigner des maladies sont bien acceptées. Les gens font la distinction entre leur santé et leur alimentation, tant que cela reste destiné aux cellules somatiques. Les individus sont considérés comme soignés et non comme génétiquement modifiés. Par contre, le tabou demeure pour toute modification au niveau germinal et à celui des gamètes.
M. Patrick Linder, président de la plateforme « biologie » de l’Académie suisse des sciences naturelles (SCNAT), l’interdiction de ces techniques engendrerait la mise en place d’un tourisme médical, et elle sera faite ailleurs avec encore moins de contrôle.
e. États-Unis : pas de moratoire, mais une autorégulation
Comme cela a été dit, c’est aux États-Unis que s’est tenu le premier sommet international sur la modification ciblée des gènes humains (human gene editing), organisée par les académies des sciences américaine, chinoise et britannique à Washington en décembre 2015. La déclaration finale encourageait largement la recherche mais recommandait un moratoire sur les modifications de la lignée germinale de l’homme.
Les rapporteurs ont rencontré un grand nombre de scientifiques aux États-Unis qui très largement sont favorables à la continuation des recherches sur les modifications ciblées du génome, y compris sur les cellules germinales humaines. Un très large consensus existe cependant pour, à ce stade, s’interdire de modifier la lignée germinale humaine, sur la base d’une autorégulation et non d’une législation contraignante
Mme Jennifer Doudna, pense qu’un jour on pourra corriger les anomalies du génome d’une cellule en formation, pour l’implanter dans une cellule germinale humaine. Si les résultats des recherches sont encourageants, la pression montera de différentes parts pour l’utiliser au niveau clinique. Elle a reçu elle-même des messages électroniques de personnes qui souffrent de maladies génétiques. CRISPR est une technologie puissante qu’il faut considérer avec sérieux avant de passer à son application clinique. Elle et ses collègues n’ont pas voulu utiliser le mot moratoire, car cela aurait signifié une réglementation difficile de faire respecter au niveau international. Les cultures, les droits sont différents sur les différents continents.
M. Rodolphe Barrangou, estime que le seul facteur limitant au niveau technique tient dans l’imagination de l’utilisateur de CRISPR. C’est pourquoi ‘il faut établir des règles qui donneront des limites aux scientifiques qui ne sauraient pas s’en donner eux-mêmes.
M. Ralph Cicerone, président de l’Académie des sciences américaine (82), résume ainsi la position de l’Académie : pas de moratoire sur la recherche tant que sont prises en compte les considérations éthiques ; il faut pouvoir continuer la recherche sur les cellules germinales, les cellules somatiques et la thérapie génique. Il pense que la communauté scientifique souhaite que la recherche soit autorégulée
Certains vont plus loin comme M. Hank Greely, Professeur de droit, université de Californie – Stanford, qui ne croit pas que la modification de la lignée germinale de l’homme soit un problème s’il s’agit de traiter des maladies. Les problèmes résident dans la sécurité de ces procédés et dans les limites que l’on se fixe, médecine ou amélioration des capacités de l’homme. Mais il ne croit pas qu’on ait besoin de modifier les cellules germinales, le diagnostic préimplantatoire (DPI) aboutit au même résultat. Dans son livre intitulé « La fin du sexe et le futur de la reproduction humaine » qu’il publié en 2016, il estime que l’on pourra à terme se passer de relations sexuelles pour donner la vie à un être humain, en utilisant des cellules souches pluripotentes induites et en les transformant en ovules. L’émergence des nouvelles technologies et techniques, le diagnostic préimplantatoire (DPI) et de la fécondation in vitro (FIV) ont déjà permis de procréer l’enfant à partir d’un embryon ex vivo. Cette procédure sera par ailleurs sûre, légale et surtout gratuite. Cela permettra d’éviter des maladies. Il conclut : « Poussée par des forces économiques, sociales, juridiques et politiques, cette science émergente a transformé les préoccupations de ce qui était de la science-fiction en des problèmes réels que nos enfants et petits-enfants devront affronter quotidiennement ».
Pour M. Bill Foster, parlementaire de la Chambre des Représentants (Illinois, démocrate), il faut établir un principe visant à maintenir une égalité d’accès à ces technologies d’édition de génome. Une entreprise qui traitera un milliardaire devrait contribuer financièrement pour l’accès de cette technique à au moins quatre familles qui n’en ont pas les moyens. Aux États-Unis, cela deviendra très rapidement une industrie milliardaire qui aura des lobbyistes très puissants pour s’adresser aux politiques.
Par contre, certains ont émis des positions divergentes, tel M. Michael Kalichman, co-fondateur du Center for ethics in science and technology, et Mme Mary Devereaux, bioéthicienne et directrice adjointe du Research ethics program, université de Californie – San Diego, qui estiment qu’il n’est pas souhaitable d’intervenir dans ces domaines tant que la science ne sera pas sûre.
f. Brésil : une commission pour évaluer les recherches
Sans être à la pointe des thérapies géniques humaines, le Brésil n’en est pas pour autant absent. Deux agences de régulation au Brésil interviennent dans les biotechnologies appliquées à la médecine humaine :
– l’Agence nationale de vigilance sanitaire (ANVISA), compétente pour les traitements médicaux et les médicaments ;
– la Commission nationale d’éthique de la recherche (CONEP), compétente pour les questions d’éthique en matière de santé humaine.
Le ministère brésilien de la santé considère la technique novatrice CRISPR-Cas9 comme un point d’inflexion technologique dû à son potentiel scientifique élevé. Il s’agit d’une technique considérée d’extrême importance pour l’avancement de la science qui exige des précautions éthiques. Le Brésil dispose d’un cadre juridique pour l’usage de cellules souches embryonnaires à de fins scientifiques et thérapeutiques, basées sur des normes de sécurité, des mécanismes de vérification et des principes éthiques.
S’agissant d’éthique, la résolution de 2012 du Conseil national de santé souligne que tout projet de recherche en génétique doit être évalué par la Commission nationale d’éthique en recherche (CONEP), instance suprême de régulation d’éthique dans le pays. La précaution, la non-malfaisance, la dignité de la personne humaine et la protection sont parmi les principes bioéthiques qui sont pris en compte dans l’analyse éthique de toute manipulation génétique, en raison de la possibilité d’effets indésirables et imprévus.
Ce parcours des positions dans différents pays montre que la question qui se pose aujourd’hui concerne seulement la recherche sur les cellules germinales.
Les rapporteurs n’ont pas pu effectuer de mission en Chine. Les informations transmises par le service pour la science et la technique (SST) de l’ambassade de France en Chine, jointes à celles publiées dans la presse, montrent que ce pays est, avec les États-Unis, le plus avancé dans l’utilisation des nouvelles thérapies géniques, et ceci particulièrement depuis l’invention de CRISPR-Cas9.
En Chine, la technique de modification ciblée (edition) de gènes par le système CRISPR-Cas9 a été utilisée par une équipe de l’université Sun Yat-Sen de Canton (voir plus haut).
Les commentaires publiés ultérieurement dans la revue Nature ont souligné que l’utilisation de la technique TALEN allait sans aucun doute permettre à ces chercheurs de contourner les difficultés techniques qu’ils ont rencontrées. Au moins quatre équipes chinoises travaillent sur l’édition de gènes dans des embryons humains.
La revue Nature a ensuite annoncé, le 15 novembre 2016, dans un article précité intitulé « La modification ciblée de gènes par CRISPR testée chez une personne pour la première fois : le mouvement des scientifiques chinois pourrait déclencher un duel biomédical entre la Chine et les États-Unis ». La revue relate qu’un groupe chinois est devenu le premier à injecter à une personne des cellules qui contiennent des gènes modifiés de façon ciblée à l’aide de la technique révolutionnaire CRISPR-Cas9. En octobre 2016, une équipe dirigée par l’oncologue Lu You à l’université du Sichuan à Chengdu a injecté les cellules modifiées à un patient atteint d’un cancer du poumon agressif, dans le cadre d’un essai clinique.
La Chine est une source d’inquiétude en raison de l’existence d’entreprises de biotechnologies conjuguant moyens financiers importants et absence de contraintes éthiques. M. Xu Xiao-Chun, Professeur à l’université de Pékin, possède la plus grosse banque de cellules souches de Chine (Boyalife à Wuxi). Celle-ci est impliquée dans tous les aspects du clonage thérapeutique et du clonage reproductif d’espèces disparues ou domestiques.
3. Moratoire ou liberté de recherche ?
Les avancées scientifiques majeures des biotechnologies, amènent à s’interroger sur la pertinence d’un moratoire sur la recherche, dans l’attente de la définition d’un cadre règlementaire adapté.
La tenue du 1er au 3 décembre 2015 à Washington du sommet international sur la modification du génome humain (International Summit on Human Genome Editing) a montré la monté des craintes outre-Atlantique (83). Comme l’a fait remarquer aux rapporteurs Mme Emmanuelle Charpentier, directrice de l’Institut Max Planck de biologie infectieuse à Berlin, le sommet de Washington de décembre 2015 « recommande » seulement de ne pas modifier la lignée germinale de l’homme, il n’utilise pas le mot « moratoire », il dit même que l’utilisation clinique de la modification ciblée de la lignée germinale devra être réexaminée régulièrement à mesure que les connaissances scientifiques avancent et que les opinions de la société évoluent. Le sommet conclut également à la poursuite des activités de recherche fondamentales et précliniques utilisant les méthodes de modification ciblée du génome sur l’homme.
Le sommet de Washington a été suivi d’une série de réunions (84) dans plusieurs pays. Ainsi, s’est tenue, en avril 2016 à Paris, une réunion des académies des sciences et de médecine de tous les continents, précédée d’une réunion des académies des seuls pays du continent européen.
On se rappelle la conférence d’Asilomar (Californie, États-Unis), en 1975, où les chercheurs américains, européens et soviétiques ont débattu sur les risques et la sûreté des premières expériences de génie génétique. La conférence d’Asilomar fut conclue par l’adoption d’un texte demandant un encadrement strict des expériences de génie génétique, ce qui sera réalisé aux États-Unis et dans le monde. En fonction de la dangerosité estimée de l’expérience envisagée, des mesures de confinement, que l’on jugerait aujourd’hui sévères, étaient proposées. La conférence recommandait le maintien du moratoire sur certaines expériences comme le clonage de gènes de toxines. Le moratoire, un temps imposé, sera levé quelques mois plus tard.
L’utilité de la conférence d’Asilomar est débattue. Certains disent que les scientifiques qui y ont participé ont eu un réflexe éthique salutaire et ont utilisé la durée du moratoire pour réfléchir et assurer la sécurité de leurs travaux. D’autres, plus sceptiques, estiment que ce moratoire temporaire n’a été qu’une manœuvre tactique des chercheurs américains, qui ont voulu un temps geler la recherche partout dans le monde pour s’assurer le dépôt de leurs propres brevets dès sa levée.
Un moratoire volontaire de la communauté scientifique comme celui de la conférence d’Asilomar serait inopérant pour les technologies de type CRISPR-Cas9, en raison de la facilité et du coût réduit de se mise en œuvre. Des sociétés privées commercialisent déjà des kits de fabrication et les sites internet décrivant les expériences sont nombreux. En outre, au vu de l’extrême hétérogénéité des positions des différents pays, un tel moratoire n’aurait aucune chance de s’appliquer de façon uniforme. La Chine, pour ne citer que ce pays, ne dispose pas de législation sur la modification ciblée du génome humain, elle a seulement adopté des lignes directrices (guidelines). Et mêmes ces mesures non contraignantes présentent un problème de contrôle de leur application, les observateurs internationaux estiment tous qu’il est extrêmement difficile de savoir ce qui se fait au fond de telle ou telle région chinoise.
Un moratoire dans un seul pays, en France ou ailleurs, serait encore moins utile. En interdisant les recherches en France, on n’empêcherait pas celles-ci de se développer ailleurs en Europe et dans le monde, mais avec le risque de décrochage de la recherche médicale française. C’est ce qui a déjà commencé à se passer en Allemagne, où des chercheurs se sont expatriés, pour travailler au Royaume-Uni ou aux États-Unis, et au moment de rentrer ont rencontré des difficultés extrêmes à se réinsérer car les recherches qu’ils avaient effectuées étaient interdites dans leur pays d’origine. Sans cultiver le paradoxe, on peut défendre la poursuite de la recherche fondamentale pour, justement, se rendre compte des difficultés et des limites à ne pas franchir.
En outre, le tourisme médical, qui est déjà une réalité en Europe et dans le monde, permettra aux patients de contourner des éventuelles interdictions nationales pour aller se faire soigner dans d’autres pays. On se rappelle les contournements similaires avant 1975 et la légalisation de l’interruption volontaire de grossesse (IVG) en France…
Enfin, d’un point de vue éthique, les rapporteurs rappellent la différence entre, d’une part, thérapie et lutte contre l’infertilité, qu’il faut bien sûr soutenir, et d’autre part, « l’amélioration de l’homme », en application de thèses eugénistes ou transhumanistes qui sont contraires aux valeurs philosophiques et morales les plus communément partagées de par le monde. Tout comme pour le diagnostic préimplantatoire (DPI), les tentations seront fortes pour obtenir des traits qui relèvent plutôt de la science-fiction : taille, couleur des yeux, voire QI… Si en France, les transhumanistes se revendiquent comme un mouvement techno-progressiste qui réfléchit à la société de demain, le transhumanisme américain porté par les « GAFA » (Google, Amazon, Facebook, Apple) soutient les recherches pour proposer un être humain « augmenté » autant physiquement que cognitivement. De l’homme soigné, on est passé à l’homme réparé et certains souhaiteraient que, grâce à l’intelligence artificielle et aux robots, on aille vers l’homme augmenté, qui aurait effacé les limites actuelles qui séparent l’homme de la machine.
Par ailleurs, l’amélioration physique existe déjà avec la chirurgie plastique corrigeant des défauts (du cosmétique à des cas plus graves). En associant la technologie à la médecine, de nouveaux procédés deviennent progressivement possibles, rendant partiellement la vue à des aveugles, fabriquant des membres pour des personnes amputées… Ce progrès est stimulant pour la science et la connaissance médicale, cependant, les dérives sont possibles. Une armée pourrait-elle vouloir des spécificités cognitives et physiques pour ses soldats, engendrant une course au soldat surhomme ? Puis cela pose évidemment la question de l’humanité : qu’entendons-nous par humanisme ? Le post-humanisme ne serait-il déshumanisé ? C’est une question qu’un des rapporteurs (85) aborde dans un rapport qui sera discuté en avril 2017 à l’assemblée parlementaire du Conseil de l’Europe.
*
* *
Sur la dimension éthique des thérapies géniques humaines, les rapporteurs proposent les recommandations suivantes.
La distinction entre recherche et intervention clinique s’impose.
Si l’autorisation des recherches permet de faire avancer la science et doit être acceptée, l’autorisation de traitement clinique ramène à la question de la modification de la lignée germinale de l’homme. La question est semblable à celle qui s’était posée pour la recherche sur les cellules souches et qui a entraîné, en 2013 en France, la modification de la loi de bioéthique.
Recommandation n °2 : Pas de moratoire, oui aux recherches sur les cellules somatiques
– S’oppose à la demande d’un moratoire en matière de recherches sur les biotechnologies de modification ciblée du génome s’appliquant à la médecine humaine. Considérant que pour fixer précisément les limites éthiques aux utilisations potentielles pour l’homme, il faut faire progresser les connaissances ;
– Souhaite qu’une première priorité soit accordée sur fonds publics à la recherche fondamentale et à l’innovation thérapeutique, notamment à la mesure de l’innocuité et de l’efficacité de ces techniques, aux effets hors cibles qui modifieraient un gène non désiré ou qui inséreraient des parties du génome ou des gènes à une mauvaise place ;
– Propose que l’Académie de médecine, le comité éthique de l’Institut national de la santé et de la recherche médicale (INSERM) ainsi que le Comité consultatif national d’éthique (CCNE) soient consultés pour organiser une veille scientifique et médicale sur toutes questions concernant les thérapies géniques et médicales et pour fixer le cadre d’une évaluation des bénéfices et des risques de ces biotechnologies ;
– Recommande que les applications médicales se focalisent sur les modifications des gènes des cellules somatiques, dans la mesure où des thérapies géniques ou des thérapies cellulaires pourraient soigner des maladies génétiques, infectieuses, neurodégénératives, le cancer, le sida ou les maladies du sang ;
– Pense que les biotechnologies ne modifient pas les problématiques de la thérapie cellulaire et de la thérapie génique, car les règles de sécurité et d’éthique en France sont suffisantes. Il n’est pas nécessaire de créer des règles spécifiques pour évaluer ces techniques de modification ciblée du génome humain.
Passons donc à la législation en ce domaine.
C. FAUT-IL MODIFIER LES LÉGISLATIONS ?
Comme pour la dimension éthique, la dimension législative des thérapies géniques humaines est essentiellement de compétence nationale. Il y a donc de grandes différences entre les pays. Partout, les législations relatives à la bioéthique et leur éventuelle modification, font l’objet de débats intenses, qui transcendent les partis politiques.
Un juriste rencontré, M. James Lawford Davies (cabinet Hempsons), résume ainsi la situation mondiale.
Les règlementations peuvent être en trois catégories : restrictive (Israël, France, Europe en général, Canada, Brésil, Australie, Inde, Corée du Sud, Japon) ; intermédiaire (États-Unis, Royaume-Uni) ; et permissive (Chine). Le Royaume-Uni est plutôt permissif mais avec une législation très précise. Les États-Unis sont également permissifs, avec une législation très générale qui est appliquée au cas par cas de façon souple.
Le graphique ci-après, publié par la revue Science, détaille les législations des différents pays en fonction des types d’intervention.
POLITIQUE DE CERTAINS PAYS REPRÉSENTATIFS
SUR LES TECHNOLOGIES LIÉES AU GÉNOME
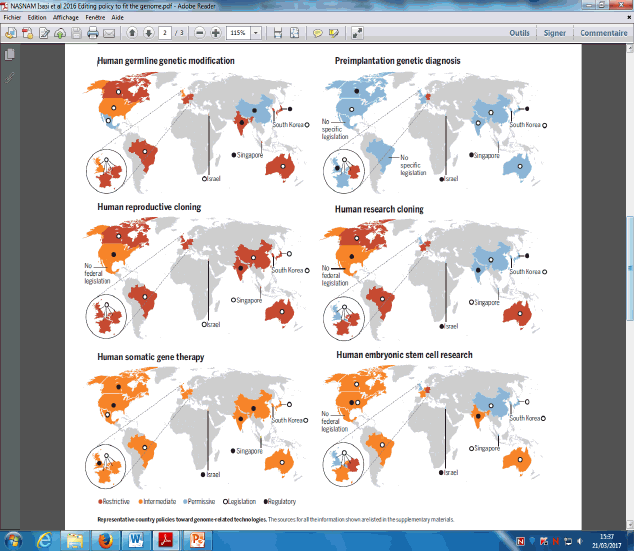
Source: “Editing policy to fit the genome? Framing genome editing policy requires setting thresholds of acceptability”, R. Isasi, E. Kleiderman,B. M. Knoppers, Science, 22 janvier 2006.
Avant de faire le tour des législations, il convient de parler de la convention d’Oviedo déjà évoquée dans les parties précédentes, qui fonde les règles éthiques de nombreux pays.
Le Conseil de l’Europe est la seule organisation qui ait produit un traité juridiquement contraignant au niveau international relatif aux droits de l’homme dans le domaine biomédical, et ses conséquences pour l’être humain, et à souligner la pertinence du cadre établi par la convention sur les droits de l’homme et la biomédecine (STE n° 164, 1997), communément dénommée « convention d’Oviedo » (86). Il comprend un comité de bioéthique, de DH-Bio, qui mène des travaux en matière de protection des droits de l’homme et de la dignité de l’être humain.
La convention d’Oviedo est complétée par quatre protocoles additionnels sur l’interdiction de clonage des êtres humains, sur la transplantation d’organes et de tissus, sur la recherche biomédicale et sur les tests génétiques.
L’article 13 de la convention d’Oviedo interdit toute intervention médicale aboutissant à une modification du génome humain qui serait héréditaire. Elle interdit également toute modification du génome humaine même non héréditaire mais qui ne serait pas justifiée par des raisons préventives, diagnostiques ou thérapeutiques. L’article 18 de la convention d’Oviedo encadre la recherche sur les embryons.
Convention d’Oviedo
Article 13 – Interventions sur le génome humain
Une intervention ayant pour objet de modifier le génome humain ne peut être entreprise que pour des raisons préventives, diagnostiques ou thérapeutiques et seulement si elle n’a pas pour but d’introduire une modification dans le génome de la descendance.
Article 18 – Recherche sur les embryons in vitro
1 Lorsque la recherche sur les embryons in vitro est admise par la loi, celle-ci assure une protection adéquate de l’embryon.
2 La constitution d’embryons humains aux fins de recherche est interdite.
L’article 13 de la convention a le mérite de tracer une ligne jaune à ne pas franchir, mais est sujet à plusieurs difficultés d’interprétation et d’application. D’abord, il est communément admis qu’il n’interdit pas les recherches sur les cellules germinales, même si ce n’est pas explicitement écrit.
Qui plus est, la convention d’Oviedo n’a pas été ratifiée par tous les pays du Conseil de l’Europe. Manquent à l’appel notamment le Royaume-Uni, l’Allemagne, (voir les raisons évoquées dans la partie précédente), l’Autriche, la Belgique, l’Irlande et la Russie. Aucun des pays associés au Conseil de l’Europe ne l’a ratifiée : Australie, Canada, États-Unis, Japon, Mexique et… Saint-Siège. La convention n’est donc pas d’application générale ni en Europe, ni de par le monde.
Les travaux continuent au Conseil de l’Europe (87). Son comité de bioéthique a adopté, le 2 décembre 2015, une déclaration sur les technologies de modification du génome, par laquelle il réaffirme son attachement à l’article 13 de la convention. L’Assemblée parlementaire du Conseil de l’Europe a adopté, le 30 novembre 2015, une proposition de recommandation intitulée « Des êtres humains génétiquement modifiés », par laquelle elle charge sa commission des affaires sociales, de la santé et du développement durable, dont la rapporteure est Mme Petra de Sutter (Belgique), de présenter un rapport à l’assemblée plénière, lors de la session de juin 2017.
Mme Emmanuelle Charpentier, directrice de l’Institut Max Planck de biologie infectieuse, estime qu’ « il est important de respecter strictement la convention d’Oviedo concernant la manipulation des embryons et des cellules germinales et interdisant la modification de la lignée germinale de l’être humain ». Mais cette convention est assez globale et, avec le développement de CRISPR-Cas9, il est urgent de la revisiter en spécifiant et en précisant ses termes, et les conditions dans lesquelles des recherches peuvent être entreprises.
2. Présentation des principales lois françaises sur la bioéthique
Plusieurs lois ont précisé la législation sur la bioéthique
• En 1994, trois lois ont été promulguées :
– loi n° 94-548 du 1er juillet 1994 relative au traitement des données nominatives ayant pour fin la recherche dans le domaine de la santé et modifiant la loi n° 78-17 du 6 janvier 1978 relative à l’informatique, aux fichiers et aux libertés ;
– loi n° 94-653 du 29 juillet 1994 relative au respect du corps humain ;
– loi n° 94-654 du 29 juillet 1994 relative au don et à l’utilisation des éléments et produits du corps humain, à l’assistance médicale à la procréation et au diagnostic prénatal. C’est cette dernière loi qui a fait l’objet d’une révision en 2004.
Les lois de bioéthique de 1994 recouvraient à la fois l’affirmation des principes généraux de protection de la personne humaine qui ont été introduits notamment dans le code civil, les règles d’organisation de secteurs d’activités médicales en plein développement tels que ceux de l’assistance médicale à la procréation ou de greffes ainsi que des dispositions relevant du domaine de la santé publique ou de la protection des personnes se prêtant à des recherches médicales.
• La loi n° 2004-800 du 6 août 2004 relative à la bioéthique :
– précise le cadre juridique dans le domaine de la thérapie cellulaire est mis en place ;
– interdit le clonage, reproductif ou thérapeutique ;
– interdit sauf dérogation la recherche sur l’embryon et les cellules embryonnaires. Par dérogation, les recherches peuvent être autorisées, pour une période limitée à cinq ans si « elles sont susceptibles de permettre des progrès thérapeutiques majeurs » ;
– élargit le cercle des personnes pouvant procéder à un don d’organe pour une greffe ;
– autorise la brevetabilité pour « une invention constituant l’application technique d’une fonction d’un élément du corps humain » ;
– crée l’Agence de la biomédecine (ABM) ;
– étend aux exportations et importations d’organes les principes de la loi de 1994 régissant le don et l’utilisation de produits du corps humain, généralise le consentement présumé et élargit le champ des donneurs vivants.
• La loi n° 2011-814 du 7 juillet 2011 est l’aboutissement de la clause de révision inscrite dans la loi de 2004 qui instaure un nouvel examen par le Parlement dans un délai maximal de sept ans après son entrée en vigueur. Elle prévoit aussi a prévu son réexamen, au plus tard en 2018, par l’OPECST puis par le Parlement. Elle :
– autorise du don croisé d’organes intervenant en cas d’incompatibilité entre proches ;
– instaure une nouvelle définition des modalités et les critères des techniques d’assistance médicale à la procréation et d’encadrement de leur amélioration et prévoit la congélation ovocytaire ultra rapide (ou vitrification).
• La loi n° 2013-715 du 6 août 2013 tendant à modifier la loi du 7 juillet 2011 relative à la bioéthique a autorisé sous certaines conditions la recherche sur l’embryon et les cellules souches embryonnaires.
3. Un exemple de législation restrictive : Allemagne
L’Allemagne est un des pays étudiés par ce rapport le plus restrictif en matière de bioéthique (88). La loi sur la protection de l’embryon de 1990 a interdit les interventions sur les cellules germinales.
La modification de la lignée germinale chez l’être humain demeure une thématique sensible pour l’opinion allemande. La plupart des interlocuteurs rencontrés par les rapporteurs ont estimé qu’il serait extrêmement difficile, voire impossible, de modifier la législation allemande sur ces sujets. Cela n’empêche pas Mme Patricia Lips, députée (CDU), présidente de la commission du Bundestag pour la recherche et l’évaluation des choix technologiques, de penser qu’avec l’évolution des technologies génétiques, il faudra peut-être modifier la loi sur la protection de l’embryon de 1990.
Il n’en reste pas moins que le ministère allemand fédéral de l’enseignement et de la recherche a mis en place un programme de soutien, dénommé « ELSA » (aspects éthiques, juridiques et sociaux des sciences de la vie modernes), dont l’objectif est de « définir les opportunités et les risques des dernières avancées des sciences de la vie » (89). Le ministère fédéral de l’éducation et de la recherche (BMBF) a très tôt reconnu l’importance de la recherche ELSA. Depuis 1997, il la soutient, à hauteur d’environ 4,5 millions d’euros.
4. Deux pays à législation intermédiaire : Royaume-Uni et États-Unis
• Le Royaume-Uni : pays de législation précise mais relativement permissive
La législation britannique est très claire : elle permet la modification ciblée du génome pour faire de la recherche et l’exclut à des fins thérapeutiques. Elle interdit d’entreprendre des modifications des cellules germinales. Cette législation fait l’objet d’une large approbation par la société
La loi sur la fertilisation et l’embryologie de 2008 autorise la recherche sur les embryons hybrides humains-animaux, issus de l’intégration d’ADN humain dans des ovules d’animaux. Ces embryons sont conçus à des fins scientifiques et doivent être détruits au bout de 14 jours de développement. Il est interdit de les réimplanter. La loi autorise les parents d’enfants souffrant de maladies graves à sélectionner les embryons qui pourront servir de donneurs pour sauver leur frère ou leur sœur malade (« bébés médicaments »).
La loi de 2008 a été modifiée en 2015 pour permettre le transfert mitochondrial, notamment lorsque l’ovocyte de la mère présente une maladie génétiquement transmissible préjudiciable pour l’enfant (la mitochondrie contient une petite partie de l’ADN qui peut être responsable de quelques maladies – voir plus loin chapitre consacré à ce thème). Les mitochondries de l’ovule défectueux sont remplacées par des mitochondries saines provenant d’une autre femme. L’ovule est ensuite implanté dans l’utérus de la mère, après avoir été fécondé par le sperme du père en laboratoire. La technique développée par un laboratoire de Newcastle permet donc de bloquer la transmission de la maladie de la mère à l’enfant.
Le futur enfant aura toutes les caractéristiques génétiques de son père et de sa mère, puisque l’ADN mitochondrial représente moins de 1 % de la quantité totale d’ADN. Cependant, la modification sera alors possible.
Le processus de modification de la législation sur ce sujet a pris près de 8 ans, 15 ans depuis sa découverte scientifique. La loi a été votée, au Royaume-Uni, parce que près de 125 enfants naissaient avec un dysfonctionnement mitochondrial transmis par la mère.
C’est la HFEA (Human Fertilisation and Ebryology Authority), rattachée au ministère de la santé, qui supervise la recherche. Elle réglemente et supervise les traitements in vivo et d’insémination artificielle. Cet organisme contrôle les recherches en lien avec l’embryon humain, tout travail de recherche doit obtenir son autorisation préalable. Pour le don de mitochondries, l’autorisation de la HFEA s’effectue en deux étapes. Un établissement hospitalier effectuant des FIV doit effectuer une demande de modification de sa licence pour ajouter de don mitochondrial dans les services qu’il offre. Il doit ensuite l’appliquer au cas par cas. Une clinique de Newcastle a fait cette demande le 16 décembre 2016 (90). La commission de la HFEA rendra son évaluation entre mars ou mai, avec peut-être une première intervention au cours de l’année 2017.
Les Britanniques se demandent si la facilité et la rapidité d’application des techniques TALEN ou CRISPR-Cas9 nécessitent une modification de la législation.
M. Robin Lovell-Badge, professeur, laboratoire de biologie des cellules souches et de développement génétique au Francis Crick Institute, propose que la loi britannique soit être modifiée sur trois points : sur les techniques pour modifier le génome humain permettant de prévenir des maladies génétiques ; sur la règle des quatorze jours de vie d’un embryon, délai fixé de façon très arbitraire, car c’est le moment du développement, des couches de l’embryon commençant à se former et se différencier ; sur l’interdiction d’utiliser les ovules et les spermatozoïdes d’un donneur, dans une création d’un embryon in vitro, pour la recherche clinique.
Le Royaume-Uni attire beaucoup de chercheurs qui viennent de pays à législations plus restrictives comme l’Allemagne ou de pays qui sont moins précisément règlementés, comme les États-Unis, qui peuvent y travailler sur les embryons.
• Les États-Unis : une approche au cas par cas
La législation américaine a été écrite antérieurement aux techniques de modification ciblée du génome humain. En l’absence de dispositions spécifiques, les règles relatives aux thérapies géniques devraient s’appliquer à ces nouvelles techniques : analyse de risque, essais cliniques... Une cellule manipulée génétiquement, y compris avec des techniques de modification ciblée du génome, est considérée comme un « médicament » (medicinal product).
Les règles qui s’appliqueraient aux modifications ciblées du génome aux États-Unis, telles que décrites dans le rapport de février 2017 des académies américaines des sciences et de médecine sur « La modification ciblée du génome humain : science, éthique et gouvernance », sont établies selon une approche souple au cas par cas. Les États-Unis étant un pays fédéral, des règles se superposent au niveau national et à celui des États, avec des différences d’un État à l’autre. Les règles sont également différentes selon que la Food and Drug Administration (FDA) est compétente ou non, selon l’origine du financement des travaux (fédéral, étatique, privé).
En général, les travaux de recherche en laboratoire font l’objet d’une surveillance locale par des comités institutionnels de biosécurité (Institutional Biosafety Committee – IBC). Les règles relatives à la sécurité et à la surveillance fédérale sont contenues dans un document dénommé « Amendements sur l’amélioration laboratoire clinique » (Clinical Laboratory Improvement Amendments – CLIA).
Les conseils institutionnels d’examen (Institutional Review Board – IRB) et les IBC sont compétents dans les phases de recherche, avec une répartition des rôles au cas par cas. Les IRB sont régis par la « Common Rule » de 1981, qui est la loi américaine de bioéthique. Les IBC ont été créés par le comité de conseil pour la recombinaison d’ADN (Recombinant DNA Advisory Committee – RAC), qui dépend des Instituts nationaux de la santé (National Institutes of Health – NIH). Le RAC édicte les règles régissant la modification d’ADN aux États-Unis depuis les années 1970 ; il a aujourd’hui la responsabilité d’approuver les protocoles de recherche sur les manipulations génétiques et de favoriser le dialogue avec le public.
La recherche sur les cellules ou tissus humains aux États-Unis est réglementée et surveillée par les IRB ; la modification ciblée du génome rentrerait dans ce cadre. Les expériences sur des cellules ou tissus humains doivent suivre les recommandations du NIH selon lesquelles, quand l’ADN est recombiné, une approbation par un IBC est nécessaire.
Les expériences de recherche sur les embryons sont permises au niveau national, mais certains États les ont interdites. Elles ne sont autorisées que sur des embryons non viables. Il est possible de créer un embryon humain pour la recherche, mais uniquement si l’étude ne peut être effectuée autrement. Ces recherches sur les embryons ne peuvent être financées par des fonds fédéraux, mais les États peuvent créer des fonds spécifiques pour ces recherches. Il en a été ainsi en particulier de la Californie, mais aussi du Connecticut, du Maryland, du New Jersey et de l’État de New York. Ainsi, la recherche sur les embryons est essentiellement le fait de compagnies privées ou de fondations.
Au niveau clinique, les technologies de modification ciblée du génome humain sont considérées comme des thérapies géniques par la FDA dans le cadre de son activité de surveillance. L’agence les réglemente dans le cadre des produits biotechnologiques et des médicaments. La FDA a autorisé un certain nombre d’essais de thérapie génique, mais n’a pas encore délivré d’autorisation de mise sur le marché. Quand une de ces thérapies est approuvée, elle reste sous la surveillance continue de la FDA, avec si nécessaire, des restrictions sur son utilisation. Les règles relatives aux essais cliniques doivent être révisées en avril 2017, étant entendu que les restrictions sur les fonds fédéraux seront maintenues.
Les essais cliniques de modification ciblée du génome sur des cellules somatiques aux États-Unis nécessitent l’approbation par la FDA d’une demande d’examen de nouveau traitement (Investigational New Drug – IND). Le protocole clinique nécessite l’approbation d’un IRB, suivi d’un examen continu. De plus, les évaluations effectuées par le RAC nourrissent les délibérations de la FDA et des IRB et offrent un lieu de discussion publique. L’autorisation d’une thérapie génique dépend de la possibilité de pouvoir bien surveiller les risques et les bénéfices qu’apporte cette thérapie.
En phase clinique, la modification de la lignée germinale humaine fait l’objet d’une interdiction légale « temporaire » au niveau national, mais qui est reconduite périodiquement par le Congrès. Reste donc interdit tout essai clinique de modification d’embryon qui aurait un caractère héréditaire.
Les académies américaines des sciences et de médecine ont publié, en février 2017, un rapport sur « La modification ciblée du génome humain : science, éthique et gouvernance » (91) dans lequel elles se prononcent sur les aspects législatifs de la modification ciblée du génome humain.
Ainsi, trois grands axes apparaissent comme nécessitant d’être développés :
1° La recherche fondamentale permet de développer et faire avancer la connaissance et la science, notamment concernant les mécanismes de réparation de l’ADN et les premiers stades de développement de l’être humain. La recherche fondamentale sur les cellules somatiques et germinales est essentielle pour cela, elle devrait continuer dans le cadre des structures législatives actuelles.
2° Les applications cliniques permettent de traiter et prévenir des maladies ou des défaillances sur des cellules somatiques. Dans ce cas, les académies mettent en garde contre des possibles dérives, dont celle de « l’amélioration » d’un être humain sans pathologie ; le rapport conclut que ces thérapies ne doivent pas être utilisées pour d’autres buts que le traitement ou la prévention de maladies ou handicaps.
Les essais cliniques de modification ciblée sur des cellules somatiques pour un traitement ou une prévention de maladies ou handicaps devraient être poursuivis. Les normes éthiques et le cadre règlementaire sont identiques à ceux pour la recherche et les traitements cliniques de thérapie génique sur des cellules somatiques. Le comité conclut qu’à ce stade, il n’est pas besoin de définir de règles relatives à l’efficacité ou à la spécificité (taux d’effets hors cible) de la modification ciblée du génome. Une évaluation au cas par cas est alors envisagée. Le rapport recommande d’évaluer la sécurité et l’efficacité dans une analyse risques – bénéfices pour l’utilisation prévue. Il se prononce pour une participation large du public concernant les utilisations allant au-delà.
3° les applications permettant de traiter ou prévenir des maladies ou des défaillances sur la lignée germinale. Ces traitements ont été testés avec succès sur des animaux, mais des défis majeurs sont encore à relever pour leur développement sur des êtres humains. Prenant en compte les préoccupations techniques et sociétales, le rapport conclut qu’il faut faire preuve de prudence dans toute modification ciblée de la lignée germinale humaine, mais que cette prudence ne signifie pas interdiction. Le rapport recommande que les essais de recherche (research trials) soient permis, mais seulement après avoir accumulé beaucoup de connaissances pour pouvoir précisément évaluer la balance entre bénéfices et risques avant d’autoriser les essais cliniques (clinical trials) et sous stricte surveillance. Les autorités ne donnent actuellement pas suite aux propositions de recherche en raison de l’interdiction de la FDA de financer une « recherche dans laquelle l’embryon humain est intentionnellement créé ou modifié avec une modification génétique héréditaire ».
Le rapport définit six critères selon lesquels la modification ciblée de la lignée germinale pourrait être autorisée, dans le cadre d’une prévention ou d’un traitement d’une maladie, au cas où la loi américaine ne s’appliquerait plus et ou des pays sans interdiction légale désireraient procéder à cette recherche :
– absence d’alternatives raisonnables ;
– restriction de la modification ciblée pour laquelle il a été démontré de manière convaincante qu’elle cause ou prédispose fortement à une maladie ou à un état grave ;
– données précliniques et/ou cliniques fiables sur les risques et bénéfices potentiels sur la santé du patient ;
– supervision rigoureuse, de manière continue, pendant les essais cliniques ;
– plan complet de long terme de suivi multigénérationnel ;
– réévaluation continue des bénéfices et risques sanitaires et sociétaux, avec apports variés et continus émanant du public.
Ce rapport mentionne aussi l’importance de l’éducation du public et de sa participation, dans le processus d’évaluation et d’application des valeurs sociétales aux risques et bénéfices des technologies de modification ciblée du génome et aux dimensions éthiques que cela implique. Le débat doit être le plus large possible.
Mme Jennifer Doudna, pense que la législation est suffisante, à ceci près que la recherche sur l’embryon ne peut être financée avec des fonds fédéraux, elle n’est possible qu’avec des fonds privés ou étatiques. Ainsi, l’État de Californie finance l’Institut californien pour la médecine régénérative (California Institute for Regenerative Medicine – CIRM), ce qui permet à des scientifiques d’utiliser CRISPR-Cas9. La Californie a été le premier État à financer ces recherches aux États-Unis.
5. Législation permissive : la Chine
Bien que n’ayant pas effectué de mission dans ce pays, les rapporteurs se sont intéressés à la réglementation en vigueur en Chine. Suivent les informations obtenues, mais qu’ils n’ont pu vérifier par des auditions.
Le droit chinois en la matière est essentiellement constitué de lignes directrices (guidelines) plusieurs fois modifiées dont la conception d’ensemble et les conditions d’exécution sont difficiles à cerner. Les règles de bonne pratique médicale proviennent des documents publiés par l’Agence des produits alimentaires et médicamenteux de Chine (Food and Drug Administration) (CFDA) et le ministère de santé (Ministry of Health – MOH ; à partir de 2013 National Health an Family Planning Commission – NHFPC).
En ce qui concerne la recherche sur les cellules souches embryonnaires humaines, les autorités chinoises ont publié des lignes directrices ministérielles et des « règlements intérimaires ». En Chine, les règlements intérimaires doivent être considérés comme valides et en vigueur, bien que flexibles et susceptibles d’être modifiés (92). Selon ces règles, les recherches ne peuvent porter que sur des embryons de 0 à 14 jours et ne peuvent être implantés. L’achat et la vente d’embryons humains, de fœtus, de gamètes ou de tissu humain sont interdits, ils doivent être donnés avec le consentement des patients. Il est interdit de produire des hybrides. La supervision nationale est opérée par l’émission de licence pour les centres de fertilisation in vitro. Les essais cliniques sur les cellules souches doivent être menés conformément au « règlement intérimaire 2007 sur l’examen de la recherche biomédicale impliquant des sujets humains » du MOH et à la « loi de la CFDA » publiée par le MOH en 2001.
Depuis 1999, les institutions médicales et le personnel qui enfreignent les dispositions réglementaires sont directement responsables, conformément aux procédures pénales spécifiquement conçues. Avec l’évolution règlementaire intervenue en 2003 (principes éthiques de recherches sur les cellules souches embryonnaires humaine), le MOH met en place des comités éthiques sur le modèle des IRB américains (Institutional Review Board – conseil d’examen institutionnel). Dans les lignes directrices de 2007, ces comités deviennent obligatoires pour toute recherche biomédicale sur un sujet humain. Ces lignes directrices donnent aussi des principes pour composer les IRB, mais ne garantissent pas suffisamment leur indépendance des institutions qu’ils évaluent, comme le souligne le rapport CURE de 2007 du Conseil médical de la recherche (Medical Research Council) du Royaume-Uni. Ce rapport faisait aussi état d’un manque de supervision nationale pour faire respecter ces principes. Le flou de la règlementation chinoise a permis à de nombreuses cliniques privées de s’établir en Chine pour mener des essais cliniques lucratifs. Des règlements intérimaires ont été publiés pour remédier à ces critiques.
En 2012, toutes les recherches impliquant des cellules souches n’ayant pas reçu au préalable d’autorisation du MOH ou de la CFDA sont devenues illégales et ont dû être interrompues. Les effets de ce règlement intérimaire ont surtout touché les institutions de recherches soutenues par l’État (93). En 2013, les contrôles par les autorités sanitaires des essais cliniques sur les cellules souches ont été renforcés par trois règlements intérimaires.
Le règlement intérimaire du 22 août 2015 renforce les règles de contrôle s’appliquant à l’utilisation clinique de cellules souches humaines manipulées in vitro. Les transplantations systématiques de cellules souches hématopoïétiques et d’essais cliniques utilisant des cellules souches affirmées comme produits pharmaceutiques, ne sont pas concernés. Dans un document complémentaire publié par la CFDA, intitulé « Contrôle de la qualité des préparations de cellules souches et lignes directrices pour la recherche préclinique », les critères de sécurité et l’évaluation de l’efficacité s’appliquant études précliniques sont précisés :
– seuls les hôpitaux de niveau 3 – la catégorie d’hôpital la mieux classée en Chine – sont autorisés à mener des essais cliniques sur les cellules souches. Pour être admissibles, ces hôpitaux doivent avoir des établissements de recherche, de soins de santé et d’enseignement et être en possession des qualifications professionnelles pertinentes ;
– les hôpitaux doivent disposer de comités d’éthique et d’études capables de traiter adéquatement les effets néfastes et de prévenir les applications à haut risque ;
– les hôpitaux sont tenus d’établir des installations de préparation de cellules souches qui soient conformes aux normes internationales GMP (Good Manufacturing Practices – bonnes pratiques de fabrication).
Le règlement intérimaire de 2015 impose aussi que les demandes d’autorisation d’essais cliniques sur les cellules souches soient effectuées dans les départements provinciaux du NHFPC et de la CFDA. Les essais doivent être inscrits en ligne au « registre et système de gestion de la médecine chinoise ». La NHFPC et les CFDA locaux examinent conjointement les projets au niveau provincial avec l’aide de comités d’experts formés spécifiquement dans ce but. Ces comités vérifient et évaluent ensuite sur place les établissements d’enseignement, les comités d’éthique et la gestion des projets. Les rapports d’étape des essais cliniques doivent être présentés aux autorités de façon régulière. Après chaque phase, les enquêteurs doivent communiquer les résultats de la recherche aux organismes provinciaux. Sur la base de ces rapports, est décidée la progression vers la phase suivante jusqu’à la phase clinique.
Le règlement vise à protéger les intérêts des patients. En effet, les chercheurs cliniques peuvent ne pas facturer pour les patients participant à des études cliniques, et les hôpitaux ne sont pas autorisés à faire de la publicité des essais de cellules souches comme des traitements. Les hôpitaux sont tenus d’informer pleinement les patients des risques potentiels de la recherche en cause et d’organiser une couverture d’assurance pour des sujets humains pour des projets impliquant un niveau de risque élevé. En cas d’urgence, des installations de sauvetage doivent être en place. En outre, les événements indésirables graves doivent être signalés au comité d’éthique de l’hôpital et aux autorités sanitaires provinciales. Ils entraînent l’arrêt immédiat du projet de recherche et le retrait de l’approbation pour l’application de la thérapie cellulaire en question.
Les sections provinciales de la NHFPC et de la CFDA ont le pouvoir de suspendre les essais sur les cellules souches et de punir les enquêteurs et le personnel conformément aux lois et règlements appropriés. L’impact de ce règlement intérimaire dépend essentiellement de son application. Dans leur étude de 2015, M. Achim Rosemann et Mme Margaret Sleebom-Falkner estiment que la nouvelle organisation des autorités chinoises permettra d’atteindre cet objectif. Les chercheurs regrettent néanmoins que ce règlement intérimaire ne fournisse pas de détails sur l’application de ces nouvelles règles. Pour les chercheurs, c’est pour les essais cliniques de la recherche privée qu’il sera le plus difficile de faire appliquer les règles. En effet, le détail des ressources mobilisées pour la réalisation de cet objectif n’est pas suffisamment clair. Le règlement manque aussi de clarté quant à son application dans les hôpitaux militaires et policiers, qui ont leurs propres autorités de régulation. Une étude de 2012 (94) parue dans la revue Cell Stem Cell signale d’ailleurs que la plupart des recherches commerciales sur les cellules souches ont lieu dans ces hôpitaux. Il apparaît cependant que l’alignement avec les normes internationales et la mise en place de cadres réglementaires sont attendus par les chercheurs chinois, qui avaient avant des difficultés d’obtention d’autorisation de mise sur le marché (AMM) pour les produits développés en l’absence de règles suffisamment précises.
6. Position des organisations internationales et européennes
Trois organisations européennes ou internationales sont compétentes en matière de thérapies géniques : l’Organisation mondiale de la santé (OMS), l’Organisation des Nations unies pour l’éducation, la science et la culture (UNESCO) et le Conseil de l’Europe.
La position dominante au sein des institutions européennes et internationales est de recommander une autodiscipline des scientifiques du monde entier, dans le cadre d’une recherche responsable.
a. L’Union européenne ne dit rien sur la lignée germinale
La charte des droits fondamentaux de l’Union européenne va moins loin que la convention d’Oviedo. Son article 3 instaure un « droit à l’intégrité de la personne » qui, « dans le cadre de la médecine humaine et de la biologie », interdit les « pratiques eugéniques, notamment celles qui ont pour but la sélection des personnes » et le « clonage reproductif des êtres humains ». Rien n’y est dit sur les modifications de la lignée germinale de l’homme dans un cadre thérapeutique et non de « sélection » ou d’« amélioration ».
Charte des droits fondamentaux de l’Union européenne
Chapitre I – Dignité
Article 3 – Droit à l’intégrité de la personne
1. Toute personne a droit à son intégrité physique et mentale.
2. Dans le cadre de la médecine et de la biologie, doivent notamment être respectés :
– le consentement libre et éclairé de la personne concernée, selon les modalités définies par la loi ;
– l’interdiction des pratiques eugéniques, notamment celles qui ont pour but la sélection des personnes ;
– l’interdiction de faire du corps humain et de ses parties, en tant que tels, une source de profit ;
– l’interdiction du clonage reproductif des êtres humains.
b. L’Organisation des Nations unies pour l’éducation, la science et la culture (UNESCO) : pour une interdiction temporaire
Le comité international de bioéthique (CIB) de l’UNESCO a publié, en octobre 2015, un rapport nommé « Mise à jour de sa réflexion sur le génome humain et les droits de l’homme » (95). Ce panel de l’UNESCO, composé de scientifiques, de philosophes, de juristes et de ministres, a appelé à une interdiction temporaire de « l’ingénierie » génétique de la lignée germinale humaine, appelant à un débat public plus large sur les modifications génétiques de l’ADN humain.
c. L’Organisation mondiale de la santé (OMS) : pas de recommandations
L’action de l’Organisation mondiale de la santé peut être appréhendée sous deux angles différents : ses efforts pour aider les pays à développer les thérapies géniques et le cadre international unique qu’elle représente pour discuter des aspects éthiques. Il faut bien reconnaître que, dans l’un et l’autre cas, les réalisations ne sont pas à la hauteur des attentes, donnant l’impression d’une organisation en grande partie paralysée face aux grands enjeux sanitaires que constituent les thérapies géniques.
L’OMS a lancé, dès 2004, un programme dénommé « Génomique humaine et santé mondiale », programme qui est cependant dormant, faute de financement et de choix de priorités... Il faudrait un mandat des pays membres de l’OMS pour réactiver ce programme sur la génomique humaine, qui n’est clairement pas la priorité de pays membres concentrés notamment sur le virus Zika, le virus VIH, le cancer ou les vaccinations.
Le secrétariat de l’OMS s’interdit de faire des recommandations. Il est de surcroît en restructuration, à la suite des critiques relatives à la gestion de la crise Ébola. En outre, le directeur général de l’OMS sera renouvelé en juillet 2017, ce qui ne favorise pas le lancement de nouveaux travaux.
7. Un accord international est-il possible ?
La signature d’un accord international de type Sommet de la Terre ou COP21 serait difficile à obtenir, selon Mme Jennifer Doudna, précitée, et M. Hank Greely, professeur de droit, université de Sanford. Des recommandations (guidelines) non contraignantes, élaborées par les organisations scientifiques, leur semblent préférables. Il faut maintenir une discussion avec les chercheurs et mettre en avant les comportements responsables, plus que chercher à interdire.
M. Bill Foster, seul parlementaire membre de la Chambre des Représentants (Illinois, démocrate) qui s’intéresse à cette question aux États-Unis, est moins pessimiste. Il aimerait qu’une autorité soit mise en place à l’échelle internationale pour autoriser les modifications de tout être humain, mais il reconnaît que ce serait probablement très difficile à réaliser. On devrait cependant arriver à un accord international sur la transparence dans les autorisations de recherche ou d’essais thérapeutiques, qui serait ensuite géré nationalement. Tout projet de modification d’un être humain devrait faire l’objet d’une publication un mois avant l’intervention. Par contre, il estime qu’il sera très dur de mettre en place un organisme international qui aurait la compétence de prendre de telles décisions. Débuter par un accord sur la transparence permettra par la suite d’arriver à faire avancer l’idée d’une autorité qui aurait le pouvoir de dire non. Et, en partant de là, pourrait se construire un cadre de négociations. Les pays les plus réticents à conclure un accord international seront les pays asiatiques et la Russie. Donc, selon lui, il vaut mieux partir d’un accord peu ambitieux mais, concernant un grand nombre de pays, pour ensuite se mettre d’accord sur le plus petit dénominateur commun.
Enfin, les législations étant différentes à travers le monde, les équipes de chercheurs multiples, une réglementation internationale ne s’appliquerait qu’aux seuls signataires et pourrait mettre la recherche dans ces pays en difficultés.
*
* *
Les rapporteurs proposent les recommandations suivantes pour les organisations internationales.
Recommandation n° 3 : Pas de modification des cellules germinales aujourd’hui
– Rappelle au respect de l’article 13 de la convention d’Oviedo du Conseil de l’Europe, relatif aux interventions sur le génome humain et appelle à son extension à d’autres pays : « Une intervention ayant pour objet de modifier le génome humain ne peut être entreprise que pour des raisons préventives, diagnostiques ou thérapeutiques et seulement si elle n’a pas pour but d’introduire une modification dans le génome de la descendance. » ;
– Propose de réexaminer l’article 13 quand les technologies seront suffisamment mûres et que les recherches sur la modification des cellules germinales en laboratoire auront fait leurs preuves. Estime que, lorsque ces technologies seront sûres, les essais thérapeutiques devront être examinés au cas par cas, afin de soigner une maladie héréditaire incurable. Cette étape devra être préparée par une concertation élargie avec la société civile.
Recommandation n° 4 : Un « GIEC » du genome editing
– Demande au Gouvernement de saisir, avec les autres pays membres, l’Organisation mondiale de la santé (OMS) pour réactiver le programme « Génomique humaine et santé mondiale », lancé en 2004 mais actuellement dormant, afin de constituer un lieu d’échange international sur l’utilisation des thérapies géniques, particulièrement les techniques de modification ciblée du génome, pour lutter contre les grandes maladies de l’humanité ;
– Souhaite un partenariat actif entre l’OMS, l’Organisation des Nations unies pour l’éducation, la science et la culture (UNESCO), en lien avec le Conseil de l’Europe sur les aspects éthiques des nouvelles biotechnologies appliquées à la médecine humaine ;
– Propose que ces deux organisations internationales s’entourent d’un comité permanent d’expert, composé de personnalités qualifiées reconnues dans leurs pays respectifs, qui, sur le modèle du groupe d’experts intergouvernemental sur l’évolution du climat (GIEC), aurait pour mission d’évaluer le degré de maturité des nouvelles thérapies géniques, d’en apprécier les enjeux sanitaires et éthiques et de proposer aux pays membres des lignes directrices.
8. Quels enseignements pour la révision de la loi française relative à la bioéthique prévue en 2018 ?
• Le contrôle des activités de recherche et cliniques
La délimitation des attributions de contrôle et d’autorisation est complexe, mais précise. Elle varie selon le type de thérapie génique et suivant la qualification du statut « recherche ou traitement clinique ».
S’agissant des recherches sur l’homme ne faisant pas intervenir gamète ou embryon et dont le promoteur est un service hospitalier ou un industriel prive, ce sont les comités de protection des personnes (CPP) (96) qui examinent le protocole de recherche et donnent ou non leur accord, ensuite transmis au ministère de la santé. Lorsque le CNRS ou l’INSERM sont les promoteurs de l’étude, c’est le comité d’évaluation éthique/Institutional Review Board (CEEI/IRB) de l’INSERM qui examine le dossier et donne ou non son accord. Tout ce qui touche aux gamètes et à l’embryon passe par l’Agence de la biomédecine (ABM). Toute expérimentation animale doit recevoir l’approbation d’un comité d’éthique de l’expérimentation animale.
• Rôle de l’Agence nationale de sécurité du médicament et des produits de santé (ANSM)
En ce qui concerne les traitements cliniques, c’est l’Agence nationale de sécurité du médicament et des produits de santé (ANSM) qui doit donner son accord. Enfin, pour le cas très particulier des recherches dans le contexte de la procréation médicalement assistée (PMA), c’est l’ANSM qui donne éventuellement à l’Agence de la Biomédecine (ABM) son accord…
Lors de l’audition publique de l’OPECST du 27 octobre 2016, M. Jean-Michel Race, directeur à l’Agence nationale de sécurité des médicaments et des produits de santé (ANSM), chargé d’une direction produits, a présenté le rôle de son agence.
L’ANSM a deux objectifs : assurer un accès le plus rapide et précoce possible à l’innovation tout en assurant le meilleur niveau de sécurité des patients. Les jugements de l’Agence reposent sur l’analyse des équilibres bénéfices/risques.
L’ANSM se situe en aval des recherches les plus pointues via les décisions qui lui incombent relatives à l’application directe sur des compatriotes. Elle autorise l’utilisation thérapeutique de produits de santé, de techniques thérapeutiques et du diagnostic. À ce titre, les thérapies géniques font l’objet d’un examen et d’une autorisation par l’ANSM avant toute application.
Un décret de mars 2016 octroie à l’ANSM une nouvelle mission : l’autorisation de toute recherche biomédicale menée dans le cadre d’une assistance médicale à la procréation. Un parallèle peut être fait entre ces deux activités. D’une part, toute demande d’autorisation sera examinée. Cet examen couvre des domaines variés. L’aspect clinique, primordial pour analyser le bénéfice, est complété par d’autres prismes : qualité pharmaceutique, qualité biologique, problématiques de sécurité virale. L’ensemble de ces points est examiné dans la question des autorisations des thérapies géniques que de l’autorisation des essais cliniques en général. La durée pour se prononcer est plus longue (quatre-vingts dix jours) que celle octroyée d’ordinaire pour l’examen d’un essai clinique (soixante jours), et peut être prorogé en cas de nécessité.
En outre, l’ANSM a l’obligation de prendre l’avis d’autres agences avant de se prononcer. Sur les autorisations de traitement et de thérapies géniques, l’avis du Haut Conseil de biotechnologies (HCB) doit être demandé et obtenu. En matière d’essais cliniques ayant trait à la procréation médicalement assistée (PMA), l’avis est demandé à l’ABM. Cette collaboration, qui intervient dès le dépôt des demandes de dossier, permet l’élaboration d’une autorisation acceptant la demande ou posant des questions aux promoteurs des thérapies et des essais de façon à clarifier les questions de bénéfices et de risques.
• Rôle de l’Agence de la biomédecine (ABM)
M. Karim Laouabdia-Sellami, directeur général adjoint chargé de la politique médicale et scientifique, a résumé le rôle de l’Agence de la biomédecine (ABM) lors de l’audition publique de l’OPECST du 27 octobre 2016.
« S’agissant de la recherche fondamentale sur les cellules souches, somatiques et germinales, une déclaration auprès du ministère de la recherche avec l’avis du comité de protection des personnes (CPP) est nécessaire. Sur l’embryon et les cellules souches embryonnaires humaines, l’autorisation est octroyée par l’ABM ».
« S’agissant de la recherche clinique sur les cellules somatiques, l’autorisation de recherche médicale est demandée à l’ANSM, avec un avis de l’ABM. La recherche en génétique est interdite par la loi sur les embryons et les cellules germinales. En vertu du code civil, aucune transformation ne peut être apportée au caractère génétique dans le but de modifier la descendance de la personne ».
La réglementation actuelle interdit toute intervention dans le but de faire naître un enfant génétiquement identique à une autre personne vivante décédée, la conception in vitro d’embryon ou la constitution par clonage d’embryon humain à des fins de recherche, la création d’embryons transgéniques ou chimériques. Un embryon ne peut être conçu par clonage ni utilisé à des fins commerciales ou industrielles. Est également interdite toute constitution par clonage d’un embryon humain à des fins thérapeutiques.
Les embryons sur lesquels une recherche a été conduite ne peuvent en aucun cas être transférés à des fins de gestation. Il s’agit seulement des embryons surnuméraires issus de fécondation in vitro (FIV) sans anomalie et sans projet parental, à l’exclusion des embryons issus de FIV qui ne sont pas transférables du fait d’anomalie morphologique, des embryons issus de FIV avec découverte d’anomalies chromosomiques au cours d’un DPI. Le consentement des parents est nécessaire.
Les autorisations de recherche sont délivrées par l’agence selon quatre critères : pertinence scientifique, finalité médicale, absence d’alternative et respect des principes éthiques relatifs à la recherche sur les embryons et les cellules souches embryonnaires.
Le circuit d’autorisation passe par les étapes suivantes : dépôt de la demande d’autorisation avec trois fenêtres par an, examen par un collège d’experts scientifiques, examen par le conseil d’orientation de l’ABM, décision de la directrice générale de l’agence qui peut autoriser la recherche, renouvelable dans les mêmes conditions.
S’agissant du suivi et du contrôle de l’autorisation de recherche, le responsable de la recherche adresse sa déclaration en début d’activité, un rapport annuel d’activités, un rapport final sur le protocole à la direction générale de l’agence. Deux registres sont instaurés afin d’assurer la traçabilité des embryons et des cellules souches : un registre tenu par les établissements et organismes autorisés à effectuer les recherches ainsi qu’un registre national des embryons et des cellules souches humaines.
Concernant le CRISPR-Cas9, M. Karim Laouabdia-Sellami précise que trois demandes d’autorisations ont été déposées à l’agence entre 2015 et 2016. Elles sont conformes aux dispositions prévues par la loi et aux protocoles autorisés. À ce jour, aucun protocole n’a été déposé pour CRISPR-Cas9 sur la recherche d’embryon.
Recommandation n° 5 : Un rôle accru pour l’Agence de biomédecine (ABM)
– Constate toutefois qu’en France, le dispositif d’évaluation est très complexe selon que l’autorisation de thérapie génique ou cellulaire concerne la recherche ou une activité clinique et que le régime est même différent s’il s’agit d’une recherche médicale menée dans le cadre d’une assistance médicale à la procréation. Cinq organismes peuvent être mobilisés, le Comité de protection des personnes, le comité d’éthique de l’INSERM, le Haut Conseil des biotechnologies (HCB), l’Agence nationale de sécurité du médicament et des produits de santé (ANSM) et l’Agence de Biomédecine (ABM) ;
– Suggère de simplifier le dispositif et qu’après avis de ces organismes, l’Agence de Biomédecine (ABM) donne l’accord final et assure le suivi et le contrôle des essais et des recherches cliniques, et que la question de la sûreté sanitaire soit abordée en coordination avec les organismes compétents européens ;
– Ces nouvelles dispositions devraient être précisées par décret qui fixera notamment les transferts de moyens correspondants à l’Agence de la biomédecine (ABM).
• La question particulière du transfert mitochondrial
La question du transfert mitochondrial a été évoquée à l’occasion de la modification de la législation britannique et du traitement de la petite Layla.
Rappelons que le patrimoine génétique de chaque être humain est contenu dans l’ADN, situé dans le noyau de ses cellules, sauf pour un petit nombre de gènes, qui se trouvent, eux, à l’intérieur de structures internes de la cellule : les mitochondries. Celles-ci constituent les « centrales énergétiques » de la cellule sans lesquelles aucun organisme ne peut survivre.
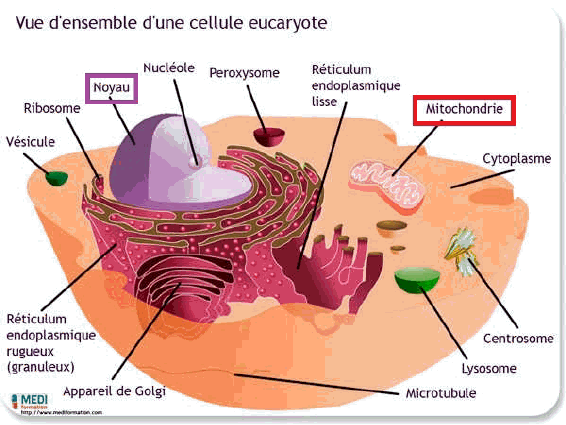
Source : Infirmiers.com – Mediformation.com (groupe Izéos).
Cet ADN dit « mitochondrial » (ADNmt) possède la particularité d’être transmis de génération en génération uniquement par les femmes. Le spermatozoïde ne transmet pas, ou très rarement, de mitochondries à l’ovule fécondé ; celles dont les cellules du bébé héritent proviennent uniquement de cet ovule.
Chez une femme porteuse d’anomalies de l’ADNmt, chaque ovule contient un nombre variable de mitochondries défectueuses. Celles-ci se répartissent de manière aléatoire dans les cellules du futur embryon, avec un mode de transmission très différent de ce qui se passe avec l’ADN du noyau (97).
À ces anomalies de l’ADNmt, est liée l’apparition de maladies dites « mitochondriales ». Aucune de ces affections ne peut actuellement être soignée. Plusieurs syndromes ont été décrits, comme le syndrome de Leigh ou la neuropathie optique de Leber qui provoque la cécité. Les conséquences sont diverses, parfois sévères (retard mental, cécité, surdité, dégénérescence musculaire…), voire mortelles. L’incidence des maladies métaboliques mitochondriales est d’un malade pour 5 000 naissances. L’intensité des symptômes dépend de la proportion de mitochondries dont l’ADNmt est muté dans les cellules de chaque organe. Les mères porteuses d’anomalies de l’ADNmt peuvent donner naissance à des enfants soit en bonne santé, soit ayant des atteintes plus ou moins sévères, qui développeront pour certains des symptômes ultérieurement. Il existe en théorie un risque à chaque grossesse, mais il est très difficile de l’évaluer ou de prédire la sévérité des atteintes. Il n’est pas rare que les femmes ne prennent conscience qu’elles sont porteuses d’un défaut de l’ADNmt qu’après la naissance d’un enfant lui-même atteint d’une maladie mitochondriale.
La technique dite de « don », « remplacement » ou « transfert mitochondrial» est de remplacer les gènes défectueux d’un embryon par ceux d’une donneuse saine pour que l’enfant naisse sans maladie grave. Ce don pourrait aider les couples dont la femme est porteuse d’une des anomalies génétiques. En combinant l’ADN non pas de deux, mais de trois donneurs, par l’assistance d’une fécondation in vitro, celle-ci éviterait la transmission de maladies rares transmises uniquement par les cellules de la mère.
Comme on l’a vu, le Royaume-Uni a été le premier pays au monde à autoriser le transfert mitochondrial.
Le journal Libération (98) a fait état d’avis opposés au transfert mitochondrial : « Pour les défenseurs de la technique, elle constitue une avancée majeure. Elle "offre aux familles la première lueur d’espoir d’avoir un bébé qui pourra vivre sans douleur ni souffrances", écrit un collectif d’associations internationales dans une lettre ouverte aux députés. Lord Robert Winston, l’un des pionniers de la fécondation in vitro, assure que "la procédure est comparable à une simple prise de sang" ».
« Pour ses opposants, cette technique va trop loin en matière de modification génétique et ouvre la boîte de Pandore de la sélection des bébés. "Une fois cette frontière éthique franchie, une fois acté le fait qu’il est permis de manipuler le génome humain, il deviendra difficile de ne pas franchir les étapes suivantes pour aboutir à un monde de bébés fabriqués sur mesure, un scénario que tout le monde veut éviter", s’alarme David King, de l’association Human Genetics Alert.[…] "Il faudra les surveiller toute leur vie, ainsi que leurs enfants. Nous ne connaissons pas encore l’interaction entre les mitochondries et l’ADN nucléaire. Dire que c’est comme changer une pile est trop simpliste, c’est beaucoup plus compliqué", souligne le Dr Trevor Stammers de l’université St-Mary de Twickenham, dans le Daily Telegraph. »
Aucun don de mitochondrie n’a encore été effectué au Royaume-Uni, mais deux essais ont eu lieu au Mexique et en Ukraine. Le 27 septembre 2016, le journal New Scientist, a publié un article sur la naissance d’un bébé au Mexique, cinq mois auparavant, par un transfert mitochondrial, le but étant d’empêcher la transmission d’une maladie génétique, le syndrome de Leigh ou encéphalomyo-pathie nécrosante subaiguë, qui avait causé la mort des deux premiers enfants d’un couple jordanien, à l’âge de 6 ans et 8 mois.
C’est une maladie neurologique progressive qui se déclare le plus souvent chez le nourrisson de moins d’un an, et qui concerne une naissance sur 36 000. Entre 10 à 30 % des cas sont liés à un dysfonctionnement des mitochondries, Les mitochondries de la femme de ce couple jordanien est porteuse de cette variante du syndrome de Leigh.
Ainsi, ce couple s’est adressé au docteur américain John Zhang, président fondateur du Centre de fertilité New Hope de New York, une clinique qui a des antennes en Chine, en Russie et au Mexique, pour procéder à une tentative de fécondation in vitro (FIV) faisant appel à une des deux techniques de transfert du noyau. La première de ces techniques, le transfert pronucléus, autorisée au Royaume-Uni, a été refusée par le couple pour des raisons religieuses, car elle impliquait la destruction d’au moins un embryon fécondé.
La technique retenue a été le transfert de fuseau maternel (spindle nuclear transfer), elle a consisté à transférer le noyau de l’ovule de la mère dans l’ovule énucléé de la donneuse, puis à le féconder avec le sperme du père et ensuite d’implanter l’embryon. On peut voir ci-après un schéma publié par l’Agence France Presse (AFP), à partir d’une source provenant de la HFEA, expliquant le transfert de fuseau maternel.
LE TRANSFERT MITOCHONDRIAL
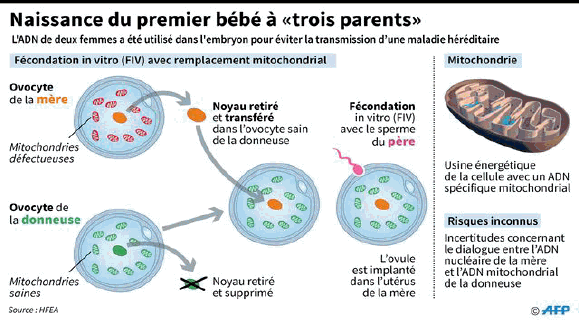
Source : AFP, via HFEA.
Le petit garçon est né en avril 2016 au Mexique où, selon le docteur, « il n’y a pas de règle », alors que la loi américaine ne permet pas l’usage de cette technique. Seulement 1 % de ses mitochondries portent le gène du syndrome de Leigh, ce qui est encourageant car les symptômes apparaissent à partir de 18 %. L’enfant est surveillé par l’équipe médicale du Dr Zhang pour s’assurer que les mitochondries malades ne se multiplient pas. Les résultats de l’étude ont fait l’objet d’une publication d’Elsevier, à la suite du congrès de la société américaine pour la médecine reproductive à Salt Lake City en octobre 2016.
M. Sian Harding, qui a mené l’examen éthique de la procédure acceptée au Royaume-Uni, considère que la méthode utilisée par Dr Zhang est une approche éthique, car évitant de détruire des embryons et en utilisant un embryon mâle. La transmission à sa descendance des mitochondries d’un individu né par cette technique pose des questions dans la mesure où des incertitudes persistent concernant l’interaction entre l’ADN nucléaire de la mère et l’ADN mitochondrial de la donneuse.
Le Dr John Zhang n’est pas le seul à avoir utilisé la technique. Le Dr Valery Zukin, un médecin ukrainien, directeur de la clinique Nadiya pour la médecine reproductive, a permis à deux nouveaux bébés de naître en janvier 2017, grâce à cette technique. Ce cas a fait polémique pour deux raisons. La première est que le docteur ukrainien a utilisé cette technique pour un cas d’infertilité inexpliqué et non pas pour une maladie mitochondriale non identifiée. La seconde est que l’un de ces bébés est une petite fille, qui pourrait donc transmettre ses mitochondries. Ces exemples illustrent la nécessité de la création au niveau international d’un groupe d’experts réfléchissant aux enjeux éthiques et médicaux du développement des nouvelles biotechnologies.
Le journal Le Monde signale que deux études appellent à la prudence dans l’usage de la technique du transfert mitochondrial. Une étude espagnole publiée dans Nature le 6 juillet 2016 observe une altération progressive des fonctions mitochondriales de rongeurs possédant un ADN nucléaire différent de leur ADNmt, leur santé déclinait et leur longévité était diminuée. En mai 2016, une étude publiée dans la revue Cell Stem Cell par des scientifiques italiens et japonais montrait que même une petite fraction de mitochondries importée lors du transfert de noyau pouvait recoloniser l’ovocyte d’accueil et des lignées cellulaires qui en étaient tirées, un phénomène susceptible de « compromettre l’efficacité du remplacement mitochondrial ».
Cependant, toujours selon Le Monde, « pour Mme Julie Steffann, du laboratoire de génétique moléculaire de l’Institut Necker à Paris, qui vient de lancer un programme d’évaluation des risques liés au transfert nucléaire, à partir d’embryons humains anormaux donnés à la recherche, la naissance de ce premier bébé est "un message d’espoir pour les patients" ». « Cette première "montre que le transfert nucléaire chez l’humain peut aboutir à un enfant vivant, ce qui n’avait jamais été fait". Le généticien américain M. Shoukhrat Mitalipov (université de l’Oregon) l’avait réalisé avec succès en 2009 sur des macaques rhésus ».
En France, cette technique est condamnée par l’association Alliance VITA, qui regrette que la communauté internationale se retrouve devant le fait accompli d’un enfant à « triple filiation ». La critique de cette naissance est émotionnellement très forte, comme le reflètent les termes « FIV 3 parents », « prise d’otage » et « stop bébé OGM ». Pour le Dr Blanche Streb, directrice des études d’Alliance VITA, de nombreuses inconnues pèsent déjà sur l’enfant à naître (99). Quelles seront les potentielles conséquences sur son développement, sur sa santé ? Quelle sera l’empreinte psychologique de cette « triple filiation » et de ces conditions de naissance ? Pour elle, les scientifiques bafouent les règles éthiques !
Alliance VITA souligne également le problème que représente le manque d’information disponible sur le développement à venir de ces enfants. Elle a rappelé l’article 13 de la convention d’Oviedo, qui interdit les modifications sur le génome humain héréditaires et non thérapeutiques. Selon le raisonnement de l’association, cet article pourrait s’appliquer à la naissance de la petite fille, les modifications éventuelles de son génome étant héréditaires. Il pourrait également s’appliquer à celles du petit garçon né en Ukraine, car elles ne sont pas effectuées dans un but « thérapeutiques » au sens de l’article 13 de la convention.
9. Quelles modifications de la loi bioéthiques en 2018 ?
Les rapporteurs pensent que ce débat sur le transfert mitochondrial doit rester ouvert. Il est bien sûr nécessaire qu’une instance de régulation autorise au préalable, dans le cadre de la loi, l’utilisation de nouvelles technologies. Ce débat est identique à celui qui est intervenu pour le DPI il y a plus de vingt ans.
Car d’un côté, il y a des incertitudes sur les conditions dans lesquelles les mitochondries se recréent lors des divisions cellulaires. Il faut donc répondre au préalable aux questions de l’altération progressive éventuelle des fonctions mitochondriales ou encore de la possibilité de redéveloppement des mitochondries dont un gène est altéré. Mais ce n’est pas en communiquant des slogans comme « Bébé a trois parents » ou « Bébé médicament » que l’on instaurera un débat apaisé car, même si bien sûr les mitochondries ne sont pas comparables à des organes comme le cœur, le rein ou le poumon, que l’on peut transplanter parce que la loi l’autorise, on procède à un transfert d’organelles. La mitochondrie n’est pas comparable à une cellule, car son ADN ne code que pour 13 protéines et pour une partie seulement des ARN servant à la fabrication de ces protéines ; tous les autres composants biochimiques de la mitochondrie sont codés par des gènes du noyau de la cellule. Cette interaction entre le noyau cellulaire et la mitochondrie est donc majeur. Les rapporteurs proposent donc que, lors du réexamen de la loi bioéthique prévu en 2018, le Parlement se saisisse de cette question. Ils pensent également qu’il faudra étudier la possibilité d’autoriser le dépistage préimplantatoire des facteurs génétiques ou métaboliques lors du développement embryonnaire chez des populations à risque. Cela permettra de réduire le délai nécessaire pour obtenir une naissance viable, abaissera l’incidence des fausses couches, réduira le nombre des grossesses multiples, diminuera le nombre de transfert d’embryons non viables, évitera la congélation d’embryons anormaux et enfin limitera les embryons surnuméraires. Les nouvelles biotechnologies d’hybridation génomiques évitent d’avoir recours à une médecine hasardeuse avec des conséquences néfastes, car on a montré que 60 % des embryons transférés ont des anomalies génétiques graves et sont non viables sur le plan métabolique.
Recommandation n° 6 : L’examen du transfert de l’ADN mitochondrial en 2018
– Propose d’intégrer la question du transfert d’ADN mitochondrial lors du réexamen de la loi bioéthique prévu en 2018, d’en débattre lors d’états généraux organisés par le Comité consultatif national d’éthique (CCNE).
Recommandation n° 7 : Réexamen de la loi de bioéthique en 2018
– Souhaite que, lors de ce réexamen, soit examinée l’autorisation de pouvoir diagnostiquer, lors d’un diagnostic préimplantatoire (DPI), les maladies dues à des facteurs génétiques ou métaboliques pour des populations à risque, ou les possibilités de conservation d’ovocytes.
III. LES BIOTECHNOLOGIES APPLIQUÉES À LA LUTTE BIOLOGIQUE ET AU DÉVELOPPEMENT DURABLE
Cette partie traite du forçage génétique (gene drive), biotechnologie qui vise à modifier une espèce vivante, comme les moustiques pour lutter contre une maladie qui se transmet à l’homme, ainsi que des autres biotechnologies industrielles et environnementales (« blanches »).
A. LA LUTTE CONTRE LES MALADIES A TRANSMISSION VECTORIELLE
Selon la définition de l’Organisation mondiale de la santé (OMS), « les vecteurs sont des organismes vivants capables de transmettre des maladies infectieuses d’un hôte (animal ou humain) » à un autre vertébré. « Il s’agit souvent d’insectes hématophages. » Lors d’un repas de sang, ils ingèrent des micro-organismes pathogènes, soit des vers (filaires, schistosomes), soit des unicellulaires, comme dans le cas du paludisme ou de la maladie de Chagas, soit des bactéries comme dans la borréliose (la maladie de Lyme), ou la peste, ou soit des virus comme dans la chikungunya, la dengue, la fièvre jaune, la fièvre du Nil, ou le Zika, présents dans un hôte infecté, pour les réinjecter dans un nouvel hôte à l’occasion de leur repas de sang suivant. Les moustiques sont les vecteurs les mieux connus, mais il en existe d’autres, comme les tiques, les mouches, les phlébotomes, les puces, les triatomes et certains gastéropodes d’eau douce. Il existe environ 3 400 espèces différentes de moustiques dans la biosphère, dont une minorité est vectrice de maladies.
Il est à noter qu’en France, le Haut Conseil des biotechnologies (HCB) a été saisi par la ministre de l’environnement, de l’énergie et de la mer de l’utilisation de moustiques génétiquement modifiés dans le cadre de la lutte antivectorielle. Le HCB organisera un colloque le 7 juin 2017 pour présenter son avis, qui sera élaboré à partir d’une part d’un rapport scientifique établi conjointement avec le Centre national d’expertise sur les vecteurs (CNEV), et d’autre part, du travail conduit au sein du HCB sur les aspects socio-économiques et éthiques.
Les maladies à transmission vectorielle sont causées par des pathogènes et des parasites présents dans les populations humaines. « Chaque année, on relève plus d’un milliard de cas (dont plus d’un million de décès) dans le monde, imputables à des maladies à transmission vectorielle telles que le paludisme, la dengue, la schistosomiase, la trypanosomiase humaine africaine, la leishmaniose, la maladie de Chagas, la fièvre jaune, l’encéphalite japonaise ou l’onchocercose ». Nous savons maintenant que le virus Zika est responsable du syndrome de Guillain-Barré et de microcéphalies.
Selon les statistiques publiées par l’OMS, les maladies à transmission vectorielle sont responsables de plus de 17 % des maladies infectieuses, et provoquent plus d’un million de décès chaque année. La dengue menace, à elle seule, plus de 2,5 milliards de personnes, dans plus de 100 pays. Elle est la cause de 30 000 décès par an. Les méthodes de lutte traditionnelle ont permis d’abaisser le nombre de décès dus au paludisme de 1 million en l’an 2000 à 450 000 par an. Ce sont les enfants qui paient le plus lourd tribut avec 1 000 enfants qui décèdent chaque jour de cette terrible maladie.
L’OPECST a consacré une audition publique, le 7 avril 2016, aux maladies à transmission vectorielle : aux caractéristiques de la transmission, à l’évolution du virus Zika en France et dans le monde et aux stratégies de lutte. À la suite de cette audition publique, un rapport (n° 3898) présenté par MM. Roland Courteau et François Commeinhes, sénateurs, a été publié le 29 juin 2016 (100).
Les voyages sur tous les continents, le commerce mondialisé, l’urbanisation non maîtrisée, le réchauffement climatique dans certains pays, ont un effet sur la transmission de nouvelles maladies. Certaines de ces maladies, comme la dengue, ou les infections dues au virus chikungunya et au virus du Nil, apparaissent dans des pays qui en étaient jusqu’alors exempts.
Selon l’OMS : « Les modifications des pratiques agricoles, dues aux variations de la température et des précipitations, peuvent influer sur la propagation des maladies à transmission vectorielle ». Le suivi des données climatiques permet de « prédire la distribution et les tendances à plus long terme du paludisme et d’autres maladies sensibles au climat ».
L’OMS a publié en mars 2016 un opuscule intitulé « Protéger la santé et la sécurité des personnes travaillant à la lutte antivectorielle d’urgence contre les moustiques de type Aedes – Lignes directrices provisoires à l’intention des personnes travaillant à la lutte antivectorielle et des agents de santé » (101). Ce document fournit des recommandations sur les mesures essentielles visant à protéger la santé et la sécurité des opérateurs et des autres personnes prenant part à la lutte antivectorielle d’urgence contre les moustiques de type Aedes spp., notamment la pulvérisation spatiale d’insecticides, l’application de larvicide, l’utilisation de moustiquaires et, dans certains cas, la pulvérisation à effet rémanent à l’intérieur des bâtiments. Il est destiné à être utilisé par les gestionnaires et opérateurs de la lutte antivectorielle, les professionnels de la santé publique, les membres des professions médicales, les agents de santé de district et les ministères de la santé. La question qui se pose aujourd’hui est celle de l’utilisation des biotechnologies contre certaines de ces maladies. L’OMS considère que les biotechnologies incluant le forçage génétique constituent un instrument supplémentaire dans la trousse à outils de lutte contre les maladies vectorielles et interviennent en complément des moyens traditionnels qu’elle préconise (insecticides, répulsifs, vêtements protecteurs, moustiquaires, moustiquaires imprégnées…).
Les chercheurs se sont intéressés aux mécanismes cellulaires de l’infection par un parasite, une bactérie ou un virus, et se sont posés la question de savoir si, par exemple, un moustique génétiquement modifié pouvait permettre de lutter efficacement contre une maladie. Plusieurs stratégies ont pu être développées pour empêcher de transmettre l’agent infectieux à l’hôte.
1. La modification des propriétés génétiques des vecteurs
Les « anciennes » biotechnologies appliquées aux insectes sont de plusieurs types : soit empêcher le moustique de transmettre la maladie, soit le contrôle des populations de moustiques. Dans le premier cas la modification agit comme une « vaccination », dans le deuxième cas elle agit comme un « insecticide ».
a. Empêcher le moustique de transmettre la maladie
On peut distinguer deux modalités. La première consiste à changer une protéine par un transgène afin que le pathogène ne soit plus capable de se développer. Elle fonctionne en théorie avec tout type de moustique. Si les recherches aboutissent, elles permettraient d’envisager de modifier les moustiques pour les rendre résistants. Celle modalité est, par exemple, utilisée avec les anophèles par M. Eric Marois, chargé de recherche à l’université de Strasbourg et à l’INSERM. Par la deuxième modalité, le moustique transgénique exprime un anticorps par lequel on désactive une protéine dont le parasite avait besoin. Cette deuxième modalité ne fonctionne qu’avec les anophèles. Elle est notamment utilisée par l’équipe d’Ethan Bier et de Valentino Gantz à l’université de Californie – San Diego. Le blocage de l’entrée d’agents pathogènes fait en sorte que les moustiques ne sont plus capables de transmettre des maladies.
Dans le cas du paludisme, une protéine de parasite joue un rôle majeur dans l’infection. Des moustiques transgéniques expriment un anticorps qui bloque cette protéine pour empêcher le mécanisme, on peut comparer dans ce cas la modification génétique à une vaccination.
b. Le contrôle des populations de moustiques
Dans d’autres cas, des chercheurs ont réussi à empêcher la transmission du vecteur en saturant une zone infestée de mâles stériles, ce qui diminue fortement les populations de moustiques.
La société anglaise de biotechnologies Oxitec, leader mondial de la modification génétique des moustiques, créée en 2002 par l’université d’Oxford, s’en est fait une spécialité, avec le moustique aedes aegypti (moustique de la fiève jaune) avec les maladies suivantes : dengue, virus Zika, chikungunya, fièvre jaune. En 2015, elle a été rachetée par la société américaine Intrexon Corp pour 160 millions de dollars. Cette entreprise a développé une méthode de contrôle de la population d’insectes, modifiés génétiquement, pour en faire une sorte d’« insecticide vivant ». Ainsi, les insectes porteurs de virus ou de maladies, ou encore ceux ravageant les cultures agricoles peuvent être contrôlés sans l’utilisation d’insecticide, donc de façon plus respectueuse de l’environnement. Cette stratégie consiste à lâcher de grandes quantités de moustiques stériles, puis de maintenir un ou deux lâchers moins importants dans les années qui suivent pour empêcher le rebond de la population de moustiques. L’avantage de la méthodologie préconisée par Oxitec est qu’elle permet une certaine forme de réversibilité : sans lâchers réguliers, les moustiques d’autres régions recolonisent la zone ciblée. Le but n’est pas l’extinction des espèces de moustique, mais leur contrôle et une diminution sensible de leur nombre. On teste actuellement la capacité à couvrir les zones urbaines à plus ou moins grande échelle.
Selon l’entreprise, la méthode fonctionne mieux qu’avec des insecticides et encore mieux dans la nature, dans l’environnement réel et ouvert dans lequel vivent les insectes. Elle a des similitudes avec la technique plus ancienne de la stérilisation des insectes par irradiation. On introduit dans l’insecte une cassette (morceau d’ADN) qui contient un transgène. La protéine introduite active de façon incontrôlée un gène qui fait mourir le moustique. Un insecte est ainsi modifié en introduisant un gène rendant sa progéniture non-viable, donc en le rendant stérile. Les insectes modifiés ont besoin d’un antibiotique, la tétracycline pour survivre. L’activité de ce gène peut être inhibée par cet antibiotique, ce qui permet de cultiver la souche d’insecte en laboratoire. Si ces animaux sont libérés en grand nombre et s’accouplent avec des femelles, la dépendance aux antibiotiques est transmise à la génération suivante et la progéniture meurt.
La première expérimentation s’est déroulée en 2009, sur les îles Caïman et elle a été financée par la fondation Bill et Melinda Gates. Environ trois millions d’insectes mâles de type aedes aegypti modifiés (dénommés OX513A) ont été libérés. Après onze semaines, la population d’insectes a diminué de 80 %. Cela a permis de démontrer que les insectes mâles modifiés étaient capables de survivre en condition réelle et de se reproduire avec des moustiques femelles sauvages. En mai 2016, les îles Caïman ont annoncé leur désir d’utiliser ce programme pour combattre les virus portés par ces moustiques.
En 2011, la même expérience menée au Brésil en collaboration avec l’entreprise Moscamed et l’université de Sao Paulo a permis de constater la réduction de 80 à 95 % des insectes. En avril 2014, pour lutter contre le virus Zika, le produit OX513A contre le moustique aedes aegypti a été approuvé par la Commission nationale de biosécurité technique du Brésil. Un essai a été réalisé en 2016 dans la ville de Piracicaba, près de Sao Paulo. Le but est de décimer la population de moustiques, qui a effectivement été réduite de 80 %, mais localement et temporairement, car les années suivantes, il faut recommencer des lâchers. Une évaluation du coût de cette technique est nécessaire avant d’envisager de la généraliser. En 2016, l’agence chargée des régulations de santé au Brésil (Anvisa) a déclaré souhaiter que la société Oxitec prouve la fiabilité et la sûreté de cette technologie, et surtout que la transmission du virus entre moustiques s’affaiblisse dans le temps (réversibilité).
D’autres essais en plein champ ont été effectués en Malaisie et au Panama. Un prochain essai sur les ilots (keys) de Floride est en cours d’autorisation par la Food and Drug Administration (FDA).
La technique d’Oxitec présente l’avantage de ne pas avoir d’effets collatéraux comme les insecticides chimiques. Elle a néanmoins l’inconvénient majeur d’avoir une efficacité très limitée dans le temps. Elle ne réduit que très ponctuellement la population d’insectes.
2. Le biocontrôle par la bactérie wolbachia
Un autre projet concerne des moustiques chez lesquels est introduite une bactérie wolbachia. Celle-ci colonise les moustiques avec, encore une fois, deux modalités possibles : soit accroître leur résistance aux virus (dengue, Zika) ; soit rendre les moustiques mâles stériles. Il est possible de combiner les deux. Les moustiques ne sont pas modifiés génétiquement. Les équipes leaders référentes dans la lutte biologiques par des bactéries de type wolbachia, résident en Australie.
Un test est en cours sur l’île de Paquetá dans la baie de Rio de Janeiro au Brésil. Il a permis d’augmenter la résistance du moustique aux virus. Un autre test est en cours en Afrique. Le programme Eliminate Dengue, en partie financé par la fondation Bill et Melinda Gates, a permis d’introduire le même type de moustiques porteurs de la bactérie wolbachia en Australie, Brésil, Colombie, Indonésie et Vietnam, afin de lutter contre la dengue (102).
La Chine expérimente également des lâchers de moustique à grande échelle. Une entreprise de la région de Ghangzhou, au sud-est de la Chine, se définit comme « la plus grosse fabrique de moustique du monde ». Elle a introduit wolbachia dans un moustique initial, qui a transmis à près de 20 millions de descendants de moustiques de type Aedes albopictus la bactérie wolbachia, de génération en génération. Dans ce cas particulier, wolbachia rend stériles les accouplements entre mâles infectés et femelles sauvages. Un premier lâcher de 500 000 moustiques mâles a été effectué sur une île au large de la ville en mars 2015. Cette expérience, menée par un professeur de l’université chinoise Sun Yat-Sen et de l’université américaine du Michigan, Xi Zhiyong, démontre une baisse de 50 % de la population des moustiques sur l’île. Un second lâcher de 20 millions de moustiques par semaine, toujours en Chine, est prévu pour 2017.
3. L’utilisation des technologies CRISPR et les potentialités du forçage génétique (gene drive)
Nous sommes aujourd’hui confrontés aux limites des méthodes de lutte actuelle contre les insectes, car même si, comme l’indique l’OMS, les moyens de lutte traditionnelle ont permis d’abaisser le nombre de victimes de ces terribles maladies, les insectes s’adaptent en permanence et mettent en place des stratégies de résistance ou de contournement. C’est là que CRISPR-Cas9 avec la technologie du forçage génétique apporte une potentialité nouvelle.
Le forçage génétique est une technique d’ingénierie génétique qui permet de propager une modification génétique au fil des générations. Le forçage génétique peut être utilisé de deux façons très différentes, puisqu’il peut soit permettre d’insérer des gènes qui bloqueraient la transmission de virus pour réduire la transmission du virus sans éliminer les moustiques, soit éradiquer les populations de moustiques et autres vecteurs. Il consiste à déjouer (ou à forcer) les lois de la génétique mendélienne où un chromosome vient du mâle, l’autre de la femelle. Il constitue un mécanisme de propagation pour transférer ces modifications au sein de la population sauvage au fil des générations et pourrait s’avérer d’une grande efficacité.
Par rapport à la technique d’Oxitec précédemment décrite, le forçage génétique présente une efficacité puissance dix par le fait que la modification de l’espèce se maintient toute seule dans le temps et s’amplifie dans l’espace. L’entreprise privée Oxitec s’est en effet déclarée non intéressée par la technique de forçage génétique, sans doute pour des raisons de rentabilité, car par une seule opération avec cette technique permet de modifier une population entière de façon durable. Cela ne justifie pas commercialement l’énorme investissement d’usines à moustiques… Ce type de raisonnement pose la question du choix entre commercialisation ou action publique sur ces techniques.
En organisant le transfert d’un gène d’infertilité sur les deux allèles (chromosomes), on obtient un forçage génétique à but d’élimination. Les nouvelles biotechnologies permettent donc de transférer le gène d’infertilité à chaque nouvelle génération de moustique. Chaque croisement entre un moustique sauvage et un moustique modifié et stérile ne donne que des moustiques stériles. Eric Marois, l’a résumé lors de l’audition publique du 7 avril 2016 : « cette réparation de l’ADN a donc pour effet de produire une photocopie du chromosome transgénique dans le chromosome sauvage pour obtenir ainsi deux copies du chromosome transgénique. Cet organisme, s’il s’agit d’une femelle, sera stérile... Ce forçage génétique n’est rien d’autre qu’une sorte de système contraceptif pour les insectes ».
La technique du forçage génétique, qui fonctionne en théorie sur toute espèce à reproduction sexuée, est décrite sommairement ci-dessous. L’application à laquelle on pense immédiatement concerne les moustiques vecteurs de maladies. D’autres espèces animales comme les mammifères invasifs (rats, belettes, opossums…) pourraient un jour être concernées. En relâchant simplement quelques individus modifiés qui possèdent une portion d’ADN élaborée par l’homme (appelée cassette de forçage génétique – gene drive) (103) dans une population naturelle, on peut théoriquement obtenir en quelques dizaines de générations une population entièrement contaminée par cette cassette. En introduisant au préalable dans la cassette la séquence d’ADN qui convient (conférant une résistance au parasite du paludisme par exemple), il est donc possible de transformer, voire d’éteindre une espèce de la nature.
PROPAGATION D’UNE MUTATION CLASSIQUE
ET D’UNE CASSETTE GENE DRIVE
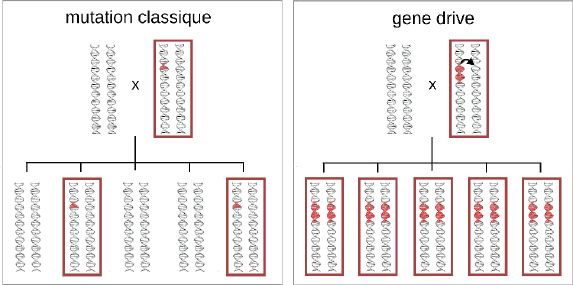
Source : Baptiste Morizot et Virginie Orgogozo.
Comme l’expliquent M. Baptiste Morizot et Mme Virginie Orgogozo (104), « chaque individu est représenté schématiquement par une paire de chromosomes. Les individus portant la mutation rouge ou la cassette de forçage génétique (gene drive) sont encadrés en rouge.
« En théorie, si 10 individus génétiquement modifiés et possédant une cassette de forçage génétique sont introduits dans une population naturelle de 100 000 individus, alors plus de 99 % des individus seront porteurs, en moyenne de cette cassette au bout de seulement 12-15 générations. À l’inverse, une mutation génétique présente dans les mêmes proportions aura disparu de la population au bout de quelques générations, sauf si elle possède un avantage sélectif.
Cette technique permet ainsi de disséminer à grande vitesse une modification du génome dans l’ensemble d’une population d’individus soumis à une reproduction sexuée ».
Le forçage génétique ne date pas de CRISPR-Cas9, mais cette technique l’a rendu très facilement utilisable. La première publication sur le forçage génétique a été signée par M. Austin Burt 2003, qui qualifiait sa technologie de transfert de « gène égoïste » car elle pouvait ensuite modifier toute la population (105). D’autres auteurs ont publié des travaux qui portaient en germe celles qui se sont développées grâce aux nouvelles biotechnologies et à CRISPR-Cas9 (106). Le premier exemple de forçage génétique chez les moustiques a été publié en 2011. Comme il était encore difficile de produire des ciseaux moléculaires à séquence spécifique de type CRISPR, le site-cible de l’enzyme, une endonuclease, avait été artificiellement introduit dans le génome, fournissant la preuve de principe.
Le ciseau moléculaire que constitue CRIPSR-Cas9 a incontestablement donné le véritable coup d’envoi du forçage génétique. L’équipe de l’université de Californie à San Diego (UCSD), avec Ethan Bier, professeur en biologie cellulaire et du développement, et Valentino Gantz, post-doctorant, à qui les rapporteurs ont rendu visite, viennent de produire des moustiques modifiés génétiquement par CRISPR-Cas9 pour résister aux parasites responsables du paludisme (plasmodium) et qui sont capables, contrairement aux règles de l’hérédité de Mendel, de transmettre cette modification à près de 98% de leur descendance, grâce au forçage génétique qui est donc une sorte de copier-coller qui passe d’un gène à l’autre. Chaque femelle transmet seulement le patrimoine génétique du mâle (modifié), comme le montre le schéma présenté ci-dessus. En dix générations de moustiques (soit un à deux ans), 100 % d’une population peut être modifiée. Les chercheurs ont fourni la preuve du concept en modifiant la couleur des yeux de mouches par fluorescence. Ils peuvent modifier des moustiques pour les rendre résistants à des parasites du genre plasmodium transmis par des moustiques infectés. La mise au point de ce mécanisme de copier/coller génétique pour propager un gène nouveau au sein d’une population sauvage au fil des générations est une avancée majeure (107). Il permet, comme l’indique une note des services scientifiques de l’ambassade de France aux États-Unis, du 4 décembre 2015 (108), la « transmission du mécanisme à l’intégralité de la génération suivante et l’installation progressive du transgène dans la population. Ce système pourra ainsi conduire à l’immunisation au fil des générations, de cette espèce de moustique face au parasite ».
Les deux chercheurs Ethan Bier et Valentino Gantz estiment que leur méthode de forçage génétique permet de ne cibler qu’une seule espèce et est donc préférable à celle des insecticides, qui nécessitent des traitements répétés, et qui tuent tous les moustiques indistinctement. « L’intérêt de l’utilisation du forçage génétique est que l’on peut choisir le moustique à éliminer, alors que les insecticides tuent sans discernement ». Ils estiment que le risque de contamination des autres moustiques, voire d’autres organismes vivants, est très faible. « Oui, il y a un risque, mais si on ne fait rien, on condamne de fait des milliers de personnes à mourir ».
Ethan Bier et Valentino Ganz ont testé leur méthode en milieu confiné sur le paludisme. Ils souhaitent maintenant la tester, en partenariat, avec d’autres centres de recherche, sur la dengue et le virus Zika. Ils envisagent de l’expérimenter d’ici un an, en milieu ouvert, sur une île contaminée par le paludisme avec une seule espèce de moustique porteur du parasite. Ils demanderont les autorisations règlementaires pour généraliser cette expérimentation d’ici cinq ans. Ils posent également la question du protocole de Carthagène qui interdit tout transfert de génome dans un virus, ce qui pourrait fortuitement se produire en utilisant cette technique, et souhaitent que ces questions soient traitées par l’OMS et par le Programme des Nations unies pour l’environnement (PNUE) pour fixer un cadre à l’utilisation des technologies de forçage génétique en se conformant à des règles éthiques.
D’autres équipes travaillent sur le forçage génétique, ainsi celle de l’université de Californie à Irvine (Anthony James), celles de l’Imperial College de Londres (Andrew Hammond, Tony Nolan, Andrea Cristani) ou encore celle de l’université de Strasbourg (Eric Marois).
Les premières expérimentations de moustiques modifiés avec forçage génétique sont donc attendues très prochainement.
Le forçage génétique a ses défenseurs et ses détracteurs. S’il offre l’avantage d’un moindre épandage d’insecticides, qui tuent les insectes et autres animaux de l’écosystème (notamment aquatiques) de façon indifférenciée et dont les effets sur la santé humaine sont plus ou moins toxiques, il pourrait aboutir à une modification permanente, voire à l’extinction de l’espèce en rendant les femelles stériles.
Ces recherches suscitent des espoirs et des craintes. L’une de celles sur lesquelles les rapporteurs attirent l’attention est celle du caractère irréversible de l’introduction des gènes que portent ces moustiques de laboratoire ou d’autres éventuels vecteurs dans les populations sauvages et les conséquences écologiques qui pourraient en résulter. La question de l’effondrement de la biodiversité se pose bien sûr, mais tous les experts pensent que l’agriculture hautement productive, le recours aux pesticides et engrais chimiques ont eu plus d’incidences sur la transformation globale du monde vivant que les techniques de modifications ciblées de gènes de certains vecteurs.
Les rapporteurs pensent que le contrôle des populations d’insectes porteurs de maladies est plus ciblé donc moins nocif que l’usage des insecticides en grande quantité, comme cela se pratique encore aujourd’hui.
La grande variabilité génétique des espèces sauvages par rapport aux modèles de laboratoire ne garantit pas la stabilité et l’efficacité de l’introduction de gènes de résistance dans le temps. Les rapporteurs préconisent donc la réversibilité des systèmes et l’élaboration de règles à l’échelon européen et international.
4. Position de l’OMS sur les techniques de lutte génétique contre les maladies à transmission vectorielle
Les rapporteurs ont rencontré à Rome M. Dirk Engels, directeur du département des maladies tropicales négligées, dépendant de l’OMS. Il leur a présenté les travaux du Vector Control Advisory Group (VCAG), créé il y a trois ans, qui conseille l’OMS sur les biotechnologies en lien avec les maladies à transmission vectorielle,
Ce groupe VCAG fonctionne avec des experts invités, une dizaine de permanents de toutes les zones du monde. Ponctuellement, l’OMS invite des experts spécifiques sur les techniques spécifiquement traitées.
L’OMS veut mettre en place, en complément aux méthodes classiques qui fonctionnent (par exemple les moustiquaires imprégnées), mais qui sont coûteuses, de nouvelles pratiques qui pourraient avoir un impact sur les moustiques et sur les maladies dont ils sont porteurs. Le VCAG a reçu une dizaine de propositions d’études ou d’expérimentations, venant des universités et des entreprises, qui sont en cours de développement et qui proposent de nouveaux outils.
Le VCAG est en cours d’évaluation dans trois stratégies de lutte :
1. Les moustiques génétiquement modifiés par la firme Oxitec. D’ailleurs en 2016, l’OMS a encouragé le processus de contrôle génétique des populations d’insectes pour lutter contre la propagation du virus Zika.
2. Le biocontrôle par la bactérie Wolbachia. Cette bactérie, qui colonise les vecteurs, a deux effets selon la souche de wolbachia employée : celui de rendre stériles les moustiques en diminuant donc les populations, mais aussi celui de bloquer la transmission des virus.
3. L’utilisation de la technologie CRISPR. L’inactivation d’un gène pose un problème de réversibilité, bien que M. Dirk Engels estime qu’en soi, l’absence de réversibilité n’est pas un problème si la technique fonctionne toujours de façon satisfaisante.
Pour l’OMS, les manipulations génétiques ne constituent pas une solution miracle, mais sont complémentaires aux méthodes traditionnelles. Elles seraient plus efficaces quand les populations de moustiques sont limitées. Le contrôle d’une population de moustiques a donc une dimension écologique et une problématique toute différente de celle de la manipulation du génome humain.
Le développement des méthodes biotechnologiques ou d’autres techniques pour contrôler les populations de moustiques se sont développées en France (universités de Strasbourg, de Montpellier, de Paris Sud et Institut Pasteur…), ainsi qu’au Royaume-Uni aux États-Unis, et en Australie. Par contre, les pays les plus concernés par ces insectes porteurs de maladies vectorielles sont les pays du sud. C’est pourquoi, afin de faire dialoguer pays du nord et du sud et de développer une approche plus collaborative entre eux, l’OMS a prévu d’organiser une réunion sur les enjeux éthiques des techniques de contrôle de la transmission des maladies vectorielles, en juillet 2017 à Genève. Des experts spécialisés sur les questions éthiques, y participeront.
De par sa compétence sur la santé et sa couverture mondiale, il revient à l’OMS de répertorier et coordonner les différents projets de modification génétique des moustiques, et de créer une instance de dialogue entre les pays du nord, détenteurs de la technologie, et du sud, principales victimes de ces maladies.
5. Les pays en pointe sur les technologies de modification du génome des vecteurs
• Le Royaume-Uni est un leader mondial sur ces technologies, mais également sur la réflexion éthique
Le Royaume-Uni est leader mondial incontesté dans les recherches sur la modification des moustiques. La Chambre des Lords britannique a publié en décembre 2015 un rapport sur les insectes modifiés, qui a été suivi d’un large débat parlementaire.
Le rapport publié le 17 décembre 2015 par la Chambre des Lords sur « Les insectes génétiquement modifiés » (109) s’organise en cinq chapitres : un premier introductif, puis la science qui sous-tend les OGM, l’application des insectes génétiquement modifiés et la technologie, ensuite la commercialisation, la régulation des insectes et pour finir les inquiétudes, perception et participation du public.
Le rapport invite le gouvernement à lancer un essai sur le terrain d’insectes génétiquement modifiés et à conforter le Royaume-Uni dans son statut de chef de file mondial dans ce domaine de la recherche.
Il conclut que :
– les insectes génétiquement modifiés ont un potentiel considérable pour lutter contre les maladies transmises par les vecteurs et par les ravageurs agricoles, mais ils ne constituent pas une recette miraculeuse ;
– le Royaume-Uni, en tant que leader mondial dans ce domaine de la recherche, pourrait tirer des avantages économiques potentiellement importants ;
– la réglementation de l’Union européenne sur les OGM a constitué un « échec lamentable » qui risque de dilapider ces avantages ; il pense que le gouvernement doit donc veiller à ce que le système réglementaire puisse fonctionner correctement ;
– le déficit d’orientation internationale sur la réglementation et la gouvernance des techniques d’insectes génétiquement modifiés pourrait affecter les pays du sud, susceptibles de bénéficier de ces technologies ;
– le gouvernement devrait lancer un programme de participation du public, en lien avec les essais sur le terrain.
Le rapport recommande au gouvernement, par l’entremise de l’agence britannique de l’innovation, Innovate UK (110), en partenariat avec les conseils de recherche, de soutenir la commercialisation de la recherche au Royaume-Uni sur les insectes génétiquement modifiés.
Le rapport de la Chambre des lords sur les insectes génétiquement modifiés a été globalement validé par le gouvernement britannique, qui estime important de maintenir sa position de leader mondial comme sur le développement des insectes génétiquement modifiés. Le budget attribué à la recherche scientifique a été maintenu, pour son impact sur la santé publique. Le gouvernement pointe le manque de coordination internationale concernant ces sujets, et l’impact écologique que le développement et l’utilisation de ces technologies pourrait engendrer. Il s’agit donc d’un nouveau défi réglementaire. Les signataires du rapport proposent d’autoriser les essais dans la nature, qui donneront lieu à un rapport annuel permettant de voir l’avancée et la durabilité de ces techniques. Enfin, le gouvernement fait part de son engagement à discuter avec l’ensemble des représentants et à instaurer un débat public pour présenter ces nouvelles applications.
Plus généralement, un débat ayant pour but d’identifier les défis et les opportunités scientifiques, technologiques et environnementales des nouvelles technologies dans les domaines de l’agriculture et de la santé a eu lieu à la Chambre des Lords en juin 2016. Les Lords ont pu y évoquer l’urgence d’une application, telle que le procédé de modification d’Oxitec, qui pourrait participer au ralentissement de la propagation du virus.
Les Lords souhaitent que la perception par le public de l’utilité des techniques de modification ciblée du génome change, et qu’il s’approprie les possibilités qu’elles offrent. Pour eux, il demeure primordial d’établir et de proposer un débat public pour entendre les inquiétudes de la population sur ce sujet, relayant ainsi les questionnements d’ordre écologique, les risques que cela pourrait engendrer, leurs évolutions ou encore le rôle de nouveaux organismes pathogènes. De plus, ils souhaitent que les risques soient évalués avant toute commercialisation. Les scientifiques et les législateurs sont conscients des risques potentiels véhiculés par ces techniques engageant un tournant important dans le domaine de la science. Ainsi, il est important de poursuivre des réunions de travail qui encouragent la recherche et l’innovation de ces technologies, ciment d’une science nouvelle.
• La recherche aux États-Unis se focalise sur la réversibilité des techniques de forçage génétique
Pour M. George Church, professeur au département de génétique de la Harvard Medical School, le forçage génétique est une technologie très prometteuse, notamment pour lutter contre des maladies comme le paludisme. Mais à son avis, toute nouvelle technique doit être réversible. Avec son équipe, il développe une procédure de réversibilité (recall), qui semble bien fonctionner mais qui doit être testée sur d’autres organismes.
Mme Jennifer Doudna, professeur à l’université de Berkeley en Californie, estime qu’il serait utile de contrôler la dispersion des maladies en apportant une modification génétique. Cependant, il faut apprécier l’impact sur l’environnement. Elle dit partager l’avis de George Church sur la réversibilité, car il est important d’être en mesure de stopper tout processus de propagation d’un gène dans la nature.
C’est aussi la position de M. Kevin Esvelt, professeur au Massachussetts Institute of Technology (MIT), qui souhaite le développement des technologies CRISPR pour modifier certaines espèces, mais que la dissémination dans la biosphère d’un caractère soit réversible, et qu’un mécanisme d’autorisation soit mis en place car « nous scientifiques sommes moralement responsables des conséquences de notre travail ». Il pense que l’actuelle réglementation n’est pas assez stricte.
L’Union internationale pour la conservation de la nature (UICN) (111) a d’ailleurs voté une motion refusant la décision de dissémination dans la nature de « gènes génocidaires ».
• La Suisse veut une évaluation
Pour M. Patrick Linder, président de la plateforme « biologie » de l’Académie suisse des sciences naturelles (SCNAT), le contrôle numérique des insectes vecteurs de maladie est préférable à l’extinction. Le forçage génétique est un sujet sensible pour des raisons sociétales. Il faut évaluer les conséquences d’une diminution ou d’une éradication totale d’une espèce avant d’utiliser une telle technique. Toutefois, cette méthode lui semble meilleure que l’utilisation d’insecticides, qui ciblent plus largement les variétés d’insectes.
• Les lâchers en plein air de moustiques au Brésil
Comme il a été dit précédemment, au Brésil, des expériences sont en cours.
M. João Trinidade Marques, professeur à l’université fédérale du Minas Gerais (UFMG), rappelle que plusieurs essais de lâchers de moustiques modifiés ont été effectués au Brésil (112).
Il n’y a pas encore de lâchers de moustiques modifiés avec forçage génétique (gene drive), qui pourraient être autorisés dans trois à cinq ans. La question est maintenant éthique et réglementaire. Des associations s’y opposent catégoriquement et l’UICN a demandé un moratoire jusqu’en 2020 pour laisser le temps de mettre en place une réglementation internationale.
Les mécanismes de réversibilité (recall) fonctionnent en laboratoire. Il reste à les tester dans la nature. M. João Trinidade Marques regrette l’absence de coordination entre les groupes de recherche qui modifient des moustiques. Il propose la tenue d’une conférence mondiale sur le sujet.
M. Alexandre Nepomuceno, chercheur de l’Embrapa et spécialiste de la CTNBio (commission technique nationale de biosécurité), explique que des expérimentations ont été réalisées dans les États de Bahia (à Juazeiro) et de Sao Paulo avec le moustique génétiquement modifié d’Oxitec. Quand il est relâché dans la nature en l’absence de son antidote la tétracycline, ce moustique transgénique devient infertile, ce qui a permis de réduire de 80 % la population de moustiques dans les zones de test.
Le forçage génétique est un des thèmes qui seront couverts par la prochaine proposition de loi de la CTNBio. Il s’agit d’une technologie très puissante à utiliser avec précaution car elle fait proliférer un gène parmi une population. Au Brésil, toutes les précautions sont prises pour pouvoir l’utiliser. Aucune demande d’autorisation n’a encore été formulée.
*
* *
6. Conclusion sur les biotechnologies appliquées à la lutte biologique
Les rapporteurs pensent que :
– les techniques utilisées sont très variées et que certaines d’entre elles s’apparentent à des systèmes de « vaccination » et ne posent pas les mêmes questions éthiques que celles qui consistent à disséminer dans la nature des gènes « génocidaires » qui pourraient éradiquer complètement une espèce de moustiques ;
– les différentes techniques de modification de moustiques ne constituent pas des solutions miracles, mais peuvent avantageusement compléter la boite à outil des moyens de lutte contre les maladies à transmission vectorielle, notamment celles utilisant les moustiquaires imprégnées d’insecticides ou de traitement des eaux stagnantes ;
– toute décision devra être prise après une évaluation détaillée. L’évaluation des risques devra être effectuée avant tout déploiement commercial ou dans le cadre d’une intervention du secteur public. Elle englobera notamment ceux concernant le vecteur : effet hors-cible en transformant une autre partie du génome ; apparition de résistances ; possibilité de propager d’autres agents infectieux. Il faudra également évaluer la place du vecteur dans l’écosystème et notamment l’impact de la modification du génome des larves ou des individus adultes par des prédateurs (insectes, araignées, batraciens, chauve-souris, oiseaux…) ;
– il faudra prendre en compte la balance entre les risques pour l’environnement, dont certains sont hypothétiques, et les bénéfices en termes de préservation de vies humaines, qui sont réels et immédiats, mais aussi de la diminution d’intrants chimiques comme les insecticides.
Eric Marois a affirmé cette position lors de l’audition du 7 avril 2016 : « Jusqu’à présent, nos méthodes de lutte étaient très brutales, les insecticides par exemple sont non spécifiques et éliminent donc la totalité des insectes présents dans le périmètre traité ». Ces substances ont ainsi contribué à un appauvrissement global de la biodiversité. Un autre problème des insecticides vient du fait qu’ils exercent par nature une pression de sélection sur les insectes, les moustiques notamment y deviennent de plus résistants ce qui compromet par exemple la lutte contre l’invasion du moustique tigre. Si les techniques de forçage génétique suscitent parfois du scepticisme quant à leur efficacité réelle sur le terrain, il se pourrait, à l’inverse, que cela fonctionne trop bien et que l’éradication d’une espèce impacte l’écosystème. C’est en effet la première fois que l’on se sent en mesure d’éradiquer intentionnellement une espèce. Ceci suppose donc une responsabilité, une réflexion énorme en amont. Il convient à cet égard d’effectuer une distinction importante entre : les espèces autochtones, comme l’anophèle en Afrique, qui est intégrée à son écosystème et soutient probablement le développement de nombreux prédateurs, et que l’on devrait seulement pouvoir modifier ; et des espèces invasives comme le moustique tigre dans le sud de la France, qui n’appartient pas à l’écosystème et n’a aucune légitimité à s’y trouver. Dans ce dernier cas, on ne devrait avoir aucun scrupule à l’éliminer.
D’ailleurs d’autres méthodes de lutte, comme l’assèchement ou le drainage des zones humides, portent également atteinte à l’environnement.
Les rapporteurs ont pu se rendre compte que les pays du nord sont à la pointe du développement des technologies de contrôle des populations de vecteurs et en particulier de moustiques, alors que celles-ci sont principalement utilisées dans les pays du sud. Un dialogue nord-sud sur les risques et les bénéfices de l’introduction de ces technologies de lutte génétique contre les maladies à transmission vectorielle est donc nécessaire, car les positions de ceux qui subissent chaque jour les dégâts de ces maladies sont, sans doute, différentes de celles de ceux qui y réfléchissent théoriquement.
Ils proposent que chaque projet ou expérience fasse l’objet d’une déclaration préalable auprès du groupe Vector Control Advisory Group (VCAG) de l’OMS, qui pourra ainsi constituer un lieu d’évaluation de ces techniques. En effet, les différentes expérimentations de lâchers de moustiques modifiés ne sont pour l’instant pas coordonnées entre elles.
Les rapporteurs soutiennent donc la position de l’Union internationale pour la conservation de la nature (UICN), ou encore celle de la Chambre des Lords britannique, visant à organiser un système d’évaluation internationale avant de procéder à la dissémination de transgènes dans la nature.
Enfin, ils se prononcent pour l’obligation de prévoir un mécanisme de réversibilité (recall) avant d’expérimenter toute technique de modification génétique de moustiques dans la nature, afin de pouvoir revenir en arrière en cas d’effets non désirés. Eric Marois a également abordé cette question, déclarant que les systèmes biologiques proposés par les laboratoires doivent être extrêmement aboutis. Il n’est en effet pas envisageable de se permettre de proposer un système bancal ou non optimal. Il est en outre important de proposer, si possible, une solution avec antidote, pour pouvoir éventuellement défaire ce qui a été fait. Ceci est actuellement en développement.
Les rapporteurs s’opposent à tout projet d’extinction ou d’éradication d’une espèce de moustique endogène qui ne permettrait pas de retour en arrière. Ils privilégient donc les techniques « d’immunisation » des moustiques, afin qu’ils ne portent plus ces maladies transmissibles à l’homme.
Recommandation n° 8 : Pas d’autorisation d’éradication d’espèces vivantes sans possibilité de retour
– Encourage la continuation des recherches et expérimentations relatives aux différentes techniques de modification d’espèces de moustiques et autres vecteurs, y compris par le forçage génétique ;
– Estime que les décisions relatives à ces techniques doivent être prises dans le cadre d’une évaluation détaillée prenant en compte la balance entre les risques environnementaux et les bénéfices pour des millions de patients victimes de maladies véhiculées par les moustiques ;
– Demande l’instauration d’un mécanisme obligatoire de réversibilité (recall) pour toute modification génétique d’une espèce de moustique, afin de pouvoir faire face à d’éventuels effets indésirables ou non conformes au but recherché. S’oppose en particulier à tout projet d’extinction d’une espèce vivante sans possibilité de retour en arrière, notamment en transférant un gène d’infertilité ;
– Souhaite que la réglementation de l’Union européenne ne répète pas sur les nouvelles biotechnologies les erreurs commises sur la gouvernance des organismes génétiquement modifiés (OGM) et qu’un mécanisme d’autorisation préalable européen soit mis en place avant toute dissémination dans la nature. Il serait opportun de prévoir une gouvernance au niveau international et un réexamen des dispositions du protocole de Carthagène en tenant compte du développement des nouvelles biotechnologies ;
– Considère que la modification d’une espèce de moustique est un sujet d’importance planétaire qui nécessite que tout projet ou expérimentation fasse l’objet d’une déclaration préalable et d’une évaluation auprès du groupe de travail spécialisé de l’OMS et souligne le rôle du groupe de travail spécialité Vector Control Advisory Group (VCAG) ;
– Souhaite qu’un projet du Programme des Nations unies pour l’environnement (PNUE) étudie les impacts de ces technologies sur la biodiversité et les équilibres écologiques ;
– Propose que la France prenne l’initiative d’un dialogue nord-sud sur l’utilisation des nouvelles biotechnologies, et en particulier des technologies de modification ciblée du génome, pour lutter contre les maladies à transmission vectorielle et soutienne l’initiative de la conférence que souhaite organiser l’OMS.
B. LES BIOTECHNOLOGIES BLANCHES POUR DES MODES DE PRODUCTION DURABLES
Les biotechnologies blanches constituent un enjeu économique et environnemental important. Une filière industrielle, qui permettrait de produire de façon durable des produits actuellement issus de la chimie traditionnelle, actuellement très polluante, pourrait transformer radicalement les industries. Les mécanismes de captation de CO2 se développent. De multiples jeunes pousses (start-up) sont créées à cette fin.
Les travaux des deux centres d’excellence en matière de biotechnologies blanches : le Genopole d’Évry et le Toulouse White Biotechnologies (TWB) illustrent ce potentiel.
L’Allemagne a pris la mesure des enjeux économiques et environnementaux des biotechnologies blanches, comme le montre le tout récent rapport de l’office des choix technologiques (TAB) du Bundestag.
• Un exemple au Genopole d’Évry, des micro-organismes pour fabriquer des produits chimiques
M. Cyrille Pauthenier, président d’Abolis, a présenté sa société, Abolis, qui reprogramme génétiquement des micro-organismes pour leur faire fabriquer des produits chimiques d’intérêt. Le processus de fabrication est rendu plus propre, en remplaçant les solvants et autres produits chimiques par du sucre et de l’eau à 37°C, qui pourront être traités plus facilement
L’objectif des biotechnologies blanches est le traitement des molécules qui ne sont pas recyclables : en chimie traditionnelle, les entreprises ont fait le tour des optimisations possibles. Il y a donc un besoin de chimie alternative, de trouver des molécules biodégradables pour des raisons évidentes de protection de l’environnement.
Le dropping, consiste à faire la même molécule mais avec des moyens propres. C’est très long, car cela veut dire changer toute la chaine de production. Cela revient à substituer un siècle de chimie industrielle par des procédés plus écologiques.
Abolis propose des solutions pour la qualité de l’air et de l’eau, ainsi que pour les problématiques liées à la chimie. M. Cyrille Pauthenier a compris qu’il y avait un marché en voyant que les besoins des grands groupes étaient tels qu’ils allaient chercher les solutions dans les laboratoires académiques. Les fonds d’investissement capital-risque ont confirmé qu’une telle société devait voir le jour. Dès à présent, Abolis est victime de son succès : elle a de nombreux clients.
Les industriels sont déjà familiarisés avec ces nouvelles techniques. Ensuite, ils pourront choisir de les utiliser pour innover dans leurs produits. Mais penser en termes de propriété est beaucoup plus compliqué qu’en termes de molécule.
Abolis a aujourd’hui des solutions pour 30 % de la chimie. L’avenir de la chimie passe par les molécules biodégradables et la substitution de procédés.
• Toulouse White Biotechnology (TWB), une structure qui finance l’innovation technologique
Toulouse White Biotechnology (TWB) est un démonstrateur préindustriel, dont le nom constitue un hommage à Jean Tirole, qui a créé la Toulouse School of Economics (TSE) avant qu’il ne reçoive le prix Nobel. M. Pierre Monsan, directeur fondateur de TWB, a expliqué lors de l’audition publique de l’OPECST du 27 octobre 2016, que sa structure créée en 2010 et lauréate en 2011 a pour but d’accélérer le transfert des résultats de la recherche fondamentale vers des applications industrielles. Cet accord de consortium qui travaille sous l’égide de l’Institut national des sciences appliquées de Toulouse (INSA), l’INRA et le CNRS, simplifie les négociations avec les organismes publics et permet de conclure un contrat en moins de six mois Il est financé à hauteur de 20 millions d’euros par le PIA1.
Les trente entreprises regroupées, comprennent des grands groupes tels que Total, Michelin ou L’Oréal, mais aussi que des petites structures comme PILI, entreprise composée de trois chercheurs. Y figurent des partenaires français, mais également chinois, américains, belges et suisses. L’autre originalité de ce consortium est de faire participer quatre financiers prêts à investir dans la création de jeunes pousses (start-up) et un pôle de compétitivité « Industries et Agroressources » mais aussi d’intégrer des philosophes et des sociologues, Une fois par mois se tient un café éthique avec des chercheurs, des techniciens et des personnels administratifs, pour les sensibiliser à la problématique de la modification du vivant.
L’activité de TWB repose sur l’utilisation d’outils biologiques innovants (enzymes, micro-organismes, consortia microbiens) qui seront implantés au cœur de procédés industriels performants, pour les marchés de la chimie (produits de base, pharmacie, arômes…), des matériaux et de l’énergie.
Ainsi a été financé pendant deux ans et demi un projet de l’équipe de Denis Pompon, chercheur au CNRS, qui contribué à développer des levures de boulanger pour produire de l’hydrocortisone, vingt-trois étapes de synthèse chimique. Denis Pompon a proposé de transformer cette levure de boulanger en micro-algue, soit remplacer le sucre traditionnel par du CO2. Ce projet a abouti au dépôt de trois brevets.
Sofinnova a financé en novembre 2015 l’entreprise EnobraQ. Qui permet l’utilisation du CO2 comme matière première de fermentation industrielle, afin de produire de grandes quantités de produits chimiques de façon durable.
Alors M. Pierre Monsan espère que, par le PIA 3, le Commissariat général à l’investissement (CGI) financera la recherche fondamentale et créative pour soutenir ces résultats innovants à l’instar du Royaume-Uni, qui en est à sa troisième feuille de route sur biologie de synthèse et a investi 350 millions de livres sterling.
• En Allemagne, un rapport de l’office des choix technologies (TAB) table sur la biotechnologie blanche
Le rapport de novembre 2016 de l’office des choix technologiques du Bundestag allemand (Büro für Technikfolgen-Abschatzung beim Deutschen Bundestag – TAB) intitulé « La biotechnologie blanche : statut et perspectives de la biotechnologie industrielle pour les entreprises durables » (113), décrit le développement de la biotechnologie industrielle en Allemagne en présentant des analyses pour les secteurs différents concernés. Il ébauche les perspectives économiques de la biotechnologie et propose des mesures politiques pour atteindre l’objectif d’une « bioéconomie ».
Le TAB prédit un impact positif des biotechnologies blanches sur l’économie allemande, en dépit du manque d’études avec des résultats quantifiables. L’impact sur l’emploi serait neutre en raison de substitution d’emplois entre branches industrielles et biotechniques ; la spécificité allemande est le savoir technologique, avec un grand nombre des brevets.
L’Asie, les États-Unis ou encore le Brésil sont les principaux pays pour les produits chimiques de base dont la production industrielle nécessite une grande quantité de la biomasse disponible. L’avantage compétitif de l’Allemagne, et de l’Europe, réside dans la production biologique des produits chimiques raffinés (enzymes), dans la transformation des matières plastiques biologiques importés et dans les services basés sur le savoir-faire technologique. Les enzymes, dont le chiffre d’affaire mondial est estimé à 3,5 milliards d’euros, jouent un rôle important pour la production d’aliments ou de détergents.
Ces dernières années, l’industrie chimique allemande, grâce à sa priorité sur la recherche et l’innovation, a mis l’accent sur la biotechnologie industrielle, qui est déjà employée dans la production des produits chimiques raffinés et des produits chimiques spéciaux. Les branches industrielles connaissent un développement différencié des biotechnologies blanches. L’Allemagne compte soixante entreprises spécialisées dans les biotechnologies. Comparée à d’autres pays, elle ne joue pas un rôle majeur comme site de production. Cela est notamment dû à la faible disponibilité et aux coûts élevés des matières premières (fossiles). Par conséquence l’Allemagne a perdu son importance comme exportateur des produits établis de la biotechnologie industrielle (enzymes, vitamines, etc.) et se retrouve à la cinquième place mondiale.
– OGM agricoles
L’importance des biotechnologies a évolué au cours des dernières années dans le secteur alimentaire. Le débat actuel en Allemagne concerne les OGM, qui constituent une particularité de cette branche au sein de la biotechnologie : les acteurs du commerce ainsi que les consommateurs rejettent l’emploi des OGM. Sur le marché allemand, peu de produits alimentaires sont des OGM, en contiennent ou sont fabriqués à partir d’OGM, nécessitant alors un étiquetage. Par contre, un grand nombre de produits alimentaires sont indirectement liés à la technique OGM, car leur processus de production contient des substances génétiques non déclarées comme telles. Cela concerne entre autres les produits alimentaires pour animaux.
Les exportations de produits issus de la biotechnologie industrielle sont bien inférieures aux produits industriels.
– La biomasse
Pour évaluer dans quelle mesure la biotechnologie industrielle pourrait contribuer à la vision d’une bioéconomie fondée sur les ressources renouvelables, il faudrait revenir au potentiel de la production durable de la biomasse. Sur ce sujet, de nombreuses études ambivalentes ont été publiées en marge du débat sur la bioénergie. La surface agricole utile allemande n’est pas suffisante pour que la bioéconomie soit entièrement centrée sur la biomasse. Une bioéconomie complète dépendra grandement des importations de biomasse. L’un des enjeux centraux seraient celui de l’opposition entre nourriture et carburant.
Le rapport du TAB recommande une non-intervention concernant la culture intensive de la biomasse. La culture intensive des ressources renouvelables en Allemagne concernant différentes activités (dont le bilan environnemental), les experts du TAB déconseillent de développer une législation spécifique pour faire progresser les produits issus de la biotechnologie.
Le rapport conseille de promouvoir les activités de R&D et les installations pilotes. Le développement et l’essai des méthodes sur la transition vers une bioéconomie pourraient aussi contribuer à étendre le débat sur la durabilité, par exemple avec des méthodes biotechnologiques qui rendent possible l’utilisation d’autres ressources renouvelables générées d’une manière classique comme les algues. L’objectif est de mettre en pratique une culture durable de la biomasse qui soit la plus écologique possible, même si le dilemme nourriture – carburant persiste et si les nuisances ne peuvent pas être évitées complètement.
Pour inciter à l’utilisation matérielle des ressources renouvelables, un certificat de production de la biomasse devrait être introduit pour que les entreprises obtiennent des subventions de l’État.
L’approche préconisée par les experts pour résoudre ou du moins affaiblir le dilemme nourriture – carburant est de coupler l’utilisation matérielle puis énergétique de la biomasse.
Enfin, en matière de sécurité biologique, les experts du TAB notent que les systèmes abritant les processus de la biotechnologie industrielle sont confinés et que la législation correspondante est déjà développée.
*
* *
En conclusion, les rapporteurs se prononcent pour les recommandations suivantes sur les biotechnologies blanches.
Recommandation n° 9 : Les biotechnologies blanches pour des procédés industriels durables
– Souligne les enjeux économiques et environnementaux importants des biotechnologies blanches (industrielles et environnementales), pour le développement d’une filière d’excellence et de procédés industriels durables et soutient notamment les demandes de financement des biotechnologies blanches par le programme d’investissements d’avenir (PIA 3). La France et l’Europe pourraient d’ailleurs retirer du développement de ces technologies un avantage économique important ;
C. L’IMPACT DES NOUVELLES TECHNIQUES DE SÉLECTION VÉGÉTALE SUR LA BIODIVERSITE
Près de quarante ans après la loi de protection de la nature de 1976, et comme cela résultait des engagements de la conférence environnementale de septembre 2012, le Parlement a renforcé et renouvelé les politiques publiques en faveur de la biodiversité par l’adoption de la loi n° 2016-1087 du 8 août 2016 pour la reconquête de la biodiversité, de la nature et des paysages (114). La France est ainsi dotée d’un opérateur intégré, l’Agence française pour la biodiversité, issue du rapprochement d’opérateurs existants dont l’Office national de l’eau et des milieux aquatiques, et comptant 1 200 agents répartis sur l’ensemble du territoire. L’agence appuie les services de l’État dans la gestion des espaces naturels, la police de l’eau et l’action internationale. La loi crée également un comité national de la biodiversité, instance d’information et d’échange pouvant être consultée par le Gouvernement sur tout sujet relatif à la biodiversité, ainsi qu’un Conseil national de protection de la nature (CNPN), instance d’expertise scientifique et technique. Dans le prolongement de la convention sur la diversité biologique, conclue à Rio en 1992, et du protocole de Nagoya, que la France et l’Union européenne s’apprêtent à ratifier, il est créé un régime d’accès aux ressources génétiques et de partage des avantages découlant de leur utilisation.
Comme il sera expliqué ultérieurement (115), les rapporteurs ont eu la surprise de découvrir que, pendant la discussion du projet de loi relatif à la biodiversité, des amendements avaient été déposés, au Sénat, puis à l’Assemblée nationale, tendant à considérer comme OGM les produits issus des nouvelles techniques de sélection végétale. Ces amendements, heureusement rejetés, n’ont aucun rapport, même lointain, avec l’objet du projet de loi en discussion, comme le démontre d’ailleurs leurs exposés des motifs, qui ne mentionnent même pas l’atteinte à la biodiversité…
Les rapporteurs ont examiné l’impact des nouvelles biotechnologies appliquées aux plantes (New Breeding Techniques – NBT) (116), notamment la modification ciblée du génome, sur la biodiversité, avec en particulier les auditions publiques de l’OPECST des 7 avril et 27 octobre 2016.
M. Eric Marois, chargé de recherche à l’université de Strasbourg et à l’INSERM, estime que ce sont les insecticides qui bouleversent la biodiversité et non les nouvelles techniques. Il faisait remarquer, le 7 avril 2016, que le monde des insectes est extrêmement vaste : il en existe six à dix millions d’espèces dont une infime minorité pose problème. Jusqu’à présent, les insecticides non spécifiques sont des méthodes de lutte très brutales qui éliminent la totalité des insectes présents sur le périmètre traité et ont des effets collatéraux sur les pollinisateurs comme les abeilles et d’autres insectes auxiliaires en agriculture. Ces substances ont contribué à un appauvrissement global de la biodiversité. Elles sont également sources de dangers pour la santé humaine : de plus en plus d’études mettent en évidence des problèmes d’infertilité masculine dus à une exposition aux insecticides ou aux pesticides en général.
M. Yves Bertheau, directeur de recherche à l’Institut national de la recherche agronomique (INRA) et au Muséum national d’histoire naturelle (MNHN), estimait que ce n’est pas aux scientifiques de répondre à la question : ces nouvelles applications iront-elles dans le sens d’une « agriculture durable et compétitive » ? Pour lui, le scientifique ne peut que donner les informations.
C’est ensuite aux responsables politiques de décider, en fonction des expertises qui sont réalisées, des bénéfices et des risques et du principe de précaution.
2. Pour les militants écologistes, les nouvelles techniques de sélection végétale (NBT) sont des OGM qui portent atteinte à la biodiversité
Le conflit est devenu frontal, comme on le constate dans les témoignages rapportés ci-dessous. Pour beaucoup de militants associatifs, les nouvelles technologies sont responsables des évolutions actuelles de l’agriculture.
L’organisation non gouvernementale (ONG) Greenpeace a publié une note de synthèse en juin 2008 intitulée « Les impacts des OGM sur l’environnement et la santé : les preuves » (117), dans laquelle l’organisation estime que les OGM sont néfastes à la biodiversité et à la santé humaine. Les écologistes auditionnés en octobre 2016, assimilent les nouvelles biotechnologies aux OGM, sans aucune distinction, et affirment leur futur impact comme une atteinte à la biodiversité.
Ainsi, M. Patrick de Kochko, représentant des Amis de la terre, rappelait qu’il y dix-huit ans, le président Jean-Yves Le Déaut l’avait invité comme paysan victime des OGM brevetés de Monsanto qui avaient contaminé sa récolte de soja bio, mis en faillite le transformateur allemand qui avait acheté son soja, imposant à la filière bio de coûteuses mesures de protection et de traçabilité jamais compensées. […] S’agissant des nouvelles biotechnologies, les clients n’en veulent pas plus que des OGM et leur autorisation sans un cadre minimal poserait des problèmes si leurs semences paysannes étaient contaminées par les plantes brevetées du voisinage. Comment s’en protéger ? […] Après la contamination de ses champs M. Patrick de Kochko a indiqué qu’il avait exploré toutes les voies légales possibles (plainte en 1998, témoignage devant le Sénat, class action aux États-Unis en 1999, etc., qui toutes ont été classées sans suite.
Pour M. Guy Kastler, membre fondateur de la Confédération paysanne, il est impossible de débattre sereinement des progrès scientifiques, techniques et agronomiques liés à ces nouvelles technologies génétiques, de par leur impact sur les brevets, sur la diversité des variétés cultivées : jusqu’à présent, les brevets portaient sur les informations génétiques de la matière biologique (plantes, gène identifié). Comme ces nouvelles techniques prétendent réaliser les mêmes process que ceux observés naturellement, elles s’appliqueront à une plante qui porte la même information génétique que celle contenue par l’invention brevetée.
Les arguments les plus fréquemment rencontrés pour affirmer que les plantes génétiquement modifiées constituent une atteinte à la biodiversité concernent le déclin des populations auxiliaires, y compris les pollinisateurs (coccinelles, abeilles). Certains mouvements écologistes parlent d’« écocide », néologisme créé sur le modèle de « génocide », (qu’ils veulent faire reconnaître par le droit international).
Plusieurs experts de l’Académie d’agriculture et de l’Association française des biotechnologies végétales (AFBV) (118) ont été consultés. Leurs réponses convergent sur quatre points :
– l’environnement doit se concevoir comme un ensemble dynamique dans lequel toute activité humaine a un impact ;
– les nouvelles techniques d’obtention végétale augmentent le nombre de caractères d’intérêt pour l’agriculture et la maîtrise de leur impact dans l’agriculture ;
– il faut envisager ces techniques au cas par cas pour comprendre exactement l’impact d’un caractère génétique nouveau sur l’environnement ;
– les implications de ces technologies d’un point de vue économique sont positives pour la biodiversité des variétés cultivées.
Comme l’ont rappelé les scientifiques interrogés sur cette question, et notamment M. Gérard Tendron, secrétaire perpétuel de l’Académie d’agriculture, l’environnement doit être considéré de manière dynamique, tout comme la biodiversité qui le compose. L’agriculture a depuis toujours modifié l’environnement. La diversité biologique au niveau des parcelles cultivées est plus faible que dans les parties non cultivées, du fait de la lutte contre les mauvaises herbes. Ainsi, les variétés végétales obtenues à partir des nouvelles techniques auront un impact sur l’environnement, tout comme les nombreuses variétés obtenues avec des techniques conventionnelles l’ont déjà profondément modifié. Il ne s’agit pas là d’un bouleversement de l’environnement, d’autant que les NBT ne sont pas envahissantes et que les variétés de plantes domestiquées ont perdu leur capacité de reproduction spontanée comme l’égrenage. De plus, ces technologies permettent de sélectionner plus vite des plantes qui sont adaptées à l’évolution de notre environnement. Ainsi, M. André Gallais, membre de l’Académie d’agriculture, signale lui aussi que ce sont les pratiques intensives de l’agriculture qui détériorent l’environnement et affectent la biodiversité, et non les variétés de plantes génétiquement modifiées.
Pour mieux appréhender l’évolution des agro-écosystèmes, l’AFBV soutient que les scientifiques spécialistes d’écologie (« écologues ») doivent s’approprier les outils de modification ciblée du génome, afin de collaborer avec des biologistes à la mise au point de nouvelles solutions aux défis environnementaux qui se posent à l’humanité. Ces technologies peuvent aider à améliorer la biodiversité en ce qu’elles augmentent le nombre de caractères d’intérêt pour l’agriculture. La précision de ces technologies en fait un très bon outil pour la conservation des ressources génétiques, qui est un « domaine d’importance stratégique », tel que le qualifie M. Georges Pelletier, membre de l’Académie d’agriculture et président du conseil scientifique de l’AFBV. La maîtrise de ces technologies permet de mieux gérer les introductions de nouvelles variétés dans l’agriculture avec leurs effets, plutôt que de les subir.
S’agissant de leur impact sur la biodiversité, Mmes Catherine Regnault-Roger et Agnès Ricroch, membres de l’Académie d’agriculture, estiment qu’une approche au cas par cas est indispensable.
Ainsi, les études recensées attestent que les plantes portant un gène de résistance aux insectes, comme le gène Bt, sont plus respectueuses de la biodiversité que les plantes traitées avec des insecticides, plus respectueuses aussi des insectes non ciblés qui n’agressent pas les cultures. Ils affirment que de nombreuses publications et méta-analyses démontrent aussi que les OGM n’ont pas d’effet sur les abeilles. Pour ces scientifiques, le caractère de résistance aux herbicides n’est pas un danger pour la biodiversité, ce sont les mauvaises pratiques qui y sont associées (monoculture, usage d’un seul type d’herbicide…) qui sont porteuses d’apparitions de résistance chez les mauvaises herbes et d’appauvrissement de la biodiversité environnante. Les caractères génétiquement modifiés de résistance aux virus, tels que par exemple ceux chez le papayer, n’ont jamais fait preuve d’effet négatif sur la biodiversité. Pour une espèce comme le maïs, un événement de transformation génétique peut être introduit dans des centaines, voire des milliers de variétés différentes. Bien au contraire, les plantes génétiquement modifiées pour résister aux herbicides présentent l’avantage que le labour n’est plus utile, ce qui est favorable à la biodiversité des sols (microbiote) et à une amélioration de la biodiversité du sol puisqu’en utilisant l’azote du sol pour leur développement elles nécessitent beaucoup moins d’engrais. Les caractères modifiant une plante pour l’alimentation, tel que l’augmentation de la teneur vitamine, sont sans effet pour la biodiversité, tout comme les plantes cultivées sous serre pour produire des molécules thérapeutiques. Les plantes génétiquement modifiées qui résistent à la sécheresse exigent moins d’irrigation, avec un moindre pompage dans les nappes.
L’AFBV se base aussi sur le rapport des Académies américaines des sciences, de l’ingénierie et de médecine « Genetically Engineered Crops : Experiences and Prospects » de mai 2016 pour conclure qu’aucun des exemples observés n’a démontré un effet écologique négatif résultant d’un flux de gènes d’une culture génétiquement modifiée à une espèce sauvage proche.
Cette analyse au cas par cas souligne l’importance du respect de bonnes pratiques de cultures des NBT (règles d’isolement) pour rendre possible la coexistence des variétés conventionnelles – voire bio – et génétiquement modifiées, ainsi que permettre une lutte efficace contre le développement de résistances aux herbicides.
L’AFBV reconnaît que les transferts de gènes peuvent être un problème vis-à-vis du label de l’agriculture biologique mais assure que cela n’a pas d’effet négatif sur la biodiversité. M. Georges Pelletier conclut que la transgenèse a un impact neutre sur la biodiversité, tandis que la mutagenèse ciblée a un impact positif puisqu’elle permet de développer de nouveaux caractères. Pour Mme Catherine Regnault-Roger, certaines NBT relèvent des techniques de mutagenèse ciblée et, en tant que telles, devraient être autorisées puisqu’elles relèvent de l’annexe 1-B de la directive européenne n° 2001/18/CE. Elle suggère qu’au même titre que les nouvelles variétés sélectionnées par des méthodes conventionnelles pour être autorisées, les plantes ainsi modifiées doivent passer par les mêmes critères de distinction, homogénéité, stabilité et de valeurs agronomique, technologique et environnementale (DHS-VATE). Elle signale également que ces technologies permettront de poursuivre sur cette voie en augmentant la fréquence d’introduction de nouvelles variétés à cultiver. Mme Regnault-Roger précise que le renouvellement des variétés utilisées n’est pas une conséquence de la technologie utilisée, mais du succès économique et de la demande des consommateurs de ces variétés.
L’Académie des technologies s’est associée à l’Académie d’agriculture pour appeler à continuer la recherche dans ce domaine. Ainsi, M. Paul Vialle, dans son discours de la séance solennelle du 5 octobre 2016, « Jusqu’où l’homme peut-il modifier la nature ? », énonce les nombreux défis qu’il reste à relever : trouver des réponses à la multiplication et aux déplacements accélérés des ravageurs, aux résistances des pathogènes, aux contournements des résistances des organismes hôtes, à l’aversion croissante des populations aux pesticides, à la recherche de nouvelles possibilités agronomiques (cultures sur terrains salés, ou résistantes à la sécheresse…), aux problèmes concernant les interactions entre l’agriculture et l’environnement, à l’adaptation au changement climatique, à la croissance vigoureuse de la population mondiale donc une demande forte sur les rendements, à la lutte contre certaines maladies, aux allergies, intolérances et carences, à la recherche de nouveaux goûts, de nouvelles formes, de nouvelles couleurs…
Les conséquences économiques de ces technologies ont aussi un impact sur la biodiversité. En effet, ces nouvelles technologies ne seront pas uniquement maîtrisées par des grands groupes multinationaux et baisseront les coûts et la durée d’obtention de nouvelles variétés, ce qui permettra aux PME du secteur de la sélection des semences d’être compétitives et de diversifier les variétés domestiquées. Ces variétés sont sujettes à un renouvellement (turnover) au niveau de leur utilisation : la moitié des variétés inscrites au Catalogue ont moins de cinq ans.
Pour l’académicien André Gallais, les revendications relatives à la mise en place d’une sélection participative nourrie par les recherches publiques ou à la suppression de la protection de la propriété intellectuelle aboutiraient à la fin de la sélection privée des semences, qui serait remplacée par un système qui ne pourrait subvenir aux besoins de la population et des agriculteurs. La diversité des semences mises à la disposition des agriculteurs serait diminuée et, en conséquence, la biodiversité. Il dénonce une confusion entre le système des brevets et celui du certificat d’obtention végétal (COV), qui génère une peur inutile. Le COV est prévu pour permettre une utilisation libre des variétés végétales et pour favoriser la sélection de nouvelles semences. C’est le cadre légal qui favorise le mieux aujourd’hui la création variétale. L’académicien précise néanmoins que la concentration des acteurs privés du secteur de la sélection des semences représente un risque pour la diversité génétique des variétés, qui est renforcé par les blocages juridiques entourant les plantes génétiquement modifiées C’est l’agriculture intensive qui est responsable de la diminution de la biodiversité.
Recommandation n° 10 : Impact sur la biodiversité
– Propose de promouvoir l’usage des bonnes pratiques agricoles pour éviter que des plantes ou des insectes deviennent résistants à des herbicides ou autres traitements. Le bilan de l’utilisation des plantes génétiquement modifiées (PGM) dans le monde prouve qu’il n’y a pas de perte de diversité génétique des principales espèces et que, si la transgenèse est neutre en termes de biodiversité, les études semblent indiquer que les nouvelles techniques de sélection améliorent la biodiversité. C’est donc, en résumé, une agriculture hautement productiviste ou mal conduite qui porte atteinte à la biodiversité.
IV. LES BIOTECHNOLOGIES APPLIQUÉES À L’AGRICULTURE : L’ÈRE POST-OGM
La modification ciblée du génome pourrait avoir des applications révolutionnaires dans l’agriculture et dans l’agroalimentaire.
Les possibilités d’applications des biotechnologies à l’agriculture ouvrent des perspectives majeures. Le premier objectif est de limiter les pertes dans les cultures, qui dans le monde peuvent atteindre de 40 à 50 % du total des récoltes. Il est possible d’introduire dans une plante un gène qui lui permette de se défendre, en éloignant les ravageurs ou en attirant des insectes « auxiliaires ». On peut transférer avec précision un gène d’une espèce sauvage vers une espèce cultivée. Par exemple, certains pommiers présentent des gènes de résistance à la tavelure qui pourraient être transférés, de manière très simple et très rapide, à d’autres variétés de pommiers. Michel Griffon, chercheur agronome et économiste, l’illustre lors de l’audition publique de l’OPECST du 7 avril 2016, en déclarant qu’il existe en permanence « au sein du vivant, une sorte de "course aux armements" entre l’expansion des ravageurs et la lutte contre ces mêmes ravageurs ». Le président de la société française Cellectis, André Choulika, a indiqué, lors de cette même audition, que sa société a développé un blé résistant à un champignon, l’oïdium.
Les nouvelles biotechnologies ont l’avantage, comme nous le verrons dans ce rapport, d’accélérer la vitesse de sélection. Les rapporteurs ont pu constater à Gruissan, dans l’Aude qu’il avait fallu plus de vingt ans, par croisements interspécifiques, à des chercheurs pour créer des vignes résistantes au mildiou, débarrassées d’autres traits génétiques non souhaitables. Ces techniques, avec en particulier CRISPR-Cas9, visant à créer de nouvelles variétés végétales ou modifier des espèces animales, constituent une rupture technologique dont l’ampleur commence seulement à être mesurée.
Les décisions qu’il faudra prendre ne peuvent l’être qu’après une analyse complète de la controverse qui s’est développée, depuis vingt ans, sur l’utilisation des plantes génétiquement modifiées (PGM). Elle a notamment créé un fossé entre la position européenne et celle du reste du monde. Si nous ne tirons pas les leçons des trente-quatre années qui ont suivi les premiers essais en plein champ aux États-Unis (trente-et-un ans en France), l’Europe refera les mêmes erreurs. L’OPECST a largement contribué à éclairer le Parlement sur les OGM, mais la confusion s’est accrue dans l’esprit de nos concitoyens, qui ont fait un amalgame entre la science et ses applications.
Face aux controverses qui se sont développées ces dernières années (sida, maladie de la « vache folle », amiante, OGM, politique vaccinale, ondes électromagnétiques, déchets nucléaires), les gouvernements qui se sont succédés depuis vingt ans ont souvent reculé ou démissionné. L’OPECST a été le premier organisme d’évaluation à affirmer que les découvertes scientifiques peuvent avoir des conséquences dangereuses, mais peuvent aussi apporter des bénéfices indéniables. Il ne faut verser ni dans le scientisme béat, ni dans la croyance aveugle à l’innocuité de certaines applications.
L’idée d’imiter la nature est excellente, mais de toujours la laisser faire peut conduire à des catastrophes ; la nature n’est pas toujours bonne et les technologies pas forcément mauvaises.
C’est le rôle de l’OPECST de procéder à l’évaluation des risques et réaliser des études d’impact, mais en les évaluant rationnellement, en tenant à distance les croyances, les partis pris et les idéologies et en organisant les confrontations publiques entre experts, politiques et citoyens. L’affaire juridique Séralini décrite ci-dessous l’illustre parfaitement. Il est grave que des responsables politiques contredisent en permanence les avis ou des recommandations de comités scientifiques et d’agences créés par l’État ou par l’Union européenne pour éclairer leurs décisions.
L’OPECST réaffirme également la nécessité de faire progresser l’intégrité scientifique, de lutter contre les conflits d’intérêts dans l’expertise, mais reste persuadé que dans tous les dossiers, y compris celui des PGM, les opinions ne peuvent pas être mises sur le même pied que le savoir.
Plus de cent lauréats du prix Nobel (dont les français Claude Cohen-Tannoudji, Roger Guillemin, Serge Haroche et Jean-Marie Lehn) ont publié, en juin 2016, une déclaration à l’adresse de Greenpeace d’une part, et de l’ONU et des gouvernements du monde entier d’autre part, pour un plus grand usage des techniques modernes de sélection végétale et pour que cessent les campagnes des organisations qui s’y opposent, Greenpeace en tête (119). Ils mettent particulièrement en avant le cas du riz doré, riz génétiquement modifié qui permettrait de sauver des centaines de milliers de personnes victimes de déficiences en vitamines A, particulièrement des enfants.
L’appel des cent prix Nobel note que toutes les agences scientifiques et réglementaires à travers le monde ont établi de manière répétée et cohérente que les cultures et les aliments améliorés grâce aux biotechnologies sont aussi sûrs, sinon plus, que ceux provenant de toute autre méthode de production. Il n’y a jamais eu un seul cas confirmé d’un résultat négatif sur la santé pour les humains ou les animaux dû à leur consommation. Les produits génétiquement modifiés sont plus étudiés que les médicaments, avec des phases d’essais portant sur des centaines de personnes, des évaluations bénéficies-risques globales et des retours d’expérience de plusieurs décennies.
Les cent prix Nobel estiment que continuer les campagnes de dénigrement des nouvelles biotechnologies constituerait un « crime contre l’humanité ».
Les rapporteurs ont choisi ici de ne rappeler que quelques étapes significatives de « l’épopée » des plantes transgéniques qui a divisé la société française. Les rapports successifs de l’OPECST, déjà cités, ont très largement rendu compte de cette question. Les rapporteurs veulent simplement ici tirer les principaux enseignements des renoncements successifs qui ont conduit à ce blocage, afin de répondre à la question qui nous est posée : quelles sont les conséquences économiques, éthiques, sociales et environnementales de l’utilisation de ces nouvelles technologies dans l’agriculture et l’agroalimentaire ?
A. HISTOIRE DES OGM EN FRANCE ET DANS LE MONDE EN QUELQUES DATES
Le récapitulatif qui suit reprend depuis 1971 les avancées scientifiques dues à la transgenèse et montre en quelques dates comment la France et l’Europe ont ostracisé l’utilisation des biotechnologies dans le domaine végétal. L’OPECST a joué un rôle important durant toute cette période en rendant de nombreux rapports (120), mais la controverse qui s’est engagée il y a une vingtaine d’années, à partir de 1996, a finalement accru la méfiance de nos concitoyens. Les responsables politiques qui auraient dû éclairer le débat se sont en réalité défaussés et, petit à petit, le dossier OGM s’est enlisé. La France a de fait perdu ses capacités d’expertise internationale dans le domaine des biotechnologies végétales. Le débat s’était focalisé sur les risques sanitaires et environnementaux. Les rapporteurs ont voulu faire le point sur cette question vingt ans après les premières cultures ; leur évaluation montre qu’il y a un décalage très fort entre les perceptions des consommateurs dans de nombreux pays du monde et celles dans les pays européens. Ces grandes étapes montrent les tournants dans ce dossier et il apparaît aux rapporteurs important de le rappeler, car les décisions réglementaires qui vont être prises au niveau européen ou national seront primordiales pour l’essor ou l’enlisement des nouvelles biotechnologies.
1. Le temps des découvertes, des premières interrogations et de la confiance totale dans les biotechnologies
Cette histoire des OGM a été résumée par Jean-Yves Le Déaut et par quelques données reprises de l’Encyclopædia Universalis.
1971 : Paul Berg : découverte de l’ADN recombinant ; naissance de l’ingénierie génétique ; possibilité d’introduire du matériel d’un organisme dans l’ADN d’un autre organisme
1975 : conférence d’Asilomar (États-Unis) : les bactéries génétiquement modifiées risquent-elles de se propager dans l’environnement ? Un moratoire de six mois est décidé.
1980 : premier brevet sur une forme de vie génétiquement modifiée, délivré par les États-Unis au microbiologiste indien Ananda Chakrabarty : une bactérie transgénique capable de dégrader les hydrocarbures.
1982 : obtention, par D. Palmiter, R. Brinster et leurs collaborateurs des premières souris transgéniques avec expression des transgènes. Première commercialisation aux États-Unis d’un médicament produit par des bactéries génétiquement modifiées : l’insuline.
1983 : premiers essais aux champs de plantes génétiquement modifiées aux États-Unis ; premier OGM végétal : un tabac génétiquement modifié à des fins purement expérimentales pour résister à un antibiotique.
1986 : premiers essais aux champs de plantes génétiquement modifiées en France… il y a trente-et-un ans.
1987 : obtention de la première protéine thérapeutique, l’activateur de plasminogène humain, dans le lait d’un animal transgénique, une souris.
1989 : l’OPECST visite en Isère un champ de tabac résistant aux herbicides.
1990 : la première directive européenne sur les OGM n° 90/2020 est publiée.
1992 : la directive européenne est transcrite dans le droit français le 13 juillet dans l’indifférence générale.
1994 : première demande d’autorisation de mise sur le marché d’un maïs résistant à la pyrale en France (Bt 176). Commercialisation, aux États-Unis et en Grande-Bretagne, du premier OGM végétal, la tomate flavr savr, ayant une saveur améliorée et un plus grand contenu en pulpe, destinée à la préparation de purée de tomate.
1995 : première autorisation en France du maïs transgénique Bt de Ciba-Geigy (Novartis) résistant à la pyrale et tolérant aux herbicides.
1996 : naissance de la brebis Dolly, le premier animal cloné.
2. La naissance de la controverse sur les aliments transgéniques
1996 : premier coup de théâtre OGM, une querelle interne au Gouvernement Juppé oppose Philippe Vasseur, ministre de l’agriculture, qui défend l’utilisation des plantes génétiquement modifiées, à Corinne Lepage qui s’y oppose en s’appuyant sur l’incertitude de la qualité sanitaire des aliments transgéniques. Elle invoque le principe de précaution. Sur fond d’« affaire du sang contaminé », le journal Libération titre « Alerte au soja fou » (121).
Mai 1996 : Philippe Séguin, Président de l’Assemblée nationale, saisit l’OPECST d’une étude intitulée « De la connaissance des gènes à leur autorisation confiée » au député Jean-Yves Le Déaut ;
Janvier 1997 : la Commission européenne donne un avis favorable à la France pour la culture du maïs Bt 176.
Février 1997 : Curieux jugement de Salomon du gouvernement Juppé. Durant la polémique due aux divisions Vasseur v Lepage, le Premier ministre interdit la culture en France, mais en autorise les importations et la consommation.
Février et avril 1998 : Louis Le Pensec, ministre de l’agriculture, autorise la commercialisation des variétés de maïs Bt 176 et Mon 810 (produits par la firme Monsanto).
1999 : accusé de vouloir obliger les agriculteurs à acheter chaque année de nouvelles semences, le groupe Monsanto renonce à sa technologie Terminator, ensemble de gènes qui rendent stériles les plantes transgéniques. José Bové se rend célèbre en organisant dans le sud de la France les premières destructions de champs de plantes transgéniques, dont certaines destinées à la recherche.
2001 : un rapport de la direction générale de la répression des fraudes estime que, en France, 40 % des semences de maïs contiennent des traces d’OGM.
3. La première conférence des citoyens sur les organismes génétiquement modifiés (OGM)
Conférence de citoyens organisée par l’OPECST en 1998
D’avril à juin 1998, 14 « candides » se forment, s’approprient le sujet des OGM pendant quatre week-ends sous l’égide de l’OPECST et d’un comité de pilotage de 7 membres :
3 scientifiques (Francine Casse, Antoine Messéan, Gérard Pascal), 3 sociologues (Daniel Boy, Dominique Donnet-Kamel, Philippe Roqueplo) et 1 juriste, Marie-Angèle Hermitte. Le panel conclut à la nécessité d’augmenter les moyens de la recherche publique « meilleure garantie de son indépendance » vis-à-vis de la recherche privée et de l’influence des multinationales. Le panel est en majorité favorable à l’analyse « au cas par cas », rendant compte des expériences accumulées. Il demande également que « si on n’est pas capable de respecter les seuils de mélange entre substances transgéniques et non transgéniques, il faut instaurer un moratoire ». Il exige également « qu’il y ait une grande transparence dans les autorisations de mise en culture ». Le panel souhaite éliminer les gènes de résistance aux antibiotiques (qui étaient à cette époque présents dans les plantes génétiquement modifiées), modifier les conditions de travail de l’instance chargée alors d’examiner les dossiers (la commission du génie biomoléculaire), privilégier la biovigilance, instaurer une politique d’étiquetage, préciser les notions de seuil, développer la recherche liée à la possibilité de transfert de gènes dans l’environnement ; il préconise pour certaines espèces un moratoire et, enfin, des règles de droit et un système d’assurance protègent nos concitoyens des dommages éventuels causés par les OGM.
Juillet 1998 : Jean-Yves Le Déaut va largement dans le sens des propositions de la conférence citoyenne et les reprend dans le rapport de l’OPECST sur « La connaissance des gènes à leur utilisation. Première partie : L’utilisation des organismes génétiquement modifiés dans l’agriculture et dans l’alimentation ». Il préconise une autorisation pour les variétés de maïs et un moratoire de trois ans pour les variétés de colza.
Août 1998 : Louis Le Pensec suit les préconisations de l’OPECST. Il autorise le maïs Monsanto 810 et deux autres variétés de maïs.
4. La bataille juridique commence.
Septembre 1998 : le Conseil d’État annule l’arrêté de février 1998 sur la culture du maïs Monsanto 810 et Bt 176 suite à un recours de Greenpeace, des Amis de la terre, d’Ecoropa France et de la Confédération paysanne.
Mai 1999 : Dominique Voynet veut suspendre toute nouvelle autorisation et renouvellement des variétés transgéniques.
Juin 1999 : deuxième jugement de Salomon : Lionel Jospin décide de soutenir à Bruxelles un moratoire sur les nouvelles autorisations, mais de maintenir les autorisations déjà accordées.
Novembre 2000 : deuxième coup de théâtre : le Conseil d’État, après consultation de la Cour de justice des communautés européennes (CJCE), revalide l’autorisation de Louis Le Pensec de février 1998.
Mars 2001 : publication de la directive européenne n° 2001/18/CE relative à la dissémination volontaire d’OGM dans l’environnement.
Novembre 2001 : le Gouvernement demande à quatre « sages », Christian Babusiaux, président du conseil national de l’alimentation, Jean-Yves Le Déaut, président de l’OPECST, Didier Sicard, président du comité consultatif national d’éthique (CCNE), et Jacques Testard président de la commission du développement durable, d’organiser un débat public sur les OGM et les essais aux champs, de le piloter, de veiller à sa déontologie et d’en assurer la synthèse.
Février 2002 : débat public au Conseil économique et social (36 experts, 230 personnalités, 120 profanes qui concluent à la nécessité d’un débat fondateur sur l’encadrement des biotechnologies, de passer des « cultures en secret » à la « culture de la transparence »). Sauf à arrêter toute recherche sur les plantes génétiquement modifiées, les « essais aux champs » sont inévitables, le milieu confiné ne pouvant suffire. Il indique également que, s’agissant de positions « éthiques, voire politiques », la discussion n’a fait apparaître ni la possibilité de conciliation, ni la perspective qu’un approfondissement du débat puisse résoudre ou simplement atténuer l’opposition entre les parties. Le rapport indique qu’aucune preuve de toxicité aigüe d’une PGM absorbée par l’homme n’a jamais été établie […] et qu’aucun problème sanitaire n’a été signalé. Ces faits n’ont pas été contestés lors de cette audition, mais la toxicologie chronique éventuelle repose sur des informations aussi difficiles à établir qu’à évaluer. Beaucoup de questions sur les risques environnementaux n’ont pas été éclaircis lors de cette audition et le rapport souligne que si la position du consommateur est souvent négative, c’est parce que les PGM expérimentés en France n’apportent aucun bénéfice pour le consommateur. On veut bien prendre des risques pour se soigner on ne veut pas prendre des risques pour manger.
Sur la recherche, le débat a nettement mis en exergue deux inquiétudes opposées : celle de voir les OGM disparaitre en France, l’autre, de conduire à des résultats porteurs de dangers irréversibles. Les rapporteurs, s’appuyant sur l’avis des scientifiques et des médecins, ont conclu que les décisions étaient de nature essentiellement politique, car d’un côté les dangers pour la santé humaine à court terme n’avaient pas été établis, mais de l’autre, les efforts de transparence n’avaient pas été suffisants. Ils souhaitaient que la France soutienne des recherches développant ces connaissances, afin notamment de garantir la fiabilité de l’expertise, et de contribuer à l’innovation. En conclusion, ils préconisaient de donner au « cas par cas » des autorisations d’expérimentation en plein champ.
5. Le temps des faucheurs volontaires
2002-2004 : peine perdue, la destruction d’essais par les faucheurs volontaires redouble. « Les OGM sont devenus le totem fédérateur de tous nos maux responsables des déboires des pays développés », a dit Bernard Chevassus-au-Louis, président du Museum national d’histoire naturelle. Comme le disaient les quatre sages, « le consensus n’est pas possible ». C’est également la position d’un des rapporteurs, Jean-Yves Le Déaut, qui dans son rapport de l’OPECST de janvier 2005 (122) indiquait : « Dans la mesure où ce combat est idéologique, il est illusoire de croire que les améliorations techniques demandées mettront fin à la controverse ». Cette phrase était prémonitoire, puisque malheureusement de 1998 à 2017, ce dossier s’est embourbé.
Alors qu’à la fin des années 1990 on comptait plus de 800 essais de culture d’OGM en France, le dernier essai en plein champ s’est terminé en 2013 avec l’arrêt par l’INRA de ses cultures de peupliers près d’Orléans.
Septembre 2003 : entrée en vigueur du protocole de Carthagène, adopté le 29 janvier 2000, qui instaure une clause de sauvegarde, laissant chaque État libre d’accepter ou de refuser des semences contenant des OGM en cas de risque sanitaire avéré pour les populations.
6. Les démissions et les compromissions des responsables politiques
Juillet à octobre 2007 : organisation du Grenelle de l’environnement
Pour donner du « grain à moudre » aux organisations et aux associations qui s’opposent aux OGM et pour déminer la question du nucléaire, afin qu’elle n’apparaisse pas dans le Grenelle de l’environnement, les OGM sont désignées comme « victimes expiatoires », l’accord tacite entre le Gouvernement et plusieurs associations, indique que la question du nucléaire ne sera pas abordée durant le Grenelle et qu’en contrepartie, le Gouvernement fera jouer la clause de sauvegarde pour suspendre la culture du maïs Mon 810, autorisé, après des déboires juridiques, par le gouvernement de Lionel Jospin.
Décembre 2007 : le ministre de l’agriculture Michel Barnier tient la promesse et suspend l’utilisation des semences du maïs Mon 810 jusqu’à février 2008, le temps qu’un comité de préfiguration du Haut Conseil des biotechnologies (HCB) donne un avis sur les risques pour la santé publique. « J’accepterai la clause de sauvegarde si des risques nouveaux sont avérés », dit le Président de la République Nicolas Sarkozy. Pour sécuriser le résultat, le sénateur Legrand est nommé président de ce comité de préfiguration.
Janvier 2008 : Le sénateur Legrand parle de risque « sérieux », alors que ce n’était pas l’avis du comité de préfiguration. Le Président de la République s’est en réalité appuyé sur un avis qui n’a pas été validé par l’autorité provisoire, car ni les termes de « risque sérieux », ni celui d’« effet négatif », n’ont été employés dans l’avis transmis par ce comité de préfiguration. Il y a donc eu instrumentalisation des experts pour parvenir à respecter les termes de l’accord du Grenelle. En lieu et place d’un débat, on a assisté à une manipulation de l’opinion. Il n’est pas étonnant qu’après de telles manœuvres, les Français ne fassent confiance ni à la science, ni à la politique.
Juin 2008 : loi du 25 juin 2008 relative aux organismes génétiquement modifiés, transposant la directive 2001/18 et créant le Haut Conseil des biotechnologies (HCB), fixant un seuil sans OGM à moins de 0,9 % de produits transgéniques (123).
Février à octobre 2008 : Michel Barnier active la clause de sauvegarde et réclame des mesures d’urgence. L’Autorité européenne de sécurité des aliments (EFSA) conclut à la légèreté des arguments de la France pour justifier de la clause de sauvegarde.
2009 à 2011 : la France est en procédure avec Bruxelles pour le maintien de cette clause de sauvegarde. La casuistique est bien rodée puisque, malgré les injonctions de la Cour de justice de l’Union européenne (CJCE) en novembre 2011, le Gouvernement réussit l’exploit d’inscrire plusieurs variétés dans le catalogue officiel des espèces et des variétés, autorisées à la commercialisation, et bien sûr pas à la culture. Le Conseil d’État donne raison à la position de la CJCE et annule le moratoire français.
Février 2011 : Nathalie Kosciuszko Morizet et Bruno Lemaire, tenaces, adressent une nouvelle demande de sauvegarde à la Commission, suspendent les cultures de Monsanto 810 (au moment de la période des semences), avec une nouvelle réponse en mai de l’EFSA, qui conclut une nouvelle fois à la vacuité et à la légèreté des arguments français. Qu’importe puisque en mai la date des mises en culture est dépassée, l’accord a donc été respecté. Ce que les rapporteurs notent, c’est qu’il n’y a même plus opposition entre les ministres de l’agriculture et de l’environnement, comme du temps de Dominique Voynet ou de Jean Glavany, ou encore de Corinne Lepage et de Philippe Vasseur. À partir de 2011, les deux ministres adoptent la même position. Les OGM deviennent « une patate chaude » que le gouvernement Fillon a réussi à repasser de main en main.
2012 : les gouvernements de gauche vont-ils sauver le soldat Jospin qui avait autorisé le maïs Mon 810 ? Que nenni, la patate est toujours chaude et il convient de s’en débarrasser. Le ministre de l’agriculture Stéphane Le Foll choisit la même stratégie et il réussira à tenir la totalité du mandat en empêchant toute reprise des cultures des plantes génétiquement modifiées. Quand le Conseil d’État annule en 2012 l’arrêté d’interdiction de culture, il reprend un autre arrêté et attend février 2014 avant la période de semis pour soutenir une proposition de loi déposée au Sénat par le sénateur Fauconnier interdisant la mise en culture du maïs Mon 810. Après des péripéties, où le sénateur Jean Bizet réussit à faire voter une motion d’irrecevabilité, les membres du groupe socialiste de l’Assemblée nationale proposent une proposition de loi allant dans le même sens. Cette loi est promulguée le 2 juin 2014 (124), elle interdit la mise en culture d’une mise en culture de variété de maïs génétiquement modifié et Stéphane Le Foll peut se débarrasser de la patate chaude.
Comme on le verra plus loin, cet imbroglio juridique n’a pris fin qu’en 2015.
Mars 2015 : modification de la directive européenne n° 2001/18, qui permet maintenant à chaque État membre d’interdire, pour des raisons autres que sanitaires ou environnementales, la culture sur son territoire national d’une plante génétiquement modifiée qui aurait pourtant reçu une autorisation au niveau européen.
Novembre 2015 : saisine de l’OPECST d’une étude sur « Les enjeux économiques, environnementaux, sanitaires et éthiques des biotechnologies à la lumière des nouvelles pistes de recherche ».
Juin 2016 : appel des cent prix Nobel sur la nécessité d’utiliser les technologies pour traiter de la question de l’autosuffisance alimentaire de 2 milliards d’êtres humains supplémentaires en 2050.
Les rapporteurs pensent qu’on ne gouverne pas sur la base de moratoires qui perdurent, que les gouvernements successifs se sont servi de ces moratoires comme calmants face à l’opinion publique. Ils le disent avec d’autant plus d’impartialité que l’OPECST a proposé, en 1998, au début de la controverse, un moratoire sur les autorisations de mise en culture de colza, mais pour une période limitée.
7. La loi de 2008, une loi pour rien ?
Le Parlement y a consacré des dizaines d’heures de débat. Les recommandations de l’OPECST ont proposé de renforcer l’expertise pour les risques environnementaux, sanitaires, réformer les procédures d’évaluation, d’organiser la biovigilance d’informer le consommateur, de compléter les directives communautaires sur l’étiquetage qui ont été intégrées dans notre législation. Ces propositions ont été largement prises en compte. Le texte transpose les dispositions de la directive n° 2001/18, crée un Haut Conseil des biotechnologies (HCB), et comme le demandait l’OPECST, donne la parole à d’autres acteurs que les scientifiques, en créant, dans le HCB, un comité économique éthique et social. La loi précise également la liberté de consommer et de produire sans OGM, crée un régime de responsabilité, organise la biovigilance sur le territoire et impose la transparence sur l’évaluation et l’utilisation des OGM. L’article 17 de la loi garantit le soutien à la recherche en génomique végétale, en toxicologie, en épidémiologie et en entomologie. Elle encourage les coopérations scientifiques en matière de recherche. On aurait pu penser que les controverses allaient cesser lors du vote de la loi. Cela n’a malheureusement pas été le cas. La loi de 2008 est en réalité une loi pour rien, car, dans la mesure où le combat est idéologique, il est illusoire de croire qu’un texte de loi puisse mettre fin à cette controverse. Les derniers essais en plein champ ont été saccagés. Le Gouvernement n’a autorisé aucun nouvel essai et a même découragé toute velléité des organismes de recherche ou des industriels… qui ont migré vers des cieux plus propices. Le ministre de l’agriculture et de la forêt Stéphane Le Foll lui-même admettait cette incapacité de la loi puisqu’il déclarait le 19 novembre 2012, en introduction de l’audition publique de l’OPECST sur l’affaire Séralini (125), sur la question des OGM, « l’arbitrage est loin d’être fait, entre ceux qui sont profondément opposés aux OGM et ceux qui peuvent considérer, sur la base d’études scientifiques dont vous allez discuter cet après-midi, que les doutes sont trop nombreux. Sur cette question, le débat démocratique n’est donc ni finalisé ni tout à fait mûr, ce qui ouvre le champ à des débats et à des confrontations souvent difficiles. »
« La messe était dite »… Quatre ans après la loi, le ministre avalisait deux possibilités, une opposition totale aux OGM ou le statu quo, puisque les doutes étaient trop nombreux. C’est cette position qui explique l’épisode de la clause de sauvegarde plusieurs fois avancée par les gouvernements successifs et par les ministres de l’agriculture Michel Barnier, Bruno Lemaire et Stéphane Le Foll pour finalement aboutir à la loi du 2 juin 2014 qui interdit la mise en culture du maïs Monsanto 810 en France sans avancer la moindre justification scientifique pour s’y opposer et alors qu’aucune étude scientifique n’a prouvé sa nocivité. Rappelons que c’était Lionel Jospin et… Dominique Voynet qui l’avait autorisée en 1998. Le Gouvernement a de fait démissionné. Cette loi n’a même pas été appliquée dans le cas des faucheurs volontaires de Colmar lors que le législateur avait prévu dans l’article 7 un délai de destruction de parcelle. La peine prévue : 2 ans d’emprisonnement et 75 000 euros d’amende était aggravée lorsque la parcelle faisait l’objet d’une recherche (3 ans d’emprisonnement et 15 000 euros d’amende). Le juge en Cour d’appel n’a pas respecté l’esprit de la loi, car précisément ce n’est pas au juge d’apprécier les risques inhérents à l’expérience mais au Haut Conseil des biotechnologies, qui informe le Gouvernement.
L’Affaire Séralini a été instruite devant l’OPECST en 2012 (126). Les rapporteurs pensent qu’il est très rare qu’une publication acceptée dans une revue à comité de lecture international comme Food and Chemical Toxicology soit retirée de la publication. Lors de l’audition publique de l’OPECST, cette publication était considérée comme acceptée, mais plusieurs spécialistes, lors de cette audition contradictoire, ont indiqué que la puissance statistique de son étude était au mieux insuffisante.
Ainsi M. Jean-Christophe Pagès, président du conseil scientifique HCB, dit que « la souche de rats Sprague Dawley que M. Séralini a choisi pour détecter l’apparition de tumeurs lorsqu’on les soumettait à un régime maïs OGM est ancienne et peut présenter des tumeurs de façon spontanée, ainsi que des anomalies hématiques et rénales ». Il poursuit en disant que l’apparition spontanée de tumeurs correspond à la fourchette de lecture de M. Séralini… Les différences statistiques ne sont corroborées par aucune des analyses présentées et il conclut donc à l’absence d’indication de risque sanitaire.
Mme Dominique Parent-Massin, présidente de la société française de toxicologie, indique que « le protocole d’étude est inapproprié et l’étude non conclusive » et « qu’il n’a pas souhaité « indiquer l’endroit où l’étude a été réalisée ». Les rapporteurs reprennent, également, dans la citation de Cédric Villani, mathématicien, médaille Fields : « Au niveau statistique, quelques points ont été mis en avant : le premier est le manque de puissance du test, dû au très faible effectif des échantillons ; le deuxième, sur le calcul des espérances de vie », et, poursuit-il, « n’est pas cohérent avec deux échantillons témoins de seulement 10 rats ». Il suffit que, par accident, quelques-uns de ces rats vivent plus longtemps que prévu et toute l’étude soit faussée. Mais c’est la mise en scène des débats avec : la une du Nouvel Observateur « Oui, les OGM sont des poisons » qui pose problème, avec un livre avec une préface de Corine Lepage, un film sur le même sujet, le fait que les autres journaux n’aient pas eu accès à la publication, ce qui fait dire à Cédric Villani : « Je suis d’autant plus consterné de cette dérive ».
M. Sylvestre Huet, à l’époque chroniqueur scientifique à Libération, dit dans un réquisitoire très argumenté que : « Lorsque la science est bonne, il n’y a pas de scoop, pas d’information exclusive accordée comme dans ce cas à un seul journal, et que la rupture avec les règles de bonnes pratiques ne peut que relever d’une volonté de manipuler l’opinion publique, à savoir obtenir une couverture poussée et totalement laudatrice ».
M. Valéry Laramée de Tanneberg, président des journalistes de l’environnement ne disait pas autre chose, critiquant le titre du Nouvel Observateur, car cette assertion n’était pas démontrée, et que, selon lui, l’article du Nouvel Observateur ne respecte pas les bonnes pratiques du journalisme.
Michel Alberganti, enfonce le clou en indiquant que M. Séralini et son équipe ont « planifié une sorte d’opération médiatique, qui s’est poursuivie par un livre puis un documentaire au cinéma et à la télévision ».
Cela fait beaucoup pour une seule affaire puisque Gilles E. Séralini a refusé pendant deux ans de fournir ses chiffres bruts, ce qui est contraire à la déontologie de la France. L’article retiré, légèrement modifié, a été depuis publié dans une revue européenne Environmental Science Europe.
Au moment où l’intégrité scientifique fait partie des priorités, il aurait été nécessaire qu’une commission indépendante fasse le point sur un dossier où il y a autant de zones d’ombre.
Car ou il s’agit d’un faux, et il y a atteinte manifeste à l’intégrité scientifique, ou c’est de la mauvaise science, et dans ce cas il s’agit d’une opération de propagande. Manifestement, cette affaire a eu une incidence sur l’opinion publique. Un article du 16 septembre 2012 fait de M. Gilles Eric Séralini une victime des lobbys européens favorables aux OGM. Autant Mediapart dénonce un vrai problème, celui des conflits d’intérêt (127), que la Commission européenne a d’ailleurs mieux pris en compte, puisque les déclarations d’intérêt sont aujourd’hui publiques, autant il aurait été utile que la journaliste s’appuie sur les travaux de l’OPECST.
C’est ce qui est dénoncé dans une résolution (n° TA n° 926) sur « Les sciences et le progrès dans la République » adoptée à l’unanimité par l’Assemblée nationale le 21 février 2017. Par la confusion entretenue entre savoir et opinion dans les espaces publics et numériques, la défiance qui en résulte menace les fondements de la recherche scientifique.
La prolifération d’informations tronquées ou inexactes génère de l’inquiétude et de l’endoctrinement, qui… conteste l’idée même de progrès et impose ses vues à force d’amalgames, d’anathèmes, voire d’actions violentes.
L’affaire Séralini illustre malheureusement ces dérives.
Ce long retour sur les OGM était, au sens des rapporteurs, nécessaire car dans l’application des nouvelles biotechnologies dans l’agriculture, certains parlent déjà « d’OGM cachés », laissant de ce fait présager du sort qui serait réservé à ces futurs évènements issus de la modification ciblée du génome.
Depuis trente ans, les rapporteurs constatent que ceux qui, dès 1988 parlaient de « nourriture Frankenstein » ont gagné leur pari, puisqu’il n’y a plus en Europe, sauf en Espagne, de culture significative de plantes génétiquement modifiées. Alors qu’à la fin des années 1990, on comptait plus de 800 essais en champ de cultures d’OGM en France, le dernier essai en plein champ s’est terminé en 2013, avec l’arrêt par l’INRA de ses cultures de peupliers d’Orléans. Quelques années auparavant, des « faucheurs volontaires » s’étaient introduits en août 2010 dans l’unité de Colmar de l’INRA pour y détruire 70 pieds de vigne transgénique. Ces recherches, engagées depuis 2005, étaient destinées à lutter contre la maladie du court-noué qui menace le vignoble français. Elles avaient été reprises au printemps 2010 à la suite de l’avis favorable du Haut Conseil des biotechnologies (HCB) et de l’autorisation des ministères de tutelle.
José Bové qui, pourtant, réclamait une loi sur les OGM en 2008, parle d’action citoyenne de neutralisation de l’essai de vigne OGM à Colmar ; cet essai avait pourtant parfaitement respecté les conditions édictées par la loi. Le marathon judiciaire va continuer après le jugement en cassation, mais les rapporteurs constatent que la justice s’est appuyée sur l’argument d’une « erreur d’appréciation des risques inhérents à l’expérience », car (sic) réalisée dans un environnement non confiné, alors que le HCB est précisément chargé par la loi de fournir cette évaluation. Il avait considéré que toutes les précautions avaient été prises en isolant les terres de culture, en travaillant sur un porte-greffe, et que ces recherches avaient été discutées au préalable avec les associations et la filière viticole. L’INRA a détruit en 2013 mille peupliers semés en 2007 à Saint-Cyr-en-Val (45), à la suite de menaces et d’intrusions et en l’absence de décision politique relative à la prolongation de l’autorisation de culture en plein champ. Selon les termes de son communiqué de presse de l’époque, l’INRA indique que : « En l’absence d’une nouvelle autorisation à poursuivre ses travaux scientifiques utilisant des peupliers génétiquement modifiés, [il] a procédé ce samedi 13 juillet 2013 à l’arrêt de son essai conduit en plein champ dans le Loiret, conformément aux engagements souscrits en 2007. Dans le cadre de ses missions de recherche publique, l’Institut souhaite toutefois maintenir des compétences et une capacité nationales d’expertise sur les OGM ».
Pourtant, tous les récents rapports, dont celui déjà cité de l’Académie nationale des sciences américaine, concluent à la possibilité de gérer, sans dégâts collatéraux, les risques de transfert de gènes, notamment en assolant les cultures, en évitant de cultiver plusieurs années de suite les mêmes plantes, ce qui favoriserait de fait les flux de gènes. Tous ces rapports concluent que cette question relève de l’utilisation de bonnes pratiques agricoles.
9. La situation des plantes transgéniques dans le monde en 2016
Le récent rapport de l’Académie des sciences américaine (128), dont les rapporteurs ont rencontré les membres à Washington en juin 2016, en présence de son président Ralph Cicerone, illustre la forte augmentation des cultures dans le monde des plantes génétiquement modifiées.
CULTURES GÉNÉTIQUEMENT MODIFIÉES COMMERCIALISÉES
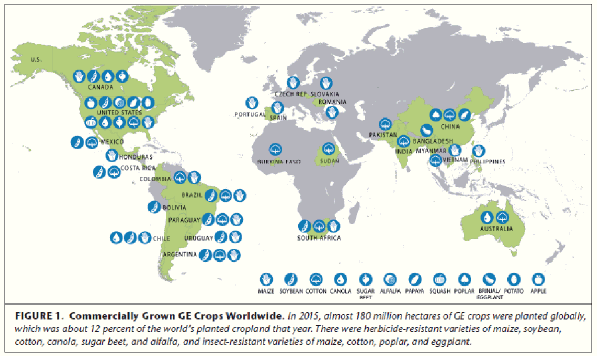
Source : rapport “Genetically Engineered Crops: Experiences and Prospects”, Académies américaines des sciences, de l’ingénierie et de la médecine, 2016.
SURFACES D’OGM CULTIVÉES DANS LE MONDE
(millions d’hectares)
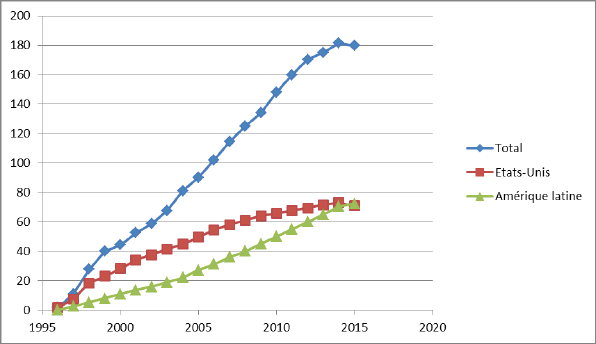
Source : OPECST, d’après données du Service international pour l’acquisition d’applications agricoles biotechnologiques (ISAAA).
Celles-ci sont cultivées dans 23 pays dans le monde, principalement en Amérique du Nord et du Sud, en Asie, en Australie et en Afrique du Sud. Quelque 85 % des PGM sont cultivées sur le continent américain. Les plantes génétiquement modifiées sont principalement des plantes résistantes aux herbicides (glyphosates) ou des plantes qui sécrètent des molécules à propriété insecticides. Les surfaces cultivées en plantes génétiquement modifiées augmentent fortement par rapport aux surfaces disponibles, notamment dans les pays émergents (Argentine, Brésil, Amérique du Sud ou Chine et Inde).
Les principales plantes génétiquement modifiées sont le soja le coton et le colza mais de nouvelles plantes apparaissent, la betterave sucrière, la tomate, le poivron, la courge, notamment en Chine, la betterave sucrière au Canada, la luzerne et la courge aux États-Unis, mais aussi des arbres génétiquement modifiés comme le peuplier ou le papayer. L’Europe reste à l’écart de cette révolution biotechnologique. La surface mondiale cultivée est à comparer avec les 14 millions d’hectares de surface agricole utile consacrée en France aux grandes cultures et principalement aux céréales. Les cultures OGM dans le monde représentent donc 13 fois les surfaces agricoles cultivées françaises. L’Europe cultive 0,14 millions d’hectares, principalement l’Espagne, soit le millième des surfaces cultivées dans le monde.
B. NOUVELLES BIOTECHNOLOGIES ET NOUVELLES PRODUCTIONS VÉGÉTALES
1. La sélection des plantes, constante de l’histoire de l’humanité
Il y a une grande continuité dans l’histoire de l’humanité. L’homme a cueilli, puis a sélectionné les plantes en fonction des caractères qui l’intéressaient, car chaque plante est en effet différente d’une autre, du fait de modifications incrémentales de son ADN. L’exemple du maïs en encadré illustre cette appropriation par l’homme des plantes qui poussent dans la nature.
Histoire du maïs
L’exemple du maïs est étroitement lié à l’histoire de l’humanité. Né il y a 7 000 ans sur les hauts plateaux du Mexique et du Guatemala, il est devenu l’aliment indispensable des hommes de ces pays. Il est introduit en Europe en 1494.
L’ancêtre du maïs est certainement le téosinte qui présente des différences importantes par rapport au maïs, tiges ramifiées, épis de très petite taille, petit nombre de grains par épi, un épi de maïs mesurait environ 2,5 centimètres il y a 7 000 ans, 10 centimètres au début de l’ère chrétienne. Aujourd’hui, il peut dépasser 30 centimètres.
Pour arriver à ce résultat, les agriculteurs ont sans relâche pratiqué une sélection, en choisissant, comme semence les grains portés par les plus belles plantes sur les beaux épis et dont les rendements et les qualités étaient les meilleurs. L’utilisation des techniques d’hybridation a ensuite permis de créer des plantes très vigoureuses mais cette méthode restait empirique. Ce sont ensuite les biotechnologies qui vont permettre d’effectuer les progrès dans le développement du maïs.
EFFETS DE LA SÉLECTION HUMAINE ET DE LA DOMESTICATION
DU TÉOSINTE (GAUCHE) QUI A PRODUIT LE MAÏS (DROITE)
Note : La pièce de monnaie américaine, qui est reproduite pour donner l’échelle, a un diamètre de 2 centimètres environ.
Source : rapport “Genetically Engineered Crops: Experiences and Prospects”, Académies américaines des sciences, de l’ingénierie et de la médecine, 2016, basé sur Fuller [2005].
À l’inverse de ce que prétendent leurs détracteurs, les biotechnologies ne bouleversent pas les lois de la nature. L’évolution, certes très lente par l’apport d’avantages sélectifs successifs, a permis la longue traversée des ères géologiques. Des virus, du matériel génétique, ont « colonisé » des cellules bactériennes, végétales ou animales, des gènes ont été échangés. La preuve, c’est qu’en quatre milliards d’années, on est passé, grâce à l’évolution, de l’algue bleue à l’espèce humaine. Ceci est illustré par une phrase de François Jacob, prix Nobel de médecine en 1965 : « L’évolution est la somme des réussites puisque la trace des échecs a disparu ». La preuve même de ces transferts de gènes est que des oncogènes susceptibles d’initier le processus de cancérisation sont intégrés dans le matériel génétique humain.
2. Les avantages de la modification ciblée du génome, par rapport à la mutagenèse aléatoire et à la transgenèse
a. Mutation aléatoire ou mutation dirigée
L’homme a d’abord observé et sélectionné les mutations. Il a ensuite provoqué des mutations en altérant le génome.
Les méthodes classiques d’amélioration des plantes sont lentes, même si les technologies ont progressé avec la sélection assistée par marqueurs et la sélection génomique. Cette dernière méthode repose sur la prédiction de l’existence d’un caractère d’intérêt dans une région du génome. Celui-ci a été piqueté par un grand nombre de marqueurs moléculaires. Il a fallu vingt ans pour sélectionner des vignes résistantes au mildiou.
D’autres part, pour des plantes polyploïdes, la probabilité qu’une mutation ait lieu simultanément sur les différentes paires de chromosomes est très faible, voire inexistante pour une plante comme le blé.
L’intérêt de ces nouvelles technologies est donc d’accélérer le rythme du progrès génétique car à vouloir « respecter le rythme naturel », de nouvelles catastrophes alimentaires risquent de se produire. On ne peut pas, d’une part accepter les technologies qui ont conduit aux progrès de la médecine et qui de ce fait ont considérablement accru la population mondiale, et d’autre part refuser les biotechnologies pour s’en remettre aux mutations de la nature pour nourrir les milliards d’individus que porte la planète.
Celles-ci peuvent êtres dues à des agents physiques (radiations diverses) ou à des substances chimiques mutagènes comme le méthane sulfonate d’éthyle (EMS). Ces altérations sont transmissibles. Les premières mutations provoquées étaient aléatoires. L’homme étant incapable de prédire l’effet d’une irradiation ou d’un produit mutagène sur le génome. Dans les années 1960, les méthodes d’hybridation découvertes en 1880 ont permis la sélection de caractères d’intérêt dans la descendance. La méthode de fusion des protopolastes a permis ensuite de créer de nouvelles espèces comme celle de la tomate en 1978, ou du citron en 2002. La première transgenèse végétale a eu lieu en 1983. C’était un tabac génétiquement modifié sur lequel avait été inséré un gène de résistance à un antibiotique, construit uniquement pour les besoins de la recherche et développement. Dans la technologie de transgenèse, l’introduction d’un gène d’intérêt dans une séquence nucléotidique se fait également au hasard. Par perméabilisation des membranes pour les levures ou les bactéries, par un procédé mécanique de canon à gènes qui projette des molécules de tungstène ou d’or qui portent le gène à insérer dans une boucle d’ADN d’origine bactérienne, le plasmide, ou encore par des vecteurs biologiques qui colonisent les cellules végétales comme, par exemple, la bactérie agrobacterium tumefaciens. La mutagenèse a pu être ensuite dirigée et au début des années 2000 on a assisté à l’essor des techniques de modification ciblée du génome, avec l’utilisation de méganucléases, de nucléases dites à « doigt de zinc » ou des « TALE nucléases » (TALEN), qui ont précédé la découverte du CRISPR-Cas9, (courtes) séquences palindromiques répétées et régulièrement espacées, qui permet de couper le gène puis de supprimer ou de remplacer certains morceaux.
A la fin de ce travail, les rapporteurs ont la conviction que les scientifiques ont un recul suffisant sur les conséquences de l’utilisation de ces premières techniques, puisque les premières mutagenèses ont été réalisées il y a 80 ans, généralisées il y a 60 ans, que la première transgenèse a eu lieu il y a environ 35 ans, et que les productions se sont ensuite développées il y a déjà 20 ans. En effet, tous les experts rencontrés (voir ci-dessous) ont confirmé qu’à ce jour, aucun risque sanitaire n’avait été démontré.
Les technologies de modification ciblée du génome sont plus précises. La nouveauté réside dans le guidage par un ARN qui permet précisément à l’ADN d’être coupé à l’endroit désiré.
La modification ciblée du génome est réalisée à l’aide de l’enzyme Cas-9, guidée par un ARN pour couper l’ARN avec précision. Le sigle CRISPR correspond à une structure génétique bactérienne naturelle qui porte la mémoire des infections antérieures de la bactérie. Le système CRISPR-Cas améliore naturellement la résistance des bactéries contre les agressions virales.
Cette technologie est révolutionnaire et apporte une rupture. Elle est à la fois simple, efficace, très puissante, universelle et facile à mettre en œuvre. Elle fonctionne sur tous les organismes vivants, des bactéries aux plantes et aux mammifères. Certaines de ces techniques ne seraient pas traçables, c’est-à-dire qu’il serait impossible de distinguer entre une mutation spontanée et une mutation ciblée. Toutes les instances d’évaluation souhaitent bien sûr vérifier qu’il n’y a pas d’effet « hors-cible » (129).
Beaucoup des interlocuteurs rencontrés ont toutefois insisté sur la difficulté actuelle d’appliquer ces technologies et pensent qu’il faut utiliser ce temps pour aborder les problèmes éthiques. Michel Griffon, déjà cité, va plus loin en disant que « Cette utilisation du ciblage apparaît donc comme une modification se situant dans le champ de l’évolution naturelle ». Le débat est posé et il est politique. Car si l’espèce humaine s’est développée sur Terre, c’est que l’homme s’est constamment appuyé sur l’évolution de techniques. Le refus global de recours aux technologies en laissant seule la nature réguler ne constitue pas la voie à choisir. Les rapporteurs sont favorables au progrès. Celui-ci bien sûr doit être maîtrisé par l’homme et surtout partagé, notamment entre les pays du nord et ceux du sud.
Ce n’est pas l’avis de Guy Kastler, membre de la Confédération paysanne, qui fait plus confiance à la nature qu’aux technologies. Il a en effet déclaré que : « La puissance de ces technologies est inquiétante. L’amélioration des plantes était jusqu’à présent assurée par une sélection paysanne millénaire, processus lent qui respecte le rythme naturel. Ces technologies induisent un rythme beaucoup plus rapide. En quelques années, un gène peut être mis en œuvre sur toute la planète, sous prétexte de gagner du temps et de l’argent, on ne respecte pas le temps de la nature afin que les écosystèmes absorbent ce nouvel élément de l’environnement ».
b. Accélération de la vitesse de détection
L’apparition des méthodes de modification ciblée du génome entraînera une accélération des méthodes de sélection.
Les méthodes de modification ciblée du génome entraînent des mutations qui pourraient intervenir naturellement, car des mutations naturelles se produisent dans tout organisme vivant. On ne fait qu’accélérer ce que la nature réalise toute seule. Les rayonnements solaires auxquels sont exposés, par définition, tous les végétaux, sont sources de mutation génétique. La plupart des végétaux et animaux servant à l’alimentation humaine et animale n’ont rien de naturel, ils résultent de 10 000 ans de sélection par l’homme, depuis l’invention de l’agriculture. Le blé en est l’illustration. Il est le résultat d’une fusion qui s’est produite il y a plus de 500 000 ans pour donner un blé tétraploïde comprenant quatre fois sept chromosomes, puis par une deuxième fusion génétique, avec une espèce sauvage pour donner un blé constitué de six exemplaires des sept chromosomes initiaux.
c. Moyens de détection du processus de modification du génome
Les modifications ciblées du génome ainsi réalisées sont en grande partie indétectables, tout au moins celles qui n’introduisent pas de gènes ni autres matériaux étranger à la plante modifiée. Une modification génétique est détectable, notamment par séquençage du génome, mais cette opération est lourde techniquement. Elle a permis de révéler un grand polymorphisme à l’intérieur d’une espèce. Il sera donc impossible de distinguer une semence transformée par une modification ciblée du génome, d’une semence obtenue à la suite d’une mutation naturelle ou par mutagenèse. Ces technologies se différencient donc des technologies qui conduisent aux plantes transgéniques, puisque dans ce cas, on peut détecter des amorces d’ADN utilisées pour insérer le gène. C’est ce qu’a indiqué aux rapporteurs Jean-Claude Pagès, président du conseil scientifique du HCB, citant l’avis du 20 janvier 2016 du conseil scientifique sur les nouvelles techniques (130) : « Les techniques moléculaires de détection ne permettent pas de distinguer certaines techniques […] à l’origine des produits ». « Les produits […] qui ne contiennent pas de transgènes, même s’il y a eu recours effectif à une NPBT lors de la production de la lignée/variété correspondante, ne seraient pas distinguables d’un même produit obtenu par une technique ne relevant pas du champ de la définition des OGM ».
C’est également ce que dit Deng Xingwang, directeur du Centre de recherche conjoint sur la génétique des plantes et la biotechnologie (Pékin), ce procédé permettrait de considérer ces plantes comme non transgéniques. En effet, « dans la mesure où aucun gène extérieur n’est ajouté à la plante, ce qui est le cas dans les cultures OGM classiques, les semences modifiées avec les nouvelles techniques d’édition du génome sont certes modifiées génétiquement, mais pas transgéniques ». Dans le cas du blé, le gène inhibant doit être inactivé de la réponse immunitaire. Par ailleurs, la généticienne chinoise Gao Caixia souligne que des modifications génétiques spontanées existent déjà dans la nature, ainsi il sera impossible de distinguer une plante modifiée naturellement ou artificiellement.
d. Nouvelles biotechnologies et nouveaux défis
Une autre évolution radicale caractérise les nouvelles techniques de modification ciblée du génome. Elles ouvrent la voie à des modifications qui ne sont pas réduites à la résistance aux herbicides ou à l’augmentation de la productivité. Les problèmes qui sont aujourd’hui posés à l’agriculture mondiale sont de résister aux maladies et aux ravageurs et de réduire le recours aux pesticides. L’INRA évalue à près de 50 % les pertes dues aux ravageurs avant la récolte et à celles qui ont lieu lors du stockage, des transports et de la transformation des produits. François Houllier alors président de l’INRA, auditionné par les rapporteurs, insiste sur le fait que les biotechnologies végétales regroupent un ensemble de techniques très larges qui ne se résume pas aux seuls OGM et que ces technologies sont un des leviers de la transition agroécologique. Le renouvellement des pratiques de production agricole, doit jouer à la fois sur la génétique végétale, mais aussi sur la diversification des cultures, l’allongement des rotations et la lutte mécanique et chimique, ainsi que sur le biocontrôle et les luttes intégrées. Pour les rapporteurs, il ne devrait donc pas y avoir opposition mais complémentarité entre les nouvelles biotechnologies et l’agroécologie.
Plusieurs compilations des résultats de la recherche mondiale ont montré des avantages indéniables du maïs génétiquement modifié pour lutter contre les ravageurs, et notamment contre la pyrale et la sésamie. Le premier, c’est qu’il ne tue que l’insecte ciblé, dans la mesure où les autres espèces ne consomment pas le maïs, le second, c’est qu’il a permis de supprimer les traitements insecticides. Deux économistes britanniques (131) évaluent la diminution de la quantité d’insecticide utilisé à plus de 40% sur la période 1996-2011. Le principal intérêt est bien sûr de développer des plantes résistantes à des ravageurs ou à des virus pour limiter les pertes.
Le nouveau défi qui se pose est de développer des caractéristiques nouvelles des plantes :
– moins consommatrices en intrants – et notamment en engrais – par une meilleure utilisation de l’azote ;
– mieux adaptées au changement climatique, en proposant des variétés plus économes en eau, résistantes au stress hydrique ou à la salinité, à des submersions ou à des événements climatiques extrêmes ;
– amélioration de la qualité nutritionnelle des aliments, pour répondre aux attentes des consommateurs (certains types d’acides gras, absence de produits allergènes…).
L’appel des cent prix Nobel, déjà cité, pose cette question et tire la sonnette d’alarme, en affirmant que ce serait un crime contre l’humanité de ne pas utiliser les nouvelles biotechnologies disponibles.
e. Un plus pour l’agriculture biologique
Le cahier des charges permettant d’obtenir le label bio exclut l’utilisation d’organismes génétiquement modifiés dans la production. La question est posée de savoir si les technologies de modification ciblée du génome, qui s’apparentent à des mutations naturelles seront ou non assimilées à des OGM par les organismes de certification. Le débat est vif, car la plupart des partisans de l’agriculture biologique ne souhaitent pas que ces nouvelles technologies puissent être utilisées dans les productions bios. Mais cette position n’est plus unanime. Michel Griffon l’indiquait, lors de l’audition publique de l’OPECST d’avril 2016, en disant que les « nouvelles biotechnologies végétales offrent des opportunités très intéressantes pour consolider une agriculture ancrée dans une vision écologique de la production végétale ». C’est aussi la position d’un des défenseurs européens de l’agriculture biologique, M. Urs Niggli, directeur de l’Institut de recherche sur l’agriculture biologique (FIBL), l’un des principaux centres au monde de recherche sur le bio, et qui dans le journal Die Tageszeitung (132) a parlé des bénéfices que doivent apporter les technologies de type CRISPR-Cas9 à l’agriculture biologique en créant des variétés résistantes aux maladies.
M. Urs Niggli est internationalement respecté pour ses travaux de recherche dans la communauté de l’agriculture biologique et au-delà. Il estime que les nouvelles biotechnologies ont un « grand potentiel », pour les sélectionneurs et les agriculteurs bio.
M. Niggli a dit que se passer de cette technologie pourrait signifier à long terme que les agriculteurs conventionnels disposeront d’une pomme de terre résistante aux parasites et maladies, qui pourra pousser entièrement sans pesticides, alors que les agriculteurs bio auraient encore à appliquer des sels de cuivre ou d’autres pesticides autorisés par les normes du bio – une situation insupportable pour lui. Il a ajouté que la technologie CRISPR-Cas9 était tout à fait différente des technologies de génie génétique traditionnelles et qu’elle supprimerait un certain nombre de préoccupations soulevées par les techniques plus anciennes. Au lieu de rejeter CRISPR-Cas9 par principe, il conviendrait d’examiner chaque application particulière. « Aujourd’hui déjà, je peux citer des applications utiles », a-t-il dit, en mentionnant les résistances à des maladies comme exemple. « On pourrait désactiver des gènes de susceptibilité à des maladies ou introduire des gènes de résistance de parents sauvages dans les cultivars modernes. Ce sont des propriétés qui ont été largement perdues dans la sélection pour le rendement et la qualité au cours des cent dernières années. Cela nous permettrait de nous passer de grandes quantités de pesticides ».
Dans l’agriculture biologique, le mildiou est un problème pour les pommes de terre, la vigne et le houblon, a dit M. Niggli, ajoutant que le cuivre utilisé dans l’agriculture biologique pour lutter contre cette maladie fongique était également un problème, car il empoisonne le sol. Avec les techniques de sélection classiques, il faudrait 30, 40 années de travail, et dépenser des sommes d’argent considérables, sans aucune garantie que l’agent pathogène soit éradiqué.
Pour lui, les plantes produites par CRISPR-Cas9 ne devraient pas être réglementées et étiquetées comme des OGM, car la technologie est beaucoup moins risquée que le génie génétique classique. La réglementation devrait être moins complexe, plus rapide et moins chère. Étiqueter ces plantes comme des OGM serait « contre-productif ».
À la question de savoir si la technologie poserait des risques inconnus, par exemple des changements involontaires et non détectés dans le génome, pouvant donner lieu à des allergies et d’autres problèmes de santé ou avoir des conséquences environnementales, il a répondu sans ambages : « Ça, vous ne le savez pas non plus avec la sélection traditionnelle », en donnant des exemples de programmes de sélection classique ayant conduit à des produits avec un potentiel allergène accru. « Je pense qu’une stratégie de risque zéro est donquichottesque. »
C’est ce même constat que les rapporteurs ont fait à Gruissan (09) en visitant le centre expérimental Pech Rouge de l’INRA qui travaille sur les vignes résistant à l’oïdium et au mildiou. Ces vignes ont été pour l’instant produites par des procédés de croisement traditionnels, mais il a fallu plus de vingt ans pour intégrer ces résistances, alors que l’utilisation de nouvelles technologies permettrait de transférer très rapidement ces gènes de résistance. C’est également l’avis du professeur Pamela Ronald, de l’université d’agronomie de Davis (133), Californie, qui indique que « les pratiques de l’agriculture biologique et de la génétique ne sont pas incompatibles, contrairement aux idées reçues, mais que au contraire, ses voies visent les mêmes objectifs de durabilité économique, environnementale et sociale pour la production agricole ».
Les Français ont dépensé 7 milliards d’euros (134) pour des aliments sans phytosanitaires. Est-il utile de préciser sans OGM, si comme semblent le démontrer toutes les récentes études, il n’y a aucun risque sanitaire pour le consommateur ? L’agriculture biologique aurait intérêt, comme l’affirment de nombreuses voix, à utiliser les nouvelles technologies pour faire baisser plus vite les utilisations de produits phytosanitaires, car elles risquent d’être contournées par les tenants de l’agriculture raisonnée, qui n’hésiteraient pas à utiliser ces technologies.
f. Complémentarité entre agroécologie et biotechnologie
Une idée préconçue mais largement diffusée oppose « biotechnologies » et « agroécologie ». Selon la définition proposée par Miguel Altieri (1995), professeur à l’université de Californie-Berkeley : « L’agroécologie est la science de la gestion des ressources naturelles au bénéfice des plus démunis confrontés à un environnement défavorable ».
Or la génétique animale et végétale demeure un levier important pour accroître la compétitivité et la durabilité du secteur agricole et agroalimentaire français. La transition agroécologique, les objectifs de multiperformance, la lutte contre le changement climatique, les nouveaux enjeux de la bioéconomie ou encore les demandes des consommateurs amènent à élargir les objectifs de recherche en amélioration et sélection animale et végétale. On peut citer entre autres la diversification des espèces, la résistance aux maladies, la réduction de l’usage des pesticides, la tolérance à la sécheresse ou à la chaleur, la robustesse des animaux dans un but de durabilité, ou encore l’adaptation de la qualité aux usages alimentaires…
Le rapport « Agriculture-Innovation 2025 : 30 projets pour une agriculture compétitive et respectueuse de l’environnement », précité, comporte un chapitre sur l’agroécologie. Il propose des projets participant à un défi majeur du
XXIe siècle, celui de nourrir l’humanité, et luttant contre le changement climatique par la transition agroécologie en exploitant notamment la biomasse.
Selon le rapport, l’agroécologie est une discipline apparue courant
XXe siècle dans l’optique de croiser deux disciplines, l’agronomie et l’écologie. Elle considère alors « les systèmes de culture et d’élevage comme des écosystèmes dans lesquels le milieu naturel est transformé par de pratiques agricoles, qui réciproquement s’adaptent au milieu ». L’agroécologie fut inscrite en 2014 dans la loi d’avenir pour l’agriculture. Elle permet ainsi de faire la transition entre une agriculture traditionnelle et la dimension écologique, articulant ingénierie agronomique et régulations naturelles. Ce principe s’appuie sur trois leviers : la biodiversité et les interactions biologiques ; les cycles de l’eau et des éléments majeurs ; et la structure et la dynamique des paysages et territoires agricoles.
Par ailleurs, l’agroécologie présente trois enjeux, celui de permettre aux sols de continuer à délivrer leurs services, d’utiliser les avancées de la science et de prédire l’effet du type de sol. Par conséquent, il est nécessaire pour agir d’améliorer la connaissance de la biodiversité de sols de références et d’identifier de nouveaux marqueurs fonctionnels, de cartographier la biodiversité des sols, d’identifier les caractères végétaux et microbiens et de concevoir et mettre en œuvre un dispositif international des réseaux d’exploitants agricoles. Ainsi, ce rapport s’intéresse à cinq points de l’agroécologie : la connaissance des sols, l’amélioration de la fertilité des sols et l’atténuation du changement climatique, anticipation du changement climatique et adaptation en développant un portail de services pour l’agriculture, développement des outils de diagnostic sanitaire rapide sur le terrain.
Ce rapport consacre également un chapitre aux biotechnologies. Il estime que la génétique et les biotechnologies font « l’objet d’une forte concurrence internationale. Or, la France dispose d’un très haut niveau de compétences en recherche, mais a pris du retard dans l’expérimentation et la diffusion ». Le rapport précise que : « Les projets recouvrent la sélection génomique végétale et animale, la maîtrise des biotechnologies, l’exploitation de la diversité métabolique végétale. Cet axe inclut également un volet réglementaire pour préciser les procédures d’homologation des variétés dérivées des biotechnologies (dans le cadre national, en lien avec le Haut Conseil des biotechnologies, et européen). »
Le rapport propose de poursuivre et d’amplifier les projets du programme des investissements d’avenir (PIA) en sélection génomique, de renforcer les infrastructures clés, de créer des data centers et d’affirmer dans le cadre européen une ambition internationale. Le rapport traite dans son axe n° 5 de la génétique et des biotechnologies. Le rapport propose quatre projets visant à : développer la sélection génomique animale et végétale ; assurer la maîtrise des nouvelles technologies ; relever l’enjeu industriel des métabolites secondaires, leur diversification et leur développement ; faire évoluer les procédures et protocoles pour favoriser le progrès génétique et son adaptation.
Les rapporteurs notent que les propositions du rapport « Agriculture-Innovation 2025 » relatives aux biotechnologies ne vont pas au-delà du soutien de principe. Il y a une sorte d’autocensure qui tient compte des positions gouvernementales. En outre, le rapport n’indique pas suffisamment comment articuler les deux outils agroécologie et biotechnologies et dans quelle mesure ils sont complémentaires. Il semble que l’INRA, tétanisé par les prises de position gouvernementales, ait choisi de privilégier l’agroécologie au détriment des outils que sont les biotechnologies. Mais l’organisation reste dans le discours et les mesures concrètes d’application font malheureusement défaut.
La FAO est plus convaincante dans la démonstration de la complémentarité des deux approches.
En septembre 2014 s’est tenu à Rome, le symposium de la FAO sur « L’agroécologie pour la sécurité alimentaire et la nutrition », préparé sous l’égide des gouvernements français et suisse.
Un premier débat a introduit les principes de l’agroécologie en expliquant l’intérêt que cela pouvait avoir sur la santé des écosystèmes. La pratique de l’agroécologie permet de respecter un capital naturel dans un contexte de changement climatique, une expansion de la vie urbaine et l’évolution de la biodiversité. Le postulat est le suivant : près de 800 millions de personnes ne peuvent pas se nourrir correctement, alors que l’obésité devient un problème sanitaire important dans nos sociétés. Le décalage est d’autant plus flagrant quand on sait qu’entre 30 et 50 % de la nourriture est jetée. Ce sont des problématiques qui participent à une prise de conscience collective et incite à mettre en place l’agroécologie. Par la suite, les scientifiques interrogés expliquent les intérêts à mettre en place dans ce genre d’agriculture, pointant la possibilité d’améliorer les rendements et la qualité dans des conditions de production intéressantes. Ils parlent d’optimisation du système agraire, tout en s’adaptant au changement climatique par une mutation rapide des plantations au nouveau climat. De plus, l’agroécologie permet de développer les différents secteurs, notamment économique, en permettant d’employer et d’améliorer la productivité et en offrant la possibilité d’allier les différents producteurs. Différents pays ont mis en place ce système d’agroécologie, comme la Colombie, dans le but de réhabiliter des terres anciennement polluées par des intrants chimiques, mais aussi en Argentine, Brésil, France, Népal, Cuba, ou encore en Inde. L’agroécologie présente différents défis, dont l’accès à une nourriture saine et de bonne qualité. Ainsi, elle peut être complétée par l’apport technologique qui lui permettrait de résoudre certaines de ces problématiques.
Deux ans après, toujours à la FAO, le directeur général de l’organisation, M. José Graziano da Silva, concluait le symposium de 2016 sur les biotechnologies agricoles en disant : « Pour répondre aux défis sans précédent du XXIe siècle, une combinaison de réponses allant de l’agroécologie, les biotechnologies agricoles aux autres approches sera nécessaire. Le symposium a indiqué que les biotechnologies agricoles et l’agroécologie pouvaient être utilisées comme options complémentaires. »
C’est M. Michel Griffon, lors du 4e colloque « Les biotechnologies au service de l’agroécologie » organisé en octobre 2014 par l’Association française des biotechnologies végétales (AFBV) et du laboratoire d’idées (think tank) saf agr’iDées, et en partenariat avec l’INRA, qui est le plus précis sur la complémentarité entre biotechnologies et agroécologie, en prônant une agriculture « écologiquement intensive ».
Il a développé le thème des liens entre agroécologie et agriculture « écologiquement intensive ». Pour lui, l’agriculture du futur devra connaître des évolutions très importantes : ne plus être polluante, garantir l’innocuité parfaite des aliments, s’adapter au changement climatique, séquestrer du carbone, réduire les consommations d’énergie fossile et d’engrais en raison de la hausse de leurs prix, cultiver la biodiversité, s’adapter à des prix agricoles plus volatils, être plus compétitive, mais aussi produire plus, diversifier les productions notamment des plantes énergétiques et des plantes fournissant de nouvelles molécules, améliorer la qualité des produits et produire des services écologiques… Pour saisir ces enjeux, elle ne pourra plus être fondée sur un « forçage » du fonctionnement des écosystèmes productifs, tendance qui a été à la base de l’intensification en intrants depuis plus d’un demi-siècle. Elle devra au contraire porter par amplification à des niveaux productifs supérieurs les équilibres de fonctionnement des écosystèmes cultivés. C’est le fonctionnement écologique de ces écosystèmes cultivés qui doit être intensif, et non le recours à des intrants externes. Cette conception dite « écologiquement intensive » désigne l’écologie ainsi que la biologie comme les sciences fondant les nouvelles techniques de production. Gérer des écosystèmes à des niveaux élevés de production demande une bonne connaissance des lois de l’écologie fonctionnelle. Les plantes du futur doivent s’adapter rapidement à ces nouveaux écosystèmes ainsi qu’à l’évolution plus erratique des milieux ce qui requiert l’utilisation de nouvelles biotechnologies. Les progrès de la chimie dans le sens de la durabilité et de la synthèse des molécules créent des potentialités nouvelles en matière de traitements phytosanitaires biomimétiques. Enfin, les technologies de l’information et des communications permettent une gestion de précision respectant de valoriser l’hétérogénéité écologique des milieux et permettant des gains de rendement.
Les rapporteurs estiment que les nouvelles techniques de sélection végétale offrent une occasion de s’affranchir des technologies des grandes entreprises multinationales, qui sont orientées vers des rendements toujours plus élevés sans rechercher de mode de production durable.
Ces nouvelles biotechnologies peuvent être utilisées dans un but favorisant la complémentarité avec l’agroécologie en utilisant notamment les techniques de biocontrôle.
Recommandation n° 11 : Nouvelles biotechnologies : pour une clarification règlementaire de la France et de l’Europe
– Souhaite que la France vote une loi fondatrice sur les biotechnologies vertes, marquant la nécessité de soutenir l’avancée des connaissances, d’améliorer la compétitivité des entreprises françaises et de promouvoir la complémentarité des biotechnologies vertes et de l’agroécologie ;
– Souhaite qu’une directive européenne clarifie rapidement les questions posées par les nouvelles biotechnologies, et notamment les questions de l’apport des biotechnologies vertes aux enjeux du réchauffement climatique, au renforcement des défenses naturelles des plantes pour mieux s’adapter, à la lutte contre les ravageurs, aux opportunités pour l’agriculture biologique, ainsi que les questions de gouvernance européenne ;
– Suggère que la réglementation de mise en culture de produits issus de techniques, dont la sécurité est avérée depuis des dizaines d’années, ne fasse pas l’objet des mêmes mesures d’autorisation de mise en culture que celles prévues pour les plantes génétiquement modifiées (PGM).
3. Les produits de la modification ciblée du génome : OGM or not OGM ?
L’incertitude prévaut dans l’Union européenne depuis dix ans sur la qualification juridique des nouvelles techniques de sélection végétale (New Breeding Techniques – NBT) au regard du droit communautaire.
a. La définition européenne des OGM
Dans l’Union européenne, les règles relatives aux organismes génétiquement modifiés (OGM) figurent essentiellement dans la directive n° 2001/18 du 12 mars 2001 relative à la dissémination volontaire d’organismes génétiquement modifiés dans l’environnement. Son article 2 définit un tel « organisme » comme « toute entité biologique capable de se reproduire ou de transférer du matériel génétique ». Ce qui signifie qu’en droit européen, un « OGM » est un « organisme, à l’exception des êtres humains, dont le matériel génétique a été modifié d’une manière qui ne s’effectue pas naturellement par multiplication et/ou par recombinaison naturelle ».
DIRECTIVE N° 2001/18
Article 2
Définitions
Aux fins de la présente directive, on entend par :
1) « organisme » : toute entité biologique capable de se reproduire ou de transférer du matériel génétique;
2) « organisme génétiquement modifié (OGM) » : un organisme, à l’exception des êtres humains, dont le matériel génétique a été modifié d’une manière qui ne s’effectue pas naturellement par multiplication et/ou par recombinaison naturelle.
Aux fins de la présente définition :
a) la modification génétique se fait au moins par l’utilisation des techniques énumérées à l’annexe I A, première partie ;
b) les techniques énumérées à l’annexe I A, deuxième partie, ne sont pas considérées comme entraînant une modification génétique ;
[…]
Article 3
Exemptions
1. La présente directive ne s’applique pas aux organismes obtenus par les techniques de modification génétique énumérées (voir ci-dessous)
[…]
ANNEXE I A : TECHNIQUES VISÉES À L’ARTICLE 2, POINT 2
PREMIÈRE PARTIE
Les techniques de modification génétique visées à l’article 2 a), sont, entre autres :
1) les techniques de recombinaison de l’acide désoxyribonucléique impliquant la formation de nouvelles combinaisons de matériel génétique par l’insertion de molécules d’acide nucléique, produit de n’importe quelle façon hors d’un organisme, à l’intérieur de tout virus, plasmide bactérien ou autre système vecteur et leur incorporation dans un organisme hôte à l’intérieur duquel elles n’apparaissent pas de façon naturelle, mais où elles peuvent se multiplier de façon continue ;
2) les techniques impliquant l’incorporation directe dans un organisme de matériel héréditaire préparé à l’extérieur de l’organisme, y compris la micro-injection, la macro-injection et le microencapsulation ;
3) les techniques de fusion cellulaire (y compris la fusion de protoplastes) ou d’hybridation dans lesquelles des cellules vivantes présentant de nouvelles combinaisons de matériel génétique héréditaire sont constituées par la fusion de deux cellules ou davantage au moyen de méthodes qui ne sont pas mises en oeuvre de façon naturelle.
DEUXIÈME PARTIE
Les techniques visées à l’article 2, point 2, sous b), qui ne sont pas considérées comme entraînant une modification génétique, à condition qu’elles n’impliquent pas l’emploi de molécules d’acide nucléique recombinant ou d’OGM obtenus par des techniques /méthodes autres que celles qui sont exclues par l’annexe I B, sont :
1) la fécondation in vitro ;
2) les processus naturels tels que la conjugaison, la transduction, la transformation, ou
3) l’induction polyploïde.
ANNEXE I B : TECHNIQUES VISÉES À L’ARTICLE 3
Les techniques/méthodes de modification génétique produisant des organismes à exclure du champ d’application de la présente directive, à condition qu’elles n’impliquent pas l’utilisation de molécules d’acide nucléique recombinant ou d’OGM autres que ceux qui sont issus d’une ou plusieurs des techniques/méthodes énumérées ci-après, sont :
1) la mutagenèse ;
2) la fusion cellulaire (y compris la fusion de protoplastes) de cellules végétales d’organismes qui peuvent échanger du matériel génétique par des méthodes de sélection traditionnelles.
La directive précise la définition en donnant en annexe I A1 quelques exemples de techniques considérées comme OGM, dont notamment la recombinaison d’ADN et l’incorporation de matériel héréditaire extérieur. L’annexe I A2 donne trois exemples de techniques qui ne sont pas des OGM. L’annexe 1 B considère comme OGM la mutagenèse et la fusion cellulaire par des méthodes de sélection traditionnelle, mais exempte ces deux techniques des dispositions de la directive (évaluation, autorisation, surveillance…). Cette exemption est justifiée par le considérant 17 de la directive : « La présente directive ne devrait pas s’appliquer aux organismes obtenus au moyen de certaines techniques de modification génétique qui ont été traditionnellement utilisées pour diverses applications et dont la sécurité est avérée depuis longtemps ».
b. La position européenne sur les nouvelles biotechnologies
Ces règles apparaissent très claires aux rapporteurs, aux scientifiques, aux membres des instances de gouvernance, ainsi qu’aux organisations professionnelles. Elles assurent le socle juridique permettant de dissocier les techniques de transgenèse de celles qui se fondent sur la modification ciblée du génome. Mais certains s’y opposent avec véhémence. José Bové l’a exprimé en justifiant l’élargissement de la réglementation OGM aux nouvelles biotechnologies et parlant même « d’OGM cachés ». Quant à Patrick de Kochko, il l’a résumé au nom des Amis de la Terre et des associations opposées aux OGM lors de l’audition publique de l’OPECST du 27 octobre 2016, par cette phrase : « moins de transgenèse, plus de mutagenèse, mais pour nous toujours des OGM ».
i. Le processus décisionnel européen
Avec cette directive, l’Union européenne a privilégié une approche par techniques. Or celles-ci ont beaucoup évolué depuis 2001 ; en particulier, les nouvelles techniques de sélection végétales mentionnées, en partie I de ce rapport n’y sont pas mentionnées car elles n’existaient pas.
La directive instaure une autorisation préalable d’une durée de dix ans renouvelable à toute mise sur le marché d’OGM et une surveillance environnementale et sanitaire consécutive. Elle rend obligatoire l’information du public et l’étiquetage des OGM. Les modalités de consultation publique sont fixées par les États membres. L’étiquetage est obligatoire sur toute denrée alimentaire et tout aliment pour animaux contenant un OGM, consistant en tel organisme ou produit à partir d’un OGM, sauf si la teneur est inférieure à 0,9 % de la denrée, de l’aliment ou de l’ingrédient et si sa présence est fortuite ou techniquement inévitable.
C’est ce qui a été fixé par la réglementation européenne, notamment du fait de la coexistence entre cultures de plantes transgéniques et cultures traditionnelles et biologiques. En dessous de ce seuil, il n’est pas obligatoire d’étiqueter la présence d’OGM. Il est important de réfléchir à cette question au préalable, pour savoir quel niveau de contamination fortuite sera exigé dans l’agriculture biologique ou dans les périmètres sous lesquels des appellations d’origine ou des labels existent. Il est également nécessaire de fixer une position lorsque la présence d’une modification n’est pas traçable, parce que la mutation est identique à celle qui aurait pu être obtenue par une mutation spontanée. Ce seuil de 0,9 % ne correspond pas à un niveau de toxicité mais à un consensus politique sur l’étiquetage. Car si le produit modifié était toxique, il devrait être interdit, comme l’indiquait dans une audition du 22 décembre 2004 Bernard Chevassus-au-Louis : « Je ne connais aucun produit dans lequel on tolèrerait la présence d’un composant considéré comme dangereux à hauteur de 0,9 % » (135).
Pour les OGM, le droit européen distingue les autorisations de culture, d’une part, des autorisations d’utilisation (importations et mises sur le marché), d’autre part. Actuellement dans l’Union européenne, le maïs MON 810 est le seul OGM dont la culture est autorisée. À la date de rédaction du présent rapport, il n’y a que cinq États membres où le maïs MON 810 est effectivement cultivé : Espagne, Portugal, Tchéquie, Slovaquie, Roumanie. Dans six autres, il est également autorisé mais pas cultivé : Royaume-Uni (Angleterre seulement), Belgique (régions bruxelloise et flamande seulement), Irlande, Suède, Finlande, Estonie et il est interdit dans les autres pays en vertu de la directive n° 2015/412. Le paradoxe est que les importations continuent.
Il y a, pour les rapporteurs, hypocrisie à autoriser l’importation du soja transgénique pour l’alimentation animale, et interdire les cultures, car ou ce maïs présente un risque pour l’alimentation animale et humaine et il faut l’interdire, ou, si comme toutes les instances l’affirment trente-quatre ans après les premières cultures en plein champ, ce risque est écarté, il convient d’autoriser dans des conditions fixées par la directive européenne de 2001 et par la loi française de 2008, à le cultiver, puisqu’il est possible de l’importer.
En 2015, 58 OGM étaient autorisés à l’importation dans l’Union européenne à des fins d’utilisation pour alimentation humaine ou animale. Ces produits concernent du maïs, du coton, du soja, du colza et de la betterave sucrière. Au même moment, 58 autres produits étaient en attente d’une autorisation. En 2013, 36 millions de tonnes d’équivalent soja étaient utilisées pour nourrir le bétail dans l’Union européenne, dont 1,4 million de tonnes d’organismes non génétiquement modifiés produits au sein de l’Union européenne.
L’Europe est donc fortement dépendante des importations de soja pour nourrir son bétail, essentiellement en provenance du Brésil, d’Argentine, des États-Unis et du Paraguay, où la culture d’OGM est prépondérante.
ii. Un processus de décision bloqué
La procédure d’autorisation d’un OGM est décrite par l’organigramme présenté ci-dessous. La demande doit d’abord être faite à un État membre, qui la transmettra à l’Agence européenne de sécurité alimentaire (EFSA). Celle-ci effectue une évaluation et transmet son avis à la Commission européenne, qui présentera une proposition de décision au comité d’experts des États membres (« comitologie »). En cas d’opinion négative ou d’absence d’opinion, la Commission convoque un comité d’appel qui répond positivement ou négativement à la majorité qualifiée. Si le comité d’appel ne parvient pas à une décision à cette majorité qualifiée, la décision finale revient à la Commission européenne, qui normalement autorisera les OGM ayant reçu un avis favorable de l’EFSA. Dès lors, pour rejeter cette autorisation sur leur territoire, les États membres pourraient prendre des mesures d’urgence (clause de sauvegarde) pour se garantir contre un nouveau risque avéré au niveau sanitaire ou écologique.
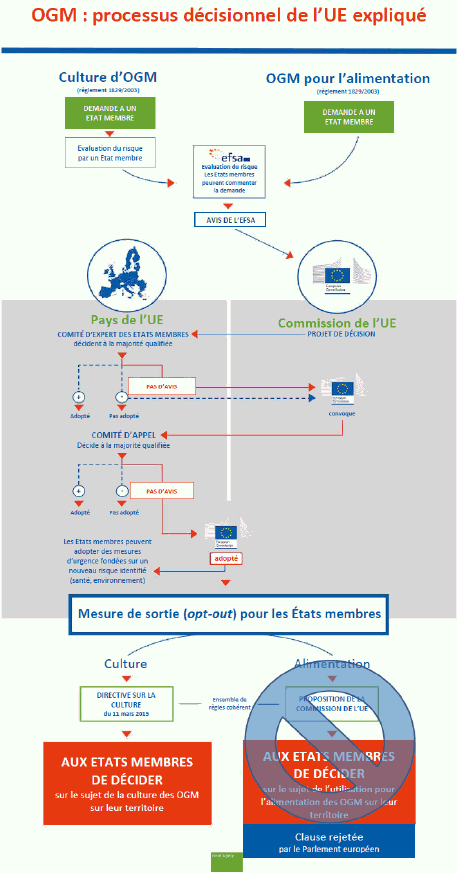
Source : Commission européenne (traduction OPECST).
La pratique constante depuis les années 2000 est que les États membres, réunis en comité d’expert divisés, ne parviennent pas à obtenir une majorité qualifiée, ne prennent pas position, laissant ainsi à la Commission la tâche de décider pour le compte de l’Union européenne.
Les rapporteurs regrettent que les États membres ne prennent pas leurs responsabilités, bloquant ainsi le fonctionnement normal du processus de décision pour l’autorisation des OGM.
Depuis la directive n° 2015/412 du 11 mars 2015 modifiant la directive n° 2001/18 en ce qui concerne la possibilité pour les États membres de restreindre ou d’interdire la culture d’OGM sur leur territoire, à l’élaboration de laquelle le Gouvernement français a pris une part active, les États membres peuvent aussi activer une clause dite « option de sortie » (opt-out) permettant à tout État membres d’interdire la culture de l’OGM sur son territoire national. Contrairement à la clause de sauvegarde, qui exige l’identification de risques sur des critères scientifiques, cette nouvelle clause peut être fondée sur « des motifs sérieux tels que ceux liés à des objectifs de politique environnementale, à l’aménagement du territoire, à l’affectation des sols, aux incidences socio-économiques, à la volonté d’éviter la présence d’OGM dans d’autres produits, sans préjudice de l’article 26 bis, à des objectifs de politique agricole ou à l’ordre public ». Cette directive, permet, certes, à l’Europe de sortir de l’enlisement, mais va indéniablement conduire à une Europe des biotechnologies à géométrie variable.
Cette clause de sortie n’est opposable que pour la culture des OGM. En effet, elle ne peut s’appliquer pour l’utilisation pour l’alimentation humaine et animale (donc les importations), le Parlement européen ayant refusé en octobre 2015 de modifier la directive en sens, au motif que ce serait contraire au marché unique et bien sûr, aux dispositions de l’organisation mondiale du commerce (OMC).
iii. L’incertitude prévaut depuis dix ans
Le développement des nouvelles techniques de sélection (New Breeding Techniques – NBT) pose la question de leur statut au sens de la directive n° 2001/18. La Commission européenne a, dès 2007, créé un groupe de travail sur ces nouvelles techniques (136). Composé d’experts des États membres, ce groupe de travail a remis son rapport en 2011. Ce rapport n’a pas été publié par la Commission européenne, mais les rapporteurs ont pu en prendre connaissance. Si les préconisations suggérées dans ce rapport étaient retenues, les techniques ODM et doigts de zinc de catégorie SDN1 ou SDN2 (137) seraient exemptées des dispositions de la directive n° 2001/18 (annexe I B). Et les techniques doigts de zinc de catégorie SDN3 (138), cisgenèse et intragenèse et greffage, seraient considérées comme des OGM (annexe I A1)). Certaines plantes obtenues par agro-infiltration seraient considérées comme des OGM, d’autres pas. Les rapporteurs du groupe de travail européen proposent que la qualification des plantes obtenues par la technique RdDM dépende de l’interprétation de la directive, au regard de l’utilisation d’organismes intermédiaires considérés comme OGM, et que les plantes obtenues par sélection inverse ne soient pas considérées comme des OGM.
Depuis 2011, la Commission remettait d’année en année la publication d’une note interprétative de la directive n° 2001/18, pour statuer sur la qualification des nouvelles techniques de sélection, créant une situation d’incertitude juridique préjudiciable à la recherche et à la filière européennes des biotechnologies vertes. L’Union européenne se met-elle volontairement en retard sur les nouvelles techniques de sélection végétale ? Lors de leur mission de décembre 2016 à Bruxelles auprès des services de la Commission européenne (direction générale de la santé et des consommateurs et direction générale de l’agriculture), les rapporteurs ont appris que la Commission européenne avait saisi pour avis sur ces nouvelles techniques un nouveau groupe d’expert, le « SAM » (Scientific Advice Mecanism), composé de scientifiques placés auprès du président de la Commission européenne et dont le secrétariat est assuré par la direction générale de la recherche et de l’innovation de la Commission (139). Le SAM devrait rendre un avis sur ce sujet courant 2017.
Qui plus est, à la suite du renvoi préjudiciel d’octobre 2016 du Conseil d’État (140), la Commission estime qu’elle devra attendre la décision de la Cour de justice de l’Union européenne (CJUE), qui nécessite en général quinze mois, ce qui nous mène au début de l’année 2018…
Les rapporteurs considèrent que, cette fois, c’est la Commission européenne qui ne prend pas ses responsabilités, en repassant la « patate chaude » à des comités d’experts successifs, puis maintenant au juge européen.
Ce n’est clairement pas au juge de définir la politique de l’Union européenne sur un sujet aussi important que les biotechnologies appliquées à l’agriculture. Il s’agit d’une décision de nature politique qui relève de la compétence de la Commission européenne, en lien avec les comités d’experts des États membres correspondant, conformément aux procédures de comitologie habituelles des institutions européennes. Il y a une grave incohérence dans la position de la commission quand, d’un côté, elle parle de croissance, de développement d’un marché unique, de priorité à l’Europe de la recherche, et que de l’autre, elle cède à un attentisme en matière de biotechnologies.
En outre, il est étonnant de constater que le dossier des biotechnologies agricoles soit géré à la Commission européenne par les services de la direction générale de la santé et de la consommation, et non de la direction générale de l’agriculture. La raison invoquée par les fonctionnaires de la Commission européenne est que la DG Santé a pris en charge ce sujet à la suite de la crise de la « vache folle » et qu’elle exerce la tutelle sur les cinq agences compétentes en la matière (141). En confiant cette gestion à la DG santé, on valide de fait le principe de la dangerosité en matière sanitaire des produits issus des OGM. Malgré les dénégations des fonctionnaires européens rencontrés, les rapporteurs ont l’impression que la Commission européenne, comme la plupart des États membres, part du principe que les OGM sont potentiellement dangereux pour la santé humaine… À la décharge de la commission, celle-ci est soumise au feu médiatique permanent des activistes anti-OGM, qui « mettent en scène » leur opposition dans des opérations identiques à celles de « l’affaire Séralini »
L’évaluation sanitaire et environnementale des produits végétaux issus des biotechnologies est effectuée en Europe par l’Agence européenne de sécurité des aliments (EFSA). Les règles et procédures qu’elle suit sont considérées parmi les plus rigoureuses au monde.
iv. L’Agence européenne de sécurité des aliments (EFSA)
L’Agence européenne de sécurité des aliments (EFSA) évalue la sécurité des OGM avant leur autorisation pour un usage d’alimentation humaine ou animale ou pour la mise en culture. Les dossiers sont d’abord soumis à l’autorité nationale compétente d’un État membre, qui transmet ensuite à l’EFSA. L’EFSA évalue l’impact potentiel sur la santé humaine, sur la santé animale et sur l’environnement, notamment la stabilité des modifications, la toxicité ou l’allergénicité. Les évaluations de l’EFSA se fondent sur les dossiers scientifiques présentés par le pétitionnaire ou toute autre information scientifique pertinente disponible. Elle rend ensuite son avis et le transmet à la Commission européenne, qui décide l’autorisation ou non avec l’aide d’une comitologie (comité composé des représentants des États membres précité).
L’EFSA travaille en étroite collaboration avec les États membres au cours du processus d’évaluation des OGM, grâce à un réseau regroupant plus d’une centaine d’organisation avec plus de 250 experts (142). L’EFSA a élaboré des lignes directrices pour l’évaluation des OGM, ainsi sur la liste des données à fournir. Les lignes directrices sur l’allergénicité ont récemment été mises à jour au terme d’un processus associant les parties prenantes.
Pour chaque évaluation d’un organisme génétiquement modifié, l’EFSA prend en compte les aspects suivants :
– la caractérisation moléculaire de l’OGM : évaluation de la structure moléculaire des protéines nouvellement créées, de leur fonctionnement et de leurs interactions possibles ;
– l’analyse comparative : comparaison de la plante génétiquement modifiée avec son équivalent conventionnel. L’objectif est de détecter toute différence dans l’apparence observable de la plante, par exemple sa taille ou sa couleur (caractéristiques phénotypiques), ou dans ses caractéristiques agronomiques, par exemple son rendement. L’analyse compare aussi la valeur nutritionnelle de la plante génétiquement modifiée avec son équivalent traditionnel ;
– l’évaluation de la toxicité et de l’allergénicité potentielles de l’OGM ;
– l’évaluation de l’impact potentiel sur l’environnement de l’OGM.
Une fois l’OGM autorisé, il reçoit normalement une licence valable pour une durée de dix ans sur le marché de l’Union européenne. Au bout de dix ans, cet organisme devra à nouveau être évalué par l’EFSA, avant qu’une nouvelle décision d’autorisation puisse être adoptée.
La législation européenne dispose que les demandes d’autorisation portant sur l’importation, la transformation ou la culture d’une plante génétiquement modifiée doivent être accompagnées d’un programme de surveillance environnementale consécutive à la mise sur le marché (PMEM). Ce programme doit décrire de quelle manière les éventuels effets néfastes de la plante génétiquement modifiée sur l’environnement seront surveillés. C’est l’EFSA qui évalue annuellement les résultats des PMEM pour les plantes génétiquement modifiées cultivées et qui soumet des recommandations à la Commission européenne si nécessaire.
Dans certains cas, l’EFSA recommande aussi la surveillance de certaines plantes génétiquement modifiées, afin de contrôler leurs effets néfastes possibles sur la santé animale ou humaine. C’est généralement le cas lorsque des aliments génétiquement modifiés destinés à l’alimentation humaine ou animale présentent une composition nutritionnelle altérée, lorsque leur valeur nutritive diffère de celle des variétés conventionnelles, ou en cas de risque d’allergénicité accru dû à une modification génétique. L’objectif de cette surveillance est d’assurer la sécurité continue des nouveaux produits génétiquement modifiés.
En 2013, la Commission européenne a donné mandat à l’EFSA de suspendre l’évaluation des nouveaux procédés de sélection des plantes, pour permettre au groupe OGM de se concentrer sur l’évaluation des dossiers d’autorisation d’OGM proprement dits, ainsi que sur le développement de nouveaux documents d’orientation. Elle attend la décision de la Cour de justice de l’Union européenne (CJCE) avant de publier son interprétation de la directive n° 2001/18, pour savoir si ces nouvelles biotechnologies sont des OGM ou pas. L’EFSA n’a d’ailleurs pas reçu de demande d’évaluation d’OGM issues des nouvelles biotechnologies, les entreprises de biotechnologie évitant de procéder à des tests extrêmement coûteux sachant qu’in fine leur demande ne sera pas examinée...
Les rapporteurs trouvent inquiétant que, sur un sujet qui est par nature politique, sur une thématique qui concerne des technologies très récentes, qui n’étaient pas inventées en 2001, la Commission s’en remette à une interprétation juridique qui se fondera sur la directive n° 2001/18, qui n’incluait pas dans ses annexes la modification ciblée du génome. Après la démission de certains gouvernements des États membres, comme ceux représentant la France depuis 2008, la Commission Européenne joue à un jeu dangereux, qui risque à terme de freiner la compétitivité européenne.
L’EFSA a publié en 2012 deux opinions scientifiques sur son site internet concernant les lignes directrices pour trois nouvelles techniques : 1° la cisgenèse et l’intragenèse ; et 2° les doigts de zinc. Elle a conclu que les documents d’orientation existant sur l’évaluation des risques (y compris le document sur l’évaluation des risques pour l’environnement) pouvaient s’appliquer à l’évaluation des denrées alimentaires et des aliments pour animaux dérivant de ces nouvelles techniques. L’EFSA serait prête à évaluer deux de ces trois techniques, car les lignes directrices peuvent être applicables.
L’EFSA assure une veille scientifique sur les publications relatives aux OGM. Pourtant, interrogés par les rapporteurs, les fonctionnaires de l’EFSA reconnaissent ne pas avoir pris connaissance de la méta-analyse effectuée sur vingt ans d’OGM mis sur le marché par l’Académie des sciences américaine dans son rapport de 2016 « Genetically Engineered Crops » (143)…
Par contre, les deux publications de M. Gilles-Éric Séralini en 2012, très discutables scientifiquement, ont connu des suites importantes à l’EFSA. La Commission européenne a donné mandat à l’EFSA de les évaluer. Les deux publications ont provoqué de nombreuses discussions entre les États membres et avec la Commission. Le règlement n° 1829/203 dresse la liste des données que les entreprises doivent fournir. À la suite des articles de M. Séralini, cette liste a été jugée par la Commission trop sommaire, elle a été complétée par le règlement d’exécution de la Commission n° 503/2013. Dans ce règlement renforçant l’évaluation sanitaire et environnementale des OGM, des données supplémentaires sont demandées aux entreprises pétitionnaires, notamment l’obligation de mener une étude de 90 jours. Toujours en application de ce règlement, la Commission examine, à intervalle régulier, les demandes de nouvelles données en fonction des résultats publiés. Par ailleurs, deux projets européens ont été lancés sur deux types d’études sur les rats, une sur 90 jours et une autre sur 2 ans. Les comités organisateurs de ces deux études comportent des représentants des États membres et de la Commission européenne, ainsi que des experts.
Par ailleurs, le journal Le Monde a publié deux articles le 19 décembre 2016 intitulés « La recherche sur les OGM est minée par les conflits d’intérêt » (144) et « L’évaluation de la toxicité des OGM remise en cause » (145).
Dans le premier cas, il s’agit de rendre compte d’une étude réalisée par des chercheurs de l’INRA (146). Ces derniers ont analysé la littérature scientifique portant sur l’efficacité ou la durabilité des plantes transgéniques Bt sous l’angle du possible lien d’intérêt entre ces recherches et les industries de biotechnologies. Ils tendent à montrer que 40 % des publications étudiées présentent un conflit d’intérêt majeur. Ils concluent en outre que ces publications sont plus fréquemment favorables aux intérêts des industries semencières en présence qu’en l’absence de conflits d’intérêt.
Le deuxième article relate une étude publiée dans la revue Scientific Reports (147) qui montrerait des différences significatives entre un maïs génétiquement modifié tolérant le glyphosate NK603 et son équivalent non modifié, qui ne sont pas prises en compte dans les évaluations du risque conduites par les autorités sanitaires, selon le principe d’« équivalence substantielle ». Les rapporteurs notent que ce type de différence est connu depuis longtemps et qu’il existe tout autant entre deux spécimens d’une même variété non OGM. On ne sollicite pas pour autant d’évaluation de toxicité ou d’allergénicité, via un battage médiatique.
Les rapporteurs s’étonnent vivement que, d’un côté, un rapport de l’Académie des sciences américaine ne soit même pas examiné par l’EFSA, et que, de l’autre, une publication en 2012 d’un chercheur, M. Gilles-Éric Séralini, très critiquée pour son analyse statistique insuffisante, en rupture avec les règles de bonne pratique (148), aient conduit à d’intenses discussions avec les États membres et la Commission européenne. La publication dans la revue Food and Chemical Toxicology a d’ailleurs été retirée par l’éditeur, le Pr Séralini n’ayant pas accepté de publier ses données. Les rapporteurs s’étonnent encore plus qu’à la suite de cette polémique, la Commission européenne ait modifié son règlement d’exécution en renforçant l’évaluation sanitaire et environnementale des OGM, notamment en rendant obligatoire un test sur des rats à 90 jours et en réexaminant périodiquement l’opportunité de demander de nouvelles données à l’entreprise productrice d’OGM.
Les rapporteurs ne peuvent s’empêcher de s’interroger également sur l’« évaluation » des deux articles parus dans le journal Le Monde du 19 décembre 2016 et dont, un mois après, les résultats n’étaient toujours pas disponibles…
c. La position française sur les nouvelles biotechnologies : le rôle du Haut Conseil des biotechnologies (HCB) et de l’Agence nationale de sécurité sanitaire de l’alimentation, de l’environnement et du travail (ANSES)
En France, depuis la loi du 25 juin 2008, c’est le Haut Conseil des biotechnologies (HCB) qui évalue les risques sanitaires et environnementaux liés à la dissémination volontaire d’OGM, donc de la culture d’OGM. Les risques liés aux aliments contenant des OGM sont examinés par l’Agence nationale de sécurité sanitaire de l’alimentation, de l’environnement et du travail (ANSES).
Lors de sa participation à l’audition publique de l’OPECST du 27 octobre 2016, la question du statut juridique des nouvelles techniques de sélection végétale a été abordée. Mme Estelle Brosset, professeure en droit public à l’université d’Aix-Marseille, avait dressé le constat que coexistent plusieurs « possibilités d’interprétation sur chacun des éléments de la définition, possiblement hétérogènes et donc, insusceptibles de déboucher sur une réponse univoque, soit sur un constat de qualification des NBT comme OGM ou non » (149).
Pour M. José Bové, député européen, les NBT sont des « OGM cachés », qui augmenteront le risque de procédure. En Allemagne, les rapporteurs ont pris connaissance d’une déclaration en mars 2016 d’une quinzaine d’ONG écologistes concluant que « les organismes dérivés des nouvelles techniques doivent être soumis aux mêmes règles que les autres OGM » (150).
La position française se résume par une démission sur ce dossier des nouvelles biotechnologies vertes. Il ne pourrait en être autrement puisque deux gouvernements appartenant à deux majorités différentes se sont mobilisés pour activer la clause de sauvegarde et pour demander à Bruxelles de pouvoir interdire toute culture sur son propre territoire. L’hypocrisie est la même au niveau national et européen puisque les gouvernements affirment que notre agriculture doit accéder à des marchés qui leur sont fermés, mais qu’elles interdisent la culture de plantes génétiquement modifiées pour des raisons dites sanitaires. Il s’agit en fait d’endormir l’opinion publique, alors qu’un débat fondateur sur les biotechnologies devrait être organisé. Les rapporteurs rejoignent la demande des opposants aux OGM, à condition bien sûr que celui-ci puisse se tenir dans des conditions sereines, à l’inverse des récents débats publics organisés par le Commission nationale du débat public (CNDP) sur la gestion des déchets radioactifs et sur les nanotechnologies. Dans le même temps, on autorise les importations pour ne pas fâcher nos partenaires commerciaux.
Le comité économique, éthique et social (CEES) du Haut Conseil des biotechnologies (HCB) a publié des recommandations le 20 janvier 2016, dans lesquelles figure une classification des technologies mises au point postérieurement à la publication de la directive de 2001. Celle-ci a été proposée conjointement par plusieurs organisations (151).
CLASSIFICATION DES NOUVELLES TECHNIQUES
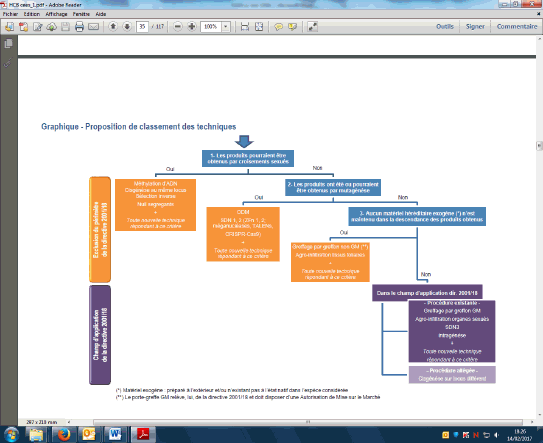
Source : Haut Conseil des biotechnologies (HCB).
Cet organigramme se base sur l’annexe I de la directive n° 2001/18 pour distinguer trois cas de figure. Le premier, qui concerne les produits qui pourraient être obtenus par croisements sexués, correspond aux « méthodes de sélections traditionnelles » de l’annexe I B2, et donc sont exemptées des dispositions de la directive. Le deuxième sur les produits qui ont été ou pourraient être obtenus par mutagenèse, correspond à l’annexe I B, également exemptée ; les techniques de modification ciblée du génome (genome editing) de catégories SDN1 et SDN2 (sans apport de matériel héréditaire exogène) sont ainsi considérées comme de la mutagenèse ciblée. Le troisième sur l’absence ou non de matériel exogène héréditaire, y compris les techniques de modification ciblée du génome de catégorie SDN3, correspond à l’annexe I A1 en cas de réponse négative, et donc entre dans le champ d’application de la directive (ce sont des OGM).
Dans le contexte des nouvelles techniques de sélection végétale, le Conseil d’État pose à la Cour de justice de l’Union européenne (CJCE) la question de le la validité de la directive au regard du principe de précaution sur le modèle de la théorie du « changement de circonstances » telle que pratiquée en droit interne (Conseil d’État et Conseil constitutionnel) ou en droit international avec la clausula « rebus sic stantibus » (« les choses restant en l’état ») reconnue par l’article 62 de la convention de Vienne.
En conclusion, les rapporteurs rappellent que les techniques traditionnelles de mutagenèse, chimique ou par radiation, sont expressément exemptées de l’application de la directive n° 2001/18. Ce point de droit ne devrait pas faire l’objet de contestation. Ils notent que les nouvelles méthodes de modification ciblée du génome (genome editing), qualifiées de « mutagenèse dirigée », sont beaucoup plus précises, présentent moins de risques que la mutagenèse chimique ou obtenue par radiation, avec mutations aléatoires, telle que pratiquée depuis les années 1920. Les rapporteurs ont constaté, dans leurs auditions dans le monde entier, qu’il y a aujourd’hui un large consensus pour affirmer (152) qu’après une phase d’apprentissage depuis la découverte de CRISPR-Cas9 en 2012, les effets hors cible de ces techniques sont maintenant moins nombreux que les mutations qui se produisent naturellement. On a vu également que les mutations induites par les techniques de modification ciblée du génome peuvent se produire naturellement à de faibles fréquences, de par la variabilité naturelle de tout organisme vivant, et qu’elles sont quasiment indétectables.
Les rapporteurs rappellent que l’appréciation du principe de précaution repose sur l’évaluation complète du risque fondée sur les données scientifiques les plus fiables et les résultats les plus récents de la recherche internationale aboutissant à une incertitude sur l’existence ou la portée de ce risque. Leurs interlocuteurs ont tous conclu en indiquant que les risques des technologies de modification ciblée du génome sont infiniment moindres que ceux provoqués par des techniques de mutagenèse ou de transgenèse. Les rapporteurs estiment que le principe de précaution ne devrait pas faire obstacle à ce que les techniques de mutagenèse dirigée soient considérées différemment des techniques de mutagenèse chimique ou par radiation. Toute décision contraire aboutirait à exempter des techniques rudimentaires, au motif qu’elles seraient plus anciennes, alors qu’on règlementerait des techniques plus récentes, mais beaucoup plus sûres. Elle aboutirait à exempter des techniques qui présentent un niveau de sécurité supérieur à celui des techniques traditionnelles de mutagenèse.
Les rapporteurs remarquent qu’historiquement, le marché des nouvelles variétés végétales, obtenues par sélection traditionnelle, n’a jamais nécessité d’étude systématique, il s’est régulé de lui-même. Ce mécanisme a bien fonctionné et les problèmes rencontrés ont été rarissimes. Donc, ce mécanisme devrait être applicable aux nouvelles techniques de sélection, car les modifications sont effectuées de façon ciblée. L’expérimentateur connaît la modification qui a été apportée. Les méthodes de mutagenèse chimique ont consisté en une sélection de mutations effectuées au hasard, et n’ont jamais été règlementées. Les nouvelles techniques de sélection permettent des modifications beaucoup plus ciblées. Il serait illogique de préconiser plus de réglementations pour des technologies ciblées où les modifications du génome sont parfaitement connues que pour des techniques aléatoires utilisées depuis 80 ans sans impact en matière sanitaire. En matière d’alimentation, la régulation s’est faite par vigilance permanente qui permis à l’homme d’éliminer les plantes toxiques de son régime alimentaire ou de les cuire pour dénaturer les composés toxiques, comme pour la pomme de terre.
En l’état des dispositions de la directive n° 2001/18, et tant que les États membres n’auront pas décider de la modifier, il semble, aux yeux des rapporteurs, que les techniques de mutagenèse dirigée (notamment la modification ciblée du génome) ne comportant pas de matériel génétique héréditaire exogène relèvent de l’annexe IB, au même titre que les techniques de mutagenèse chimique ou par radiation, et qu’elles doivent être exemptées des règles relatives aux OGM.
Il est urgent que la Commission européenne prenne ses responsabilités et donne maintenant un statut juridique aux plantes issues des nouvelles biotechnologies, afin que la recherche publique et les sélectionneurs privés puissent travailler à égalité avec les pays les plus dynamiques.
Recommandation n° 12 : C’est le politique qui doit trancher sur les risques d’une technologie
– Estime qu’il incombe à la Commission européenne et aux États membres de prendre ses responsabilités sur la qualification juridique des nouvelles techniques, et non à la Cour de justice de l’Union européenne (CJUE), dont le rôle doit se limiter au respect du droit dans l’interprétation et l’application des traités ; émet le vœu que le Parlement européen et les États membres se saisissent de cette question ;
– Considère que les produits qui pourraient être obtenus par croisements sexués et les produits qui ont été ou pourraient être obtenus par mutagenèse traditionnelle ou dirigée (notamment par modification ciblée du génome) sans matériel génétique héréditaire exogène ne sont pas des OGM au sens de la directive n° 2001/18 du 12 mars 2001 relative à la dissémination volontaire d’OGM dans l’environnement (schéma ci-joint) ;
– Estime qu’en cas de blocage institutionnel persistant sur cette question, il conviendrait de repenser la législation européenne pour qu’elle puisse s’adapter aux nouvelles technologies, en évaluant les produits et non les procédés ;
– Propose que l’évaluation de la sécurité par l’Agence européenne de sécurité des aliments (EFSA), en lien avec le Haut Conseil des biotechnologies (HCB) et l’Agence nationale de sécurité sanitaire de l’alimentation, de l’environnement et du travail (ANSES), tienne compte des risques encourus par la technologie utilisée.
d. La qualification des nouvelles biotechnologies dans les autres pays
La qualification juridique des nouvelles techniques fait l’objet de débats intenses dans tous les pays, avec une tendance certaine à ne pas les considérer comme des OGM.
• Royaume-Uni
Mme Ottoline Leyser, Professeur en science des plantes, laboratoire Sainsbury, université de Cambridge, a l’ambivalence de la distinction entre le naturel et le non naturel. Certains veulent rejeter ce qui n’est pas naturel, alors que depuis des siècles l’homme a façonné la nature par ses activités agricoles. « Le fruit est une récompense que donne la plante à celui qui la consomme en contrepartie de la semence. Les graines ingérées par les animaux sont rejetées après digestion avec de l’engrais pour qu’elles se développent. La plante ne cherche pas à faire plaisir aux espèces qui la consomment et à leur permettre d’être en bonne santé, mais à répandre ses semences. Tout ce qu’a fait l’homme depuis 10 000 ans a été de réduire la toxicité des plantes qu’il mange. Le débat doit un peu s’éloigner de cette dichotomie nature – non naturel. Il faudrait plutôt s’intéresser à la notion de « durable ». La modification génétique par les nouvelles biotechnologies n’est pas éloignée de ce qui s’est passé depuis 8 000 ou 10 000 ans. Avec la modification ciblée du génome, on peut mieux comprendre ces modifications. On fait délibérément ce que la nature fait depuis longtemps. Les modifications conventionnelles par mutation présentent plus d’effet hors cible que la modification ciblée du génome.
M. Robin Lovell-Badge, Professeur, laboratoire de biologie des cellules souches et de développement génétique au Francis Crick Institute, estime « que la question de savoir s’il s’agit des "OGM cachés" est délicate à évaluer, si on apporte un petit changement dans le génome d’une plante ou d’un animal, peut prendre des générations pour être observé ». Il ne pense pas que la modification ciblée du génome devrait être appelée modification génétique, car il n’y a pas d’introduction d’un ADN étranger. « Cela se passe déjà dans la nature, par mutation due à des radiations ou pour d’autres causes. Beaucoup des végétaux que nous mangeons portent des mutations naturelles et l’homme a utilisé la mutagenèse pour sélectionner des plantes ou végétaux qui sont particulièrement adaptés ». Il conclut en affirmant que « les modifications spontanées du génome ou le « genome editing » apportent le même résultat final ».
• Suisse
La Suisse est le pays du siège d’une des trois grandes multinationales des biotechnologies appliquées à l’agriculture : Syngenta. La constitution Suisse stipule qu’il faut respecter l’« intégrité des organismes vivants », ce qui confère, en Suisse, aux biotechnologies vertes un dimension éthique.
Pour Mme Patricia Ahl Goy, de l’équipe de réglementation des semences, dans la société Syngenta, les nouvelles techniques de sélection végétales (NBT – new breeding techniques) se situent entre la sélection traditionnelle et les OGM transgéniques. « L’évaluation en Europe du risque devra se faire sur le produit et non sur la technologie. Il faut que cette évaluation soit proportionnelle au risque potentiel. Les NBT ne doivent pas induire les mêmes études que les OGM. Toutes les NBT sont différentes, il n’est pas possible de donner une réponse générale, cela dépend de la culture et du type de gène. Certaines nouvelles techniques de sélection sont l’objet de l’introduction d’un nouveau gène, une évaluation de type OGM s’avère alors nécessaire, mais elles devraient être moins coûteuse. Certaines nouvelles techniques de sélection font l’objet d’un échange de nucléotides, que l’on aurait pu obtenir dans la nature. Les dossiers d’homologation doivent, à son avis, tenir compte du type de modification, du type de culture, du type de gêne modifié ou inséré, car dans certains cas, il n’y a aucune différence avec les produits issus de méthodes sélectives traditionnelles.
En Suisse, la Commission fédérale d’éthique pour la biotechnologie dans le domaine non humain a publié en mars 2016 un communiqué intitulé « Nouvelles techniques de sélection végétale : réflexions éthiques », s’interrogeant pour savoir s’il s’agissait de procédés de génie génétique (153). La commission estime que l’évaluation des nouvelles techniques de sélection végétale doit porter sur les techniques et leurs produits. Pour elle, restreindre cette évaluation au seul produit, comme certains le demandent dans le débat actuel, ne permettrait pas une évaluation adéquate. La grande majorité de la commission craint que la vitesse croissante avec laquelle des plantes d’un nouveau type se retrouvent dans l’environnement augmente la probabilité que des dommages surviennent. L’article 120 de la constitution suisse dispose qu’il faut respecter l’« intégrité des organismes vivants » ; la version allemande de cet article de la constitution évoque la « dignité de la créature » (der Würde der Kreatur).
Ce n’est pas l’avis de l’Académie suisse des sciences a réalisé en 2016 une fiche d’information sur « Les nouvelles techniques de sélection végétale pour l’agriculture suisse – gros potentiel, avenir ouvert » (154).
Pour l’Académie, des nouvelles techniques permettent de modifier très précisément le patrimoine génétique des plantes. Dans la plupart des cas, ces modifications pourraient aussi se produire dans des conditions naturelles et aucun ADN étranger ne subsiste dans la plante. Ces techniques élargissent de manière déterminante les possibilités de sélection végétale et facilitent ainsi le chemin vers une agriculture suisse plus respectueuse de l’environnement, plus économique et, finalement, plus durable. Sachant que des premières variétés résultant de ces techniques innovantes existent d’ores et déjà, et que de nouvelles vont suivre sous peu, il est indispensable de clarifier la réglementation pour savoir si les plantes produites à l’aide de ces nouvelles techniques de sélection sont réglementées ou pas par la loi sur le génie génétique. Pour l’académie suisse, du point de vue des sciences naturelles, aucune raison ne justifie d’instaurer une réglementation sévère des plantes sélectionnées en utilisant ces méthodes.
L’académie suisse mentionne les avantages de ces nouvelles techniques, leur précision et vitesse d’action pour modifier le patrimoine génétique des plantes. Son argumentation s’organise en deux points, le premier relatif au défi de produire plus avec moins avec des nouvelles techniques présentées comme innovantes, et le second sur la sécurité et les bases légales. Il y a donc débat sur ce sujet en Suisse.
e. Le positionnement d’autres pays qui utilisent les nouvelles biotechnologies
• Aux États-Unis, le pragmatisme prévaut
On peut remarquer une évolution récente aux États-Unis. Sous la pression croissante des consommateurs, plusieurs projets de loi sont en discussion aux États-Unis sur l’étiquetage des produits OGM (26 États sur 50 à ce jour). La plupart de ces débats n’ont pas abouti.
Dans certains États, un référendum a été organisé. À la suite d’une campagne de presse du syndicat des industries agroalimentaires (Grocery Manufacturers Association – GMA), un projet de loi portant étiquetage des OGM n’a pas été adopté en Californie. Un projet de loi similaire a été adopté dans le Vermont en 2014 ; sa mise en œuvre prévue en 2016 a été reportée en juillet 2017.
Certaines entreprises américaines (Campbell Soup, Mars, Kellogg’s…) ont fait le choix d’étiqueter volontairement l’ensemble de leurs produits, un étiquetage spécifique pour les produits commercialisés au Vermont n’étant pas économiquement rentable. D’autres entreprises se lancent dans la reformulation de leurs produits afin d’exclure les OGM (notamment dans les secteurs du sucre et du lait).
Il est dès lors question d’adopter une législation au niveau de l’union, annulant de ce fait les initiatives des États.
Le sénateur Pat Roberts, président de la commission de l’agriculture du Sénat, a déposé une proposition de loi sur l’étiquetage volontaire de la présence d’OGM dans les aliments. Elle a été rejetée en séance plénière en mars 2016. Une proposition de loi similaire, à la suite d’une initiative du représentant Mike Pompeo, a été adoptée en juillet 2015 à la Chambre des Représentants. Il reste bien sûr à aboutir à un accord entre les deux chambres.
M. Ralph Cicerone, alors président de l’Académie nationale des sciences (américaine) estimait devant les rapporteurs qu’on ne sait toujours pas si l’étiquetage des OGM sera mis en place aux États-Unis. Il y a une nouvelle force sur le marché agroalimentaire, celle des fabricants de produits dit « complétement purs et naturels », dont le prix est majoré. L’étiquetage les aide dans leur publicité. Un produit OGM ne peut être étiqueté comme issu de l’agriculture biologique, même si l’agriculteur n’utilise pas de pesticide.
Dans les négociations relatives au projet de partenariat transatlantique de commerce et d’investissement (TTIP), la Commission européenne a pour mandat des États membres de ne rien accepter sur le bœuf aux hormones, sur les OGM ou sur le clonage. Il est cependant à noter qu’en 2015, en pleine négociation du TTIP, la Commission européenne a autorisé la mise sur le marché de 17 variétés nouvelles d’OGM, ce qui est considéré comme un geste à l’égard des États-Unis, sous la présidence Obama… Le gouvernement américain, de son côté, essayait, il y a quelques mois, d’introduire dans l’accord TTIP un article sur « les nouvelles technologies de l’agriculture moderne ».
Les États-Unis n’ont pas de législation fédérale spécifique aux organismes génétiquement modifiés (OGM) (155). Les OGM sont régis par la législation générale sur la santé, la sécurité et l’environnement relative aux produits conventionnels.
Les États-Unis assimilent la réglementation des nouvelles biotechnologies à celle des OGM, très souple.
Les OGM sont réglementés aux États-Unis en vertu du Cadre coordonné pour la réglementation de la biotechnologie (Coordinated Framework for Regulation of Biotechnology), publié en 1986, conformément aux dispositions législatives qui régissait précédemment les produits conventionnels, en mettant l’accent sur la nature des produits plutôt que sur le processus avec lequel ils sont produits.
Les plantes génétiquement modifiées sont réglementés par le service d’inspection sanitaire et phytosanitaire (APHIS) du ministère de l’agriculture des États-Unis (US Department of Agriculture – USDA), en vertu de la loi sur la protection des végétaux. Les OGM dans les aliments, les médicaments et les produits biologiques sont réglementés par la Food and Drug Administration (FDA) en vertu de la loi fédérale sur les aliments, drogues et cosmétiques et la loi sur les services de santé publique. Les pesticides et microorganismes OGM sont réglementés par l’Agence de protection de l’environnement (Environmental Protection Agency – EPA) en vertu de la loi sur les insecticides, les fongicides et les rodenticides (rongeur) et la loi sur le contrôle des substances toxiques. La forme de la réglementation varie en fonction du type d’OGM concerné.
En cas de doute pour savoir à quelle agence il incombe d’évaluer un sujet, les trois agences se réunissent afin de trancher, l’une étant déclarée compétente à titre principal. La FDA et l’USDA régulent les produits alimentaires. L’USDA n’a que très peu de pouvoir. Il ne régule que trois types de produits : la viande, la volaille entière, et les œufs transformés. La FDA régule tout le reste. C’est un système absurde dans lequel l’agence est responsable en fonction, par exemple, de celui qui découpe la volaille à mettre sur le marché ; si cela se passe dans l’exploitation agricole, c’est l’USDA, si cela se passe dans le circuit de distribution, c’est la FDA...
L’APHIS réglemente la plantation, l’importation et le transport des végétaux génétiquement modifiés en vertu de la loi sur la protection des végétaux, qui autorise l’USDA à « interdire ou restreindre l’importation, l’entrée, le commerce de toute plante, produit végétal (etc.) si le ministre de l’agriculture détermine qu’il est nécessaire d’empêcher l’introduction d’un organisme nuisible ou d’une mauvaise herbe nuisible aux États-Unis ». L’APHIS classe la plupart des végétaux génétiquement modifiés comme des organismes nuisibles ou potentiellement nuisibles et comme des « articles réglementés ». L’approbation préalable de l’APHIS est nécessaire avant son introduction.
La FDA réglemente la sécurité de tous les produits destinés à l’alimentation humains et animale aux États-Unis (autres que la viande, la volaille et les œufs), ainsi que les médicaments et thérapies géniques. Les substances ajoutées aux aliments peuvent être classées soit comme des « additifs alimentaires », qui nécessitent l’approbation de la FDA comme étant sûres avant leur commercialisation, et les substances ajoutées à des aliments classés « généralement reconnus comme sûrs » (GRAS), pour lesquelles l’approbation préalable n’est pas nécessaire. Dans une déclaration de politique de 1992, la FDA a réaffirmé que, dans la plupart des cas, elle traiterait des aliments dérivés d’OGM comme ceux dérivés de plantes classées de manière conventionnelle et que la plupart des aliments dérivés de plantes GM seraient présumés « GRAS ». Toutefois, en ce qui concerne un produit OGM « qui diffère significativement de structure, de fonction ou de composition par rapport à des substances actuellement présentes dans les denrées alimentaires », l’approbation préalable à la commercialisation de la substance en tant qu’additif alimentaire est requise.
L’EPA a établi que les micro-organismes OGM sont des substances chimiques soumises à la réglementation de la loi de contrôle des substances toxiques.
Malgré plusieurs tentatives tant au niveau fédéral qu’étatique, il n’existe aucune loi aux États-Unis exigeant que les aliments génétiquement modifiés ou les aliments contenant des ingrédients d’OGM soient étiquetés de manière à l’indiquer.
M. Mark Petry, directeur adjoint au ministère de l’agriculture américain (USDA), Foreign Agriculture Service (FAS), rappelle qu’à chaque changement dans l’application de la loi, l’obligation d’impliquer le public doit être respectée. Dans le cas de sujets sensibles, de nombreuses réunions publiques seront organisées, et des documents à visée informative seront publiés. Légiférer sur ces technologies paraît néanmoins complexe, car celles-ci sont en constante évolution. Ainsi, l’accent est mis sur les produits finaux qui nous sont présentés. Il est souhaitable de ne réglementer que ce qui représente un risque pour la santé des animaux et des plantes.
Pour M. Petry, parfois, « il est difficile, voire impossible, de faire la différence entre un produit qui a été génétiquement modifié et un produit qui ne l’a pas été. L’ingénierie génétique permet de diminuer le temps de mise au point du produit. Ce gain de temps est précieux car nous risquons de faire face dans le monde entier à d’avantage de maladies et de ravageurs, donc nous devons accélérer notre temps de réaction ». Ainsi, les administrations américaines étudient la possibilité de ne pas réglementer de tels produits. En ce qui concerne la modification ciblée du génome, les agences américaines réglementent les produits et non pas les techniques (CRISPR…). La législation américaine s’appuie sur l’intention. Si le produit est fait pour lutter contre les ravageurs, si le produit est modifié pour résister aux pesticides, alors il sera considéré comme un pesticide.
Mme Jennifer Doudna, Professeur à l’université de Californie-Berkeley, estime qu’il est intéressant de voir les différentes définitions apportées par les pays aux organismes génétiquement modifiés (OGM). À son avis, « s’il y a des modifications apportées à une plante sans introduction d’éléments étrangers, ce n’est pas un OGM ». En cas d’apport d’ADN étranger cela dépend : si l’on présente de l’ADN d’un poisson et on l’injecte dans une plante, ce n’est pas la même chose que s’il s’agit de l’ADN de la même plante. Un tel croisement pourra être fait naturellement, mais sera plus lent et durera vingt-cinq ans au lieu de cinq semaines que demande la technologie CRISPR-Cas9. Ce qu’il faut retenir de ces auditions, c’est le pragmatisme des positions américaines qui ont mis en place un processus d’analyse des risques qui s’appuie sur les faits scientifiques, l’implication du public, l’analyse du produit final et non celle de la technique.
Les rapporteurs pensent que la réglementation doit prendre en compte la précision de la technologie et comparer celle-ci dans l’analyse des risques avec les technologies antérieures.
• Au Brésil, la définition des OGM se fonde sur l’insertion d’un gène étranger
La CTNBio (Commission technique nationale de biosécurité) a récemment créé deux groupes de travail sur la modification ciblée du génome (genome editing), l’un sur le secteur végétal et l’autre sur l’humain et l’animal.
Le rapport définitif sera publié après une consultation publique d’une durée d’un mois. Enfin, CTNBio rédigera une proposition de loi qui sera transmise aux pouvoirs publics.
Pour M. Alexandre Nepomuceno, chercheur de l’Embrapa (Entreprise brésilienne de recherche agricole) et spécialiste du CTNBio, la loi sur la biosécurité de 2005 est aujourd’hui dépassée. Ces nouvelles biotechnologies vertes ont très récentes, mais « la loi a laissé une ouverture ». Elle évoque les mutations transgéniques, avec transfert de gène d’un organisme à l’autre. Les plantes issues de la mutagenèse ne sont pas règlementées par la loi de 2005.
La tendance au Brésil sera de suivre les positions prises par l’Argentine ou les États-Unis. Si une simple mutation, qui aurait pu se produire de manière naturelle ou par mutagenèse à la suite d’une irradiation, elle ne sera pas considérée comme OGM. La position personnelle de M. Nepomuceno est « qu’une plante n’est pas considérée comme OGM s’il n’y a pas eu insertion d’un gène étranger ».
M. Luiz Antonio Gonçalves Rodrigues de Souza, ingénieur agronome, fonctionnaire au ministère de l’agriculture brésilien, rappelle que l’article 36 de la loi sur la biosécurité définit ce qu’est un OGM, « il s’agit de toute modification d’ADN par toute technique ». Cette définition est très différente de la définition européenne ou américaine qui limite les OGM à des transferts de gènes d’une espèce à une autre. Beaucoup d’experts ont déjà estimé que cette loi couvre les nouvelles générations de techniques, mais il n’y a pas de consensus sur cette question au Brésil et il attend de connaître les propositions du groupe de travail du CNTBio pour savoir s’il faut ou non modifier la loi.
Mme Eliane Key, directrice exécutive d’Agrobio, expose la position de cette association qui représente des entreprises de biotechnologies dans l’agriculture et l’agro-industrie. Elle affirme qu’« à son avis il faudrait modifier cette législation ». La majorité des techniques NBTs ne devraient pas relever de la loi de 2005 sur la biosécurité. En effet, ce sont des techniques d’amélioration génétique et non des OGM. Pour Agrobio, la loi de 2005 sur la biosécurité est dépassée.
f. La saisine de la Cour de justice de l’Union européenne (CJUE) : une nouvelle démission des responsables politiques
Par ailleurs, neuf organisations françaises (Les Amis de la Terre France, Collectif vigilance OGM et Pesticides 16, Confédération paysanne, CSFV 49, Fédération nature et progrès, OGM Dangers, Réseau semences paysannes, Vigilance OG2M, Vigilance OGM 33) avaient déposé un recours devant le Conseil d’État en décembre 2014 tendant à contester l’article D 531-2 du code de l’environnement, qui transpose la directive n° 2001/18 sur l’exemption des organismes obtenus par mutagenèse. Comme on l’a dit, le Conseil d’État a déposé, le 3 octobre 2016, un renvoi préjudiciel devant la Cour de justice de l’Union européenne (CJUE), par lequel il pose quatre questions (156) :
1° Les organismes obtenus par mutagenèse (en particulier ceux obtenus par les techniques nouvelles de mutagenèse dirigée telles que, par exemple, la mutagenèse dirigée par oligonucléotide (ODM), ou la mutagenèse par nucléase dirigée (SDN1), qui utilise différents types de protéines (nucléases à doigts de zinc, TALEN, CRISPR-Cas9…) constituent-ils des OGM au sens de la directive n° 2001/18 ? Ou, faut-il au contraire considérer que ces organismes obtenus par mutagenèse, ou seulement certains d’entre eux (ceux obtenus par les méthodes conventionnelles de mutagenèse existant avant à l’adoption de la directive) sont exemptés des mesures de précaution, d’évaluation des incidences et de traçabilité prévus par cette directive ?
2° Les variétés obtenues par mutagenèse constituent-elles des « variétés génétiquement modifiées » soumises aux règles posées par la directive n° 2002/53 du 13 juin 2002 ou sont-elles exemptées des obligations prévues par cette directive pour l’inscription de variétés génétiquement modifiées au catalogue commun des espèces de plantes agricoles ?
3° Si la directive n° 2001/18 exclut de son champ d’application les organismes obtenus par mutagenèse, cela signifie-t-il que les États membres ont l’interdiction de soumettre ces organismes obtenus par mutagenèse à tout ou partie des obligations prévues par la directive ou à tout autre obligation ou disposent-ils, au contraire, d’une marge d’appréciation pour définir le régime susceptible d’être appliqué aux organismes obtenus par mutagenèse ?
4° Si la directive n° 2001/18 exempte les organismes obtenus par mutagenèse des mesures de précaution, d’évaluation des incidences et de traçabilité, sa validité au regard du principe de précaution (garanti par l’article 191-2 du traité sur le fonctionnement de l’Union européenne) peut-elle être remise en cause ? Et faut-il tenir compte, à cet égard, de l’évolution des procédés de génie génétique, de l’apparition de variétés de plantes obtenues grâce à ces techniques et des incertitudes scientifiques actuelles sur leurs incidences et sur les risques potentiels en résultant pour l’environnement et la santé humaine et animale ?
Les rapporteurs constatent qu’il s’agit là d’une nouvelle démission des responsables politiques français et européens, car ils laisser juger en droit la qualification de l’utilisation d’une technologie qui n’était pas inventée lors de la promulgation de la directive 2001/18 ou lors du vote de la loi française sur les organismes génétiquement modifiés de 2008.
Les points de droit qui indiquent que les techniques de mutagenèse chimique ou physique ne sont exemptées de l’application des dispositions de la directive 2001/18 ne font pas l’objet de contestation. Il aurait donc été important que le Gouvernement français donne sa position sur ce sujet avant de laisser le Conseil d’État dire le droit, comme il aurait été utile que la Commission n’enterre pas le travail rendu par l’EFSA, à qui elle a demandé de suspendre l’évaluation des produits issus des nouvelles biotechnologies vertes, en attendant la décision de la Cour de justice de l’Union européenne. Cette « patate chaude » des biotechnologies vertes a été transmise à une instance qui précisément aurait souhaité connaître l’avis des scientifiques avant de dire le droit. Il aurait été plus responsable que les États membres et la Commission prennent au préalable leurs responsabilités en proposant un statut pour les organismes modifiés avec les nouvelles biotechnologies vertes, s’appuyant sur les connaissances scientifiques.
Dans la première question préjudicielle, le Conseil d’État demande en substance si tous les organismes issus de mutagenèse sont exclus du champ d’application de la directive n° 2001/18 ou seuls les organismes issus d’une mutagenèse aléatoire (et résultant de mutations spontanées). L’Union français des semenciers (UFS) considère qu’au vu du texte de la directive et de son interprétation historique et systématique, le concept de « mutagenèse » visé à l’annexe IB de la directive inclut la mutagenèse ciblée et que cette dernière doit être exclue du champ d’application de la directive relative aux OGM. Au contraire, l’association Inf’OGM, soutenue par les députés et sénateurs Verts des parlements français et européen, considère que, depuis l’apparition des nouvelles techniques de sélection végétales, avec CRISPR-Cas9 et les mutagenèses dirigées par oligonucléotide, les organismes issus de la mutagenèse sont mal définis et devraient entrer a posteriori dans le champ d’application de la directive n° 2001/18, puisqu’elles n’existaient pas à son entrée en vigueur.
Dans la seconde question préjudicielle, le Conseil d’État a posé la même question, mais au regard de la directive européenne relative au catalogue commun. L’UFS considère que cette directive emploie la même définition et le même concept d’OGM que la directive n° 2001/18 relative aux OGM (par exemple la même définition de référence complétée par les exemptions prévues aux annexes). Ceci fait que les organismes résultant de quelque forme de mutagenèse que ce soit ne constituent pas des OGM et, par conséquent, ne sont pas soumis aux exigences spécifiques qui y sont relatives, mais uniquement aux exigences générales concernant les semences en vertu de la directive relative au catalogue commun. À l’inverse, Inf’OGM considère que la définition des OGM dans la directive relative au catalogue renvoie à l’article de la directive n° 2001/18 définissant un OGM sans renvoyer également à son article qui exclut du champ d’application de cette dernière, notamment, les organismes obtenus par mutagenèse. Les organismes issus de la mutagenèse devraient donc être soumis aux exigences spécifiques prévus pour les OGM dans la directive relative au catalogue, selon l’association.
Dans la troisième question préjudicielle, le Conseil d’État a demandé si les États ont une marge de manœuvre pour soumettre les organismes obtenus par mutagenèse à tout ou partie des obligations prévues par la directive ou à toute autre obligation. L’UFS considère que les États membres n’ont aucune marge de manœuvre, puisqu’il s’agit d’une mesure d’harmonisation complète, qui leur interdirait de soumettre des organismes obtenus par mutagenèse aux dispositions de la directive n° 2001/18 relative aux OGM. Inf’OGM, comme les neuf organisations requérantes, estime que les États membres devraient disposer de cette marge de manœuvre pour, éventuellement, appliquer des mesures de précaution aux organismes issus de la mutagenèse.
Dans sa quatrième question préjudicielle, le Conseil d’État, s’est interrogé sur la compatibilité de la directive n° 2001/18 avec le principe de précaution, du fait en particulier qu’elle exempte les « nouveaux » organismes et les variétés obtenues grâce à de nouvelles techniques de mutagenèse du champ d’application de la directive relative aux OGM. L’UFS considère que le principe de précaution ayant été pris en compte dans l’élaboration de la directive n° 2001/18, le simple fait de l’existence de progrès technologiques (sous la forme de nouvelles techniques de mutagenèse) ne justifie pas une révision des dispositions d’exemption de la directive relative aux OGM, ceci certainement en l’absence de toute identification de changements ou de présence d’effets indésirables qui résulteraient de l’utilisation de ces techniques améliorées. Inf’OGM considère à l’opposé que l’argument d’ancienneté valable pour les organismes issus des anciennes techniques de mutagenèse ne peut s’appliquer aux nouvelles, en raison du principe de précaution.
Trois principes spécifiques guident, au niveau européen, le recours au principe de précaution : une évaluation scientifique aussi complète que possible, et la détermination, dans la mesure du possible, du degré d’incertitude scientifique ; une évaluation du risque et des conséquences potentielles de l’absence d’action ; la participation de toutes les parties intéressées à l’étude de mesures de précaution.
À cette dernière question de la validité de la directive n° 2001/18 au regard du principe de précaution, Mme Estelle Brosset, consultée par les rapporteurs, estime qu’au plan général, cette validité ne fait guère de doute. Depuis 1992, le principe a été inséré à l’article 191-2 du traité sur le fonctionnement de l’Union européenne, qui prévoit que « la politique de l’Union dans le domaine de l’environnement […] est fondée sur les principes de précaution ». Dans le domaine des OGM, le principe de précaution a été pris en compte dès la directive n° 90/220, où ont été adoptées des mesures appropriées afin de prévenir certains risques potentiels pour la santé publique, la sécurité et l’environnement « sans […] que la réalité et la gravité de ces risques soient pleinement démontrés ». La CJCE elle-même l’a déjà admis, puisque lorsque, interrogée par le Conseil d’État à propos de la directive n° 2001/18, elle a expliqué que le principe de précaution trouvait dans le système de la directive « une expression suffisante » (157). Dans la directive n° 2001/18, le principe est cité expressément. Dans le considérant 8, il est rappelé qu’« il en a été tenu compte […] lors de la rédaction de la présente directive et il devra en être tenu compte lors de sa mise en œuvre ». Une telle référence figure même dans les premiers mots de l’article 1er de la directive : « Conformément au principe de précaution, la présente directive vise à rapprocher les dispositions législatives, réglementaires et administratives des États membres et à protéger la santé humaine et l’environnement […] ».
4. Les enjeux économiques dans un contexte de concurrence internationale
Les nouvelles techniques de sélection végétales représentent, en termes de recherche, d’investissements, d’activité économique, d’exportations et d’emploi, un enjeu économique important pour le secteur semencier français et européen. Dans un marché globalisé, la tentation des délocalisations hors d’Europe, pour des raisons réglementaires, est réelle. Le fait de ne pas décider, d’invoquer des arguments spécieux non corroborés par les études sur le terrain constitue un handicap pour les chercheurs et pour les sélectionneurs privés.
a. Le retard de la France et de l’Union européenne
• Le secteur semencier français et européen
Le secteur semencier en France comptait en 2015, 73 entreprises de sélection, 244 entreprises de production, 19 000 agriculteurs multiplicateurs, 23 000 enseignes de détail et 9 000 salariés. Ces acteurs généraient 3,2 milliards d’euros de revenus, dont 1,75 milliards pour l’Union européenne. C’est proportionnellement au regard de l’importance de la France, une activité 5 fois plus faible que celle de la seule firme américaine Monsanto. Cela est bien sûr dû à la méfiance des responsables politiques qui ont sacrifié en France et en Europe, le développement des biotechnologies. La balance commerciale à l’exportation était de 841 millions, et 15 % du chiffre d’affaire du secteur était réinvesti en recherche et développement. Dans l’Union européenne, il s’agit de 10 % de réinvestissement, ce qui correspond à 700 millions d’euros par an.
L’Union européenne est le troisième marché mondial des semences après les États-Unis et la Chine, les deux tiers du marché européen étant concentrés dans cinq États membres (France, Allemagne, Italie, Espagne et Pays-Bas). L’industrie européenne des semences représente plus de 7 000 entreprises, dont une majorité de PME, emploie environ 50 000 personnes, la France étant le premier pays en termes d’emploi. Ces entreprises sont reconnues pour être des moteurs de l’innovation et de la croissance. On peut évaluer, du fait de cette inertie dans le soutien aux biotechnologies, un « manque à créer » de 200 000 emplois perdus en France
M. Eric Devron, directeur général de l’Union française des semenciers (UFS), qui a participé à l’audition publique de l’OPECST du 27 octobre 2016, a précisé aux rapporteurs après l’audition qu’il est très difficile de mesurer les incidences de l’interdiction de fait des OGM en France sur la recherche, sur les investissements et sur l’emploi, dans la mesure ou les stratégies d’entreprises dans ce domaine ne sont pas publiques ou détaillées par régions. Par ailleurs les entreprises se sont adaptées au fil de l’eau et on peut difficilement imaginer ce qu’aurait été le secteur aujourd’hui si le cadre réglementaire et surtout politique avait été différent.
Néanmoins, l’UFS observe la quasi-disparition de travaux de recherche sur les plantes génétiquement modifiées en Europe, quand les investissements se poursuivent dans l’ensemble des grands pays agricoles. Ces technologies sont un outil stratégique de leurs politiques alimentaires. L’UFS constate aussi que les entreprises qui proposent ces technologies n’ont absolument pas modifié leurs stratégies de développement global du fait de l’interdiction des OGM en Europe. Les sociétés plus dépendantes du marché européen, souvent basées en France, ont dû acquérir ces technologies via des licences couteuses pour les marchés qui sont ouverts à la culture des variétés OGM.
S’il est difficile de mesurer les effets à court terme, l’UFS craint néanmoins les conséquences macroéconomiques à plus longue échéance, liées à la moindre maîtrise de technologies. Les entreprises les plus performantes au niveau mondial capteront du fait de leur performance une part croissante de la valeur des semences (évaluées à plus de 80 milliards d’euros). Jean-Michel Gouache, directeur des affaires internationales de Limagrain, disait en audition publique le 8 avril 2016 que « Limagrain créait en moyenne 400 variétés nouvelles chaque année et dépensait 14 % du chiffre d’affaires dans la recherche », n’indiquant pas le coût des licences dont il devait s’acquitter vis-à-vis des détenteurs de brevets, que les rapporteurs estiment à plus de 100 millions d’euros.
Les données économiques du secteur français des semences sont encore aujourd’hui favorables – mais sur une échelle de temps courte –, elles doivent être analysées avec circonspection. Le succès actuel du secteur semencier français est le fruit d’une politique publique volontariste mise en place dans les années 1960 et qui s’est poursuivie jusque la fin des années 1990. Il n’est pas certain qu’il soit en mesure demain de proposer des variétés innovantes et performantes dans un marché globalisé devenant de surcroît plus exigeant. L’UFS ajoute au titre des signaux faibles les difficultés de recrutement dans le secteur de la recherche en biotechnologie et en amélioration des plantes, avec le départ des jeunes chercheurs les mieux formés dans des laboratoires aux États-Unis ou en Asie.
NBT Platform est une association professionnelle de PME, de grandes industries, d’universités et d’instituts de recherche dont le but est de s’exprimer dans le débat européen sur les nouvelles techniques de sélection (New Breeding Techniques – NBT) (158).
Selon l’association, les nouvelles techniques de sélection permettent de produire des variétés similaires aux techniques traditionnelles, mais avec un gain de temps et de précision. Les nouvelles techniques de sélection offrent trois avantages : elles permettent d’augmenter les rendements, de diminuer l’impact environnemental de l’agriculture, et d’améliorer la qualité des produits.
NBT Platform détaille les impacts de ces avantages sur les semenciers, les agriculteurs, les industries agroalimentaires de gros et de détail, le consommateur et la biodiversité. Le gain de rapidité et de précision dans la mise au point des semences permet aux semenciers un gain de compétitivité pour que l’Europe, qui représente 20 % du marché mondial des semences, reste à la pointe de l’innovation. En effet, la moitié des recherches sur les nouvelles techniques de sélection dans le monde sont faites dans l’Union européenne. Ainsi, il est important que les entreprises semencières restent dans l’Union européenne car elles fournissent un effort important de recherche et de développement, en y investissant 10 à 25 % de leurs revenus.
Les nouvelles techniques de sélection bénéficient aussi aux agriculteurs. En effet, elles permettent une plus grande résistance au changement climatique, une diminution du risque de perte et donc une augmentation de la production, avec une diminution des coûts de production qui permet un gain de compétitivité à l’exportation. Du point de vue des industriels de gros et de détail, l’amélioration de la qualité des produits permet d’avoir une plus longue durée de vie des produits à l’étalage, et donc de diminuer le gaspillage alimentaire. Ainsi, cela diminue l’impact environnemental du secteur agroalimentaire et les coûts pour le consommateur. Pour ce dernier, l’amélioration de la qualité des produits se ressent sur le plan sanitaire autant que sensoriel. Enfin, les nouvelles techniques de sélection apportent de nouvelles variétés à la biodiversité, qui auparavant demandaient une trop grande technicité pour les méthodes traditionnelles.
Cependant le cadre juridique dans lequel s’inscrivent les nouvelles techniques de sélection manque de clarté, vis-à-vis du sens de directive n° 2001/18, ce qui ralentit les applications commerciales de ces innovations.
L’interdiction en Europe des nouvelles techniques de sélection, selon la plateforme, créerait une situation injuste par rapport à la concurrence internationale. En effet, les produits obtenus à partir de ces techniques ne peuvent pas, dans la plupart des cas, être distingués des plantes obtenues par des techniques traditionnelles. L’association plaide pour un environnement légal permettant le développement scientifique et commercial des nouvelles techniques de sélection.
Dès avant l’apparition des nouvelles techniques de sélection des plantes, la situation actuelle en France et en Europe, où les biotechnologies sont mal acceptées socialement, a amené les entreprises concernées à se désengager de ces technologies en Europe. Le groupe coopératif français Limagrain n’y échappe pas.
Les rapporteurs ont rencontré à Sao Paulo M. Emmanuel Aubry, coordinateur de la recherche internationale sur le maïs tropical, Limagrain Brésil. Il leur a précisé que la coopérative française est le premier semencier français et le quatrième mondial avec un chiffre d’affaires de 2,5 milliards d’euros (dont plus de 70 % à l’international) et 2 000 salariés dans la recherche.
Limagrain s’est implanté sur le marché semence maïs en Amérique du Nord dans les années 1980. Le maïs était la principale espèce commercialisée par Limagrain et le marché mondial passait nécessairement par l’Amérique du Nord. Ce choix stratégique était renforcé par le fait que le matériel génétique d’Amérique du Nord est bien adapté à l’Europe. Vers la fin des années 2000, Limagrain, déjà bien implanté en Amérique du Nord, a décidé d’investir sur un autre marché à fort potentiel de croissance : l’Amérique du Sud. Il y emploie aujourd’hui plus de 200 personnes sur quatre pays, dont une centaine pour la recherche.
Limagrain investit beaucoup en R&D. Pour les grandes cultures, l’amélioration végétale se fait sur les zones des cultures concernées. Les équipes de Clermont-Ferrand assurent un soutien centralisé : laboratoire d’analyses moléculaires, bio-statistiques, développement et maintenance de logiciels et de nouveaux outils de recherches… Concernant la recherche impliquant des plantes génétiquement modifiées, des essais en laboratoire et sous serre s’effectuent en Europe ou aux États-Unis : développement de nouveaux produits, test de validation... Les essais aux champs avec des OGM sont par contre exposés à des risques de destructions en France. Ce que Limagrain ne peut faire en France, il le fait sur le continent américain, et le choix des produits génétiquement modifiés qui seront développés commercialement s’effectue aux États-Unis, pour sécuriser la conduite des essais, mais aussi parce que le marché pour ces produits se situe sur le continent américain.
Pour être présent sur le marché, Limagrain doit négocier des licences et payer des royalties auprès des grands groupes semenciers (Monsanto/Bayer, Dow Chemical/DuPont/ Pioneer, Syngenta/ChemChina…) pour avoir accès aux évènements de transformation disponibles à ce jour. D’un autre côté, il investit aussi lui-même lourdement dans la recherche de produits génétiquement modifiés, cet investissement devant contribuer dans le long terme à la compétitivité du groupe et à son indépendance vis-à-vis des sociétés qui maîtriseraient ces techniques, et bien sûr à contribuer à sa pérennité économique.
Limagrain a des programmes de sélections au Brésil pour développer des maïs adaptés au marché local. Ces programmes travaillent notamment à l’amélioration des rendements et des performances agronomiques sous climat tropical. Limagrain utilise aussi les ressources génétiquement modifiées disponibles, sous licence des fournisseurs de traits OGM, pour ajouter à ses variétés issues de sa propre génétique des résistances aux herbicides (glyphosate) et surtout des résistances aux insectes (chenilles).
M. Gérard Lespourci, directeur général de Limagrain Argentine, complète les propos de son collègue en rappelant que, d’un point de vue économique, l’industrie semencière est très forte en France. Si on passe à côté de ces technologies, cela veut dire qu’on continuera à payer des licences aux fournisseurs de biotechnologies vertes. Les Chinois rachètent Syngenta car ils ont un intérêt stratégique à l’accès aux semences (population à nourrir) et s’intéressent aux biotechnologies. Limagrain est un des grands acteurs mondiaux et a déjà cédé à la tentation de délocaliser, la coopérative l’a déjà fait pour la recherche sur les OGM, le Brésil et l’Argentine représentant plus de 23 millions d’hectares de maïs quasiment à 100 % OGM. Pour continuer à se développer, Limagrain doit dans ces pays proposer des plantes OGM.
Les mêmes causes produisent les mêmes effets. En Allemagne, les entreprises biotechnologiques sont également tentées par les délocalisations.
La plupart des Allemands et des Européens sont contre les biotechnologies, même s’il n’existe pas de preuves concrètes de leur dangerosité. BASF et Bayer ont délocalisé à l’étranger leurs secteurs de biotechnologies. Un coup dur pour l’entreprise a été l’annulation de l’autorisation de la commercialisation en Europe de la pomme de terre Amflora (génétiquement modifiée) par la Cour de justice de l’Union européenne (CJUE). À l’avenir, les recherches s’effectueront en Amérique.
BASF est persuadé que les biotechnologies seront une technologie de pointe pour le XXIe siècle. Mais le groupe BASF a abandonné l’espoir d’une percée en Europe des plantes génétiquement modifiées, faute d’adhésion sociale. C’est pourquoi, les activités de recherche effectuées à Limburgerhof, près du siège du groupe à Ludwigshafen, dans le land de Rhénanie-Palatinat, sont abandonnées et se feront aux États-Unis dans la Caroline du Nord à Raleigh.
La filiale CropSciences du groupe Bayer ne va plus poursuivre ses recherches dans le domaine des biotechnologies sur les plantes. Les activités seront concentrées à Gand, en Belgique. À Potsdam, les travaux sur les additifs alimentaires sont complètement arrêtés. Une des raisons invoquées est le manque de soutien politique pour les biotechnologies. Cependant, les biotechnologies sur les plantes restent, pour Bayer, un secteur en plein développement. 130 millions d’euros (20 % du total des recherches pour la protection des plantes), sont dépensées par an pour la recherche des biotechnologies pour les plantes. La filiale CropSciences a annoncé un investissement d’environ 750 millions d’euros, de 2008 à 2012, dans la recherche pour la biotechnologie.
Le groupe suisse Syngenta n’est pas épargné par les délocalisations.
Mme Patricia Ahl Goy, équipe de réglementation des semences, Syngenta, indique que son entreprise dispose d’un laboratoire en Caroline du Nord à Raleigh. Par ailleurs, Syngenta a ouvert un centre de recherche en Chine, près de Pékin. L’entreprise Ciba avait un centre de recherche en Suisse, puis il a été recentralisé aux États-Unis. Le centre de recherche de Ciba était à Bâle, celui de Novartis était à Toulouse. Ce dernier existe toujours, mais travaille maintenant sur la sélection naturelle.
*
* *
L’enjeu des nouvelles technologies de modification ciblée du génome est d’accélérer considérablement le développement des nouvelles espèces quand on connaîtra les gènes d’intérêt. Passer à côté de ces nouvelles biotechnologies vertes exposerait la France et l’Europe au risque concurrentiel en provenance des autres continents, et donc à un affaiblissement de la filière et, partant, de notre agriculture.
Les enjeux économiques sont donc considérables. Les coûts liés à la mise sur le marché et à la régulation globale des OGM sont très importants, entre 120 et 140 millions d’euros par nouvelle variété végétale. Cela est notamment dû aux contraintes réglementaires demandées par les autorités de régulation des États membres et de l’Europe. Ces coûts élevés ne sont amortissables que sur de très grands marchés, ce qui explique que l’offre de produits OGM existe principalement sur des espèces majeures (soja, maïs, blé…) et pour des caractéristiques (traits) agronomiques répondants à des problématiques largement répandues, notamment celles de la résistance aux herbicides. Qualifier d’OGM les nouvelles techniques de sélection végétale conduirait à pérenniser cette situation et paralyserait le développement d’autres variétés comme les fruits ou les légumes, ces derniers étant beaucoup plus consommés en Europe que sur le continent américain. La facilité d’utilisation de la technique est-elle un atout pour les petites entreprises ?
La conviction des rapporteurs est que si la France et l’Europe continuent de tergiverser, les sociétés européennes seront à terme condamnées.
Les rapporteurs pensent que si l’utilisation des nouvelles biotechnologies vertes en matière de sélection végétale venait à relever de la directive n° 2001/18, cela aboutirait à la délocalisation – voire la faillite – de nombreuses entreprises du secteur. Nous sommes à la croisée des chemins : soit l’Europe continue à multiplier les obstacles juridiques et réglementaires et ce dossier s’enlisera totalement dans une jungle administrative, soit l’Europe évolue, associant plus de pragmatisme à plus de biovigilance et elle pourra rattraper le retard pris dans le domaine des biotechnologies. C’est cette solution que nous préconisons, car les techniques de modification ciblée du génome sont plus précises, elles induisent donc a priori moins de risque ; d’autre part elles sont peu coûteuses, elles pourront donc plus facilement se diffuser dans le tissu des petites et moyennes entreprises.
Un des autres avantages mis en avant par plusieurs interlocuteurs est que la modification ciblée du génome (genome editing) est facile à mettre en œuvre. Concevoir et produire de nouvelles semences sera plus facile et moins coûteux qu’auparavant. Cela ne sera plus le privilège des grands industriels comme Montsanto-Bayer, Syngenta-ChemChina ou DuPont-Pioneer. Une des critiques les plus largement entendues à l’encontre des OGM est celle de la domination économique qu’elle procure par la rente constituée par le coût des licences, par le verrouillage technologique de certains brevets. Cela peut entraîner des situations de dépendance des agricultures vis-à-vis des grandes firmes agrochimiques. Les nouvelles techniques de modification ciblée du génome permettront d’échapper à l’engrenage économique dans lequel la même entreprise multinationale, par exemple Monsanto, peut commercialiser les plantes modifiées et l’herbicide associé comme le Roundup. Par contrecoup, les petits agriculteurs dans le monde (qui représentent 80 % des agriculteurs de par le monde), et non plus seulement les grandes exploitations industrialisées, pourraient potentiellement bénéficier des nouvelles variétés végétales ainsi créées. Si les interrogations en termes de sécurité alimentaire étaient levées on pourrait assouplir le processus réglementaire. Dans cette éventualité, les petites entreprises pourraient innover car le coût de mise sur le marché d’une plante génétiquement modifiée est aujourd’hui colossal.
C’est un avantage que met en avant M. Urs Niggli, déjà cité, qui compare le faible coût de la technologie, par opposition aux énormes sommes d’argent nécessaires au génie génétique classique. « CRISPR-Cas9 peut être utilisé même par de petits sélectionneurs : techniquement, c’est extrêmement facile et chaque application coûte environ 50 ou 60 euros », a-t-il dit, ajoutant que CRISPR-Cas9 est une « méthode démocratique », contrairement aux anciennes qui n’étaient abordables que pour les grandes entreprises.
Un institut public comme l’INRA, Max Planck (Allemagne) ou une université pourront alors développer des nouvelles variétés végétales. Une entreprise de taille moyenne comme Limagrain (2 milliards d’euros de chiffre d’affaires), voire une coopérative sectorielle d’agriculteurs, pourra également le faire.
Par ailleurs, l’étude de l’Académie des sciences américaine conclut que les cultures modifiées ont eu un impact économique positif, mais que les résultats dépendent aussi d’autres facteurs, comme le coût des semences modifiées. C’est notamment le cas dans les petites exploitations agricoles qui ont difficilement accès au crédit et font face à de gros risques financiers dans le cas où une culture ne donnerait pas les rendements espérés.
b. Les rapports avec les pays du sud
L’alimentation de la population mondiale actuellement et à terme constitue un problème. Selon les estimations de l’Organisation des Nations unies pour l’alimentation et l’agriculture (FAO), près de 800 millions de personnes, soit environ un sur neuf, n’ont pas assez de nourriture à manger, alors qu’un nombre encore plus grand sont mal nourris. Dans le même temps, la planète connait une phase de croissance démographique exceptionnelle, avec une population mondiale que l’on peut estimer à 9 milliards d’individus en 2050. Il n’y a donc que deux possibilités, celle d’augmenter les surfaces cultivées et de peser encore plus sur l’équilibre de la planète, ou d’augmenter les rendements grâce à des apports agronomiques et technologiques. Si la surface cultivée de par le monde est au moins constante, pourra-t-on le faire à technologie constante ? La FAO indique que la production mondiale de denrées alimentaires, d’aliments pour animaux et de fibres devra doubler d’ici 2050 pour répondre aux besoins d’une population mondiale croissante.
Avec les nouvelles techniques, la recherche et le développement deviendront accessibles aux acteurs publics et privés des pays du sud.
Le coût de développement et de commercialisation mondiaux d’une plante génétiquement modifiée se situe entre 100 et 150 millions d’euros. De ce fait, on le réserve actuellement aux grandes cultures comme le soja, le maïs ou le blé. La baisse des coûts fait qu’on va pouvoir envisager de développer des modifications pour d’autres variétés végétales, comme les fruits et légumes dans les pays du Sud.
Les études de la FAO (159) démontrent que même si l’agriculture africaine s’améliore ou devient plus productive, et que la moitié de ses profits viennent de l’export, il faudra améliorer les rendements des cultures pour faire face à l’augmentation de la population. Les biotechnologies vertes ne constituent bien sûr pas la seule solution, mais il serait criminel de ne pas utiliser les techniques simples en complément de mesures agroécologiques, pour notamment améliorer la résistance aux parasites, permettre une adaptation aux changements climatiques (variétés résistantes au stress hydrique, à la sécheresse ou capables de résister aux inondations).
L’activisme anti-biotechnologies ne se limite pas à l’Europe. Des erreurs ont été commises notamment au Burkina Faso, où un coton Bt modifié a, du fait de la modification, perdu en qualité de fibre. Cela a eu un effet dévastateur mais cette erreur ne condamne pas définitivement l’usage de ces techniques.
Car le manifeste des prix Nobel est clair : l’autosuffisance alimentaire ne pourra être atteinte que par augmentation des rendements ou par augmentation des surfaces cultivées, ce qui exacerberait la dégradation des ressources naturelles.
c. La position de l’Organisation des Nations unies pour l’alimentation et l’agriculture (FAO)
Les projections de la FAO suggèrent qu’en 2050, la production agricole devrait augmenter de 60 % globalement et de 100 % dans les pays en voie de développement, pour répondre aux demandes alimentaires accrues d’une population d’environ 9 milliards de personnes. Cette intensification devra être atteinte malgré des conditions naturelles dégradées où la disponibilité de la terre et de l’eau se réduit, où la compétition pour ces ressources augmente et où la productivité des écosystèmes naturels s’étiole. Le changement climatique provoque des bouleversements (température, pluviométrie, disponibilité de l’eau, fréquence et l’intensité des évènements extrêmes, niveaux des mers et salinité) et impacte les pays en situation d’insécurité alimentaire et de malnutrition.
De plus, la FAO évoque le passage d’une intensification de production durable à des systèmes alimentaires durables. En effet, 30 % de l’alimentation produite est soit perdue, soit gaspillée tout au long de la chaîne de valeur. Ainsi, plusieurs objectifs stratégiques sont instaurés : la protection agricole durable, les chaînes de valeur, les régimes alimentaires durables et les systèmes alimentaires durables. Par conséquent, le besoin d’innovation semble important pour la FAO, pour améliorer la gestion de l’eau, réduire le temps de travail, réduire les pertes post-récolte, améliorer les ressources naturelles, augmenter la fertilité des sols ou lutter contre les ravageurs.
La FAO utilise une définition large des biotechnologies, qui couvre les approches de haute technologie, telles que les méthodologies avancées basées sur la sélection par marqueurs, la transgenèse et les modifications ciblées du génome, mais aussi les approches de faible technologie, telles que celles impliquant l’insémination artificielle, la fermentation microbienne et les biofertilisants.
Les interlocuteurs rencontrés à la FAO ont semblé paralysés par les deux camps qui se partagent le monde, les tenants des biotechnologies transgéniques et les opposants à ces technologies (principalement l’Europe).
Mme Maria-Helena Semedo, directrice générale adjointe de la FAO coordinatrice des ressources naturelles, a indiqué que l’organisation et son secrétariat restent neutres, leur rôle se limite être un centre de discussion, une plateforme d’information et des programmes d’aide et de renforcement des capacités. Il en résulte une sorte de « consensus mou » qui semble proche de la paralysie, alors que les défis sont immenses. Les divergences fortes entre les pays membres sur un sujet comme les biotechnologies réduisent le rôle de l’organisation et de son secrétariat à celle de greffier, pour rendre compte des positions des uns et des autres.
Un temps active, l’équipe spéciale mixte constituée avec le Codex Alimentarius sur les biotechnologies a suspendu ses travaux, faute de demande des pays membres. La FAO dispose d’une commission des ressources génétiques pour l’alimentation et l’agriculture (160), où les pays membres peuvent discuter des impacts de ces technologies. Cette commission se réunit tous les deux ans. La modification ciblée du génome (gene editing) a été identifié par la commission comme une technologie parmi d’autres nécessitant d’un examen plus approfondi de ses impacts. Du 30 janvier au 3 février 2017, a eu lieu la dernière réunion de la commission. Malheureusement, la modification ciblée du génome n’a pas figuré à son ordre du jour, qui était exclusivement consacré à la conservation des ressources génétiques (161). Les rapporteurs se demandent s’il faudra attendre la prochaine réunion de cette commission… en 2019, pour voir le sujet de la modification ciblée du génome traité à la FAO.
L’appel des prix Nobel n’a manifestement pas été entendu.
La FAO a organisé deux symposiums internationaux, l’un sur l’agroécologie en 2014 (162), notamment à la demande de la France, l’autre sur les biotechnologies en 2016 (163), notamment à la demande des États-Unis, du Canada et de l’Argentine. On retrouve dans l’organisation des débats de la FAO, l’opposition entre les tenants et les détracteurs des PGM. Pour la FAO, agroécologie et biotechnologies sont complémentaires, ce qui est l’avis des rapporteurs.
Mme Maria-Helena Semedo précise que ce sont les membres de la FAO qui décident du programme de travail. Le fait d’avoir réussi à organiser deux symposiums l’un sur de l’agroécologie l’autre sur les biotechnologies est pour elle une grande réussite. Le système de gouvernance de la FAO est compliqué, car lorsqu’il s’agit de décisions politiques, de modifications de normes, on doit passer par une gouvernance complexe intégrant l’avis de la (conférence, des états et du conseil…), car le secrétariat de l’organisation n’a pas de pouvoir décisif.
Le symposium de février 2016 de la FAO sur « Le rôle des biotechnologies agricoles dans les systèmes alimentaires durables et la nutrition » se proposait d’établir un état des lieux, avec un inventaire des bonnes pratiques, des besoins et des problèmes, pour ensuite, si possible, définir un plan d’action avec des actions d’assistance technique.
La FAO voulait traiter des biotechnologies agricoles dans une arène neutre, sur différents sujets comme la prévention des risques et les considérations de sécurité sanitaire des aliments, les dimensions environnementales, sociales et économiques, la gestion des données et des mécanismes de partage.
Ce symposium se proposait également d’« explorer l’application des biotechnologies au profit des exploitants familiaux en prenant en compte le changement climatique ». Le directeur général de la FAO, M. José Graziano da Silva, a exprimé le souhait d’éradiquer la faim dans le monde et combattre la malnutrition en mettant en place une agriculture durable, dans le contexte de changement climatique et d’une démographie croissante.
Les principaux axes du symposium ont été :
– le changement climatique (étude des variétés de riz de submersion profonde, développement par sélection assistée par marqueurs ADN, résistance aux inondations ; atténuation par les biotechnologies des émissions de gaz à effet de serre) ;
– les systèmes alimentaires durables (recherche pour améliorer la nutrition ; acceptabilité des nouveaux produits par le grand public ; potentiel des nouvelles techniques de modifications ciblées du génome, telle que CRISPR-Cas9) ;
– les populations, les politiques, les institutions et les communautés (permettre un environnement favorable au développement et à l’application des biotechnologies agricoles, puis accumuler les preuves à partir d’évolutions des impacts sociaux, économiques et environnementaux des biotechnologies sur les systèmes agricoles tenus par les petits exploitants ; mettre en place des politiques, règlementations et droits à la propriété intellectuelle).
Pour conclure, le symposium a permis de débattre au-delà de la polarisation sur les OGM, qui entrave le développement et l’utilisation de la gamme complète des biotechnologies, prouvant que les biotechnologies sont bien plus que les OGM. La FAO rappelle qu’elle se doit d’être neutre pour examiner les risques, les avantages, les difficultés et les opportunités des biotechnologies agricoles : en cas de défaut de consensus sur certains sujets, elle se contente de fournir un document pour relater des discussions tenues lors de ces journées. De plus, la FAO insiste sur la complémentarité des approches par les biotechnologies et l’agroécologie pour réaliser des systèmes alimentaires durables et améliorer la nutrition. Un accroissement de la productivité serait ainsi possible en assurant une durabilité, mêlant ainsi le savoir traditionnel et les ressources génétiques.
Plusieurs témoignages d’expériences ont été réalisés. Le plus connu est le « riz doré » développé essentiellement en Asie, qui contient un précurseur de la vitamine A (également testé pour les oranges, les patates douces et le maïs).
– En Chine, on expérimente un « riz super vert » qui présente une résistance accrue contre les maladies, est économe en eau et riche en nutriments.
– Les nombreuses plantes modifiées Bt sont protégées contre les insectes sans insecticide chimique.
– Une tomate violette contient un antioxydant, le lycopène.
– En Éthiopie, les pois chiches modifiés développent une résistance au changement climatique. Il semble possible de réduire la production de méthane entérique des ruminants.
Les sols agricoles et forestiers peuvent séquestrer le dioxyde de carbone.
– Un projet africain développe un maïs économe en eau.
– Au Kenya, l’espèce d’arbre Allamblackia a été modifiée pour produire de l’huile comestible, du bois et des produits médicamenteux.
– Aux Pays-Bas, on teste l’utilisation des biotechnologies pour accroitre la durée de stockage des fruits.
– Une expérience malheureuse a été relatée au Burkina Faso, notamment par Guy Kastler. Le transfert d’un gène sur un coton a modifié sa qualité mécanique. Dévalorisé, le coton du Burkina Faso a ainsi perdu d’importantes parts de marché. M. Kastler met en avant la démesure des industriels face aux petits exploitants, indiquant que ces derniers ont pâti les premiers de cette introduction d’un coton OGM, que cela a engendré un coût. Il pense que le but des agrochimistes serait de favoriser des espaces de monocultures pour l’exportation, donc de globaliser l’agriculture.
Selon Mme Maria-Helena Semedo, déjà citée, le symposium de février 2016 aurait dû être suivi de de séminaires régionaux, pour favoriser les échanges. Le symposium sur l’agroécologie de 2014 avait été décliné en cinq séminaires régionaux, afin d’examiner des exemples locaux d’agroécologie. Pour le symposium sur les biotechnologies, la France a expliqué qu’il n’était pas envisageable de faire comme pour l’agroécologie, avec des séminaires régionaux dans une approche verticale (top down), donc la FAO réfléchit à des séminaires thématiques. Les positions de l’Union européenne et de la France ont été les plus radicales, la ministre hongroise s’étant prononcé contre l’utilisation des biotechnologies en agriculture, les français étant M. Jean de Foucauld, Ceva Santé animale, M. Rodrigo Sara, bureau du consortium du CGIAR, M. Olivier le Gall, Institut national de la recherche agronomique (INRA), et M. Guy Kastler, La Via Campesina (Narbonne).
M. Guy Kastler (164) y a développé une position opposée aux biotechnologies dans l’agriculture et l’alimentation. Il a exposé la position des associations qu’il représente et le rôle que devrait jouer la FAO dans ce débat. Dans un premier temps, il explique la nécessité de représenter l’ensemble des protagonistes dans ce débat public, et pas seulement les grands groupes industriels ou de recherche. Ensuite, il poursuit en expliquant pourquoi ces plantes génétiquement modifiées ont été créées ; pour résister aux herbicides, méthodes qui ont été utilisées de manière exponentielle pour traiter les cultures. Cependant, il indique que l’utilisation de ces produits fait émerger des résistances et que des risques sanitaires et de toxicité sur l’environnement, mais aussi envers les agriculteurs, sont réels.
M. Kastler développe cette notion de biodiversité en indiquant que, depuis des siècles, l’agriculture a évolué avec son environnement, les semences étant transportées par le vent. Désormais, aux États-Unis, près de 94 % des plantations de soja sont OGM. M. Kastler parle même de violation des droits des exploitants qui, pour s’adapter au changement climatique, doivent utiliser des semences adaptées à ce phénomène. Par ailleurs, la réaction vive du public contre les OGM incite les industriels à contourner les règlementations actuelles des OGM, notamment le protocole de Carthagène. Ainsi, il dénonce la « perversion » des industriels qui souhaitent redéfinir les OGM et la distinction entre modification qui pourrait se trouver dans la nature et modification anthropique. M. Kastler conclut en demandant à la FAO d’arrêter ce nouveau « bio-piratage » et de ne plus soutenir ces nouvelles technologies qui permettent de faire des modifications génétiques. Il indique l’importance de prendre en considération la biodiversité et les organisations paysannes et de recherches impliquées dans les programmes de sélection collaborative paysanne, pour la souveraineté alimentaire et l’agroécologie paysanne.
Les rapporteurs estiment que la FAO aurait pu mettre au débat la question posée par les cent prix Nobel qui pensent que si rien n’est fait, on court à la catastrophe.
Ils sont très étonnés qu’aucun ministre n’ait représenté la France dans ce débat, laissant à la Hongrie le soin de donner une position européenne qui n’est sans doute pas partagée par tous les États membres.
La mutagenèse physique ou chimique est autorisée, comme l’hybridation depuis plus de 60 ans. Cet exemple illustre le renoncement des politiques laissant s’exprimer une opinion, certes respectable, s’appuyant sur un parti pris idéologique, sans la conforter aux savoirs et à la connaissance.
Pour rappeler la phrase de Bertrand Russel « La science n’a jamais tout à fait raison, mais elle a rarement tout à fait tort, et, en général, elle a plus de chance d’avoir raison que les théories non scientifiques. Il est donc rationnel de l’accepter à titre d’hypothèse ».
Il n’est pas étonnant que dans ces conditions, la FAO soit paralysée et fasse le grand écart, écartelée entre les financeurs.
Recommandation n° 13 : Pour un soutien de l’Organisation des Nations unies pour l’alimentation et l’agriculture (FAO) à l’appel des prix Nobel
À la suite de l’appel des cent lauréats du prix Nobel le 29 juin 2016,
– Demande que le Gouvernement saisisse l’Organisation des Nations unies pour l’alimentation et l’agriculture (FAO) des potentialités des nouvelles biotechnologies appliquées à l’agriculture pour réduire la faim dans le monde et contribuer à l’alimentation de 2 milliards d’êtres humains supplémentaires à l’horizon 2050 ; et de l’évaluation de l’impact des nouvelles techniques de sélection végétale ;
– Recommande que les délégations nationales dans les symposiums de la FAO soient présidées par un représentant du Gouvernement et que des parlementaires soient associés aux séminaires des organisations internationales dépendant des Nations unies ;
– Suggère que l’Europe fasse du dialogue nord-sud une de ses priorités et qu’elle propose l’organisation de forums régionaux, en lien avec la FAO, sur le rôle des biotechnologies vertes et des mesures agroécologiques dans le développement de l’agriculture, l’amélioration des conditions sanitaires et l’énergie ;
– Préconise un renforcement des centres de recherche et des universités africaines dans le domaine des biotechnologies.
5. Les positions des pays développés et des pays émergents
Les rapporteurs ont effectué une mission dans les trois pays utilisant le plus les OGM : les États-Unis, le Brésil et l’Argentine.
a. Les États-Unis, un pays pionnier
Aux États-Unis, les recherches autorisées par le ministère de l’agriculture (USDA) avec modification ciblée du génome sont très nombreuses et se portent maintenant majoritairement sur la technique CRISPR-Cas9.
EXEMPLES DE PROJETS DE RECHERCHE PAR MODIFICATION
CIBLÉE DE GÉNOME (GENOME EDITING) AUTORISÉS PAR L’USDA (MAI 2016) (*)
Centre de recherche |
Objet |
Technique |
Service de recherche agricole de Floride |
Résistance et tolérance de citrons à maladie du dragon jaune (黃龍病 Huanglongbing) |
CRISPR-Cas9 |
Université de Georgia |
Croissance et développement de rhizomes, dans un objectif de productivité accrue |
CRISPR-Cas9 |
Université d’État du Kansas |
Ingénierie ciblée de la biochimie des graines de camélia pour synthétiser des matières premières oléochimiques valorisables |
Biologie de synthèse |
Centre scientifique des plantes Donald Danforth de St. Louis |
Ingénierie de la photosynthèse C4 dans le maïs pour développer l’utilisation de l’azote |
CRISPR-Cas9 |
Université d’Arizona |
Modification ciblée de gènes hôtes endogènes pour la résistance aux virus |
TALEN |
Université de Floride |
Caractérisation des composants des traits et amélioration génétique des herbes |
Intragénique, mutagenèse dirigée, modification ciblée du génome et empilement de gènes |
Université de Georgia |
Variation du poids des fruits dans les lignes de reproduction de tomates |
CRISPR-Cas9 |
Université d’Etat du Montana |
Analyse fonctionnelle de la résistance à la rouille du blé |
Caractérisation des gènes |
Université du Nebraska |
Amélioration de la digestibilité du sorgho et de sa qualité en protéines |
Modification ciblée du génome et utilisation d’une plate-forme génomique fonctionnelle |
Station expérimentale agricole de Genève (New York) |
Manipulation génétique de la fausse arpenteuse du choux (Trichoplusia ni) pour identification des sites cible pour leur contrôle |
CRISPR-Cas9 |
Université d’État du Dakota du Sud |
Compréhension des contrôles génétiques de la dormance et de la longévité des graines chez les espèces d’herbe |
Clonage et caractérisation du loci QTL ; modification ciblée du génome |
Université du Tennessee |
Développer des cultures bioénergétiques tolérantes à la sécheresse grâce à la biotechnologie et à la biologie synthétique des espèces CAM |
Caractérisation et ingénierie génétique avec CRISPR-Cas9 |
(*) Liste complète sur le site internet de l’USDA : http://cris.nifa.usda.goc/
Source : USDA.
Pour M. Jacob Sherkow, professeur associé, New York Law School, les premiers produits découlant de la technologie CRISPR et dont le commerce sera autorisé, aux États-Unis seront des champignons non oxydés. Ce champignon a été modifié pour ne pas brunir à l’air. Selon cet interlocuteur, cette modification vise à améliorer l’apparence et la durée de vie du champignon, à faciliter une récolte mécanique et à diminuer le gaspillage. L’USDA a indiqué en avril 2016 que dans ce cas précis, le champignon modifié par la technologie CRISPR-Cas9 ne sera pas soumis à la loi sur les produits issus de l’ingénierie génétique. Cette décision pose la question des moyens de détection de traces d’ADN étrangers dans le génome. L’entreprise DuPont a obtenu, en octobre 2016, l’autorisation de commercialisation d’un maïs ne produisant plus que de l’aminopectine, utilisée pour l’industrie du papier et qui du fait de la technique utilisée ne contient plus d’ADN étranger. Ces autorisations ont donc été obtenues en considérant qu’il ne s’agissait pas d’OGM.
Les rapporteurs ont également rencontré M. Peter Beetham, président et CEO de CIBUS, à San Diego qui utilise un procédé biotechnologique différent.
Cibus a développé une technologie de mutagenèse ciblée de type « Oligonucleotide Directed Mutagenesis » (ODM), dénommée « RTDS » (Rapid Trait Developpement System). Cette technologie préexistait à l’invention de CRISPR-Cas9. Par rapport à une mutagenèse classique, due à des substances chimiques ou à des radiations, la mutation opérée par RTDS est plus précise. Elle permet d’intervenir sur un seul gène, voire sur plusieurs gènes préalablement définis. Alors que la mutagenèse classique contient des mutations aléatoires et qu’il faut sélectionner celles qui présentent un intérêt, la méthode RTDA aboutit directement au résultat souhaité. Les mutations induites par RTDS sont traçables après séquençage du génome. Cibus a breveté la méthode RTDS. L’entreprise pourrait étudier la mise en place d’un système de certificat d’obtention végétale (COV) pour l’Europe. Ses produits sont déjà autorisés aux États-Unis et au Canada, elle espère des autorisations dans d’autres pays en 2018. Pour l’Union européenne, la question est de savoir si ces produits seront considérés comme issus d’une technologie de mutagenèse ou comme des OGM au sens de la directive n° 2001/18. Six pays européens considèrent déjà que cette méthode s’apparente à une technologie de mutagenèse.
b. L’Allemagne, l’exemple de la timidité européenne
En Allemagne comme en France, le sujet des biotechnologies végétales et des OGM est très controversé. Il fait l’objet d’une réaction négative assez largement répandue dans la population. L’Académie des sciences de Berlin-Brandebourg (BBAW) s’est prononcée sur ce sujet, après le rendu d’un groupe de travail interdisciplinaire.
Cette Académie, a publié en 2013 un rapport sur l’utilisation des biotechnologies en agriculture. En Allemagne, les plantes modifiées génétiquement sont toujours controversées.
La culture de ces plantes génétiquement modifiées est quasiment inexistante en Allemagne et comme en France, l’Allemagne importe des produits génétiquement modifiés principalement pour nourrir les animaux. Les règles d’étiquetage doivent permettre la coexistence des différents modes de production, avec ou sans OGM. Le rapport mentionne l’importance de la brevetabilité du vivant et des incidences que pourraient avoir l’instauration de brevets sur des séquences de gènes présentes dans les variétés traditionnelles. L’évaluation pour l’académie doit être procédée au cas par cas.
L’intérêt de ces techniques est discuté dans des débats sociétaux, en essayant de faire la balance entre les bénéfices, notamment les intérêts économiques et les risques. Ce groupe de travail interdisciplinaire de la BBAW a émis différentes recommandations concernant l’utilisation des biotechnologies en agriculture.
Il fait le point sur l’état des connaissances en matière de science et de technologie, ainsi que sur les impacts possibles sur la santé et l’environnement. Il rappelle que toute expérience doit être approuvée par l’Autorité européenne de sécurité alimentaire (EFSA), qui n’a à ce jour répertorié aucun effet sanitaire négatif. Les bénéfices économiques des biotechnologies appliquées à l’agriculture sont soulignés. Il recommande l’organisation de débats éthiques entre les citoyens et les scientifiques.
Il regrette les départs à l’étranger de scientifiques dans le domaine de la biologie végétale. C’est malheureusement un phénomène que l’on peut constater au niveau de l’Europe. Pour l’Académie, ces nouvelles technologies devraient être un moteur de l’innovation en Allemagne. Le rapport affirme que des expériences dans les champs sont indispensables, afin de permettre ces recherches, il considère que l’évaluation du risque est essentielle, notamment celles en lien avec les questions de santé et d’environnement.
La décision politique doit s’appuyer sur l’expertise scientifique.
c. La Suisse, précurseur des votations et de la consultation citoyenne
La Suisse est un pays de votations. Les citoyens peuvent demander à ce qu’un scrutin soit organisé sur tout sujet. On a pu le constater récemment sur la question de l’accueil des étrangers.
Le 7 juin 1998, la question posée aux citoyens était de savoir s’il fallait ou non interdire la production, l’acquisition et la remise d’animaux génétiquement modifiés, la dissémination ou l’octroi de brevets.
La population a souhaité à 65 % continuer à autoriser la recherche et la production industrielle de produits issus de la transgenèse. Cela était sans doute dû à l’importance de l’industrie pharmaceutique dans la région de Bale et de Genève. Aujourd’hui, les interlocuteurs industriels se plaignent du cadre réglementaire trop lourd et du surcoût qui empêche de proposer des solutions à des cultures plus spécialisées, comme par exemple les légumes. Mme Patricia Ahl Goy, de l’équipe de réglementation des semences, chez Syngenta, a déclaré aux rapporteurs que le dossier réglementaire coûte 20 à 30 fois plus cher que le coût de la R&D. Si le cadre réglementaire était moindre, cela permettait d’aller plus vite et à moindre coût, le surcoût est notamment dû aux études requises et réalisées.
d. Le Brésil et l’Argentine, la confiance dans les technologies
• Brésil
Au Brésil, la législation s’est ajustée à la réalité, car les interdictions de cultures d’OGM avaient été contournées. À la fin des années 1990, Les agriculteurs brésiliens ont importé illégalement d’Argentine les semences de soja OGM. Le président Lula, dans un premier temps opposant aux OGM, a alors été contraint de modifier la législation brésilienne et d’autoriser leur culture.
Selon la loi brésilienne de 2005, la Commission technique nationale de biosécurité (CTNBio) est l’instance multidisciplinaire à caractère consultatif et délibératif pour donner l’appui technique et l’avis juridique au gouvernement fédéral dans la formulation, la mise à jour et la mise en place de la politique nationale de biosécurité des organismes génétiquement modifiés (OGM) et de leurs dérivées. CNTBio est aussi compétente dans la formulation de normes techniques de sécurité, des avis techniques relatifs à l’autorisation des activités qui impliquent la recherche et l’usage commercial d’OGM et de leurs dérivés, sur la base de l’évaluation des risques zoo-phytosanitaire, pour la santé humaine et pour l’environnement.
Selon les données fournies par Mme Eliane Key, directrice exécutive d’AgroBio, association brésilienne des entreprises de biotechnologies dans l’agriculture et l’agro-industrie, 93 « évènements » (165) en lien avec les OGM ont été autorisés au Brésil entre 1998 et 2016. Durant l’année 2015, 101 essais en plein champ ont été autorisés et 19 autorisations commerciales ont été données. Le Brésil est aujourd’hui le deuxième pays cultivant des OGM.
Selon le cabinet de consultants brésilien Céleres, « la récolte 2016-2017 relève un total de 49,1 millions d’hectares de cultures génétiquement modifiées au Brésil, en augmentation de 7,4 % par rapport à la récolte précédente, pour les cultures de soja de maïs et de coton, représentant 93,4 % de la surface totale de cultures. » […].
ÉVÈNEMENTS GÉNÉTIQUEMENT MODIFIÉS AUTORISÉS AU BRÉSIL
(par année)
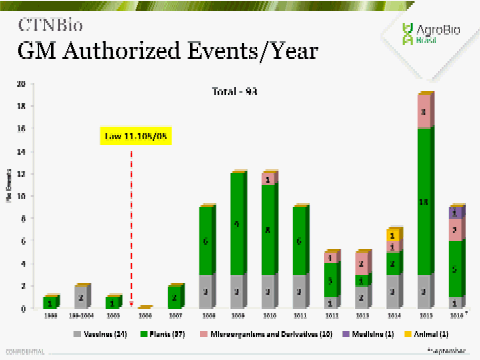
Source : AgroBio.
ÉVÈNEMENTS GÉNÉTIQUEMENT MODIFIÉS AUTORISÉS AU BRÉSIL
(année 2015)
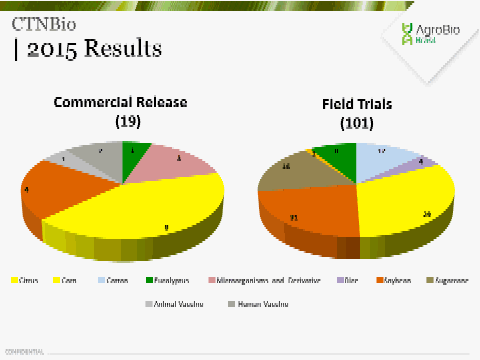
Source : AgroBio.
Un consensus fort existe au sein des milieux scientifiques brésiliens pour soutenir les cultures génétiquement modifiées.
Un chercheur de l’Embrapa et spécialiste du CTNBio, M. Alexandre Nepomuceno, estime que ces technologies ont un grand potentiel. Au Brésil, l’emploi des insecticides a été considérablement réduit avec cette technique, en utilisant des plantes modifiées, tout comme en Argentine. En revanche, l’utilisation d’herbicide a augmenté, mais c’est avant tout en raison des pratiques d’utilisation. Pour ce type de maïs, l’autorisation d’utilisation a été accordée au Brésil et en Chine (maïs Drought Guard de Monsanto).
Pour M. Nepomuceno, « on peut éviter les contournements de résistance pour le soja OGM par une meilleure gestion des plantations. Il faut prendre les mesures adaptées (durée d’utilisation recommandée). Des plantes avec ces caractéristiques sont déjà vendues, mais si on ne les plante pas de la bonne manière, alors cela ne fonctionnera pas, mais c’est un problème agronomique ». Il existe des problèmes isolés, mais à l’échelle du pays, aucun problème sérieux n’a été signalé.
Il est difficile de dire si les agriculteurs gagnent plus ou moins d’argent avec les OGM et si les consommateurs et l’environnement y trouvent un bénéfice. Pour M. Luiz Antonio Gonçalves Rodrigues de Souza, ingénieur agronome, ministère de l’agriculture brésilien, à la question de savoir qui est gagnant avec les OGM, une série d’évaluations montrent soit des gains importants, soit une absence de différences. Les sociétés productrices de semences transgéniques proposent de nouvelles plantes qui permettent de maintenir la résistance aux insectes, dans ce que l’on peut appeler une « obsolescence programmée » (166). Le ministère forme les agriculteurs à utiliser les techniques à utiliser les bonnes pratiques. Un grand pays comme le Brésil ne peut pas se passer d’outil comme ces nouvelles technologies.
Le débat est intense avec la confédération nationale des producteurs ruraux, qui utilisent des plantes transgéniques même si l’avantage économique n’est pas évident. On peut donc se poser la question de savoir pourquoi ils continuent à utiliser les transgéniques en l’absence de gain économique. Le ministre de l’économie a répondu aux rapporteurs qu’à son avis la quantité de travail de l’agriculture est moindre.
Une autre technologie qui monte est l’utilisation de l’ARN de manière ciblée. Il serait ainsi possible de diminuer l’utilisation de pesticide et d’herbicide. Bayer a acheté Monsanto, car Monsanto investit beaucoup sur l’ARN-I (ARN interférent) (167), qui est encore plus révolutionnaire que CRISPR-Cas9.
M. Leonardo Zebral, ingénieur agronome, chercheur en biotechnologie végétale à l’université fédérale de Lavras, laboratoire central de biologie moléculaire, explique que ses recherches portent sur le café et les eucalyptus génétiquement modifiés. Les gènes d’intérêt agronomique sont la cellulose pour la pâte à papier (eucalyptus) et la tolérance à la sécheresse et à l’aluminium (café). En effet, au Brésil, le sol présente une forte teneur en aluminium qui est toxique pour les plantes.
Le projet sur le café est mené depuis 2012 en coopération avec le Centre de coopération internationale en recherche agronomique pour le développement (CIRAD) (168). Le travail s’effectue en parallèle sur les deux variétés de café arabica et canephora (robusta), en phase initiale de test. Le fonctionnement de CRISPR-Cas9 a été testé sur le café, une plante à cycle long, avec une biosynthèse de caroténoïdes. La difficulté technique est que le café est une plante qui a un génome complexe différencié en trois ou quatre sous-génomes (diploïdes, tétraploïdes). Il faut donc les toucher simultanément pour réussir la modification génétique. La biosynthèse de la caféine a également été testée par la technologie CRISPR-Cas9, La prochaine étape sera de générer des modifications multiples, ce qui est bien sûr possible avec la technologie CRISPR-Cas9, qui pourra agir sur les différents sous-génomes.
M. Leonardo Zebral pensait que son équipe aurait été la première à publier sur la modification ciblée du génome de plantes ligneuses (peupliers), mais une équipe japonaise l’a devancé en 2015. Des effets hors cible (169) sur les quatre sous-génomes ont été relevés lorsque cette technologie CRISPR-Cas9 avait été utilisée. Les chercheurs s’efforcent de développer des guides ARN de plus en plus spécifiques. Le séquençage du génome permet de mesurer les effets hors cible.
Les autorisations de recherche, qui sont dénommées certificats de qualification, sont délivrées par CNTBio. M. Leonardo Zebral évalue à une cinquantaine le nombre d’expérimentations transgéniques actuellement menées au Brésil.
• Argentine
En Argentine, ce que l’on appelle le « Paquet biotechnologique », à la fin des années 1990, a associé semis direct sans labour, OGM et herbicide, essentiellement le Roundup (glyphosate). L’Argentine cultivait environ 20 millions d’hectares de cultures de soja et 10 millions d’hectares pour le blé et le maïs, sur un total de 35 millions d’hectares cultivés en 2016. La quasi-totalité du soja et du maïs est transgénique, une proportion croissante du blé le devient.
Ce système de production de haute technologie permet un ensemencement direct sans labour avec un seul passage de machine agricole par récolte. L’Argentine est ainsi le pays qui dépense le moins de carburant par gramme de céréale produite (20 litres par tonne en Argentine, contre 70 litres en moyenne mondiale). Ce système n’encourage pas la minéralisation, le sol a une grande capacité de captation de chaleur, avec carbone incorporé.
La Commission nationale de biotechnologie agropastorale (CONABIA) centre de contrôle des biotechnologies en Argentine, est chargée d’approuver les plantes génétiquement modifiées, pour déterminer la sûreté d’un point de vue biologique, environnemental et alimentaire, et ainsi permettre la mise sur le marché. Quand elle approuve, la commission certifie ces trois aspects.
Le « Paquet biotechnologique » a engendré une standardisation des pratiques agricoles avec une forte mécanisation et une réduction des coûts de production. Il tend à la concentration des terres car il nécessite moins de main d’œuvre à l’hectare. Quelque 2 000 producteurs se sont approprié les technologies OGM, ils représentent 20 % du nombre total des agriculteurs mais 80 % des surfaces cultivées, essentiellement avec le soja. Certains parlent de confrontation des modes d’agriculture, entre les acteurs de l’« agrobusiness » et les défenseurs des pratiques traditionnelles (agriculture familiale, petits et moyens paysans, autres cultures que le soja).
La monoculture du soja OGM a entraîné des problèmes de résistance des mauvaises herbes aux herbicides (essentiellement le Roundup). L’absence de rotation des cultures a entraîné une pression accrue de sélection sur les mauvaises herbes. Dans un discours de vérité sur les contournements de résistance, M. Lino Barañao, ministre des sciences, de la technologie et de l’innovation productive, a reconnu qu’on avait sans doute été trop loin dans la dévolution des terres à la monoculture du soja modifié.
Le nouveau président argentin Mauricio Macri, élu en décembre 2015, a pris conscience du problème. Dès son entrée en fonction, il a supprimé les taxes à l’exportation sur l’ensemble des productions agricoles (blé de 25 % à 0 %), mais il les a abaissées de « seulement » 5 points sur le soja (de 35 % à 30 %). Les autres cultures sont redevenues compétitives (blé, maïs…) dès 2016 une diminution des surfaces cultivées en soja et une augmentation des autres (un million d’hectares a été constaté). Le CONABIA explique qu’en complément de ces mesures fiscales incitatives, il travaille sur un projet de loi sur les bonnes pratiques agricoles, avec un protocole d’utilisation des herbicides au niveau national, même si les régions argentines peuvent choisir individuellement leurs pratiques.
Pour M. Gérard Lespourci, directeur général de Limagrain Argentine, les techniques de semis direct, c’est-à-dire l’ensemencement des champs sans labour, ont simplifié la mise en culture. On passe une fois ou deux avec un désherbant total, ce qui consomme moins d’herbicide à l’hectare. Le temps d’intervention et les coûts sont réduits, ils permettent de cultiver plus de surface. Selon une étude de M. Lino Barañao, ministre argentin des sciences, de la technologie et de l’innovation productive, 75 millions de dollars de bénéfices ont été générés en vingt ans grâce aux biotechnologies.
M. Sergio Feingold, coordinateur du programme national de biotechnologie, Institut national de technologie agricole (INTA), rappelle que l’institut encourage la rotation des cultures. Il dit aux agriculteurs qu’il faut apprendre à cohabiter avec les mauvaises herbes ; la notion de « seuil de dégradation minimale », en cours de définition, devrait permettre de concrétiser cet objectif. L’apparition des nouvelles biotechnologies est, selon l’INTA, une occasion historique à saisir pour modifier les pratiques agricoles. Par ailleurs, l’INTA mène des recherches sur les pommes de terre (qui ne noircissent pas, qui nécessitent moins d’eau, qui résistent à des virus) et la tomate riche en vitamine E.
Les plantes modifiées génétiquement sont très largement acceptées en Argentine par les scientifiques, les agriculteurs et les consommateurs ; des oppositions, très minoritaires, se font néanmoins entendre.
Ainsi, M. Daniel Sallaberry, avocat spécialisé en droit environnemental, explique qu’en utilisant l’article 41 de la constitution argentine relatif au droit à un environnement sain, une action de groupe (class action) a été menée en 2015 visant à imposer un étiquetage OGM et à suspendre provisoirement la culture des OGM. Le juge fédéral argentin a accepté cette action de groupe dénommée « Jiménez Alicia Fanny », qui oppose « l’État national et douze entreprises semencières » (Monsanto, Bayer, Syngenta, DuPont, Dow…) à « l’ensemble de la population argentine » (soit 40 millions de personnes). Cette action de groupe demande la prévention, la recomposition et le dédommagement collectif contre les entreprises productrices d’OGM et de produits chimiques, puis la mise en place d’une loi de biosécurité, qui n’existe pas en Argentine. L’action de groupe demande l’instauration d’un fonds de compensation pour l’environnement (reforestation) et pour recomposer l’ensemble du système ferroviaire (qui bénéficierait à la population rurale). Les jugements définitifs n’ont pas encore été rendus.
Une autre procédure judiciaire a vu, en juin 2015, un juge d’appel confirmer la condamnation d’un agriculteur et de son pilote d’avion pour épandage de Roundup (glyphosate) sur des champs proche du quartier d’Ituzaingo, proche de la ville de Cordoba.
Les rapporteurs remarquent que dans, dans les deux procès, seul le désherbant a été mis en cause, pas les cultures génétiquement modifiées. Il est vrai que les opposants aux OGM font souvent la confusion entre les deux, en Argentine ou ailleurs.
e. La Chine va développer du blé génétiquement modifié
Les rapporteurs n’ont pas effectué de mission en Chine, mais l’importance de ce pays pour les biotechnologies végétales est réelle.
Mme Gao Caixia, généticienne chinoise, membre de l’Académie des sciences de Chine, a été la première de son pays à appliquer CRISPR-Cas9 pour modifier des végétaux, en créant un blé résistant au mildiou, parasite dévastateur (170). Dans un article publié en 2013 dans la revue Nature Biotechnology, elle explique que, « comparé aux autres techniques disponibles, CRISPR est si simple à utiliser ! ». Jusqu’ici, aucun OGM de blé n’avait été créé, tant l’ADN de la semence est complexe. Le cas du blé est intéressant car il s’agit d’une plante hexaploïde, c’est-à-dire que chacune de ses cellules contient trois génomes. La modification de la semence s’effectue en isolant et neutralisant gène visé dans les trois génomes.
6. La nécessité de donner un nouvel élan aux recherches sur les biotechnologies végétales
a. Le rapport « Agriculture – Innovation 2025 »
Le rapport « Agriculture – Innovation 2025 » a été présenté le 22 octobre 2015 par M. François Houllier, alors président de l’INRA, M. Jean-Marc Bournigal, président de l’Institut national de recherche en sciences et technologies pour l’environnement et l’agriculture (IRSTEA), M. Philippe Lecouvey, directeur général du réseau des instituts des filières animales et végétales (ACTA), et M. Pierre Pringuet, président du conseil d’administration d’AgroParisTech à M. Stéphane Le Foll, ministre de l’agriculture, M. Thierry Mandon, secrétaire d’État chargé de l’enseignement supérieur et de la recherche, et Mme Axelle Lemaire, secrétaire d’État chargée du numérique.
Ce rapport indique que la génétique et les biotechnologies font « l’objet d’une forte concurrence internationale. Or, la France dispose d’un très haut niveau de compétences en recherche, mais a pris du retard dans l’expérimentation et la diffusion ». Il y a lieu de s’interroger sur la cause de ce retard, en particulier sur le lien avec la controverse sur les OGM. Le rapport précise que : « Les projets recouvrent la sélection génomique végétale et animale, la maîtrise des biotechnologies, l’exploitation de la diversité métabolique végétale. Cet axe inclut également un volet réglementaire pour préciser les procédures d’homologation des variétés dérivées des biotechnologies (dans le cadre national, en lien avec le Haut Conseil des biotechnologies, et européen). »
Le rapport propose de poursuivre et d’amplifier les projets du programme des investissements d’avenir (PIA) en sélection génomique, de renforcer les infrastructures clés, de créer des data centers et d’affirmer dans le cadre européen une ambition internationale.
Le rapport traite dans son axe n° 5 de la génétique et des biotechnologies. Il propose quatre projets visant à : développer la sélection génomique animale et végétale ; assurer la maîtrise des nouvelles technologies ; relever l’enjeu industriel des métabolites secondaires, leur diversification et leur développement ; et faire évoluer les procédures et protocoles pour favoriser le progrès génétique et son adaptation.
Le rapport « Agriculture – Innovation 2025 » recommande une action dénommée « Mobilisant le levier génétique et les biotechnologies [Gén] » par laquelle elle « inclut aussi un volet réglementaire pour préciser les procédures d’homologation des variétés dérivées des biotechnologies (en lien avec le Haut conseil des biotechnologies [HCB] et dans le cadre européen) ».
b. Le projet « Genius » de l’Institut nationale de la recherche agronomique (INRA)
En dehors de quelques équipes qui, contre vents et marées, continuent de travailler sur les biotechnologies végétales, l’INRA ne porte actuellement plus qu’un seul projet de génétique agricole : « Genius ».
Le projet Genius (2012-2019) (171), financé sur le programme des investissements d’avenir (PIA) à hauteur de 10 millions d’euros, associe dix partenaires publics dans les domaines des sciences de la vie et des sciences sociales et cinq entreprises du secteur privé spécialisées dans la création variétale et/ou les biotechnologies. Il s’organise autour de cinq groupes de travail : la gestion de projet avec un dialogue et une méthode de travail participative, l’insertion précise des gènes, la modification et le remplacement des gènes, le transfert facilité des gènes et les impacts socioéconomiques. Le projet Genius intègre donc la thématique de la modification ciblée du génome.
Le projet Genius met en place des outils qui seront testés pour obtenir des plantes résistantes à des virus ou des parasites, tolérantes à la salinité présente dans certains sols, tolérantes à la sécheresse ou ayant un meilleur rendement. Il concerne neuf espèces cultivées qui sont le blé, le maïs, le riz, le colza, la tomate, la pomme de terre, le peuplier, le pommier et le rosier. Même si la France fait aujourd’hui le choix de ne pas cultiver de plantes génétiquement modifiées en plein champ, ce que les rapporteurs regrettent, leur culture en environnement confiné (serres fermées) reste un outil indispensable en recherche fondamentale. La France pourrait ainsi disposer d’outils performants d’obtention de plantes génétiquement modifiées pour continuer à faire des découvertes qui seront les innovations de demain, soutenir la compétitivité des semenciers français sur le marché mondial et avoir une capacité d’expertise scientifique publique dans le domaine du génie génétique au niveau international.
Les rapporteurs estiment inadmissible que trois établissements travaillant sur le projet Genius ont été envahis par des opposants aux OGM à Avignon, Colmar et Lyon. Ils estiment qu’il s’agit d’agressions caractérisées. Ils notent que l’aboutissement d’une démarche de recherche telle que Genius nécessitera de reposer, à terme, la question de l’expérimentation en plein champs qui permette de tester ces plants en condition réelle de culture.
L’enjeu des nouvelles technologies de modification ciblée du génome est de pouvoir accélérer le développement des nouvelles espèces quand on connaîtra mieux le rôle les gènes d’intérêt. Passer à côté de ces nouvelles technologies exposerait la France, et les autres pays européens opposés aux biotechnologies agricoles, au risque concurrentiel en provenance des autres continents, et donc à un affaiblissement de notre agriculture.
En agriculture, il faut prendre en compte les systèmes de production et de transformation dans leur ensemble et mettre en place des dispositifs qui permettent de dialoguer avec la société et les parties prenantes.
La situation actuelle en France et en Europe, où les biotechnologies sont mal acceptées socialement, a amené les entreprises concernées, comme Limagrain, à se désengager de ces technologies, tout comme en Allemagne Bayer ou BASF. Il est paradoxal que le gouvernement allemand soit aussi timide sur son sol et qu’il soutienne de fait la concentration du géant agrochimique Bayer qui devient après le rachat de Monsanto, le numéro 1 mondial des biotechnologies. Il y a une sorte d’hypocrisie européenne à interdire la culture des plantes génétiques qui ont acquis les caractères leur permettant notamment de résister à des maladies, de geler la R&D en Europe, mais d’accepter que les entreprises de ce secteur se développent à l’international.
c. Un soutien accru à la recherche et au développement
Les rapporteurs constatent que l’INRA et les autres organismes de recherche agricole ont baissé la garde, même si les chercheurs sont convaincus que ce serait une erreur de ne pas utiliser les biotechnologies vertes.
Les responsables de la recherche agronomique française semblent paralysés, adoptent la stratégie du hérisson et en faisant de l’autocensure en attendant des jours meilleurs. Il est vrai qu’ils ont été échaudés par la destruction des derniers essais expérimentaux sur le caféier en Guyane ou sur la vigne résistante au virus du court noué à Colmar.
Les rapporteurs regrettent que les OGM soient de fait interdits de cultures expérimentales sur tout le territoire national et qu’aucun essai au champ n’ait été engagé, depuis la destruction des lignées modifiées de peupliers dans le Loiret en 2014. Ils sont consternés qu’aucune des 48 unités expérimentales de l’INRA ne travaille sur la transgenèse, en dehors des recherches menées en milieu confiné.
Ils pensent, comme les auteurs du rapport Agriculture-Innovation 2025, qu’aucun des outils disponibles ne réglera seul tous les problèmes qui se posent pour l’agriculture à l’horizon 2025. Les biotechnologies vertes ne sont qu’un moyen d’action parmi d’autres, comme l’agroécologie, la bioéconomie, le biocontrôle, l’agriculture numérique apportant la précision, l’économie agricole, la formation continue. Le levier génétique est nécessaire pour compléter ces autres pratiques de production agricole. Il l’est notamment dans la lutte contre les ravageurs.
Ils souhaitent que l’INRA reste en pointe dans la création de variétés porteuses de résistance durable qui sont obtenues par l’association de plusieurs gènes de résistance. Le levier génétique est également un des leviers majeurs d’adaptation au changement climatique (tolérance à la sécheresse) ou de la réduction des intrants, comme les pesticides ou les engrais. Les rapporteurs constatent qu’en ayant suspendu les activités de recherche fondamentale dans ces domaines, la France continue de perdre ses capacités d’expertise publique indépendante, de veille scientifique, technologique et réglementaire.
L’OPECST est attentif à l’indépendance de la recherche publique. Seule celle-ci permet de mesurer l’impact sur l’environnement des cultures génétiquement modifiées, comme celui concernant l’étude des flux de gènes via les pollens ou encore l’apparition de molécules toxiques ou l’allergénicité de certains produits.
L’INRA, l’IRD et le CIRAD doivent travailler de manière plus étroite avec les pays du sud sur la manière de résoudre certaines questions liées au changement climatique.
Enfin, les rapporteurs sont très inquiets de la démission des responsables gouvernementaux successifs sur le dossier des biotechnologies vertes et notamment sur celui de l’utilisation des techniques de modification du génome. Alors que d’autres pays ont déjà précisé leur position sur les méthodes d’évaluation des produits issus de cette nouvelle technique, la France et l’Europe sont attentistes, se cachant derrière une lointaine décision de la Cour de justice de l’Union européenne (CJUE). Celle-ci ne se fera que sur des bases juridiques anciennes, celles de la directive européenne n° 2001/18. Ils craignent que de ce fait le développement des biotechnologies vertes ne soit freiné par rapport aux pays qui les ont adoptées et que la coupure du monde des biotechnologies ne s’aggrave.
Recommandation n° 14 : Une reprise de l’expérimentation en plein champ pour les plantes issues des nouvelles biotechnologies
– Recommande un soutien accru aux recherches sur la modification ciblée du génome dans le domaine animal et végétal. Cet effort accru doit permettre de renforcer l’expertise indépendante et la veille scientifique, technologique et réglementaire ;
– Propose que l’Institut national de la recherche agronomique (INRA) et les autres centres publics et privés comme l’Institut français de recherche pour l’exploitation de la mer (IFREMER), le Centre de coopération internationale en recherche agronomique pour le développement (CIRAD) ou l’Institut de recherche pour le développement (IRD), relancent leur programmes de recherche avec des expérimentations en plein champ sur des plantes modifiées par des techniques de transgenèse ou des techniques de modification ciblée du génome,
– Suggère que trois ou quatre sites d’expérimentations, dans des régions françaises volontaires soient créés, et que l’INRA dispose de la réserve foncière lui permettant d’isoler ces essais des cultures traditionnelles ;
– Souhaite que la collecte de toutes les données acquises concernant l’agriculture, et notamment les conditions de culture, soit rassemblée par des plateformes nationales pour aider au développement d’une agriculture de précision, conformément aux conclusions adoptées par l’OPECST à l’issue de son audition publique du 2 juillet 2015 sur « La place du traitement massif des données (Big Data) dans l’agriculture » ;
– Préconise que le soutien aux biotechnologies vertes conditionne la compétitivité des entreprises et peut aider au développement de petites entreprises françaises et européennes dans le secteur de l’agroalimentaire ou des semences, à condition de défendre dans les négociations internationales un modèle ouvert d’innovation basée sur le certificat d’obtention végétale (COV), considérant les ressources génériques comme un bien commun de l’humanité ;
– Réitère sa demande d’octroyer des moyens supplémentaires pour conserver et valoriser les fonds génétiques, conformément aux conclusions adoptées par l’OPECST dans son rapport (n° 2967) du 9 juillet 2015 sur « La filière semencière française ».
C. NOUVELLES BIOTECHNOLOGIES ET NOUVELLES PRODUCTIONS ANIMALES
Le développement d’animaux transgéniques est moins avancé que celui des plantes transgéniques. Les rapporteurs ont cependant étudié ce sujet lors de leurs missions aux États-Unis et surtout en Argentine et au Brésil.
La première souris transgénique a été développée en 1980 par John W. Gordon et Frank H. Ruddle. Cette publication n’a eu que peu d’échos, comme l’écrit Louis Marie Houdebine (172) Deux ans plus tard, deux équipes ont publié à quelques semaines près des publications montrant qu’un gène transposé pouvait induire la production d’une quantité plus importante d’hormones de croissance humaine, qui est un polipeptide de 191 acides aminés. Cette technologie a l’avantage de fabriquer un produit pharmaceutique, tout en évitant la transmission au patient de prions, présents dans les extraits d’hypophyse humaine qui était auparavant injecté aux malades. L’équipe de J.L. Marx (173) a publié dans Science le 24 décembre 1982, précédée par l’équipe de R.D. Palmiter, qui a publié dans Nature, le 16 décembre 1982 (174). Comme l’écrit L.M. Houdebine « Dès l’année 1983, il a été observé que des souris transgéniques portant un gène d’hormone de croissance de mammifères étaient plus grosses que les souris de référence et que leur sang contenait… une quantité plus grande de la molécule codée par le transgène » (175).
Ces premiers animaux transgéniques ont été conçus pour les besoins de la R&D, pour tester de nouvelles thérapies ou pour produire des anticorps monoclonaux.
On peut, comme cela a été rappelé plus haut, concevoir des souris génétiquement modifiées pour étudier le rôle d’inactivation d’un gène (souris knock-out).
Certains travaux ont pour but de servir de modèle pour des expérimentations de maladies humaines (rat, poisson-zèbre…) ou produisent des médicaments (chèvres, poulets…) ou des exo-greffes (cochons), qui ont été abordés dans la partie II du présent rapport (médecine humaine) ;
D’autres visent à modifier des animaux pour leur épargner des maladies ou leur apporter des traits intéressants pour l’alimentation humaine.
Plusieurs projets ont trait aux modifications du lait pour diminuer la teneur en lactose, un sucre qui provoque des intolérances, pour augmenter certains acides gras comme les oméga-3, bénéfiques pour la santé.
Mais ces animaux sont restés à l’écart du débat public qui s’est plutôt focalisé sur les plantes transgéniques et pourtant, après vingt ans de controverse aux États-Unis, la FDA vient d’autoriser la vente d’un saumon génétiquement modifié par transfert d’une hormone de croissance et d’une protéine qui lui permet de mieux résister au froid. Il peut atteindre la taille adulte en 18 mois au lieu de 3 ans pour un saumon « sauvage ». L’hormone accélère leur développement sans aboutir à des poissons géants. Cette autorisation a été assortie de conditions drastiques, imposées pour que ces saumons soient produits en maîtrisant les risques pour l’environnement. Il est rustique et stérile et ne consomme pas d’antibiotiques comme les saumons d’élevage. La multiplication s’effectue aux Iles du Prince Édouard (Canada) et la croissance au Panama. Une autorisation de mise sur le marché a été accordée au Canada puis aux États-Unis. Aucune obligation d’étiquetage n’a été établie. L’EPA a estimé qu’il n’y avait pas de risque pour l’environnement… car rien n’était réalisé sur le territoire américain.
Cette autorisation a bien sûr suscité une énorme controverse, et ce saumon a été qualifié par l’association Inf’OGM de « FrankenFish », en comparaison avec la nourriture Frankenstein qui avait caractérisé les OGM... Selon la réglementation européenne, ce saumon devrait être étiqueté GM s’il était commercialisé en France. L.M. Houdebine indique qu’il faut 25 % moins de nourriture pour élever des saumons GM par rapport aux animaux conventionnels (176). Il en résulte une moindre pollution. Enfin, pour obtenir un kilo de poisson frais, il faut 1,1 kg de nourriture sèche provenant de poisson contre 8,1 kg, 3,1 kg, 2,1 kg respectivement avec des vaches, des porcs et des poulets.
Lors des visites des rapporteurs, plusieurs expériences conduisant à des animaux génétiquement modifiés ont été relatées.
En Argentine, plusieurs projets sont en cours avec notamment des vaches à lait anallergique et maternisé. D’autres projets sont encore en cours d’expérimentation : des vaches sans corne (la justification est celle d’« améliorer le bien-être animal », la coupe des cornes étant très douloureuse), des cochons résistants à la peste porcine africaine (« pig 26 »)…
En Allemagne, comme pour les OGM végétaux, le sujet est sensible.
M. Arnold Sauter, vice-président du Bureau allemand d’évaluation des choix technologiques auprès du Bundestag (Büro für Technikfolgen-Abschätzung beim Deutschen Bundestag – TAB), note que l’ensemble des pays européens auront un problème avec les animaux génétiquement modifiés. En Allemagne, a lieu un débat très controversé sur les liens entre l’utilisation des biotechnologies et la protection des animaux.
Aux États-Unis, les projets se multiplient.
Mme Larisa Rudenko, conseillère à la Food and Drug Administration (FDA), précise que trois autorisations viennent d’être accordées aux États-Unis concernant des animaux issus de l’ingénierie génétique. La première pour l’entreprise GTC, qui a mis au point une chèvre qui produit de l’ATryn, un médicament anticoagulant. La FDA a examiné l’autorisation de produire cette chèvre, puis l’autorisation de mise sur le marché du médicament. La seconde autorisation concernait un poulet qui produit un médicament à usage humain. L’autorisation la plus controversée a été celle du saumon, qui a été le premier animal génétiquement modifié autorisé pour la consommation humaine en 2015. Six mois plus tard le Canada a suivi. Aucun produit issu d’un animal génétiquement modifié ne peut être autorisé si la production de l’animal ne l’a pas été.
Celle-ci a indiqué que la Maison blanche, du temps de l’administration Obama, préparait une modification de la règlementation de 1986, mise à jour pour la dernière fois en 1992, sur les biotechnologies.
La loi demande aux agences de contrôler la sécurité des produits issus de ces animaux. Les règles applicables pour les animaux génétiquement modifiés sont les mêmes que celles applicables aux médicaments à usage humain. En outre, doivent être respectées les dispositions de la loi NEPA (National Environmental Policy Act) sur la protection environnementale. Des lignes directrices ont été définies pour appliquer les objectifs de la loi. La dernière version de ces lignes directrices date de 2009, une modification est envisagée en 2016, pour tenir compte des dernières évolutions.
Le document réglementaire cadre pour les biotechnologies a été publié en 1986 et mis à jour en 1992. Il explique l’action et la coordination des trois agences réglementaires : l’APHIS (Animal and Plant Health Inspection Service) de l’USDA, la FDA et l’EPA. Les principes énoncés dans ces documents continuent de guider la pratique réglementaire dans ce domaine. Cependant, la Maison blanche souhaite réexaminer ce document à l’aune des nouvelles biotechnologies. Un document a été publié par le bureau de la présidence en juillet 2015. Il s’agit d’une mise à jour, mais aussi de l’élaboration d’une stratégie. Des organismes extérieurs, notamment l’Académie des sciences, doivent réaliser une étude, afin d’évaluer les applications qui seront présentés sur les cinq à dix prochaines années. Toutes ces informations sont publiées sur le site internet de la Maison blanche. Il est prévu qu’une mise à jour préliminaire du cadre règlementaire et du cadre stratégique soit faite en 2017.
M. Andy May, directeur scientifique de Caribou Biosciences, indique qu’il vient de conclure un partenariat avec Genus, un des leaders mondiaux de la reproduction de bétail porcins, où il doit proposer des solutions pour lutter contre certaines maladies.
Au Brésil, la société américaine Recombinetics (177) travaille pour reproduire du bétail sans corne avec la technologie TALEN ; elle expérimente dans l’État du Mato Grosso.
En Argentine, un projet est en phase avancée pour modifier génétiquement des vaches qui devraient produire un lait anallergique, maternisé et riche en nutriments. D’autres projets concernent la régénération du cartilage des articulations des chevaux de course, ou encore les maladies respiratoires des volailles. Des équipes de recherche travaillent sur l’encéphalite bovine spongiforme (ESB), dite « maladie de la vache folle ».
Mme Carolina Bluguermann, post-doctorante au Conseil national de recherche scientifique et technique (CONICET), indique qu’elle travaille sur la biotechnologie de la reproduction. La technologie CRISPR-Cas9 est selon elle beaucoup plus facile. Elle permet l’intégration de gènes d’intérêt de manière précise dans le génome. Elle lui a permis de réaliser plusieurs projets. Le premier concerne une vache où l’on a inséré dans son génome le gène inhibant la sécrétion de bêta-lactoglobuline (protéine allergène), présent dans le lait. Les embryons ont été vitrifiés, et quatre gestations étaient déjà en cours en octobre 2016. Le lait devrait présenter deux modifications principales, être hypoallergénique, ce qui est intéressant car 5 % de la population mondiale est intolérante au lactose, et bénéficier de nouvelles protéines avec des valeurs nutritionnelles intéressantes. L’objectif est de mettre de la lactoferrine humaine dans le lait de vache pour faciliter le passage du lait maternisé au lait de vache. CONABIA, l’organisme compétent de régulation, a autorisé ces manipulations. Ce laboratoire a également créé le premier animal transgénique, la vache dénommée ISA, qui produit du lait maternisé. Une vache est née en 2011 à l’INTA à partir d’une technologie plus ancienne, mais il n’a pas été possible d’obtenir une expression suffisante des protéines du lait, et les nouvelles technologies de type CRISPR-Cas9 sont véritablement plus faciles à utiliser.
Le CONICET a d’autres projets de reprogrammations cellulaires, à des fins thérapeutiques. Mme Bluguermann travaille également sur les chevaux, et veut utiliser CRISPR-Cas9 pour réparer les cartilages ou articulations chez les chevaux de course par exemple. Le travail est effectué en coopération avec des institutions américaines, comme l’université de Davis en Californie, pour faire des études sur des porcs.
Le dernier projet sur lequel travaille le CONICET est celui de l’augmentation de l’efficacité du clonage d’embryons bovins et de chevaux, mais les chercheurs ont rencontré un problème de méthylation pour les clones.
M. Sergio Feingold, coordinateur du programme national de biotechnologie à l’Institut national de technologie agricole (INTA), précise que l’institut travaille sur des projets de recherche sur la résistance à la maladie de la « vache folle » et sur un vaccin recombinant pour traiter les maladies respiratoires infectieuses des volailles.
La question est donc de savoir si les nouvelles technologies de modification ciblée du génome vont accroître le développement d’animaux dont le génome a été modifié.
L’Argentine montre que ces techniques se diffusent de manière exponentielle dans les universités et les centres de recherches, car elles sont peu coûteuses.
Comme l’indique LM Houdebine déjà cité, « Après trois décennies, il apparaît que la production de protéine thérapeutique par des animaux transgéniques est moins simple que l’on ne l’imaginait. »
D. ÉVALUATION SANITAIRE ET ENVIRONNEMENTALE DES BIOTECHNOLOGIES VERTES
Alors que la position de l’Union européenne est attentiste, puisque les États membres sont divisés et que la plupart d’entre eux refusent, de fait, la culture d’organismes génétiquement modifiés, la plupart des autres pays acceptent une attitude plus pragmatique sur l’utilisation des nouvelles biotechnologies et ne considèrent pas que les produits ainsi obtenus soient des OGM.
Dans ces pays, les autorisations d’expérimentations, de cultures et de mise sur le marché s’appuient sur des évaluations scientifiques et sanitaires. Les rapporteurs pensent que la défiance des pays européens vient à la fois du fait de la réticence des usagers à consommer des produits qui peuvent présenter un risque, mais surtout du fait que les autorités ont tardé à organiser sur ces questions complexes un véritable débat entre l’expert, le politique et le citoyen.
Les États-Unis ont par exemple demandé à l’Académie des sciences américaine de faire un bilan de toutes les publications scientifiques qui ont traité des risques pour la santé ou pour l’environnement, et de comparer les avantages et les inconvénients des technologies utilisées.
Les rapporteurs ont, au cours de leur mission aux États-Unis en juin 2016, rencontré plusieurs membres de l’Académie des sciences américaines, dont le président Ralph Cicerone, décédé en août 2016.
Selon l’étude de cette académie (mai 2016) intitulée « Culture génétiquement modifiées : expériences et perspectives » (178), les nouvelles technologies d’ingénierie agricole perturbent la distinction autrefois claire entre les différentes méthodes d’améliorations des plantes et des semences. La méta-analyse conduite par l’Académie, de 1996 à 2011, conclut qu’aucune preuve n’a été apportée de risque d’un OGM alimentaire pour la santé ou pour l’environnement. Tout en reconnaissant la difficulté inhérente à détecter des effets faibles ou à long terme sur la santé ou l’environnement, le comité d’étude chargé du rapport conclut que l’on n’a pas trouvé de preuve d’effets négatifs de ces technologies sur la santé humaine, ni de lien de causalité avec les problèmes environnementaux rencontrés.
L’académie a également analysé les effets de plantes modifiées mises sur le marché. Le comité mis en place par l’académie a utilisé des données accumulées au cours des deux dernières décennies pour évaluer les prétendus effets négatifs et les prétendus avantages des cultures génétiquement modifiées. De plus, le comité a entendu 80 intervenants divers au cours de 3 réunions publiques et 15 séminaires en ligne (webinars) et a lu plus de 700 commentaires de participants, afin d’élargir sa compréhension des questions entourant les cultures transgéniques. Le comité a examiné près de 900 publications de recherche et d’autres publications sur le développement, l’utilisation et les effets des caractéristiques génétiquement modifiées du maïs, du soja et du coton.
Trois conclusions principales sont tirées dans les domaines sanitaire, socio-économique et environnemental :
– aucune étude scientifique ne relate un quelconque effet néfaste des OGM sur la santé humaine ;
– il n’y a pas de relation de cause à effet entre les problèmes environnementaux et l’utilisation de cultures OGM. Sur les effets environnementaux, de manière générale, les plantes OGM qui sont cultivées, le soja, le maïs, le coton, n’ont pas ou peu de cousin sauvage, donc il n’y a pas de risque de transfert de gènes. Aucun effet agronomique ou environnemental négatif n’a été trouvé. Toutefois, la résistance accrue aux caractéristiques génétiquement modifiées des cultures constitue un problème agricole majeur ;
– en terme économique, les agriculteurs qui ont adopté les OGM ont pu constater un effet positif, car ils ont réduit la quantité d’herbicide utilisé. Une des conclusions notables de l’étude est que l’introduction des gènes Bt de résistance aux pesticides n’a pas augmenté la productivité de ces plantes lorsqu’il n’y avait pas eu d’attaque par des ravageurs. Par contre, une augmentation des rendements dans les endroits où la pression exercée par les insectes était très conséquente a été observée.
Depuis les années 1980, les biologistes ont utilisé le génie génétique pour produire des traits particuliers dans les plantes conférant par exemple à des fruits une durée de vie plus longue, une teneur plus élevée en vitamines ou des résistances aux maladies. Cependant, les seules caractéristiques introduites dans les plantes largement commercialisées sont la résistance aux insectes et la résistance aux pesticides. Les cultures concernées sont le soja, le maïs, le coton et le riz en Asie. À partir de 2015, d’autres plantes modifiées ont commencées à être mises sur le marché. Certaines plantes ont été modifiées pour résister à un virus, comme la papaye ou la courge, d’autres l’ont été pour réduire le brunissement de leur chair, comme avec les pommes de terre ou les pommes ; ces plantes n’ont cependant été produites qu’en petites quantités.
Pour analyser les effets des plantes modifiées sur la santé, trois types de tests ont été réalisés : tests sur les animaux, analyse de la composition et tests d’allergénicité. Bien que la conception et l’analyse de nombreuses études sur l’alimentation des animaux n’aient pas réalisées dans des conditions optimales, les nombreuses études expérimentales menées sur des animaux ont fourni des preuves raisonnables que les animaux ne sont pas affectés en mangeant des aliments dérivés de plantes génétiquement modifiées. Les analyses de composition montrent des variations significatives dans la composition chimique et nutritive qui tombent cependant dans l’éventail des différences statistiquement constatées. Beaucoup s’inquiètent du fait que la consommation d’aliments génétiquement modifiés pourrait entraîner une incidence plus élevée de problèmes de santé spécifiques comme le cancer, l’obésité, les maladies gastro-intestinales, les maladies rénales et les troubles du spectre de l’autisme ou des réactions allergiques. En l’absence d’études à long terme et contrôlées pour examiner certaines hypothèses, le comité a examiné les données épidémiologiques des États-Unis et du Canada, où les aliments génétiquement modifiés ont été consommés depuis la fin des années 1990 et des ensembles de données similaires du Royaume-Uni et d’Europe occidentale, où la nourriture génétiquement modifiée n’est pas largement consommée. Aucune différence n’a été trouvée entre les pays en ce qui concerne les problèmes de santé spécifiques après l’introduction des aliments génétiquement modifiés dans les années 1990.
Il est prouvé que les cultures résistantes aux insectes ont eu des effets bénéfiques sur la santé humaine en réduisant les intoxications par les insecticides. En outre, plusieurs cultures transgéniques sont en cours de développement et sont conçues pour apporter des bénéfices à la santé humaine, comme par exemple le riz doré avec une teneur accrue en bêta-carotène pour aider à prévenir la cécité et la mort causées par les carences en vitamine A dans certains pays en développement.
2. L’évaluation environnementale
Dans l’ensemble, le comité de l’Académie américaine n’a trouvé aucune preuve concluante des relations de cause à effet entre les cultures GM et les problèmes environnementaux. Toutefois, la nature complexe de l’évaluation des changements environnementaux à long terme a souvent rendu difficile l’obtention de conclusions définitives. L’utilisation de cultures résistantes aux insectes ou résistantes aux herbicides n’a pas réduit la diversité des plantes et des insectes dans les fermes et même, parfois, les cultures résistant aux insectes ont entraîné une augmentation de leur diversité. Alors que le flux génétique – le transfert des gènes d’une culture transgénique à une espèce relative sauvage – s’est produit, aucun exemple n’a démontré un effet environnemental négatif de ce transfert.
Le fait que seulement deux caractéristiques aient été largement utilisées est l’une des raisons pour lesquelles le comité a évité de se prononcer sur les avantages et les risques des cultures transgéniques en général. Les allégations concernant les effets des cultures transgéniques existantes supposent souvent que ces effets s’appliqueraient au processus de génie génétique en général, mais des caractéristiques différentes sont susceptibles d’avoir des effets différents. Une caractéristique génétiquement modifiée qui altère le contenu nutritionnel d’une culture, par exemple, est peu susceptible d’avoir les mêmes effets environnementaux ou économiques qu’une caractéristique pour la résistance aux herbicides.
Les experts se prononcent pour une analyse au cas par cas, pour chaque événement génétique considéré. Ils pensent que plus une modification est précise, moins il y aura d’impact éventuel sur les gènes voisins. C’était déjà un des points qu’avait souligné Jean-Yves Le Déaut, dans son premier rapport de l’OPECST en 1998, faisant remarquer qu’une transgenèse obtenue par un « canon à gènes » pouvait se faire sur différents lieux dans le génome et que toute insertion d’un gène pouvait avoir des conséquences sur l’expression des gènes adjacents, et même sur l’activation des gènes dormants.
a. Plantes à propriété insecticide
Le rapport de l’Académie américaine s’intéresse à la modification par le Bacillus thuringiensis (Bt), une bactérie permettant d’intégrer dans leur génome le gène de synthèse d’un insecticide. Les études montrent une réduction des pertes dans les cultures Bt, permettant aux agriculteurs d’obtenir des rendements effectifs proches des rendements espérés. Ces cultures ont permis de réduire la population d’insectes nuisibles. Tous les agriculteurs en ont bénéficié, y compris ceux qui n’avaient pas adopté de culture Bt. La présence de ces cultures est même corrélée positivement avec une plus grande biodiversité d’insectes. L’utilisation d’insecticide a diminué parfois même chez les cultures non-Bt voisines des cultures Bt. La résistance des insectes aux pesticides a été lente à se développer, sauf là où les stratégies de bonne gestion de la résistance n’ont pas été respectées.
Le bilan de l’utilisation des gènes de résistance et des insecticides est donc meilleur que celui que les détracteurs des plantes génétiquement modifiées ont établi sans bases scientifiques. Il est intéressant de constater que l’utilisation des plantes génétiquement modifiées a accru la biodiversité. Cela est tout simplement dû au fait que les insecticides ne sont pas spécifiques, à l’inverse des plantes génétiquement modifiées, et tuent sans discernement une grande variété d’insectes. La polémique qui a fait grand bruit il y a une quinzaine d’années sur le papillon monarque a donc fait long feu, car s’il est vrai que certains papillons ou larves pouvaient être tués par la toxine Bt, la quasi-totalité des autres espèces n’était pas affectée.
La résistance aux herbicides a permis d’améliorer les rendements des récoltes, tout en diminuant l’utilisation d’herbicide les premières années de l’adoption de ces nouvelles variétés. Les risques environnementaux et sanitaires sont considérés comme faibles, et ces risques varient en fonction de l’herbicide. Ces usages n’empêchent pas les « mauvaises herbes » naturellement plus résistantes à certains produits phytosanitaires de pousser, mais le comité chargé de l’étude n’a pas trouvé de preuve de dégâts qui auraient pu être causés par des avantages sélectifs donnés à certaines plantes adventices. Certaines d’entre elles ont développé une résistance au glyphosate et les techniques de gestion de la résistance ne font que retarder de telles évolutions. Les efforts de recherche sur la résistance des « mauvaises herbes » doivent donc être maintenus.
c. Contournements de résistance
Comme on l’a vu précédemment, plusieurs cas de contournement de résistance des plantes génétiquement modifiées sont apparus, chez des plantes adventices ainsi que des résistances d’insectes aux pesticides. Les rapporteurs notent qu’il en a toujours été ainsi dans la chaine biologique, entre un ravageur et sa nourriture, entre des plantes adventices et leurs agents toxiques. Il s’agit d’une lutte perpétuelle aussi ancienne que la vie.
Aucun des experts rencontrés aux États-Unis, au Brésil ou en Argentine n’a nié l’apparition de telles résistances. Ils font remarquer que les résistances apparaissent plus souvent, ou plus vite, quand les consignes de bonnes pratiques ne sont pas respectées par les agriculteurs : quantité et période d’épandage, monoculture… La course à plus de pesticides, à plus d’herbicides, est alors un cercle vicieux. Enfin, plusieurs experts ont rappelé aux rapporteurs que les biotechnologies n’ont jamais prétendu constituer la solution miracle, ils ne sont qu’un élément de la boite à outils, incluant notamment les méthodes de biocontrôle.
Mme Larisa Rudenko, conseillère de Food and Drug Administration (FDA), rappelle que c’est l’APHIS (Animal and Plant Health Inspection Service) de l’USDA qui est chargée des problèmes de résistance aux pesticides. Elle rappelle qu’il s’agit d’une course entre le pathogène et les chercheurs, car l’apparition de la résistance n’est toujours qu’une question de temps.
Cette question est majeure, car si, en vingt ans, on n’a pas observé de phénomène d’irréversibilité des disséminations de gènes en milieu ouvert, on doit au préalable mesurer l’impact sur l’environnement et évaluer les dommages potentiels qui pourraient en résulter.
Les rapporteurs ont pu le constater au Brésil où :
Selon le cabinet de consultants brésilien Céleres : « La technologie stack sur le soja constitue l’événement de transformation le plus cultivé sur le territoire, avec 20,3 millions d’hectares de soja pour la récolte 2016-2017. Elle apporte donc des bénéfices économiques aux producteurs de soja, mais aussi une amélioration et une facilitation de la production. Les témoignages d’agriculteurs et de semenciers révèlent que cette technologie apporte une amélioration du potentiel économique, car elle assure une meilleure productivité et un meilleur contrôle de l’exploitation des cultures.
« Les règles de bon usage des technologies, comme les zones de refuge, ne sont pas toujours respectées, ce qui rend difficile leur développement, allant jusqu’à annuler les bénéfices en termes économiques et de gestion de production. L’agriculteur brésilien ne fait pas de gestion intégrée de ses plantations, utilisant le plus souvent une seule technologie ou un seul produit phytosanitaire, sans respecter le principe de rotation des cultures, portant ainsi préjudice au progrès technologie, en plus d’augmenter les risques d’apparition d’insectes ou d’adventices résistants.
« Le mauvais usage des technologies, accompagné de la pression intense exercée par des organismes (ravageurs, adventices et maladies) favorisés par les conditions climatiques tropicales brésiliennes (dans lesquelles il est possible de cultiver la terre toute l’année), génère des résistances aux évènements génétiquement modifiés, leur vie utile pouvant être considérablement réduite.
Si les producteurs ruraux brésiliens ne prennent pas conscience du problème en cause, c’est toute l’agriculture brésilienne qui sera la grande perdante. L’utilisation des plantes génétiquement modifiées doit être durable et pour cela il convient de respecter des règles de bonne pratique ».
M. Emmanuel Aubry, coordinateur de la recherche internationale sur le maïs tropical de Limagrain Brésil, indique aux rapporteurs que la problématique de la lutte contre les insectes en milieu tropical est très complexe et le contrôle des insectes doit passer par une combinaison de plusieurs éléments de lutte (qu’il qualifie de lutte intégrée). L’utilisation du maïs résistant OGM doit être complétée par plusieurs modes d’actions, traitements chimiques d’appoint, des rotations de cultures ou un suivi de la population d’insectes… Pour le contrôle des ravageurs, qu’il s’agisse d’insectes ou de maladies, il y a depuis toujours (bien avant l’apparition des OGM) une compétition entre l’adaptation des plantes à ces « pestes » et l’évolution des maladies. Les stratégies de sélections (avec ou sans OGM, et dans le futur avec ou sans les nouvelles techniques d’amélioration des plantes) s’inscrivent toujours dans ce contexte.
M. Gérard Lespourci, directeur général de Limagrain Argentine, explique qu’on trouve effectivement des résistances, mais par rapport aux gains que les OGM ont pu apporter (résistance aux herbicides et aux insectes), il n’est pas envisageable de revenir en arrière et faire à nouveau du soja ou du maïs non OGM. L’apparition des résistances est contrôlable. La bonne pratique agricole permet une rotation agricole, ce qui pose problème en Argentine c’est la prédominance du soja. Les grandes cultures en Argentine représentent 20 millions d’hectares pour le soja sur 35 millions de surfaces cultivées, 10 millions pour le maïs et le blé.
Les rapporteurs ont en effet constaté que les mauvaises herbes résistantes à des herbicides existaient déjà, bien avant les OGM. La société des sciences des adventices d’Amérique (WSSA) rapporte que des mauvaises herbes résistantes à des herbicides existaient déjà quarante ans avant les cultures génétiquement modifiées. Les premiers cas connus avaient été rapportés en 1957, une « comméline commune » (Dayflower) envahissante d’Hawaï et une carotte sauvage. Depuis lors, 250 espèces d’adventices ont montré une résistance à 160 herbicides différents dans 66 pays parmi 86 cultures différentes. Le rapport de la WSSA a montré que les adventices résistantes apparaissent lorsqu’une seule approche de gestion est utilisée de manière répétitive à l’exclusion de tout autre contrôle, qu’il soit chimique ou par des pratiques agricoles, faisant d’une approche diversifiée et intégrée de la gestion des adventices la première ligne de défense. De nombreux producteurs ont combattu avec succès ces résistances en adoptant un éventail plus diversifié de mesures.
d. Nouvelles biotechnologies vertes : moins ou autant d’incertitudes qu’avec les OGM ?
Les rapporteurs réaffirment la nécessité d’évaluer de façon approfondie et continue les plantes issues du génie génétique. Le risque zéro n’existe cependant pas, pas plus dans les biotechnologies qu’ailleurs : traitements médicaux (risques de l’anesthésie…), les médicaments (contre-indications), voire les aliments dits « naturels » (allergies, toxines dues à des bactéries ou à des champignons…). Toute évaluation prend en compte la balance bénéfices-risques. Comme il a été dit dans la partie précédente, les technologies de modification ciblée du génome sont bien plus précises que la mutagenèse ou les techniques transgéniques précédemment utilisées. De ce fait, il paraît logique que les procédures d’évaluation soient adaptées à chaque cas. La législation européenne existante distingue déjà les nouveaux végétaux issus de la mutagenèse, méthode très fruste mais connue depuis plusieurs décennies et dont l’innocuité a été prouvée dans la durée, des techniques transgéniques qui sont soumises aux procédures d’évaluation les plus lourdes. On a vu que les techniques de modification ciblée du génome étaient plus précises que la mutagenèse, logiquement, elles devraient être à notre avis exemptées des lourdes procédures d’évaluation de l’EFSA.
Au-delà de la décision – qui se fait attendre – de la Commission européenne relative à la qualification des nouvelles techniques de sélection végétale au regard du droit communautaire, les rapporteurs estiment que l’on devrait réfléchir à une évolution du droit européen vers une évaluation des produits ainsi créés et non des procédés qui les conçoivent. De toute façon, comme on l’a vu précédemment, il va devenir quasiment impossible de savoir si une nouvelle variété végétale aura été créée par sélection naturelle ou biotechnologie.
Les nouvelles techniques d’ingénierie, telles que CRISPR-Cas9, permettront aussi d’introduire de nouvelles caractéristiques (résistance à la sécheresse, amélioration de la photosynthèse et des nutriments…) à de plus nombreuses variétés de plantes, pour résister à différents nuisibles et ainsi augmenter les rendements. L’Académie des sciences américaine recommande un équilibre dans l’investissement public pour ces technologies, en ne négligeant pas d’autres approches. Étant donnée la grande diversité des méthodes d’amélioration des plantes, le comité de l’Académie recommande une règlementation (régulation) des produits, plutôt que des procédés utilisés pour les modifier. Le comité recommande une nouvelle approche de contrôle testant les caractéristiques nouvelles prévues ou imprévues et l’exposition aux risques potentiels. Un investissement public permettant un accès plus égalitaire à ces nouvelles technologies est recommandé par le comité.
La politique actuelle des États-Unis en matière de nouvelles variétés végétales est, en théorie, axée sur les produits, mais l’USDA et l’EPA déterminent quelles plantes doivent être réglementées au moins partiellement en fonction du processus de leur élaboration. Une approche basée sur les processus devient de moins en moins techniquement défendable, les anciennes approches du génie génétique devenant moins nouvelles et les procédés nouveaux – tels que la modification ciblée du génome et la biologie synthétique – ne rentrent pas dans les catégories réglementaires actuelles du génie génétique.
La distinction entre sélection conventionnelle et génie génétique est de moins en moins évidente, indique le rapport de l’Académie américaine, qui passe également en revue les technologies émergentes. Par exemple, des technologies d’édition de génome telles que CRISPR-Cas9 peuvent maintenant être utilisées pour effectuer un changement génétique en substituant un seul nucléotide à un gène spécifique. Le même changement peut être apporté par une méthode qui utilise des rayonnements ou des produits chimiques pour induire des mutations, puis utilise le séquençage génomique pour identifier les plantes ayant la mutation souhaitée – approche qui est considérée comme une sélection conventionnelle par la plupart des systèmes réglementaires nationaux. Certaines technologies émergentes de génie génétique ont le potentiel de créer de nouvelles variétés végétales qui sont difficiles à distinguer génétiquement des plantes produites par la sélection conventionnelle ou des processus qui se produisent dans la nature. On peut s’attendre à ce que des variétés végétales classiquement sélectionnées pour être résistantes à un herbicide et des plantes génétiquement modifiées pour résister au même herbicide aient des avantages et des risques similaires associés.
Le rapport de l’Académie américaine recommande de communiquer activement avec le grand public à propos de l’utilité de ces technologies et de leur réglementation. La science ne peut pas être la seule réponse apportée aux questions soulevées par ce sujet. La politique concernant les cultures transgéniques a des dimensions scientifiques, juridiques et sociales. Le comité de l’Académie américaine estime par exemple que l’étiquetage obligatoire des denrées alimentaires génétiquement modifiées n’est pas justifié pour protéger la santé publique, mais il note que la question comporte des choix sociaux et économiques qui vont au-delà des évaluations techniques de la sécurité sanitaire ou environnementale. En fin de compte, l’étiquetage implique des choix de valeurs et de modèle d’agriculture que les évaluations techniques ne peuvent, à elles seules, trancher.
Recommandation n° 15 : Une règlementation qui s’appuie sur les retours d’expérience
– Souhaite que la réglementation française s’appuie sur des évaluations sanitaires et environnementales et que les exigences du dossier d’évaluation tiennent compte des risques encourus et des acquis de l’expérience dans les secteurs public et privé ;
– Propose de proportionner l’évaluation aux risques réellement encourus pour éviter l’absurdité actuelle où, pour des raisons historiques, certaines biotechnologies anciennes et frustes sont exemptées de procédure d’évaluation, alors que d’autres plus récentes et précises risquent de ne pas l’être ;
– Souhaite que toute décision sur l’utilisation des nouvelles biotechnologies s’appuie sur les connaissances accumulées depuis trente ans et non sur des croyances ou des partis pris. Et recommande au Gouvernent de s’appuyer sur la résolution au titre de l’article 34-1 de la Constitution intitulée « Sciences et progrès dans la République » et adoptée à l’unanimité par l’Assemblée Nationale le 21 février 2017. Celle-ci propose notamment de s’appuyer davantage sur les travaux et recommandations des académies et préconise de renforcer le rôle de l’OPECST pour mener les études d’impact avant l’examen de tout projet de loi à caractère scientifique ou technologique ;
– Recommande un investissement public conséquent sur la biovigilance, notamment sur le recensement des impacts négatifs, ainsi que sur la veille scientifique et technologique, en particulier sur les effets hors cible détectés grâce au séquençage du génome, sur les effets toxiques de certains produits, sur le contournement des résistances, sur la réduction des intrants et sur la complémentarité dans l’utilisation des biotechnologies avec les autres mesures agroécologiques.
Les rapporteurs tirent de leurs auditions, tables rondes et visites à l’étranger plusieurs conclusions résumées en dix points :
1) Ils constatent que les surfaces des PGM dans le monde augmentent régulièrement depuis leur mise en culture généralisée il y a vingt ans (180 millions d’hectares cultivés dans le monde en 2016). Les nouvelles biotechnologies vont considérablement accélérer cette tendance, avec une augmentation des surfaces, mais également avec une grande diversification des traits de caractère transférés qui seront utilisés dans d’autres types de cultures. On le constate déjà aujourd’hui dans plusieurs pays du monde qui utilisent la modification ciblée du génome pour insérer des traits de résistance contre des ravageurs à des arbres fruitiers ou à des légumes. Il y a une véritable coupure entre une partie du monde qui refuse les OGM, principalement l’Europe, et le reste du monde, qui les accepte. Cette division risque d’ailleurs de se reproduire en Europe, avec des pays qui, comme l’Espagne ou le Royaume-Unis, vont autoriser les cultures transgéniques, alors qu’un certain nombre d’autres pays s’y refusent. On risque donc de voir apparaître une Europe des biotechnologies à deux vitesses. Ce phénomène va s’amplifier avec le Brexit, puisque le Royaume-Uni est favorable aux OGM et qu’il fera probablement évoluer sa législation quand il sera sorti de l’Union européenne.
2) Après ce tour du monde des biotechnologies vertes, vos rapporteurs ont acquis la conviction que les nouvelles biotechnologies sont à la fois d’une très grande précision, d’une grande efficacité et peu coûteuses à mettre en œuvre. Jennifer Doudna, une des co-découvreuses de la technologie CRISPR-Cas9 l’a résumé en indiquant que « dans le passé, toutes les nouvelles technologies étaient des sortes de marteaux de forgeron pour taper sur les gènes, alors que maintenant on travaille avec des scalpels moléculaires, pour découper le génome ». Cela s’explique par un guide ARN qui positionne la protéine Cas à l’endroit choisi pour la coupure. Les auditions ont également toutes confirmé les termes du rapport de l’Académie des sciences américaines, qui conclut, à partir des analyses de toutes les études menées depuis vingt ans, qu’aucune preuve d’effet négatif sur la santé n’a été apportée. Le seul interlocuteur qui nous ait dit l’inverse, en Argentine, a cité l’étude de Gilles-Éric Séralini, référencée en annexe, très critiquée lors de l’audition publique de l’OPECST en 2012. La méta-analyse de toutes les données publiées a également montré qu’il n’y a pas de lien de causalité avec les problèmes environnementaux actuels. Ces mêmes experts au Brésil, en Argentine, aux États-Unis nous indiquent par contre que l’apparition de résistance aux herbicides pourrait à l’avenir poser un problème majeur, mais que cette question est susceptible d’être résolue si tous les agriculteurs appliquent des règles de bonnes pratiques agricoles.
3) Les rapporteurs pensent qu’il serait aberrant que des techniques plus précises que les mutations spontanées ou que celles utilisant des technologies aléatoires de la mutagenèse (exemptées de procédure lourde d’évaluation par l’EFSA) soient soumises à des procédures d’évaluation identiques à celles de la transgenèse. Ils proposent une réglementation en comparant les nouvelles technologies actuellement utilisées aux technologies de transgenèse (179).
4) La situation européenne vient de l’activisme d’associations qui depuis plus de vingt ans ont frappé l’opinion publique en parlant de risques sanitaires. Ce pilonnage a petit à petit produit ses effets, alors qu’aujourd’hui, avec vingt ans de recul, les agences nationales, européennes, internationales, les académies, concluent toutes à l’absence de risque sanitaire. L’autre raison qui a sans doute façonné l’opinion publique est que le consommateur n’y a trouvé aucun intérêt en matière de qualité ou de prix.
A l’inverse de ce que déclarent certaines associations comme Inf’OGM, l’OPECST est partisan d’une totale transparence, y compris pour les expériences menées par des chercheurs engagés dans le combat contre les biotechnologies, mais ne voit pas l’utilité d’étiqueter des produits qui ne sont pas des OGM et qui sont obtenus par des technologies beaucoup plus précises que celles précédemment utilisées et dont personne, en 60 ans, n’avait demandé l’étiquetage. L’OPECST n’a aucun lien avec les firmes agrochimiques, il veut seulement éviter que l’Europe des biotechnologies ne s’enlise dans des ornières administratives.
5) Le risque de domination économique est également posé mais précisément, le moyen le plus pertinent de peser sur ce débat est de ne pas laisser le monopole du développement des biotechnologies aux États-Unis, à la Chine, à l’Argentine ou au Brésil. Il est d’ailleurs paradoxal que l’Union européenne et les États membres s’accommodent de l’importation de produits génétiquement modifiés en évaluant les risques sanitaires pour la consommation humaine et animale et qu’ils refusent toute expérimentation et toute culture sur le territoire de la plupart des pays. Les rapporteurs sont persuadés que la domination économique des pays qui possèdent ces brevets est la principale question qu’il convient de se poser, alors que depuis vingt ans le battage médiatique a instauré la défiance dans les populations en mettant en avant le risque sanitaire.
6) Les rapporteurs affirment que le développement des biotechnologies doit être un exemple de progrès partagé, notamment avec les pays du sud.
7) Une des conséquences dramatiques est que la France, et notamment l’INRA, ont petit à petit perdu leur excellente position dans le domaine de la recherche, de l’expertise scientifique, ainsi que leur capacité pour peser sur ces sujets au niveau international.
8) Les rapporteurs proposent l’organisation d’un débat public sur les nouvelles technologies vertes, qui fasse à la fois le bilan de l’évaluation des impacts dus à la transgenèse et la balance entre les bénéfices et les risques de ces techniques en matière de santé, d’agriculture, de fermentation industrielle, de valorisation de la biomasse, des déchets ou des produits de la mer. Il serait plus opportun de mettre en place, comme le proposent les rapporteurs, un système de vigilance transparent qui ferait l’inventaire des incidents.
9) Les rapporteurs souhaiteraient enfin qu’une nouvelle directive européenne clarifie rapidement toutes ces questions et qu’elle conduise pour chacun des États membres au vote d’une loi fondatrice sur les biotechnologies.
10) Un autre point qui a marqué les rapporteurs est le désintérêt, voire la compromission, du monde politique sur les biotechnologies végétales. Les gouvernements successifs en ont fait une variable d’ajustement et d’adaptation dans le domaine de l’environnement. Avec trente ans de recul, les rapporteurs pensent que le fait d’avoir monté en épingle les risques en matière sanitaire et environnemental des OGM a entraîné une controverse vaine, qui a participé à la rupture de confiance pour nombre de nos concitoyens.
PROPOSITIONS POUR RÉGLEMENTER LES TECHNOLOGIES DE MODIFICATION DU GÉNOME AU REGARD DU DROIT FIXÉ PAR LA DIRECTIVE EUROPÉENNE N° 2001/18
TECHNIQUES |
INCIDENCES |
OGM OU NON ? (dir. 2001/18) |
DÉTECTABLE PAR ANALYSE |
REMARQUES |
– MUTAGENÈSE « conventionnelle » |
– modifications chimiques ou cassures, induisant des mutations |
non |
(0) |
– exclu annexe IB directive |
– MÉGANUCLÉASES – NUCLÉASES (ZN) – TALEN |
– modifications ponctuelles du génome – insertion gène au même endroit |
non |
(0) (+ si mutation connue) |
– exclu annexe IB directive – identique aux mutations spontanées |
– CRISPR–CAS9 – CRISPR–CpF1 – … |
– modifications ponctuelles du génome – insertion gène au même endroit |
non |
(0) (+ si mutation connue) |
– CpF1 : coupe ADN et ARN – candidat applications thérapeutiques |
– INTERFÉRENCE ARN |
– accent sur ARN messager |
non |
(0) (+ complexe par nécessité de connaître les cibles) |
– ne modifie pas l’ADN |
– ODM |
– mutagenèse dirigée par oligonucléotide |
non |
(0) (+ si mutation connue) |
– exclu annexe IB directive – identique aux mutations spontanées |
– CISGENÈSE |
– insertion d’un gène issu de la même plante |
non |
(0) (+ si séquence introduite connue) |
– peut parfois être obtenue par reproduction sexuée |
|
– MODIFICATION ÉPIGÉNÉTIQUE (RdDM) |
– méthylation de l’ADN |
non |
(0) (+ si cible connue) |
– peut être obtenue par reproduction sexuée |
– SÉLECTION À PARTIR D’UNE LIGNÉE TRASNGÉNIQUE |
– par exemple suppression transgène ou d’une modification par croisement |
non |
(0 + si séquence sélectionnée connue) |
– le transgène n’est plus présent – sélection inverse |
– AGRO–INFILTRATION (tissus foliaires) |
– présence transitoire et ne concernant pas les organes de reproduction |
non |
(0 +) |
– modification non transmise à la descendance |
– TRANSGENÈSE |
– insertion d’un transgène étranger à l’espèce |
oui |
(+) |
– plante GM |
– CRISPR–Cas9 ET AUTRES NUCLÉASES |
– avec insertion d’un transgène étranger |
Oui (et non si SDN3 avec cisgenèse) |
(+) si séquence sélectionnée connue |
– SDN3 plante GM |
– GREFFE |
– insertion greffon GM |
oui |
(+) |
– plante GM |
– AGRO–INFILTRATION (cellules reproductrices) |
– transgène transféré |
oui |
(+) |
– plante GM |
L’OPECST a été saisie de deux demandes spécifiques, l’une sur les vignes résistantes à l’oïdium et au mildiou et l’autre sur les huitres triploïdes.
Les rapporteurs ont souhaité aborder ces deux demandes dans le cadre du présent rapport, même si dans l’un et l’autre cas, ce ne sont pas des « biotechnologies » dans le sens le plus restreint du terme (modification de leur génome par intervention en laboratoire).
1. Les vignes résistantes à l’oïdium et au mildiou
Le sujet des vignes résistantes à l’oïdium et au mildiou résulte d’une saisine de l’OPECST par le Bureau de l’Assemblée nationale (courrier de M. Claude Bartolone, président, du 25 mars 2016) (180) :
« Conformément à l’article 6 ter de l’ordonnance du 17 novembre 1958 relative au fonctionnement des assemblées parlementaires, le Bureau a décidé, au cours de sa réunion du 23 mars 2016, à la demande de M. André Chassaigne, président du groupe de la Gauche Démocrate et Républicaine, de saisir l’Office parlementaire d’évaluation des choix scientifiques et technologiques d’une étude sur "les moyens de réduire l’utilisation des produits phytosanitaires en agriculture, plus particulièrement dans le secteur de la viticulture". Vous trouverez ci-joint le courrier de M. Chassaigne motivant sa demande. »
Une délégation de l’OPECST (MM. Jean-Yves Le Déaut, député, et Roland Courteau, sénateur), accompagnée de Mme Marie-Hélène Fabre, députée, et de M. Jacques Bascou, président de la communauté d’agglomérations du Grand Narbonne, s’est rendue sur le site expérimental de Pech Rouge, le 9 septembre 2016. Cette visite a réuni les principales parties prenantes : parlementaires, élus locaux, dirigeants et chercheurs de l’INRA, représentants des viticulteurs. Elle a permis un large débat.
Il est à noter que cette visite faisait suite à celle de MM. José Bové et Eric Andrieu, députés européens, en juin 2016, intéressés par le fait que les vignes résistantes développées par l’INRA diminuent, voire suppriment, l’utilisation de substances fongicides et notamment de sulfate de cuivre. Cette visite a d’ailleurs été suivie de celle de M. Henri Cabanel, sénateur, et plusieurs autres élus, en septembre 2016.
a. La demande de M. André Chassaigne, député, président du groupe GDR
La demande de M. Chassaigne (courrier du 14 mars 2016 au président de l’Assemblée nationale) estimait que la réduction de l’utilisation des produits phytosanitaires en agriculture était devenue un enjeu prioritaire, en raison notamment des effets de l’utilisation des pesticides sur la santé humaine et l’environnement. Présenté en janvier 2015, le plan Ecophyto II porte l’objectif de baisse de 50 % du recours aux produits phytopharmaceutiques en France à horizon de 10 ans. Sur la base de ces objectifs ambitieux, l’action des pouvoirs publics doit faciliter l’adoption et la diffusion des avancées techniques et scientifiques les plus efficaces.
Ainsi, la viticulture, qui ne représente qu’un peu moins de 3 % de la surface agricole utile, avec près de 760 000 ha de vignes, consomme en revanche près de 20 % des produits phytosanitaires utilisés dans l’agriculture (statistiques INRA).
Depuis trente ans, la recherche publique française s’est mobilisée pour apporter des solutions techniques en matière d’amélioration des plants de vigne résistants aux champignons comme le mildiou ou l’oïdium. Ces recherches menées par M. Alain Bouquet, ont donné des résultats exceptionnels, puisque la durabilité des résistances en l’absence totale de traitement est avérée dans les parcelles expérimentales de l’INRA sur le site de Pech Rouge (Aude) depuis une dizaine d’années.
Des blocages sont cependant apparus à l’INRA pour la mise en culture et la commercialisation du résultat de ces recherches. Le débat scientifique se cristallise sur la question du risque de contournement de résistance sur les cépages dit « Bousquet » et d’autres cépages résultant de recherches menées également par l’INRA à Colmar sur des plants dit « polyrésistants », mais dont les expérimentations devraient encore durer plusieurs années pour assurer un niveau de qualité de vin. À ce jour, l’INRA a refusé tout transfert de ces avancées scientifiques à plus grande échelle.
Ce blocage expose à la concurrence de la commercialisation très prochaine de variétés résistantes étrangères moins performantes et qui offrent encore moins de garanties de durabilité. Il se pourrait d’ailleurs que les cépages commercialisés par certains pays comme l’Italie et la Hongrie proviennent de variétés sélectionnées par Alain Bouquet et qui ont été échangées dans le passé.
b. L’amélioration des résistances des cépages au mildiou et à l’oïdium
Les champignons dénommés mildiou et oïdium, mais aussi black-rot, sont apparus en Europe à la fin du XIXe siècle avec l’introduction de plants de vigne américains résistants au phylloxéra. Le classement d’une vingtaine de cépages en 1955, obtenu par rétrocroisements, a été un échec en raison de leur qualité insuffisante, à l’exception du Baco blanc utilisé dans l’Armagnac. La sélection avait été médiocre et d’autres caractères ont été transférés avec le gène de résistance.
L’INRA a calculé que 35 000 tonnes de matières actives fongicides sont déversées chaque année sur les vignobles français, avec en moyenne 12 traitements par an. Cela coûte aux agriculteurs 300 millions d’euros, avec un impact sur l’environnement et la santé humaine et l’apparition de résistances.
L’INRA a développé une recherche forte en amélioration génétique de la vigne conduisant aux variétés « Bouquet » et « Resdur », avec une connaissance de la génétique des résistances et de leur provenance, ainsi que des marqueurs pour pouvoir détecter ces gènes et les combiner ou accélérer le transfert de ces gènes dans des cépages majeurs. Les méthodes utilisées étaient des méthodes de sélection classique comme le rétrocroisement assisté par marqueur. L’INRA et l’Institut français de la vigne et du vin (IFV) disposent de la collection de ressources génétiques de cépages la plus riche au monde. L’INRA travaille par création variétale de nouveaux cépages et sélection clonale issue de mutations spontanées. INRA et IFV ont créé la société Entav-International pour commercialiser les innovations variétales.
À la suite des travaux du regretté Alain Bouquet (181), chercheur à l’INRA, depuis 1974, des programmes ont permis de tester de nouveaux cépages résistants, créée par rétrocroisements à partir d’une souche apparentée au genre Vitis, Muscadinia rotundifolia, retrouvée dans le sud-est des États-Unis et totalement résistante aux champignons. D’autres plants de l’espèce Vitis ont également été identifiés comme présentant des résistances partielles plus ou moins élevées. Deux gènes de résistance au mildiou et à l’oïdium ont été isolés, plus d’autres gènes qui les stabilisent. Les loci responsables de la résistance au mildiou sont dénommées « Rpv », ceux de l’oïdium sont dénommés « Run ». Les travaux d’Alain Bouquet ont mené aux génotypes dénommés « Bouquet ». L’INRA a engagé à partir des années 2000 un programme de création variétale axé sur le couplage des résistances (dit « pyramidage ») des génotypes « Bouquet » avec des variétés inscrites au catalogue allemand (« Regent » ou « Bronner »), aboutissant aux génotypes « ResDur » (six gènes de résistance). Le passage du fond génétique sauvage d’origine à un fond génétique cultivé nécessite de 5 à 7 générations, soit de 5 à 20 ans d’efforts selon la réussite des croisements.
L’INRA rappelle qu’un premier cas de contournement de résistance au mildiou a été décrit en 2010 sur une souche appelée Lednice chez le cultivar résistant Bianca (Hongrie). Des infections naturelles d’oïdium ont été décrites en Amérique du Nord sur des plants porteurs du locus Run1 ; le contournement de Run1 par une souche d’oïdium a été confirmé par des expériences sur des plants portant le gène de résistance Run1 issu d’une vigne transgénique (2013) ou issus de croisements (2015). Des contournements de résistance partielle se sont progressivement produits pour les trois cépages allemands Regent, Prior et Bronner.
L’INRA indique qu’elle se préoccupe de la qualité des vins et des produits de la vigne. Elle entame également une diversification, avec des vins à faible degré d’alcool ou des jus de raisin (possibilité de classement en 2019). Une filière jus de raisin pourrait ainsi être créée avec des variétés moins sucrées, plus acides, à haute teneur en polyphénols et sans résidus phytosanitaires. L’INRA a donné son accord en mai 2016 pour enclencher l’inscription au catalogue de trois créations pour jus de raisin à partir de variétés « Bouquet » et leur développement en partenariat avec les viticulteurs.
c. Pourquoi l’INRA n’a pas commercialisé ces cépages ?
C’est la question que pose avec détermination le député André Chassaigne.
L’INRA a déclaré que son objectif était de créer les conditions d’un déploiement aussi rapide que possible des innovations sur le terrain, avec une accélération des créations variétales et leur déploiement opérationnel, au moyen d’une démarche de partenariat et de dispositifs de parcelles. Il s’agit pour l’INRA de mettre en marché aussi rapidement que possible du matériel à haut niveau de résistance génétique aux maladies, tout en améliorant l’efficacité de ces résistances dans le temps. L’INRA ne méconnaît pas l’offre variétale résistante étrangère (européenne), mais insiste sur la responsabilité collective de tous les acteurs, pour limiter les risques d’un effondrement et d’une perte irréversible des gènes majeurs de résistance utilisés. La position de l’INRA arrêtée en 2011 privilégie le déploiement des variétés à résistance polygénique (stratégie dite de « pyramidage ») ; les éléments issus de la littérature scientifique et des démarches expérimentales qu’elle a conduites n’ont pas été de nature à modifier sa position. L’Organisation internationale de la vigne et du vin (OIV) a d’ailleurs adopté en 2014 une résolution préconisant d’utiliser plusieurs gènes de résistance. Les stratégies de déploiement incluent l’alternance des cultures, le mélange de variétés et des pratiques agricoles adaptées. En particulier, la suppression totale des traitements peut s’avérer dangereuse et il peut s’avérer nécessaire de traiter de façon limitée.
Dans ce cadre, l’INRA a créé un observatoire sur la durabilité des résistances de la vigne aux bioagresseurs (« Oscar »). Piloté conjointement par l’INRA et l’IFV, l’observatoire permettrait d’objectiver le débat sur des arguments scientifiques, notamment en modélisant les risques de contournement. L’observatoire permettrait de mutualiser les expériences individuelles et de favoriser le transfert de connaissances entre les acteurs. Il serait chargé du recueil des données sur les agents pathogènes et de la surveillance des parcelles. L’année 2016 est consacrée à la constitution du comité de pilotage, à l’élaboration des protocoles d’expérimentation, à la définition des parcelles (12) et à l’organisation des partenariats. Le démarrage du suivi des parcelles pourrait commencer en 2017.
d. L’inscription et le classement des variétés de l’INRA en 2018
L’enjeu est l’inscription et le classement des variétés de l’INRA et de l’Institut français de la vigne et du vin – IFV (« ResDur » et « Bouquet »), mais aussi des 24 variétés déjà classées dans d’autres pays européens, avec la possibilité d’un classement temporaire.
Pour être commercialisés, les cépages doivent être inscrits et classés sur les catalogues nationaux, français et étrangers. L’inscription au catalogue officiel suppose une DHS (distinction, homogénéité, stabilité) et une VATE (valeur agronomique, technologique et environnementale). En France, le classement passe par le comité technique permanent de la sélection (CTPS) et par une commission spécialisée de FranceAgriMer.
L’évolution en 2016 du cadre règlementaire voit la séparation entre les procédures de classement des variétés et d’inscription au catalogue. Avec l’entrée en vigueur du catalogue européen, il s’agissait d’éviter le classement direct des variétés étrangères inscrites dans ce catalogue européen. Le nouveau régime met en place un régime dérogatoire aux autorisations de plantation, le classement temporaire, à des fins d’expérimentation pour l’évaluation de cépages dans un objectif de classement définitif. Ce dispositif permet la production et la commercialisation des vins à partir des cépages en cours d’évaluation, créant une sorte d’autorisation provisoire de vente de vin sans indication géographique.
L’INRA envisage l’inscription au catalogue de quatre variétés « ResDur » en décembre 2017. Ensuite les viticulteurs volontaires devront être choisis. Dans le cadre de l’observatoire des résistances, l’INRA mène des expérimentations avec différents partenaires en 2016 et en 2017. Ces expérimentations sont encadrées dans des conventions pour définir les droits et devoirs de chacun. Une demande de classement temporaire a été faite pour ces quatre cépages du programme « ResDur ». Les présentations au catalogue de deux autres séries de croisements « ResDur » sont prévues en 2020 et 2023. Pour les cépages « Bousquet », l’INRA explore encore les différentes options.
Pour résumer, l’INRA confirme sa stratégie de déploiement basée sur des variétés résistantes polygéniques et propose la création d’un observatoire sur la durabilité des résistances de la vigne. Elle accepterait de proposer l’inscription de variétés monogéniques après vérification de leur statut sanitaire et si le risque de contournement reste très faible. « L’INRA pourrait alors décider, en lien avec son partenaire IFV et la filiale Entav-International AFV-Agri-Obtentions, d’enclencher un dispositif expérimental officiel en vue d’une proposition de classement et d’inscription de certaines de ces variétés ». Ces explications sont sans doute vraisemblables, mais elles n’expliquent pas le « sur-place » constaté depuis 2011. Dans le domaine de la recherche, les rapporteurs ont écrit précédemment que l’INRA avait « baissé la garde » et pratiqué une sorte d’autocensure. On ne peut pas blâmer la direction générale parce que les ministres de l’agriculture des gouvernements successifs n’ont pas soutenu les biotechnologies. Mais il est paradoxal que des vignes obtenues par des procédés de sélection traditionnelle n’aient pas été valorisées. L’explication donnée du risque de contournement de résistance ne peut pas tout expliquer dans la mesure où précisément certains laboratoires de l’INRA possèdent une expertise mondialement reconnus sur les acquisitions de multi-résistances.
Les rapporteurs pensent donc qu’il convient de rattraper le temps perdu, car à quoi servirait-il d’être dans le peloton de tête en matière de recherche si l’on est dans le « gruppetto » en matière de transfert d’innovation.
e. Diminuer les produits phytosanitaires et les sulfates de cuivre
La viticulture est la production agricole française qui utilise le plus de produits phytosanitaires afin d’assurer une production de raisin de qualité, face à une pression parasitaire pratiquement permanente.
Une étude de l’INSERM intitulée « Pesticides : les effets sur la santé » et publiée en 2013 montre qu’en France les tonnages de pesticides vendus sont représentés pour plus de la moitié par des fongicides sur la période 1980-2007. L’utilisation importante de fongicides minéraux (à base de soufre et de cuivre) à des doses pouvant atteindre plusieurs kilogrammes par hectare de culture (sur la vigne notamment) explique en grande partie le fort tonnage de fongicides. Ainsi, de 1998 à 2007, environ 20 000 tonnes de cuivre et de soufre ont été utilisées annuellement, soit la moitié des tonnages totaux en fongicides et un quart a un tiers des pesticides totaux sur la période 1998‑2008. Les cultures françaises dans leur ensemble sont de fortes consommatrices de fongicides, notamment les cultures pérennes (dont la vigne), mais aussi les céréales à fort rendement. L’INSERM constate néanmoins que la consommation d’insecticides a fortement diminué au cours des vingt dernières années en France. Une enquête de 2006 du service Agreste du ministère de l’agriculture identifiait les 20 principales substances actives utilisées (15 fongicides, 3 herbicides et 2 insecticides acaricides).
Eurostat mesure, avec l’European Crop Protection Association (ECPA), que les quantités de pesticides utilisées varient sur la période 1995‑2003 entre 30 et 40 kg de substances actives par hectare pour la viticulture. L’ANSES a mesuré que le soufre s’utilise en fortes quantités sur les cultures, principalement sur la vigne. Une baisse importante des quantités commercialisées est néanmoins observée, puisque celles-ci passent de plus de 25 000 tonnes en 2001 à près de 15 000 tonnes en 2005. Lors de la mission confiée à Pierre-Benoit Joly pour évaluer la faisabilité de recherches sur les vignes transgéniques à l’INRA, le chiffre de 400 kg de pesticides par pied de vigne sur les 40 ans de vie du cep avait été avancé.
Il faut savoir que les vignobles bios ont l’autorisation d’utiliser les fongicides comme le sulfate de cuivre ou la bouillie bordelaise (sulfate de cuivre et chaux). Les vignes bio sont souvent plus traitées (jusqu’à 18 fois par an en 2016) que les vignes conventionnelles (7 fois en moyenne en système unique, mais cette moyenne cache des variations sont importantes) au sulfate de cuivre, pour la raison le label bio ne permet pas d’autres traitements chimiques. Sans sulfate de cuivre, aucune exploitation commerciale de vignoble bio ne serait rentable économiquement.
Pourtant, les dangers du sulfate de cuivre pour l’environnement et la santé sont connus. L’accumulation de cuivre dans les sols entraîne un appauvrissement qui est irréversible. Le cuivre est un oligoélément nécessaire à très faible dose dans l’alimentation. Il devient toxique pour l’homme avec des effets aigus au-delà de 0,3 à 1,4 g/kg de poids corporel (toxicité variant selon les spécialités), le sulfate de cuivre étant le plus toxique. Les pathologies principales sont : conjonctivite, irritation des muqueuses et de la peau, dermites, eczéma, maux de tête, mais aussi problèmes respiratoires et irritations nasales. Sans être très toxique par ingestion de faible dose telle qu’elle est préparée, la bouillie bordelaise est un produit toxique, voire très toxique s’il est inhalé. Avec l’expansion urbaine, de plus en plus de vignobles se trouvent en bordure de zones résidentielles. L’épandage de sulfate de cuivre ou de bouillie bordelaise peut devenir dangereux en fonction de la force et de la direction du vent. En mai 2014, son utilisation aurait provoqué toux, douleurs dans la gorge, picotements de la langue, irritations des yeux, nausées et mal de tête chez vingt-trois élèves de deux classes de l’école primaire de Villeneuve, près de Bourg-sur-Gironde (Gironde). L’épandage de sulfate de cuivre est également dangereux pour ceux qui le font. Les équipements de protection individuelle existent, mais combien d’agriculteurs les portent, surtout dans le sud de la France où la chaleur est importante ? Et que dire que l’image d’agriculteurs en tenue de cosmonautes vis-à-vis des touristes ?
La grande nouveauté de la période récente est le basculement des citoyens et des consommateurs vers les cultures bios, non traités, sans pesticide, ou – pour le moins – avec le moins possible de produits chimiques. En restant attentiste, l’INRA a été pris à contre-pied. Longtemps, les viticulteurs ne se montraient pas intéressés par les variétés résistantes. Cela s’explique par le mauvais souvenir des variétés hybrides d’après-guerre de basse qualité, provoquant une phobie prononcée contre ces cépages. La plupart de ces hybrides ont été arrachés. Les viticulteurs ne voulaient pas que l’on modifie leurs cépages, à leurs yeux garants de qualité. Les vins bordelais, en particulier, restaient fidèles à leur encépagement, codifié dans l’AOC. Mais récemment, sous la pression des consommateurs, des objectifs de réduction des produits phytosanitaires, les viticulteurs sont devenus demandeur de cépages résistants. Ils estiment maintenant que l’INRA ne va pas assez vite dans cette direction, voire bloque leur déploiement sur les terroirs. Les représentants des viticulteurs l’ont dit aux rapporteurs lors de leur visite sur le site expérimental Pech Rouge de l’INRA (Gruissan).
f. La demande des viticulteurs
Outre la France, les principaux acteurs européens de la sélection de variétés de raisins résistantes se trouvent en Allemagne, en Italie, en Hongrie et en Suisse. Alors que la sélection française s’était arrêtée après les hybrides de mauvaise qualité de l’après-guerre, l’Allemagne a été précurseur dans les cépages résistants, rouges (Régent) et blancs (Phoenix, Johanniter, Solaris, Cabernet blanc). Trois générations de cépages résistants se sont succédé en Allemagne en 1969 (prise de conscience), 1983 (recherche de qualité) et 1991 (diversité des gènes de résistance en raison des risques de contournement). La surface occupée par ces cépages résistants est néanmoins restés faible (8 % à 10 %).
Les obtenteurs ne sont pas tenus de dévoiler l’architecture génétique de leurs variétés, et parfois même ne la connaissent pas précisément. Un matériel génétique diffusé par l’INRA à un institut hongrois, sous condition de ne pas rediffuser, a peut-être été à l’origine des programmes italiens de vignes résistantes… Au-delà de l’Europe, la concurrence s’intensifie en Chine, en Australie, Nouvelle-Zélande, au Chili… Certains de ces pays, comme la Chine, utilisent déjà des vignes génétiquement modifiées. Ces pays copient notre savoir-faire, utilisent nos cépages résistants sans plus de précautions, se servent de noms de cépages français et… se rapprochent de la qualité française. Il y a donc une aberration à ce que nos pays utilisent nos cépages résistants, alors que ceux-ci sont refusés à nos viticulteurs.
Les viticulteurs estiment maintenant que l’INRA développe des stratégies trop prudentes et donc trop lentes, face à l’évolution de la demande des consommateurs et face à la concurrence étrangères. Le blocage date de 2009. Pour eux, il faut maintenant rassurer sur ce qu’on boit (produits phytosanitaires). Les viticulteurs estiment que le déploiement rapide des cépages résistants est devenu fondamental pour la viticulture française. Combien d’années d’expérimentations faudra-t-il attendre pour prouver l’absence de contournement ? Plusieurs syndicats professionnels de viticulteurs disent maintenant que si l’INRA ne leur propose pas rapidement des cépages résistants, ils demanderont l’inscription de cépages résistants étrangers. Il en est de même des pépiniéristes, qui, sans cépages français résistants, risquent de prendre du retard par rapport aux pépiniéristes des autres pays européens.
Les représentants des producteurs de cognac, présents à la réunion de Gruissan, ont marqué très tôt leur intérêt pour les cépages résistants. Exportant leur production à 98 %, ils ont été très tôt confrontés aux demandes des consommateurs de vins issus de vignobles non traités. Ils estiment que les cépages résistants sont leur seule solution pour respecter dans les délais l’objectif de réduction de 50 % des pesticides. Exportant également une grande partie de leur production, les producteurs de champagne sont aussi très intéressés par les cépages résistants.
Le développement des variétés résistantes de l’INRA semble suffisamment avancé aux yeux des viticulteurs pour qu’elles soient présentées, dès maintenant, au classement et à l’inscription (DHS et VATE, respectivement deux ans et six ans en théorie, mais on peut aller plus vite), à base de génotypes « ResDur » et « Bouquet » (rV6 Cabernet-Sauvignon et rV5 Marselan). L’arrêté du 9 mai 2016 établissant les modalités de classement des variétés de vignes à raisins de cuve permet une inscription provisoire avec plusieurs options : DHS seule (article 4.II) ou DHS et VATE (article 4.I).
Il convient donc de demander le déploiement rapide de mise en culture de cépages résistants, dans le cadre de l’observatoire sur la durabilité des résistances. Ce déploiement nécessite une inscription et un classement rapide des cépages déjà expérimentés par l’INRA, des espèces « ResDur » comme « Bouquet ». Bien que l’INRA semble privilégier les variétés « ResDur » (avec plus d’un gène majeur de résistance), les variétés « Bouquet », plus avancées d’un point de vue du développement et du transfert, doivent être traitées de la même façon pour faire progresser la connaissance, en allant à l’inscription dans le cadre de DHS et de l’observatoire. Les références « Bouquet » sont quelques fois qualifiées de monogénique : en fait, elles sont monogéniques en gène majeur de résistance, mais disposent de gènes secondaires actifs qui confortent la résistance. Les variétés « ResDur » ne sont d’ailleurs pas dépourvues de critiques : les premières générations qui seront inscrites fin 2017 seront de qualité mal adaptées au midi, car trop hybrides et qui plus est avec des variétés allemandes. Il ne faudrait pas attendre encore dix ans ou plus pour ce très hypothétique risque de contournement des variétés « Bouquet », qui peut être géré par ailleurs (un ou deux traitement phytosanitaire de précaution) si besoin est. C’est ce qui est déjà accepté par l’INRA dans le cas des références « Bouquet » sélectionnées pour le jus de raisin (DHS et VATE en cours). De 2009 à mars 2016, l’INRA a refusé la DHS comme la VATE sur les références « Bouquet ». Au printemps 2016, l’INRA a accepté la DHS et la VATE sur les références « Bouquet » sur jus de raison, et ouvert sa position à la DHS seule sur raisin de vin, en repoussant à terme sa décision sur la VATE. Ce déploiement des variétés « Resdur » et « Bouquet » s’effectuerait dans le cadre d’une démarche contractuelle avec les viticulteurs, portant notamment sur les pratiques agricoles, avec in fine l’obligation d’arrachage si l’apparition de résistances le nécessite.
Lors d’une conférence de presse du 16 janvier 2017, l’INRA et l’IFV ont annoncé le déploiement des variétés « ResDur » et de sept variétés « Bouquet » sous l’étroite surveillance de l’observatoire des cépages résistants. L’objectif est d’installer les variétés résistantes sur une surface significative (au moins 0,5 hectares) dans différents contextes pédoclimatiques et selon différents modes de conduite. L’engagement des interprofessions (Pays d’Oc, Languedoc, Cognac) sera matérialisé par la signature d’accords de diffusion avec l’INRA. Les procédures de demande de DHS et de VATE sont enclenchées, avec comme objectif un déploiement en 2019 et une inscription en 2022. Les rapporteurs estiment qu’il s’agit d’un premier pas qu’il convient de compléter rapidement, par l’enclenchement des procédures pour l’ensemble des variétés « Bouquet » identifiées par les comités interprofessionnels, soit en tout une quinzaine de variétés telles que présentées en septembre 2016 aux rapporteurs lors de leur visite à Gruissan.
g. Des modifications réglementaires européennes
Alors que la France a toujours été le chef de file de cadres règlementaires rigoureux depuis les années 1960, on peut s’interroger maintenant sur l’évolution l’organisation commune des marchés (OCM) vitivinicoles. En effet, l’article 93 du règlement (UE) n° 1308/2013 portant organisation commune des marchés des produits agricoles précise que les AOP proviennent exclusivement de vins issus de cépages appartenant à la seule espèce Vitis vinifera, et que les IGM proviennent de cépages appartenant à l’espèce Vitis vinifera ou de croisements de Vitis vinifera et d’une autre espèce du genre Vitis. Or l’espèce Muscadinia rotundifolia, qui contient le gène principal de résistance, est seulement apparentée à l’espèce vitis. Un hybride contenant le matériel génétique résistant de Muscadinia rotundifolia serait encore constitué de vitis à plus de 99 % à la fin d’un programme de sélection. Peut-on encore parler d’hybrides dans ce cas ? Les viticulteurs qui défendent l’évolution des règles européennes font valoir que les clones (mutations naturelles) sont permis alors que leur variation génétique est bien supérieure. Faut-il permettre par exemple un seuil minimum (97 % ?) de vitis sous condition d’un strict cahier des charges ?
L’évolution des cépages entraîne également un risque de confusion des dénominations. Plusieurs cépages étrangers se dénomment Merlot Kanthus (grec), Merlot Khorus, Cabernet Volos, Cabernet Cortis, Cabernet blanc, Cabernet noir, Sauvignon Kretos, Sauvignon Nepis, Sauvignon Rytos... Ils sont issus de croisements entre le Cabernet Sauvignon et un hybride interspécifique. Ces variétés résistantes ne sont donc pas des Merlot ou des Cabernet. On se sert manifestement de la notoriété des cépages français. Le risque est, avec la multiplication des cépages hybrides, une banalisation des termes comme Merlot, Cabernet ou Sauvignon, tous issus de terroirs français. Mais tous les viticulteurs ne sont pas d’accord, les représentants de l’IGP Pays d’Oc, par exemple, revendiquent la possibilité d’utiliser ces noms de cépage parents… L’article 2 de l’arrêté du 9 mai 2016 précité dispose que : « La proposition de dénomination de la variété de vigne par le demandeur ne doit pas pouvoir induire le consommateur en erreur. » La solution pourrait aussi passer par une règlementation européenne ou internationale (Organisation internationale du vin et de la vigne – OIV), les cépages renommés allemands ou italiens étant dans le même cas.
h. La modification ciblée du génome sur les vignes ?
L’INRA avait été précurseur en matière de développement des OGM, mais l’opposition des opinions publiques et le refus des responsables politiques ont entraîné une démotivation des chercheurs et une baisse des budgets de recherche. L’INRA ne poursuit actuellement qu’un seul projet en matière de biotechnologies, le projet Genius.
En 2016, aucun laboratoire de l’INRA n’utilisait la technologie de modification ciblée de génome CRISPR-Cas9, découverte en 2012. Pourtant, cette technologie est simple, peu coûteuse et rapide. Les raisonnements invoqués par l’INRA pour sa non-utilisation tombent jour après jour, en fonction de la vitesse de développement de cette technologie par des centaines de laboratoires dans le monde. En particulier, l’argument invoqué par l’INRA selon lequel il n’est pas possible actuellement de faire des modifications génétiques « sans trace » n’est sans doute plus valable aujourd’hui. Il conviendrait en outre d’accélérer les travaux de connaissance du génome de la vigne, encore peu recherchés.
L’INRA estime que les technologies de modification ciblée du génome (genome editing), en particulier sa dernière génération, CRISPR-Cas9, suscitent un intérêt certain. La facilité de mise en œuvre de CRISPR-Cas9 représente une véritable révolution pour l’amélioration variétale. Son potentiel d’utilisation est considérable. Les modifications ciblées sont plus « propres » que celles induites par mutagenèse chimique ou spontanée, dans la mesure où elles ne laissent pas de trace (signature) dans le génome et qu’elles sont très précises (peu, voire aucun effet hors cible). Il est possible de réaliser plusieurs mutations simultanément, permettant de travailler sur des caractères modérément complexes. Les modifications ciblées sont surtout beaucoup plus rapides (une génération) que les croisements interspécifiques. CRISPR-Cas9 permettrait donc d’accélérer les schémas de sélection et de créer de nouveaux caractères impossibles à obtenir par croisements.
Malgré ces possibilités, l’INRA estime que certaines limites de CRISPR-Cas9 doivent encore être levées pour son utilisation dans la vigne. Il faut d’abord éviter l’insertion d’un transgène, car la modification génétique ne pourrait plus être qualifiée de « propre ». Ensuite il faut obtenir une expression transitoire de la nucléase CRISPR et de son ARN guide, puis l’éliminer après modification. En outre il faut s’assurer de l’absence d’effet hors cible. Si la production de mutations de type perte de fonction est bien maîtrisée actuellement chez les plantes, il reste à maîtriser les techniques d’introduction de mutations dirigées spécifiques. En conclusion, les méthodes de modification ciblée du génome ne seraient intéressantes en sélection, pour l’INRA, que dans les cas où l’inactivation d’un gène apporterait un nouveau caractère recherché, pour des caractères à déterminisme simple et un nombre limité de gènes. Enfin la connaissance du déterminisme génétique des gènes est indispensable (on connaît aujourd’hui le déterminisme génétique de peu de caractères). Les travaux de modification ciblée du génome des vignes devront tout d’abord s’intéresser à des caractères dont l’architecture génétique est simple et connue.
Enfin, l’INRA estime que « le potentiel de la méthode Crispr-cas9 pourrait être un atout pour la sélection de la vigne, pour peu que les aspects juridiques et éthiques soient résolus, et que la société en accepte l’utilisation. Dans un premier temps, les caractères pour lesquels elle pourra être utilisée sont des caractères à déterminisme simple, qui peuvent être modifiés par des mutations de type perte de fonction, liés à la qualité et/ou à la résistance aux maladies. La première étape limitante clé à lever pour envisager l’utilisation de cette méthode pour la sélection de la vigne est la maitrise de l’expression transitoire chez la vigne du système Cas9. Nous pensons qu’en deux ou trois années, cette limite pourra être levée, compte tenu des évolutions technologiques. Entre temps, nous pourrions envisager de tester la méthodologie sur quelques gènes disponibles en produisant des plantes transgéniques. »
À plus long terme, l’INRA estime que les nouvelles technologies de modification ciblée de génome (CRISPR-Cas9) « pourraient bouleverser les processus d’innovation variétale et par voie de conséquence notre capacité à produire des vignes résistantes aux maladies et aux champignons, comme le mildiou et l’oïdium. Ceci souligne l’impérieuse nécessité de travailler sur ces technologies et d’anticiper ce qui pourra être une révolution ».
En outre, la seule façon d’introduire les gènes de résistance dans le génome des variétés qui forment l’encépagement des AOC, sans passer par l’hybridation, est le recours à la transformation génétique. Ces techniques pourraient valoriser rapidement l’excellent travail mené à Montpellier, à Gruissan (centre expérimental de Pech Rouge) près de Narbonne ou à Colmar. Dans le cas précis des vins bio, la question posée par Urs Niggli, de l’Institut de recherche de l’agriculture biologique (FIBL), est d’actualité, car peut-on continuer à mentir au consommateur en présentant comme bio un vin qui contient du cuivre, substance toxique à dose élevée et qui de plus stérilise le sol, alors que des plants de vigne résistants permettraient de faire du vin en utilisant peu ou pas de fongicide ?
Il sera ainsi possible de rendre les cépages résistants tout en conservant 8 000 ans de sélection, depuis les premières traces archéologiques de vignes à vin sauvages dans le Caucase et en Géorgie.
*
* *
Recommandation n° 16 : les vignes résistantes à l’oïdium et au mildiou, une opportunité pour les viticulteurs
Sollicité par le Bureau de l’Assemblée nationale sur les moyens de réduire l’utilisation des produits phytosanitaires dans le secteur de la viticulture, l’OPECST :
– Constate la qualité exceptionnelle des travaux de recherche de l’INRA sur la vigne tant à Bordeaux qu’à Colmar, Montpellier et Gruissan sur le site expérimental Pech Rouge. Ces travaux ont permis, par des méthodes classiques d’amélioration des plantes, de sélectionner des cépages dotés de résistance naturelle au mildiou, à l’oïdium ou à d’autres champignons ;
– Regrette que l’INRA, créateur de ces variétés résistantes au mildiou et à l’oïdium, ne les ait pas commercialisées pour continuer à atteindre les objectifs de baisse de 50 % du recours aux produits phytopharmaceutiques en France à horizon 2025. Souhaite que toutes les stratégies puissent être mises en œuvre pour réduire l’utilisation du sulfate de cuivre ;
– Demande dès 2017 d’enclencher l’inscription et le classement au catalogue officiel des génotypes INRA de vignes résistantes à l’oïdium et au mildiou « ResDur » et de l’ensemble des références « Bouquet » développées initialement par l’INRA, pour les variétés validées et demandées par les comités interprofessionnels, avec DHS (distinction, homogénéité et stabilité) et VATE (valeur agronomique, technologique et environnementale), ainsi que le déploiement des cépages correspondant auprès des viticulteurs, dans le cadre contractuel de l’observatoire sur la durabilité des résistances de la vigne mis en place par l’INRA ;
– Souhaite que l’INRA et les autres centres de recherche engagent des travaux de recherche, après débat avec tous les acteurs concernés, sur les techniques de modification ciblée du génome pour étendre rapidement les traits de résistance à l’oïdium et au mildiou à tous les cépages dont les organisations de viticulteurs en feraient la demande ;
– Propose qu’une réflexion soit menée avec la filière bio pour utiliser plutôt des vignes résistantes aux champignons que du sulfate de cuivre ;
– Recommande une évolution du règlement (UE) n° 1308/2013 portant organisation commune des marchés des produits agricoles, afin que les appellations d’origine protégée (AOP) et les indications géographiques protégées (IGP) puissent ne plus provenir exclusivement de vins issus de cépages appartenant à la seule espèce Vitis vinifera, dans le strict respect de cahiers des charges à définir, qui permettrait, avec des technologies précises, d’isoler et transférer un gène de résistance d’une espèce voisine ;
– Préconise parallèlement un renforcement des règlementations européenne (règlement n° 1308/2013) et internationale (Organisation internationale du vin et de la vigne – OIV) pour éviter les risques de confusion de dénomination des cépages tels que « Sauvignon Kretos ».
Lors d’une séance tenue au Sénat le mardi 12 mai 2015 autour des risques inhérents à l’exploitation de l’huître triploïde, au cours de laquelle M. Joël Labbé, sénateur, émit quelques réserves et inquiétudes, M. Alain Vidalies, secrétaire d’État auprès de la ministre de l’écologie, du développement durable et de l’énergie, chargé des transports, de la mer et de la pêche, a suggéré à l’OPECST de se saisir du sujet (182). Le bureau de l’Office a donc décidé de rajouter le sujet des huîtres triploïdes à l’étude des rapporteurs déjà nommés sur les enjeux… des nouvelles biotechnologies.
L’OPECST l’ayant accepté, les rapporteurs ont alors organisé, le 22 novembre 2016, une table ronde regroupant différents représentants des activités ostréicoles pour discuter des enjeux de la production des huîtres triploïdes, en présence de l’Institut français de recherche pour l’exploitation de la mer (IFREMER).
a. La demande d’évaluation issue du débat au Sénat en mai 2015
Une huître sauvage est « diploïde » quand elle est constituée d’une paire de chromosomes, elle nait en mer. L’huître « triploïde » est créée artificiellement par un processus d’ingénierie biologique, en croisant des huîtres tétraploïdes avec des huîtres diploïdes. Le patrimoine génétique n’est donc pas affecté. L’huître triploïde nait en écloserie et possède trois jeux de chromosomes au lieu de deux. Cette huitre provient donc d’une combinaison de matériel génétique inédite, donc sans recours aux biotechnologies de transgenèse ou de modification ciblée du génome (183). Il ne s’agit donc pas d’organismes génétiquement modifiés (OGM), bien que l’association Inf’OGM parle de « manipulation bien cachée ». Cette huître triploïde est de fait stérile et ne dépense plus d’énergie pour la reproduction sexuelle, raccourcissant ainsi son cycle de production de trois ans à deux. Elle a en outre l’avantage d’être « une huître quatre saisons » et de pouvoir être récoltée en été. Le consommateur apprécie ses qualités gustatives puisqu’elle est plus « gouteuse et moins laiteuse ». C’est ce qui la différencie des huîtres diploïdes qui peuvent être consommées les mois en « r », de septembre à avril, en dehors du site de reproduction sexuée.
Les huîtres triploïdes, considérées comme des organismes vivants modifiés (OVM), représentent entre 30 à 40 % de la production française et peuvent être récoltées toute l’année. Elles participent ainsi à une évolution du secteur ostréicole, en le rendant plus productif. La discussion au Sénat a posé les questions de la traçabilité de ces modifications des mollusques, de l’information des consommateurs sur la provenance et la qualité des produits qu’ils consomment, ainsi que sur les conséquences sur l’environnement.
Ce débat intervient dans un contexte de crise que traverse actuellement le secteur ostréicole Ces dernières années, un phénomène de surmortalité est apparu, qui serait notamment dû au climat, mais pourrait être aussi dû au virus herpétique OsHV-1, qui n’a cessé de se développer. Certains scientifiques ont émis l’hypothèse que l’infection virale pourrait être apparue lors de l’introduction massive des triploïdes dans le milieu.
S’agissant de l’impact environnemental, certains s’interrogent sur le risque éventuel de déséquilibre pour les écosystèmes, et se demandent si cette innovation pourrait entraîner un risque de stérilisation progressive du milieu et un affaiblissement du patrimoine génétique des huîtres et, ainsi, de leur résistance aux bactéries et aux virus.
Les huîtres triploïdes sont par principe stériles, mais des producteurs posent la question de savoir si celles-ci peuvent présenter un risque de fécondation avec le naissain sauvage et d’invasion des bassins naisseurs d’huîtres diploïdes. Comment s’assurer que la production d’huîtres triploïdes n’aboutisse pas à la disparition de l’huître naturelle ? Comment le faire sans porter atteinte à la liberté de chaque producteur de pratiquer le type d’ostréiculture qu’il souhaite ?
b. La position de l’IFREMER sur les huîtres triploïdes en mai 2016
L’IFREMER a une longue expérience de production. Les rapporteurs ont interrogé par écrit l’IFREMER pour poser les questions soulevées lors du débat au Sénat. L’IFREMER a répondu par écrit en mai 2016 (184). Concernant la surmortalité des huîtres triploïdes, l’institut constate une surmortalité généralisée des espèces bivalves (moules, coques, filon tronqué…), qui n’accrédite pas l’idée d’une situation spécifique des huîtres. Le virus herpétique OsVH-1 est apparu dans les années 1990 et une variante a été détectée en France en 2008. Une première version d’huître triploïde a été introduite au début des années 1990, puis une seconde en 2010. Par conséquent, le changement de méthode de production des huîtres triploïdes ne coïncide pas avec l’apparition de la variante du virus OsVH-1.
De plus, comme les triploïdes dépensent moins d’énergie à leur reproduction, elles sont plus robustes, en particulier en période estivale. Par ailleurs, les épisodes de mortalité massive affectent autant les diploïdes que les triploïdes.
L’IFREMER estime que la question sur la gestion de la privatisation du vivant et de ses enjeux économiques n’est pas de son ressort, pas plus que celle relative à la traçabilité des huîtres, qui est une compétence de l’Union européenne. On peut toutefois se poser la question si l’IFREMER n’est pas juge et partie, dans la mesure où d’une part, elle évalue les risques et que d’autre part elle vend les naissains.
Pour l’ex-Agence française de sécurité sanitaire des aliments (AFSSA), devenue depuis Agence nationale de sécurité sanitaire de l’alimentation, de l’environnement et du travail (ANSES), le caractère polyploïde ne constitue pas un facteur de risque sanitaire. Il ne justifierait donc pas un étiquetage spécifique car d’autres espèces comme le blé par exemple, ont évolué depuis leur forme sauvage à une paires de chromosomes, jusqu’aux formes cultivées hexaploïdes, donc à trois paires de chromosomes.
Concernant un risque éventuel de déséquilibre des écosystèmes, le COMEPRA (Comité d’éthique et de précaution) a, dans un avis rendu en octobre 2004 sur le thème « ostréiculture et biotechnologie », conclu qu’il n’y avait pas de raisons avérées de ne pas cultiver ces huîtres. Le contrôle a posteriori du réseau « Biovigilance » établit qu’il n’y a pas eu de reproduction des triploïdes.
L’IFREMER partage cette position en indiquant que les huîtres triploïdes sont peu fécondes et infertiles. Ces dernières produisent peu de gamètes, ne les émettent pas et peuvent se reproduire uniquement par fécondation artificielle (dilacération des gonades). Leur gamétogenèse est donc très faible. La reproduction des triploïdes en milieu naturel est extrêmement peu probable. De plus, un rapport rendu en 2009 au ministère de l’agriculture et de la pêche par MM. Bernard Chevassus-au-Louis, Gilles Bœuf, François Bonhomme et Michel Mathieu, tous experts extérieurs à l’IFREMER, confirme que les cas de reproductions sont quasiment inexistants et ont eu des conséquences négligeables.
c. Audition collective et contradictoire sous la forme de table ronde de l’OPECST sur les huîtres triploïdes
La table ronde organisée au Sénat le 22 novembre 2016, a rassemblé des représentants du comité national de la conchyliculture (CNC), du syndicat des écloseries et nurseries de coquillages de France (SENC), de l’association « Ostréiculteur Traditionnel », de l’IFREMER et une scientifique indépendante en microbiologie environnementale, en présence d’un représentant du ministère de l’environnement.
L’IFREMER indique que son étude intervient dans un contexte international d’augmentation des études conchylicoles, notamment concernant les animaux mollusques marins triploïdes, et d’une demande à l’initiative du ministère de l’agriculture, dans un but de soutien à l’innovation. Le but est de transmettre ces compétences aux professions concernées, avec un encadrement de la part des acteurs public. L’IFREMER a toujours été conscient que la production d’huîtres triploïdes pouvait poser des interrogations d’ordre éthique, scientifique et sociétal. Des avis extérieurs ont d’ailleurs été sollicités.
La première expertise sur les risques environnementaux liée à l’introduction d’huîtres creuses triploïdes dans le milieu naturel a été conduite par M. Bernard Chevassus-au-Louis en 1992, à la demande de la direction des pêches maritimes et de l’aquaculture (DPMA). Puis en octobre 2004, à la demande de l’IFREMER, le COMEPRA a émis un avis sur le thème ostréiculture et biotechnologies. À la suite de ces deux études, aucune raison avérée n’a été identifiée pour limiter la diffusion de ce type de produits dans les filières conchylicoles, mais les conclusions appellent à la vigilance quant à l’apparition d’huîtres triploïdes dans les naissains de captage. Un réseau de vigilance a donc été mis en place par l’IFREMER. De nouvelles expertises ont conclu à une consommation sans risque sanitaire des huîtres triploïdes, ainsi qu’à un risque très faible de croisement avec des huîtres sauvages dans la nature.
Le comité national de la conchyliculture (CNC) rappelle l’importance économique du secteur conchylicole sur le littoral français. Il insiste sur le problème que représente les vagues de surmortalités annuelles des huîtres. Lors de ces épisodes, la filière dispose de deux modes d’approvisionnement, à savoir le captage dans les naissains des huîtres naturelles et la reproduction en écloserie. Environ 40 % des entreprises du secteur travaillent avec des huîtres triploïdes et diploïdes, 20 % ne travaillent qu’avec des huîtres diploïdes et les 20 % restant n’utilisent que des huîtres triploïdes. Face aux questions que posent par les huîtres triploïdes, le CNC entreprend des démarches pour mieux protéger les ressources conchylicoles et ses activités. L’interprofession a obtenu du ministère que les sites contenant des huîtres tétraploïdes fécondes soient encadrés, afin d’empêcher leur dissémination dans un milieu ouvert. Jusqu’alors seul l’IFREMER produisait ces huîtres tétraploïdes ; aucun régime d’encadrement n’existait. Le brevet de production des huîtres tétraploïdes stériles de l’IFREMER a été racheté par le CNC, avec un droit de regard par l’interprofession. Un débat sera ouvert pour en préciser les conditions dans le cadre des prochaines réunions du secteur huître de l’interprofession.
L’association « Ostréiculteur Traditionnel » met en garde sur les propriétés de l’huître crassostrea gigas, l’huître creuse japonaise, qui font d’elle une espèce invasive. Pour la contenir, elle préconise la pêche à pied, en particulier pour des motifs touristiques, afin d’éviter les rochers couverts d’huitres. Cependant, dans les années 2000, l’apparition des écloseries a détourné les pêcheurs de cette pratique, ce qui, selon elle, porte atteinte à l’équilibre de la biodiversité sur les littoraux. L’association a déposé une requête auprès du tribunal administratif de Rennes contre l’IFREMER, pour développement de biotechnologies sans en mesurer les conséquences. L’association souhaite un étiquetage, l’établissement de statistiques précises relatives aux productions et aux ventes, ainsi qu’une traçabilité de la crassostrea gigas triploïde. Le président de l’association demande un moratoire de la production d’huître d’écloserie diploïdes et triploïdes.
Le syndicat des écloseries et nurseries de coquillages de France (SENC) rappelle les opérations de biovigilance pour surveiller les huîtres triploïdes, les différentes études qui sont conduites sur ces huîtres, ainsi que la grande part que représentent les huîtres triploïdes dans l’économie ostréicole française. Le syndicat rappelle aussi l’étude de la fondation pour la recherche sur la biodiversité concluant qu’aucune étude scientifique n’a à ce jour établi que l’huître triploïde était une menace pour la biodiversité. Les huîtres triploïdes sont cultivées au même titre que les huîtres sauvages dans de nombreux pays, comme la Nouvelle-Zélande, l’Australie, le Japon ou les États-Unis. Issues d’écloseries, elles répondent souvent à un besoin, du fait de difficultés de récoltes d’huîtres de naissain, après des épisodes de surmortalité. Le syndicat met en garde contre les « idéologies » qui pourraient casser une dynamique qui classe la filière ostréicole parmi les plus performantes au monde. Il faut également rappeler que les huîtres portugaises ont pratiquement disparu de nos côtes et que l’huître japonaise dite crassostrea gigas, dont certains préconisent de récolter le naissain de manière traditionnelle, n’est pas une huître autochtone.
L’IFREMER rappelle que l’huître creuse, lors de son importation initiale du Japon, ne se reproduisait que dans des bassins très localisés et qu’elle a commencé à devenir invasive lorsque la température de l’eau de mer a augmenté. Alors qu’on ne la trouvait qu’au sud de la Loire, on en découvre aujourd’hui jusque dans les îles Shetland. Cependant, ce problème est indépendant de l’ostréiculture en écloserie.
Pour le CNC, la pêche à pied a été revalorisée à la suite des épisodes de surmortalités d’huîtres dans les naissains. Les écloseries ont alors représenté une solution parallèle tout aussi utilisée. Mais pour le SENC, au contraire, la pêche à pied a été trop intensive et il a fallu la réguler. Les écloseries représentent donc une solution parallèle qu’il faut bien sûr soutenir.
Les équipes Labéo du laboratoire Frank Duncombe travaillent sur la surmortalité des huîtres en Normandie depuis 2008. Celles-ci précisent qu’on ne peut pas aujourd’hui établir de lien de causalité entre la surmortalité des huîtres et l’introduction de triploïdes dans le milieu naturel. Ce qui est établi, c’est que la surmortalité des naissains est due à un virus, alors que la surmortalité des huîtres adultes est causée par une bactérie. En ce qui concerne les naissains, il n’y a pas de différence de mortalité entre les huîtres diploïdes et les huîtres triploïdes. En revanche, chez les adultes, on constate une surmortalité des triploïdes par rapport aux diploïdes, sans distinction de leur provenance (naissain ou écloserie). Ce résultat contredit les précédentes études qui établissaient que les triploïdes étaient plus résistantes grâce à leur gamétogenèse moins importante, qui leur permettait d’allouer plus d’énergie à combattre les bactéries et les virus. Il avait été observé que 25 % des triploïdes se comportaient comme des diploïdes au niveau de leur gamétogenèse. L’étude du laboratoire Frank Duncombe en a observé 50 %. Mais cette étude ne porte que sur la Normandie et semble contredite dans d’autres régions.
L’IFREMER a réalisé une méta-analyse de toutes ces études et a mesuré que les taux de mortalité étaient différents selon les régions observées. Dans certaines, les huîtres diploïdes avaient une plus grande mortalité que les triploïdes, dans d’autres c’était l’inverse, et dans d’autres encore les taux de mortalité étaient inchangés. L’institut appelle à la prudence et a lancé une étude pour comprendre ces résultats.
L’association « Ostréiculteur Traditionnel » a mis en garde contre la perte de diversité du patrimoine génétique des huîtres triploïdes d’écloseries, qui se reproduisent avec une moins grande diversité de partenaires que dans le milieu naturel. Introduites dans le milieu naturel, celles-ci réagiraient plus uniformément aux problèmes sanitaires rencontrés, et donc pourraient mourir toutes en même temps.
Le SENC oppose à l’association qu’il appartient au syndicat des sélectionneurs avicoles et aquacoles français (SYSAAF), qui, en partenariat avec l’INRA, encadre et valide les programmes de sélection génétique des écloseries du SENC. Pour le syndicat, il n’y a pas de déviance entre ces animaux et ceux trouvés dans le milieu naturel. Le SENC rappelle que les centres techniques régionaux ont conclu que les huîtres triploïdes, en milieu naturel, finissaient par mourir après avoir été contaminées par les huîtres diploïdes qui sont souvent les premières infectées. L’IFREMER infirme la position prise par les ostréiculteurs traditionnels. Elle fait état de la très grande diversité des patrimoines génétiques dans la nature de la crassostrea gigas, et souligne que le lot d’huîtres observé est déjà une donnée qui fait varier l’expérience, quelle que soit sa composition. L’institut dispose d’ailleurs d’outils de cryogénisation de gamètes qui permettraient de parer à une quasi-extinction de l’espèce.
L’IFREMER précise que la reproduction des huîtres triploïdes passe par la récupération des gamètes. Sans intervention humaine, le potentiel reproductible de ces huîtres est estimé à 0,06 % de celui des animaux diploïdes. En effet, ces huîtres produisent peu de gamètes et, quand ils apparaissent, ne donnent que peu de descendants. Il faut savoir aussi que, de manière négligeable, les huîtres diploïdes peuvent donner naissance à des huîtres triploïdes.
Le laboratoire Labéo signale que, durant son étude, un lot de triploïde avec la capacité de pondre en expulsant naturellement ses gamètes a été observé. Les calculs statistiques correspondant n’ont cependant pas encore été faits.
L’association « Ostréiculteur Traditionnel » s’inquiète de cette capacité des triploïdes à pondre naturellement, ainsi que de la préservation des diploïdes si les fécondations avec le triploïdes augmentent dans le milieu naturel.
La question se pose donc de savoir si les huîtres triploïdes ont un avantage sélectif. Le SENC souligne que tous les pays cultivant des triploïdes connaissent des épisodes de fortes mortalités, et que cela permet un certain équilibre vis-à-vis du caractère invasif de l’huître. Le CNC a ouvert une discussion sur les pratiques de sélections des huîtres dans la filière conchylicole et laisse aux membres de la profession le soin d’y répondre.
L’association « Ostréiculteur Traditionnel » appelle à sanctuariser les bassins naisseurs, ainsi qu’à mettre en place un étiquetage et une traçabilité des huîtres d’écloseries, au nom du principe de précaution.
Les débats ont été riches et chacune des parties prenantes a pu s’exprimer.
d. Conclusions et propositions
Les différentes réflexions et avis émis ont permis aux rapporteurs de tirer certaines conclusions et de formuler certaines propositions, qui sont les suivantes :
1° Il faut poursuivre la recherche sur la biologie des huîtres, pour déterminer les impacts réels de la triploïdie sur les mollusques et leur environnement. La biologie des huîtres n’est pas suffisamment comprise. Il faut continuer les recherches visant à comprendre les phénomènes de surmortalité, les interactions entre huîtres diploïdes et triploïdes, les naissances spontanées d’huîtres triploïdes alors qu’elles sont stériles. Beaucoup de questions restent encore sans réponse suffisante. Les actions de l’IFREMER comme des autres instituts de recherche, privés et publics, sont complémentaires.
2° Il n’a pas été établi, de façon scientifiquement prouvée, de relation de causalité entre l’élevage des huîtres triploïdes en écloseries et l’apparition de surmortalités. Ces surmortalités périodiques constituent un phénomène récurrent, constaté depuis des décennies, tant sur les huîtres que sur les autres mollusques. Les dates d’apparition de ces surmortalités ne coïncident pas avec les dates de développement des huîtres triploïdes. Ces surmortalités restent encore largement inexpliquées et les facteurs comme la température de l’eau, les pollutions maritimes ou les autres conditions environnementales seraient en cause.
3° La fertilité et la fécondité constatée sur les huîtres triploïdes, a priori stériles, restent marginales. Les experts évaluent le pourcentage de potentiel reproductible dans la nature à 0,06 %, ce qui ne permet pas de colonisation ni d’invasion. Aucune étude appuyée sur des arguments scientifiques ne corrobore donc l’idée que les huîtres triploïdes seraient invasives en milieu naturel et porteraient ainsi atteinte à la biodiversité.
4° Il semble important de conforter le réseau de biovigilance pour renforcer la sécurité. Les dispositifs d’observation des surmortalités, des fécondations et interactions entre espèces, de la fertilité des huîtres triploïdes doivent être mis en place ou renforcés. Les études menées doivent être diffusées aux différentes parties prenantes, producteurs comme consommateurs, dans un souci de transparence le plus total.
5° Il convient de réfléchir à une conservation du patrimoine génétique des différentes espèces d’huîtres. Les huîtres traditionnellement cultivées sur les côtes françaises, qui proviennent de souches portugaises, ont quasiment disparu dans les années 1970, même au Portugal. L’IFREMER devrait assurer, comme l’INRA pour les semences, une conservation systématique des différences souches d’huître à des fins de conservation du patrimoine génétique.
6° Les débats n’ont pas permis de conclure à des entraves, voire à une impossibilité de la coexistence entre les différents types d’ostréiculture : pêche à pied sur rochers, ostréiculture traditionnelle, écloseries-nurseries, bassins d’élevage... Une telle coexistence des différentes façons de faire de l’ostréiculture est donc à défendre.
7° Enfin, les rapporteurs ont été frappés par l’absence de développement des biotechnologies dans le secteur de l’ostréiculture et de la conchyliculture en particulier. Le développement des huîtres triploïdes est le résultat d’un processus de fécondation biologique, pas d’une modification biotechnologique. Le risque serait grand que d’autres pays comme l’Australie ou les États-Unis aillent plus loin et plus vite que la France dans l’obtention d’huîtres issues du génie génétique. Les programmes de l’IFREMER sont insuffisants. Or le changement climatique, les pollutions marines, les modifications de l’environnement naturel des huîtres, augmentent les risques encourus par les huîtres, qu’elles soient diploïdes ou triploïdes. En cas de crise, il serait sans doute difficile de les rendre résistantes à une bactérie ou à un virus qui serait potentiellement ravageur, pour les adapter au réchauffement climatique. Les contaminations déjà observées par des virus de l’herpès ou par des bactéries de type vibrio aestuarianus devraient pourtant nous inciter à anticiper. Nous ne sommes pas à l’abri d’une attaque virale ou bactérienne, comme celle qui a détruit les huîtres portugaises. Les nouvelles technologies de modification ciblée du génome, comme CRISPR-Cas9, constituent indéniablement l’occasion de relancer les travaux de biotechnologie sur les huîtres.
Recommandation n° 17 : les huîtres triploïdes, un traité de coexistence
À la suite d’une demande du sénateur Joël Labbé, après une table ronde consacrée à cette thématique, l’OPECST :
– Souhaite que les différents modes d’ostréiculture – bassins de nurseries-écloseries et pêche à pied traditionnelle – puissent continuer à coexister, aucun lien de causalité n’ayant été établi entre culture des huîtres triploïdes et surmortalités virales ou bactériennes, aucune preuve n’ayant été apportée de la menace contre la biodiversité que pourrait constituer une éventuelle interfertilité des huitres triploïdes avec les huîtres naturelles ;
– Demande que soient poursuivies les recherches, par l’Institut français de recherche pour l’exploitation de la mer (IFREMER) et les autres instituts de recherche publics et privés, sur les impacts réels de la triploïdie sur les mollusques et leur environnement, la biologie des huîtres n’étant pas encore suffisamment comprise ;
– Suggère que l’IFREMER mette en place un système de conservation du patrimoine génétique des différentes souches d’huîtres, sur le modèle de ce que fait l’INRA pour les semences ;
– Préconise que l’IFREMER et les autres centres de recherche saisissent l’occasion de l’apparition des techniques de modification ciblée du génome pour étudier l’évolution des espèces d’huîtres, leur adaptation au changement climatique et aux pollutions marines et les moyens de parer à une éventuelle crise sanitaire. Il faut anticiper et ne pas prendre de retard sur les recherches concernant les mollusques par rapport aux autres pays producteurs ;
– Recommande le renforcement des actions de biovigilance recensant les cas de surmortalités et de fécondation et d’interactions entre espèces d’huître ;
– Souhaite que des études d’impact sanitaires et environnementaux soient réalisées et que les résultats de ces études soient totalement transparents vis-à-vis des producteurs et des consommateurs ;
– Propose que, comme pour d’autres produits déjà commercialisés, il n’y ait aucune distinction d’étiquetage entre les huîtres diploïdes et les huîtres triploïdes, mais que le terme d’élevage pleine mer ou bassin puisse être précisé.
V. LES ENJEUX JURIDIQUES ET SÉCURITAIRES
Deux questions concernent toutes les applications des nouvelles biotechnologies : la propriété intellectuelle et la sécurité.
A. LA PROPRIÉTÉ INTELLECTUELLE DES BIOTECHNOLOGIES
La propriété intellectuelle constitue un enjeu économique important du secteur des biotechnologies. On a vu en agriculture les enjeux financiers que constituent les brevets détenus par les grandes multinationales des biotechnologies. Les nouvelles biotechnologies font l’objet d’un accroissement important de dépôts de brevets, source de disputes juridiques, pour la propriété intellectuelle de CRISPR-Cas9 et des autres techniques.
Le rachat de Monsanto par le groupe Bayer illustre le changement de stratégie par des sociétés européennes qui, par des rachats externes, vont contrôler le marché des semences et de la protection des cultures. Les rapporteurs sont, en effet, inquiets de voir quelques grandes firmes agrochimiques internationales devenir des « monstres » sur certains marchés majeurs pour demain. On sait en effet que de 2 milliards de personnes supplémentaires devront se nourrir.
La nouvelle société contrôlera le quart du marché des semences mais il y a un paradoxe à voir d’une part, la commissaire européenne à la concurrence, Mme Margrethe Vestager, s’inquiéter de la situation de monopole que pourrait acquérir ce nouveau géant, et d’autre part, constater l’inertie de ses collègues européens à l’agriculture qui font du « sur place » et qui contribuent à l’enlisement du dossier des plantes génétiquement modifiées.
Il est vrai que cet attentisme s’explique notamment par les positions allemandes et françaises. On ne peut pas d’un côté crier haro sur les concentrations et la domination des États-Unis aujourd’hui, et peut-être de la Chine demain, en faisant tout pour freiner le développement des sociétés européennes.
1. Le différend sur la propriété intellectuelle initiale de CRISPR-Cas9
Deux camps se disputent la propriété intellectuelle initiale de CRISPR-Cas9, d’un côté Emmanuelle Charpentier (en son nom propre), l’université de Californie-Berkeley de Jennifer Doudna et l’université de Vienne, qui ont publié le premier article en 2012, montrant que le complexe CRISPR-Cas9 peut coupler des morceaux d’ADN spécifique in vitro, et que ce processus est universel, et de l’autre le Broad Institute de Feng Zhang à Boston. Deux différends sont en cours, l’un devant l’United States Patent and Trademark Office (USPTO), l’autre devant l’Office européen des brevets (OEB).
Comme l’a expliqué M. Jacob Sherkow, professeur associé, New York Law School, les deux différends n’ont pas le même calendrier. Une décision majeure est intervenue aux États-Unis début 2017 (185), mais il est tout à fait probable que cela ne règle pas tous les problèmes posés. Avec les procédures d’appel, la décision finale sera rendue probablement fin 2018 ou au cours de l’année 2019. En Europe, le processus de délivrance des brevets est plus lent et prend environ cinq à sept ans. Le processus a commencé en Europe en 2014, donc la décision pourrait être rendue au plus tôt en 2019. Mais, au-delà de cette date, des appels seront possibles auprès de l’organe de règlement des différends de l’Office européen des brevets (OEB).
Les politiques de licence du Broad Institute et de l’université de Berkeley sont très différentes. Le Broad Institute s’est engagé, en cas de succès de la procédure de brevet, à accorder des licences peu élevées aux institutions académiques, ainsi qu’à délivrer des licences non exclusives pour des technologies portant sur des gènes non humains. L’université de Californie a vu ses revenus diminuer depuis plusieurs années et se tourne vers une politique de licences de brevet qui pourrait lui assurer des revenus. Traditionnellement, cette université reçoit un financement provenant de l’État de Californie, mais cet État a connu des contraintes financières très importantes. Elle a autorisé Mme Jennifer Doudna à attribuer le brevet directement à son entreprise Caribou Biosciences. Qu’une université abandonne ses droits de propriété intellectuelle au profit d’une entreprise privée, dans le but de garder sa scientifique vedette, ne s’était encore jamais vu aux États-Unis.
Le droit américain des brevets a connu une modification importante en 2013. Avant le Leahy-Smith America Invents Act, promulgué le 16 septembre 2011 et entré en vigueur le 16 mars 2013, s’appliquait le système du premier inventeur (first to invent), système unique au monde en droit des brevets. Il permettait une voie de recours par la procédure dite d’« interférence » qui permet de déterminer le premier inventeur de l’invention revendiquée et donc le droit au brevet. Les deux équipes ont déposé leur brevet sous le système du premier inventeur. Depuis 2013, le droit américain des brevets s’est calé sur les pratiques les plus communes de par le monde, en particulier en Europe, où la priorité est donnée au premier qui dépose un brevet.
Mme Emmanuelle Charpentier, directrice de l’Institut Max Planck de biologie infectieuse, rappelle qu’elle-même et Mme Jennifer Doudna ont la priorité et l’antériorité. Elle indique que c’est elle qui a eu l’idée originale et qu’elle peut le prouver avec des copies d’écran d’ordinateur et des demandes de financement antérieures même à sa collaboration avec Mme Jennifer Doudna en 2011 prouvant la fiabilité, l’efficacité et l’universalité du système CRISPR-Cas9. C’est elle qui a proposé une collaboration avec Mme Jennifer Doudna pour finaliser l’invention de CRISPR-Cas9, car elle avait besoin d’un spécialiste des structures pour envisager des recombinaisons du génome des cellules eucaryotes, alors que jusque-là d’autres développaient des kits avec les technologies TALEN ou doigts de zinc, plus difficiles à mettre en œuvre.
a. La décision de l’USPTO du 15 février 2017
L’USPTO a rendu une première décision, le 15 février 2017, donnant raison à M. Feng Zhang et au Broad Institute. À la date de rédaction du présent rapport, Mmes Emmanuelle Charpentier et Jennifer Doudna n’avaient pas encore indiqué leur intention de faire appel.
À Washington, le 15 février 2017, le tribunal de l’Office américain des brevets et des marques (USPTO) a rendu une décision sur le contentieux qui oppose le Broad Institute d’Harvard et de l’Institut de Technologie du Massachussetts (MIT) à l’université de Californie-Berkeley de Mme Jennifer Doudna, l’université de Vienne et Mme Emmanuelle Charpentier (en son nom propre). Les deux parties se disputent le brevet sur le système et les méthodes d’application de CRISPR-Cas9. En mai 2012, l’université de Californie-Berkeley de Mme Jennifer Doudna, l’université de Vienne et Mm Emmanuelle Charpentier (en son nom propre) avaient déposé une demande de brevet à l’USPTO sur l’utilisation de CRISPR-Cas9. En décembre 2012, le Broad Institute a déposé une demande de brevet pour l’application de CRISPR-Cas9 aux cellules eucaryotes (celles comprenant un noyau présentes chez les plantes, les animaux et l’homme, à l’inverse des cellules procaryotes sans noyau telles que les bactéries) via une procédure d’examen accélérée plus onéreuse. Il obtient le brevet en avril 2014, avant Mmes Doudna et Charpentier. Les deux équipes ont déposé leur brevet sous le système du premier inventeur (avant la réforme du droit des brevets américain de 2013).
Mmes Doudna et Charpentier ont donc engagé une procédure d’interférence. Selon elles, M. Zhang n’aurait jamais pu développer seul sa méthode, ce que M. Zhang ne dément pas. En effet, il allègue que sa demande ne porte que sur l’application de CRISPR aux cellules eucaryotes. Mmes Doudna et Charpentier contestaient cette application en avançant que leur invention fonctionne « pour tout type de cellule », procaryotes et eucaryotes.
La décision de l’USPTO en faveur du Broad Institute indique que l’application de l’invention CRISPR-Cas9 aux cellules eucaryotes n’était pas « évidente » à partir du travail de Mmes Jennifer Doudna et Emmanuelle Charpentier. Les juges ont estimé que la demande de brevet déposée par le Broad Institute ne causait pas d’interférence avec la demande de brevet plus large du duo Charpentier-Doudna.
Mme Jennifer Doudna relativise la victoire de M Feng Zhang et espère que son brevet aura alors un champ d’application plus large et portera sur tous les types de cellule. M. Jorge Contreras, professeur de droit de la propriété intellectuelle à l’université de l’Utah et membre du comité de gestion des règles de procédure de la propriété intellectuelle à l’Académie américaine des Sciences, considère qu’un tel brevet est envisageable. M. Jacob Sherkow, professeur associé à l’école de droit de New York, estime que le Broad Institute a obtenu des droits lui permettant d’exclure les autres d’un certain champ d’application de CRISPR, que même si l’université de Berkeley parvenait à obtenir des droits plus larges sur CRISPR, « ce brevet serait faible et ne résisterait probablement pas à des actions futures devant les tribunaux », tel qu’il l’a affirmé à l’Agence France Presse (AFP) juste après la décision de l’USPTO.
Cette décision ne concerne que la procédure aux États-Unis. La demande de brevet sur CRISPR-Cas9 déposée par l’université de Californie-Berkeley de Mme Jennifer Doudna, l’université de Vienne et Mme Emmanuelle Charpentier (en son nom propre) devant l’Office européen des brevets est toujours en cours d’examen à la date de rédaction du présent rapport. Parallèlement, des demandes de brevets ont également été déposées au plan national. Selon le Quotidien du Médecin (186), « l’Office de la propriété intellectuelle du Royaume-Uni a, par exemple, déjà accordé un brevet à l’université de Berkeley ».
b. Ce différend ne devrait pas gêner la recherche
En Europe, comme indiqué tant dans le considérant 14 de la directive 98/44/CE que dans la jurisprudence constante des chambres de recours de l’OEB, un brevet d’invention n’autorise pas son titulaire à mettre l’invention en œuvre, mais se borne à lui conférer le droit d’interdire aux tiers de l’exploiter à des fins industrielles et commerciales. Dès lors, le droit des brevets n’est pas susceptible de remplacer ni de rendre superflues les législations nationales, européennes ou internationales, fixant d’éventuelles limitations ou interdictions, ou organisant un contrôle de la recherche et de l’utilisation ou de la commercialisation de ses résultats, notamment par rapport aux exigences de santé publique, de sécurité, de protection de l’environnement, de protection des animaux, de préservation de la diversité génétique et par rapport au respect de certaines normes éthiques.
Aux États-Unis, M. George Church, professeur à la Harvard Medical School, département de génétique, confirme que les questions portant sur les brevets et les litiges ne ralentiront pas les choses, rien ne pourrait être plus rapide que le progrès de cette discipline.
Mme Jennifer Doudna, professeur à l’université de Californie-Berkeley, a la même approche. Les universités se disputent la propriété intellectuelle de CRISPR-Cas9, mais cela n’empêchera pas la recherche académique. Elle souhaite que cette technologie permette de résoudre des vrais problèmes et que ça ne soit pas empêché pour des raisons juridiques.
M. Samir Elamrani, partenaire spécialisé en propriété intellectuelle, Wilson Sonsini Goodrich & Rosati, va dans le même sens : les incidences sur les entreprises qui utilisent déjà CRISPR-Cas9 ne sont pas problématiques pour l’instant. Quand l’interférence sera résolue, cela pourrait être plus compliqué.
En ce qui concerne l’aspect thérapeutique, le premier essai sur l’homme a eu lieu au début de 2016. Les investisseurs croient que des licences dans le domaine thérapeutique seront mises à disposition, car cela serait inconcevable pour les industries de ne pas pouvoir poursuivre avec cette méthode, et un compromis sera trouvé. De plus, si l’on se réfère au tableau de la partie I, un prix Nobel a toujours été attribué lors des grandes étapes qui ont jalonné les découvertes en biologie moléculaire. Celui-ci aura peut-être pour effet de résoudre amicalement ce litige.
2. Le nombre des dépôts de brevets explose depuis 2013
Au-delà du différend sur la propriété intellectuelle initiale, l’invention de CRISPR-Cas9 a déclenché une bataille internationale de brevets de grande ampleur.
Si l’on regarde les dépôts relatifs à des inventions en biotechnologies, toutes techniques confondues (CRISPR-Cas9 et autres), auprès de l’Office européen des brevets (OEB), on constate un point d’inflexion très net en 2013.
DÉPÔTS DE BREVETS EUROPÉENS EN BIOTECHNOLOGIES (*)
(nombre et %)
2011 |
2012 |
2013 |
2014 |
2015 |
5 870 |
5 539 |
5 269 |
5 754 |
6 048 |
– 24,0 % |
– 5,6 % |
– 4,9 % |
+ 9,2 % |
+ 5,1 % |
(*) Analyse fondée sur les demandes de brevet européen déposées auprès de l’OEB (demandes européennes directes et demandes internationales (PCT) entrant dans la phase européenne).
Source : Office européen des brevets (OEB).
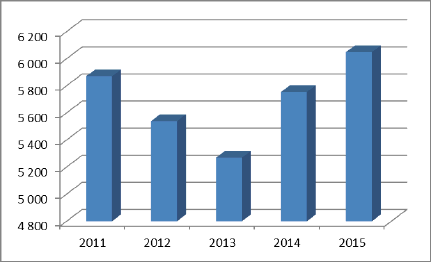
Les dix principaux demandeurs de brevets étaient en 2015 (total 6 048) : DSM (456), Hoffmann-La Roche (177), Novozymes (107), INSERM (104), DuPont (80), Bayer (61), BASF (55), Sanofi (55), Novartis (44), Qiagen (42).
Les principaux pays des demandeurs étaient : États-Unis (32 %), Allemagne (11 %), Pays-Bas (10 %), France (8 %), Japon (8 %), Suisse (6 %), Royaume-Uni (3 %) et Corée du Sud (2 %).
Lors de la mission des rapporteurs en Suisse, la société IPStudies, spécialisée en analyse, stratégie et management de brevets, a observé, depuis 2012-2013, une forte augmentation du nombre de brevets revendiquant l’utilisation du système CRISPR.
M. Fabien Palazzoli, expert de la problématique des brevets couvrant la technologie CRISPR-Cas9, société IPStudies, indique que plus d’un tiers des brevets sont chinois. Les Chinois ont une approche moins globale que les Américains ou les Européens. Ils détaillent leurs demandes de brevets, alors que les Américains et les Européens font des demandes plus larges, susceptibles d’avoir de meilleures chances de protection. Le complexe CRISPR comprend deux éléments, la protéine Cas9 et le guide ARN. Les dépôts peuvent par exemple couvrir Cas9, mutée ou non, et/ou le guide ARN et/ou l’ensemble du système et/ou des applications thérapeutiques spécifiques (Editas Medicine, CRISPR Therapeutics), ou des applications transgéniques végétales ou animales.
Une demande de brevet peut en général être rédifée pour tenter de « protéger le monde entier ». Les examinateurs pointent souvent le fait que trop de choses soient demandées pour la protection, et le brevet délivré se trouvera alors plus restreint. Quelque 40 % des demandes de brevets couvrent les cellules humaines, 35 % les cellules de mammifères et 20 % les cellules de plantes. Par exemple, des brevets ont été déposés sur les cellules T modifiées par CRIPSR ou autre technique, Editas Medicine s’y intéresse vivement pour des thérapies. Les cellules CHO expriment un anticorps thérapeutique, permettant une production de biomédicaments. Dans une stratégie pour rédiger un brevet, il faut être suffisamment flou et large, puis gêner les concurrents qui auraient besoin des licences. En Europe, un certain retard persiste, tout comme au Japon, sur les dépôts de brevets en biotechnologie.
À la suite de sa rencontre avec les rapporteurs, M. Fabien Palazzoli d’IPStudies a partagé avec eux les principaux résultats de l’étude « CRISPR Patent Landscape » (paysage des brevets sur CRISPR), qui a été actualisée au début de l’année 2017 par IPStudies (187).
IPStudies s’est intéressée à montrer l’évolution entre 2002 et 2016 des dépôts de brevets revendiquant CRISPR selon leur déposant/propriétaire (inventeur, institution académique, collaboration académique/entreprise, industrie). L’augmentation du nombre des brevets a commencé en 2013. Les dépôts ont été multipliés par 3 entre 2012 (environ 60) et 2013 (environ 200), puis par 1,8 entre 2013 et 2014 (environ 360). Les données de 2015 et 2016 ne sont pas encore complètes en raison du délai de publication de 18 mois de la plupart des juridictions.
Entre 2002 et 2016, les brevets sont principalement déposés par les catégories de déposants suivantes :
– les institutions : 707 dépôts soit 61,7 % ;
– les industriels : 358 dépôts soit 31,2 % ;
– les inventeurs individuels : 48 dépôts soit 4,2 % ;
– conjointement les industriels et les entreprises : 33 codépôts soit 2,9 %.
Les quatre déposants principaux sont, sans surprise, ceux qui revendiquent l’invention initiale du système CRISPR-Cas9 :
– Massachusetts Institute of Technology (MIT) (plus de 100) ;
– Broad Institute (plus de 80) ;
– Harvard University (plus 70) ;
– University of California (45).
Puis suivent l’Académie des sciences chinoise, les entreprises DuPont, Sangamo Biosciences, Editas Medicine et Cellectis, puis l’Académie des sciences agricoles chinoise, l’université d’agriculture chinoise, l’entreprise Dow Chemical, l’hôpital général du Massachusetts, le centre médical des enfants de Dallas, l’université de Pékin… Les rapporteurs notent que l’entreprise française Cellectis est le seul acteur français – et même européen – parmi les 33 principaux premiers déposants de brevet au monde : États-Unis (22 organismes déposant), Chine (8), France (1), Japon (1), Corée du Sud (1). Les statistiques sur les dépôts de brevets en biotechnologies et les dépôts sur CRISPR font apparaître les mêmes organismes et les mêmes pays.
Ces dépôts de brevets se distribuent en trois catégories, avec les principales (188) finalités suivantes :
– les applications : modification ciblée du génome (931), modification de cellule (539), diagnostic et thérapeutique (447) ;
– les cellules et l’organisme : cellule et organisme indéfinis (547), cellule humaine (472), cellule et organisme de mammifère (399), cellules et organismes de plantes (239) ;
– les outils moléculaires : vecteur de livraison/transmission (247), système CRISPR-Cas (234), séquence guide de l’ARN (225).
Toujours entre 2002 et 2016, parmi les dépôts de brevets CRISPR, certains comportent aussi le dépôt d’un brevet d’une autre technologie :
– Nucléases TALEN (289) ;
– Nucléases doigts de zinc (247) ;
– Méganucléases (109).
La carte ci-dessous est très instructive. Elle montre la distribution des dépôts prioritaires de brevets par pays. Le retard de l’Europe et, singulièrement, de la France, est… patent. La majorité des acteurs européens du domaine semblent en effet privilégier des dépôts prioritaires aux États-Unis, plutôt que dans leur pays d’origine.
CARTE MONDIALE DES DÉPOTS PRIORITAIRES
(CRISPR Patent Analytics 2014 - 2017)
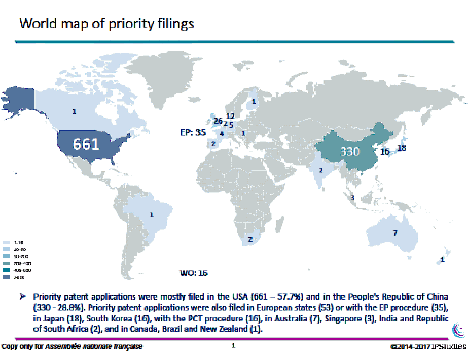
Source : ©2017 IPStudies Sarl, Switzerland.
Les dépôts prioritaires de brevets prioritaires (189) ont principalement été effectués aux États-Unis (661, 57 %) et en Chine (330, 28,8 %). Ils l’ont aussi été directement dans les États membres de l’Union européenne (53) ou avec la procédure européenne de brevet (35), au Japon (18), en Corée du Sud (16), avec la procédure « PCT » du traité de coopération en matière de brevets (16), en Australie (7), à Singapour (3), en Inde (2), en Afrique du Sud (2), au Canada (1), au Brésil (1) et en Nouvelle-Zélande (1). Là encore, on retrouve les mêmes pays à peu près aux mêmes places.
Un graphique publié sur ScienceMag.org (190), interactif sur ce site, montre la multiplicité des chercheurs, sociétés et domaines sur la propriété intellectuelle des brevets CRISPR :
Source : ScienceMag.org, 15 février 2017.
Mme Nicole Déglon, du laboratoire de neurothérapies cellulaire et moléculaire du centre hospitalier universitaire vaudois, note la persistance d’une véritable différence culturelle. L’Europe est orientée vers la recherche académique, alors que les États-Unis sont plus axés sur le business. Le schéma américain serait brevet et business puis publication, alors qu’en Europe, celui-ci se résume à publication et brevet, ce qui est problématique pour obtenir un brevet qui doit être nouveau et ne pas avoir été publié auparavant. Il faut donc d’abord déposer une demande de brevet avant de soumettre l’article en publication.
En ce qui concerne le retour sur investissement, l’hypothèse à la base de la protection par brevet est de permettre de rentabiliser la recherche et le développement qui, dans le domaine du génie génétique, peuvent impliquer des sommes considérables d’investissements à haut risque. Il convient de noter cependant que la forme et les détails des retours financiers sont réglés par le droit et les contrats de licence. Une licence négociée entre un titulaire de brevet et un tiers permet à ce dernier d’exploiter l’invention protégée par ledit brevet.
3. Que peut-on breveter dans le corps humain ?
Le cadre légal des brevets dans l’Union européenne est régi par la convention sur le brevet européen (CBE) et la directive n° 98/44/CE, qui sont deux textes très similaires, ainsi que par la jurisprudence des chambres de recours de l’Office européen des brevets (OEB).
La règle 29 de la CBE (ou l’article 5 de la directive n° 98/44/CE) différencie subtilement ce qui est brevetable de ce qui ne l’est pas dans le corps humain :
Règle 29 : Le corps humain et ses éléments
(1) « Le corps humain, aux différents stades de sa constitution et de son développement, ainsi que la simple découverte d’un de ses éléments, y compris la séquence ou la séquence partielle d’un gène, ne peuvent constituer des inventions brevetables (191).
(2) « Un élément isolé du corps humain ou autrement produit par un procédé technique, y compris la séquence ou la séquence partielle d’un gène, peut constituer une invention brevetable, même si la structure de cet élément est identique à celle d’un élément naturel.
(3) « L’application industrielle d’une séquence ou d’une séquence partielle d’un gène doit être concrètement exposée dans la demande de brevet. »
La partie (1) concerne ce qui relève d’une découverte, tandis que la partie (2) est applicable à une invention sur un élément isolé, c’est donc là que réside le critère de brevetabilité. Ainsi, la découverte de Flemming en 1928 sur la mort des bactéries dans une boîte de culture contaminée par un champignon n’est pas brevetable. A l’inverse Florey, qui en déduit la pénicilline, en 1939, obtient une invention brevetable. L’invention doit avoir une fonction déterminée pour être brevetable.
Les droits conférés par un brevet ne s’étendent pas au corps humain et à ses éléments dans leur environnement naturel.
Dans la partie (3), apparaît un autre critère de brevetabilité pour les séquences de gènes, l’application industrielle. On rappelle qu’un gène est codé par une séquence de bases azotée (A : adénine, T : thymine, G : guanine, C : cytosine). Les séquences complètes ou partielles de gènes humains sont brevetables sans distinction juridique entre les séquences naturelles et synthétiques, dès lors qu’il s’agit que ceux-ci ont une application industrielle. Mais la position des rapporteurs est qu’un gêne n’est pas brevetable en tant que tel.
La jurisprudence des chambres de recours de l’OEB montre une interprétation restrictive en ce qui concerne la brevetabilité des éléments du corps humain et des séquences de gènes humains. Moins de 17 % des demandes portant sur des séquences humaines ont été délivrées jusqu’à présent. Quelques brevets ont certes été délivrés au début sur des séquences génétiques codantes pour des protéines connues prévues pour une utilisation médicale. Mais l’OEB ne délivre pas de brevet pour les séquences sans fonction sortant du séquençage automatisé. Peu de demandes revendiquant des séquences humaines déposées avant la publication de la séquence du génome humain en 2001 ont conduit à la délivrance d’un brevet. Les brevets d’aujourd’hui tiennent compte des évolutions techniques. L’OEB ne délivre plus de brevet de portée étendue. Pour un tel brevet, il faut prouver un effet inventif. Les brevets portant sur le génome humain concernent des variants génétiques, des nouveaux procédés diagnostics, des anticorps, des biomarqueurs...
4. La dualité de la protection des plantes par brevet et certificat d’obtention végétale (COV)
Le droit européen connait deux systèmes de protection des nouvelles plantes : le brevet et le certificat d’obtention végétale (COV). À titre de comparaison, le droit américain en connait trois : le certificat d’obtention végétal, le brevet et le brevet végétal (« plant patent »). L’Office européen des brevets (OEB) gère le dépôt des brevets pour les 53 pays de l’organisation. C’est l’Union pour la protection des obtentions végétales (UPOV) qui gère les certificats d’obtention végétale (COV).
En Europe, les variétés végétales sont protégeables seulement en vertu des droits de l’obtention végétale conformément à la convention de l’UPOV et, plus précisément, au règlement (CE) n° 2100/94 du Conseil du 27 juillet 1994 instituant un régime de protection communautaire des obtentions végétales. En conformité avec l’article 53 b) de la convention sur le brevet européen – CBE (article 4 (1) de la directive n° 98/44/CE) (192), les brevets européens ne sont pas délivrés pour les variétés végétales comme par exemple la pomme Golden Delicious.
Le meilleur exemple en est une invention typique dans le domaine du génie génétique qui donne le moyen de conférer à des végétaux (on pourrait aussi dire à un ensemble végétal) la propriété voulue en insérant un gène dans leur génome. Une revendication portant sur des tomates qui contiennent le gène A pour augmenter le contenu en vitamine C ne serait donc pas exclue de la brevetabilité selon l’article 53 b) CBE. A contrario, un brevet européen ne saurait être délivré pour une pomme Golden Delicious contenant le gène B responsable pour une autre propriété. En effet, pour qu’un brevet soit délivré, il faudrait que la propriété donnée par le gène B, soit applicable à d’autres variétés que la Golden Delicious.
Cependant, selon la règle 27 b) CBE (article 4 (2) de la directive n° 98/44/CE), les inventions portant sur des végétaux sont brevetables si la faisabilité technique de l’invention n’est pas limitée à une variété végétale déterminée. Comme il est également indiqué dans le considérant 31 de la directive, un brevet ou plutôt une revendication dans laquelle il n’est pas revendiqué individuellement des variétés végétales spécifiques n’est pas exclue de la brevetabilité en vertu de l’article 53 b) CBE, même si elle peut couvrir des variétés végétales (voir décision G 1/98 de la grande chambre de recours de l’OEB). Une telle invention ne peut pas être protégée par un droit d’obtenteur, lequel est accordé pour des ensembles végétaux définis par l’intégralité de leur génome et non par des caractères individuels.
Il s’ensuit qu’en Europe, les systèmes de protection des brevets et des obtentions végétales sont complémentaires dans le sens que l’un des systèmes de protection englobe ce qui n’est pas protégeable par l’autre. L’étendue de l’exclusion de la protection par brevet est la réplique exacte de l’étendue du droit de protection des variétés végétales qui est accordé. Le droit de l’obtention végétale n’est accordé que pour des variétés végétales déterminées ; l’obtenteur doit mettre au point un ensemble végétal qui répond en particulier aux exigences d’homogénéité et de stabilité. Le brevet protège des enseignements techniques susceptibles d’être mis en œuvre sur un nombre indéfini de variétés végétales. L’inventeur dans le domaine du génie génétique ne pourrait pas obtenir une protection complète s’il était limité à des variétés végétales particulières. La protection accordée par les droits d’obtention végétale serait toujours limitée à un petit nombre de variétés, même si l’inventeur a donné le moyen d’insérer le gène dans tous les végétaux qui s’y prêtent.
En ce qui concerne l’étendue des droits conférés, il existe entre les deux systèmes quelques différences importantes relatives à la portée des exceptions qu’ils prévoient. L’exception prévue à l’article 15.1)iii) UPOV et à l’article 15 c) et d) de la directive n° 2100/94/CE permet l’utilisation d’une variété protégée afin de créer, de découvrir ou de développer d’autres variétés, y compris la commercialisation et la vente de ces autres variétés. C’est l’exception en faveur de l’obtenteur dite « large ». Dans le système des brevets, quelques lois nationales comme celles de l’Allemagne, de la France et des Pays-Bas prévoient aussi une exception aux droits du titulaire d’un brevet pour les actes accomplis aux fins de la création de nouvelles variétés sans s’étendre cependant à la commercialisation de nouvelles variétés. C’est-à-dire que la vente, par exemple, d’une nouvelle variété créée en utilisant une matière biologique protégée par brevet reste soumise à l’autorisation du titulaire du brevet. C’est l’exception en faveur de l’obtenteur dite « limitée » qui se trouve aussi dans l’article 27 c) de l’accord relatif à une juridiction unifiée en matière de brevets.
Plusieurs législations européennes prévoient en outre que les droits conférés par le brevet ne s’étendent pas aux actes accomplis à titre expérimental qui portent sur l’objet de l’invention brevetée (exception en faveur de la recherche).
Les rapporteurs souhaitent que l’Union européenne et les États membres soutiennent plus un système d’innovation ouvert, en matière de sélection végétale, adossée au certificat d’obtention végétale. C’est, à leur sens, le seul système qui favorise la recherche et valorise les ressources génétiques.
5. La question des semences replantables et « Terminator »
Le droit de l’agriculteur d’utiliser pour reproduction ou multiplication le produit de sa récolte obtenu par la mise en culture de matériel de multiplication protégé se trouve tant dans l’article 14 de la directive n° 2100/94/CE que dans l’article 11(1) de la directive n° 98/44/CE.
Mais, de fait, seules les plantes « autogames » (soja, blé…) permettent aux producteurs de garder les semences d’une année à l’autre. Pour les plantes « hybrides » (maïs, coton, tournesol…), cela n’est pas pratiqué, car cela aboutirait à une baisse de rendement entraînant une perte de recettes supérieure au coût de rachat de nouvelles semences.
La technologie de stérilisation des semences, dénommée gène « Terminator » par les medias, qui empêchent de replanter, est restée dans les laboratoires. C’est l’entreprise Monsanto qui est détentrice des brevets. Cette technologie a vite semé le trouble dans le public, qui redoutait les effets nocifs que pouvaient avoir ces semences stériles sur les petits agriculteurs dans les pays en développement. Ces agriculteurs cultivent des semences naturelles, qu’ils replantent chaque année depuis des siècles. La technologie de stérilisation était accusée de faire peser une menace sur leur subsistance et leur mode vie. Monsanto explique sur son site internet qu’elle partage bon nombre de ces préoccupations : elle s’est donc engagée, en 1999, à ne pas commercialiser de semences stériles dans le domaine des cultures alimentaires (193).
M. Gérard Lespourci, directeur général de Limagrain Argentine, précise qu’il faut distinguer les hybrides (maïs, tournesol) des plantes autogames (blé, soja). En hybride, pour conserver le potentiel de rendement, l’agriculteur rachète des semences tous les ans. Les plantes autogames peuvent être ressemées d’une année sur l’autre par l’agriculteur, lui évitant de racheter des semences. Les semences achetées et la récolte sont quasiment identiques génétiquement. Donc comment protéger la propriété intellectuelle pour assurer un retour sur investissement ? La France a établi une « contribution volontaire obligatoire ». Cela a permis le développement d’une industrie semencière. Si la France n’avait pas eu les certificats d’obtention végétale (COV) de l’UPOV et la protection intellectuelle, il n’y aurait pas eu d’industrie semencière en plantes autogame. En Argentine, la rémunération des semences des plantes autogames fait débat. Monsanto n’a pas pu protéger son soja résistant au Roundup. Cette technologie est devenue accessible aux agriculteurs argentins sans payer. La loi argentine date des années 1970. En outre, l’Argentine n’est pas signataire de la dernière convention de l’UPOV et ne dispose donc pas de son système de protection.
Monsanto a, en 2014, introduit un nouvel évènement, celui de la protection « insecte et herbicide », avec un brevet déposé en Argentine ; pour y avoir accès, l’agriculteur doit signer un contrat reconnaissant sa propriété et payer les royalties sur la récolte. Si les agriculteurs achètent 80 kilogrammes de semences pour un hectare, ils peuvent produire 3 tonnes de soja par hectare. Avec 1 hectare de récolte, on peut produire pour ensemencer 40 hectares. Le taux de certification et de protection est relativement bas en Argentine. Ainsi, Monsanto, suivant une méthode américaine, a fait signer des contrats à la filière, pour s’assurer du paiement de royalties. Bien que les agriculteurs argentins aiment la nouveauté et les technologies, ils se sont rendu compte du schéma dans lequel ils entraient, ce qui a entraîné une levée de bouclier contre Monsanto.
Les rapporteurs pensent qu’il faut trouver un juste milieu entre un système très contraignant de domination de grosses firmes agro-chimiques et un système alliant producteurs, État et industrie semencière, qui contrôle la propriété intellectuelle et soutient la recherche. Mais le plus difficile sera d’imposer cette vision aux grandes multinationales du secteur des biotechnologies.
Recommandation n° 18 : refuser la brevetabilité des gènes, soutenir un système d’innovation ouvert
– Est convaincu que c’est sur cette question de propriété intellectuelle que l’Europe aurait dû engager un bras de fer avec les grosses firmes agro-chimiques qui dominent le marché mondial de la semence ;
– Opte pour un système d’innovation ouvert adossé au certificat d’obtention végétale (COV) permettant la recherche et la valorisation des ressources génétiques ;
– Incite l’Union européenne à refuser toute brevetabilité des gènes existant déjà dans la nature, même s’ils sont obtenus par des procédés chimiques ou biotechnologiques ;
– Encourage le développement des technologies de modification ciblée du génome qui permettra à de petites entreprises de développer l’innovation dans les biotechnologies vertes, rouges ou blanches.
Un des points soulevés par les rapporteurs lors des auditions et missions est celui de la biosécurité. Ce terme recouvre deux réalités : la sécurité au sein même des laboratoires, avec les questions de confinement et de manipulations involontaires ; le bioterrorisme, qui suppose alors une utilisation malintentionnée de l’outil.
Mme Joanne Kamens, directrice générale, Addgene (194), organisation à but non lucratif, « livre des plasmides seulement à des laboratoires rattachés à une université et non à un chercheur pour son propre intérêt ou à des laboratoires officieux. Elle contrôle que tous les comptes sont affiliés à des centres de recherches. Concernant les cadres réglementaires, Addgene ne livre pas en Corée du Nord, ni à Cuba, elle a pu envoyer un plasmide en Irak, mais désormais il n’y a plus l’autorisation ».
Mme Jennifer Doudna, professeur à l’université de Californie-Berkeley, précise « qu’il sera difficile pour les « biopirates » (biohackers) de toucher à cette technologie et de faire plus que des expériences très simples, comme sur la levure par exemple. Ça n’est pas un grand danger aujourd’hui. Il y a toujours la possibilité d’avoir des « mauvais acteurs », des scientifiques qui pourraient s’en servir dans des applications non désirables, mais cela est toujours vrai en matière de technologie ».
M. Hank Greely, professeur de droit, université de Sanford, par contre, estime que « la facilité d’utilisation, le faible coût et la rapidité de CRISPR-Cas9 posent problème. Si ce qui se passe dans les institutions est contrôlé (université, centres de recherche), ce n’est pas le cas des chercheurs isolés qui utilisent CRISPR-Cas9. Les applications sur les êtres humains sont bien contrôlées mais les applications non humaines lui paraissent poser plus de problèmes. Des « biopirates » (biohackers) pourraient modifier une bactérie pour provoquer des maladies ou la mort ». Rien non plus n’exclut un accident non intentionnel provoqué sans malveillance.
Les laboratoires sont classés (niveau 1 à 4) par niveau de dangerosité croissante, avec des règles d’autorisation, de confinement et de sécurité correspondantes. L’organisation mondiale de la santé (OMS) édicte des recommandations en la matière (195). Il n’est pas du ressort du présent rapport de développer ces règles, celui-ci se limitera à examiner dans quelle mesure les nouvelles biotechnologies accroissent les risques.
La « biologie de garage » pourrait se développer grâce à la grande nouveauté CRISPR-Cas9, alors que les techniques précédentes, nécessitaient de lourds moyens d’ingénierie génétique. C’est ce qu’a confirmé le TAB, l’équivalent allemand de l’OPECST.
La commission pour l’éducation, la recherche et l’évaluation des technologies du Bundestag, présidée par Mme Patricia Lips (CDU/CSU), s’est réunie le 30 septembre 2016 pour un débat public sur « la biologie de synthèse, le genome editing et le biohacking : enjeux des nouvelles techniques génétiques » (196). Le Bureau allemand d’évaluation des choix technologiques (Büro für Technikfolgen-Abschätzung beim Deutschen Bundestag – TAB) avait présenté, en 2016, un rapport sur la biologie de synthèse, à la demande de la commission, qui a servi de base au débat.
Le rapport rappelle que le génie génétique a connu un essor important ces dernières années, notamment avec le développement de la technique CRISPR-Cas permettant des modifications génétiques précises et facilement réalisables. Ces nouvelles techniques pourraient également être utilisées dans des pays peu développés technologiquement. ».
Le « biohacking », que certains qualifient de « biologie participative », offre une alternative aux grandes institutions établies, et veut s’affranchir des monopoles des laboratoires universitaires et industriels. Le libre échange de connaissances, de méthodes et de matériel y est prépondérant. Dans le contexte du développement de la biologie participative et de CRIPSR-Cas, les scientifiques et parlementaires ont également abordé les thèmes de la biosécurité (protection contre les conséquences écologiques et sanitaires non souhaitées de la manipulation d’organismes génétiquement modifiés) et de la biosûreté (protection contre les manipulations illégales et les mésusages). Le risque bioterroriste est régulièrement l’objet de débats. Cependant, il n’existe aucun indice concret d’un manque de sécurité grave provenant de la biologie participative. En Europe, contrairement aux États-Unis, l’ouverture d’un laboratoire est soumise à des conditions strictes, ce que les représentants du « biohacking » ont critiqué : selon eux, la recherche n’est pas démocratique et les connaissances ne sont pas librement accessibles.
M. Arnold Sauter, vice-président du Bureau allemand d’évaluation des choix technologiques auprès du Bundestag (Büro für Technikfolgen-Abschätzung beim Deutschen Bundestag – TAB), estime que, concernant la « biologie de garage », CRISPR-Cas9 et autres techniques de modification ciblée sont devenues tellement faciles et peu coûteuses que cela pourrait engendrer de nouveaux problèmes. Mais il ne considère pas que les biologistes de garages puissent devenir des bioterroristes, en revanche, il est davantage question de la biosécurité, c’est à dire que quelqu’un fasse quelque chose d’involontaire et que ce soit catastrophique.
En France, le contrôle et la surveillance des activités de recherche et d’application des biotechnologies est assuré par un certain nombre d’agences dont le Haut Conseil des biotechnologies (HCB), l’Agence de biomédecine (ABM), l’Agence nationale de sécurité des médicaments (ANSM) et d’autres comités (comité d’évaluation éthique de l’INSERM, comités de protection des personnes, comité d’éthique de l’expérimentation animale…). La recherche en biotechnologies, les applications cliniques, les autorisations de culture et de mise sur le marché de variétés végétales, sont déjà parfaitement encadrées.
Les rapporteurs estiment donc qu’en France, comme en Allemagne ou dans les autres pays européens, les règles relatives aux laboratoires de recherche sont suffisamment sûres et qu’il n’est pas nécessaire de les renforcer avec l’arrivée de la technique CRISPR-Cas9.
2. Un risque accru de bioterrorisme ?
La question est toute autre des utilisations potentiellement malveillantes des biotechnologies, on pense par exemple à la création d’un virus ou d’une bactérie mutant, ou à la modification d’un moustique par forçage génétique (gene drive).
L’Allemagne et les États-Unis s’en sont préoccupés.
Le comité d’éthique allemand a émis en 2014 un avis sur « Biosécurité – liberté et responsabilité de la recherche » (197). Le comité incite les chercheurs à être attentifs et à s’engager dans les débats sur les problèmes liés à la biosécurité. En effet, pour le comité, les chercheurs sont aptes à estimer les risques potentiels et les mauvaises utilisations dans leur domaine de recherche. Il s’est prononcé pour une initiative européenne et internationale visant à encadrer les biens à « double usage » dans les sciences de la vie.
Ainsi cinq recommandations sont faites :
– élever le niveau de conscience pour les questions de biosécurité dans la communauté scientifique ;
– élaborer un code national de biosécurité pour la conduite de recherches responsables concernant qui définisse ce qui constitue une manière responsable de s’occuper des questions de biosécurité ;
– n’assurer le financement public ou privé que des recherches qui respectent le code de conduite allemand pour une recherche responsable ;
– préciser la législation allemande sur les biens à double usage dans les sciences de la vie. Les chercheurs doivent se référer à une commission interdisciplinaire ad hoc déterminant un cadre de travail et les évaluant annuellement avant de poursuivre leur recherche ;
– mener une réflexion européenne internationale conduisant à un consensus sur un code de conduite sur la biosécurité pour une recherche responsable. L’Allemagne doit promouvoir une définition internationale harmonisée des biens à double usage dans les sciences de la vie. Pour ce faire, une déclaration conjointe de l’UNESCO et de l’OMS doit précéder une convention internationale en la matière. L’Allemagne doit aussi promouvoir la création d’une commission des biens à double usage dans les sciences de la vie au niveau européen et dans tous les États membres, afin d’examiner le respect des préconditions d’une recherche responsable dans le cadre des programmes-cadres de recherche et développement.
Aux États-Unis, la CIA a souhaité, en 2016, classer CRISPR comme une arme de destruction massive. La modification ciblée du génome interpelle l’administration et les institutions en charge de la sûreté de l’Etat. Ainsi, plusieurs rapports ont été établis sur les risques potentiels de CRISPR-Cas9 ou sont en cours de rédaction. Dans ces différents documents, il est mentionné le potentiel que pourraient avoir ces nouvelles technologies si celles-ci étaient mal utilisées.
Ainsi, la CIA (Central Intelligence Agency) indiquait, en février 2016, dans son rapport annuel, que la « méthode révolutionnaire » CRISPR inquiète les services de sécurité du territoire américain. En effet, bien que son utilisation permettrait de faire avancer la médecine, d’autres utilisations plus nocives doivent être prises en considération, amenant même à considérer un outil tel que CRISPR (bien qu’il ne soit pas cité dans le texte) comme une « arme de destruction massive ». Par son coût relativement bas (à partir de 60 dollars) et la facilité d’utilisation de cet outil (une licence de biologie suffit pour le manipuler), la possibilité de créer des agents dangereux, mais aussi la possibilité de modifier les gènes, comme l’indiquait le directeur du renseignement national américain, M. James Clapper, présentent pour la CIA une véritable menace. Ainsi, le secrétaire du département de la sécurité intérieure (United States Department of Homeland Security), M. Daniel Gerstein, explique que « la biotechnologie a plus que dans d’autre domaine, un potentiel énorme pour le bien-être de l’être humain, mais la possibilité de la détourner est aussi réelle ».
Suite à ce rapport, une lettre fut adressée en ce sens au président Barack Obama, en novembre 2016. En effet, le rapport mentionnait la possibilité de créer des virus de manière volontaire, présentant un risque grandissant et sophistiqué, à hauteur des nouvelles technologies.
Par ailleurs, le Groupe de conseillers en matière de choix scientifiques et technologiques du président américain (United States President’s Council of Advisors on Science and Technology – PCAST) propose des recommandations à court, moyen et long terme. La première mesure serait la création d’urgence d’une entité chargée d’élaborer d’une stratégie de « biodéfense » nationale. Cette entité (ou interagence) aura cinq objectifs permettant aux États-Unis d’acquérir le statut de précurseur dans ce domaine et d’évaluer l’ampleur de la menace : l’analyse scientifique ; la détection des activités et des adversaires potentiels ; la biosurveillance pour détecter la présence des biomenaces ; le développement des médicaments pour se prémunir et se protéger des biomenaces ; et l’organisation de réunions interagence.
Les personnes rencontrées par les rapporteurs sont d’avis partagés.
M. George Church, professeur à la Harvard Medical School, département de génétique, estime que beaucoup d’autres technologies sont plus dangereuses que CRISPR-Cas9.
Par contre, pour M. Bill Foster, Chambre des Représentants (Illinois, démocrate), il faut aussi se poser la question des applications militaires. Aux États-Unis, la question concerne plus les virus génétiquement modifiés que les humains génétiquement modifiés. Le principe de transparence aura plus de mal à s’appliquer dans ce domaine, mais il sera absolument nécessaire, il limitera les applications militaires. Les applications militaires sur l’humain représentent un risque très effrayant sur le long terme.
M. David Liu, membre du JASON’s Group, partage ces craintes. Le JASON’s Group est un groupe de scientifiques indépendants qui conseille le gouvernement américain sur les sujets, souvent controversés, de sciences et de technologie (198). Il travaille actuellement sur les dangers des nouvelles biotechnologies, il est prévu qu’une partie du rapport final soit déclassifiée. Les nouvelles biotechnologies représentent des défis certains. Certes CRISPR-Cas9 ne facilite pas la production d’agents toxiques. Mais se pose la question de la signature des modifications génétiques et des objectifs nuisibles possibles de ces applications (santé, perturbations économiques, agriculture…). En matière de défense, il faut envisager les contre-mesures pour combattre les éventuelles utilisations offensives. Certaines technologies peuvent avoir un double usage, ainsi le forçage génétique. Le gouvernement américain a demandé aux entreprises de biotechnologies de l’aider en signalant les utilisations potentiellement dangereuses.
Comme le rappelle l’Académie des sciences française, le risque des armes biologiques et chimiques est connu depuis la première guerre mondiale. Ce risque existe encore et pourrait évoluer avec les progrès des connaissances scientifiques. La manipulation par certains centres de recherche de bactéries et de virus hautement pathogènes suscite des inquiétudes.
Comment obtenir que les connaissances en sciences de la vie soient mises exclusivement au service du bien-être général et ne contribuent pas à la prolifération de moyens de destruction ? Quelles sont les méthodes et traitements préventifs ou curatifs susceptibles de réduire le risque d’un détournement des travaux de recherche vers des applications militaires ou terroristes ? Comment concilier les impératifs de sécurité avec ceux de liberté et d’indépendance des chercheurs, indispensables à l’avancée des connaissances ?
Bien que les avancées des nouvelles biotechnologies présentent des bénéfices indéniables dans le domaine des sciences de la vie, les risques résultant d’une dissémination accidentelle ou issus d’un détournement, sont envisageables.
À la suite des recommandations du rapport de l’Académie des sciences française de 2008 « Les menaces biologiques – Biosécurité et responsabilité des scientifiques » coordonné par les professeurs Henri Korn et Patrick Berche et par le médecin général Patrice Binder, le Gouvernement a créé un conseil national consultatif pour la biosécurité (CNCB) par le décret n° 2015-1095 du 31 août 2015 (199). Il en a confié la mise en place au secrétariat général de la défense et de la sécurité nationale (SGDSN) (200). Ce conseil réunira le secrétaire général de la défense et de la sécurité nationale, des personnalités scientifiques qualifiées proposées par l’Académie des sciences, ainsi que des hauts fonctionnaires des ministères chargés des affaires étrangères, de l’enseignement supérieur et de la recherche, de la santé, de la défense et de l’intérieur.
Ce conseil s’apparente au NSABB (National Science Advisory Board for Biosecurity) américain, créé en 2005. Il se réunit pour réfléchir aux détournements possibles d’usage des sciences du vivant et aux moyens de s’en prémunir. Sur saisine des établissements publics ou reconnus d’utilité publique ayant une mission de recherche, de l’Académie des sciences ou des autorités publiques, il effectue des travaux de prospective et de veille sur les recherches à caractère dual dans le domaine des sciences de la vie. Il propose des mesures propres à assurer la prévention et la détection d’éventuelles menaces, leur traitement, l’information du public, la responsabilisation du monde scientifique et de la santé, le respect et l’amélioration des engagements internationaux. Il formule des recommandations visant à s’assurer que les progrès des sciences biologiques ne soient pas générateurs de nouvelles menaces.
Ainsi, ce conseil a pour but d’éclairer les pouvoirs publics, la communauté scientifique et la population sur les bénéfices et les risques que représentent les progrès de la recherche en sciences de la vie. Pour cela, le conseil national consultatif pour la biosécurité s’appuie sur les organismes compétents, tel que le Haut Conseil des biotechnologies (HCB), pour produire des recommandations, avis et conseils. Les axes de travaux actuels s’orientent vers les différents enjeux de la biologie de synthèse et les nouvelles techniques de modification ciblée du génome.
*
* *
Les rapporteurs proposent de conclure sur la biosécurité par les recommandations suivantes.
Recommandation n° 19 : une stratégie de défense contre le bioterrorisme
– Considère que les règles de biosécurité des laboratoires de recherche sont suffisantes et que les moyens de contrôle et d’évaluation ne nécessitent pas d’être renforcés du fait du développement des nouvelles biotechnologies ;
– Se félicite des moyens nouveaux mis en place par la direction générale de l’armement du ministère de la défense sur les techniques de détection rapide permettant de repérer la présence d’agents pathogènes ;
– Recommande de travailler en amont sur une panoplie de stratégies de défense qui pourrait être mises en œuvre dans des scenarii d’attaques bioterroristes ;
– Se félicite de la création comité national consultatif pour la biosécurité (CNCB), par le décret du 31 août 2015, mais déplore, malgré plusieurs actions de sensibilisation du Gouvernement, que des parlementaires spécialisés dans ces questions, membres de l’OPECST ou des commissions de la défense des deux assemblées, ne puissent pas contrôler notre système de riposte aux éventuelles actions bioterroristes ;
– Regrette que les liens et la coordination des travaux entre la recherche menée dans les universités et les établissements publics scientifiques et techniques, d’une part, et dans les établissements militaires, d’autre part, soient insuffisants (c’est également vrai dans le domaine de la sécurité informatique). En conséquence, propose qu’au moins dans ces deux domaines, le bioterrorisme et la sécurité des systèmes informatiques, des crédits de recherche soient affectés pour des actions communes à des pôles civils et militaires qui travailleraient en étroite coopération ;
– Souhaite toutefois qu’un point soit fait au niveau européen et international sur les risques accrus d’utilisation malveillante des biotechnologies, du fait de leur faible coût et de la simplicité d’acquisition du savoir-faire.
VI. L’ÉVALUATION DES RISQUES ET LE DÉBAT PUBLIC
A. L’ÉVALUATION DES RISQUES SANITAIRES ET ENVIRONNEMENTAUX
En France, depuis la loi du 25 juin 2008 relative aux OGM, c’est le Haut Conseil des biotechnologies (HCB) qui évalue les risques sanitaires et environnementaux liés à la dissémination volontaire d’OGM, donc de la culture d’OGM. Les risques liés aux aliments contenant des OGM sont examinés par l’Agence nationale de sécurité sanitaire de l’alimentation, de l’environnement et du travail (ANSES).
1. Le Haut Conseil des biotechnologies (HCB)
Créée par la loi du 25 juin 2008, c’est une instance indépendante chargée d’éclairer la décision publique sur toutes questions relatives aux biotechnologies.
Ses missions ont été précisées dans le décret du 5 décembre 2018. Placé auprès des ministres chargés de l’environnement, de l’agriculture, de la santé et de la consommation, il conseille les décideurs publics. La création du HCB s’est largement inspirée des recommandations des rapports de l’OPECST de 1998 et de 2005. Le HCB est le fruit de la fusion des anciennes commissions en charge du génie génétique (en charge de l’expérimentation en milieux confinés) et du génie biomoléculaire (en charge de l’expérimentation en plein champ). L’OPECST avait souhaité qu’à côté du comité scientifique, un comité éthique et social analyse les aspects sociétaux des biotechnologies.
Contrairement aux instances « classiques » d’expertise, composées exclusivement ou essentiellement d’experts scientifiques, le HCB est composé de deux comités. Son comité scientifique (CS) est composé de 40 experts reconnus pour leurs compétences scientifiques dans le champ des missions du HCB (génétique, biologie moléculaire, microbiologie, protection de la santé humaine et animale, agronomie, sciences appliquées à l’environnement, statistiques, sciences appliquées à l’environnement, éco-toxicologie). Il évalue les risques des biotechnologies pour l’environnement et la santé publique. Le comité économique, éthique et social (CEES) est composé de 33 membres (et leurs suppléants) parmi lesquels des élus et de représentants d’organisations professionnelles, de salariés, d’associations de protection de l’environnement, d’associations de défense des consommateurs et de personnalités qualifiées. Instance de débat, le CEES se prononce sur les aspects économiques, sociaux et éthiques des biotechnologies et de leurs applications. Il s’appuie pour ses travaux sur des grilles d’analyse des différents types de dossiers qu’il est amené à instruire. La loi de 2008 dispose que le CS rend des avis alors que le CEES émet des recommandations.
Le décret a demandé d’autre part que la composition du comité scientifique soit plus pluridisciplinaire. Le HCB évalue donc les risques liés à l’utilisation des biotechnologies, et notamment des OGM, avec une double approche scientifique et sociétale. Il se prononce sur leurs impacts sur l’environnement et la santé publique, ainsi que sur la surveillance biologique du territoire. Il a notamment pour compétences :
– de donner un avis aux autorités françaises et européennes sur les démarches d’autorisations d’expérimentation, de cultures ou d’utilisation d’organismes génétiquement modifiés, en milieu confiné ou en plein champ. Il éclaire la décision gouvernementale ainsi que l’ANSES lors du votre des états membres pour autoriser la culture ou l’utilisation en alimentation humaine et animale d’OGM ;
– la contribution à l’encadrement réglementaire des biotechnologies en France, en Europe ou au niveau international ;
– la surveillance environnementale de la dissémination des plantes génétiquement modifiées dans l’environnement ;
– suivant les dispositions du décret, il a d’autre part la possibilité d’éclairer la décision publique sur toutes questions du ressort des biotechnologies d’organiser l’évaluation, d’assurer la transparence, d’évaluer la coexistence des filières transgéniques ou non transgéniques, d’assurer la protection des inventions biotechnologiques.
Le HCB a donc compétence pour donner un avis sur les nouvelles techniques de sélection végétale (New Breeding Techniques – NBT) et notamment sur la modification ciblée du génome, il a d’ailleurs rendu un rapport le 20 janvier 2016 constituant une première réflexion sur les NBT. Mais deux questions majeures se posent : d’abord celle des conflits internes qui opposent les deux conseils au sein du HCB, d’autre part celle du manque de ligne directrice du Gouvernement et de l’Europe sur la qualification des technologies de modification ciblées du génome dans le panel des techniques utilisées sous le vocable général de biotechnologies vertes.
Le rapport « Agriculture – Innovation 2025 » de novembre 2015, précité, recommande une action dénommée « Mobilisant le levier génétique et les biotechnologies [Gén] » par laquelle elle « inclut aussi un volet réglementaire pour préciser les procédures d’homologation des variétés dérivées des biotechnologies (en lien avec le Haut conseil des biotechnologies [HCB] et dans le cadre européen). »
Les rapporteurs ont constaté que le HCB est en crise et ne peut plus répondre à sa mission.
2. La crise d’identité du Haut Conseil des biotechnologies
Le HCB s’est autosaisi du sujet des nouvelles techniques de sélection végétale, lors de la séance du 16 décembre 2015, et le CS du HCB a finalisé la rédaction de son avis (201). Un des membres du CS, M. Yves Bertheau, présent à cette réunion, a ensuite émis une position divergente sur certains points. N’ayant pas fait l’objet de discussion en séance, comme stipulé dans le règlement intérieur du HCB, cette position divergente a été déclarée non recevable et n’a donc pas été incluse dans l’avis.
Le 5 février 2016, M. Yves Bertheau, directeur de recherche à l’INRA, a démissionné du HCB ainsi que les représentants au CEES de sept associations (Amis de la Terre, Confédération Paysanne, Fédération nationale d’agriculture biologique, France Nature Environnement, Greenpeace, Réseau semences paysannes, Union nationale de l’apiculture française) ; celles-ci ont saisi le Défenseur des droits en octobre 2016, arguant d’un « vrai-faux avis scientifique partial », et « d’une prétendue consultation de la société civile au sein du HCB.
Le CEES a ensuite rédigé un document portant « recommandations », mais qui n’est que la compilation des positions divergentes de ses membres. Les documents des deux comités du HCB sur les nouvelles techniques de sélection, réunis en un « avis » unique, ont été publiés en janvier sur le site internet du Haut Conseil.
Plusieurs questions écrites (202) ont, par la suite, été posées au Gouvernement sur le statut juridique des nouvelles techniques de sélection ; le Gouvernement y a répondu, en rappelant la position du CS du HCB (les nouvelles techniques de sélection végétale qui peuvent être obtenus par croisement sexué ou par mutagenèse ou qui ne comportent pas de matériel héréditaire exogène ne sont pas des OGM), mais en indiquant qu’il ne s’agissait que d’un « rapport » provisoire.
« En France, le Haut Conseil des biotechnologies (HCB) a publié le 4 février 2016 le résultat d’une première étape de sa réflexion sur les nouvelles techniques de sélection. Le comité scientifique du HCB conclut que toute technique qui permet de produire une plante non distinguable d’une autre plante de même espèce, et qui aurait pu être obtenue par croisement conventionnel ou par sélection de mutants naturels ou induits, ne devrait pas faire l’objet d’une étude systématique calquée sur le modèle des OGM. C’est le cas des techniques de mutagenèse ciblée ». Pour d’autres techniques conduisant à l’insertion de gènes, le comité scientifique considère que l’évaluation des OGM devrait s’appliquer ou bien que des exemptions pourraient être envisagées au cas par cas. « Le comité économique, éthique et social du HCB a produit de son côté une synthèse des contributions des parties prenantes et des débats qui ont eu lieu sur les enjeux liés aux nouvelles techniques ».
Le HCB va poursuivre son travail afin d’approfondir certains points comme les possibilités de détection et de traçabilité, ou la brevetabilité des techniques et de leurs produits.
Le Gouvernement assure que « l’analyse du HCB sera prise en compte par le Gouvernement pour intervenir au niveau européen sur la question des nouvelles techniques de sélection. Il convient de veiller à ce que les décisions qui seront prises au niveau européen soient proportionnées aux risques et aux enjeux de ces techniques et tiennent compte de la finalité des applications qui peuvent être développées avec ces techniques ». Le Gouvernement français indique qu’il sera par ailleurs vigilant à la sécurité juridique des décisions prises au niveau européen. »
La réponse du Gouvernement à une question écrite (203) ultérieure a précisé les statuts des documents publiés par le CS et du CEES du HCB, parlant de contributions.
« Les potentialités de ces techniques sont immenses, mais les enjeux qui leur sont associés ne sont pas clairement cernés aujourd’hui. Qu’il s’agisse du domaine des procédures d’évaluation des risques, mais aussi de celui lié à la traçabilité et à la surveillance, ou encore de la propriété industrielle, leur encadrement réglementaire doit être décidé en garantissant que toutes les précautions nécessaires soient mises en œuvre ». …« Il est fondamental que tous les avis, y compris minoritaires ou divergents, soient pris en compte et portés à la connaissance de tous ». « Le Haut Conseil des biotechnologies aura à examiner l’ensemble des risques et des bénéfices apportés par cette nouvelle génération de techniques de modification du génome, et à traiter de tous les enjeux sanitaires, environnementaux, et socio-économiques impactés par l’éventuelle dissémination de ces produits ». « Enfin, il convient de préciser que, au niveau européen, cette question est en jachère, abordée sous un angle très juridique par la Commission européenne, à ce jour sans consultation des États membres ».
Le HCB a d’ailleurs tiré les conséquences du caractère provisoire des documents de janvier 2016 de ses deux comités en les déclassant sur son site internet de la rubrique « avis » à la rubrique « publications »…
La crise à laquelle se trouve confrontée le HCB n’est pas la première depuis sa création. Elle rappelle celle qui a éclaté en 2012, avec la démission
– déjà – des représentants de plusieurs organisations professionnelles pro-OGM siégeant au CEES, conséquence de l’impossibilité pour eux de s’entendre sur des questions comme la coexistence entre cultures OGM et non-OGM ou des sujets hors du champ de compétence du HCB (destructions de cultures transgéniques, décision du Gouvernement de maintenir l’interdiction de mise en culture du maïs MON810). Cela a paralysé l’activité du HCB jusqu’à la fin de son premier mandat (avril 2009 – avril 2014), et a retardé de près d’un an le début de son second mandat, intervenu seulement début 2015. Il aura fallu que le décret du 1er septembre 2014 fixe une nouvelle composition du CEES. Ces changements n’ont visiblement pas permis l’évolution souhaitée vers un effort de dialogue plus constructif.
3. Le rôle de l’Agence nationale de sécurité sanitaire de l’alimentation, de l’environnement et du travail (ANSES) : la sécurité alimentaire des produits autorisés à l’importation
La sécurité alimentaire est, depuis 2003, du ressort européen, avec l’Autorité européenne de sécurité des aliments (EFSA) (204). Toutefois, les États membres ont la possibilité d’évaluer ces dossiers. Selon la législation européenne, les industriels doivent soumettre une demande d’autorisation de mise sur le marché, fournissant les éléments nécessaires à une évaluation des risques pour examiner la sécurité de l’OGM et des denrées alimentaires ou aliments pour animaux qui en sont dérivés. L’ANSES ne se prononce donc que sur l’aspect de sécurité des aliments contenant des OGM ou des produits dérivés destinés à la consommation animale et humaine. Elle fournit des analyses scientifiques indépendantes aux ministères concernés. Sur la base de ces avis, qui éclairent la France en matière sanitaire, notamment lors du vote des États membres pour autoriser la mise sur le marché européen, la France transmet ses remarques à l’EFSA.
Le site d’Angers a été désigné laboratoire national de référence pour la détection des OGM.
Les rapporteurs se félicitent de la réforme de 2003 qui a dévolu à l’EFSA la responsabilité de l’évaluation sanitaire des plantes transgéniques. Il regrette qu’une méta-analyse du risque sanitaire, basée sur la compilation de tous les résultats scientifiques, n’ait pas été demandée par le Gouvernement, ce qui aurait permis de mieux anticiper sur l’affaire Séralini et d’infléchir certaines décisions gouvernementales depuis 2008.
L’ANSES a d’ailleurs une position claire sur l’affaire Séralini, indiquant qu’il y avait eu surinterprétation des résultats. Les rapporteurs pensent toutefois qu’une meilleure coordination des rôles assignés en France au HCB et à l’ANSES pourrait optimiser l’efficacité du dispositif. Il n’est pas souhaitable de laisser perdurer ces querelles qui nuisent à la crédibilité de cette filière.
Recommandation n° 20 : les autorisations à l’Agence nationale de sécurité sanitaire de l’alimentation, de l’environnement et du travail ANSES, en lien avec l’’Autorité européenne de sécurité des aliments (EFSA)
– Propose que la loi modifie les missions des deux comités actuels du Haut Conseil des biotechnologies (HCB) ;
– Recommande, par souci de cohérence et de simplification, le transfert de toutes les missions confiées aujourd’hui au comité scientifique du HCB à l’Agence nationale de sécurité sanitaire de l’alimentation, de l’environnement et du travail (ANSES). Le HCB sera constitué d’un collège unique. Il anime le débat entre les acteurs, fait un état régulier de la situation sanitaire et environnementale, évalue les données sur la biovigilance et propose des évolutions éventuelles de l’encadrement règlementaire ;
– Demande à la France de soutenir une réforme des procédures européennes de « comitologie », pour que les décisions concernant les OGM, et plus généralement les produits issus des biotechnologies, soient effectivement prises par les ministres concernés réunis en conseil, et non par des représentants des États membres. Au niveau européen, les difficultés rencontrées sont dues au fait que souvent les Etats membres ne se prononcent pas ou s’abstiennent, ne prenant pas de position claire sur des sujets controversés, et se défaussant de fait de leurs responsabilités sur le conseil des ministres. Préconise d’autre part une totale transparence en rendant publics les avis ;
– Suggère que le niveau de technicité du dossier à fournir pour évaluer des plantes modifiées par les nouvelles biotechnologies soit fonction des règles édictées par l’Union européenne et les États membres. Souhaite que le Gouvernement et l’Union européenne tiennent compte, dans ce dossier, de l’expérience et du recul acquis dans l’utilisation de ces techniques depuis des dizaines d’années.
B. LA DIFFICULTÉ DU DÉBAT PUBLIC SUR LES BIOTECHNOLOGIES
L’arrivée des nouvelles biotechnologies, avec les enjeux qui ont été précédemment décrits, nécessite un large débat public. La première question qui se pose, s’agissant de toute nouvelle technologie, est de savoir quand entamer ce débat public. Les rapporteurs estiment indispensable que ce débat ait lieu dès maintenant, même si on en est encore très largement à la phase de recherche sur ces technologies de modification ciblée du génome, même si les premières applications – médicales ou alimentaires –, commencent seulement à arriver et sont encore loin d’être opérationnelles. Faute de quoi, le débat risquerait d’être confisqué par les opposants, comme cela a été le cas précédemment sur d’autres thèmes importants (OGM, nucléaire…). La presse grand public s’est déjà amplement saisie du sujet de la modification du génome par la technique CRISPR-Cas9, mais cela ne constitue qu’une sensibilisation. Nos concitoyens ont droit à une information complète, ils doivent pouvoir être entendus et contribuer au débat, avant que les décisions ne soient prises.
Il aurait évité que le débat public soit accaparé par des opposants systématiques.
Comme cela a été vu précédemment, sur des sujets comme les thérapies géniques (bioéthique) ou les nouvelles techniques de sélection végétale (OGM ou pas ?), le risque est grand que le débat public soit approprié par ceux qui ont légitimement peur des dérives éventuelles mais qui traduisent cette peur par le principe d’inaction, en voulant empêcher la recherche. En effet, en France, on constate une accaparation du débat public par ceux qui défendent des positions extrêmes, ne laissant plus de place au citoyen pour y participer, ne lui permettant pas de se forger une opinion. Les rapporteurs notent que la presse grand public a tendance à relayer les peurs et les craintes, comme ce rapport le montre en citant Le Nouvel Observateur ou Médiapart.
Au terme de quinze mois d’étude, les rapporteurs ont noté que, si les biotechnologies à usage médical pour l’homme sont bien acceptées dans l’opinion publique, les biotechnologies dans l’agriculture font l’objet d’un fort rejet, de la part de la population française et européenne. Pourtant, ce sont les mêmes technologies. Les médicaments issus du génie génétique, communément dénommés « biomédicaments » ou « médicaments biologiques », sont apparus à la fin des années 1970, et sauvent quotidiennement de nombreuses vies humaines, soignent des millions de personnes dans le monde : anticorps monoclonaux, facteurs de croissance, insuline… Ils constituent des avancées majeures pour lutter contre des maladies chroniques graves ou invalidantes telles que certains cancers, les déséquilibres thyroïdiens, les insuffisances rénales, l’hématologie ou encore le diabète. Huit nouveaux médicaments sur dix autorisés sur le marché sont des biomédicaments. Les techniques de modification ciblée du génome vont très certainement permettre d’en concevoir d’autres encore (205). D’ailleurs, des manifestations contre ces médicaments n’existent pas, pas plus que des slogans du type « stop biomédicaments », sur le modèle de « stop OGM ». Nos concitoyens veulent bien prendre des risques pour se soigner, mais pas des risques pour manger.
Cela fait maintenant vingt ans que, dans des pays comme les États-Unis, le Brésil ou l’Argentine, des aliments issus de plantes OGM sont consommés par des animaux et par des êtres humains et aucun des problèmes sanitaires prédits n’a jamais été constaté, qu’aucune des catastrophes environnementales annoncées ne s’est produite. Du soja et du maïs modifiés sont utilisés pour l’alimentation animale en provenance du continent américain dans tous les pays d’Europe. Les consommateurs ne savent pas que les fromages d’appellation d’origine protégée (AOP) sont sans doute produits avec des vaches ayant mangé du maïs OGM importé, que le soja OGM importé, plante riche en protéine, est utilisée dans l’alimentation d’animaux comme les poulets, cochons, lapins, canards ou veaux.
Les rapporteurs ont eu la surprise de découvrir que, pendant la discussion du projet de loi relatif à la biodiversité (206), des amendements avaient été déposés tendant à clore une discussion avant qu’elle n’ait commencé. En effet, deux amendements ont été déposés, au Sénat (207), puis à l’Assemblée nationale (208) et dans des termes identiques ; ce qui signifie pour les connaisseurs de la technique parlementaire qu’ils avaient la même origine, émanant d’un lobby :
« II. – L’article L. 531-2 du code de l’environnement est complété par un alinéa ainsi rédigé :
« Les produits issus d’une ou de plusieurs nouvelles techniques de modification génétique d’une manière qui ne s’effectue pas naturellement par multiplication ou recombinaison naturelles et qui n’ont pas fait l’objet d’une utilisation traditionnelle sans inconvénient avéré pour la santé et l’environnement ne peuvent en aucun cas être exonérés de l’application des dispositions du présent titre et des articles L. 125-3 et L. 515-13. »
Or il est de la compétence de l’Union européenne de définir ce qu’est un organisme génétiquement modifié (OGM) au regard du droit européen, pas du Parlement français, ni d’ailleurs d’aucun autre parlement national. Et on ne peut arguer du fait que la Commission européenne repousse sans cesse son interprétation de la directive n° 2001/18 pour décider à sa place… En outre, ces amendements auraient sans doute été censurés par le Conseil constitutionnel, l’article 45 de la Constitution disposant que tout amendement doit avoir un lien, même indirect, avec le texte en discussion et que les plantes issues de ces techniques ne modifient pas la biodiversité, comme nous l’avons démontré.
À peu près au même moment, en mars 2016, M. José Bové, député européen, cofondateur de la confédération paysanne et ancien porte-parole de Via Campesina, organisait à Bruxelles un colloque intitulé « Nouvelles techniques de sélection : OGM cachées ? » (209). En lisant le programme du colloque, on constate que neuf organisateurs (M. José Bové, M. Bart Staes et Mme Maria Heubuch, députés européens) ou invités (M. Yves Bertheau, chercheur à l’INRA, démissionnaire du HCB, et des représentants d’IFAOM (210), Via Campesina, TestBiotech, ENSSER (211), Réseau semences paysannes et Corporate Europe Observatory) sont tous de tendance anti-OGM, contre trois représentants d’institutions (agence environnementale autrichienne, EFSA, Commission européenne) et un avocat spécialiste du droit des brevets. On ne peut parler de débat réellement contradictoire et on n’assure pas ainsi la pleine et entière information des citoyens.
Le domaine médical, bien que dans une mesure moindre, n’est pas exempt de ces polémiques. Certaines associations, comme Alliance Vita, sont opposées aux avancées de la médecine pour des raisons de refus global des technologies d’assistance médicale à la procréation et de recherche sur les cellules souches embryonnaires. Mais le diagnostic préimplantatoire (DPI) est autorisé en France depuis 1999 (212) ; bien encadré, il n’a pas fait l’objet des détournements ni des débordements que ses opposants craignaient. Depuis la révision de la loi de bioéthique de 2013, la recherche sur les cellules souches embryonnaires est autorisée en France, encadrée par l’Agence de la biomédecine (ABM). Elle peut être menée à partir d’embryons surnuméraires conçus dans le cadre d’une procréation médicalement assistée (PMA) ne faisant plus l’objet d’un projet parental. Les détracteurs de cette loi ne peuvent que constater que ces recherches ont été menées dans le strict respect de la loi.
Peut-on continuer à tolérer, en France, État de droit et de démocratie, les actions illégales de « faucheurs volontaires » de plantations OGM, qui détruisent en une nuit le résultat de travaux de recherches engagées depuis plusieurs années et qui ont envahi les laboratoires de l’INRA qui travaillaient sur les nouvelles techniques de modification ciblée du génome ? De la même manière, peut-on accepter les « faucheurs volontaires de débats publics », qui empêchent que se tiennent des réunions publiques, où justement les citoyens peuvent s’informer ? L’obstruction d’un petit nombre d’opposants déterminés aux réunions de la Commission nationale du débat public (CNDP), en 2009 sur les nanotechnologies ou, plus récemment, en 2013 sur le centre de stockage réversible profond des déchets radioactifs (Cigéo) (213), a empêché tout débat. Comment pourrait-on renouveler les conditions d’un débat apaisé, tel qu’il s’était déroulé, les samedis 20 et dimanche 21 juin 1998, lors de la première conférence de citoyens organisée en France, par l’OPECST, sur l’utilisation des OGM en agriculture et dans l’alimentation (214) ? Aujourd’hui encore, ce précédent reste un succès unique, avec son panel de quatorze citoyens tirés au sort et les nombreuses propositions qu’il a pu formuler sur les thèmes sanitaires, économique, environnemental, juridique et politique, chacun reconnaît qu’ils s’étaient appropriés la thématique, avaient à la fois demandé des évolutions sans les risques potentiels, mais avaient affirmé qu’il fallait poursuivre les recherches, y compris en plein champ.
C. INSTAURER LES CONDITIONS D’UN DÉBAT PUBLIC RENOUVELÉ
1. Ce que révèle l’analyse sémantique
Les rapporteurs ont entrepris une analyse textuelle de leurs travaux. Le corpus des textes analysés est constitué du compte rendu des rencontres effectuées lors des missions à l’étranger et des deux auditions publiques réalisées dans le cadre de l’étude de l’OPECST sur les biotechnologies (plus de 220 personnes rencontrées en 15 mois). Chaque compte rendu est identifié (mission ou audition, numéro de l’audition, lieu de la mission). En outre, chaque mission est étiquetée en fonction de la thématique principale de l’interlocuteur.
Pour identifier les thématiques, l’algorithme Alceste, conçu par Reinert, a été utilisé avec le logiciel Iramuteq. Celui-ci construit, à travers la proximité d’usage des termes, des « mondes lexicaux », c’est à dire des mots qui sont associés dans les phrases. L’analyse de contenu a pour objectif d’obtenir un nombre restreint de classes de termes (entre 5 et 10), afin de procéder à une catégorisation des thématiques abordées dans ces missions et auditions publiques.
Le nuage de mots ci-dessous résume la fréquence des termes dans l’ensemble de ces comptes rendus.

Chacun des 4 486 morceaux de texte identifiés a été catégorisé dans une classe. En tout, 121 comptes rendus ont permis d’identifier 8 classes stables, qui permettent de classer 87 % des morceaux de textes (215).
La structure des classes avec les termes les plus spécifiques est représentée par le dendogramme suivant :

Il est alors possible d’associer chacune de ces classes à une thématique principale :
soin |
lignée humaine |
technologie |
agriculture |
recherche |
débat public |
régulation législative |
propriété intellectuelle |
La présence des mots dans chaque classe permet de vérifier que la problématique qu’il porte a bien été traitée, et ce d’autant mieux que le mot est écrit en gros caractères.
Le dendogramme décrit, il n’explique pas. La proportion de chaque classe représente la capacité d’une thématique à « tirer » le débat vers elle. Il n’y a pas d’explication unique des proportions : choix des interlocuteurs rencontrés, caractéristiques du sujet qui, partant du contexte de la recherche, pose un problème éthique, juridique, etc. En fait, chaque classe peut être développée en fonction de l’histoire du débat autour de CRISPR.
Les trois classes présentant la plus grande fréquence sont celles relatives à la technologie, au débat public et à la propriété intellectuelle (entre 14 % et 16 %) ; elles sont communes à toutes les applications biotechnologiques. Juste en dessous, on trouve la classe relative à l’agriculture (13,6 %). Est-ce révélateur de la polarisation du débat sur les OGM ou seulement de l’intérêt des rapporteurs pour la question ? Encore une fois, l’outil statistique décrit seulement la situation, il ne donne pas d’explication univoque. Les rapporteurs font seulement remarquer que, dans le choix des personnes rencontrées et dans leurs entretiens, ils ont donné une égale importance à toutes les problématiques : recherche, médecine, agriculture… À l’opposé, les classes relatives aux soins et à la lignée humaine sont les moins fréquentes (8 à 9 %). Est-ce en raison de la bonne acceptation générale par l’opinion publique de ces technologies pour soigner les maladies humaines, qui font moins débat ?
Les deux graphiques suivants représentent des projections des formes actives principales et des modalités des variables sur l’espace des classes. Ces projections permettent de visualiser les classes d’une autre manière. Les couleurs indiquent la classe la plus proche de la variable ou du terme. Les termes, les lieux, les intervenants peuvent être représentés dans l’espace des classes projetés sur deux dimensions, leur taille étant proportionnelle à la spécificité du terme à la classe. La distance entre les termes (ou les lieux, ou les intervenants) donne une idée de leur proximité ou éloignement dans les comptes rendus. Ainsi, les termes, lieux ou intervenants représentés au centre du graphique sont ceux qui sont présents dans la majorité des propos. Ceux les plus éloignés du centre dénotent une spécialisation dans l’une des huit classes.
Le graphique ci-après permet de cartographier le champ lexicographique.
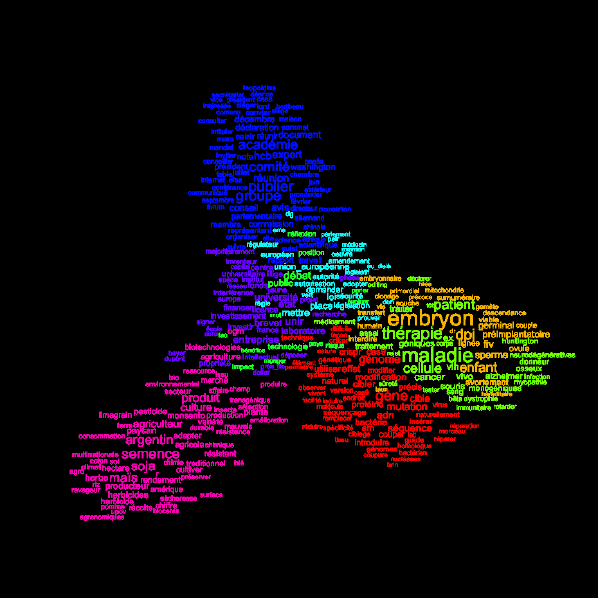
Chaque mot est plus ou moins central, selon qu’il intervient dans un contexte moins ou plus spécialisé. Ainsi les mots « laboratoire », « technique », recherche » ou « CRISPR » sont très centraux, ils sont employés très largement. Le mot « embryon » est clairement au centre des mots utilisés dans la classe de la « lignée humaine » (jaune), où l’on trouve aussi les mots « enfant », « DPI », « FIV » et « sperme ». Le mot « maladie » est au centre de la classe « soin » (vert), avec également « thérapie », « cellule » et « cancer ». Le mot « semence » est au centre de la classe « agriculture » (rose), avec « argentin », « soja », « maïs » et « produit ». Le mot « gène » est au centre de la classe « technologie » (rouge), avec « séquence », « mutation », « génome » et « cible/cibler/ciblage ». Le vocable central de la classe « régulation législative » (bleu clair) est « Union européenne », ce qui n’est pas sans signification… Les classes « soin » (vert) et « lignée germinale » (jaune) sont très proches, dénotant des domaines très imbriqués.
Le graphique ci-dessous, qui pourrait se superposer au précédent, cartographie les interlocuteurs et les lieux.

La position d’un interlocuteur permet donc de repérer à quel point il a tenu un discours qui se situe dans une classe particulière (couleur). Ainsi, la classe « agriculture » correspond plus particulièrement à la mission réalisée en Argentine. Les noms des intervenants pendant les auditions publiques permettent ainsi de positionner les thématiques autour de personnes représentant des groupes d’intérêts spécifiques : par exemple MM. Patrick de Kochko, Guy Kastler et Eric Devron en « agriculture » ; M. Pierre Jouannet et Mme Blanche Streb en « lignée humaine ».
2. Les autres pays font-ils mieux ?
Le débat public se passe de façon très différente d’un pays à l’autre, en fonction des positions des parties prenantes (acceptation ou opposition), selon le contexte spécifique dans lequel se posent les questions relatives aux biotechnologies (médecine, agriculture).
• Royaume-Uni
Au Royaume-Uni, où l’opinion publique est majoritairement favorable aux thérapies géniques, le débat public a pu être engagé sur les modifications ciblées du génome, avec notamment les travaux du Nuffield Council on Bioethics.
Le Nuffield Council on Bioethics a publié en mai 2016 un rapport à la suite de l’atelier tenu le 17 mars sur « Le dialogue public sur la modification ciblée du génome : Pourquoi ? Quand ? Qui ? » (216). Le Nuffield Council on Bioethics est un conseil indépendant, il examine les questions éthiques sur les sujets en lien avec la biologie et la médecine. Il a été créé en 1991 par la fondation Nuffield, qui a rejoint en 1994 le Wellcome Trust et le conseil de la recherche médicale. Son but est de définir et d’identifier les questions sur l’avancée des recherches en biologie et en médecine, d’organiser l’examen et l’exposé du sujet à un grand public, pour qu’il puisse être compris et discuté. Son travail est d’établir des rapports et d’organiser des colloques sur ces sujets, puis d’identifier les questions éthiques importantes au travers d’ateliers. L’ensemble de ses publications est relu, avant publication, par des experts externes. Les corrections de ces derniers sont ensuite discutées.
L’atelier du 17 mars 2016 a réuni vingt-huit participants, répartis en groupes restreints, discutant de l’utilisation des technologies et de leurs dérives potentielles. Ainsi, des scientifiques et inventeurs ont été invités à présenter les avancées de leur recherche scientifique. Pour introduire le débat mené par des scientifiques et des experts sur les possibilités et des limites d’un dialogue public élargi sur la modification du génome, trois questions ont été posées aux participants à l’atelier : Est-ce que des applications spécifiques nécessitent un dialogue public ? Le dialogue serait-il inutile, prématuré voire contreproductif ? Quelle place dans le débat public au cœur d’un débat plus large ? Ces questionnements interviennent à un moment où les nouvelles techniques révolutionnent les pratiques de modifications du génome (CRISPR-Cas9).
La modification du génome est une méthode qui ne cesse d’évoluer, et ce rapidement. Elle concerne l’ensemble des domaines (humains, végétaux, animaux). Ce sujet doit être discuté par des chercheurs et être présenté dans le débat public sous une forme encore non définie, pour les informer de l’évolution des nouvelles technologies et mettre en place des politiques et législations adéquates concernant l’application des techniques d’édition du génome sur l’homme (santé et reproduction assistée). Cependant, le grand public ne doit pas être engagé trop tôt dans le débat public.
Le Nuffield Council propose qu’un observatoire commun aux institutions publiques et organisations intéressées par ce sujet soit mis en place, pour permettre une réflexion autour du développement de l’étude scientifique du génome. Il présente une réflexion sur la méthode d’organiser ces débats publics. Il mesure le pour et le contre de mettre en place ce type de dispositif.
Ce genre de débat est aussi pédagogique : il présente à l’ensemble du public ce qu’est la modification du génome. Cela permet de discuter des problématiques éthiques et sociales et d’indiquer les différentes protections des individus envisagées face aux biotechnologies, pour discuter de l’utilisation et dérives potentielles. Cependant, le dialogue doit être présenté de manière hiérarchique, avec les conséquences sur les animaux, les végétaux et sur les êtres humains.
Au Royaume-Uni, le débat public n’est pas sous-estimé. Les scientifiques et les ONG, non représentatives de l’ensemble de la population, évoquent les possibilités scientifiques et leur utilisation à des fins commerciales dans un monde globalisé et concurrentiel.
• Allemagne
En Allemagne, où l’opinion publique est très sensible sur la dimension éthique des thérapies géniques, le débat public est plus difficile à réaliser, surtout sur les cellules germinales.
Le Pr Peter Dabrock, président du Comité d’éthique allemand (Deutschen Ethikrat) indique que la conférence annuelle publique du Comité d’éthique allemand sur le thème de CIRSPR-Cas9, a accueilli, en juin 2016, cinq cent participants. Y furent abordés la modification ciblée du génome, la chirurgie génétique et CRISPR-Cas9. Le comité voulait se concentrer sur la question de l’utilisation sur les êtres humains, car c’est une des questions qui pose le plus de débat dans la société. Beaucoup de personnes en Allemagne ne sont pas prêtes à accepter ces techniques. On est encore loin d’un débat. Aucun orateur de la conférence n’a pris la position radicale selon laquelle il faudrait soit tout interdire, soit tout autoriser. La possibilité de changer l’homme n’a pas encore été débattue au sein du Conseil d’éthique allemand, car personne ne considère que CRIPSR-Cas9 soit envisageable dans un futur proche pour modifier la lignée germinale.
• Suisse
Deux experts suisses ont fait remarquer aux rapporteurs les potentiels du Téléthon pour informer le public sur les nouvelles biotechnologies.
Mme Nicole Déglon, laboratoire de neurothérapies cellulaires et moléculaires du centre hospitalier universitaire vaudois, et M. Bernard Baertschi, Maître d’enseignement et de recherche, Institut éthique histoire humanités de l’université de Genève (UNIGE), sont d’accord sur la façon de communiquer avec le grand public et la communauté scientifique pour éviter le rejet de l’inconnu. Ils estiment qu’en France, le Téléthon, permet d’améliorer la compréhension du public. Et qu’en Suisse, les espaces éthiques qui sont mis en place, dans les hôpitaux des cantons helvétiques, pourraient être des lieux de dialogue sur ces techniques.
• États-Unis
Deux experts américains des questions éthiques dans les sciences et la recherche ont insisté auprès des rapporteurs sur la responsabilité des scientifiques pour communiquer auprès du grand public sur leurs travaux de recherche.
Pour M. Michael Kalichman, cofondateur du Center for ethics in science and technology, et Mme Mary Devereaux, bioéthicienne et directrice adjointe du Research ethics program, université de Californie San Diego (UCSD), proposent d’organiser le débat public comme un lieu de discussions dans lequel ces nouvelles techniques seraient expliquées en amont. Ce pourrait être une opportunité pour informer les citoyens sur ces nouvelles technologies, et éviter que cela ne devienne un débat qui se cristallise entre les « pour » et les « contre ».
Ils proposent d’impliquer davantage les scientifiques, non seulement dans ces instances, mais aussi dans les écoles et institutions où ils parleraient de sciences et expliqueraient leurs travaux de recherche.
Inciter les étudiants de master ou les doctorants à parler de leur recherche, c’est les rendre capables de participer à l’éducation du public sur ces sujets. Journalistes et scientifiques ne communiquent pas de la même manière, un scientifique communiquant des faits de sciences, M. Kalichman et Mme Devereaux craignent qu’aux États-Unis, le manque de dialogue creuse un fossé entre la science et le public.
Les agences américaines utilisent les réseaux sociaux. Les rapporteurs ont abordé cette question avec l’US Department of Agriculture (USDA) et l’Environmental Protection Agency (EPA) : en présence de M. Mark Petry, Deputy Director, New Technologies and Production Methods Divsion, USDA; Mme Sally Mccammon, Biotechnology Regulatory Services Animal and Plant Health Inspection Service, USDA; Mme Ann Marie Thro, Senior Advisor, Office of the Chief Scientist, USDA ; et M. Chris Wozniak, Biotechnology Special Assistant, EPA.
Mme Sally McCammon, Biotechnology Regulatory Services Animal and Plant Health Inspection Service, US Department of Agriculture, USDA, indique que, dans la plupart des cas, l’agence organise des réunions même si elle n’est pas tenue de le faire. L’USDA organise des « réunions des parties prenantes », au moins une fois par an. Les participants peuvent suivre la réunion par internet, mais aussi en étant présents physiquement.
M. Mark Petry, Deputy Director, New Technologies and Production Methods Divsion, USDA, précise que, dans ces réunions, à chaque fois que l’agence reçoit un commentaire écrit, elle est tenue de répondre. Dans la majorité des cas, ces réunions sont tenues à Washington, mais elles sont aussi organisées dans d’autres états. Les gens qui se rendent à ces réunions sont principalement des citoyens très informés, des universitaires, des industriels. À titre d’exemple, lors de la loi sur les produits labellisés bio, plus de trois cent mille commentaires ont été reçu.
M. Chris Wozniak, Biotechnology Special Assistant, Environmental Protection Agency, EPA, indique que son agence pratique des séminaires en ligne, comme en 2015 sur les tribus amérindiennes. L’EPA a reçu beaucoup de questions sur les conséquences des OGM sur les plantes considérées comme médicinales ou sacrées. Ils ont un régime alimentaire particulier, ils consomment essentiellement du poisson, et se demandaient quelle était l’action de l’EPA pour la nourriture des poissons, l’impact de l’alimentation par soja et/ou au maïs génétiquement modifié. L’agence a aussi un panel de conseillers scientifiques conformément à ses statuts. Dans le cas de questions scientifiques précises, l’EPA les fait venir pour deux ou trois jours pour qu’ils répondent à toutes ces questions comme pour les ARN-I. Le public a là aussi la possibilité d’envoyer des questions à l’oral ou à l’écrit.
Une initiative intéressante, prise par le Massachusetts Institute of Technology (MIT), maintenant d’ampleur internationale, gagnerait à être connue et médiatisée. La fondation iGEM (International Genetically Engineered Machine – fondation internationale de machines génétiquement modifiées) organise une compétition internationale de biologie de synthèse chaque année à Boston. Cette compétition a commencé en 2003 comme un cours indépendant pour les étudiants du Massachusetts Institute of Technology (MIT), où les étudiants devaient développer des dispositifs biologiques pour fabriquer des cellules clignotantes. En 2004, ce cours est devenu une compétition d’été avec 5 équipes et a continué à croître, avec plus de 300 équipes venant de 30 pays en 2016.
• Brésil
Au Brésil, avec une population largement favorable aux biotechnologies agricoles, les blocages arrivent à être surmontés après débat avec les opposants.
M. Luiz Antonio Gonçalves Rodrigues de Souza, ingénieur agronome au ministère de l’agriculture brésilien, indique qu’au Brésil, « si les anti-OGM existent, ils n’ont pas un grand poids, les choses qu’ils disent sont légitimes et doivent être prises en considération ».
Au sein de la Commission technique nationale de biosécurité (CTNBio), siègent des représentants en lien avec les mouvements de contestation, ils permettent de susciter une réflexion sur la sécurité de la santé humaine et l’agriculture sans cependant bloquer une technologie. Après l’autorisation du premier arbre OGM au Brésil, un eucalyptus, quelques exploitations expérimentales ont été détruites. Mais les études faites par des experts ont montré que ce produit était sûr. Après deux réunions au cours desquelles chacun a pu s’exprimer, l’eucalyptus transgénique a été approuvé.
D. UN DÉBAT PUBLIC EST-IL POSSIBLE ?
Les rapporteurs se sont interrogés sur la façon d’instaurer en France un débat public renouvelé.
Ils estiment d’abord que nul, fut-ce l’OPECST, ne peut revendiquer le monopole de l’organisation du débat public sur les nouvelles biotechnologies. Une pluralité d’instances est possible et même souhaitable : le Parlement, les académies, le Haut Conseil des biotechnologies (HCB), la Commission nationale du débat public (CNDP), le Comité consultatif national d’éthique pour les sciences de la vie et de la santé (CCNE), les instituts de recherche eux-mêmes, les ONG, la presse… Au niveau européen, on trouve : le Conseil de l’Europe, le Parlement européen et la Commission européenne (217), ou encore l’European Parlementary Office of Technology Assesment (EPTA, associant les offices parlementaires scientifiques et technologiques du parlement européen, des parlements nationaux et du Conseil de l’Europe). Chacun touche un public et une audience différents.
Comme le suggère les Suisses, le succès populaire du Téléthon pourrait être saisi davantage pour organiser l’information du public sur les nouvelles possibilités médicales et sur ces enjeux éthiques des nouvelles biotechnologies. Les vingt-quatre heures et la grande affluence à cet événement pourraient être l’occasion de conférences-débats.
Les rapporteurs soulignent la responsabilité des medias pour présenter au grand public les enjeux des nouvelles biotechnologies, comme de toutes les autres avancées scientifiques et techniques. Même si les prises de position de certains d’entre eux reposent souvent plus sur des a priori idéologiques que sur des faits précis et avérés, même si pour certains surfer sur la vague anti-OGM et ses dangers sanitaires supposés est plus porteur, la part de la presse grand public est essentielle.
Pour éviter que ne soient publiés des articles décrivant les nouvelles techniques de sélection végétale comme des « OGM cachées », mais aussi pour éviter qu’un reportage sur une découverte en recherche fondamentale ne donne de faux espoirs à des milliers de patients, il faut que scientifiques eux-mêmes, s’expriment davantage sur les recherches qu’ils entreprennent et qu’ils s’engagent dans le débat public. En France, comme ailleurs, il n’est pas dans leur culture d’aller au-devant des citoyens pour décrire leurs travaux, présenter leurs découvertes et évaluer les enjeux, pour susciter un débat. Mais ils sont les plus aptes à expliquer leurs recherches.
L’effort de communication se justifie d’autant plus que celles-ci sont financées ou cofinancées par des fonds publics, et qu’il s’agit ainsi d’un retour vers le citoyen qui est en droit de demander des comptes.
Par ailleurs, tout débat public doit prendre en compte les faits scientifiques et dans une approche pluridisciplinaire qui inclut également les sciences humaines et sociales (218). La participation de philosophes, sociologues, historiens, géographes, linguistes, psychologues ou encore éthiciens devrait être systématisée dans ce type de débats. Il y a des synergies entre sciences humaines et sciences technologiques. Au-delà de la problématique science et société, il est intéressant de voir dans quelle mesure les sciences humaines peuvent guider les sciences technologiques en s’attachant à mieux comprendre ce qui détermine les attentes, les craintes, les peurs ou les réflexes de notre société. Les sciences humaines ne doivent pas être considérées comme des freins aux développements technologiques, mais comme une contribution à supprimer des blocages culturels ou psychologiques. Comment expliquer autrement que par des raisons culturelles le fait que les Européens et les Américains n’appréhendent pas de la même manière les biotechnologies, la recherche sur les cellules souches embryonnaires, et même, pour certains, la théorie de l’évolution.
Les rapporteurs demandent en outre à sortir de la paralysie le Haut Conseil des biotechnologies de par la dualité de ses deux comités, dont l’un rend des avis et l’autre émet des recommandations. Ils suggèrent de supprimer cette dualité dans les conditions précédemment décrites (219).
Enfin les rapporteurs rappellent le rôle du Parlement, et singulièrement de l’OPECST, dans l’organisation du débat public sur les sujets scientifiques et technologies. L’OPECST a été saisi pour étudier de manière approfondie ces technologies, notamment la modification ciblée du génome et CRISPR-Cas9, véritable rupture technologique qui peut apporter le meilleur, mais dont les applications doivent être soumises à des règles éthiques.
Les deux auditions publiques réalisées les 7 avril et 27 octobre 2016, ouvertes à la presse et disponibles en vidéo sur les sites de l’Assemblée nationale et du Sénat, contribuent à un débat public et contradictoire. Les représentants d’associations opposées à ces biotechnologies, tant dans l’agriculture que pour la médecine, ont pu s’y exprimer amplement. Mais la parole a également été donnée aux scientifiques – auteurs des recherches et inventions – aux responsables administratifs, aux industriels, aux agriculteurs, aux grands témoins européens ou internationaux, aux juristes et à des experts en sciences humaines et sociales. La publication du présent rapport met sur la table le résultat de quinze mois d’études, tant investigations que recommandations, pour l’information de tous et la formation de l’opinion de chacun.
Les rapporteurs notent que l’acceptabilité sociale des nouvelles technologies sera d’autant plus forte que l’on constatera des avantages pour tous. L’innovation doit être au service de la société. Si elle n’est pas uniquement technologique, elle est aussi sociale. Si les biotechnologies risquent d’être concentrées entre les mains d’un petit nombre de grandes entreprises, les individus seront beaucoup moins enthousiastes. En revanche, si les avantages peuvent être largement partagés, et pourront être utilisés par un grand nombre de personnes, elles seront mieux acceptées. Dans le domaine médical, il s’agira de s’assurer que le coût des nouvelles thérapies humaines ne les réserve pas aux patients les plus fortunés.
Il s’agit d’un problème de justice sociale car il y a une certaine confusion. Les individus sont inquiets, car des grandes multinationales utilisent ces méthodes pour faire du profit au lieu de soutenir l’agriculture pour nourrir les populations. Or, comme cela a été dit précédemment, les nouvelles techniques de sélection végétale vont changer la donne si elles permettent à de petites structures de réaliser des créations qui étaient jusqu’à présent le monopole des grands groupes.
Les rapporteurs pensent qu’il convient de simplifier ce dispositif par souci de cohérence entre les évaluations rendues, d’une part par le comité scientifique du HCB sur la dissémination volontaire des OGM, sur l’expérimentation en milieux confinés, sur les essais de thérapie génique, et d’autre part par l’ANSES sur le volet sanitaire des OGM importés en lien avec l’Agence européenne de sécurité des aliments (EFSA). Ils proposent donc le transfert des missions confiées aujourd’hui au comité scientifique du HCB à l’ANSES. Cette agence dispose d’une expertise reconnue en termes d’évaluation des risques et, de surcroît, bénéficie de l’appui technique d’une administration. Il suffit de modifier les missions de l’ANSES par décret pour notamment lui permettre d’évaluer les demandes d’autorisation relatives à des thérapies géniques et permettre à l’ANSES de se doter d’un conseil scientifique spécialisé dans le domaine des biotechnologies.
La proposition est de maintenir le HCB qui sera constitué d’un collège unique reprenant les compétences de l’actuel comité économique, éthique et social, notamment en organisant le débat entre tous les acteurs, en faisant un état de l’évaluation sanitaire et environnementale, y compris en gérant les retours d’expérience en France et dans l’Union européenne, en évaluant les données sur la biovigilance et en proposant des évolutions éventuelles de l’encadrement réglementaire. Un décret fixera sa composition. Les rapporteurs pensent qu’il serait opportun que le HCB remette un rapport annuel au Parlement qui serait présenté au préalable devant l’OPECST. Ce rapport reprendra l’inventaire des suggestions et des propositions du HCB.
Recommandation n° 21 : le rapport de l’OPECST, matériau d’un débat dans toutes les terminales de France, en 2018
– Recommande au Gouvernement d’organiser un débat public sur la thématique des nouvelles biotechnologies, car la confusion est entretenue par certains entre savoir et croyances. En conséquence, qu’une initiation à la culture scientifique, technique et environnementale soit faite dès l’école, puis au collège et au lycée, et enfin que les pratiques pédagogiques intègrent la sélection pertinente d’informations diffusée par le réseau internet ;
– Recommande au ministre de l’éducation nationale de proposer à tous les lycées de France d’entamer un débat, dans toutes les terminales S, dans le cadre du thème « génétique et évolution », sur les conclusions du rapport à l’OPESCT et de donner leurs avis sur l’utilisation des nouvelles technologies en santé et en agriculture ;
– Souligne la nécessité d’un débat public renouvelé sur les biotechnologies, centré sur l’évaluation et la gestion des risques biotechnologiques, distinguant les éventuels dangers intrinsèques dus à la technologie considérée et les risques inhérents à son utilisation dans la nature. Cette évaluation doit établir une balance entre les bénéfices et les risques socio-économiques, sanitaires et environnementaux liés autant à l’adoption de la technique de modification ciblée du génome (genome editing) que, le cas échéant, au renoncement à celle-ci ;
– Propose, en s’appuyant sur la résolution adoptée à l’unanimité par l’Assemblée Nationale le 21 février 2017, au titre de l’article 34-1 de la Constitution, sur « Sciences et progrès dans la République française », que les académies concernées (sciences, médecine, technologies, agriculture, pharmacie, sciences morales et politiques) soient saisies de la question des applications de la modification ciblée du génome et chargées d’animer, en lien avec le Comité consultatif national d’éthique (CCNE), les chercheurs des établissements publics scientifiques et techniques et les universitaires, un débat public, collectif et contradictoire ;
– Souhaite que les chaînes de télévision et les stations de radio du service public renforcent l’offre d’émissions scientifiques contradictoires aux heures de plus grande écoute, en s’efforçant d’en faire un espace ludique de connaissances.
Au terme de ce rapport, les rapporteurs ne peuvent que se féliciter de la lucidité du législateur lorsqu’il a manifesté, en 1983, par la loi créant l’OPECST, le souci que le Parlement se dote de moyens lui permettant de préparer, très en amont du travail législatif, la réflexion sur les domaines d’évolutions scientifiques et technologiques pouvant avoir des incidences majeures pour la société, dans le but d’anticiper l’analyse d’éventuelles adaptations de lois et règlements.
C’est, en effet, dans le cadre de la procédure par laquelle un organe interne du Parlement peut solliciter une étude sur l’état des recherches dans un domaine que le président de la commission du développement durable et de l’aménagement du territoire de l’Assemblée nationale, M. Jean-Paul Chanteguet, a demandé, en février 2015, une étude sur les enjeux économiques et environnementaux des nouvelles biotechnologies, qui ont profondément élargi les possibilités de modifier le génome.
Cette demande a rencontré un véritable besoin de revisiter les divers aspects des biotechnologies, celles touchant à l’agriculture et à l’environnement, mais aussi celles impliquées dans la médecine humaine, à la lumière de la révolution opérée par la mise au point, en 2012, de la protéine Cas9, qui rend facile, peu coûteuse, universelle et très précise, la modification ciblée du génome.
Ce rapport s’efforce d’apporter tous les éléments d’analyse permettant d’appréhender les conditions dans lesquelles cette révolution de la modification ciblée du génome (genome editing) peut apporter des solutions nouvelles à des problèmes jusque-là hors de la portée des connaissances scientifiques, comme c’est le cas avec certaines maladies génétiques, tout en respectant les règles fondamentales qui préservent l’inaliénable intégrité du capital biologique de l’espèce humaine et des autres êtres vivants.
L’OPECST a souhaité compléter l’étude en adjoignant l’examen des enjeux sanitaires et éthiques à la saisine initiale.
Les recommandations proposées visent à dessiner un cadre permettant de concilier au mieux les avantages potentiels de cette nouvelle révolution des biotechnologies avec les procédures préalables de dialogue indispensables à leur mise en œuvre. Celles-ci sont incontournables face à la l’absolue nécessité de maîtriser les dérives véritablement inacceptables pour l’avenir de l’homme et de l’environnement.
Certains auraient souhaité que l’incertitude réglementaire conduise aux mêmes controverses que celles que l’Europe connaît depuis vingt ans avec les OGM, et ont qualifié à cette fin les produits issus de la modification ciblée du génome d’OGM « cachés ». Pour notre part, nous avons proposé une réglementation pour l’Europe qui vise à la prise en compte des risques sanitaires et environnementaux, ainsi que des retours d’expérience des techniques de transgenèse. Nous avons préconisé la liberté de recherche et non le moratoire, car c’est précisément par la recherche que les décideurs acquièrent les connaissances qui leur permettent de se prononcer.
Ce rapport constitue l’un des tout premiers documents parlementaires en Europe englobant, sur un champ aussi vaste – allant de l’agriculture à la santé – toutes les questions que pose l’arrivée de cette nouvelle révolution de la génomique. Au passage, il apporte un éclairage sur certaines questions à la marge du champ des biotechnologies sur lesquelles l’OPECST a également été sollicité, celui des huitres triploïdes, celui des vignes résistantes de Pech Rouge, pour en resituer plus précisément les enjeux.
Il faut souhaiter que la mise en place effective des lignes directrices proposées permettra de dépasser les peurs infondées et les controverses paralysantes auxquelles les avancées précédentes de ce domaine de la science ont été confrontées. Une nouvelle fois, l’OPECST préconise un débat public, collectif, contradictoire mais apaisé, devant permettre aux décideurs publics de se prononcer en pleine connaissance de cause sur certaines technologies risquant de disparaître du paysage européen.
Recommandations
L’Office parlementaire d’évaluation des choix scientifiques et technologiques (OPECST) :
La recherche en biotechnologies
Recommandation n° 1 : Pour un effort de recherche accru sur les nouvelles biotechnologies
– Encourage le développement de la recherche sur la modification ciblée du génome (genome editing), afin de faire progresser les connaissances et pouvoir tirer profit des avancées qui seront ainsi obtenues en médecine humaine, en agriculture et dans les applications industrielles et environnementales ;
– Estime inapproprié tout moratoire sur ces recherches car, il faut faire progresser les connaissances pour fixer précisément les règles d’utilisation et les limites de ces technologies. Un tel moratoire serait inapplicable à l’échelle planétaire, car certains pays ne l’appliqueraient pas, il ferait prendre du retard à la recherche en France et en Europe et ferait fuir nos chercheurs ;
– Demande qu’en France, la stratégie nationale de recherche (SNR) prenne mieux en compte les biotechnologies, pour conserver une importance à la hauteur des enjeux et à des niveaux similaires à ceux des grands pays développés (États-Unis, Japon, Royaume-Uni…) ;
– Souhaite qu’un volet du programme d’investissements d’avenir PIA 3 soit consacré à ces thématiques.
Les biotechnologies appliquées à la médecine
Recommandation n °2 : Pas de moratoire, oui aux recherches sur les cellules somatiques
– S’oppose à la demande d’un moratoire en matière de recherches sur les biotechnologies de modification ciblée du génome s’appliquant à la médecine humaine. Considérant que pour fixer précisément les limites éthiques aux utilisations potentielles pour l’homme, il faut faire progresser les connaissances ;
– Souhaite qu’une première priorité soit accordée sur fonds publics à la recherche fondamentale et à l’innovation thérapeutique, notamment à la mesure de l’innocuité et de l’efficacité de ces techniques, aux effets hors cibles qui modifieraient un gène non désiré ou qui inséreraient des parties du génome ou des gènes à une mauvaise place ;
– Propose que l’Académie de médecine, le comité éthique de l’Institut national de la santé et de la recherche médicale (INSERM) ainsi que le Comité consultatif national d’éthique (CCNE) soient consultés pour organiser une veille scientifique et médicale sur toutes questions concernant les thérapies géniques et médicales et pour fixer le cadre d’une évaluation des bénéfices et des risques de ces biotechnologies ;
– Recommande que les applications médicales se focalisent sur les modifications des gènes des cellules somatiques, dans la mesure où des thérapies géniques ou des thérapies cellulaires pourraient soigner des maladies génétiques, infectieuses, neurodégénératives, le cancer, le sida ou les maladies du sang ;
– Pense que les biotechnologies ne modifient pas les problématiques de la thérapie cellulaire et de la thérapie génique, car les règles de sécurité et d’éthique en France sont suffisantes. Il n’est pas nécessaire de créer des règles spécifiques pour évaluer ces techniques de modification ciblée du génome humain.
Recommandation n° 3 : Pas de modification des cellules germinales aujourd’hui
– Rappelle au respect de l’article 13 de la convention d’Oviedo du Conseil de l’Europe, relatif aux interventions sur le génome humain et appelle à son extension à d’autres pays : « Une intervention ayant pour objet de modifier le génome humain ne peut être entreprise que pour des raisons préventives, diagnostiques ou thérapeutiques et seulement si elle n’a pas pour but d’introduire une modification dans le génome de la descendance. » ;
– Propose de réexaminer l’article 13 quand les technologies seront suffisamment mûres et que les recherches sur la modification des cellules germinales en laboratoire auront fait leurs preuves. Estime que, lorsque ces technologies seront sûres, les essais thérapeutiques devront être examinés au cas par cas, afin de soigner une maladie héréditaire incurable. Cette étape devra être préparée par une concertation élargie avec la société civile.
Recommandation n° 4 : Un « GIEC » du genome editing
– Demande au Gouvernement de saisir, avec les autres pays membres, l’Organisation mondiale de la santé (OMS) pour réactiver le programme « Génomique humaine et santé mondiale », lancé en 2004 mais actuellement dormant, afin de constituer un lieu d’échange international sur l’utilisation des thérapies géniques, particulièrement les techniques de modification ciblée du génome, pour lutter contre les grandes maladies de l’humanité ;
– Souhaite un partenariat actif entre l’OMS, l’Organisation des Nations unies pour l’éducation, la science et la culture (UNESCO), en lien avec le Conseil de l’Europe sur les aspects éthiques des nouvelles biotechnologies appliquées à la médecine humaine ;
– Propose que ces deux organisations internationales s’entourent d’un comité permanent d’expert, composé de personnalités qualifiées reconnues dans leurs pays respectifs, qui, sur le modèle du groupe d’experts intergouvernemental sur l’évolution du climat (GIEC), aurait pour mission d’évaluer le degré de maturité des nouvelles thérapies géniques, d’en apprécier les enjeux sanitaires et éthiques et de proposer aux pays membres des lignes directrices.
Recommandation n° 5 : Un rôle accru pour l’Agence de biomédecine (ABM)
– Constate toutefois qu’en France, le dispositif d’évaluation est très complexe selon que l’autorisation de thérapie génique ou cellulaire concerne la recherche ou une activité clinique et que le régime est même différent s’il s’agit d’une recherche médicale menée dans le cadre d’une assistance médicale à la procréation. Cinq organismes peuvent être mobilisés, le Comité de protection des personnes, le comité d’éthique de l’INSERM, le Haut Conseil des biotechnologies (HCB), l’Agence nationale de sécurité du médicament et des produits de santé (ANSM) et l’Agence de Biomédecine (ABM) ;
– Suggère de simplifier le dispositif et qu’après avis de ces organismes, l’Agence de Biomédecine (ABM) donne l’accord final et assure le suivi et le contrôle des essais et des recherches cliniques, et que la question de la sûreté sanitaire soit abordée en coordination avec les organismes compétents européens ;
– Ces nouvelles dispositions devraient être précisées par décret qui fixera notamment les transferts de moyens correspondants à l’Agence de la biomédecine (ABM).
Recommandation n° 6 : L’examen du transfert de l’ADN mitochondrial en 2018
– Propose d’intégrer la question du transfert d’ADN mitochondrial lors du réexamen de la loi bioéthique prévu en 2018, d’en débattre lors d’états généraux organisés par le Comité consultatif national d’éthique (CCNE).
Recommandation n° 7 : Réexamen de la loi de bioéthique en 2018
– Souhaite que, lors de ce réexamen, soit examinée l’autorisation de pouvoir diagnostiquer, lors d’un diagnostic préimplantatoire (DPI), les maladies dues à des facteurs génétiques ou métaboliques pour des populations à risque, ou les possibilités de conservation d’ovocytes.
Les biotechnologies appliquées à la lutte biologique et à celle contre les maladies à transmission vectorielle
Recommandation n° 8 : Pas d’autorisation d’éradication d’espèces vivantes sans possibilité de retour
– Encourage la continuation des recherches et expérimentations relatives aux différentes techniques de modification d’espèces de moustiques et autres vecteurs, y compris par le forçage génétique ;
– Estime que les décisions relatives à ces techniques doivent être prises dans le cadre d’une évaluation détaillée prenant en compte la balance entre les risques environnementaux et les bénéfices pour des millions de patients victimes de maladies véhiculées par les moustiques ;
– Demande l’instauration d’un mécanisme obligatoire de réversibilité (recall) pour toute modification génétique d’une espèce de moustique, afin de pouvoir faire face à d’éventuels effets indésirables ou non conformes au but recherché. S’oppose en particulier à tout projet d’extinction d’une espèce vivante sans possibilité de retour en arrière, notamment en transférant un gène d’infertilité ;
– Souhaite que la réglementation de l’Union européenne ne répète pas sur les nouvelles biotechnologies les erreurs commises sur la gouvernance des organismes génétiquement modifiés (OGM) et qu’un mécanisme d’autorisation préalable européen soit mis en place avant toute dissémination dans la nature. Il serait opportun de prévoir une gouvernance au niveau international et un réexamen des dispositions du protocole de Carthagène en tenant compte du développement des nouvelles biotechnologies ;
– Considère que la modification d’une espèce de moustique est un sujet d’importance planétaire qui nécessite que tout projet ou expérimentation fasse l’objet d’une déclaration préalable et d’une évaluation auprès du groupe de travail spécialisé de l’OMS et souligne le rôle du groupe de travail spécialité Vector Control Advisory Group (VCAG) ;
– Souhaite qu’un projet du Programme des Nations unies pour l’environnement (PNUE) étudie les impacts de ces technologies sur la biodiversité et les équilibres écologiques ;
– Propose que la France prenne l’initiative d’un dialogue nord-sud sur l’utilisation des nouvelles biotechnologies, et en particulier des technologies de modification ciblée du génome, pour lutter contre les maladies à transmission vectorielle et soutienne l’initiative de la conférence que souhaite organiser l’OMS.
Recommandation n° 9 : Les biotechnologies blanches pour des procédés industriels durables
– Souligne les enjeux économiques et environnementaux importants des biotechnologies blanches (industrielles et environnementales), pour le développement d’une filière d’excellence et de procédés industriels durables et soutient notamment les demandes de financement des biotechnologies blanches par le programme d’investissements d’avenir (PIA 3). La France et l’Europe pourraient d’ailleurs retirer du développement de ces technologies un avantage économique important ;
Recommandation n° 10 : Impact sur la biodiversité
– Propose de promouvoir l’usage des bonnes pratiques agricoles pour éviter que des plantes ou des insectes deviennent résistants à des herbicides ou autres traitements. Le bilan de l’utilisation des plantes génétiquement modifiées (PGM) dans le monde prouve qu’il n’y a pas de perte de diversité génétique des principales espèces et que, si la transgenèse est neutre en termes de biodiversité, les études semblent indiquer que les nouvelles techniques de sélection améliorent la biodiversité. C’est donc, en résumé, une agriculture hautement productiviste ou mal conduite qui porte atteinte à la biodiversité ;
Les biotechnologies appliquées à l’agriculture
Recommandation n° 11 : Nouvelles biotechnologies : pour une clarification règlementaire de la France et de l’Europe
– Souhaite que la France vote une loi fondatrice sur les biotechnologies vertes, marquant la nécessité de soutenir l’avancée des connaissances, d’améliorer la compétitivité des entreprises françaises et de promouvoir la complémentarité des biotechnologies vertes et de l’agroécologie ;
– Souhaite qu’une directive européenne clarifie rapidement les questions posées par les nouvelles biotechnologies, et notamment les questions de l’apport des biotechnologies vertes aux enjeux du réchauffement climatique, au renforcement des défenses naturelles des plantes pour mieux s’adapter, à la lutte contre les ravageurs, aux opportunités pour l’agriculture biologique, ainsi que les questions de gouvernance européenne ;
– Suggère que la réglementation de mise en culture de produits issus de techniques, dont la sécurité est avérée depuis des dizaines d’années, ne fasse pas l’objet des mêmes mesures d’autorisation de mise en culture que celles prévues pour les plantes génétiquement modifiées (PGM).
Recommandation n° 12 : C’est le politique qui doit trancher sur les risques d’une technologie
– Estime qu’il incombe à la Commission européenne et aux Etats membres de prendre ses responsabilités sur la qualification juridique des nouvelles techniques, et non à la Cour de justice de l’Union européenne (CJUE), dont le rôle doit se limiter au respect du droit dans l’interprétation et l’application des traités ; émet le vœu que le Parlement européen et les États membres se saisissent de cette question ;
– Considère que les produits qui pourraient être obtenus par croisements sexués et les produits qui ont été ou pourraient être obtenus par mutagenèse traditionnelle ou dirigée (notamment par modification ciblée du génome) sans matériel génétique héréditaire exogène ne sont pas des OGM au sens de la directive n° 2001/18 du 12 mars 2001 relative à la dissémination volontaire d’OGM dans l’environnement (schéma ci-joint) ;
– Estime qu’en cas de blocage institutionnel persistant sur cette question, il conviendrait de repenser la législation européenne pour qu’elle puisse s’adapter aux nouvelles technologies, en évaluant les produits et non les procédés ;
– Propose que l’évaluation de la sécurité par l’Agence européenne de sécurité des aliments (EFSA), en lien avec le Haut Conseil des biotechnologies (HCB) et l’Agence nationale de sécurité sanitaire de l’alimentation, de l’environnement et du travail (ANSES), tienne compte des risques encourus par la technologie utilisée.
Recommandation n° 13 : Pour un soutien de l’Organisation des Nations unies pour l’alimentation et l’agriculture (FAO) à l’appel des prix Nobel
À la suite de l’appel des cent lauréats du prix Nobel le 29 juin 2016,
– Demande que le Gouvernement saisisse l’Organisation des Nations unies pour l’alimentation et l’agriculture (FAO) des potentialités des nouvelles biotechnologies appliquées à l’agriculture pour réduire la faim dans le monde et contribuer à l’alimentation de 2 milliards d’êtres humains supplémentaires à l’horizon 2050 ; et de l’évaluation de l’impact des nouvelles techniques de sélection végétale ;
– Recommande que les délégations nationales dans les symposiums de la FAO soient présidées par un représentant du Gouvernement et que des parlementaires soient associés aux séminaires des organisations internationales dépendant des Nations unies ;
– Suggère que l’Europe fasse du dialogue nord-sud une de ses priorités et qu’elle propose l’organisation de forums régionaux, en lien avec la FAO, sur le rôle des biotechnologies vertes et des mesures agroécologiques dans le développement de l’agriculture, l’amélioration des conditions sanitaires et l’énergie ;
– Préconise un renforcement des centres de recherche et des universités africaines dans le domaine des biotechnologies.
Recommandation n° 14 : Une reprise de l’expérimentation en plein champ pour les plantes issues des nouvelles biotechnologies
– Recommande un soutien accru aux recherches sur la modification ciblée du génome dans le domaine animal et végétal. Cet effort accru doit permettre de renforcer l’expertise indépendante et la veille scientifique, technologique et réglementaire ;
– Propose que l’Institut national de la recherche agronomique (INRA) et les autres centres publics et privés comme l’Institut français de recherche pour l’exploitation de la mer (IFREMER), le Centre de coopération internationale en recherche agronomique pour le développement (CIRAD) ou l’Institut de recherche pour le développement (IRD), relancent leur programmes de recherche avec des expérimentations en plein champ sur des plantes modifiées par des techniques de transgenèse ou des techniques de modification ciblée du génome,
– Suggère que trois ou quatre sites d’expérimentations, dans des régions françaises volontaires soient créés, et que l’INRA dispose de la réserve foncière lui permettant d’isoler ces essais des cultures traditionnelles ;
– Souhaite que la collecte de toutes les données acquises concernant l’agriculture, et notamment les conditions de culture, soit rassemblée par des plateformes nationales pour aider au développement d’une agriculture de précision, conformément aux conclusions adoptées par l’OPECST à l’issue de son audition publique du 2 juillet 2015 sur « La place du traitement massif des données (Big Data) dans l’agriculture » ;
– Préconise que le soutien aux biotechnologies vertes conditionne la compétitivité des entreprises et peut aider au développement de petites entreprises françaises et européennes dans le secteur de l’agroalimentaire ou des semences, à condition de défendre dans les négociations internationales un modèle ouvert d’innovation basée sur le certificat d’obtention végétale (COV), considérant les ressources génériques comme un bien commun de l’humanité ;
– Réitère sa demande d’octroyer des moyens supplémentaires pour conserver et valoriser les fonds génétiques, conformément aux conclusions adoptées par l’OPECST dans son rapport (n° 2967) du 9 juillet 2015 sur « La filière semencière française ».
Recommandation n° 15 : Une règlementation qui s’appuie sur les retours d’expérience
– Souhaite que la réglementation française s’appuie sur des évaluations sanitaires et environnementales et que les exigences du dossier d’évaluation tiennent compte des risques encourus et des acquis de l’expérience dans les secteurs public et privé ;
– Propose de proportionner l’évaluation aux risques réellement encourus pour éviter l’absurdité actuelle où, pour des raisons historiques, certaines biotechnologies anciennes et frustes sont exemptées de procédure d’évaluation, alors que d’autres plus récentes et précises ne le sont pas ;
– Souhaite que toute décision sur l’utilisation des nouvelles biotechnologies s’appuie sur les connaissances accumulées depuis trente ans et non sur des croyances ou des partis pris. Et recommande au Gouvernent de s’appuyer sur la résolution au titre de l’article 34-1 de la Constitution intitulée « Sciences et progrès dans la République » et adoptée à l’unanimité le 21 février 2017. Celle-ci propose notamment de s’appuyer davantage sur les travaux et recommandations des académies et préconise de renforcer le rôle de l’OPECST pour mener les études d’impact avant l’examen de tout projet de loi à caractère scientifique ou technologique ;
– Recommande un investissement public conséquent sur la biovigilance, notamment sur le recensement des impacts négatifs, ainsi que sur la veille scientifique et technologique, en particulier sur les effets hors cible détectés grâce au séquençage du génome, sur les effets toxiques de certains produits, sur le contournement des résistances, sur la réduction des intrants et sur la complémentarité dans l’utilisation des biotechnologies avec les autres mesures agroécologiques.
Deux saisines spécifiques de l’OPECST
Recommandation n° 16 : les vignes résistantes à l’oïdium et au mildiou, une opportunité pour les viticulteurs
Sollicité par le Bureau de l’Assemblée nationale sur les moyens de réduire l’utilisation des produits phytosanitaires dans le secteur de la viticulture, l’OPECST :
– Constate la qualité exceptionnelle des travaux de recherche de l’INRA sur la vigne tant à Bordeaux qu’à Colmar, Montpellier et Gruissan sur le site expérimental Pech Rouge. Ces travaux ont permis, par des méthodes classiques d’amélioration des plantes, de sélectionner des cépages dotés de résistance naturelle au mildiou, à l’oïdium ou à d’autres champignons ;
– Regrette que l’INRA, créateur de ces variétés résistantes au mildiou et à l’oïdium, ne les ait pas commercialisées pour continuer à atteindre les objectifs de baisse de 50 % du recours aux produits phytopharmaceutiques en France à horizon 2025. Souhaite que toutes les stratégies puissent être mises en œuvre pour réduire l’utilisation du sulfate de cuivre ;
– Demande dès 2017 d’enclencher l’inscription et le classement au catalogue officiel des génotypes INRA de vignes résistantes à l’oïdium et au mildiou « ResDur » et de l’ensemble des références « Bouquet » développées initialement par l’INRA, pour les variétés validées et demandées par les comités interprofessionnels, avec DHS (distinction, homogénéité et stabilité) et VATE (valeur agronomique, technologique et environnementale), ainsi que le déploiement des cépages correspondant auprès des viticulteurs, dans le cadre contractuel de l’observatoire sur la durabilité des résistances de la vigne mis en place par l’INRA ;
– Souhaite que l’INRA et les autres centres de recherche engagent des travaux de recherche, après débat avec tous les acteurs concernés, sur les techniques de modification ciblée du génome pour étendre rapidement les traits de résistance à l’oïdium et au mildiou à tous les cépages dont les organisations de viticulteurs en feraient la demande ;
– Propose qu’une réflexion soit menée avec la filière bio pour utiliser plutôt des vignes résistantes aux champignons que du sulfate de cuivre ;
– Recommande une évolution du règlement (UE) n° 1308/2013 portant organisation commune des marchés des produits agricoles, afin que les appellations d’origine protégée (AOP) et les indications géographiques protégées (IGP) puissent ne plus provenir exclusivement de vins issus de cépages appartenant à la seule espèce Vitis vinifera, dans le strict respect de cahiers des charges à définir, qui permettrait, avec des technologies précises, d’isoler et transférer un gène de résistance d’une espèce voisine ;
– Préconise parallèlement un renforcement des règlementations européenne (règlement n° 1308/2013) et internationale (Organisation internationale du vin et de la vigne – OIV) pour éviter les risques de confusion de dénomination des cépages tels que « Sauvignon Kretos ».
Recommandation n° 17 : les huîtres triploïdes, un traité de coexistence
À la suite d’une demande du sénateur Joël Labbé, après une table ronde consacrée à cette thématique, l’OPECST :
– Souhaite que les différents modes d’ostréiculture – bassins de nurseries-écloseries et pêche à pied traditionnelle – puissent continuer à coexister, aucun lien de causalité n’ayant été établi entre culture des huîtres triploïdes et surmortalités virales ou bactériennes, aucune preuve n’ayant été apportée de la menace contre la biodiversité que pourrait constituer une éventuelle interfertilité des huitres triploïdes avec les huîtres naturelles ;
– Demande que soient poursuivies les recherches, par l’Institut français de recherche pour l’exploitation de la mer (IFREMER) et les autres instituts de recherche publics et privés, sur les impacts réels de la triploïdie sur les mollusques et leur environnement, la biologie des huîtres n’étant pas encore suffisamment comprise ;
– Suggère que l’IFREMER mette en place un système de conservation du patrimoine génétique des différentes souches d’huîtres, sur le modèle de ce que fait l’INRA pour les semences ;
– Préconise que l’IFREMER et les autres centres de recherche saisissent l’occasion de l’apparition des techniques de modification ciblée du génome pour étudier l’évolution des espèces d’huîtres, leur adaptation au changement climatique et aux pollutions marines et les moyens de parer à une éventuelle crise sanitaire. Il faut anticiper et ne pas prendre de retard sur les recherches concernant les mollusques par rapport aux autres pays producteurs ;
– Recommande le renforcement des actions de biovigilance recensant les cas de surmortalités et de fécondation et d’interactions entre espèces d’huître ;
– Souhaite que des études d’impact sanitaires et environnementaux soient réalisées et que les résultats de ces études soient totalement transparents vis-à-vis des producteurs et des consommateurs ;
– Propose que, comme pour d’autres produits déjà commercialisés, il n’y ait aucune distinction d’étiquetage entre les huîtres diploïdes et les huîtres triploïdes, mais que le terme d’élevage pleine mer ou bassin puisse être précisé.
Les enjeux juridiques et sécuritaires
Recommandation n° 18 : refuser la brevetabilité des gènes, soutenir un système d’innovation ouvert
– Est convaincu que c’est sur cette question de propriété intellectuelle que l’Europe aurait dû engager un bras de fer avec les grosses firmes agro-chimiques qui dominent le marché mondial de la semence ;
– Opte pour un système d’innovation ouvert adossé au certificat d’obtention végétale (COV) permettant la recherche et la valorisation des ressources génétiques ;
– Incite l’Union européenne à refuser toute brevetabilité des gènes existant déjà dans la nature, même s’ils sont obtenus par des procédés chimiques ou biotechnologiques ;
– Encourage le développement des technologies de modification ciblée du génome qui permettra à de petites entreprises de développer l’innovation dans les biotechnologies vertes, rouges ou blanches.
Recommandation n° 19 : une stratégie de défense contre le bioterrorisme
– Considère que les règles de biosécurité des laboratoires de recherche sont suffisantes et que les moyens de contrôle et d’évaluation ne nécessitent pas d’être renforcés du fait du développement des nouvelles biotechnologies ;
– Se félicite des moyens nouveaux mis en place par la direction générale de l’armement du ministère de la défense sur les techniques de détection rapide permettant de repérer la présence d’agents pathogènes ;
– Recommande de travailler en amont sur une panoplie de stratégies de défense qui pourrait être mises en œuvre dans des scenarii d’attaques bioterroristes ;
– Se félicite de la création comité national consultatif pour la biosécurité (CNCB), par le décret du 31 août 2015, mais déplore, malgré plusieurs actions de sensibilisation du Gouvernement, que des parlementaires spécialisés dans ces questions, membres de l’OPECST ou des commissions de la défense des deux assemblées, ne puissent pas contrôler notre système de riposte aux éventuelles actions bioterroristes ;
– Regrette que les liens et la coordination des travaux entre la recherche menée dans les universités et les établissements publics scientifiques et techniques, d’une part, et dans les établissements militaires, d’autre part, soient insuffisants (c’est également vrai dans le domaine de la sécurité informatique). En conséquence, propose qu’au moins dans ces deux domaines, le bioterrorisme et la sécurité des systèmes informatiques, des crédits de recherche soient affectés pour des actions communes à des pôles civils et militaires qui travailleraient en étroite coopération ;
– Souhaite toutefois qu’un point soit fait au niveau européen et international sur les risques accrus d’utilisation malveillante des biotechnologies, du fait de leur faible coût et de la simplicité d’acquisition du savoir-faire.
L’évaluation des risques et le débat public
Recommandation n° 20 : les autorisations à l’Agence nationale de sécurité sanitaire de l’alimentation, de l’environnement et du travail ANSES, en lien avec l’’Autorité européenne de sécurité des aliments (EFSA)
– Propose que la loi modifie les missions des deux comités actuels du Haut Conseil des biotechnologies (HCB) ;
– Recommande, par souci de cohérence et de simplification, le transfert de toutes les missions confiées aujourd’hui au comité scientifique du HCB à l’Agence nationale de sécurité sanitaire de l’alimentation, de l’environnement et du travail (ANSES). Le HCB sera constitué d’un collège unique. Il anime le débat entre les acteurs, fait un état régulier de la situation sanitaire et environnementale, évalue les données sur la biovigilance et propose des évolutions éventuelles de l’encadrement règlementaire ;
– Demande à la France de soutenir une réforme des procédures européennes de « comitologie », pour que les décisions concernant les OGM, et plus généralement les produits issus des biotechnologies, soient effectivement prises par les ministres concernés réunis en conseil, et non par des représentants des États membres. Au niveau européen, les difficultés rencontrées sont dues au fait que souvent les Etats membres ne se prononcent pas ou s’abstiennent, ne prenant pas de position claire sur des sujets controversés, et se défaussant de fait de leurs responsabilités sur le conseil des ministres. Préconise d’autre part une totale transparence en rendant publics les avis ;
– Suggère que le niveau de technicité du dossier à fournir pour évaluer des plantes modifiées par les nouvelles biotechnologies soit fonction des règles édictées par l’Union européenne et les États membres. Souhaite que le Gouvernement et l’Union européenne tiennent compte, dans ce dossier, de l’expérience et du recul acquis dans l’utilisation de ces techniques depuis des dizaines d’années.
Recommandation n° 21 : le rapport de l’OPECST, matériau d’un débat dans toutes les terminales de France, en 2018
– Recommande au Gouvernement d’organiser un débat public sur la thématique des nouvelles biotechnologies, car la confusion est entretenue par certains entre savoir et croyances. En conséquence, qu’une initiation à la culture scientifique, technique et environnementale soit faite dès l’école, puis au collège et au lycée, et enfin que les pratiques pédagogiques intègrent la sélection pertinente d’informations diffusée par le réseau internet ;
– Recommande au ministre de l’éducation nationale de proposer à tous les lycées de France d’entamer un débat, dans toutes les terminales S, dans le cadre du thème « génétique et évolution », sur les conclusions du rapport à l’OPESCT et de donner leurs avis sur l’utilisation des nouvelles technologies en santé et en agriculture ;
– Souligne la nécessité d’un débat public renouvelé sur les biotechnologies, centré sur l’évaluation et la gestion des risques biotechnologiques, distinguant les éventuels dangers intrinsèques dus à la technologie considérée et les risques inhérents à son utilisation dans la nature. Cette évaluation doit établir une balance entre les bénéfices et les risques socio-économiques, sanitaires et environnementaux liés autant à l’adoption de la technique de modification ciblée du génome (genome editing) que, le cas échéant, au renoncement à celle-ci ;
– Propose, en s’appuyant sur la résolution adoptée à l’unanimité par l’Assemblée Nationale le 21 février 2017, au titre de l’article 34-1 de la Constitution, sur « Sciences et progrès dans la République française », que les académies concernées (sciences, médecine, technologies, agriculture, pharmacie, sciences morales et politiques) soient saisies de la question des applications de la modification ciblée du génome et chargées d’animer, en lien avec le Comité consultatif national d’éthique (CCNE), les chercheurs des établissements publics scientifiques et techniques et les universitaires, un débat public, collectif et contradictoire ;
– Souhaite que les chaînes de télévision et les stations de radio du service public renforcent l’offre d’émissions scientifiques contradictoires aux heures de plus grande écoute, en s’efforçant d’en faire un espace ludique de connaissances.
EXAMEN DE L’ÉTUDE DE FAISABILITÉ LE 3 MARS 2016
M. Jean-Yves Le Déaut, député. Abordant maintenant l’étude de faisabilité sur les biotechnologies, je commencerai par une petite introduction, Mme Catherine Procaccia développera ensuite la technique nouvelle – dénommée CRISPR-Cas9 – qui se développe de manière exponentielle au niveau mondial, puis je vous indiquerai le périmètre de l’étude que nous vous proposons de mener.
Je remercie Mme Hélène Bergès, chercheuse à l’Institut national de recherche agronomique (INRA), membre du conseil scientifique de l’Office, d’être présente aujourd’hui parmi nous.
La commission du développement durable de l’Assemblée nationale a saisi l’Office, le 11 février 2015, d’une « demande portant sur les enjeux économiques et environnementaux des biotechnologies », justifiée par « l’intérêt d’effectuer un point sur l’état des recherches en matière de biotechnologies ».
Le bureau de l’Office a cependant souhaité attendre que le rapport « Agriculture-Innovation 2025 » soit remis aux trois ministres chargés respectivement de l’agriculture, de l’enseignement supérieur et de la recherche et du numérique, le 22 octobre 2015. Ce rapport a été rédigé par M. Jean-Marc Bournigal, président de l’Institut de recherche en sciences et technologies pour l'environnement et l'agriculture (IRSTEA), M. François Houllier, président de l’Institut national de la recherche agronomique (INRA), M. Philippe Lecouvey, directeur de la fédération des quatorze instituts techniques agricoles (ACTA) et M. Pierre Pringuet, président du conseil d’administration d’AgroParisTech. Nous avons reçu plusieurs des auteurs du rapport, en juin 2015 puis en février 2016.
Le rapport remis aux ministres traite, dans son axe n° 5, de la génétique et des biotechnologies. Il propose quatre projets visant à : développer la sélection génomique animale et végétale, assurer la maîtrise des nouvelles technologies, relever l’enjeu industriel des métabolites secondaires, leur diversification et leur développement et faire évoluer les procédures et protocoles pour favoriser le progrès génétique et son adaptation.
Ce rapport n’épuise cependant pas le sujet, loin de là. L’Office a désigné, le 24 novembre 2015, M. Jean-Yves Le Déaut, député, et Mme Catherine Procaccia, sénateur, comme rapporteurs d’une étude sur les biotechnologies.
Cette nouvelle étude actualiserait un travail permanent de l’OPECST sur les biotechnologies, qui a commencé avec le rapport de M. Daniel Chevallier, député élu des Hautes-Alpes, en 1990, à l’occasion de la première transposition d’une directive européenne sur les biotechnologies, puis a continué avec notamment les rapports sur les organismes génétiquement modifiés (OGM) que j’ai eu l’honneur de présenter en 1998 et en 2005 et, dernièrement, les rapports de 2012 de Mme Geneviève Fioraso sur la biologie de synthèse et de M. Bruno Sido et de moi-même sur l’étude de M. Gilles-Eric Séralini sur le maïs transgénique NK 603.
Avec Mme Catherine Procaccia, nous avons procédé à onze auditions entre décembre 2015 et février 2016. Nous avons pris connaissance de la rupture technologique considérable que représente la découverte du procédé CRISPR-Cas9 (« Clustered Regularly Interspaced Short Palindromic Repeats », pour « courtes séquences palindromiques répétées, groupées et régulièrement espacées »), à la suite de la publication d’un article par Mmes Emmanuelle Charpentier et Jennifer Doubna, en 2012, dans la revue scientifique américaine Science. Mme Catherine Procaccia y reviendra.
Se pose alors la question des potentialités et des craintes liées à CRISPR-Cas9 et des autres nouvelles biotechnologies. La technique a évolué tellement rapidement qu'il est essentiel que le Parlement s'en saisisse dès maintenant.
Les biotechnologies se développent depuis maintenant cinquante ans, après la découverte de la double hélice de l’acide désoxyribonucléique (ADN) par Watson et Crick en 1953, puis du code génétique par Niremberg en 1962 et, ensuite, de la transgenèse (possibilité de transférer un gène d’une bactérie à une autre) par Schapiro en 1971.
L’essor des techniques de modification ciblée du génome (genome editing) date du début des années 2000.
Le comité scientifique du Haut Conseil des biotechnologies (HCB), dans un avis remis à la Commission européenne, le 16 janvier 2016, a établi une typologie de ces nouvelles techniques : nucléases dirigées, mutagenèse dirigée par oligonucléotides, techniques exploitant les mécanismes épigénétiques… On pourrait ajouter à la liste du HCB deux techniques nouvelles prometteuses, confirmées et largement utilisées depuis des années dans le domaine des biotechnologies : la PCR (Polymerase Chain Reaction), soit la possibilité d’amplifier des parties du génome, et la GFP (Green Fluorescent Protein), protéine émettant une fluorescence verte.
On distingue trois techniques de modification ciblée du génome dénommées « SDN » (Site-Directed Nuclease) : SDN1 (on coupe un morceau et on laisse l’ADN se réparer tout seul), SDN2 (on coupe et on remplace par un morceau équivalent de la même espèce) et SDN3 (on coupe et on remplace par une séquence provenant d’une autre espèce). Dans ce dernier cas, il s’agit de transgenèse effectuée de manière différente.
Quatre générations de nucléases se sont succédées : les méganucléases, qui étaient trop compliquées et ne sont plus maintenant utilisées ; les nucléases à doigt de zinc, qui ont été utilisées pour un essai contre le SIDA, qui sont encore utilisées mais qui ne fonctionnent pas avec tous les organismes vivants ; les TALE (Transcription Activator-Like Effector) nucléases, encore utilisées mais avec un processus long et coûteux ; et enfin, en 2012, l’apparition d’une nouvelle technique, CRISPR-Cas9, qui représente une véritable révolution.
Je laisse maintenant Mme Catherine Procaccia vous en parler.
Mme Catherine Procaccia, sénateur. La découverte de CRISPR-Cas9, en 2012, est le fruit de recherches fondamentales, démarrées en 1987, et non de la recherche appliquée.
À l’origine, deux femmes, l’une française, Mme Emmanuelle Charpentier, actuellement directrice de l’Institut Max Planck de biologie infectieuse à Berlin (Allemagne), et Mme Jennifer Doubna, américaine, professeure de chimie et de biologie moléculaire et cellulaire à l’université de Californie-Berkeley. Elles menaient des recherches sur le système immunitaire naturel des bactéries, lequel les protège de leurs virus – les phages.
CRISPR-Cas9 est, en fait, le système d’immunité de la bactérie. La bactérie apprend naturellement à reconnaitre les virus en captant un petit morceau de leur génome et en le mettant dans son propre chromosome. Si un virus ayant le même génome revient, la bactérie fabrique une protéine (Cas9) et un petit ARN qui guide la protéine vers le génome du phage et le coupe en morceaux. Cas9 joue donc le rôle de ciseaux.
Ce système naturel des bactéries est transposé à l’ingénierie du génome. La nouveauté réside dans le guidage par l’ARN, qui permet à l’ADN d’être précisément coupé à l’endroit désiré. C’est ici que se trouve la profonde révolution.
La primauté de la découverte de cette technique de modification ciblée du génome est revendiquée aussi par d’autres chercheurs, en particulier par M. Feng Zhang, professeur d’ingénierie biomédicale au Massachusetts Institute of Technology (MIT) de Boston ainsi que, à moindre titre, par M. George Church, généticien, ingénieur moléculaire et chimiste, également au MIT, mais dans une autre équipe.
Cette technologie simple, efficace, très facile, très puissante et pas chère à mettre en œuvre – le coût d’une intervention par CRISPR-Cas9 serait de seulement dix ou quinze euros. Cela constitue une véritable rupture technologique. Elle se prépare en à peine deux semaines quand les autres techniques mettent plusieurs mois, si ce n’est des années, pour aboutir. Elle est en pleine explosion. De très nombreux laboratoires l’utilisent, d’autant qu’elle fonctionne sur tous les organismes vivants : levures, plantes, poissons, amphibiens, mammifères, y compris chez l’homme.
CRISPR-Cas9 permet d’enlever ou de modifier un gène (mutation ou correction d’une mutation). Elle peut aussi introduire plusieurs mutations à la fois. Cas9 couplée à une autre enzyme pourra provoquer l’expression d’un gène, éteindre un gène trop exprimé ou modifier l’épigénome de la région (au sens biologique : changement de l’environnement du gène, de son architecture tridimensionnelle), de telle sorte que son expression sera également changée.
Avec CRISPR-Cas9, on pourra faire de l’imagerie en fixant un fluorophore à Cas9. On pourra aussi contrôler dans le temps le moment où on souhaite que cette nucléase agisse ; on peut artificiellement couper la nucléase en deux, l’introduire à l’endroit indiqué dans les cellules, puis recoller les deux morceaux pour la réactiver au moment voulu.
Avant CRISPR-Cas9, si on voulait modifier les gènes d’un organisme, par exemple celui d’une souris, il fallait prendre des cellules souches embryonnaires, faire de la recombinaison homologue, sélectionner les rares cellules où ça avait fonctionné, les réintroduire dans les embryons, remettre les embryons dans la souris, obtenir les petits, sélectionner les embryons qui ont intégré la modification dans leur lignée germinale et produire deux nouvelles générations. Cela durait dix-huit mois environ.
Avec CRISPR-Cas9, il suffit de prendre une cellule de l’embryon, d’injecter la protéine Cas9 avec son ARN et de la réimplanter. Aucun acide nucléique n’a été introduit, seulement une protéine qui disparaitra par la suite. C’est cette protéine qui va modifier le génome de l’embryon.
Les interventions faites avec la technologie CRISPR-Cas9 sont, ou seraient, peu ou pas traçables du tout. Ce point est encore discuté par les scientifiques.
La technique s’améliore chaque semaine. Depuis le début de cette étude, plusieurs améliorations et découvertes ont dû voir le jour. Dans les laboratoires du CNRS, cette technique est utilisée de façon routinière pour des besoins de recherche fondamentale, pour faire de la mutagenèse.
La technologie CRISPR-Cas9 peut être utile pour reproduire de manière efficace et simple, sur un animal, une anomalie que l’on a observée sur l’homme, pour comprendre et observer ce qu’il se passe puis tenter de la corriger.
Une question reste encore pendante, celle des effets hors cible (off target) ou non-intentionnels. Lors des essais réalisés, on a parfois pu constater des coupures à des endroits non désirés. Ces coupures sont potentiellement mutagènes. Leur nombre dépend de la séquence de la protéine ou de l’ARN guide choisi.
Depuis deux ans, les chercheurs ont fait progresser cette technique et arrivent à n’avoir quasiment aucun effet en dehors du site voulu (99 % des cas). Avec une seule Cas9, l’ADN était coupé deux fois. Ils ont muté les Cas9 de façon à ce que qu’elles ne coupent qu’un seul brin. Cela permet à l’ADN de se réparer tout seul. En outre, en utilisant deux ARN guide, les chercheurs ont obtenu plus de spécificité et de précision.
Chez les plantes, on fait la coupure et la réparation, puis on sélectionne la plante qui a la bonne coupure et la bonne réparation en éliminant les effets hors cible. Cette question des effets hors cible a, pour certains chercheurs, une durée de vie temporaire au sens où la spécificité de ces systèmes est tellement élevée qu’elle n’est pas une source d’inquiétude.
Cependant, les effets hors cibles sont très difficilement détectables à cause du grand nombre de divisions de cellules. Leur nombre a tellement diminué qu’on n’arrive plus à les distinguer des variations dues aux divisions naturelles de la cellule.
Les applications potentielles de CRISPR-Cas9 sont considérables, notamment en thérapie génique et agronomie.
Au Royaume-Uni, en novembre 2015, un essai thérapeutique est intervenu sur une enfant de onze mois atteinte de leucémie ayant résisté à tous les autres traitements, avec l’aide de la technologie mise en œuvre par un laboratoire français, Cellectis. Aux États-Unis, M. George Church du MIT, déjà cité, travaille sur l’augmentation de la fertilité féminine ou sur la fente labiale (anciennement appelée « bec de lièvre »).
En thérapie génique, la technique CRISPR-Cas9 est une révolution. Elle permet de supprimer un gène ayant muté naturellement et ayant entraîné une maladie génétique. Il peut être remplacé par un gène non muté pour reconstituer la séquence d’ADN. Pour les maladies génétiques, il suffirait de modifier une certaine fraction des cellules anormales ; elles seraient en fait tuées et mettraient fin à la maladie génétique.
Le rythme des publications sur les applications thérapeutiques de CRISPR-Cas9 est soutenu. Cette technique permet de toucher des types cellulaires qui étaient inaccessibles auparavant : cellules cardiaques, cellules musculaires, voire neurones.
Un autre domaine d’application possible a trait à l’antibiorésistance des bactéries, c’est un enjeu important sanitaire et économique. CRISPR-Cas9, pourrait cibler ces bactéries antibiorésistantes et les éradiquer par d’autres moyens que des antibiotiques. Bien sûr, il faut faire très attention, surtout quand on agit dans l’environnement biologique.
La technologie fonctionne aussi sur des cellules germinales qui sont transmissibles d’une génération à l’autre. Des expériences ont eu lieu en Chine sur des macaques et des embryons humains non viables. Au Royaume-Uni, la manipulation génétique d’embryons à des fins de recherche a été autorisée en février 2016. Actuellement les essais germinaux sur l’homme en vue de lui assurer une descendance fonctionnent mal mais ils fonctionneront un jour. Il faudra alors être sûr de pouvoir les contrôler.
J’aimerais rappeler que nous en sommes encore au stade de la recherche ; il n’y a pas encore eu d’applications en matière de santé pour l’homme, mis à part le cas cité de la petite fille au Royaume-Uni ; la technique a été découverte en 2012 et le temps d’un essai thérapeutique est au minimum de cinq ou six ans.
Certaines maladies dramatiques pour l’homme comme la drépanocytose (et les thalassémies) pourraient être traitées avec ce système de mutation ciblée. Ainsi, pour l’hémophilie, on sait qu’il suffirait de supprimer moins de 1 % des protéines pour guérir le malade.
Il y a donc de grands espoirs, même si les applications sur l’homme ne seront pas opérationnelles tant qu’on n’aura pas ramené le taux de hors cible à zéro ou quelque chose de négligeable, car le risque lié à des transformations non désirées est évidemment plus sensible chez l’humain que dans le règne végétal ou animal.
Une vigilance s’impose donc pour vérifier l’arrivée à maturité de ces technologies, avec un très haut niveau d’exigence s’agissant d’applications sur l’homme. Ce n’est pas une question de législation, sauf bien sûr pour les cellules germinales.
Dans l’agro-alimentaire, CRISPR-Cas9 permet d’accélérer la création de nouvelles espèces végétales et animales.
Les avantages de CRISPR-Cas9, par rapport à la mutagenèse, sont la précision et la rapidité. Tous les semenciers travaillent sur ces techniques. Cela ne va pas bouleverser la sélection variétale telle qu’elle est faite aujourd’hui. Mais si des caractères sont vraiment importants, notamment de résistance à des maladies, la nouvelle technique permet de les introduire beaucoup plus rapidement qu’auparavant. Ceux qui ne pourront en disposer seront pénalisés par la concurrence.
Pour l’INRA, les biotechnologies ne sont qu’un moyen d’action parmi d’autres : agroécologie, bioéconomie, agriculture numérique, robotique, biocontrôle, innovation ouverte, économie agricole et formation. Aucun de ces outils ne règlera seul tous les problèmes que l’on peut se poser en agriculture à l’horizon 2025. Mais, pour l’INRA, l’idée de ne pas utiliser les biotechnologies serait une erreur. En agriculture, il faut prendre en compte les systèmes de production et de transformation dans leur ensemble et mettre en place des dispositifs qui permettent de dialoguer avec la société et les parties prenantes.
Pour l’INRA toujours, le levier génétique est un des leviers majeurs permettant de s’adapter au changement climatique (tolérance à la sécheresse…), pour réduire les intrants, avec des plantes qui ont moins besoin de pesticides, et pour obtenir des animaux plus robustes et moins sensibles aux maladies.
L’enjeu des nouvelles technologies de modification ciblée du génome est d’accélérer considérablement le développement des nouvelles espèces. Passer à côté de ces nouvelles technologies exposerait la France et l’Europe au risque concurrentiel en provenance des autres continents, et donc à un affaiblissement de notre agriculture.
On peut citer comme exemple d’application le feu bactérien chez le pommier, qui est une maladie des vergers. Le gène, qui est dans toutes les variétés de pommiers cultivés, a un allèle de sensibilité à cette bactérie alors que les pommiers sauvages ont un allèle de résistance. Quand, il y a des centaines d’années, on a fait des sélections de pommiers, de façon très empirique, pour la qualité, la grosseur, la saveur ou la perte de l’astringence, on ne s’est pas rendu compte que l’on avait aussi perdu l’allèle de résistance à cette maladie.
Pour rendre les pommiers résistants, trois solutions sont possibles. On peut d’abord recroiser toutes les variétés de pommiers avec des pommiers résistants et on resélectionne. Sachant que l’on a une floraison par an et que cela nécessite quinze à vingt croisements, cela représente donc quinze à vingt ans de travail. La deuxième solution est de changer l’allèle du pommier sensible à partir du pommier résistant. Cela peut être fait facilement si l’on arrive à introduire l’ADN (technique SDN2). Cette solution est plus rapide que la solution par croisements. La troisième solution (SDN3), consiste à utiliser les zones identiques du génome que l’on veut modifier : on introduit un fragment d’ADN qui n’existe pas un endroit particulier dans le génome. Il s’agit d’une transgenèse ciblée qui peut se réaliser avec un gène synthétisé.
D’autres exemples sont constitués par les champignons de la vigne et la tavelure de la pomme.
CRISPR-Cas9 pourrait permettre de généraliser des améliorations apportées par l’INRA depuis plusieurs années dans la lutte contre le mildiou et l’oïdium de la vigne. À la suite de recherches commencées il y a trente-cinq ans pour explorer la biodiversité, l’INRA a retrouvé une variété de vigne sauvage muscadine résistante à ces maladies fongiques. Après vingt années de croisements, la résistance a été incorporée à un cépage. Les producteurs de cognac et de champagne sont maintenant demandeurs d’une telle solution pour leurs propres cépages.
À la suite de quarante années de croisements, l’INRA a réussi à proposer à la culture le pommier Ariane résistant à la tavelure, un autre champignon. Cette variété permet de réduire de moitié le nombre de traitements phytosanitaires habituellement réalisés sur cet arbre très sensible aux parasites.
Comme pour les précédentes biotechnologies, les domaines d’applications vont au-delà de la médecine et de l’alimentation. On peut citer la chimie, les matériaux, les procédés industriels, l’énergie ou l’environnement.
Le rapport s’efforcera d’en préciser les potentialités, sachant que beaucoup de choses sont actuellement en mouvement et qu’il faudra essayer d’aller aussi vite que les chercheurs.
M. Jean-Yves Le Déaut. Afin de conclure, je vais vous exposer les questions qui se posent et pour lesquelles nous devons prendre des décisions ce matin.
L’étude demandée par la commission du développement durable de l’Assemblée nationale porte sur des enjeux économiques, environnementaux. Mais, comme il a été indiqué précédemment par Mme Catherine Procaccia, il s’agit aussi d’aspects sanitaires et éthiques. Nous souhaitons donc vous proposer d’élargir ainsi le périmètre de l’étude.
Les questions qui seront abordées dans l’étude sont les suivantes.
Il s’agit, premièrement, de la recherche et de l’innovation. On a, face à nous, une découverte, CRISPR-Cas9, basée sur des travaux de recherche fondamentale. Ces mêmes travaux de recherche fondamentale ont abouti à une application majeure, une réelle rupture : c’est une technique facile, peu coûteuse et pour laquelle on peut, selon les cas, détecter ou non les modifications. Il faudra distinguer ce qui peut être détecté et ce qui est caché, dissimulé ou invisible.
Les enjeux économiques passent par l’intermédiaire des brevets. Comme dans le cas du brevet du SIDA, il y aura une bataille entre, d’un côté, Mmes Emmanuelle Charpentier et Jennifer Doubna et, d’un autre côté, MM. Feng Zhang et George Church, qui revendiquent également la découverte. Cela laisse entrevoir une bataille économique à ce sujet avec des enjeux importants. En matière d’organismes génétiquement modifiés (OGM), on peut citer la coopérative Limagrain, qui est le quatrième semencier mondial, avec 2 milliards de chiffre d’affaires, 15% revenant à la recherche et au développement. Or la R&D ne se fait plus en France mais en Amérique du Sud ou aux États-Unis, à cause du blocage sur les biotechnologies en France. Ces pays sont les premiers producteurs de blé. À cause de la domination de Monsanto, Limagrain doit payer des royalties à cette entreprise pour utiliser des technologies de résistance qui ont été développées.
Les enjeux agricoles découlent de ces enjeux économiques majeurs. Suivent les enjeux énergétiques et environnementaux. L’étude tentera de déterminer s’il y a d’autres enjeux que ceux du champ de l’agriculture et du domaine de la santé.
Les chercheurs estiment qu’il faut préserver le droit à la recherche dans ces technologies, pour apprivoiser l’amélioration des connaissances. Lors des auditions que nous avons réalisées jusqu’à maintenant, personne n’a demandé l’arrêt des recherches. C’est important à souligner car, lors de l’examen en cours de la loi sur la biodiversité, des amendements allaient dans ce sens. Il risque d’y avoir une bataille similaire à celles que nous avons connue avec les OGM, et sans doute plus violente.
Un moratoire généralisé n’est envisagé par aucune des personnes que nous avons auditionnées. Faut-il, à un moment donné, traiter de façon séparée les modifications de cellules humaines ? Oui, bien-sûr ! Mais nous avons déjà, en droit français et européen, un cadre interdisant l’utilisation sur des cellules germinales. Au niveau européen, c’est la convention d’Oviedo, mais elle n’est pas signée par tous les pays, notamment ni par le Royaume-Uni, les États-Unis ou la Chine.
Les entreprises demandent un cadre juridique stable. Le domaine de la propriété intellectuelle est d’importance majeure car même si, au niveau européen, cela semble géré et établi, lorsqu’on examine l’Office européen des brevets (OEB) d’aujourd’hui et les règles relatives aux brevets, on s’aperçoit que les différences entre brevet et certificat d’obtention végétale (COV) ne sont pas aussi maîtrisées qu’on pourrait le penser.
Pour cela, nous serons amenés à aller à Munich, afin d’observer la stratégie et la politique menée par l’OEB, notamment au regard d’une probable et intense bataille sur les brevets autour de ces technologies.
Il est interdit de breveter un gène en tant que tel, ce que les Américains n’avaient pas souhaité soutenir au départ, puisque M. Craig Venter avait déposé des brevets sur les ressources naturelles et sur des centaines de millions de bactéries dont il avait réalisé le séquençage de leur génome. Tout cela annonce une gigantesque bataille sur la propriété intellectuelle, qui viendra se superposer à la bataille autour de la paternité de la technologie.
L’autre point crucial de cette nouvelle biotechnologie est de savoir s’il s’agit d’OGM. La question se pose de savoir si les organismes obtenus par les nouvelles techniques de modifications ciblées des gènes rentrent, ou non, dans le cadre de la définition des OGM et doivent, ou non, être régulés comme tels. Des disparités réglementaires pourraient apparaître entre les États-Unis et l’Europe. De ce fait, une consultation est en cours de la Commission européenne auprès des États membres. La réponse, qui devait être donnée en 2015, a été retardée en 2016 et la possibilité d’une position unique est difficile à envisager. La plupart des États membres estiment que SDN1 et SDN2 étant équivalents à la mutagenèse, ils produiraient des OGM exemptés du régime juridique de la directive ; certains disent même que ce pourrait ne pas être des OGM. CRISPR-Cas9 serait une technologie « douce », « naturelle », les modifications qu’elle provoque n’étant pas différentes de celles apparaissant naturellement par la variabilité des espèces.
Ici surgit la difficulté : peut-on assimiler la technique à des mutations naturelles, sachant que l’on a des millions de mutations quotidiennes dans les organismes vivants ? Une étude publiée dans le magazine Science, en novembre 2015, montre que, sur les trente-six neurones du cerveau humain d’un individu, on dénombre 1 500 mutations somatiques propres à chaque neurone et toutes différentes. Chacune de nos cellules connaît des mutations. Cela est un point sur lequel nous serons amenés à travailler.
Les impacts sur l’environnement devront également être traités dans notre étude. Cela résulte d'ailleurs de la saisine initiale, avec la coexistence des cultures OGM et non OGM. Les cultures qui seraient obtenues par ces nouvelles technologies seraient-elles assujetties aux mêmes règles de coexistence que celles qui ont été définies dans la loi du 25 juin 2008 relative aux organismes génétiquement modifiés ? Il n’y a pas, aujourd’hui, au niveau de la France, d’application, ni d’interdiction d’OGM. La régulation n’engendre aucune autorisation. La loi de 2008 permet les cultures en plein champs mais aucune autorisation n’est donnée. Je rappelle que le dernier essai en plein champ, sur des peupliers, a été arrêté sans interdiction ni autorisation ; il y a eu une non décision politique.
L’autre impact sur l’environnement concerne la technologie du guidage des gènes (gene drive). Cette technique permettrait d’éradiquer les moustiques porteurs de maladies graves pour l’homme (malaria, chikungunya, dengue), en supprimant ou en modifiant la fertilité de certains moustiques, donc en modifiant globalement la biodiversité. Nous nous posons alors la question de l’opportunité de leur application et de la maîtrise des risques pour l’environnement.
Le Sénat nous a également demandé d’étudier l’exemple des huitres triploïdes et les questions qu’elles posent en matière de mortalité, d’équilibre de l’écosystème et d’envahissement. Nous traiterons également cette question.
Enfin, nous travaillerons sur la complémentarité entre biotechnologies et agroécologie, en élargissant les objectifs de recherche en amélioration et sélection animale et végétale, sans opposer les techniques : diversification des espèces, résistance aux maladies, réduction de l’usage des pesticides, tolérance à la sécheresse ou à la chaleur, robustesse des animaux dans un but de durabilité, ou encore adaptation de la qualité aux usages alimentaires…
Les impacts sur la santé ont été globalement développés, ils posent un certain nombre de questions éthiques et d’interrogations autour de la sécurité et de la sûreté, dans la mesure où ces technologies peu coûteuses risquent de laisser prospérer ce qu’on appelle la « biologie de garage », comme il y a eu de « l’informatique de garage ». La sûreté, ce sont des risques de bioterrorisme qui seraient entraînés par une technologie à faible coût avec l’adjonction de toxines et de différents composés. Les aspects éthiques, avec les tentations d’eugénismes et de transhumanisme, ont été soulevés par des essais chinois, en 2015, sur des embryons humains non viables ; l’expérimentation a été arrêtée car des modifications sur des parties non ciblées du génome ont été repérées. L’expérience chinoise, à l’inverse de ce qui a été dit dans la presse, n’était qu’une expérimentation de recherche.
Au Royaume-Uni, une autorisation a été accordée au Dr Kathy Niakan, en début d’année 2016, afin de pouvoir entreprendre des recherches sur l’embryon humain, mais cette recherche ne s’effectue pas dans le cadre d’un embryon viable et l’essai ainsi autorisé a été bien défini par la commission d’éthique. Cela serait sans doute impossible à envisager en France. La convention d’Oviedo, avec l’interdiction de modifier la lignée germinale de l’homme, a le mérite d’exister. Il faut réussir à la mettre en avant et demander, par des discussions internationales, qu’au regard du développement de ces nouvelles technologies, elle soit signée par tous les pays.
Plusieurs organismes se sont prononcés : le comité d’éthique de l’Institut national de la santé et de la recherche médicale (INSERM), en octobre 2015 ; le comité des droits de l’homme et de bioéthique du Conseil de l’Europe (DH-BIO) sur les technologies de modification de génome, en décembre 2015, avec une proposition de recommandation de son assemblée parlementaire ; la déclaration des académies des sciences européennes en juillet 2015 ; ainsi que le comité international de bioéthique de l’UNESCO dans un rapport, en octobre 2015.
Tous souhaitent que l’on encadre ces technologies, notamment lorsqu’il s’agit de la modification des cellules humaines. En décembre 2015, une conférence sur ce sujet s’est tenue à Washington, d’où découlent deux interrogations : une régulation internationale spécifique est-elle nécessaire et comment faut-il l’organiser ? Faut-il créer, sur le modèle du groupe intergouvernemental d'experts sur l'évolution du climat (GIEC), une instance internationale de chercheurs sur les questions relatives aux biotechnologies ?
Le débat public et l’information des citoyens sont des nécessités. Des questions concernent le Haut Conseil des biotechnologies : clarification de son rôle, compétence, paralysie… Alors que, dans le précédent mandat du Haut Conseil, la totalité des semenciers et des industriels avaient démissionné, aujourd’hui un seul chercheur, M. Yves Bertheau, a démissionné. Après sa démission, celui-ci a participé, le 2 mars 2016, à une conférence
co-organisée par M. José Bové au Parlement européen, à Bruxelles, et intitulée « Nouvelles techniques de sélection : OGM cachés ? ».
Quel sera le cadre de travail de l’étude de l’Office ? Deux auditions publiques sont programmées, l’une à l’Assemblée nationale, le 7 avril 2016, sur la technologie CRISPR-Cas9, et l’autre au Sénat, en octobre 2016, sur un thème restant à définir.
Les déplacements prévus par les rapporteurs couvrent les États-Unis, l’Argentine et le Brésil, mais aussi trois pays européens avec le Royaume-Uni, l’Allemagne et la Suisse. Ce sont les pays ayant le plus développé ces technologies. Nous souhaitons également aller à la rencontre des institutions telles que celles de l’Union européenne à Bruxelles (Commission européenne, Parlement européen), et à Munich (Office européen des brevets…), l’Organisation mondiale de la santé (OMS) à Genève et l’Organisation pour l’alimentation et l’agriculture (FAO) à Rome.
Un comité de pilotage de l’étude est en cours de constitution.
Nous pensons et souhaitons présenter le projet de rapport à la fin de l’année 2016 ou au début de l’année 2017.
À l’issue de cette étude de faisabilité, les rapporteurs, Mme Catherine Procaccia et moi-même, proposons à l’Office d’engager l’étude dont il a été saisi, en élargissant son périmètre aux problématiques sanitaires et éthiques.
M. Bruno Sido, sénateur, vice-président de l’OPECST. Ce qui a été dit est très intéressant. Je pense que, effectivement, il faut aller de l’avant avec ces nouvelles technologies et bien examiner les conséquences juridiques. Ces technologies, si elles sont approchées de façon intelligente, permettront de lever le blocage actuel sur les OGM. Je considère que ce qui vient d’être dit est tout à fait novateur. Les perspectives envisagées ainsi que l’élargissement du sujet sont tout aussi pertinents. Je soutiens le projet d’étude de faisabilité qui nous est proposé.
Mme Hélène Berges, membre du conseil scientifique de l’OPECST. Je ne peux que constater que la démarche proposée constituerait un moyen de dépassionner ce débat en s’appuyant sur des faits scientifiques. Cependant, ce n’est pas parce que l’on a un discours intelligent que l’on est toujours entendu. Il faut essayer de communiquer suffisamment et correctement autour de ces technologies et de leurs applications. Il est clair qu’il s’agit d’une technologie aux retombées énormes et puissantes ; il faut l’encadrer et la plupart des chercheurs y réfléchissent. Il ne faut surtout pas renouveler le modèle que l’on a actuellement avec les OGM, par rapport à d’autres pays qui avancent beaucoup plus vite. Les retombées économiques sont très importantes.
M. Bruno Sido. Peut-on imaginer pouvoir traiter, avec ces nouvelles méthodes, des maladies de types chromosomiques, telle que la trisomie 21 ?
Mme Hélène Berges. Ce serait vraiment pour traiter des maladies plus simples, que l’on connaît, c’est-à-dire avec un seul gène pathogène. Ce n’est pas le cas de toutes les pathologies.
La trisomie 21 est une translocation, un grand fragment, c’est différent. CRISPR-Cas9 n’est, pour le moment, pas un type d’application possible pour cette maladie, et toutes celles entraînant la multiplication d’un chromosome.
C’est vraiment adapté aux problématiques d’un gène pour une pathologie. Il existe des phénomènes beaucoup plus complexes, qui régissent des caractères. Mais les applications possibles existent déjà, et nous n’en sommes qu’au début. Nous pouvons imaginer, en termes d’applications, encore beaucoup de choses.
M. Jean-Yves Le Déaut. Nous avons demandé aux ambassades de plusieurs pays du monde de nous décrire la situation dans leur pays. Nous avons reçu des rapports de pratiquement tous nos services scientifiques.
Dans celui relatif au Japon, où l’on observe que ce pays n’est pas à la pointe de ces technologies et qu’il a pris un peu de retard, nous avons pris connaissance d’un tableau intéressant sur l’évolution du nombre des publications scientifiques sur ces nouvelles biotechnologies depuis 2012.
L’exponentialité que révèle le tableau est assez incroyable. Tous les pays augmentent entre 2014 et 2015, sauf la France qui est en baisse. Cela est expliqué par la précaution, la prudence envers la signification que revêtirait cette technologie s’il s’agissait véritablement d’OGM. Ce tableau sera annexé à l’étude de faisabilité pour que tous les membres de l’Office en prennent connaissance.
Après l’audition publique du 7 avril prochain, il sera utile de rédiger, pour nos collègues parlementaires, un « deux pages » ou « quatre pages » sur ce sujet. Car je vois les tentatives de certains de « verrouiller » le système sans l’avoir étudié, alors que le président de la commission du développement durable de l’Assemblée nationale, en saisissant l’Office, nous a demandé de nous en occuper. Il nous faut présenter l’outil, les instruments législatifs, nos réflexions et nos préconisations, afin de sensibiliser les parlementaires et, au-delà, le public.
Mme Catherine Procaccia. Par rapport aux OGM, il me semble que la différence est constituée par le levier sur les maladies génétiques. Le fait que cette technique s’applique aussi à l’humain peut être un atout pour empêcher que l’on mette un frein en matière végétale.
Nous avons évoqué la drépanocytose, ainsi que la piste consistant à immuniser les moustiques contre des virus mortels. Les enjeux humains sont considérables, évidemment, pas pour toutes les maladies, mais pour un bon nombre d’entre elles, dont beaucoup trop de personnes sont victimes. Cela pourrait être un atout dans la communication des chercheurs. Il faut une approche globale. Par ailleurs, je suis étonnée du grand nombre d’articles sur ce thème publiés dans la presse grand public. Cette présentation par rapport aux maladies devrait pouvoir être traitée de façon différente en France.
Mme Hélène Berges. J’ai tendance à dire que les OGM ne posent pas de problème à partir du moment où ils n’intègrent pas les plantes génétiquement modifiées (PGM).
M. Jean-Yves Le Déaut. Pour relativiser, je rappelle que le diagnostic préimplantatoire (DPI) est une technique adaptée aux maladies monogéniques. Ainsi, nous pouvons tester l’œuf à partir du moment où la maladie risque d’être transmise pour la troisième ou quatrième fois à l’enfant, et le réimplanter par fécondation in vitro (FIV). Le DPI existe déjà pour traiter les problèmes indiqués.
EXAMEN DU RAPPORT LE 28 MARS 2017
M. Bruno Sido, sénateur, premier vice-président de l’OPECST. Monsieur le Président, Chers Collègues, le rapport que vous allez nous présenter aujourd’hui avec Catherine Procaccia sera le dernier de la session parlementaire, et donc aussi le dernier de la législature pour nos collègues députés, tant il est vrai que le Sénat est une assemblée permanente. Il s’inscrit dans la lignée des précédents rapports que l’OPECST a consacrés depuis le début des années 1990 aux biotechnologies en général, et aux organismes génétiquement modifiés (OGM) en particulier.
Votre rapport me paraît frappant par son ambition. En effet, il dresse un vaste panorama de la recherche internationale en biotechnologies et passe en revue tous les domaines dans lesquels celle-ci se déploie.
Il comporte également des développements sur les enjeux juridiques des biotechnologies, et n’esquive pas, et c’est heureux, les difficultés du débat public autour des risques sanitaires et environnementaux que celles-ci peuvent poser. À cet égard, je fais entièrement confiance à nos deux rapporteurs pour nous présenter des recommandations qui soient raisonnables et équilibrées et qui prennent pleinement en compte la dimension éthique de ces pistes de recherche.
Personnellement, j’estime que ce n’est pas parce qu’une prouesse en biotechnologie peut être réalisée techniquement, qu’elle doit forcément être avalisée éthiquement. Même si certains pays ne se fixent aucune limite en la matière, je considère que c’est tout à l’honneur de la France et de l’Union européenne d’avoir des principes et de s’y tenir.
Face à certaines voies de développement de la recherche en biotechnologie qui nous paraîtraient aberrantes, nous ne devons pas transiger sur nos règles éthiques, mais au contraire plaider pour qu’elles deviennent des normes internationales.
Je n’en dirai pas plus pour laisser la parole aux deux rapporteurs.
M. Jean-Yves Le Déaut, député, président de l’OPECST. L’OPECST a été saisi le 11 février 2015, par le président de la commission du développement durable de l’Assemblée nationale, d’une « demande portant sur les enjeux économiques et environnementaux des biotechnologies », « en raison de l’intérêt d’effectuer un point sur l’état des recherches en matière de biotechnologies et d’organismes génétiquement modifiés ». Par la suite, deux demandes complémentaires ont été formulées : sur les vignes résistantes, par le président de l’Assemblée nationale à la demande du président du groupe de la Gauche démocrate et républicaine (GDR), et sur les huîtres triploïdes, par le secrétaire d’État chargé de la mer et de la pêche.
Lors de sa réunion du 3 mars 2016 approuvant l’étude de faisabilité, l’OPECST a souhaité élargir la question posée aux « Enjeux économiques, environnementaux, sanitaires et éthiques des biotechnologies à la lumière des nouvelles pistes de recherche ».
Depuis le début des années 1990, l’OPECST s’est intéressé de près aux biotechnologies, avec la transposition de la première directive européenne sur les OGM : rapport de Daniel Chevalier de 1990, rapport de Jean-Yves Le Déaut en 1998 à l’issue de la première conférence de citoyens en France, trois rapports de Jean-Yves Le Déaut de 2005 préparatoires à la loi de 2008 sur les OGM, rapport de Geneviève Fioraso de 2012 sur la biologie de synthèse, pour ne parler que des plus importants.
Les biotechnologies ont fait récemment des progrès considérables, notamment avec les technologies de modification ciblée du génome (genome editing). Parmi elles, la découverte du système dénommé « CRISPR-Cas9 », par Emmanuelle Charpentier (Française, directrice de l’Institut Max Planck d’infectiologie à Berlin) et Jennifer Doubna (chercheur à l’université de Californie à Berkeley), qui a fait l’objet en 2012 d’une publication dans la revue scientifique américaine Science, constitue une véritable rupture car il est plus simple, plus rapide et moins coûteux et fonctionne sur tout organisme vivant.
Les applications possibles sont très prometteuses en médecine humaine (biotechnologies rouges). Ces techniques révolutionnent les méthodes de sélection des plantes (et des animaux) destinées à l’alimentation, dans une « ère post-OGM » (biotechnologies vertes), et rendent possibles des procédés industriels respectueux de l’environnement (biotechnologies blanches). Les craintes sont à la hauteur des potentialités : questions éthiques sur la modification de l’espèce humaine, évaluation environnementale et sanitaire des nouvelles techniques de sélection végétale, propriété intellectuelle, biosécurité... Ces nouvelles techniques questionnent l’adéquation des règles actuelles tant au niveau national, qu’européen et international.
Nous présentons notre rapport à l’issue de quinze mois d’étude, de deux auditions publiques contradictoires et ouvertes à la presse, de plusieurs missions en France (Génopole d’Évry, centre INRA de Gruissan dans l’Aude) et à l’étranger (Royaume-Uni, Allemagne, Suisse, États-Unis, Argentine, Brésil) et auprès d’organisations européennes et internationales (Commission européenne, Autorité européenne de sécurité des aliments – EFSA, Office européen des brevets – OEB, Organisation des Nations unies pour l’agriculture et l’alimentation – FAO, Organisation mondiale de la santé – OMS). Soit l’audition de plus de 220 personnes : scientifiques, médecins, universitaires, ministres, parlementaires, responsables administratifs, industriels, représentants de la société civile, comités d’éthiques, ONG de patients… Nous sommes le premier parlement au monde à nous prononcer sur ce sujet.
Le rapport a étudié : (I) la recherche en biotechnologies ; (II) les applications des nouvelles biotechnologies à la médecine humaine ; (III) les applications à l’environnement, (IV) ; les applications agricoles dénommées « nouvelles techniques de sélection » ; (V) les enjeux juridiques et sécuritaires ; et (VI) l’évaluation des risques et les conditions du débat public.
I-. La recherche en biotechnologies a réalisé des avancées majeures depuis le début des années 2000
Nous sommes loin de la découverte de la double hélice d’ADN par Cricks et Watson en 1953. Les techniques de « modification ciblée du génome » (genome editing), depuis le début des années 2000, ont renouvelé les biotechnologies. Après les méganucléases, les doigts de zinc, les TALEN, la dernière génération, avec CRISPR-Cas9 et CRISPR-Cpf1, représente une véritable rupture technologique comme on en connaît peu par décennie, par siècle. Les applications opérationnelles recourent encore majoritairement à la technique TALEN, mais sans doute plus pour longtemps. Avec CRISPR-Cas9, le nombre de publications scientifiques a augmenté exponentiellement, les laboratoires du monde entier s’en sont emparés. Fruit de la recherche fondamentale, à partir du mécanisme de défense des bactéries contre les phages, CRISPR-Cas9 associe un ciseau moléculaire à un guide ARN qui permet des modifications précises au gène près.
Les nouvelles biotechnologies ne se limitent pas aux techniques de modification ciblée du génome. La Commission européenne a recensé sept autres techniques : mutagenèse dirigée par oligonucléotides (ODM), modulation de l’expression des gènes par RdDM, agro-infiltration, greffe végétale, cisgenèse/intragenèse, ségrégants négatifs et génomique synthétique. Ces techniques sont radicalement différentes et beaucoup plus précises que celles de la transgenèse classique, qui sert notamment à fabriquer les plantes « OGM », et de la mutagenèse par radiation ou chimique, utilisée depuis des décennies. D’autres ruptures technologiques ont eu lieu (réaction de polymérisation en chaîne – PCR et protéine fluorescente verte – GFP), ou sont en train d’apparaître (optogénétique, CRISPR-Cpf1…).
La France possède une longue tradition d’excellence en matière de recherche en biotechnologies. Le rejet des OGM végétales depuis deux décennies a démobilisé les équipes et les laboratoires, la recherche française pointe maintenant en sixième position derrière les États-Unis, la Chine, l’Allemagne, le Japon et le Royaume-Uni en nombre de publications avec un très fort impact. Notre pays semble décrocher du peloton de tête. Le CNRS, l’INSERM et l’Institut Pasteur sont de loin les organismes français qui publient le plus sur CRISPR-Cas9.
Si plusieurs chercheurs ayant contribué à l’invention de CRISPR-Cas9 proviennent de l’Institut Pasteur, une nouvelle fois la recherche appliquée nous échappe et se concentre aux États-Unis sur les côtes Est (Boston) et Ouest (Californie). « La France a perdu sa capacité d’expertise internationale en biotechnologies », comme l’indique l’Organisation de l’agriculture et de l’alimentation (FAO). Quelques pôles d’excellence, par exemple le Génopole d’Evry, tentent de résister.
Nous nous prononçons contre un moratoire des recherches sur les techniques de modification ciblée du génome. Nous demandons que la stratégie nationale de recherche (SNR) consacre une plus grande priorité aux biotechnologies.
II-. L’espoir des biotechnologies appliquées à la médecine humaine
Mme Catherine Procaccia, sénateur, vice-présidente de l’OPECST. De nombreuses maladies ont des causes génétiques. « Réparer » le génome constitue un espoir et une piste thérapeutique prometteuse. Les premières recherches sur le génome humain à but thérapeutique ont débuté à la fin des années 1990. Après la démocratisation du séquençage du génome, après vingt ans de thérapies géniques, après les techniques des doigts de zinc et des TALEN, CRISPR-Cas9 fait naître de grands espoirs pour soigner non seulement des maladies génétiques, mais aussi le cancer, le sida et d’autres maladies très répandues comme la drépanocytose, Alzheimer, Parkinson, le diabète, l’obésité….
Quelque 80 % des 7 000 maladies rares, ont une origine génétique et même monogénique. Trois millions de personnes sont concernées en France et 30 millions à l’échelle européenne. Le diagnostic préimplantatoire (DPI) permet d’éviter certaines maladies mais pas toutes, il ne résout pas tous les cas et il ne les corrige pas.
La baisse significative du coût des recherches aves CRISPR a permis la multiplication des projets à travers le monde. Les premiers essais cliniques sur certains des patients sont attendus aux États-Unis en 2017 (cancer et amaurose congénitale de Leber). En Chine, des essais cliniques auraient été effectués en 2016 pour le cancer. Une petite fille d’un an et demi, Layla, atteinte de leucémie aiguë lymphoblastique incurable, a été traitée à titre « compassionnel » et guérie, au Royaume-Uni en 2016, grâce à la technique des TALEN mise au point par la société française Cellectis. L’OMS n’a malheureusement pas mesuré l’enjeu de ces technologies et n’a pas réactivé son programme de génomique humaine, dormant depuis plus de dix ans.
Ces modifications du génome peuvent provoquer des imprécisions dues à des effets hors cible, c’est-à-dire des coupures à d’autres endroits du génome. Ils ne peuvent être tolérés lorsqu’il s’agit de l’homme. Tous les scientifiques interrogés ont répondu que ces effets hors cible avaient déjà considérablement baissé et n’étaient maintenant pas plus nombreux que les variations qui surviennent naturellement au quotidien dans un organisme vivant, ne serait-ce que par l’effet du soleil. C’est plutôt le transfert du gène modifié dans la cellule, ou l’inoculation par un vecteur qui, pour l’instant, s’avère complexe.
Ces technologies posent cependant des questions éthiques et doivent conduire les États à s’interroger sur les règles. Il faut distinguer les interventions sur les cellules somatiques, qui ne concernent que le patient que l’on traite, de celles sur les cellules germinales, qui sont transmissibles à la descendance. L’article 13 de la convention d’Oviedo interdit de modifier le génome de la descendance, mais peu de pays au monde l’ont signée même si beaucoup l’appliquent. L’INSERM, l’Académie de médecine française, les académies américaines…, toutes les instances compétentes émettent des avis avec une grande convergence : il faut continuer les travaux de recherche, mais ne pas toucher à la lignée germinale humaine dans les traitements cliniques. De rares oppositions se manifestent, comme l’association Alliance Vita en France qui demande un moratoire, y compris sur les recherches fondamentales.
Les législations nationales de bioéthique sont très diverses, plutôt restrictives en Europe, notamment en Allemagne – à l’exception notable du Royaume-Uni –, plutôt permissives aux États-Unis et surtout en Chine, où l’application effective du droit en vigueur pose problème. Les États-Unis se prononcent pour une autorégulation dans le cadre d’une recherche responsable.
Le Royaume-Uni a autorisé, en 2015, le transfert mitochondrial, une réparation génétique sur un élément périphérique de la cellule humaine et faisant intervenir un tiers donneur. Les premiers essais cliniques ont eu lieu au Mexique et en Ukraine. La réparation entraîne une modification héréditaire, mais le futur enfant aura toutes les caractéristiques génétiques de son père et de sa mère, puisque l’ADN mitochondrial représente moins de 1 % de la quantité totale d’ADN.
Nous estimons qu’il faut continuer les recherches, qu’un moratoire n’est ni souhaitable, ni possible. Il n’est cependant pas acceptable de modifier la lignée germinale humaine pour l’améliorer ou l’« augmenter », selon les thèses transhumanistes. Beaucoup de chercheurs pensent que, lorsque ces technologies seront sûres, il sera difficile d’interdire des modifications héréditaires du génome humain, au cas par cas, afin de soigner une maladie grave ou incurable. Cette décision devra être prise après une nécessaire concertation élargie avec la société civile. OMS et UNESCO devraient s’entourer d’un comité permanent d’experts sur le modèle du groupe d'experts intergouvernemental sur l'évolution du climat (GIEC), qui aurait pour mission d’évaluer le degré de maturité des nouvelles thérapies géniques, d’en apprécier les enjeux sanitaires et éthiques et de proposer des lignes directrices. En France, les règles de sécurité et d’éthique sont suffisantes, il n’est pas nécessaire de créer des règles spécifiques pour évaluer ces techniques de modification ciblée du génome humain. Le réexamen de la loi de bioéthique prévu en 2018 doit être l’occasion de poser la question du transfert mitochondrial.
III-. Les biotechnologies appliquées à la lutte biologique et au développement durable
Cette partie traite des techniques de modification des insectes porteurs de maladies à transmission vectorielle, afin de lutter contre les maladies qu’ils transmettent à l’homme et particulièrement de la nouvelle biotechnologie du « forçage génétique » ou gene drive qui modifie une espèce vivante, mais aussi des biotechnologies industrielles et environnementales et de l’impact des nouvelles techniques de sélection végétale sur la biodiversité.
Les maladies à transmission vectorielle (notamment par les insectes) sont responsables de plus de 17 % des maladies infectieuses, elles provoquent plus d’un million de décès chaque année (dengue, paludisme, mais aussi, trypanosomiase humaine africaine, leishmaniose, maladie de Chagas, fièvre jaune, virus Zika…). Les enjeux sont considérables.
L’OMS considère que les biotechnologies, incluant celle du forçage génétique, pourraient être un instrument supplémentaire utile et complémentaire des moyens traditionnels qu’elle préconise (insecticides, répulsifs, vêtements protecteurs, moustiquaires imprégnées…).
Le forçage génétique est une biotechnologie rendue possible avec CRISPR-Cas9, qui devrait être rapidement opérationnelle. Elle permet de passer outre les lois de l’hérédité de Mendel en propageant une modification génétique au fil des générations à 99 % de la population. Il est possible soit de modifier le gène de l’insecte pour le rendre résistant au virus qu’il transporte et l’empêcher de transmettre la maladie aux hommes, soit d’éteindre l’espèce purement et simplement. Cette dernière possibilité pose un problème d’éthique et environnemental car on ne mesure pas les incidences sur la chaîne écologique.
D’autres méthodes de modification des moustiques existent et font l’objet d’expérimentations au Brésil, au Vietnam, en Chine…, peut-être bientôt en Floride :
– le contrôle de la population de moustiques avec la technique de la société d’origine britannique Oxitec consistant à rendre les mâles stériles en l’absence d’un antibiotique et à procéder à des lâchers successifs de moustiques ;
– et un projet de biocontrôle avec des moustiques non modifiés génétiquement chez lesquels est introduite une bactérie wolbachia pour accroître leur résistance aux virus (dengue, Zika).
Le forçage génétique présente une efficacité puissance dix car la modification de l’espèce se maintient toute seule dans le temps et s’amplifie dans l’espace. Il n’est plus nécessaire de procéder à des lâchers successifs de moustiques. La question de l’effondrement de la biodiversité se pose bien sûr, mais tous les experts s’accordent à dire que l'agriculture hautement productive, le recours aux pesticides et engrais chimiques ont eu plus d’incidences sur la transformation globale du monde vivant que n’en auront les techniques de modifications ciblées de gènes de certains vecteurs.
Nous nous prononçons donc pour la continuation des travaux et expériences de modifications génétiques de moustiques, en prenant en compte la balance entre les risques éventuels pour l’environnement et les bénéfices en termes de lutte contre des maladies humaines occasionnant des centaines de milliers de morts chaque année. Par contre, nous demandons l’instauration d’un mécanisme de réversibilité en cas d’effet non désiré et nous nous opposons à tout projet d’extinction d’une espèce vivante. Enfin un dialogue entre les pays du nord, détenteurs des technologies, et du sud, qui subissent les maladies, doit être organisé dans le cadre de l’OMS.
L’étude a tenté de mesurer l’impact des nouvelles techniques de sélection végétale sur la biodiversité.
Les associations écologistes affirment que les OGM portent atteinte à la biodiversité (déclin des populations auxiliaires – coccinelles, abeilles –, contamination des cultures voisines ou des espèces sauvages par transfert de gènes, pollution des sols ou encore augmentation de la monoculture) et tentent d’assimiler les nouvelles biotechnologies aux OGM, sans aucune distinction.
Par contre, les nombreux experts scientifiques consultés et les académies recommandent d’envisager ces nouvelles techniques au cas par cas, et de comprendre exactement l’impact d’un caractère génétique nouveau sur l’environnement. Celui-ci doit se concevoir comme un ensemble dynamique dans lequel toute activité humaine a un impact ; les nouvelles techniques d’obtention végétale augmentent le nombre de caractères d’intérêt pour l’agriculture, sans compter leurs implications positives d’un point de vue économique et pour la biodiversité des variétés cultivées, car elles ciblent plus précisément l’insecte ravageur, alors que plusieurs insecticides tuent tous les insectes sans discrimination.
Les conclusions des académiciens français rejoignent celles des académies américaines des sciences et de médecine dans le rapport « La modification ciblée du génome humain : science, éthique et gouvernance » de février 2017 : les plantes génétiquement modifiées ne portent pas atteinte à la biodiversité, bien au contraire, car elles limitent l’usage de pesticides dont certains sont susceptibles de détruire tous les insectes sans distinction ni sélectivité.
Les biotechnologies blanches consistent à remplacer les composants chimiques polluants issus de la chimie traditionnelle par des produits durables. Cette nouvelle filière industrielle pourrait transformer radicalement les industries. Elle constitue un enjeu économique et environnemental important. De multiples jeunes pousses (start-up) sont créées à cette fin, qui travaillent, par exemple, sur les mécanismes de captation de CO2. Si l’Allemagne est très en pointe sur ces technologies, le Toulouse White Biotechnology et le Genopole d’Évry constituent deux centres d’excellence en France.
Nous demandons le soutien des recherches françaises sur les biotechnologies blanches par le programme d’investissements d’avenir PIA3 et la stratégie nationale de recherche (SNR).
IV-. Les biotechnologies appliquées à l’agriculture, l’ère post-OGM
M. Jean-Yves Le Déaut. Les techniques de modification ciblée du génome pourraient avoir des applications révolutionnaires dans l’agriculture. Comme on l’a vu, elles consistent à introduire des modifications génétiques très précises qui permettent d’accélérer la vitesse de sélection. Elles représentent une rupture fondamentale par rapport aux « anciens » OGM, dans la mesure où elles pourraient se produire naturellement et sont d’ailleurs quasi-indétectables. Elles s’inscrivent dans le droit fil de l’histoire de l’agriculture, avec 10 000 ans de sélection végétale. Les traits recherchés ne concernent plus seulement la résistance au glyphosate (Roundup) ou l’amélioration de la productivité, comme pour les OGM actuels développés par les multinationales, ils peuvent améliorer la qualité nutritionnelle des aliments (acide gras de type oméga-3), procurer une résistance accrue aux pestes et aux ravageurs, au stress hydrique, au réchauffement climatique ou à la salinité des terres, allonger la durée de conservation « sur étagère » (champignon qui ne brunit pas)… Les plantes modifiées permettent en particulier de diminuer, voire de supprimer, l’utilisation de produits phytosanitaires potentiellement toxiques.
Des espèces végétales créées avec la modification ciblée du génome (TALEN) sont déjà autorisées sur le continent américain. Partout dans le monde – sauf en Europe ? – les projets se multiplient de façon exponentielle avec le système CRISPR-Cas9. Les projets d’animaux modifiés voient également le jour : cochons résistants aux bactéries pathogènes, vaches sans cornes (diminution de la souffrance animale), vaches au lait anallergique et maternisé. Le premier saumon génétiquement modifié, qui grandit deux fois plus vite, a été commercialisé aux États-Unis et au Canada en 2016. Certaines de ces techniques devraient être régulées, voire interdites, d’autres favorisées.
L’histoire des OGM en France et en Europe est l’histoire de renoncements successifs qui ont conduit à un blocage généralisé, alors qu’ils se développent dans les autres parties du monde. Les premiers essais aux champs de plantes transgéniques ont été réalisés en 1983 aux États-Unis, en 1986 en France. La première directive européenne sur les OGM date de 1990. En 1995, la France accorde la première autorisation de maïs transgénique résistant à la pyrale et tolérant aux herbicides. Mais dès 1996, les premières polémiques arrivent jusqu’au sommet de l’État et, depuis 1997, les gouvernements successifs interdisent les cultures OGM en plein champ (au mépris des autorisations européennes), alors que sont autorisées les importations et la consommation des mêmes plantes OGM… Pendant vingt ans, cette polémique prendra des proportions considérables avec deux camps irréconciliables, sur fond de « faucheurs volontaires » qui saccagent en une nuit des années de recherche. Alors qu’à la fin des années 1990, on comptait plus de 800 essais de culture d’OGM en France, le dernier essai en plein champ s’est terminé en 2013 avec l’arrêt par l’INRA de ses cultures de peupliers près d’Orléans. Lors du Grenelle de l’environnement de 2007, un accord tacite entre le Gouvernement et plusieurs associations prévoit que la question du nucléaire ne sera pas abordée en contrepartie de l’invocation de la clause de sauvegarde contre le maïs Mon810… Nous avons voté, en 2008, une loi « relative aux OGM » qui ne sert à rien. En 2012, l’« affaire Séralini » a vu un scientifique publier un article concluant à la toxicité d’un maïs OGM sur des rats, puis retiré par l’éditeur, fait rarissime, pour insuffisance de puissance statistique et choix d’une souche de rats présentant des tumeurs de façon spontanée. Malgré un désaveu scientifique général, la presse et l’opinion publique en restent durablement marqués.
Les nouvelles techniques de sélection végétale ne sont pas opposées mais complémentaires des méthodes d’agroécologie telles que préconisées par le Gouvernement dans le rapport « Agriculture – Innovation 2025 » de novembre 2015, et par la FAO, lors de deux symposiums internationaux organisés en 2014 et 2016. On aurait pu penser que ces nouvelles biotechnologies allaient surmonter les polémiques sur les OGM. Ces techniques offrent une occasion de s’affranchir des technologies des grandes entreprises multinationales, qui sont orientées vers des rendements toujours plus élevés sans rechercher de mode de production durable. L’un des défenseurs européens de l’agriculture biologique, M. Urs Niggli, directeur de l’Institut suisse de recherche sur l’agriculture biologique (FIBL), estime que les nouvelles biotechnologies ont un « grand potentiel » pour les sélectionneurs et les agriculteurs bio. M. Michel Griffon, lors de l’audition publique de l’OPECST, estimait que les « nouvelles biotechnologies végétales offrent des opportunités très intéressantes pour consolider une agriculture ancrée dans une vision écologique de la production végétale. » Les nouvelles techniques de sélection végétale peuvent être appropriées par les pays du Nord comme du Sud, par les multinationales comme par les structures de plus petite taille.
Les OGM sont définis juridiquement au niveau européen dans la directive n° 2001/18 : « organisme dont le matériel génétique a été modifié d'une manière qui ne s'effectue pas naturellement ». En sont exclues les techniques de mutagenèse par irradiation ou exposition chimique, utilisées sans problème depuis des dizaines d’années et non soumises aux obligations d’évaluation, de surveillance et d’étiquetage. Or la Commission européenne ne cesse de reporter, depuis dix ans, la qualification juridique des nouvelles techniques de sélection végétale. Après un avis demandé à un groupe de travail en 2011, un nouvel avis est maintenant demandé au groupe d’experts « SAM » auprès du président de la Commission européenne et, dernièrement, un nouveau délai a été créé par le renvoi préjudiciel du Conseil d’État français devant la Cour de justice de l’Union européenne (CJUE), dont la décision est attendue en... 2018. Les États membres également se « repassent la patate chaude » : depuis vingt ans, ils ne prennent pas leurs responsabilités dans les comités d’experts, laissant la Commission européenne seule décider au nom des vingt-huit, et bloquant ainsi le fonctionnement du processus d’autorisation des OGM. L’Agence européenne de sécurité alimentaire (EFSA), qui coordonne les évaluations relatives aux OGM, a reçu mandat de la Commission européenne de suspendre l’évaluation des nouveaux procédés de sélection des plantes. Cette agence a même renforcé ses protocoles d’évaluation à la suite des publications de M. Séralini, dont on a dit la faiblesse scientifique. Dernière reculade, en mars 2015, la modification de la directive européenne n° 2001/18 permet maintenant à chaque État membre d’interdire, pour des raisons autres que sanitaires ou environnementales, la culture sur son territoire national d’une plante génétiquement modifiée qui aurait pourtant reçu une autorisation au niveau européen. Résultat : les cultures OGM en Europe sont marginales, alors que l’alimentation animale est dépendante des importations de soja génétiquement modifié...
Les biotechnologies vertes constituent une filière économique importante au niveau mondial. Les États-Unis, le Brésil et l’Argentine en profitent largement. Le refus européen des OGM végétaux a conduit les entreprises et les chercheurs à se délocaliser sur d’autres continents, notamment américain : c’est le cas pour la coopérative française Limagrain, mais aussi pour les sociétés allemandes Bayer et BASF. L’INRA, un temps leader des plantes génétiquement modifiées, n’a plus qu’un seul projet relatif au génie génétique, Genius, sans possibilité de faire des essais en plein champ. Or, les nouvelles techniques de sélection végétale, avec la baisse de leur coût, constituent une occasion pour l’Europe de se réapproprier cette filière.
Cent prix Nobel ont publié, en juin 2016, une déclaration à l’adresse de Greenpeace, des organisations internationales et des gouvernements du monde entier pour un plus grand usage des techniques modernes de sélection végétale. Pour eux, ne pas le faire constituerait un « crime contre l’humanité ». Les projections de la FAO suggèrent qu’en 2050, la production agricole devrait augmenter de 60 % globalement pour répondre aux demandes alimentaires d’une population accrue de 2 milliards de personnes. Pourtant, la FAO semble paralysée par les dissensions entre ses membres et a jusqu’à ce jour échoué à lancer un plan d’action pour utiliser le potentiel des biotechnologies vertes pour relever ces défis.
L’évaluation sanitaire et environnementale des OGM a été réalisée en 2016 par l’Académie des sciences américaine. Une méta-analyse portant sur les publications relatives aux OGM depuis vingt ans montre qu’il n'y a jamais eu un seul cas confirmé d'un résultat négatif sur la santé pour les humains ou les animaux dû à leur consommation. Ni d’ailleurs de conséquence négative sur l’environnement ou la biodiversité. Les résistances des mauvaises herbes et des ravageurs par contre sont avérées, mais il s’agit d’une lutte perpétuelle aussi ancienne que la vie et les mauvaises pratiques agricoles en sont sans doute la cause principale.
Nous soutenons le développement des nouvelles techniques de sélection végétale, qui se fera de toute façon en dehors de l’Europe. Nous estimons qu’elles ne sont pas des OGM au sens de la directive européenne n° 2001/18. Nous proposons dans un tableau une classification de ces nouvelles biotechnologies au regard de la règlementation. Il serait aberrant que des techniques plus précises que les mutations spontanées ou que celles utilisant des technologies aléatoires de la mutagenèse (exemptées de procédure lourde d’évaluation par l’EFSA) soient soumises à des procédures d’évaluation identiques à celles de la transgenèse. Il faut adapter les évaluations aux risques encourus.
Nous avons étudié deux cas spécifiques : les vignes résistantes et les huîtres triploïdes.
L’INRA a développé depuis trente ans, par sélection végétale classique, des variétés de vignes résistantes aux champignons oïdium et mildiou et conservant leurs qualités œnologiques. Ces variétés permettraient de réduire fortement l’utilisation des fongicides, notamment le sulfate de cuivre, dont la toxicité est réelle. Nous nous prononçons pour un classement rapide des nouveaux cépages dans le catalogue officiel, afin de procéder à leur exploitation commerciale. Nous estimons que l’utilisation des techniques de modification ciblée du génome permettrait d’étendre les traits de résistance aux autres cépages, comme ceux utilisés dans le champagne ou le cognac, sans attendre vingt années de sélection classique.
L’IFREMER a développé et permis la mise en culture d’huîtres triploïdes, résultats d’une modification génétique obtenue par sélection classique. Les critiques relatives à la surmortalité subie par ces huîtres ou à leur caractère invasif n’ont jamais été démontrées scientifiquement. Nous nous prononçons pour la poursuite des recherches et le renforcement de la biovigilance des huîtres. Nous estimons que la coexistence des différentes façons de cultiver des huîtres, écloserie-nurserie et ostréiculture traditionnelle, n’est pas menacée par les huîtres triploïdes. Nous souhaitons le développement des biotechnologies dans le secteur de l’ostréiculture, afin de mieux connaître la biologie des huîtres et pouvoir faire face aux risques que constituent les virus, les changements climatiques ou les pollutions marines.
V-. Les enjeux juridiques et sécuritaires
Mme Catherine Procaccia. La propriété intellectuelle de ces biotechnologies constitue un enjeu économique important. Les brevets détenus par les grandes multinationales en agriculture génèrent d’énormes enjeux financiers. S’agissant de CRISPR-Cas9, dont les applications sont multiples dans les domaines de la santé, du végétal ou de l’environnemental, l’enjeu est particulièrement important.
Deux camps se disputent la propriété intellectuelle initiale de CRISPR-Cas9, d’un côté Emmanuelle Charpentier (en son nom propre) et Jennifer Doudna (UC Berkeley), et de l’autre Feng Zhang (Broad Institute à Boston). Le différend est parti pour durer des années, malgré la reconnaissance des droits de Feng Zhang en première instance par l’Office américain des brevets en février 2017. Il ne devrait cependant pas gêner les activités de recherche. Sans oublier, en toile de fond, l’attribution potentielle du prix Nobel à l’un ou plusieurs d’entre eux.
On constate depuis 2012 un accroissement important des demandes de dépôts de brevets pour la propriété intellectuelle des applications de CRISPR-Cas9 et des autres biotechnologies, principalement aux États-Unis et en Chine, l’Europe et les autres pays restant loin derrière.
En Europe, la jurisprudence des chambres de recours de l’Office européen des brevets (OEB) montre une interprétation restrictive de la brevetabilité des éléments du corps humain et des séquences de gènes humains.
Quant aux nouvelles plantes, le droit européen connaît deux systèmes : le brevet et le certificat d’obtention végétale (COV). Les deux systèmes sont complémentaires : l’un des systèmes de protection englobe ce qui n’est pas protégeable par l’autre.
De fait, seules les plantes « autogames » (soja, blé..) permettent aux producteurs de conserver les semences d’une année à l’autre. Pour les plantes « hybrides » (maïs, coton, tournesol…), cela n’est pas pratiqué car cela entraînerait une baisse de rendement et une perte de recettes supérieure au coût de rachat de nouvelles semences. La technologie de stérilisation des semences, dénommée gène « Terminator » par les médias, qui empêche de replanter, est restée dans les laboratoires Monsanto, détenteurs des brevets, s’étant engagés en 1999 à ne pas la commercialiser.
Nous refusons la brevetabilité des gènes. Nous souhaitons donc que l’Union européenne et les États membres soutiennent davantage en matière de sélection végétale un système d’innovation ouvert, adossé au certificat d’obtention végétale (COV). C’est le seul système qui favorise la recherche et valorise les ressources génétiques. Il faut trouver un juste milieu entre un système très contraignant de domination de grosses firmes agro-chimiques et un système alliant producteurs, État et industrie semencière, qui contrôle la propriété intellectuelle et soutient la recherche.
Nous sommes persuadés que le développement et la facilité d’accès de la technique CRISPR-Cas9 devraient permettre à des petites structures de développer des semences qui, jusqu’à présent, en raison de leur coût, restaient le monopole des grosses firmes agrochimiques, avec des redevances souvent excessives.
La biosécurité recouvre deux réalités : la sécurité au sein même des laboratoires, avec les questions de confinement et de manipulations involontaires, et le bioterrorisme.
S’agissant du premier point, nous estimons qu’en France, comme dans les autres pays européens et occidentaux, les règles relatives aux laboratoires de recherche sont suffisamment sûres et que l’arrivée de CRISPR-Cas9 ne justifie pas un renforcement des règles de sécurité.
Par contre, la simplicité et le faible coût de la technique laissent craindre le développement de ce que l’on peut appeler la « biologie de garage ». En outre, les utilisations potentiellement malveillantes des biotechnologies, comme la création d’un virus ou d’une bactérie mutants, ou à la modification d’un moustique par forçage génétique deviennent possible. Aux États-Unis, en 2016, la CIA a classé CRISPR comme une « arme de destruction massive », compte tenu du risque de bioterrorisme accru. Conscient de ces menaces, le Gouvernement français a créé en 2015 le Conseil national consultatif pour la biosécurité (CNCB).
La biosécurité des nouvelles biotechnologies constitue effectivement une menace qui doit être appréhendée aux niveaux européen et international. Nous préconisons un renforcement de la coordination des travaux de recherche civile et militaire, avec des moyens accrus sous le contrôle des parlementaires de l’OPECST et des commissions de la défense des deux assemblées.
VI-. L’évaluation des risques et le débat public
En France, depuis la loi du 25 juin 2008 relative aux OGM, c’est le Haut Conseil des biotechnologies (HCB) qui évalue les risques sanitaires et environnementaux liés à la culture d’OGM. Les risques liés aux aliments contenant des OGM sont examinés par l’Agence nationale de sécurité sanitaire de l’alimentation (ANSES). Ces deux organismes interviennent dans le cadre de la législation européenne, avec des décisions prises par la Commission européenne après expertise de l’Agence européenne de sécurité des aliments (EFSA).
L’ANSES dispose de moyens d’analyse avec notamment le site d’Angers, désigné laboratoire national de référence pour la détection des OGM. Elle fonctionne de façon satisfaisante.
Ce n’est pas le cas du HCB, constitué de deux comités. Le comité scientifique (CS), composé de 40 experts, reconnus pour leurs compétences scientifiques (génétique, biologie moléculaire, microbiologie, protection de la santé humaine et animale, agronomie, sciences appliquées à l’environnement, éco-toxicologie…), évalue les risques des biotechnologies pour l’environnement et la santé publique. Le comité économique, éthique et social (CEES) est composé de 33 membres parmi lesquels des élus et des représentants d’organisations professionnelles, de salariés, d’associations de protection de l’environnement, d’associations de défense des consommateurs et des personnalités qualifiées. Instance de débat, le CEES se prononce sur les aspects économiques, sociaux et éthiques des biotechnologies et de leurs applications. Il s’appuie pour ses travaux sur des grilles d’analyse des différents types de dossiers qu’il est amené à instruire. La loi de 2008 dispose que le CS rend des avis alors que le CEES émet des recommandations.
Or le HCB connaît une crise d’identité à répétition. Déjà en 2012, la démission du CEES de plusieurs organisations pro-OGM, avait paralysé l’institution pendant plusieurs années. Début 2016, de nouveau, plusieurs organisations anti-OGM ont suspendu leur participation au HCB. La cause en est le dépôt d’un avis du HCB sur les nouvelles techniques de sélection végétale (NTB), avec le refus du CS de publier l’opinion dissidente d’un de ses membres, M. Yves Bertheau, chercheur à l’INRA, reçue hors délai.
Nous pensons qu’une meilleure coordination des rôles assignés en France au HCB et à l’ANSES pourrait améliorer l’efficacité du dispositif. Il n’est pas souhaitable de laisser perdurer ces querelles qui nuisent à la crédibilité de cette filière. Nous recommandons le transfert de toutes les missions confiées aujourd’hui au CS du HCB à l’ANSES, agence qui dispose d’une expertise reconnue en termes d’évaluation des risques et qui, de surcroît, bénéficie de l’appui technique d’une administration. Le HCB sera constitué d’un collège unique reprenant les compétences de l’actuel CEES, notamment en organisant le débat entre tous les acteurs, en faisant un état de l’évaluation sanitaire et environnementale, y compris en analysant les retours d’expérience en France et dans l’Union européenne, en évaluant les données sur la biovigilance et en proposant des évolutions éventuelles de l’encadrement réglementaire.
L’arrivée des nouvelles biotechnologies, avec les enjeux qui ont été précédemment décrits, nécessite un large débat public. Force est de constater les difficultés du débat public en France sur ce sujet, comme sur d’autre domaines technologiques que sont le nucléaire, le gaz de schiste ou les nanotechnologies. Avant même d’entamer le débat sur les nouvelles biotechnologies, les opposants historiques aux OGM parlent d’« OGM cachés », alors qu’il s’agit de techniques très différentes. L’utilisation des biotechnologies, anciennes et nouvelles, appliquées à la médecine humaine ne suscite pas les mêmes oppositions que pour les applications agricoles, alors qu’il s’agit des mêmes technologies. Avant les premières applications de CRISPR-Cas9, 8 médicaments nouveaux sur 10 sont déjà issus de procédés biotechnologiques : ils sauvent de nombreuses vies humaines ; ils constituent des avancées majeures pour lutter contre des maladies chroniques graves ou invalidantes telles que certains cancers, les déséquilibres thyroïdiens, les insuffisances rénales, l’hématologie ou encore le diabète.
Nous estimons qu’il faut engager dès maintenant le débat public sur les nouvelles biotechnologies, même si elles sont encore à un stade expérimental, faute de quoi il risquerait d’être confisqué par leurs opposants systématiques. Nos concitoyens ont droit à une information complète, ils doivent pouvoir être entendus et contribuer au débat, avant que les décisions ne soient prises. Nous proposons que les terminales S de tous les lycées de France débattent du thème « génétique et évolution ». Nous soulignons la nécessité d’un débat public renouvelé avec une approche pluridisciplinaire et dans toutes les instances possibles : académies, Comité consultatif national d’éthique (CCNE), centres de recherche, presse… Ce sujet majeur nécessite un débat apaisé.
M. Bruno Sido. Je félicite les deux rapporteurs et leurs collaborateurs pour cette somme de travail considérable, dont la présentation aurait probablement mérité une journée de travail. Les vingt recommandations comprennent en fait une centaine de propositions détaillées. Ce travail touche de nombreux domaines qui auraient nécessité plusieurs rapports. La médecine est un domaine extrêmement important, avec des perspectives fabuleuses, notamment si l’on réussit à changer le génome de l’anophèle femelle pour qu’elle ne puisse plus porter la malaria, cela changerait la vie de la zone tropicale et équatoriale – sans la supprimer – même si beaucoup d’humains ne s’en plaindraient pas. L’agriculture l’est également, avec la possibilité de modifier le génome de plantes, sans que ce soit considéré juridiquement comme des OGM au regard du droit européen (recommandation n° 12). La recherche décroche en France, c’est grave, c’est un problème récurrent. Est-ce la recherche publique ou privée ? La question des interventions sur les cellules germinales, pour soigner des maladies graves et incurables, est importante car elle touche à la reproduction.
Vous formulez plusieurs recommandations à la Commission européenne. Or la recherche est mondiale et ce qui ne se fera pas en France ou en Europe se fera ailleurs. L’idée d’un GIEC de la modification ciblée du génome (genome editing) me paraît très bonne. Il faut réunir tous les chercheurs du monde pour travailler sur cette question. Les règles éthiques doivent être les mêmes partout pour éviter les débordements. La recommandation n° 8 (pas d’autorisation d’éradication d’espèces vivantes sans possibilité de retour) se justifie, car il faut conserver les ressources génétiques de tous les organismes vivants. La recommandation n° 10 sur la biodiversité (c’est l’agriculture productiviste qui porte atteinte à la biodiversité, et surtout le mauvais usage des produits phytosanitaires, en particulier des insecticides, et non les biotechnologies) n’en est pas vraiment une et gagnerait à être réécrite.
En agriculture, plus qu’une directive européenne, il faudrait un GIEC. Les OGM sont cultivés sur tout le continent américain et nous, Européens, les consommons : il y a une part d’hypocrisie... Je suis d’accord avec les recommandations n° 12 (c’est le politique qui doit trancher sur les risques d’une technologie), n° 13 (pour un soutien de l’Organisation des Nations unies pour l'alimentation et l'agriculture – FAO – à l’appel des prix Nobel) et n° 14 (une reprise de l’expérimentation en plein champ pour les plantes issues des nouvelles biotechnologies). L’arrachage des vignes OGM, fruit de trente ou quarante ans de travail est un scandale. La recommandation n° 16 (les vignes résistantes à l’oïdium et au mildiou, une opportunité pour les viticulteurs) me paraît évidente. Dans la recommandation n° 17 (les huîtres triploïdes, un traité de coexistence), vous êtes à contre-courant de ce qui se fait aujourd’hui en étiquetage : il faudra bientôt une ramette de papier pour décrire tout produit mis en vente... On n’y comprend rien mais c’est obligatoire et c’est dans le sens du vent…
La recommandation n° 18 (refuser la brevetabilité des gènes, soutenir un système d’innovation ouvert) pose la grande question de la brevetabilité du génome. Cela doit rester interdit, sinon l’humain sera lui-même breveté. Je partage la position du président de l’OPECST sur le fait que, sur tous ces sujets, il faut des décisions politiques et non pas prises par des techniciens. Je suis en particulier d’accord avec un contrôle parlementaire accru sur ces questions.
C’est un très bon rapport, il mérite d’être travaillé en profondeur et devrait déboucher sur un certain nombre de propositions de lois. Nous sommes à la veille d’une révolution qui accompagne celle de l’informatique. Ces techniques permettent d’aller beaucoup plus vite dans la sélection. On touche à un domaine qui évolue extrêmement rapidement. Il faudrait que le Parlement se saisisse le plus rapidement possible d’un certain nombre de questions pour les contrôler. Sinon, cela pourrait partir dans beaucoup de directions.
Ce rapport est une belle pierre à l’édifice de l’évolution scientifique dans ce siècle commençant.
M. Patrick Hetzel, député. Je remercie et félicite les rapporteurs. Vous mettez des enjeux en perspective. Ce rapport sera très largement cité et utilisé dans les mois et années à venir, par les parlementaires et les décideurs gouvernementaux, pour avancer dans un certain nombre de directions.
Je voudrais revenir sur trois points. Je souscris pleinement à la recommandation n° 14 (une reprise de l’expérimentation en plein champ pour les plantes issues des nouvelles biotechnologies). Sachant que nous sommes législateurs, il me semble utile, dans le prolongement de vos travaux, de mener un travail spécifique pour sécuriser juridiquement cette proposition. Les organismes en question ne demandent pas mieux, mais il ne faudrait pas qu’ils soient en première ligne pour des questions de nature juridique. Cela passera par un projet ou une proposition de loi.
Je vous remercie tout particulièrement pour la recommandation n° 18 (refuser la brevetabilité des gènes, soutenir un système d’innovation ouvert). On voit bien que, de part et d’autre de l’Atlantique, nous n’avons pas la même vision. Je pense que, tout comme un combat français avait été mené dans le passé pour faire accepter l’idée de l’exception culturelle, nous devrons remonter au créneau pour nous opposer à certaines formes de brevetabilité des gènes. On voit bien que ce qui est en jeu est une sorte de captation, par des entreprises privées, d’éléments qui fondamentalement sont issus de la nature elle-même. C’est un vrai sujet, notre droit continental peut apporter une contribution pour insuffler une autre vision.
Toutes vos recommandations sont pertinentes, la recommandation n° 19 (une stratégie de défense contre le bioterrorisme) l’est particulièrement. Le contrôle parlementaire sur les systèmes de riposte en matière bioterroriste est encore inexistant. On pourrait procéder par parallélisme des formes avec les dispositifs de contrôle en matière de renseignement, notamment la délégation parlementaire. Le renseignement est un sujet extrêmement sensible. Si on veut légitimer un certain nombre d’actions auprès de nos concitoyens, il faut aussi leur expliquer qu’il y a des dispositifs de contrôle. Ce n’est pas une machine folle qui ne serait pas contrôlée par des mécanismes fondamentalement démocratiques.
M. Jean-Louis Touraine, député. Je félicite à mon tour les rapporteurs pour la précision et la prudence de leur excellent rapport, sans basculer dans la facilité de l’interdiction. La conjugaison entre nécessité du progrès et opportunité du contrôle est très bien transcrite, au point que le rapport pourra servir de base à la réflexion en vue de la prochaine révision de la loi de bioéthique.
La thérapie génique sur les cellules somatiques ne présente pas de problème éthique puisqu’elle est acceptée de façon assez universelle. Il reste des problèmes techniques. Ainsi, des complications avaient pu survenir dans les cas de déficits immunitaires, mais ces problèmes sont maintenant réglés. L’extension dans différents champs nécessite des mises au point techniques. Les thérapies géniques sont pratiquées en immunologie, en hématologie et dans plusieurs autres pathologies.
Reste la question de la thérapie génique à visée germinale. La prudence est pour l’instant de l’interdire, vous l’avez rappelé. Pour autant, ne devrait-on pas assortir cette position de l’idée que cette interdiction va devoir, dans le futur, au fur et à mesure de la progression des connaissances, des techniques et des possibilités, être levée, pour préparer les esprits. Je rappelle ce que disait Sir Peter Medawar, il y a un demi-siècle, au moment où il recevait le prix Nobel de physiologie ou médecine : nous assistons, avec les progrès de la médecine, à la possibilité pour un grand nombre de sujets ayant des maladies graves, congénitales – qui dans le passé aboutissaient au décès dans l’enfance – d’atteindre l’âge adulte jeune et de se reproduire. Il annonçait l’augmentation de l’incidence des gènes de ces maladies et nous la constatons maintenant. Mais il ajoutait qu’il n’était pas pour autant nécessaire de s’en inquiéter, qu’il n’est pas nécessaire non plus de recourir à l’eugénisme, parce qu’il y aura parallèlement des progrès en génétique qui permettront de corriger, pour l’espèce humaine, certaines de ces défaillances génétiques. Il faudra accepter, dans le futur, de ne pas refuser de faire disparaître dans l’espèce humaine, et sans trop manier le spectre de l’apprenti sorcier, au moment où les choses seront parfaitement contrôlées, certains gènes de maladies, y compris dans la descendance.
C’est en même temps très important d’être ferme sur l’interdiction actuelle et de ne pas laisser se répandre dans les esprits que c’est une interdiction définitive. J’entends bien que cela peut, sur certains esprits extrémistes, heurter les idées de ceux qui croient que l’on ne doit pas toucher à la nature. Mais il n’empêche que, quand la nature fait des erreurs, il nous appartient de pouvoir les corriger, non seulement sur le malade, mais aussi sur sa descendance. Je parle d’un futur dans plusieurs décennies bien sûr.
M. Christian Bataille, député. Par ce rapport, chers collègues, vous concluez magnifiquement la législature. Je ne veux pas rentrer dans le détail de cette matière abondante, par le volume de ses développements et le nombre des sujets abordés. Je crois que cela mériterait plus que les quelques heures d’une petite séance ; il faudrait prendre davantage de temps, avec la totalité des collègues de l’Office. Nous nous contenterons aujourd’hui de cet échange. Je voudrais insister sur le contenu véritablement politique de votre contribution. À l’Office, nous avons sans cesse affirmé la victoire de la science et de la raison dans notre civilisation, dans un contexte baignant dans l’irrationalisme porté par certains médias. Malheureusement, un rapport du poids de celui-là ne trouvera sans doute pas l’écho qu’il mérite. Au contraire, on verra, manipulée par les uns ou par les autres, telle ou telle anecdote prospérer sur tel ou tel aspect.
Les rapporteurs sont symboliques de ce que représente notre Office, gauche et droite, majorité et opposition. Très souvent, nous nous sommes retrouvés sur ces sujets. Je pense que l’Office devrait jouer, dans l’avenir, un rôle beaucoup plus grand que celui auquel les textes règlementaires le limitent. L’Office aborde le fond des sujets, explore des champs scientifiques nouveaux, alors que les commissions permanentes ont un rôle véritablement conservateur sur ces sujets, nous l’avons constaté au cours de cette législature. La richesse de ce rapport mériterait un autre destin que de garnir les étagères de la collection déjà très riche des rapports de l’OPECST.
Ce rapport devrait nourrir des projets tels que celui que Patrick Hetzel a proposé et que je soutiens. L’Office devrait avoir un rôle législatif direct qu’il n’a pas ; nous devons passer par le filtre des commissions ou attendre du Gouvernement qu’il recherche des équilibres parfois complexes. L’Office a toujours joué un rôle qui était amputé des conséquences de ses propositions. J’en suis l’illustration exceptionnellement contraire : il y a vingt-cinq ans de cela, un rapport que j’avais rédigé sur les déchets nucléaires est devenu une loi, grâce à l’établissement d’une connexion entre le travail de l’Office et les commissions permanentes de l’Assemblée. J’ai le sentiment, aujourd’hui, que ce n’est pas vraiment le cas, au contraire ; les commissions cherchent à mettre des bâtons dans les roues de l’Office. Je conclus mon propos en vous félicitant de la qualité de ce rapport qui réaffirme le rôle de la science et de la recherche, dans un contexte où la raison doit dominer. Pour une prochaine législature, il conviendrait de le traduire en droit mieux que nous n’avons pu le faire, jusqu’à présent, pour les autres travaux de l’OPECST, en raison des limites des textes réglementaires.
Mme Delphine Bataille, sénatrice. Je souligne aussi l’importance et la qualité du travail que vous avez réalisé sur les enjeux et les recommandations. J’aurais deux questions pratiques. L’une sur l’espoir que constituent les biotechnologies appliquées à la médecine humaine. Je salue votre volonté de continuer les recherches. Vous avez indiqué clairement qu’un moratoire n’était ni souhaitable, ni possible. D’autres organismes que vous avez rencontrés, à l’instar d’Alliance Vita, demandent-ils un moratoire sur les recherches fondamentales sur les cellules germinales ? Je ne partage en rien les positions de cette association, je souhaiterais connaître leurs motivations, au-delà du fait que ces recherches pourront vite être appliquées.
Sur la dimension éthique, quels enseignements tirez-vous des législations trop restrictives (Allemagne) ou plus permissives (Royaume-Uni) ? Quel est le comportement des autorités publiques de ces pays face à ces restrictions ? Que peut-on espérer pour un accord européen, voire international, et quel rôle pourrait jouer la France dans cette perspective ? Vous avez fort justement souligné l’insuffisance du contrôle parlementaire. Cela s’applique-t-il à d’autres pays d’Europe ?
Mme Catherine Procaccia. Sur les thérapies géniques, pour l’instant les techniques ne sont pas suffisamment sûres pour être appliquées aux cellules germinales, mais nous estimons qu’il ne faut pas rester bloqué sur cette question. Il y aura des expérimentations en laboratoire. Au Royaume-Uni, on peut faire des recherches sur les embryons jusqu’à quatorze jours. Quand ces techniques auront fait leurs preuves en matière somatique, il sera temps de passer aux cellules germinales. Ceux qui sont porteurs de ces maladies invalidantes, insoignables, sans médicaments, ne pourraient pas concevoir de continuer à transmettre leurs maladies aux nouvelles générations. On a bien éradiqué la variole, certes par d’autres méthodes, pourquoi ne le ferait-on pas pour d’autres maladies ? Tous les chercheurs qui travaillent sur ces hypothèses nous ont dit que cela devrait intervenir dans quinze ou vingt ans. Ces techniques nous permettront peut-être d’aller plus loin. Pour l’instant, il ne faut surtout pas interdire la recherche fondamentale.
Alliance Vita se base sur des dérives qui pourraient intervenir, comme l’eugénisme, alors que nous n’en sommes qu’à la recherche fondamentale. C’est vraiment un espoir. Nous avons rencontré en Allemagne des associations plus conservatrices encore qu’Alliance Vita, qui refusent toute intervention sur les gènes. Nous sommes le premier parlement à s’être penché sur les nouvelles biotechnologies appliquées dans leurs trois domaines (rouges, vertes et blanches). Nous avons une avance qui nous permettra de légiférer. Ainsi, lors de l’examen récent du projet de loi sur la biodiversité, nous avons pu nous opposer à un amendement qui visait à considérer les nouvelles techniques de sélection végétale comme des OGM, empêchant ainsi la recherche.
Le travail que nous avons accompli permettra, je l’espère, d’enclencher un mouvement international. Mais je pense personnellement que les organisations internationales ne servent à rien. L’étiquetage des huitres « diploïdes » ou « triploïdes », n’évoque rien pour les consommateurs, par contre indiquer huitres « de pleine mer » ou « de bassin » clarifierait les choses.
M. Jean-Yves Le Déaut. Sur votre question relative à l’étiquetage, je répondrai par une autre question : seriez-vous favorables à ce que l’on indique sur les étiquettes « blé hexaploïde » ou « farine hexaploïde » ? Le saumon génétiquement modifié qui est élevé dans des bassins à terre mériterait, par contre, un étiquetage. Je confirme que la recherche décroche en France et que nous perdons notre capacité d’expertise internationale. Aucune des 48 unités de l’INRA ne travaille sur des techniques de transgenèse en champ, elles opèrent uniquement en milieu confiné. Toutes les expérimentations sont arrêtées. La controverse sur les OGM a nui, globalement, à notre crédibilité dans un certain nombre de secteurs, il faut le savoir. L’ancienne présidente de l’INRA, Marion Guillou, le dit lors d’auditions publiques depuis un certain nombre d’années déjà. Il peut paraître utile d’éradiquer des espèces d’insectes porteurs de maladies, mais attention à la transmission interespèces d’un gène d’infertilité avec forçage génétique. Il faut bien réfléchir à toutes les conséquences possibles. C’est pour cela que nous demandons la réversibilité. C’est pour cela aussi que nous demandons la réunion d’experts au niveau international.
Très peu parlent aujourd’hui des conséquences sanitaires des OGM végétales. Un grand nombre de mutations génétiques se produisent chaque jour dans tout être vivant, il n’y a pas de raison que la modification d’un seul gène d’une plante constitue un problème sanitaire – outre le fait que toute plante nouvelle est potentiellement pathogène (en cas d’allergie, par exemple). Ces dernières années, nous avons déposé plusieurs propositions de loi à la suite de rapports de l’OPECST.
Nous ne proposons pas de déclasser juridiquement les OGM. La mutagenèse est dispensée des dispositions de la directive européenne n° 2001/18 dans l’Union européenne, au contraire de ce qui se passe au Brésil. Comment peut-on s’en remettre, dans un pays démocratique, à une décision de la Cour de justice (CJCE) sur des technologies qui n’existaient pas en 2001 et avec des définitions qui ne sont plus adaptées à ces technologies ? Il s’agit d’une démission du politique. Le HCB doit donner son avis pour les autorisations, mais il n’y a pas de raison que les analyses réglementaires des nouvelles techniques de sélection soient les mêmes que pour les OGM, qui connaissent des risques d’activation de gènes dormants.
Sur la brevetabilité des gènes, notre modèle, qui s’appuie sur un système d’innovation ouvert avec le certificat d’obtention végétale (COV), doit être promu dans les conventions internationales. Nous sommes opposés à la brevetabilité des gènes, qui n’est pas permise au niveau international, mais qui peut être contournée si l’on dit qu’on les fabrique de façon synthétique. Un groupe d’experts internationaux devrait aborder cette question.
Nous considérons qu’il ne faut pas travailler sur les cellules germinales. Mais, comme le disent certains, soigner des personnes comporte le risque qu’ils transmettent leur maladie alors qu’ils seraient morts sinon. C’est un vrai sujet philosophique que nous n’avons pas abordé, car aujourd’hui, le diagnostic préimplantatoire (DPI) suffit.
En France, la science et la raison n’ont pas l’importance qu’elles ont ailleurs. Nous avons une culture dominante juridique et politique. Il faudrait mieux équilibrer la formation de nos élites. Comme indiqué dans la résolution sur les sciences et le progrès dans la République, adoptée par l’Assemblée nationale en février 2017, il faut faire la distinction entre les croyances et les opinions, qui sont respectables, et les savoirs, sur lesquels on doit pouvoir s’appuyer. L’expertise doit être à la base de la décision politique, après avoir organisé un débat pour les citoyens.
M. Bruno Sido. Je remercie les rapporteurs pour leur travail considérable et les réponses apportées au cours de ce débat. Des questions politiques et philosophiques importantes ont été abordées. Un scientifique ne se satisfera jamais de débattre avec des personnes qui ne connaissent pas le sujet.
M. Jean-Yves Le Déaut. Je remercie les collaborateurs de l’OPECST pour leur travail tout au long de cette étude.
Mme Catherine Procaccia. Je suis heureuse d’avoir travaillé avec M. Le Déaut sur ce sujet, qui a été passionnant, et qui constitue son dernier rapport à l’Office.
*
* *
Après modification de la recommandation n° 10, l’Office a adopté à l’unanimité les recommandations des rapporteurs et autorisé la publication du rapport.
COMPOSITION DU COMITÉ DE PILOTAGE
§ M. Hervé Chneiweiss, président du comité d’éthique de l’Institut nationale de la santé et de la recherche médicale (INSERM), ancien membre du conseil scientifique de l’OPECST
§ Mme Hélène Berges, chercheur à l’Institut national de la recherche agronomique (INRA), membre du conseil scientifique de l’OPECST
§ M. Jean-Christophe Pages, président du conseil scientifique du Haut Conseil des biotechnologies (HCB)
§ Mme Karine Giovanangeli, chercheur au Muséum national d’histoire naturelle (MNHN)
§ M. Eric Marois, chercheur à l’université de Strasbourg, INSERM et CNRS
§ M. Pierre Jouannet, membre de l’Académie nationale de médecine et du comité d’éthique de l’INSERM
LISTE DES PERSONNES AUDITIONNÉES
I. AUDITIONS
Auditions individuelles
§ Mme Marion Guillou, présidente de l’IAVFF-Agreenium et ancienne présidente de l’Institut national de la recherche agronomique (INRA)
§ M. Jean-Christophe Pagès président du comité scientifique du Haut Conseil des biotechnologies (HCB), professeur des universités, patricien hospitalier à l’université François Rabelais de Tours et au CHRU, responsable des laboratoires de recherches de thérapies innovantes à l’EFS
§ Mme Catherine Jessus directrice de l’institut des sciences biologiques (INSB) du CNRS
§ M. Christian Brechot, directeur général de l’Institut Pasteur
§ M. François Houllier, président de l’INRA et M. Antoine Momot, chef du cabinet du président de l’INRA
§ M Patrick Gaudray, président de la section technique du Comité consultatif national d’éthique (CCNE), chercheur en génétique et en génomique, directeur de recherche au CNRS
§ M. Hervé Chneiweiss, directeur du laboratoire Neurosciences Paris-Seine (INSERM/CNRS/UPMC) de l’Institut de biologie.
§ M. Alain Fischer, professeur de médecine au Collège de France, directeur de l’Institut Imagine-hôpital Necker enfants malades
§ Mme Carine Giovanangeli, Laboratoire structure et instabilité des génomes, CNRS UMR7196 – INSERM U1154 – Museum national d’histoire naturelle, directeur de l’Institut thématique multi-organisme bases moléculaires et structurales du vivant (Aviesan)
§ M. Georges Pelletier, directeur de recherche honoraire à l’INRA, membre de l’Académie d’agriculture, membre de l’Académie des sciences
§ Mme Marie-Christine Blandin, sénatrice, membre de l’OPECST
§ M. Philippe Lecouvey, directeur général des instituts techniques agricoles (ACTA)
§ Mme Emmanuelle Charpentier, directrice de l’institut Max-Planck de biologie infectieuse de Berlin, co-découvreuse de la technologie CRISPR-Cas9
§ M. Eric Devron, directeur général, Union française des semenciers (UFS), et M. Marc Richard-Mollard, délégué permanent, Initiatives biotechnologiques végétale (IBV)
§ M. Luc Mathis, CEO Calyxt, groupe Cellectis
§ M. Philippe Mauguin, président de l’INRA, et M. Christian Huygues, directeur scientifique adjoint agriculture de l’INRA
§ M. Edwin F. F. Hecker, président de NBT Platform, M. Andrea Boccuni, secrétariat de NBT Platform
§ M. André Choulika, PDG du groupe Cellectis
Table ronde
Table ronde sur les huîtres triploïdes, Sénat, Paris (22 novembre 2016)
§ M. Philippe Ortin, vice-président du comité national de la conchyliculture (CNC) et président du secteur Huîtres, accompagné de M. Philippe Maraval, directeur général, et M. Charles-Louis Ponchy-Pommeret, responsable des affaires juridiques du CNC
§ M. Stéphane Angeri, président du syndicat des écloseries et nurseries de coquillages de France (SENC), accompagné de M. Bertrand du Mesnildot, membre du bureau du syndicat
§ M. Benoît Le Joubioux, président de l’association Ostréiculteur Traditionnel, accompagné de M. Louis Teyssier, vice-président de l’association, également président du CRC Normandie.
§ Mme Mayline Houssin, chercheuse au laboratoire Frank Duncombe (virologie, bactériologie), microbiologiste environnementale
§ Mme Sylvie Lapegue, responsable de l’une des unités en charge de ces questions au sein de l’IFREMER (santé, génétique et microbiologie des mollusques), accompagnée de M. Philippe Goulletquer, membre de la direction scientifique
§ M. Andreas Seiler, chef du bureau de la conchyliculture et de l’environnement littoral, sous-direction de l’aquaculture et de l’économie des pêches, direction des pêches maritimes et de l’aquaculture, ministère de l’environnement, de l’énergie et de la mer
§ M. Joël Labbé, sénateur
Conférences et séminaires
§ Séminaire du comité d’éthique de l’INSERM sur CRISPR-Cas9, Paris (16 mars 2016)
§ Séance publique à l’Académie des sciences : conférences de Mmes Emmanuelle Charpentier et Jennifer Doudna sur CRISPR-Cas9, Paris (22 mars 2016)
§ Séminaire de la Fédération des académies de médecine européennes (FEAM) à l’Académie des sciences, Paris (28 avril 2016)
II. AUDITIONS PUBLIQUES
A. AUDITION PUBLIQUE DU 7 AVRIL 2016.
Les enjeux des nouvelles biotechnologies : la modification ciblée du génome avec CRISPR-Cas9
1. Table ronde n° 1 : CRISPR-Cas9 : une rupture technologique issue de la recherche fondamentale
§ M. Pierre Jouannet, professeur émérite à l’université Paris V- Descartes, membre de l’Académie nationale de médecine
§ Mme Jennifer Merchant, professeur à l’université Paris-2 Panthéon-Assas, politologue, membre de l’institut universitaire de France
§ M. Jean-Claude Ameisen, médecin, président du Comité consultatif national d’éthique (CCNE)
§ M. Jean Christophe Pages, professeur, président du comité scientifique du Haut Conseil aux biotechnologies (HCB)
§ M. Philippe Horvath, cadre scientifique (senior scientist), DuPont
2. Table ronde n° 2 : Les différents domaines d’applications de CRISPR-Cas9
a. Thérapies géniques : de la recherche à la clinique
§ M. Jean-Louis Mandel, médecin, généticien à l’Institut de génétique et de biologie moléculaire et cellulaire (IGBMC)
§ M. Jean-Claude Weill, professeur d’immunologie a l’institut Necker Enfants Malades (INEM), membre de l’Académie des sciences
§ M. Mark Bale, président du comité de bioéthique du Conseil de l’Europe
§ Mme Emily Hamblin, conseillère scientifique de l’ambassade britannique à Paris
§ M. André Choulika, PDG de Cellectis
b. Quel potentiel des nouvelles biotechnologies pour une agriculture durable et compétitive ?
§ M. Eric Marois, chargé de recherche à l’université de Strasbourg et à l’INSERM
§ M. Michel Griffon, chercheur agronome, économiste
§ M. Yves Bertheau, directeur de recherche à l’Institut national de la recherche agronomique (INRA) et au Muséum national d’histoire naturelle (MNHN)
§ M. Jean-Christophe Gouache, directeur des affaires internationales de Limagrain
§ M. Pierre-Benoit Joly, économiste et sociologue, directeur de recherche INRA, LISIS et IFRIS
B. AUDITION PUBLIQUE DU 27 OCTOBRE 2016.
Les nouvelles biotechnologies : quelles applications, quel débat public ?
1. PREMIÈRE TABLE RONDE : LES NOUVELLES BIOTECHNOLOGIES : RECHERCHE ET DEBAT PUBLIC
§ Mme Christine Pourcel, chercheur à l’Institut de biologie intégrative de la cellule (I2BC), université Paris Saclay
§ M. David Bikard, responsable de laboratoire à l’Institut Pasteur
§ M. Pierre Monsan, président de la Fédération française des biotechnologies (FFBiotech), directeur fondateur de Toulouse White Biotechnology
§ M. David Winickoff, professeur associé de bioéthique à l’université de Californie-Berkeley, analyste à l’OCDE en nanotechnologies, biotechnologies et technologies convergentes
§ M. Philipp Lengsfeld, député (CDU-CSU) au Bundestag
§ M. Daniel Boy, directeur de recherche à la Fondation nationale des sciences politiques (FNSP) et au Centre de recherches politiques de Sciences Po (CEVIPOF), enseignant à Sciences Po Paris
2. DEUXIÈME TABLE RONDE : APPLICATIONS DES NOUVELLES BIOTECHNOLOGIES EN MÉDECINE HUMAINE : POTENTIALITÉS ET QUESTIONS ÉTHIQUES
§ M. Karim Laouabdia-Sellami, directeur général adjoint chargé de la politique médicale et scientifique de l’Agence de la biomédecine (ABM)
§ M. Jean-Michel Race, directeur à l’Agence nationale de sécurité des médicaments et des produits de santé (ANSM), chargé d’une direction produits
§ M. Hervé Chneiweiss, président du comité d’éthique de l’Institut national de la santé et de la recherche médicale (Inserm), membre du conseil scientifique de l’OPECST
§ M. Pierre Cordelier, directeur de recherche Inserm, responsable d’équipe au sein du Centre de recherches en cancérologie de Toulouse, président de la Société française de thérapie cellulaire et génique
§ M. Christian Cottet, directeur général de l’Association française contre les myopathies (AFM)
§ Mme Blanche Streb, directrice des études d’Alliance Vita
§ M. Frédéric Simard, directeur de recherche à l’Institut de recherche pour le développement (IRD), maladies infectieuses et vecteurs : écologie, génétique, évolution et contrôle (MIVEGEC)
3. TROISIÈME TABLE RONDE : APPLICATIONS DES NOUVELLES BIOTECHNOLOGIES EN AGRICULTURE : LES MODIFICATIONS CIBLÉES DU GÉNOME DES PLANTES ET DES ANIMAUX
§ M. Peter Rogowsky, chef adjoint du département biologie et amélioration des plantes (BAP) de l’Institut national de recherche agricole (INRA)
§ Mme Estelle Brosset, professeure en droit public à l’université Aix-Marseille
§ M. Eric Devron, directeur général de l’Union française des semenciers (UFS)
§ M. Patrick De Kochko, représentant des Amis de la Terre
§ M. Guy Kastler, membre fondateur de la Confédération paysanne
§ M. Etienne Gangneron, vice-président de la Fédération nationale des syndicats d’exploitants agricoles (FNSEA)
III. MISSIONS EFFECTUÉES EN FRANCE
A. VISITE DU SITE EXPÉRIMENTAL « PECH ROUGE » DE L’INRA ET TABLE RONDE SUR LES VIGNES RÉSISTANTES, GRUISSAN (9 SEPTEMBRE 2016)
§ M. Christian Huygues, directeur scientifique agriculture, Institut national de la recherche agronomique (INRA), accompagné de M. François Hequet, cabinet du président de l’INRA
§ M. Hernàn Ojeda, directeur de l’INRA Pech Rouge, Gruissan
§ M. Jean-Louis Escudier, INRA Pech Rouge, Gruissan
§ Mme Carole Caranta, direction du développement des biotechnologies et de l’amélioration des plantes, INRA
§ M. Delmotte, INRA Bordeaux
§ M. Dominique Forget, INRA Bordeaux
§ M. Patrice This, INRA Montpellier
§ M. Laurent Brukner, INRA Montpellier
§ M. Rémy Cailliatte, INRA Avignon
§ M. Schneider, INRA Colmar
§ M. Didier Merdinoglo, INRA Colmar
§ M. François Hochereau, INRA Evry
§ M. Jean Tkaczuk, président du comité consultatif régional R&D technologique (CCRRDT) de la région Occitanie
§ M. Jacques Gravegeal, Vins de Pays d’Oc
§ M. Xavier de Volontat, AOC Corbières, président du conseil interprofessionnel des vins AOC du Languedoc et des IGP Sud de France (CIVL)
§ M. Bernard Augé, directeur général adjoint Œnotourisme et innovation, CIVL
§ M. Ferreira, bureau national interprofessionnel du Cognac (BNIC)
§ M. Jean-Pierre Van Ruyskensvelde, directeur général de l’institut français de la vigne et du vin (IFV)
§ M. Laurent Audeguin, responsable sélection, R&D, IFV, ENTAV-INRA
§ M. Roland Courteau, sénateur, vice-président de l’OPECST
§ Mme Marie-Hélène Fabre, députée
§ M. Jacques Bascou, président du Grand-Narbonne
§ M. René Moreno, conseiller régional
B. VISITE DU GÉNOPOLE D’EVRY (12 DÉCEMBRE 2016)
§ Présentation du Génopole et discussion : M. Pierre Tambourin, directeur général de Génopole ; M. Emmanuel Dequier, directeur de Génopole Recherche et Plates-Formes
§ AFM-Téléthon / Généthon : Christian Cottet, directeur général de l’AFM-Téléthon ; M. Frédéric Revah, directeur général du Généthon, M. Serge Braun, directeur scientifique de l’AFM-Téléthon ; Mme Isabelle Richard, responsable de l’équipe de recherche du Généthon sur les dystrophies musculaires
§ Déjeuner-débat : Mme Cécile Martinat, directrice du laboratoire I-Stem, M. Marc Peschanski, directeur scientifique du laboratoire I-Stem ; M. Emmanuel Dequier, directeur de Génopole Recherche et Plates-Formes
§ Visite de l’Institut de biologie systémique et synthétique (ISSB) : M. François Kepes, directeur ; M. Joan Herisson
§ Visite de la société Abolis : M. Cyrille Pauthenier, président
IV. MISSIONS EFFECTUÉES À L’ÉTRANGER
A. ROYAUME-UNI, LONDRES (23 ET 24 MAI 2016)
§ Le point de vue des donateurs : Mme Katherine Litter, conseillère au Wellcome Trust, Mme Sarah Rappaport, conseillère au Wellcome Trust ; M. Robin Buckle, directeur des programmes des sciences au Medical Research Council (MRC) ; Mme Sophia Abbasi, directeur des programmes au Biotechnology and Biological Science Research Council (BBSRC)
§ M. Peter Border, Parliamentary Office for Science and Technology (POST)
§ Pr Robin Lovell-Badge, Crick Institute
§ Pr Ottoline Leyser, Sainsbury Laboratory, Université de Cambridge
§ M. Renaud Wilson, conseiller, Department for Environment, Food and Rural Affairs (DEFRA)
§ M. Pete Mills, Nuffield Council of Bioethics
§ Le cadre législatif : M. Ian Rees, directeur d’unité, stratégie d’inspection, Medicines and Healthcare Products Regulatory Authority (MHRA) ; Mme Louise Bisset, expert en pharmacologie, médecine biologique, MHRA ; M. Martin O’Kane, directeur de l’unité des essais cliniques, MHRA ; M. Andy Gregory, directeur adjoint, MHRA ; M. Julian Bonnerjea, Manager, unité de biologie, division des licences, MHRA ; M. Mark Bale, directeur adjoint et conseiller scientifique du ministère de la santé ; M. Colin Pavelin, directeur de la médecine régénérative et des maladies rares, ministère de la santé ; Mme Juliet Tizzard, directrice de la stratégie, Human Fertilisation and Embryology Authority (HFEA) ; et Mme Mary Collins, directrice de la division des thérapies avancées, National Institute for Biological Standards and Control (NIBSC)
§ M. James Lawford Davies, juriste, Hempsons
§ Le débat public : M. Nick Meade, Genetic Alliance ; et Mme Hilary Sutcliffe, MATTER
B. ÉTATS-UNIS (MAI-JUIN 2016)
1. Boston (31 mai 2016)
§ CRISPR Therapeutics : M. Rodger Novak, CEO, fondateur ; M. Bill Lundberg, chef du service scientifique ; M. Chad Cowan, chercheur ; M. Samarth Kulkarni, chef du service commercial
§ Editas Medicine : M. Tim Hunt, vice-président des affaires internes ; Mme Katrine Bosley, CEO ; Mme Sandra Glucksman, COO; et M. David Liu, co-fondateur
§ Pr George Church, Harvard Medical School, Université de Harvard
§ Addgene : Mme Joanne Kamens, directrice exécutive ; M. Andy Baltus, Directeur du Business Development ; et Mme Melina Fan, fondateur et CSO
§ Café des sciences: M. Olivier Pourquié, professeur de génétique et de pathologie à Harvard Medical School et Brigham and Woman’s Hospital ; et M. Julien Muffat, chercheur en cellules souches au Whitehead Institute, Massachusetts Institute of Technology (MIT)
§ M. Jean-Jacques Yarmoff, attaché pour la Science et la Technologie au Consulat général de France
§ M. Valéry Freland, consul général
2. Washington (1er et 2 juin 2016)
§ M. Jacob Sherkow, professeur associé, New York Law School
§ Mme Natalie Kirilichin, staff de Mme Patty Murray, sénatrice, spécialiste des questions de politique de santé
§ Académie nationale des sciences : M. Ralph Cicerone, président de l’Académie nationale des sciences ; Mme Diane Griffin, vice-présidente de l’Académie nationale des Sciences ; Mme Robin Schoen, directrice du comité sur l’agriculture et les ressources naturelles
§ Mme Nathalie Broadhurst, ministre conseiller de l’ambassade de France
§ M. Rodolphe Barrangou, professeur associé en science de l’alimentation, université d’Etat de Caroline du Nord
§ US Department of Agriculture (USDA) et Environmental Protection Agency (EPA) : M. Mark Petry, Deputy Director, New Technologies and Production Methods Divsion, USDA; Mme Sally Mccammon, Biotechnology Regulatory Services Animal and Plant Health Inspection Service, USDA; Mme Ann Marie Thro, Senior Advisor, Office of the Chief Scientist, USDA ; et M. Chris Wozniak, Biotechnology Special Assistant, EPA
§ Federal Department of Agriculture (FDA) :
Center for Veterinary Medicine : Mme Larisa Rudenko, directrice, Animal Biotechnologies Group ; Mme Tracey Forfa, Deputy Director ; M. Harlan Howard, Master Reviewer, Animal Biotechnology Group ; Mme Malini Wileman, Regulatory Reviewer, Animal Biotechnology Group ; M. Eric Schulze, Regulatory Reviewer, Animal Biotechnology Group ; Mme Adrianne Roa, Project Manager, Animal Biotechnology Group
FDA’s Commissioner’s Office : Mme Ritu Nalubola, conseillère (Senior Policy Advisor) ; M. Matthew Scherer, International Policy Analyst
FDA’s Center for Food Safety and Nutrition : M. Jason Dietz, Policy Analyst, Office of Food Additive Safety ; et M. Robert Merker, Supervisor, Division of Biotechnology and GRAS Notice Review, Office of Food Additive Safety
§ M. Bill Foster, député (Representative), Congrès des États-Unis [vidéoconférence du 21 septembre 2016]
§ Mme Minh-Hà Pham, conseillère pour la science et la technologie au Consulat général de France
§ Mme Mireille Guyader, directrice du bureau INSERM-USA
§ M. Clément Lefort, attaché adjoint pour la science et la technologie au Consulat général de France
3. San Diego (3 et 4 juin 2016)
§ Cibus : M. Peter Beetham, Président et CEO ; M. Greg Gocal, directeur scientifique ; et M. Sean O’Connor, Senior Vice President
§ M. Samir Elamrani, avocat, partenaire spécialisé en propriété intellectuelle, Wilson Sonsini Goodrich & Rosati
§ M. Guy Bertrand, professeur et directeur du laboratoire conjoint UCSD/CNRS, université de Californie San Diego
§ M. Pradeep Khosla, président (Chancellor), université de Californie de San Diego (UCSD)
§ M. Ethan Bier, professeur en biologie cellulaire et du développement ; et M. Valentino Gantz, post-doctorant, université de Californie San Diego (UCSD)
§ Center for Ethics in Science & Technology, université de Californie San Diego (UCSD) : M. Michael Kalichman, cofondateur du centre ; et Mme Mary Devereaux, bioéthicienne et directrice adjointe du UCSD Research Ethics Program
§ M. Eric Fullerton, professeur, fondateur du laboratoire international associé (LIA) CNRS/UCSD, université de Californie San Diego, université Paris-Sud et université de Lorraine
§ M. Fabien Agenes, attaché pour la Science et la Technologie au Consulat général de France
4. San Francisco (5 et 6 juin 2016)
§ Dîner-débat : Mme Nathalie Dubois-Stringfellow, vice-présidente, gestion et développement des produits, Sangamo BioSciences ; M. Christian Vaisse, professeur à université de Californie San Francisco (UCSF) ; M. Jacques Mallet, UCSF et Institut du cerveau et de la moelle épinière à Paris ; M. Dominique Loqué, directeur de recherche au Joint BioEnergy Institute et chercheur affilié au Lawrence Berkeley National Laboratory et au Synthetic Biology Institute de l’université de Californie-Berkeley ; M. Didier Perez, entrepreneur ; M. Romain Rouet, post-doctorant à l’université de Californie-Berkeley
§ Mme Jennifer Doudna, professeure, université de Californie-Berkeley, co-découvreuse de la technologie CRISPR-Cas9
§ M. Hank Greely, professeur de droit à l’université de Stanford, spécialiste des implications éthiques, légales et sociales des technologies biomédicales
§ M. Andy May, Chief Scientific Officer de Caribou Biosciences, jeune pousse (startup) co-fondée par Mme Jennifer Doudna
§ M. Alex Marson, médecin, chercheur en génomique, membre de l’Innovative Genomics Initiative, université de Californie San Francisco (UCSF) ; et Mme Kathrin Schumann, post-doctorante, UCSF
§ M. Philippe Perez, attaché pour la Science et la Technologie au Consulat général de France
§ M. Hocine Lourdani, attaché adjoint pour la Science et la Technologie au Consulat général de France
C. ALLEMAGNE (JUILLET 2016)
1. Berlin (4 et 5 juillet 2016)
§ Ministère fédéral de l’enseignement et de la recherche (BMBF) : M. Stephan Roesler, responsable du département Éthique et loi ; M. Dietmar Walter, adjoint responsable département Éthique et loi ; et Mme Katrin Benninghoff, responsable du département Stratégie et politiques publiques pour les sciences de la vie
§ Mme Christine Lang, présidente du Haut conseil à la bioéconomie allemand et directrice de la société Organobalance
§ Commission pour la recherche et l’évaluation des choix technologiques, Bundestag : Mme Patricia Lips (CDU), présidente, M. René Röspel (SPD), député, et M. Stefan Kaufmann (CDU), député
§ Société civile : M. Christof Potthof, Réseau pour l’éthique génétique (Gen-ethisches Netzwerk) ; et Heike Moldenhauer, Alliance pour l’environnement et la protection de la nature (BUND)
§ M. Arnold Sauter, vice-président du Bureau allemand d’évaluation des choix technologiques auprès du Bundestag (TAB)
§ M. Harald Ebner (Vert), député, commission pour la recherche et l’évaluation des choix technologiques, Bundestag
§ Comité d’éthique allemand : M. Peter Dabrock, président ; M. Joachim Vetter, responsable du bureau du comité à Berlin ; et Mme Nora Schultz, chargée de mission scientifique
§ M. Daniel Forler, Alliance Manager, Global External Innovation & Alliances, Bayer Pharma
§ Pre Emmanuelle Charpentier, directrice de l’institut Max-Planck de biologie infectieuse de Berlin, co-découvreuse de la technologie CRISPR-Cas9
§ Académie des sciences de Berlin-Brandebourg, groupe de travail sur les technologies génétiques : M. Ferdinand Hucho, fondateur et porte-parole adjoint du groupe de travail, professeur de biochimie à l’université libre de Berlin ; M. Jens Reich, membre du groupe de travail, directeur du groupe de recherche « bioinformatique » du Centre Max Delbrück de médecine moléculaire ; Mme Lilian Marx-Stölting, collaboratrice scientifique du groupe de travail
§ et M. Ralf Kühn, directeur du groupe de recherche « modèles pathologiques basé sur les cellules iPS » du Centre Max Delbrück de médecine moléculaire.
§ S. E. M. Philippe Etienne, ambassadeur de France
2. Munich (6 juillet 2016)
§ Helmholtz Zentrum München (HMGU) : Pr Dr h.c. Martin Hrabé de Angelis, Deutsches Zentrum für Diabetesforschung (HMGU/DZD) ; Pr Dr Wolfgang Wurst, directeur du centre de recherche allemand pour la santé et l’environnement, HMGU ; et Dr Astrid Glaser, DZD
§ Académie des sciences Leopoldina : Pr Dr Bärbel Friedrich; Pr Dr Ernst-Ludwig Winnacker ; Dr Marina Koch-Krumrei
§ Déjeuner-débat : Pr Dr rer. nat. Klaus-Peter Janssen, directeur du laboratoire Molekulare Tumorbiologie, Technische Universität München, (TUM-CHU) ; Dr Ulrike Artmeier-Brandt, représentante de la commission d’éthique de la chambre bavaroise des médecins ; Dr Hannemor Keidel, vice-présidente Relations Internationales, Technische Universität München (TUM)
§ Office européen des brevets (OEB) : M. Benoît Battistelli, président ; M. Gilles Requena, directeur de cabinet du président ; Mme Siobhàn Yeats, directrice campagne médiatique, communication ; M. Dieter Tzschoppe, directeur chimie pure et appliquée ; M. Yann Ménière, économiste en chef ; Mme Sylvie Strobel, juriste ; M. Marko Schauwecker, juriste ; et Mme Heli Pihlajamaa, directrice du droit des brevets
§ M. Paul Alibert, attaché de coopération scientifique et universitaire au Consulat général de France
§ Mme Antoinette Humeau, volontaire international, Centre de coopération universitaire franco-bavarois-SST, ambassade de France en Allemagne
§ M. Jean-Claude Brunet, consul général
D. BRÉSIL (SEPTEMBRE 2016)
1. Rio de Janeiro (27 et 28 septembre 2016)
§ Institut national du cancer José Alencar Gomes da Silva (INCA) : M. Luis Felipe Ribeiro Pinto, chercheur et directeur par intérim ; Dr Martin Hernan Bonamino, chercheur, docteur en chimie biologique ; Dr João Viola, chercheur, chef de la division de la recherche expérimentale et translationnelle, chef du programme de biologie cellulaire ; Dr Amilcar Tanuri, docteur en sciences biologiques (génétique) à l’université fédérale de Rio de Janeiro, chef du laboratoire de virologie moléculaire ; M. Joao Viégas, chargé de mission coopération internationale ; Mme Livia de Oliveira Pasqualin, chargée de mission coopération internationale
§ M. Marcelo Bozza, médecin, docteur en biologie moléculaire et cellulaire, université fédérale de Rio de Janeiro (UFRJ)
§ M. João Trinidade Marques, professeur associé, université fédérale du Minas Gerais (UFMG)
§ M. Alexandre Nepomuceno, docteur en biologie moléculaire des plantes, chercheur, Agence brésilienne de recherche en agronomie / Commission technique nationale de biosécurité (Embrapa/CTNBio)
§ M. Luiz António Gonçalves Rodrigues De Souza, ministère de l’agriculture brésilien
§ Fondation Oswaldo Cruz (Fiocruz) : Dr Vinicius Cotta Almeida, professeur en immunologie, chercheur en santé publique ; Dr Arnon Jurberg, post-doctorant ; et Mme Daniela Mendes da Cruz
§ M. Leonardo Zebral, ingénieur agronome, chercheur en biotechnologie végétale, laboratoire central de biologie moléculaire, université fédérale de Lavras (UFL)
2. Sao Paulo (28 et 29 septembre 2016)
§ Mme Eliane Kay, Directrice de l’association des entreprises de biotechnologies en agriculture et en agro-industrie (Agrobio)
§ M. Emmanuel Aubry, coordinateur de la recherche internationale sur le maïs tropical Limagrain
§ Université de Sao Paulo (USP): Pr Dr Luis Carlos e Souza Ferreira, docteur en sciences biologiques, departement de microbiologie, Institut des sciences biomédicales (ICB) ; Dr Márcio de Castro Silva Filho, docteur en biologie moléculaire des plantes, professeur à l’école supérieure d’agriculture Luiz de Queiroz (ESALQ), Piracicaba ; Dr Carlos Frederico Martins Menck, ICB ; Dr Oswaldo Keith Okamoto, professeur de neurologie expérimentale, Institut des biosciences ; Dr Mayana Zatz, docteure en génétique, Institut des biosciences ; Dr Wilson Silva Junior, faculté de médecine, Ribeirão Preto ; Dr Jose Eduardo Krieger, pro-recteur pour la recherche, faculté de médecine ; Gabriel Padilla, chef du département de microbiologie
§ M. Hugh Lacey, philosophie des sciences, université de Sao Paulo (USP) ; Mme Solange Teles, professeur de droit en environnement et militante anti-OGM ; et Mme Marijane Lisboa, IDEC
§ Mme Solenne Lhéritier, chargée de mission pour la science et la technologie, à Brasilia
§ Mme Laura Peudenier, chargée de mission pour la science et la technologie, à Brasilia
§ M. Julien Roques, chargée de mission pour la science et la technologie, à Rio de Janeiro
§ M. Philippe Martineau, conseiller de coopération et d’action culturelle adjoint
E. ARGENTINE (30 SEPTEMBRE AU 3 OCTOBRE 2016)
§ Société civile : Dr. Daniel Sallaberry, avocat, spécialisé en droit environnemental ; Lic. Viviana Cousté, biologiste, consultante en biotechnologie
§ Comisión Nacional Asesora de Biotecnología Agropecuaria (CONABIA, ministère de l’agro-industrie) ; Lic. Martin Lema, directeur de biotechnologie ; Ing. Agr. Néstor Roulet, secrétaire à la valeur ajoutée ; et Dr Omar Odarda, directeur national des relations agroalimentaires internationales
§ Congrès national : M. Marcelo Monfort, député, président du groupe d’amitié France-Argentine ; M. José Luis Patiño, député
§ Consejo Nacional de Investigaciones Científicas y Técnicas (CONICET) : Mg Cynthia Jeppesen, directrice d’évaluation et planification ; Dr Manuel Muñoz, enseignant-chercheur, Institut de physiologie, biologie moléculaire et neurosciences (IFIBYNE-UBA-CONICET) ; Dr Patricio Yankilevich, chef du groupe de bioinformatique (IBioBA) ; Dra Carolina Bluguermann, post-doctorante au laboratoire de recherches biotechnologiques (IIB-INTECH, UNSAM-CONICET), spécialiste de biotechnologie appliquée à la reproduction et amélioration génétique animale ; Dr Alberto Kornblihtt, directeur de l’Institut de physiologie, biologie moléculaire et neurosciences, spécialiste de biologie moléculaire et génétique
§ M. Gérard Lespourci, directeur général de Limagrain Argentine SA
§ Dîner-débat : Dra Valeria Hernandez, chercheure, Institut de la recherche pour le développement (IRD), Centre d’études en sciences sociales des mondes africains, américains et asiatiques ; Dr Christophe Albaladejo, chercheur, Institut national de la recherche agronomique (INRA), directeur français du laboratoire binational Agriterris
§ Visite des champs expérimentaux de blé de l’entreprise Florimond Desprez Argentina : Ing. Francisco Ayala, ingénieur agronome, développeur blé OGM
§ Institut d’agrobiotechnologie de Rosario (INDEAR) : Dr. Ezequiel Marchionni, directeur opérationnel ; Ing. Gerónimo Watson, directeur de technologie Bioceres ; et Lic. Clara Bisio
§ Institut national de technologie agricole (INTA) : Dr. Amadeo Nicora, président ; M. Sergio Feingold, coordinateur du programme national de biotechnologie, responsable du laboratoire d’agrobiotechnologie de Balcarce ; Mme Ruth Heinz, directrice de l’institut de biotechnologie de Castelar ; Mme Elisa C. Carrillo, directrice du centre de recherche en sciences agricoles et vétérinaires de Castelar ; Mme Dalia Marcela Lewi, responsable du groupe transformation génétique végétale de l’Institut de génétique Ewald A. Favret ; M. Oscar Taboga, coordinateur de biologie moléculaire, Institut de biotechnologie de Castelar
§ Dr Lino Barañao, ministre de science, de la technologie et de l’innovation productive, docteur en chimie, chercheur
§ M. Eric Bourland, attaché pour la Science et la Technologie au Consulat général de France
§ M. Marc Jamin, conseiller consulaire
§ M. Michel Menini, conseiller consulaire
§ Mme Suzanne Thiais, conseillère consulaire
§ Mme Valeria Hernandez, chercheuse Institut de la Recherche pour le Développement (IRD)
§ M. Christophe Albaladejo, chercheur Institut National de la Recherche Agronomique (INRA)
§ M. Raphael Trannoy, consul général
§ M. Arnaud Roux, ministre conseiller de l’ambassade de France
§ M. Grégory Varennes, premier secrétaire de l’ambassade de France
§ S.E. Pierre-Henri Guignard, ambassadeur de France en Argentine
F. ITALIE, ROME : ORGANISATION DES NATIONS UNIS POUR L’AGRICULTURE ET L’ALIMENTATION (FAO) (28 OCTOBRE 2016)
§ Organisation des Nations uniques pour l’agriculture et l’alimentation (FAO) : M. Ren Wang, sous-directeur général, département de l’agriculture et de la protection des consommateurs (AG) ; Mme Renata Clarke, directrice, bureau de la sûreté des aliments (AGF) ; M. Samy Gaïji, directeur, équipe recherche et vulgarisation (AGDR) ; M. Hans Dreyer, directeur, division production et protection des plantes (AGP) ; et M. John Ruane, consultant, équipe recherche et vulgarisation (AGDR)
§ Organisation des Nations Unies pour l’agriculture et l’alimentation (FAO) : M. Berhe Tekola, directeur de la division production et santé animale (AG) ; M. Paul Boettcher, officier, production animale, division production et santé animale (AG) ; M. Ahmed El Idrissi ; M. Henning Steinfeld, chef, information élevage, section politique et analyse sectorielle, division production et santé animale (AG) ; et M. Juan Lubroth, chef, équipe santé animale, division production et santé animale (AG)
§ Organisation des Nations uniques pour l’agriculture et l’alimentation (FAO) : Mme Maria-Helena Semedo, directrice générale adjointe, coordinatrice des ressources naturelles
§ Mme Isabelle Mialet-Serra, conseiller scientifique, représentation permanente de la France auprès des institutions des nations unies à Rome
§ M. Jérôme Audin, représentant permanent adjoint, représentation permanente de la France auprès des institutions des nations unies à Rome
G. SUISSE, GENÈVE (30 NOVEMBRE ET 1ER DÉCEMBRE 2016)
§ Organisation mondiale de la santé (OMS) : Dr Ed Kelley, directeur du département prestation de services et sécurité (SDS) ; Dr Marie-Charlotte Bouësseau, conseillère au département SDS, chargée de l’initiative sur la génomique et la santé mondiale ; Mme Marie-Paule Kieny, sous-directrice générale systèmes de santé et innovation ; et M. Michael Stouffs, consultant OMS, docteur en biologie
§ Organisation mondiale de la santé (OMS) : Dr. Dirk Engels, directeur du département des maladies tropicales négligées
§ Dîner-débat : Pr Samia Hurst-Majno, directrice de l’Institut éthique histoire humanités de l’université de Genève (UNIGE), membre de la commission nationale d’éthique dans le domaine de la médecine humaine ; Dr Sylvain Aubry, collaborateur scientifique, secteur ressources génétiques et technologies, Office fédéral de l’agriculture (OFAG) ; et Pr Nicolas Mermod, directeur de l’Institut de biotechnologies de l’université de Lausanne (UNIL)
§ Débat : Pr Patrick Francioli, vice-président de Swissethics, professeur, président de la commission cantonale d’éthique de la recherche sur l’être humain du canton de Vaud ; Dr Fabien Palazzoli, expert de la problématique des brevets couvrant la technologie CRISPR/CAS9, société IPStudies ; Dr Bernard Baertschi, maître d’enseignement et de recherche, Institut éthique histoire humanités de l’université de Genève (UNIGE) ; et Pr Nicole Déglon, professeur associée à la faculté de biologie et médecine de l’université de Lausanne, directrice du laboratoire de neurothérapies cellulaires et moléculaires du Centre hospitalier universitaire vaudois (CHUV)
§ Mme Patricia Ahl Goy, responsable de la gestion des connaissances, équipe de règlementation des semences, Syngenta
§ Débat : Pr Yvan Arsenijevic, professeur associé, chef de l’unité de thérapie génique et de biologie des cellules souches au service ophtalmologique universitaire de Lausanne ; Pr Patrick Linder, professeur, président de la plate-forme Biologie de l’Académie suisse des sciences naturelles (SCNAT) ; et Dr Franziska Oeschger, collaboratrice scientifique du forum Recherche génétique de l’Académie suisse des sciences naturelles (SCNAT)
§ Mme Marie-Anne Mortelette, conseillère santé à la représentation permanente de la France auprès de l’ONU à Genève et des organisations internationales en Suisse
§ Dr Emilie Fallet, chargée de mission scientifique, ambassade de France en Suisse
§ Pr Jérôme Pousin, attaché de coopération universitaire, scientifique et technologique, ambassade de France en Suisse
§ Mme Elisabeth Laurin, ambassadeur, représentant permanent de la France auprès de l’Office des Nations Unies à Genève et des organisations internationales en Suisse
H. BELGIQUE, BRUXELLES : COMMISSION EUROPÉENNE (6 DÉCEMBRE 2016)
§ Commission européenne, direction générale de la santé et de la sécurité alimentaire
(DG Santé) : M. Robert Vanhoordre, chef de l’unité Médicaments ; Mme Rocio Salvador Roldan, responsable des politiques pharmaceutiques, unité Médicaments ; Mme Sirkku Heinimaa, chef d’unité adjointe Biotechnologies ; M. Laurent Vernier, chargé des affaires juridiques, unité Biotechnologies et M. Jérôme Boehm, Agence européenne du médicament (EMA)
§ Commission européenne, direction générale de la recherche et de l’innovation
(DG RTD), Groupe européen d’éthique des sciences et des nouvelles technologies (GEE) : Dr Jim Dratwa, chef du secrétariat ; Mme Joanna Parkin, chargée de mission ; et Dr Sigfid Weiland, chargée de mission
§ Commission européenne, centre commun de recherche (CCR) : M. Vladimir Šucha, directeur général ; M. Guy van den Eede, chef de l’unité Connaissance au service de la santé et de la sécurité des consommateurs ; et M. Jean-Pierre Gammel, assistant du directeur général
§ Commission européenne, direction générale de la recherche et de l’innovation
(DG RTD) : M. David Gancberg, responsable de projets scientifiques et techniques, unité Outils, technologies et concepts innovants pour la recherche en santé.
§ European Food Safety Authority (EFSA) : M. Christophe Wolff, chargé des relations interinstitutionnelles du département communication et relations extérieures de l’EFSA ; Mme Sylvie Mestdagh, cadre, unité « organismes génétiquement modifiés », Autorité européenne de sécurité des aliments (EFSA) [téléconférence du 19 janvier 2016]
1 () Voir dans le tome II en annexe n° 2.
2 () Journal officiel du 13 mai 2015 : http://www.senat.fr/seances/s201505/s20150512/s20150512.pdf.
3 () Voir le compte rendu en fin du tome I du présent rapport.
4 () Le CGB est un organisme consultatif qui a précédé l’actuel Haut Conseil des biotechnologies.
5 () Les références des rapports sont précisées dans le tome II en annexe n° 1.
6 () CRISPR-Cas9 : Clustered Regularly Interspaced Short Palindromic Repeats – CRISPR associated protein 9.
7 () Voir dans le tome II en annexe n° 8.
8 () Voir dans le tome II en annexe n° 6.
9 () Voir à la fin du tome I.
10 () Convention pour la protection des droits de l'homme et de la dignité de l'être humain à l'égard des applications de la biologie et de la médecine : convention sur les droits de l'homme et la biomédecine.
11 () « Nouvelles techniques – New Plant Breeding Technologies – Première étape de la réflexion du HCB : Comité scientifique – Note sur les "Nouvelles techniques" ». http://www.hautconseildesbiotechnologies.fr/fr/system/files/file_fields/2016/03/30/cs_1.pdf
12 () J. Doudna et E. Charpentier, The new frontier of genome engineering with Crispr-Cas9, Science, n° 345 (2014).
13 () Voir le tableau précédent sur les grandes étapes de la biologie moléculaire.
14 () Philippe Horvath a participé à l’audition publique de l’OPECST du 7 avril 2016.
15 () http://www.lemonde.fr/festival/article/2016/07/19/crispr-le-big-bang-de-la-genetique_4971697_4415198.html
16 () http://www.cell.com/cell/pdf/S0092-8674%2815%2901705-5.pdf
17 () Francis Mojica a fait cinq demandes de publications entre 2003 et 2005. L’article fut proposé à Nature en novembre 2003, puis à Proceedings of the National Academy of Sciences, Molecular Microbiology, Nucleic Acid Research et enfin Journal of Molecular Evolution dans lequel il sera publié le 1er février 2005.
18 () Organismes unicellulaires procaryotes, constitués d’une cellule unique sans noyau ni organites, mais proches des bactéries.
19 () Locus, plur. loci : emplacement précis d'un gène sur le chromosome qui le porte.
20 () L’article d’Alexandre Bolotin fut publié dans Microbiology en septembre 2005.
21 () Christine Pourcel a par ailleurs participé à l’audition publique de l’OPECST du 27 octobre 2016.
22 () Gilles Vergnaud a proposé son article à cinq revues et fut publié en mars 2005 dans Microbiology.
23 () “It will be hard to detect whether something has been mutated conventionally or genetically engineered.”
24 () Voir infra.
25 () On avait déjà traité cette maladie chez le chien par thérapie génique en remplaçant un gène muté.
26 () http://www.hautconseildesbiotechnologies.fr/sites/www.hautconseildesbiotechnologies.fr/files/file_fields/2016/02/04/160204hcb-note-csnpbt.pdf
27 () Une autre présentation de ces nouvelles techniques de sélection végétale est fournie par la fiche d’information publiée par les Académies suisses des sciences en 2016 « Nouvelles techniques de sélection végétale pour l’agriculture suisse – gros potentiel, avenir ouvert », Vol. 11, No. 4, 2016 :
http://www.akademien-schweiz.ch/dms/F/Publications/Factsheets/Factsheet_TechniquesDeSelectionVegetale_F.pdf
28 () SDN : Site-Directed Nucleases.
29 () ZFN : Zinc Finger Nuclease.
30 () Les méganucléases (MN) n'ont pas fait l'objet d'une fiche du HCB car son groupe de travail a estimé que la technique était déjà dépassée par les autres outils de modification ciblée.
31 () TALEN : Transcription activator-like effector nuclease.
32 () CRISPR : Clustered Regularly Interspaced Short Palindromic Repeats.
33 () ODM : Oligonucleotide Directed Mutagenesis.
34 () RTDS : Rapid Trait Development System.
35 () RdDM : RNA-dependent DNA methylation.
36 () Jeune cellule méristèmatique.
38 () http://www.futura-sciences.com/sante/definitions/medecine-optogenetique-6414/
39 () https://www.sciencesetavenir.fr/sante/optogenetique-eclairer-les-neurones-pour-retrouver-la-memoire_29055
40 () « Modifications génétiques : le système CRISPR-Cpf1 modifie l’ARN aussi bien que l’ADN »
http://www.diplomatie.gouv.fr/fr/politique-etrangere-de-la-france/diplomatie-scientifique/veille-scientifique-et-technologique/allemagne/article/modifications-genetiques-le-systeme-crispr-cpf1-modifie-l-arn-aussi-bien-que-l
41 () "Cpf1 : CRISPR-Enzymschere schneidet RNA und DNA", communiqué de presse de l’Institut Max Planck, 21 avril 2016 : https://www.mpg.de/10464309/crispr-cpf1
42 () “Genome editing Showdown between Cas9 and Cpf1”, Nature Methods 13, 714 (2016), août 2016.
43 () “Genome-wide specificities of CRISPR-Cas Cpf1 nucleases in human cells”, Benjamin Kleinstiver et alii, Nature Biotechnology, juin 2016.
44 () Données issues de la base du Web of Science à la date du 22 novembre 2016.
45 () Premier centile.
46 () https://www.elsevier.com/
47 () Premier décile.
48 () Les résultats complets figurent dans le tome II en annexe n° 4.
49 () Voir dans le tome II en annexe n° 5.
50 () https://www.elsevier.com/
51 () Genome ENgineering Improvement for Useful plants of a Sustainable agriculture.
52 () La problématique de la recherche appliquée en biotechnologies vertes par les entreprises françaises et allemandes sera traitée dans la partie III du présent rapport.
53 () Voir le rapport présenté en février 2017 par M. Jean-Yves Le Déaut, député, et M. Bruno Sido, sénateur, sur « L'évaluation de la stratégie nationale de recherche 2015-2020 ».
54 () Voir le compte rendu de la mission dans le tome II.
55 () Précitée.
56 () Source : INSERM.
57 () Voir dans le tome II le compte rendu des missions effectuées par les rapporteurs.
58 () Voir dans le tome II en annexe n° 1.
59 () Anomalie sanguine héréditaire caractérisée par la présence dans les hématies d'une hémoglobine anormale (hémoglobine 5) qui leur confère la forme d'une faucille (falciforme) (Robert).
60 () Forme grave d'anémie, répandue surtout dans le bassin méditerranéen et due à une perturbation héréditaire de la synthèse de l'hémoglobine (Robert).
61 () Voir infra la partie sur les législations nationales.
62 () Les maladies soulignées sont celles en cours d’essais (cf. tableau suivant).
63 () “CRISPR gene-editing tested in a person for the first time – The move by Chinese scientists could spark a biomedical duel between China and the United States”, David Cyranoski, 15 novembre 2016, Nature.
64 () Audition de M. David Gancberg, responsable de projets scientifiques et techniques, unité Outils, technologies et concepts innovants, direction générale de la recherche et de l’innovation (DG RTD), Commission européenne.
65 () « Saisine concernant les questions liées au développement de la technologie CRISPR (clustered regularly interspaced short palindromic repeat) -Cas9 » http://www.inserm.fr/mediatheque/infr-grand-public/fichiers/l-ethique-a-l-inserm/crispr-saisine-cei-fr-fevrier-2016
66 () http://www.inserm.fr/inserm/accueil/qu-est-ce-que-l-inserm/l-ethique-a-l-inserm/seminaires-du-comite-d-ethique/atelier-du-comite-d-ethique-inserm-fostering-responsible-research-with-crispr-cas9/%28language%29/eng-GB
67 () Voir dans le tome II en annexe n° 14.
68 () https://rm.coe.int/CoERMPublicCommonSearchServices/DisplayDCTMContent?documentId=090000168007cf99
69 () http://www.academie-medecine.fr/wp-content/uploads/2016/04/Vesrion-bulletin-11.pdf
70 () Voir le compte rendu de ses propos dans le tome II.
71 () Voir le texte du règlement européen dans le tome II en annexe n° 15.
72 () http://ec.europa.eu/research/ege/index.cfm
73 () Voir infra la partie sur les législations nationales.
74 () Voir dans le tome II en annexe n° 17.
75 () Voir dans le tome II en annexe n° 18.
76 () http://www.ethikrat.org/press/press-releases/2016/press-release-05-2016
77 () Voir dans le tome II en annexe n° 20.
78 () http://www.gentechnologiebericht.de/bilder/BBAW_Human-Genome-Surgery_PDF-A1b-1.pdf
79 () Voir dans le tome II le compte rendu des missions effectuées par les rapporteurs.
80 () Voir dans le tome II en annexe n° 21.
81 () http://www.nek-cne.ch/fr/thematiques-en-cours-delaboration/edition-genomique/
82 () Décédé en novembre 2016.
83 () http://www.nationalacademies.org/gene-editing/Gene-Edit-Summit/index.htm .
84 () Février, avril et juillet 2016.
http://www.nationalacademies.org/gene-editing/consensus-study/meetings/index.htm
85 () Jean-Yves Le Déaut, « Intelligence artificielle, convergence technologique et droit de l’homme ».
86 () Voir dans le tome II l’annexe n° 11.
87 () Voir dans le tome II les annexes n° 9 et 10.
88 () Voir législation allemande sur la modification du génome humain dans le tome II en annexe n° 19.
89 () http://www.gesundheitsforschung-bmbf.de/de/186.php
90 () https://www.theguardian.com/science/2016/dec/15/three-parent-embryos-regulator-gives-green-light-to-uk-clinics
91 () “Human genome editing : science, ethics, and governance”, National Academy of Sciences and National Academy of Medicine, http://nationalacademies.org/cs/groups/genesite/documents/webpage/gene_177260.pdf
http://nationalacademies.org/gene-editing/consensus-study/index.htm
92 () Comme le signale l’article des docteurs Achim Rosemann et Margaret Sleebom-Faulkner paru dans la revue Regenerative Medecine le 18 septembre 2015.
93 () Comme l’a signalé l’article de M. David Cyranoski : « China’s stem cell rules go unheeded ». Nature 484(7393), 149–150 (2012).
94 () Yuan W, Sipp D, Wang ZZ, et al. Stem cell science on the rise in China. Cell Stem Cell 10(1), 12–15 (2012).
95 () Voir dans le tome II en annexe n° 12.
96 () Créés en application de l’article 16 de la convention d’Oviedo.
97 () « Les maladies mitochondriales », Agnès Roity, Marlène Rio et Arnold Munnich – campus.cerimes.fr
98 () http://www.liberation.fr/sciences/2015/02/03/bientot-des-bebes-a-trois-geniteurs-en-grande-bretagne_1194663
99 () Voir, dans le tome II, le compte rendu de l’audition publique de l’OPECST du 27 octobre 2016. Voir également le site internet d’Alliance Vita : http://www.alliancevita.org/2016/09/naissance-dun-bebe-par-la-technique-de-la-fiv-3-parents-une-transgression-sans-precedent/
100 () http://www.assemblee-nationale.fr/14/pdf/rap-off/i3898.pdf
101 () http://www.who.int/csr/resources/publications/zika/emergency-vector-control/fr/
102 () http://www.eliminatedengue.com/program
103 () Cette cassette « CRISPR » est constituée d’un guide ARN qui reconnaît la portion d’ADN à modifier et d’une protéine Cas9 qui sert de ciseau pour modifier ou insérer un gène sur la paire de chromosomes.
104 () « Faut-il relâcher le "gene drive" dans la nature ? Enjeux civilisationnels des « OGMs sauvages » Baptiste Morizot, philosophe, maître de conférences, université d’Aix-Marseille, et Virginie Orgogozo, biologiste, directrice de recherche au CNRS, Institut Jacques Monod, Paris, mai 2016. https://www.normalesup.org/~vorgogoz/gene-drive.html
105 () “Site-specific selfish genes as tools for the control and genetic engineering of natural populations”, M. Austin Burt, Department of Biological Sciences and Centre for Population Biology, Imperial College, Silwood Park, Ascot.
106 () Knipling 1979; Curtis 1985; Hastings 1994.
107 () http://www.technologyreview.com/news/543721/with-this-genetic-engineering-technology-theres-no-turning-back/
108 ) http://www.france-science.org/L-outil-CRISPR-Cas9-ouvre-la-voie.html
109 () http://www.publications.parliament.uk/pa/ld201516/ldselect/ldsctech/68/68.pdf
110 () https://www.gov.uk/government/organisations/innovate-uk
111 () Congrès de l’Union internationale pour la conservation de la nature (UICN) à Hawaï en septembre 2016.
112 () Voir infra, point 3.
113 () „Weiße Biotechnologie: Stand und Perspektiven der industriellen Biotechnologie für nachhaltiges Wirtschaften“ – http://www.tab-beim-bundestag.de/de/untersuchungen/uI0023.html
114 () http://www.senat.fr/dossier-legislatif/pjl14-359.html
http://www.assemblee-nationale.fr/14/dossiers/biodiversite.asp
Loi n° 2016-1087 du 8 août 2016 pour la reconquête de la biodiversité, de la nature et des paysages.
115 () Voir en partie IV du rapport.
116 () Ou New Plant Breeding Techniques (NPBT).
117 () https://cdn.greenpeace.fr/site/uploads/2017/02/les-impacts-des-ogm-sur-l-envi.pdf?_ga=1.124737482.1318086168.1488382958
118 () L’AFBV a réuni un groupe d’expert de ses membres constitué de MM. André Gallais, Philippe Dumont, Georges Freyssinet et Mme Yvette Dattée.
119 () Voir dans le tome II en annexe n° 7.
120 () Liste dans le tome II en annexe n° 1.
121 () Voir également la Revue de l’Académie d’agriculture n° 5 de janvier 2015 : « Chronologie des autorisations et interdictions des variétés de maïs génétiquement modifiés en France », Mme Agnès Ricroch, « Interdiction du maïs Bt MON810 en France : un vrai risque pour la sécurité alimentaire », Mme Catherine Regnault-Roger, « Contestation des PGM et de l’amélioration des plantes ; un même combat idéologique », M. André Gallais.
Voir aussi la Revue de l’Académie d’agriculture n° 7 d’octobre 2015 : « Interdiction des maïs Bt en France : l’épilogue », Mme Catherine Regnault-Roger.
https://www.academie-agriculture.fr/publications/academie-communique/revue-aaf
122 () Voir dans le tome II en annexe n° 1.
123 () Voir ci-dessous : la loi de 2008, une loi pour rien ?
124 () Loi n° 2014-567 du 2 juin 2014 relative à l'interdiction de la mise en culture des variétés de maïs génétiquement modifié.
125 () Voir ci-dessous.
126 () Audition publique du 19 novembre 2012 ; rapport (n° 759) du 27 février 2013.
127 () La journaliste parle de Gilles Eric Séralini, « professeur au CRIIGEN » (sic), en ignorant que le Comité de recherche et d’information indépendant sur le génie génétique n’est pas une université. Elle aurait pu également constater que Corinne Lepage, auditionnée le 9 février 2005 devant l’OPECST, avait déclaré que le CRIIGEN avait reçu 150 000 francs (sic) (en 2005 il s’agissait sans doute d’euros*, correspondant à un don d’entreprises dont Carrefour [voir le rapport (n° 2254) d’avril 2005 à la suite de la mission d’information de l’Assemblée nationale sur les OGM (cf. annexe page 580)]. Dans ce cas comme dans celui des scientifiques, qui auraient travaillé pour des entreprises du secteur agro-alimentaires, il y a un conflit d’intérêt, puisque par exemple dans le cas de Carrefour, l’étiquetage « non-OGM » peut leur apporter un avantage concurrentiel.
128 () “Genetically Engineered Crops – Experiences and prospects” The National Academies of Science, Engineering and Medecine (17 mai 2016).
129 () Ce sujet a été traité dans la partie III du rapport (médecine humaine).
130 () http://www.hautconseildesbiotechnologies.fr/fr/system/files/file_fields/2016/03/30/cees_1.pdf, page 15.
131 () Graham Brookes et Peter Barfoot « GM Crops Impact » – 2014, www.pgeeconomics.co.uk
132 () Die Tagezeitung (taz), 6 avril 2016.
133 () https://www.safagridees.com/interview/pamela-ronald/
134 () Agence bio, 21 février 2017.
135 () Rapport (n° 2254) de la mission d’information du 13 avril 2005.
136 () http://ec.europa.eu/food/plant/gmo/legislation/plant_breeding_en
137 () Le rapport du groupe de travail est intervenu avant l’invention de CRISPR-Cas9 et au moment de l’invention de TALEN, mais le raisonnement serait le même avec ces deux techniques.
138 () Voir note précédente.
139 () Voir le compte rendu des missions dans le tome II.
140 () Voir infra.
141 () Agence européenne des médicaments (EMA), actuellement basée à Londres, Agence européenne de sécurité alimentaire (EFSA) à Parme, Agence européenne des produits chimiques (ECHA), en tutelle en commun avec la direction générale du marché intérieur, de l’industrie, de l’entreprenariat et des PME (DG Growth), Centre européen de prévention et de contrôle des maladies (ECDC) à Stockholm et Office communautaire des variétés végétales (CPVO).
142 () En France, l’Agence nationale de sécurité sanitaire de l'alimentation, de l'environnement et du travail (ANSES), pour le volet alimentation, et le Haut Conseil des biotechnologies (HCB), pour le volet environnement, sont les deux agences qui participent à l’évaluation des dossiers OGM.
143 () Précité.
144 () http://www.lemonde.fr/planete/article/2016/12/19/ogm-l-inra-pointe-une-recherche-sous-influence_5050955_3244.html
145 () http://www.lemonde.fr/planete/article/2016/12/19/l-evaluation-de-la-toxicite-des-ogm-remise-en-cause_5051163_3244.html
146 () http://presse.inra.fr/Communiques-de-presse/Conflits-d-interet-et-publications-sur-le-sujet-des-plantes-OGM-Bt
147 () http://www.nature.com/articles/srep37855
148 () Voir supra le chapitre sur l’affaire Séralini.
149 () Voir le compte rendu de l’audition publique dans le tome II.
150 () http://www.greenpeace.org/eu-unit/Global/eu-unit/reports-briefings/2016/Joint%20position_New%20techniques%20of%20genetic%20engineering_March%202016-1.pdf
151 () Coopératives de France, Fédération nationale des syndicats d’exploitants agricoles (FNSEA), Groupement national interprofessionnel des semences (GNIS), Jeunes Agriculteurs (JA) et Union française des semenciers (UFS).
152 () En partie I du présent rapport.
153 () http://www.ekah.admin.ch/fr/la-commission/actualites/news-details/nouvelles-techniques-de-selection-vegetale-reflexions-ethiques/
154 () Vol. 11, N°4, 2016. http://www.sciencesnaturelles.ch/uuid/9253bc53-7881-5347-9c10-cd772cf79dd6?r=20161005181841_1475028583_0a769cf5-927e-501e-b52b-19e1e62cb091
155 () https://www.loc.gov/law/help/restrictions-on-gmos/usa.php
156 () http://www.conseil-etat.fr/Actualites/Communiques/Organismes-obtenus-par-mutagenese .
157 () CJCE, 21 mars 2000, Greenpeace France c/ Ministère de l’Agriculture, aff. C-6/99, Rec. p. I-1651, point 40.
158 () http://www.nbtplatform.org/
159 () Chapitre suivant.
160 () http://www.fao.org/nr/cgrfa/cgrfa-home/fr/
161 () http://www.fao.org/nr/cgrfa/cgrfa-meetings/cgrfa-comm/sixteenth-reg/fr/
162 () http://www.fao.org/about/meetings/afns/fr/
163 () http://www.fao.org/about/meetings/agribiotechs-symposium/fr/
164 () M. Guy Kastler a également participé aux deux auditions publiques organisées par l’OPECST sur les nouvelles biotechnologies (voir dans le tome II).
165 () Dans les biotechnologies appliquées à l’agriculture, on parle d’« évènement » pour toute nouvelle variété modifiée découverte ou mise sur le marché.
166 () Les agriculteurs sont de fait obligés d’acheter régulièrement des nouvelles semences pour bénéficier des dernières évolutions technologiques.
167 () Voir en partie I du rapport.
168 () Établissement public industriel et commercial français placé sous la double tutelle du ministère de la recherche et du ministère des affaires étrangères.
169 () Les effets hors cible sont traités dans les parties I et II du rapport.
170 () Le Monde du 13 février 2017.
171 () « Genome ENgineering Improvement for Useful plants of Sustainable agriculture » (ingénierie cellulaire : amélioration et innovation technologique pour les plantes d’une agriculture durable) : www.genius-project.fr.
172 () Louis-Marie Houdebine, « Premières souris transgéniques », Encyclopædia Universalis : http://www.universalis.fr/encyclopedie/premieres-souris-transgeniques/
173 () J.L. Marx et coll. « Building bigger mise through gene transfert » - Science, décembre 1982.
174 () R.D. Palmiter, R.L.B rinster et RL Evans - Nature 300 16/12/1982.
175 () L.M. Houdebine, note académique de l’Académie d’agriculture de France 2016.
176 () L.M. Houdebine, La mise sur le marché des premiers animaux génétiquement modifiés - Science et pseudo-sciences (2016 n° 316)
177 () http://www.recombinetics.com/precise-gene-editing/for-livestock-producers/acceligen/
178 () « Genetically engineered crops: Experiences and Prospects”, May 2016, National Academy of Sciences: https://www.nap.edu/catalog/23395/genetically-engineered-crops-experiences-and-prospects
179 () Voir tableau ci-dessous.
180 () Voir ce courrier en début de rapport.
181 () Décédé en 2009.
182 () Voir compte rendu du Sénat en début de rapport.
183 () La directive européenne n° 2001/18 exclut explicitement l’induction polyploïdique de sa définition des OGM.
184 () Voir dans le tome II en annexe n° 3.
185 () Voir infra le commentaire de la décision de l’USPTO du 15 février 2017.
186 () http://www.lequotidiendumedecin.fr/actualites/article/2017/02/20/brevet-crispr-cas-9-apres-une-premiere-decision-la-bataille-juridique-sannonce-longue_844912
187 () http://www.ipstudies.ch/crispr-patent-analytics/
188 () Ensemble des catégories sur : http://www.ipstudies.ch/crispr-patent-analytics/
189 () Un « dépôt prioritaire » est le premier dépôt d’une demande de brevet dans un pays (ou une région du monde) portant sur une invention donnée. Ce dépôt prioritaire peut ensuite être étendu dans d’autres pays (on parle alors d’extension) qui sont désignés par le déposant.
190 () http://www.sciencemag.org/news/2017/02/how-battle-lines-over-crispr-were-drawn
191 () Considérant 16 : cellules germinales comprises.
192 () Chaque règle européenne est prescrite deux fois, dans la convention sur le brevet européen (CBE) et dans la directive n° 98/44/CE.
193 () http://www.monsanto.com/global/fr/actualites/pages/monsanto-va-t-elle-concevoir-ou-vendre-des-semences.aspx
194 () Voir en partie I le rôle d’Addgene en tant que centre de dépôt des plasmides.
195 () http://www.who.int/csr/resources/publications/biosafety/LabBiosMan3rdFrenchweb.pdf
196 () « Biohacking und Synthetische Biologie », communiqué de presse du Bundestag, 30/09/2016 - https://www.bundestag.de/presse/hib/201609/-/442890.
197 () http://www.ethikrat.org/files/opinion-biosecurity.pdf
198 () https://fas.org/irp/agency/dod/jason/
199 () https://www.legifrance.gouv.fr/jo_pdf.do?id=JORFTEXT000031122973
https://www.legifrance.gouv.fr/jo_pdf.do?id=JORFTEXT000031490053
200 () Allocution d’ouverture par M. Louis Gautier, SGDSN, le 2 décembre 2015.
201 () Voir en partie IV du rapport sur l’agriculture.
202 () Voir notamment les questions écrites n° 92147 de Mme Brigitte Allain, députée, et n° 92148 de M. Olivier Dussopt, député : http://www2.assemblee-nationale.fr/recherche/questions .
203 () Question écrite n° 94999 de Mme Brigitte Allain.
204 () Les compétences de l’EFSA ont été détaillées dans le chapitre IV.
205 () Voir en partie II du rapport.
206 () http://www.senat.fr/dossier-legislatif/pjl14-359.html
http://www.assemblee-nationale.fr/14/dossiers/biodiversite.asp
Loi n° 2016-1087 du 8 août 2016 pour la reconquête de la biodiversité, de la nature et des paysages.
207 () http://www.senat.fr/amendements/2014-2015/608/Amdt_469.html
208 () http://www.assemblee-nationale.fr/14/amendements/3564/AN/821.pdf
209 () “New Breeding Techniques: Hidden GMOs?”: http://www.greens-efa.eu/fr/article/new-breeding-techniques/
210 () Fédération internationale du mouvement de l'agriculture biologique.
211 () European Network of Scientists for Social and Environmental Responsibility.
212 () Il a été voté dans la première loi bioéthique de 1994.
213 () Rapport n° 2226 « L’évaluation du plan national de gestion des matières et des déchets radioactifs, PNGMDR 2013-2015 » déposé par MM. Christian BATAILLE, député, et Christian NAMY, sénateur, le 18 septembre 2014 au nom de l’OPECST : http://www.assemblee-nationale.fr/14/pdf/rap-off/i2226.pdf
214 () Rapport n° 1054 « De la connaissance des gènes à leur utilisation – Première partie : l’utilisation des OGM dans l’agriculture et l’alimentation » déposé par M. Jean-Yves Le Déaut le 8 juillet 1998 au nom de l’OPECST : http://www.assemblee-nationale.fr/11/dossiers/981054.asp
215 () Seules les formes « actives » sont conservés (suppression des propositions et des mots n’apparaissant qu’une fois). Pour l’analyse, seules les formes actives présentes au moins trois fois sont gardées.
216 () http://nuffieldbioethics.org/wp-content/uploads/Public-Dialogue-on-Genome-Editing-workshop-report.pdf
217 () Le commissaire européen à la santé a indiqué son intention d’organiser le, 28 septembre 2017, une conférence largement ouverte sur les biotechnologies, avec en particulier les problématiques des nouvelles biotechnologies.
218 () Rapport n° 3896 sur « L'interaction des sciences humaines et sociales avec les sciences technologiques et les sciences du vivant » présenté le 29 juin 2016 par MM. Jean-Yves Le Déaut, député, et Bruno Sido, sénateur, au nom de l’OPECST. http://www.assemblee-nationale.fr/14/pdf/rap-off/i3896.pdf
219 () Voir partie IV du rapport.
© Assemblée nationale