
N° 4277
______
ASSEMBLÉE NATIONALE
CONSTITUTION DU 4 OCTOBRE 1958
QUATORZIÈME LÉGISLATURE
Enregistré à la Présidence de l'Assemblée nationale le 6 décembre 2016
RAPPORT
FAIT
AU NOM DE LA COMMISSION DES AFFAIRES ÉTRANGÈRES SUR LE PROJET DE LOI autorisant la ratification de l’accord de passation conjointe de marché
en vue de l’acquisition de contre-mesures médicales,
PAR M. Jean-Paul BACQUET
Député
——
ET
ANNEXE : TEXTE DE LA COMMISSION DES AFFAIRES ÉTRANGÈRES
Voir le numéro :
Assemblée nationale : 4026.
___
Pages
INTRODUCTION 5
I. UN ACCORD QUI DOIT CONTRIBUER À AMÉLIORER LA RÉPONSE AUX CRISES SANITAIRES TRANSFRONTIÈRES 7
A. LES DIFFICULTÉS RÉVÉLÉES PAR LA PANDÉMIE DE GRIPPE A/H1N1 7
B. LE PRÉSENT ACCORD FAIT PARTIE D’UN ENSEMBLE PLUS VASTE DE MESURES CONTRE LES MENACES TRANSFRONTIÈRES GRAVES SUR LA SANTÉ 8
1. La notion de menace transfrontière grave sur la santé 8
2. Les principaux apports de la décision n°1082/2013/UE du 22 octobre 2013 9
3. La valeur ajoutée du présent accord : un nouvel instrument pour des passations conjointes de marché en vue d’acquérir des contre-mesures médicales 11
II. PRÉSENTATION DÉTAILLÉE DE L’ACCORD 13
A. UN DISPOSITIF NOUVEAU QUI VIENT EN COMPLÉMENT DU CADRE NATIONAL SANS S’Y SUBSTITUER 13
B. LES PRINCIPALES STIPULATIONS 14
1. Dispositions générales 14
2. Architecture institutionnelle 15
3. Procédures de passation de marché 17
4. Gestion des informations ou documents et des conflits d’intérêts 19
5. Dispositions finales 20
C. ETAT DES SIGNATURES ET DES RATIFICATIONS 22
CONCLUSION 25
EXAMEN EN COMMISSION 27
ANNEXE N° 1 : LISTE DES PERSONNES AUDITIONNÉES PAR LE RAPPORTEUR 29
ANNEXE : TEXTE DE LA COMMISSION DES AFFAIRES ÉTRANGÈRES 31
Mesdames, Messieurs,
Parmi les conclusions tirées de la pandémie de grippe A/H1N1, qui s’est déclarée en 2009, il est notamment apparu que les mécanismes en vigueur pour l’acquisition des vaccins et médicaments ne permettaient pas nécessairement de garantir des conditions contractuelles correctes en matière de prix, de fiabilité et de flexibilité (lorsqu’il a fallu adapter les quantités commandées aux besoins réels).
En réponse à ces difficultés, l’accord soumis à votre Commission organise une procédure conjointe de passation de marché, ouverte à tous les Etats membres de l’Union européenne et visant à acquérir en commun des contre-mesures médicales contre des menaces transfrontières graves sur la santé. Cela devrait permettre de renforcer la puissance d’achat des Parties contractantes et ainsi d’améliorer les conditions contractuelles dont elles peuvent bénéficier.
Des procédures conjointes de passation de marché ont déjà été mises en œuvre dans d’autres domaines, par exemple en matière de défense et de transports, dans un cadre intergouvernemental. Au plan communautaire, un premier mécanisme de passation conjointe de marché concernait des plateformes d’enchères pour les quotas de gaz à effet de serre (1).
Le présent accord reste néanmoins un instrument relativement inhabituel puisqu’il est conclu entre la Commission européenne et les Etats membres de l’UE. Dans une note explicative (2), la Commission européenne estime qu’il ne s’agit pas d’un accord international au sens de la convention de Vienne sur le droit des traités, c’est-à-dire conclu entre Etats et régi par le droit international, mais d’un arrangement administratif, considéré comme une simple mesure d’application d’un acte de droit communautaire – la décision n°1082/2013/UE du Parlement européen et du Conseil, adoptée le 22 octobre 2013 et relative aux menaces transfrontières graves sur la santé.
Conformément à l’article 5 de cette décision, la mise en œuvre de la procédure conjointe de passation de marché est d’ailleurs soumise au respect des dispositions du règlement (UE, Euratom) 966/2012 relatif aux règles financières applicables au budget général de l’UE (ci-après : « le règlement financier ») et du règlement délégué (UE) 1268/2012, relatif aux règles d’application du précédent règlement (ci-après : « les règles d’application »). De même, tous les différends relatifs à l’accord seront soumis à la Cour de justice de l’Union européenne.
A l’instar des accords relatifs à des plateformes d’enchères pour les quotas de gaz à effet de serre, le présent accord est toutefois soumis au Parlement. Il a en effet été considéré que les dispositions de l’article 43, en ce qu’elles dérogent aux principes de droit commun régissant la responsabilité de l’Etat, portent sur le domaine législatif et sont de nature à faire entrer l’accord dans le champ d’application de l’article 53 de la Constitution. Sa ratification requiert ainsi une autorisation préalable du Parlement (3).
I. UN ACCORD QUI DOIT CONTRIBUER À AMÉLIORER LA RÉPONSE AUX CRISES SANITAIRES TRANSFRONTIÈRES
Le présent accord a été élaboré en réponse aux difficultés dont s’est accompagnée la gestion de la pandémie grippale A/H1N1 de 2009, qui a notamment révélé des faiblesses structurelles dans les passations de marché pour l’achat de vaccins.
Notre Assemblée a créé en février 2010 une commission d’enquête sur la manière dont a été programmée, expliquée et gérée la campagne de vaccination contre la grippe A/H1N1 (4). La Cour des comptes y a également consacré des travaux (5). Globalement, la gestion de la pandémie grippale A/H1N1 a fait l’objet d’appréciations très critiques.
La pandémie de grippe A/H1N1 Le 11 juin 2009, l’Organisation mondiale de la santé qualifiait de pandémie l’épidémie de grippe A/H1N1 apparue un mois et demi auparavant. Le niveau maximal d’alerte a été maintenu jusqu’en août 2010. En France, l’épidémie aurait été directement responsable de 1 334 cas graves et de 342 décès en métropole et outre-mer. Préparé à réagir en cas de pandémie grippale frappant son territoire depuis l’alerte à la grippe aviaire, le Gouvernement français a activé un plan national de prévention et de lutte contre la pandémie de grippe A/H1N1 prévoyant notamment une campagne de vaccination. Source : rapport public annuel 2011 de la Cour des comptes. |
Le rapport de la commission d’enquête précitée a mis en lumière un bilan peu flatteur, mais tout de même assez comparable à ce qui s’est produit dans d’autres pays européens : des commandes massives de vaccins, une très faible vaccination de la population (moins de 10 %) et, par conséquent, des stocks importants de vaccins non utilisés et de coûteuses résiliations de contrats.
Les passations de marché sont notamment apparues très perfectibles, particulièrement en ce qui concerne le prix et la possibilité d’adapter les quantités commandées aux besoins réels. Comme l’a souligné la Cour des comptes, les passations de marché ont été marquées par une position de dépendance vis-à-vis des fournisseurs, qui « a sans nul doute été aggravée par l’absence de toute coordination, notamment européenne, entre les différents Etats demandeurs ».
Parmi les recommandations formulées à la suite de la campagne de lutte contre cette pandémie, tant la commission d’enquête de notre Assemblée que la Cour des comptes ont insisté sur la nécessité d’améliorer la coordination au niveau de l’Union européenne pour la gestion des crises sanitaires transfrontières et de mettre en place des stratégies mutualisées d’achat de vaccins pour renforcer la position des Etats dans les négociations.
Les institutions européennes se sont saisies de cette question sur le fondement de l’article 168 du traité sur le fonctionnement de l’Union européenne (TFUE), qui donne notamment compétence à l’UE pour compléter les politiques nationales liées à la lutte contre les menaces transfrontières graves sur la santé.
Le Conseil de l’UE, dans ses conclusions du 13 septembre 2010 « sur les enseignements tirés de la pandémie A/H1N1 », a ainsi invité les Etats membres et la Commission « à envisager de collaborer à la définition de procédures conjointes de passation de marchés et à la mise en place d’approches communes en matière de négociation de contrats d’achat de médicaments ». Dans une résolution adoptée le 8 mars 2011, le Parlement européen a également souligné la nécessité de mettre en place un mécanisme de passation conjointe de marché.
Un groupe de travail, rassemblant les Etats membres, a été constitué dès 2011 par la Commission européenne. Ses travaux ont abouti en 2014 et le processus de signature de l’accord a été lancé au mois de juin de la même année.
B. LE PRÉSENT ACCORD FAIT PARTIE D’UN ENSEMBLE PLUS VASTE DE MESURES CONTRE LES MENACES TRANSFRONTIÈRES GRAVES SUR LA SANTÉ
L’accord soumis à la Commission s’inscrit dans un cadre plus général de dispositions adoptées au plan communautaire pour améliorer la coordination et la coopération entre les Etats membres dans la lutte contre les menaces transfrontières graves sur la santé, en réponse aux préoccupations qui viennent d’être rappelées par votre Rapporteur.
La décision n°1082/2013/UE du Parlement européen et du Conseil, relative aux menaces transfrontières graves sur la santé, définit ainsi cette notion :
« Un danger mortel ou tout autre danger grave pour la santé, d’origine biologique, chimique, environnementale ou inconnue, qui se propage ou présente un risque important de propagation par-delà les frontières nationales des États membres, et qui peut nécessiter une coordination au niveau de l’Union afin d’assurer un niveau élevé de protection de la santé humaine » (article 3).
L’article 2 de cette même décision énumère les catégories suivantes :
a) menaces d’origine biologique, comprenant :
i) les maladies transmissibles;
ii) la résistance aux antimicrobiens et les infections associées aux soins de santé liées aux maladies transmissibles ;
iii) les biotoxines ou autres agents biologiques nocifs non liés aux maladies transmissibles ;
b) les menaces d’origine chimique ;
c) les menaces d’origine environnementale ;
d) les menaces d’origine inconnue ;
e) les événements pouvant constituer des urgences de santé publique de portée internationale au titre du Règlement sanitaire international, à condition qu’ils relèvent de l’une des catégories de menaces visées aux points a) à d).
La décision précitée a permis de réaliser plusieurs avancées importantes en matière de lutte contre les menaces transfrontières graves sur la santé.
Le comité européen de sécurité sanitaire (CSS), groupe jusque-là informel de représentants de haut niveau des Etats membres, a été juridiquement officialisé et renforcé. Le CSS est chargé d’un rôle d’appui et de coordination pour les Etats membres et la Commission européenne.
Selon des éléments communiqués par le ministère des affaires étrangères et du développement international, le CSS a permis, au fil des ans, de conférer une base solide aux activités de préparation :
– en permettant aux États membres de l'UE d'échanger des informations et d'évaluer les incidents sanitaires ;
– en faisant office de forum de discussion et de conseil pour les ministres de la santé ;
– en coordonnant les réactions nationales aux menaces transfrontières graves sur la santé, ainsi que la communication relative aux risques et aux crises.
La décision de 2013 précitée visait également à renforcer l’évaluation des risques en donnant une nouvelle impulsion aux activités de surveillance coordonnées par le Centre européen de prévention et de contrôle des maladies (ECDC), établi par un règlement européen de 2004.
Le système d’alerte précoce et de réaction (SAPR) exploité par l’ECDC a été étendu à toutes les menaces transfrontières graves sur la santé. Ce système permet à la Commission et aux autorités nationales compétentes d’être en communication permanente pour notifier des alertes, évaluer les risques pour la santé publique et déterminer les mesures qui pourraient être nécessaires.
La décision de 2013 établit aussi une procédure permettant à la Commission de reconnaître une situation d’urgence au niveau de l’UE en matière de santé publique, afin d’accélérer la mise à disposition de médicaments.
Enfin, l’article 5 de cette même décision permet d’engager une procédure conjointe de passation de marché en vue de l’achat anticipé de contre-mesures médicales relatives à des menaces transfrontières graves pour la santé. Tel est l’objet de l’accord soumis à la Commission.
La notion de contre-mesures médicales Selon l’article 2 de l’accord, on entend par contre-mesures médicales « tout médicament, dispositif médical ou autre bien ou service destiné à la lutte contre des menaces transfrontières graves sur la santé au sens de la décision nº 1082/2013/UE ». Un document technique de la Commission européenne (direction générale de la santé et de la sécurité alimentaire) relatif aux contre-mesures médicales pouvant faire l’objet d’achats communs en vertu de l’accord de passation conjointe de marché (6), apporte les précisions complémentaires suivantes : « Le terme « contre-mesures médicales» devrait donc recouvrir les médicaments, produits médicaux et autres biens ou services lorsque ceux-ci peuvent s'avérer nécessaires pour prévenir des maladies humaines graves et lutter contre leur propagation par-delà les frontières des États membres ou pour lutter contre d'autres menaces transfrontières graves sur la santé. Par conséquent, tout médicament, dispositif médical, autre bien ou service susceptible d'être utilisé pour atténuer/traiter un danger mortel ou tout autre danger grave pour la santé d’origine biologique, chimique, environnementale ou inconnue, qui se propage ou présente un risque important de propagation par-delà les frontières nationales des États membres, et qui peut nécessiter une coordination au niveau de l’Union afin d’assurer un niveau élevé de protection de la santé humaine, peut faire l’objet d’un achat commun en vertu de l'accord de passation conjointe de marché. En ce qui concerne les produits et services, l'accord de passation conjointe de marché peut porter, par exemple, sur les épreuves de laboratoire, les instruments/kits de diagnostic pour la grippe saisonnière ou pandémique, les vaccins antigrippaux, les médicaments antiviraux, les produits de décontamination, les masques et les équipements de protection individuelle ou d'autres biens et services, selon le besoin généré par une menace transfrontière grave sur la santé. » |
3. La valeur ajoutée du présent accord : un nouvel instrument pour des passations conjointes de marché en vue d’acquérir des contre-mesures médicales
La mutualisation des forces d’achat des Etats membres participant à une passation commune de marché doit permettre de renforcer leur pouvoir de négociation. Selon l’exposé des motifs du projet de loi, l’accord vise ainsi à garantir :
– que les vaccins et autres contre-mesures médicales soient disponibles en quantités suffisantes ;
– que tous les Etats membres participants aient accès aux vaccins ou contre-mesures médicales ;
– que toutes les Parties soient traitées de façon égale et bénéficient de conditions contractuelles correctes.
Au regard de ces considérations, on peut regretter que le champ des bénéficiaires du dispositif reste assez limité. L’accord n’est ouvert qu’aux Etats membres de l’Union européenne, seule une participation des Etats de l’Association européenne de libre échange (Islande, Liechtenstein, Norvège et Suisse) et des Etats candidats à l’adhésion à l’UE pouvant également être envisagée, sous réserve d’un accord par lequel ces pays accepteraient que le règlement financier de l’UE (voir supra)soit applicable aux procédures auxquels ils souhaiteraient participer (article 49 de l’accord).
Dans une logique de solidarité, s’agissant de répondre à des menaces transfrontières graves sur la santé, il aurait pu être utile d’associer des pays moins développés et disposant de moyens budgétaires moindres, c’est-à-dire dont le pouvoir individuel de négociation est plus limité. Ces Etats tiers pourront simplement faire l’objet de donations – éventuelles – de contre-mesures médicales acquises dans le cadre du présent accord, dans les conditions prévues par l’article 31.
Deux passations conjointes de marché ont déjà été lancées par la Commission européenne : la première, initiée en mars 2016, vise à acquérir des tenues de protection individuelles pour les personnels de santé qui seraient amenés à traiter des patients atteints de maladies infectieuses graves, de type Ebola ou pandémie grippale ; la seconde, plus récente encore (novembre 2016), concerne de l'antitoxine botulinique. Il a été indiqué à votre Rapporteur que la Commission européenne mène également une réflexion sur des passations conjointes de marché pour du BCG, de la Tuberculine et de l'antitoxine diphtérique.
Aucune procédure n'ayant été clôturée jusqu’à présent, il n’existe pas à ce stade d’évaluation des résultats que permettent d’obtenir de telles passations conjointes de marché au regard des objectifs présentés par votre Rapporteur.
La France n’a pas participé aux procédures déjà lancées, le présent accord n’ayant pas encore été ratifié. En revanche, le Gouvernement souhaite s’intégrer à la démarche sur les vaccins pandémiques dans la mesure où le Parlement autoriserait sa ratification – le lancement du processus relatif aux vaccins pandémiques étant envisagé début 2017.
II. PRÉSENTATION DÉTAILLÉE DE L’ACCORD
Avant de présenter les principales stipulations de l’accord, ainsi que l’état des signatures et des ratifications, votre Rapporteur souhaite clarifier son articulation avec le dispositif existant au plan national. Le caractère volontaire de la participation des Parties aux procédures de passation de marché, au cas par cas, est en effet un élément essentiel pour apprécier l’opportunité d’une adhésion de la France à ce mécanisme.
Si le présent accord permet d’organiser avec d’autres Etats et la Commission européenne des procédures conjointes de passation de marché pour l’acquisition de contre-mesures médicales, la possibilité de continuer à recourir à des mécanismes strictement nationaux dans ce domaine n’est pas remise en cause. La participation des Parties aux passations de marché lancées sur le fondement de l’accord reste en effet volontaire.
Deux points méritent d’être soulignés à cet égard :
– l’adhésion au présent accord n’oblige pas à participer ensuite aux procédures de passation de marché qui sont engagées dans ce cadre ;
– les Parties restent libres de mener des procédures de passation de marché en dehors du présent accord, y compris pour l’acquisition de contre-mesures médicales faisant l’objet d’une procédure conjointe de passation de marché.
S’agissant du dispositif en vigueur en France, il faut rappeler que la nouvelle Agence nationale de santé publique (ANSP) (7), créée conformément à la loi n° 2016-41 du 26 janvier 2016 de modernisation de notre système de santé, est chargée de la préparation et de la réponse aux menaces, alertes et crises sanitaires. L’ANSP « assure, pour le compte de l’Etat, la gestion administrative, financière et logistique de la réserve sanitaire et de stocks de produits, équipements et matériels ainsi que de services nécessaires à la protection des populations face aux menaces sanitaires graves » (article L. 1413-1 du code de la santé publique).
L’ANSP exerce cette mission sur la base du programme d’acquisition défini par l’Etat selon les différentes menaces sanitaires identifiées et les plans de réponses associés – volet pandémie grippale, volet variole, volet épidémiologie, volet nucléaire, radiologique, biologique et chimique (NRBC)…
Cette compétence est aujourd’hui exercée par l’opérateur dans un cadre national, en vertu des principes de la commande publique. Avec l’accord soumis à la Commission, l’ANSP pourra exercer cette compétence en se groupant avec d’autres Etats membres volontaires.
On peut en attendre un certain nombre d’avantages, liés au renforcement de la position de négociation vis-à-vis des firmes pharmaceutiques (voir supra). Pour autant, la question des contraintes juridiques et administratives supplémentaires peut se poser.
Comme le souligne l’étude d’impact, avec un certain art de l’euphémisme, l’action de l’ANSP « s’inscrira, le cas échéant, dans un environnement « collégial », avec toutes les conséquences que cela implique au niveau procédural, tenant compte de la répartition des compétences entre Commission et Etats membres. La Commission aura en effet des compétences propres (pilotage des procédures, représentation juridictionnelle en particulier) et les Etats interagiront selon la comitologie dédiée (comité directeur, comité d’évaluation des offres, etc.).
Par ailleurs, le degré de complexité des passations conjointes de marché dépendra de l’analyse précise des besoins de chaque Etat membre, en particulier leur homogénéité, qui facilitera ou non la rédaction de cahiers des charges communs.
Le choix de recourir à la procédure d’achat européenne mise en place par le présent accord ou de rester au contraire dans un cadre national devra donc faire l’objet d’une appréciation au cas par cas.
Les articles 1er à 4 de l’accord, respectivement relatifs à son objet, aux définitions, aux règles régissant la procédure conjointe de passation de marché et aux prérogatives accordées à la Commission, n’appellent que deux remarques de la part de votre Rapporteur.
Tout d’abord, une procédure conjointe de passation de marché, conduite en application du présent accord, est susceptible de déboucher sur trois types de contrats.
– Un « contrat-cadre » peut être conclu entre plusieurs Parties à l’accord et un contractant (toute personne physique ou morale ou entité publique avec laquelle un marché public est passé). Ce type de contrat, régi par l’article 101 du règlement financier de l’UE (voir supra) et l’article 122 des règles d’application, peut être utilisé lorsque certains paramètres, comme le moment exact de la livraison et la quantité des contre-mesures, ne peuvent pas être déterminés à l’avance.
– Un « contrat spécifique » est conclu entre des co-contractants d’un accord-cadre afin d’assurer sa mise en œuvre. De tels « contrats spécifiques » peuvent être signés par les Parties à concurrence du nombre maximal de contre-mesures médicales qu’elles ont réservées au titre du contrat-cadre (2e alinéa du paragraphe 1 de l’article 27 du présent accord).
– A la différence d’un « contrat-cadre », un « contrat direct » peut être conclu à la suite d’une passation conjointe de marché lorsque toutes les clauses nécessaires à sa mise en œuvre peuvent être établies d’emblée.
Il faut également souligner que la Commission européenne joue un rôle pilote dans la mise en œuvre de l’accord. Aux termes de l’article 4, elle est en effet chargée, au nom des Parties :
– de conduire les procédures conjointes de passation de marché, y compris l’attribution et la gestion des contrats-cadres, ainsi que l’attribution des contrats directs – seuls les contrats spécifiques sont conclus et gérés de manière individuelle par chaque Partie ;
– d’agir en tant qu’unique représentant des Parties dans toute instance, sauf lorsque celle-ci est intentée au titre d’un contrat spécifique.
Le titre II met en place une « comitologie » spécifique, c’est-à-dire un ensemble de comités associant la Commission européenne et les Etats membres pour l’exécution de l’accord.
Les articles 5 à 7 instituent deux catégories de comités directeurs.
– Le comité directeur de l’accord (CDAPCM) est chargé de questions générales telles que le type de contre-mesures médicales à acquérir et l’ordre chronologique de leur acquisition, les suites à donner à d’éventuels manquements des Parties, le règlement des différends et les modifications de l’accord. Le CDAPCM est composé d’un représentant de chaque Partie (Etats membres et Commission européenne).
– Un comité directeur pour une procédure de passation de marché spécifique (CDPPMS) est créé pour traiter des questions spécifiquement liées à chaque marché (cahier des charges, critères de répartition des contre-mesures médicales, composition des comités d’évaluation ou encore type de procédure de passation de marché). Un CDPPMS distinct est créé pour toute procédure conjointe de passation de marché. Il est composé d’un représentant de chaque Partie ayant décidé de participer à la passation de marché concernée.
La présidence et le secrétariat des comités directeurs sont assurés par la Commission européenne.
S’agissant de la France, un représentant du ministère chargé de la santé sera désigné au CDAPCM, où il sera assisté d’un représentant de l’Agence nationale de santé publique (ASNP) ; au sein des CDPPMS, l’ANSP devrait représenter l’Etat, un représentant du ministère de la santé pouvant toutefois être désigné en considération de la sensibilité de la conduite de la procédure. Les profils concernés seront les suivants : pharmaciens/médecins et juristes (8).
Les comités directeurs prennent leurs décisions d’un commun accord ou, quand celui-ci ne peut être obtenu, par un vote qui est d’abord acquis à la majorité qualifiée (9) puis, à l’occasion d’une nouvelle réunion si cette majorité n’a pas pu être réunie, à la majorité simple. Si celle-ci n’a pas été atteinte, la proposition est réputée adoptée, à moins qu’une majorité qualifiée ne s’y oppose, lors d’une réunion ultérieure.
Les articles 8 à 10 établissent des comités chargés d’évaluer les demandes de participation ou les offres.
Ils sont composés de 8 personnes au maximum, désignées par la Commission européenne. Cinq d’entre elles, au maximum, sont nommées après approbation du CDPPMS, parmi des candidats présentés par les Etats participants. Il n’est donc pas prévu que chacun d’entre eux soit représenté dans les comités d’évaluation.
Par ailleurs, les membres présentés par les Etats participants sont nommés ad personam et doivent agir en tant qu’évaluateurs indépendants. Dans l’exercice de leurs fonctions, ils ne peuvent solliciter ni accepter des instructions. Tous doivent signer une déclaration d’absence de conflits d’intérêts et de protection de la confidentialité qui est annexée au présent accord.
L’article 11, relatif aux modalités d’organisation des réunions des différents comités, n’appelle pas de commentaires particuliers de votre Rapporteur.
L’article 12 précise le rôle de la Commission européenne dans la procédure conjointe de passation de marché :
– elle assure la préparation et l’organisation globales de la procédure ;
– elle facilite la résolution à l’amiable des désaccords éventuels entre les Parties ;
– elle est leur unique représentant auprès des opérateurs économiques ;
– elle a une compétence exclusive de représentation juridictionnelle, les Parties pouvant toutefois l’assister à sa demande ;
– elle fournit un soutien administratif au cours de la procédure (potentiellement : rédaction de correspondance, conservation des comptes rendus des réunions, gestion des informations et documents, etc.)
L’article 13 établit les conditions d’ouverture des procédures de passation de marché. Tout membre du CDAPCM, c’est-à-dire les Etats parties à l’accord et la Commission européenne, peuvent en faire la proposition. Il suffit que 5 membres soient volontaires pour qu’une procédure soit ouverte. La Commission européenne doit faire partie de ces 5 membres.
La Commission fixe le délai dans lequel d’autres Parties peuvent manifester leur intérêt, ainsi que le délai dans lequel les besoins d’approvisionnement doivent être signifiés.
Aux termes de l’article 14, le type de procédure de passation de marché est décidé par le CDPPMS, selon les principes définis par le règlement financier et ses règles d’application. Le type de procédure doit être précisé dans l’avis de marché. Il peut s’agir :
– d’une procédure ouverte (tous les opérateurs économiques intéressés peuvent soumissionner) ;
– d’une procédure restreinte (tous les opérateurs économiques peuvent demander à participer mais seuls les candidats satisfaisant aux critères de sélection peuvent présenter une offre) ;
– d’une procédure négociée (seuls des opérateurs économiques répondant aux critères de sélection sont choisis par le pouvoir adjudicateur pour négocier les conditions de l’offre), éventuellement sans publication préalable d’un avis de marché ;
– d’un dialogue compétitif (lorsque le pouvoir adjudicateur n’est pas en mesure de définir les moyens techniques permettant de répondre à ses besoins, dans le cas de contrats complexes, il ouvre avec les candidats satisfaisant aux critères de sélection un dialogue pour développer une ou plusieurs solutions, les participants pouvant remettre leur offre sur cette base).
La procédure négociée et le dialogue compétitif font respectivement l’objet de stipulations spécifiques aux articles 25 et 26 de l’accord.
Aux termes de l’article 15, le CDPPMS décide du type de marché, de la durée du contrat-cadre et des modalités de réexamen du contrat.
L’article 16 détermine le rôle de la Commission européenne et celui du CDPPMS dans la définition du contenu des documents d’appel à la concurrence. Sont soumis à l’approbation du CDPPMS les documents suivants : avis de marché, cahier des charges, documents descriptifs, projets de contrat, lettre d’invitation à soumissionner. Le contenu des autres documents est déterminé par la Commission, après avis du CDPPMS.
L’article 17 est relatif à la répartition des contre-mesures médicales acquises dans le cadre de la passation conjointe de marché. Les critères de répartition sont soumis à l’approbation du CDPPMS. Des dérogations temporaires peuvent être autorisées par le CDPPMS, d’un commun accord (voir supra), pour des raisons fondées et dûment motivées, telles que des problèmes liés à la livraison ou des besoins urgents. Des dérogations temporaires peuvent également être convenues entre plusieurs Parties, le CDPPMS devant simplement en être informé.
L’article 18 prévoit la publication d’un avis de marché au Journal officiel de l’Union européenne. Les documents d’appel à la concurrence sont mis à la disposition des acteurs économiques sur demande.
Les demandes de participation et les offres sont ouvertes par une commission d'ouverture composée de représentants de la Commission européenne (article 19).
Celle-ci décide de l'exclusion ou de l'éviction d'un candidat ou d'un soumissionnaire, après approbation par le CDPPMS, sur la base d’un examen réalisé par le comité d'évaluation au regard des critères d'exclusion et de sélection (article 20).
Les critères d’exclusion, qui visent à déterminer si un opérateur peut participer à la procédure, sont établis par les articles 106 et 107 du règlement financier (par exemple : faillite, liquidation judiciaire, condamnation pour tout délit affectant la moralité professionnelle, situation de conflit d’intérêts ou fausses déclarations). Les critères de sélection, définis par l’article 146 des règles d’application, visent à évaluer la capacité financière, économique, technique et professionnelle du soumissionnaire.
Aux termes de l’article 21, la décision d’attribution du marché est adoptée par la Commission européenne, en son nom propre et au nom des autres Parties, après approbation du CDPPMS.
L’article 22 est relatif à la signature des contrats et à leur entrée en vigueur.
Aux termes de l’article 23, la Commission européenne est l'unique point de contact entre les Etats participants et les acteurs économiques pour toute question relative à une procédure conjointe de passation de marché.
Les Parties peuvent renoncer collectivement ou individuellement, pour des raisons fondées et dûment motivées (par exemple si les résultats de l’appel à la concurrence ne sont pas jugés satisfaisants), à la procédure conjointe de passation de marché avant l'attribution du marché ou annuler collectivement la procédure d'attribution avant la signature du contrat, sans que les candidats ou les soumissionnaires puissent prétendre à être indemnisés. Les appels d'offres doivent mentionner cette faculté (article 24).
Des dispositions spécifiques sont établies en cas de recours à la procédure négociée (article 25) ou au dialogue compétitif (article 26).
Les marchés spécifiques, on l’a dit, peuvent être attribués par les Parties à concurrence du nombre maximal de contre-mesures médicales qu’elles ont réservées au titre d’un contrat-cadre, les Parties concernées étant pleinement responsables de l’exécution des contrats spécifiques (article 27).
Les articles 28 à 31 définissent les conditions dans lesquelles les Parties peuvent modifier la répartition de tout ou partie des quantités de contre-mesures médicales réservées dans le cadre d’un contrat-cadre ou commandées dans le cadre d’un marché spécifique et revendre des produits déjà livrés ou faire des donations de contre-mesures médicales acquises dans le cadre d’une passation conjointe de marché. Des Etats non Parties à l’accord et des organisations internationales peuvent bénéficier de telles donations.
Les articles 32, 33 et 35 à 37 définissent les règles relatives au partage des documents et informations nécessaires pour l’application de l’accord ou gérés dans ce cadre, à leur utilisation, à leur communication à des tiers et au public, à leurs mesures de protection et au respect du secret professionnel.
L’article 34 met à la charge des Parties une obligation de prévention des conflits d’intérêts.
En cas de manquement aux dispositions relatives à la gestion des informations ou documents et aux conflits d’intérêts, les Parties sont tenues d’informer le CDAPCM, de lui transmettre les résultats de l’enquête qu’ils doivent mener rapidement en la matière et d’éliminer les effets de tout manquement, d’y remédier ou de les atténuer (article 38).
L’article 39, relatif à l’obligation de coopération sincère, impose en particulier de s’abstenir de toute mesure qui pourrait mettre en péril la réalisation des objectifs de l’accord. Toutefois, on l’a dit, cela n’interdit pas de mener des procédures de passation de marché en dehors de l’accord pour acquérir des contre-mesures médicales faisant l’objet d’une passation conjointe de marché ou d’un contrat-cadre.
En cas de manquements à l’accord ou de différends relatifs à son interprétation ou à son application (article 40 à 41), le CDAPCM doit être saisi dans un premier temps. Si la difficulté ne peut être réglée dans un délai de trois mois à compter de la saisine du CDAPCM, la Cour de justice de l’Union européenne a compétence exclusive pour statuer.
S’agissant de l’article 42, on relèvera en particulier que le droit applicable aux contrats-cadres et aux contrats directs est déterminé par ces accords, de même que la juridiction compétente pour connaître d’éventuels litiges en découlant.
L’article 43 définit la responsabilité des Parties contractantes et de la Commission européenne dans les actions en dédommagement. Ainsi que le souligne l’exposé des motifs, plusieurs dispositions dérogent aux principes de droit commun régissant la responsabilité de l’Etat :
– lorsque la Commission doit dédommager un tiers ou un Etat membre pour un dommage causé totalement ou partiellement par un ou plusieurs Etats membres, mais que celui-ci ou ceux-ci ne peuvent être identifiés, l’ensemble des Etats membres indemnisent la Commission du coût de réparation du dommage ;
– lorsque la Commission a subi un dommage causé par une ou plusieurs Parties contractantes, mais que celle-ci ou celles-ci ne peuvent être identifiées, l’ensemble des Etats membres indemnisent la Commission du coût de réparation du dommage.
Pour être exonéré de cette obligation d’indemnisation, un Etat membre doit apporter la preuve qu’il ne peut avoir causé le dommage, même partiellement.
L’article 44 définit les obligations des Parties en matière de prix et précise les modalités de paiement. Les Parties doivent se conformer au document descriptif accompagnant l’avis de marché, en cas de procédure de dialogue compétitif, et au contrat-cadre conclu avec le contractant. Il leur revient de s’acquitter directement auprès de lui de tout engagement financier résultant d’un contrat-cadre, au prorata de leur part du nombre total de contre-mesures médicales.
Aux termes de l’article 45, l’accord s’interprète à la lumière du droit de l’UE, notamment la décision 1082/2013/UE précitée, le règlement financier relatif au budget général de l’UE et ses règles d’application.
Le même article renvoie à 4 annexes techniques, qui font partie intégrante de l’accord :
– une déclaration d’absence de conflit d’intérêts et de protection de la confidentialité, à remplir par les membres des comités d’évaluation ;
– une déclaration confirmant que les procédures nationales pour l’approbation de l’accord ont été accomplies ou que de telles procédures ne sont pas nécessaires ;
– un accord relatif à la participation aux travaux du CDAPCM en qualité d’observateur (cf. article 52) ;
– une liste des versions linguistiques faisant foi.
L’accord ne peut être modifié ou résilié qu’à l’unanimité ; il est conclu pour une durée indéterminée, c’est-à-dire tant qu’il n’est pas remplacé par un autre accord ou résilié (articles 46 et 47).
Chaque Partie peut se retirer à tout moment de l’accord ; en cas de retrait, elle doit réparer tout préjudice résultant de ses obligations au titre des contrats régis par l’accord (article 48).
L’article 49 permet la participation de tout Etat membre de l’UE, de l’AELE ou candidat à l’adhésion à l’UE sous la réserve précitée (10). Toutefois, une nouvelle Partie à l’accord ne peut pas prendre part aux procédures de passation de marché qui seraient en cours au moment de son adhésion. Ce point mérite d’être souligné s’agissant de la temporalité qui sera celle de l’adhésion de la France.
L’article 50, relatif aux règles de communication des notifications au titre de l’accord, n’appelle pas de commentaires particuliers de votre Rapporteur.
L’accord entre en vigueur 14 jours après la date à laquelle un tiers des Parties signataires ont transmis à la Commission européenne une déclaration confirmant que les procédures nationales pour l’approbation de l’accord ont été accomplies ou qu’elles ne sont pas nécessaires. Il entre ensuite en vigueur à l’égard des autres Parties dans un délai de 14 jours après la transmission de cette déclaration (article 51).
Les Parties n’ayant pas notifié à la Commission européenne que l’accord est entré en vigueur en ce qui les concerne peuvent participer aux travaux du CDAPCM en qualité de simples observateurs, pourvu qu’elles aient signé l’accord prévu à l’annexe III (article 52).
L’article 53, relatif à la publication de l’accord, n’appelle pas de commentaires particuliers.
Le présent accord a été ouvert à la signature au mois de juin 2014 et signé par la France le 22 septembre 2015. Selon l’étude d’impact jointe au projet de loi, ce délai est lié à « des difficultés de traduction et des échanges sur la version authentique de l’accord avec la Commission ».
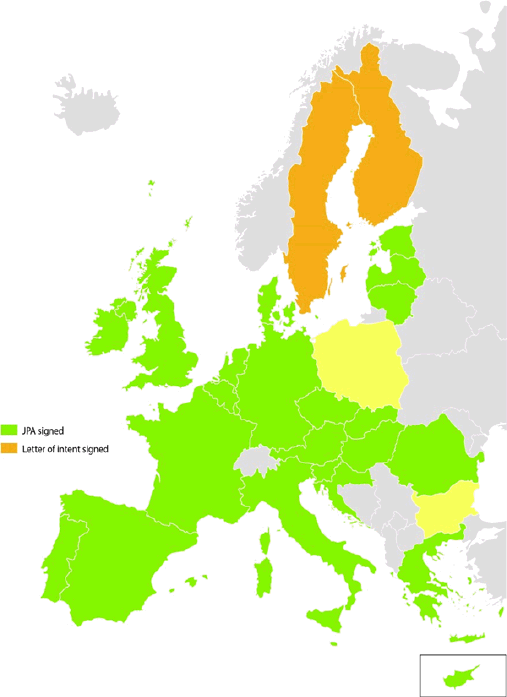
A ce stade, l’accord a été signé par 24 Etats membres de l’UE (représentés en vert sur la carte ci-après) (11). La Commission européenne l’a par ailleurs signé le 20 juin 2015.
Selon les éléments communiqués par le ministère des affaires étrangères et du développement international :
– la France est le seul Etat membre où un processus formel de ratification est en cours, l’accord étant entré en vigueur à l’égard des autres signataires ;
– deux Etats membres ont engagé un processus d’approbation interne nécessaire à leur signature, sans qu’une date ait pour l’instant été annoncée (en orange sur la carte) ;
– deux Etats membres (représentés en jaune), la Pologne et la Bulgarie, n’ont pas encore marqué leur intérêt pour une participation à l’accord.
S’agissant de ces deux pays, le ministère des affaires étrangères a apporté les précisions suivantes à votre Rapporteur :
– « la Pologne estime ne pas être en mesure de signer un accord-cadre de passation de marché pour des vaccins pandémiques qui prévoit le paiement d’honoraires liés à la réservation d’une partie de la production du fournisseur et elle ne souhaite donc pas signer pour l’instant l’accord » ;
– il n’existe pas d’explication officielle en ce qui concerne la position de la Bulgarie, ce pays n’ayant jamais répondu aux sollicitations de participation, ni de manière positive, ni de manière négative.
Votre Rapporteur estime que le présent accord peut offrir une réelle valeur ajoutée pour l’acquisition de contre-mesures médicales, même si l’engagement et la conduite d’une procédure de passation conjointe de marché associant la Commission européenne et plusieurs Etats membres sont naturellement susceptibles de présenter un degré de complexité supérieur à celui d’une passation de marché restant dans un cadre strictement national.
Cette valeur ajoutée sera à évaluer au cas par cas. Il faut en effet souligner que chaque Partie à l’accord reste libre de participer ou non, sur une base volontaire, à chaque passation de marché spécifique. L’accord ne fait qu’organiser un cadre procédural.
Au bénéfice de ces observations, votre Rapporteur vous invite à autoriser la ratification du présent accord, ouvert à la signature dès juin 2014, en rappelant qu’il est déjà entré en vigueur pour la plupart des Etats membres de l’Union européenne et que des passations conjointes de marché ont déjà été lancées.
La commission examine le présent projet de loi au cours de sa séance du mardi 6 décembre 2016.
Après l’exposé du rapporteur, un débat a lieu.
Mme Odile Saugues, présidente. J’aurais pour ma part une question. S’agissant de l’épidémie de grippe H1N1, vous avez parlé de commandes massives et d’une très faible vaccination en retour. Connaissons-nous le nombre de vaccins non-utilisés ?
M. Jean-Paul Bacquet, rapporteur. Je n’ai pas les chiffres précis en tête, si ce n’est qu’il y a eu moins de 10 % de la population vaccinée alors que les risques avaient conduit à acheter des stocks de vaccins extrêmement importants. Il faut se replacer dans le contexte de l’époque. Des données sur les stocks non-utilisés existent néanmoins. Elles figurent notamment dans un rapport de la Cour des comptes et dans celui d’une commission d’enquête de notre Assemblée. Je pourrai donc vous les communiquer par écrit.
L’épidémie H1N1 a été extrêmement préjudiciable, notamment pour la réputation de la vaccination. Des personnes en ont mis en doute la nécessité. Néanmoins le risque existait et on a finalement eu de la chance. A partir du moment où nous pourrons négocier d’être alimentés en fonction des besoins, grâce à ce nouveau mécanisme, nous aurons la possibilité de répondre à la demande de manière graduée, en fonction de ce que la population acceptera de faire ou non.
M. Philippe Baumel. J’ai une question, qui est quasiment de détail, sur l’architecture institutionnelle. L’accord prévoit la constitution de comités directeurs auxquels participeront deux représentants français, l’un du ministère de la santé et l’autre de l’Agence nationale de santé publique. A aucun moment, il ne semble avoir été envisagé qu’un des représentants français vienne du quai d’Orsay. On peut pourtant imaginer que, sur certains enjeux, il serait utile d’avoir un éclairage diplomatique. A priori, cela a été écarté. Savez-vous pour quelles raisons ?
M. le rapporteur. J’ai eu l’occasion de me rendre à la direction générale de la sécurité civile lors de la crise Ebola et j’ai noté que, déjà, ce n’était pas le ministère des Affaires étrangères qui gérait le dossier. S’agissant du présent accord, les profils concernés devraient être des pharmaciens ou des médecins et des juristes. Est-ce le meilleur choix ? Je vous en laisse juge. Mais, étant moi-même médecin, je ne pense pas que les professionnels de santé soient les plus qualifiés pour ces questions de stratégie.
M. Thierry Mariani. Merci au rapporteur pour son excellent travail. Nous sommes rassurés de voir que nous gardons notre liberté et nous voterons ce texte. J’ai bien compris que le gouvernement a choisi la procédure qui consiste à passer cet accord au Parlement, ce qui est plutôt positif. Mais j’aimerais savoir pourquoi la Bulgarie et la Pologne n’ont pas souhaité participer à l’accord.
M. le rapporteur. Sur cette question, le ministère des affaires étrangères m’a apporté les précisions suivantes. « La Pologne estime ne pas être en mesure de signer un accord-cadre de passation de marché pour des vaccins pandémiques qui prévoit le paiement d’honoraires liés à la réservation d’une partie de la production du fournisseur et elle ne souhaite donc pas signer l’accord cadre de passation de marchés pour l’instant. La Bulgarie n’a jamais répondu aux sollicitations de participation, ni de manière positive, ni de manière négative, il n’y a donc aucune explication officielle à son absence ». Pour la Bulgarie, c’est simple. Pour la Pologne, je dois dire que cela me surprend davantage. Les montants en cause ne devraient pas mettre en péril ce pays.
Suivant l’avis du rapporteur, la commission adopte à l’unanimité le projet de loi n° 4026 sans modification.
ANNEXE N° 1 :
LISTE DES PERSONNES AUDITIONNÉES PAR LE RAPPORTEUR
Néant
TEXTE DE LA COMMISSION DES AFFAIRES ÉTRANGÈRES
Article unique
(Non modifié)
Est autorisée la ratification de l’accord de passation conjointe de marché en vue de l’acquisition de contre-mesures médicales (ensemble quatre annexes), signé à Paris le 22 septembre 2015, et dont le texte est annexé à la présente loi.
NB : Le texte de l’accord figure en annexe au projet de loi (n° 4026)
© Assemblée nationale